Contents
エルゴチオネインはコロナウイルス患者の治療に役立つか?
Could Ergothioneine Aid in the Treatment of Coronavirus Patients?
www.mdpi.com/2076-3921/9/7/595/htm
en.wikipedia.org/wiki/Ergothioneine
要旨
SARS-CoV-2に感染すると、コロナウイルス感染症2019(COVID-19)というパンデミックが発生し、現在、世界で1100万人以上が感染している。COVID-19患者の中には、呼吸器または多臓器不全に至る可能性のある過剰な炎症によって拍車がかかり、重篤で重篤な疾患を発症する者もいる。
数多くの研究により、食用アミノ酸エルゴチオネインのユニークな細胞保護特性の配列が確立されている。
試験管内試験(in vitro)および生体内試験(in vivo)モデルの研究に基づいて、エルゴチオネインは、炎症を調節し、フリーラジカルを消去し、急性呼吸窮迫症候群から保護し、内皮機能障害を防止し、虚血および再灌流傷害から保護し、神経細胞の損傷から保護し、鉄の調節異常に対抗し、肺および肝臓の線維化を抑制し、肺、腎臓、肝臓、消化管、および精巣への損傷を緩和する能力を示している、他の多くの中で。この証拠をまとめると、エルゴチオネインがCOVID-19の根本的な病態の治療に応用できる可能性があることを示唆している。
我々は、エルゴチオネインがCOVID-19の重症度および死亡率を減少させる治療薬として、特に高齢者および基礎的な健康状態を有する者に使用され得ることを提案する。本レビューでは、この提案を支持するエビデンスを提示する。
キーワード:エルゴチオネイン、COVID-19、抗酸化剤、コロナウイルス、SARS、炎症、サイトカイン、NETs
1. イントロダクション コロナウイルスとCOVID-19
エンベロープされたノンセグメントのポジティブセンスRNAからなるコロナウイルスは、ウイルスの中で最大のグループである[1]。それらは動物およびヒトにおいて様々な呼吸器感染および腸管感染を引き起こすが、2002年の重症急性呼吸器症候群コロナウイルス(SARS-CoV)という2つの新規変異体[2]と、10年後の中東呼吸器症候群(MERS)CoV[3]によって、その感染性と致死性が世界的に認識されるまで、ヒトにおいては高度な病原性を持つとは考えられていなかった。
2019年12月には、オリジナルのSARS CoVと高い遺伝的類似性(~79%)を持つ新規コロナウイルス[4]が中国・武漢から出現し、その高い感染力で世界を沸かせそうになった。SARS CoV-2によるヒト呼吸器上皮の感染により、コロナウイルス感染症2019(COVID-19)が発生する。本稿執筆時点では、世界で1100万人以上の診断例があり、53万人近くが死亡している(WHO、COVID-19状況報告書)。しかし、その数は日々増加している。
COVID-19の感染に関する現在の情報では、主に直接および間接的な(汚染された表面または物体[5])接触、および感染者が近距離で話したり、咳をしたり、くしゃみをしたりしたときの近距離(6フィート以内)の飛沫感染を介して感染することが示唆されている(US-CDC)。SARS-CoVと同様に、SARS-CoV-2のエンベロープ上に見られるスパイク(S)糖タンパク質は、鼻上皮や体内の他の場所にあるヒトアンジオテンシン変換酵素2(ACE2)受容体に結合している[8]。
スパイクタンパク質はサブユニットS1とS2から構成され、それぞれ受容体結合と膜融合を促進し、宿主プロテアーゼである膜貫通型セリンプロテアーゼ2(TMPRSS2)[9]とプロタンパク質変換酵素Furin[10,11]による細胞内移動のために、2つの部位での切断を必要とする。ACE2受容体およびTMPRSS2/furinの発現に関する研究から、両者は気道、角膜、食道、回腸、結腸、肝臓、胆嚢、心臓、腎臓、精巣を含む幅広い組織に存在することが明らかになった[12]。しかし、鼻腔スワブは咽頭スワブよりも高いウイルス負荷を示しており、鼻上皮が主な感染部位であることを示している[13]。
SARS-CoVとSARS-CoV-2の間には高い遺伝的類似性があるにもかかわらず、回収されたCOVID-19患者の血清はSARS-CoVとの交差中和が限られていることが示されており、またその逆も示されている[8,14]。しかし、少数の感染者(特に高齢者や基礎となる慢性疾患を持つ人)は重症化して重症化することがある。
COVID-19の最も一般的な臨床症状は、初期のコロナウイルス感染症(すなわち、SARS CoVおよびMERS CoV)と類似しており、90%近くの症例で発熱を示し、3分の2以上が咳を発症する [15]。また、息切れ(~19%;呼吸困難)、咽頭痛(~14%;咽頭炎)、嗅覚(無嗅覚)および味覚(ageusia)機能の喪失、筋肉痛(筋痛)、吐き気、下痢、嘔吐、および神経学的合併症を含む(ただしこれらに限定されない)さまざまな症状を呈する患者もいる [15,16,17]。
嗅覚および味覚機能の喪失は、症例の約34%で報告されており[17]、他の症状が現れる前の早期のイベントであることが多い[18]。
中国における45,000人近い患者の研究に基づく推定では、症例の約81%が無症状または軽度の症状を呈する一方で、約14%がより重度の症状を呈し、5%が重症化することが示されている[19]。COVID-19の推定死亡率は約3.4%で、これは以前のMERSのCoV(34.4%)やSARSのCoV(11%)よりもはるかに低い。
しかし、死亡率は国によって大きく異なり、1%未満から7%を超えるものまである[20]が、これは一部の地域での集団検診の実施[21]、医療制度の能力、および人口に占める高齢者の割合に関連している。
死亡率と年齢の上昇には強い相関関係があり、80歳以上では約17.5%(その年齢の全症例の%)が死亡しているが、イタリアと中国の症例死亡率の平均によると、70~79歳では約10.5%、60~69歳では約3.5%、60歳未満では約0.5%しか死亡していない[20]。COVID-19による死亡の80%以上が60歳以上の患者で発生している [22]。
死亡の最も一般的な原因は急性呼吸窮迫症候群(ARDS)と考えられており、多くの場合、臓器不全や併存疾患の増悪などの他の合併症を引き起こしており、高齢で既往症のある人はARDSを発症するリスクが高いため、年齢との相関関係を説明していると考えられる[23]。しかし、本疾患の実際の病態生理については多くのことが不明であり、COVID-19の罹患率と死亡率につながるプロセスをさらに理解するためには、より多くのデータが緊急に必要とされている。
2. エルゴチオネインの生物学
エルゴチオネイン(エルゴチオネイン; エルゴチオネインの詳細な概要については[24,25,26]を参照)は、最初にGrundemannら[24,26,27,28]によって発見されたようにエルゴチオネインの輸送に特異的な役割を持っている有機カチオントランスポーター小説型1(OCTN1)の存在に起因する体内のほとんどの細胞や組織に蓄積することができる天然に存在する食餌性アミノ酸である。
エルゴチオネインの生合成は、いくつかの真菌や細菌でこれまでに実証されている一方で、それは普遍的に動物で発見されており、それは経口摂取後に熱心に吸収され、私たちの体内に蓄積され、重要な生理的役割を示唆している[29,30,31,32]。エルゴチオネインは急速に代謝されたり、尿中に排泄されたりすることはなく、同じトランスポーターであるOCTN1が体中に分布している[24,28,29]。
長い半減期と体内に蓄積される能力は、エルゴチオネインが生理的pHでは主にチオン互変異性体で存在し、グルタチオンなどの他のチオールと比較してより安定性が高いという事実に部分的に起因している[25]。
エルゴチオネインは幅広いユニークな特性を持ち、特にヒドロキシルラジカル(-OH)[33]、次亜塩素酸(HOCl)[33]、一重項酸素(1O2)[34,35]、およびペルオキシナイトライト(ONOO-)[36]のような活性酸素および活性窒素種(ROS/RNS)を消去する能力を含む、様々な細胞保護能力を付与する。
しかしながら、広範な他の研究は、エルゴチオネインが、他のものの中でも、炎症を調節したり[37,38,39]、鉄や銅などの二価金属カチオンをキレートしたり(それによって、これらの金属イオンが酸化的損傷を刺激する能力を減少させる)[33,40,41,42]、紫外線誘発損傷から保護したり[43]することができることを実証していた。[44]、血管接着タンパク質の発現を阻害し[45,46]、ミエロペルオキシダーゼ活性を阻害し[47]、貪食球呼吸バーストから保護し[48,49]、熱ショックタンパク質-70の発現を誘導し[39,50]、神経細胞の分化を促進し[51,52,53]、肺[54]および肝臓[55,56]の線維化を防止する。
エルゴチオネインのこれらの特徴およびCOVID-19の様々な病理学的側面に対するそれらの適用は、コロナウイルス感染症の潜在的な治療薬としてのエルゴチオネインの多機能性を実証するために、本レビューを通してより詳細に議論されるであろう。
さらに、研究は、エルゴチオネインが酸化ストレスおよび炎症にさらされた組織に優先的に蓄積され、OCTN1のレベルを細胞内で調節することによって組織傷害の部位に集中する可能性があることを示唆している[24,32,56,57]。
これらのエルゴチオネインのユニークな能力は、細胞、動物モデル、および集団研究での幅広い研究で報告されており、エルゴチオネインの細胞保護能力が認知症などの障害に対して有用であることを示唆している[58]。
59,60]、うつ病[61]、アテローム性動脈硬化症[45,46]、心血管疾患[46,62,63,64]、非アルコール性脂肪肝疾患[56]、子癇前症[65,66]、虚血再灌流障害[39,50,67]、そしてこの場合に特に関連するARDS[68]。
このリストは決して網羅的なものではなく、がんワクチンの有効性の改善[69]や化学療法誘発性末梢神経障害の保護[70]など、人間の健康の他の分野でもエルゴチオネインの新しい応用が常に確認されている。
エルゴチオネインは、高齢者の虚弱体質のリスクを軽減することができる長寿栄養素であることさえ示唆されている[60,71,72,73]。
実際、エルゴチオネインの低血漿濃度は、加齢に関連した障害[60,64,74]と関連しており、エルゴチオネインは、これらの障害のリスクを低減するための治療または予防サプリメントとして有益である可能性があることを示唆している。
さらに、我々や他の研究者は、血中エルゴチオネイン濃度が加齢とともに低下することを確認しており、おそらく高齢者は、虚弱体質、心血管疾患、および神経変性疾患を含む可能性のある加齢関連疾患[60,72,75]のリスクの増加を素因としていると考えられる。
3. エルゴチオネインはどのようにCOVID-19の緩和に有益であるかもしれない?
3.1. COVID-19の重症度を軽減するための抗酸化物質の使用
SARS-CoV-2(および他の病原体)による侵入の初期段階では、免疫応答は、酸素ラジカルおよび他の活性酸素が重要な役割を果たすプロセスであるウイルスを根絶する上で重要な役割を果たしている。特に、好中球は、スーパーオキシド(O2–)、H2O2、およびHOClなどの活性酸素の発生を伴う呼吸バーストを介して侵入病原体を不活性化することができる([76]でレビューされている)。しかしながら、多くの患者において、免疫応答の過剰な活性化は、損傷および経験された症状の多くに寄与する。
実際、酸素ラジカルおよび他の活性酸素、例えばHOClおよびONOO-および炎症性メディエーターによる過剰な損傷は、多くの慢性炎症性疾患およびインフルエンザ、デング熱、および他のコロナウイルスなどの感染症の進行において重要な役割を果たすことが知られている[76,77,78,79,80,81]。
活性酸素の発生はヒト免疫応答の必須要素であるが、活性酸素の過剰な産生は生体分子を損傷し(すなわち、酸化的損傷)、このプロセスは組織の損傷および酸化ストレスの悪循環のさらなる伝播を助長する可能性がある[76]。活性酸素は、損傷および疾患の進行の主要なメディエーターであり得るので[76]、抗酸化物質は、COVID-19の疾患の持続期間および重症度を食い止める手段として提案されてきた。
上海市医師会からの初期報告では、症状の重症度を軽減するためにCOVID-19で入院した患者に高用量のアスコルビン酸を使用することを支持している。いくつかの研究では、重篤な感染症の間はビタミンCのレベルが枯渇することが示されており [82]、ビタミンCを補充した患者はプラセボ対照よりも良好な成績を収め [83]、機械換気やICUでの滞在時間が短縮されていることが示されている [84]。そのため、中国、イタリア、米国では、高用量(3-12g/日)のビタミンCを静脈内投与する臨床試験が数多く開始されている(clinicaltrials.gov試験:NCT04264533/NCT04323514)。
これらの用量は、欧州食品安全局(European Food and Safety Authority)による成人の1日の推奨摂取量の133倍以上である[85]。経口投与した場合、100mg/日を超えると血漿アスコルビン酸濃度は腎クリアランスを介してプラトー化し[85]、高用量アスコルビン酸の経口投与にはほとんど正当性がないかもしれないことを示唆している[86]。
さらに、約2時間の半減期を持つ高用量の静脈内投与アスコルビン酸の急速なクリアランスのため、血漿中の所望の高濃度を維持するためには、静脈内投与を1日に何度も繰り返す必要があるだろう[87]。これは、取るに足らない再取り込み[88]と糸球体濾過および排泄が原因である。
アスコルビン酸は強力な抗酸化剤と考えられているが、それはまた、鉄または銅[76,89]とのプロ酸化反応を促進するかもしれないので、注意がそのアプリケーションで取られるべきである、特にARDS [90]で発見されるかもしれないような鉄代謝の制御異常を持っている可能性がある障害の間に、[76,89]。
実際、静脈内のアスコルビン酸が生体内でプロオキシダント作用を発揮するという証拠があるが [91,92,93]、アスコルビン酸が生体内で重要な抗酸化物質であるという証拠は、おそらく呼吸器管を除いて非常に弱いものである[76,94,95]。
対照的に、エルゴチオネインは積極的に吸収され、経口摂取後の体内で高濃度で蓄積され、腎再吸収による高い滞留がある[29]。さらに、動物を用いた我々の研究では、エルゴチオネインは体内のほとんどの(すべてではないにしても)臓器や組織に分布して蓄積され、高レベルの酸化ストレスにさらされている組織に優先的に蓄積されることが示されている[32]。
前述のように、多くの研究では、-OH、HOCl、ONOO-および1O2などのROS/RNSを非常に高い速度でスカベンジするエルゴチオネインの能力が示されており[33,36,96,97]、また、それはまた、O2からの損傷から生体分子を保護すると主張されていた–[43,98,99]およびH2O2 [97,100]。
実際、試験管内試験(in vitro)および生体内試験(in vivo)の広範な研究は、システムがストレス因子の範囲にさらされたときに、エルゴチオネインが酸化的損傷から生体分子を保護し、抗酸化剤および他の能力を介して細胞保護を実証することができることを示している(それは後に探索される)[99,100]。
逆に、OCTN1をコードする遺伝子をサイレンシングすると、細胞や動物はより高いレベルの酸化的損傷を受けやすくなる[101,102,103]。このことは、体内のエルゴチオネインの組織レベルを上昇させることが、酸化的損傷からの保護に有益であることを示唆している[57,104]。さらに、エルゴチオネインは高いバイオアベイラビリティーを持っており、必要とされる細胞や組織に積極的に取り込まれる。
さらに、いくつかのエビデンスは、エルゴチオネインを組織損傷部位へとさらに誘導するOCTN1の発現を調節するフィードバック機構を示唆している[57,105]。
このことは、エルゴチオネインの臨床的安全性が実証されていることと相まって(セクション3)、重症のCOVID-19患者の死亡率と組織損傷を制限するためにエルゴチオネインを臨床応用するための強力なケースを提示している。
3.2. ウイルス複製の直接阻害
今日まで、コロナウイルスの複製を直接阻害するエルゴチオネインの可能性を調べた研究はなかった。Suwannarachら[106]による最近のレビューでは、主要な活性成分がエルゴチオネインである真菌抽出物が、HIV-1のような他のRNAウイルスに対して阻害活性を示す可能性を強調しており、コロナウイルスの結合または複製の阻害への応用の可能性を示唆している。
同様に、Xiaoら[107]は、純エルゴチオネインがHIV長末端リピート領域(宿主DNAにウイルスゲノムを組み込むためのプロモーター・エンハンサーとして機能する)のpro-fs(ヒト免疫不全ウイルス-1タンパク質;HIV-1)活性化を用量依存的に阻害することを試験管内試験(in vitro)アッセイで実証しており、エルゴチオネインが直接HIVの転写を阻害することを示唆している。
最近の別の研究では、エルゴチオネインを主な有効成分とする一般的な食用キノコの水抽出物が、NS3/4Aプロテアーゼ活性を阻害し(~90%阻害)、C型肝炎ウイルス(HCV)ゲノム複製を阻害し(~93%のウイルス負荷の減少)[108]。同様に、アガリクス・ブラゼイ茸抽出物を用いた別の研究では、C型肝炎患者の末梢血ウイルス負荷をわずかに減少させた[109]。
これらの研究は、ウイルスのプロテアーゼを阻害し、ウイルスの結合と複製を防ぐ真菌抽出物の能力に関する文献のほんの一部である。
もちろん、これらの研究は、エルゴチオネインが原因となる成分であることを証明するものではなく(キノコは体内のエルゴチオネインの主要な食事源であるが)、エルゴチオネインがSARS-CoV-2の取り込みまたは複製を直接的に減少させることに有益であるかどうかを評価するためには、さらなる研究が必要である。
このセクションでは、SARS-CoV-2の取り込みおよび複製に対するエルゴチオネインの阻害活性と、その直接的な抗ウイルス活性を評価する研究の必要性を強調している。
3.3. 炎症、サイトカインストーム、急性呼吸窮迫症候群の調節
炎症反応は、抗体、好中球、マクロファージ、T細胞を中和することで、ウイルスのクリアランスと回復の重要なメディエーターとなる。初期感染時には、上気道で免疫系がウイルスを抑えることができないと、ウイルスは肺へと移動し、感染の重症度が著しく上昇する可能性がある。肺では、細胞へのウイルスの浸潤とそれに続く細胞死(多くの場合、炎症反応を開始するプログラムされた細胞死であるピロプトーシスによって)が肺の免疫反応を誘発し、マクロファージおよび単球を損傷部位に引き寄せる [110]。
一方、サイトカインの放出は、適応性T細胞およびB細胞免疫応答の呼び水となる。健康な個体では、この基本的な免疫応答は、典型的には、ウイルスが大幅に複製および拡散する前にウイルス感染を停止させることができ、過剰な免疫応答を防ぎ、組織損傷を制限することができる。しかし、特定の患者では、基礎疾患による免疫応答の機能不全により、ウイルスの抑制が不十分になり、過剰な炎症反応が起こることがある。実際、COVID-19患者では、IL-1β、IL-2、IL-7、IL-8、IL-9、IL-10、IL-17、IFNγ、IP-10、TNF-α、およびMCP-1を含む炎症性サイトカインの血清レベルの著しい上昇が認められている[111]。
肺での広範囲にわたる過剰な炎症(サイトカインストームと呼ばれる)は、肺胞に損傷(一部は過剰な活性酸素産生およびプロテアーゼ分泌を介して)を引き起こし、肺水腫(肺における体液の蓄積)を引き起こし、ガス交換を制限する [112]。これは呼吸困難(呼吸困難)を引き起こし、~10~15%の症例では、ARDSへとさらに進行し、しばしば致命的である [23,113]。
研究によると、呼吸不全に至るARDSはCOVID-19患者の死因の第一位であり、その推定値は70~90%である [114,115,116]。しかしながら、COVID-19により死亡したすべての患者が何らかの形の呼吸障害を有していたことが報告されている。さらに、肺および他の組織からの大量の炎症性サイトカイン(特に、TNF-α、IL-1β、およびIL-6)の放出は、敗血症および多臓器不全を引き起こす可能性のある全身性サイトカインストームを誘発する[117,118]。
いくつかの研究では、エルゴチオネインの抗炎症特性および炎症性サイトカインを調節する可能性があることが実証されている(例えば、パルミチン酸誘発性IL-6発現の阻害および試験管内試験(in vitro)での筋細胞死の防止[37]および肺および腸の虚血再灌流傷害による血清IL-1βおよびTNF-αレベルの有意な低下によって)マウスにおいて、未処置の対照と比較して実証されている[39,67]。
ラットのARDSモデル(サイトカイン注入療法は、ARDSの病理学的特徴の多くを再現しており、潜在的な治療法を調査するためのモデルとして一般的に使用されている)を用いた重要な研究では、エルゴチオネインによる治療前(15および150mg/kg)および治療後(150mg/kg)の両方が保護され、未治療のコントロールと比較して肺損傷および炎症(肺好中球)の減少をもたらしたことが明らかにされた[68]。
著者らは、ARDSに対する保護の主なメカニズムとして、エルゴチオネインのフリーラジカル消去作用(以前に詳述したように)、二価金属キレート作用、および抗炎症特性を挙げている[68]。特に後者については、マクロファージおよび好中球の肺へのリクルートに関与するNF-κB活性化およびIL-8発現の阻害である。
肺胞上皮細胞をエルゴチオネインで前処理すると、H2O2とTNF-κBの活性化とIL-8発現のダウンレギュレーションの両方を防ぐことができた[38]。また、ラット褐色細胞腫(PC-12)細胞における NF-κB 発現を抑制する エルゴチオネイン の能力も検証されている [119]。
過度の炎症による組織損傷における重要な構成要素は、好中球の主要な構成要素である酵素ミエロペルオキシダーゼ(MPO)であり[76]、これは侵入した病原体を破壊するのに役立つように、H2O2からのHOClなどの反応性分子の産生を触媒する。COVID-19患者の血液中の好中球数の増加は、より高い重症度および死亡の可能性と関連しており、患者の重症転帰を予測する初期の手段として使用されることさえある [16,120]。
好中球はまた、さらなる炎症の促進に加えて、微小血管血栓症、敗血症、および多臓器不全に寄与することが知られている好中球細胞外トラップ(NETs;DNA繊維、ヒストン、および抗菌性タンパク質の網目)を産生する[121,122]。
NETは感染時の病原体の除去に重要であるが、それらはまた、子癇前症[123]や輸血関連急性肺損傷[124]などの疾患で役割を果たすことが示されている。だけでなく、MPOとネットの形成に必要な活性酸素であるが、MPOは実際に悪循環[125]の伝播でさらに活性酸素を生成し、NETのコンポーネントである。
血清NETの上昇は、COVID-19患者で見られている(無細胞DNA、MPO-DNA、およびシトルリン化ヒストンH3バイオマーカーの上昇によって示される)。さらに、COVID-19患者からの血清は、正常好中球に添加したときにNETosis(NETの活性化および放出)を刺激した[120]。NETosisは、サイトカインストーム、ARDS、血栓関連イベント、炎症およびROSによる過剰な組織損傷を含むCOVID-19の重篤な転帰を促進する重要なプレーヤーであることが示唆されている[113]。
エルゴチオネインは1μMの濃度でもMPO活性を阻害することが示唆されている。さらに、エルゴチオネインはアスコルビン酸やグルタチオン[47]よりも高い速度でHOCl[33]などのMPO由来の反応性ハロゲン化分子をスカベンジすることが知られている。
また、エルゴチオネインが試験管内試験(in vitro)および生体内試験(in vivo)でハロゲン化からDNAを保護し(好中球蓄積のためのUV-B誘発マウス皮膚モデルを使用して)、皮膚に関連する病理組織学的変化を減少させることも実証された[47]。Servilloら[48]はまた、phorbol-12-myristate-13-acetateで活性化されたex vivoヒト好中球を用いて、呼吸バースト中にHOClをスカベンジするエルゴチオネインの能力を実証した。これらの知見は、エルゴチオネインが好中球主導のNETosisの伝播を妨害する可能性があることを示唆している。
ここで得られたエビデンスをまとめると、エルゴチオネインの投与は、炎症性サイトカイン、MPO活性、およびNETosisを阻害することにより肺炎の重症度を低下させ、それによりARDSを防御し、COVID-19の間のサイトカインストームを防ぐことができる可能性があることが明らかになった。これは、より重篤な転帰が予測される患者、好中球レベルが高い患者、または基礎となる併存疾患を有する患者に特に適用可能である。
3.4. 内皮機能障害に対する保護
最近の報告 [126] は、血管を裏打ちする血管内皮細胞に対するウイルスの損傷が敗血症および多臓器不全につながる可能性を示唆している。実際、血管内皮細胞はACE2受容体を発現し、ウイルスの取り込みを促進する[12]。これは免疫介在性の細胞死および内皮機能障害につながる可能性がある[126]。
内皮系の機能障害は、高血圧、冠動脈疾患、慢性心不全、末梢血管疾患、糖尿病、慢性腎不全を含む広範な心血管系疾患の中心であり、またウイルス感染症の病理学の中心でもある[127]。実際、内皮の機能不全は、血管収縮、炎症性サイトカイン、および血栓状態の促進をもたらし、次のセクションで議論される高凝固状態に寄与する[127]。
SARS-CoV-2が血管内皮に浸潤し損傷を与える免疫介在過程は、肺胞を覆う上皮細胞(肺気球)のそれと類似しており、肺障害、呼吸困難、および重度の場合にはARDSを引き起こす[128]。ウイルスは、ウイルス体の存在によって示されるように、いくつかの臓器の内皮を貫通し、さまざまな臓器(肺、心臓、腎臓、肝臓、および腸)の内皮炎を引き起こす可能性がある[126]。
また、内皮は、免疫細胞の浸潤およびサイトカイン産生を調整することにより、ウイルス感染時にサイトカインストームを促進する中心的な役割を果たしていることが研究で示されている[129]。さらに懸念されるのは、血管内皮への持続的な損傷が、高血圧、動脈硬化、脳卒中、または心筋梗塞などの心血管系イベントのリスク上昇につながる可能性があるということである。
以前の研究では、エルゴチオネインがヒト内皮細胞に取り込まれ、様々なストレス因子によって引き起こされる酸化ストレスおよび炎症から保護されることが実証されている[45,98,130]。さらに、血中エルゴチオネイン濃度が高いほど、心血管疾患や死亡率のリスクが低いことが明らかになっている[64]。
健康なボランティアを対象とした薬物動態学的研究では、エルゴチオネインを1日25mgで1週間経口投与すると、血漿中濃度が最大3倍に上昇することが実証されている[29]。Liらによる研究[130]では、ヒト脳微小血管内皮細胞(HBMEC)がエルゴチオネインを取り込む能力があることが実証された。
ラットの分離された基底動脈とHBMECを用いて、エルゴチオネインの補給は、ピロガロール、ヒポキサンチン/キサンチンオキシダーゼ、または高グルコースによるアセチルコリン誘発性弛緩の阻害と酸化ストレス誘発性HBMECの死をそれぞれ防ぐことができることを実証した。
同様に、単離されたラット胸部大動脈において、エルゴチオネインはヒポキサンチン/キサンチンオキシダーゼまたはスーパーオキシドディスムターゼ1阻害剤ジエチルジチオカルバメートによるスーパーオキシドの生成を有意に減少させ、大動脈輪の濃度依存的な緩和を実証した[63]。これらの保護効果は、内皮の除去[63]またはsiRNA[130]を用いたエルゴチオネイントランスポーター(OCTN1)のサイレンシングによって否定された。他の研究では、過酸化水素、パラコート、高グルコース、または酸化LDLの投与による内皮細胞死の防止を介したエルゴチオネインの細胞保護能力も認められている[45,62,98]。
エルゴチオネインの投与は、グルタチオン還元酵素、カタラーゼ、スーパーオキシドジスムターゼ1および2の発現を増加させ、内皮細胞におけるNADPHオキシダーゼ1の発現を減少させた[130]。内皮細胞をプロ炎症性サイトカインIL-1βまたは酸化LDLでインキュベートすると、炎症性細胞接着分子(CAM)が誘導される。
しかし、ヒト大動脈または臍帯静脈内皮細胞(HAECs/HUVECs)にエルゴチオネインをプレロードすると、血管(VCAM-1)、細胞内(ICAM-1)および内皮白血球(E-selectin)接着分子の発現が有意に減少した[45,46]。さらに、1-3 mMのエルゴチオネインを添加したHAECは、IL-1βによる刺激時にU937ヒト単球による結合を有意に減少させる[46]。
以前の研究では、肺胞上皮細胞における以前の研究を含めて、エルゴチオネインの抗炎症特性も実証されている[37,38,45,131,132,133]。これらの研究は、SARS-CoV-2の内皮への侵入による内皮機能障害から保護し、それによってサイトカインストーム、血栓症の形成、および心血管イベントなどの関連する病態を緩和するために、エルゴチオネインの補給が有効であることを示している。
3.5. 高凝固状態および虚血性障害への影響
COVID-19患者におけるカテーテルライン血栓症、深部静脈血栓症、肺塞栓症、虚血性脳卒中、心筋梗塞などの血栓塞栓症イベントの増加が多数の報告で示されている [134,135]。Klokらによる研究[136]では、重症のCOVID-19患者184人のうち、約31%が血栓性合併症に苦しんでいたことが明らかになった。COVID-19病理学の一部として先に述べた高レベルの好中球およびNETosisの促進は、血管血栓症の促進において重要な役割を果たすことが知られている[137]。
病原体を結合することに加えて、NETはまた、赤血球に結合することが示されており、血小板の接着および活性化を引き起こし、さらなる凝集、および最終的には、血栓[138]につながる。研究では、DNasesまたは抗凝固剤ヘパリンの投与は、血栓性イベントが発生する前に、このネットの集合体を分割することができることが示されている[138]。実際、COVID-19患者におけるヘパリンの使用は重症転帰および死亡率の減少と関連していたが[139]、他の研究では血栓予防の有益性は認められていない[135,140,141]。
また、いくつかのグループは、SARS-CoV-2の血管内皮への浸潤が炎症および内皮機能障害(第3.4節)を引き起こし、COVID-19患者の微小血管系における血栓性イベントに役割を果たしていることを強調している[126,142]。実際、内皮機能障害は、広範な心血管障害および高凝固状態の促進に関与しており、脳卒中、心筋梗塞、および急性腎障害につながる可能性がある[127]。
いくつかの研究では、COVID-19患者はDダイマーおよびフィブリン/フィブリノーゲン分解産物の上昇を伴う高凝固状態にあり、患者は血栓塞栓性イベントに素因することがさらに報告されている[135,140]。血栓塞栓症の高リスクにつながる正確なメカニズムは知られていないが、前述の因子の組み合わせがCOVID-19患者における血栓性イベントの促進につながる可能性が高い。
前述したように、エルゴチオネインは、MPO、炎症性サイトカイン、および活性酸素のスカベンジングの直接的な阻害を介して、NETossisの阻害において重要な役割を果たす可能性がある。また、エルゴチオネインは内皮機能障害の予防にも役割を果たしている可能性があり、これらの両方の作用は、COVID-19における凝固障害の予防におけるエルゴチオネインの役割を示唆している。イタリアからの報告では、赤紫色の病変を呈し、そのほとんどが小児または青年であり、典型的には無症状または軽度の症状を呈するCOVID-19患者に発生する、アクロ虚血(指の虚血)の数多くの症例が同定されている[143]。
他にも、急性虚血性病変に関連した報告があり、主に若年者で発生している [144,145]。生命を脅かすものではない(そして広く報告されていない)が、これらの病変は、より不吉な病態、すなわちSARS-CoV-2感染による高凝固状態の指標である可能性がある。
New England Journal of Medicine誌に掲載された報告では、基礎的な危険因子がなく、場合によってはCOVID-19の他の症状が出る前に、若年者(50歳以下)のCOVID-19患者で大血管脳卒中を発症した症例が多数報告されている[146]。さらに、中国からのいくつかの報告では、COVID-19患者における心筋損傷および梗塞の発生率の高さが致死的転帰と有意に関連していることが示されている [147,148]。
これらの報告はいずれも、ウイルスおよび/またはその結果として生じる炎症が血管系に損傷を与え、高凝固状態を促進し、全身の組織および臓器に虚血性のイベントを引き起こす能力を示している。これは、呼吸器損傷による低酸素レベルと相まって、多臓器不全を引き起こす可能性がある。また、脳卒中および心筋梗塞のリスクは、個人の一過性の虚血性イベントの後、何年にもわたって有意に上昇することが研究で示されているので、COVID-19後にも適切であろう [149]。
血栓症形成によるものであれ、呼吸不全によるものであれ、低酸素状態は臓器および組織の傷害を引き起こす可能性がある。さらに、組織への酸素の回復(特に患者が機械的換気を行っている場合)は、再灌流障害を引き起こす可能性がある [76,150]。
いくつかの先行研究では、虚血再灌流傷害にさらされた組織においてエルゴチオネインが保護的であることが実証されている。Bedirliら[50]は、ラットへのエルゴチオネインの事前投与により、虚血再灌流傷害から肝臓を保護し、7日間の生存率を有意に増加させることを報告した。同様に、Sakrakら[39]は、エルゴチオネインがラットの腸虚血性障害から保護することを実証し、IL-1β、TNF-α、MPO、脂質過酸化のレベルが対照と比較して有意に低下し、エルゴチオネインを投与した動物の組織形態が改善されたことを明らかにした。
両研究とも、エルゴチオネインはヒートショックプロテイン-70(HSP-70)[39,50]の発現を促進することも報告している。これは、炎症を調節し、活性酸素から保護し、アポトーシスを防止することで、組織ストレスや低酸素時に細胞を保護することが知られている内因性シャペロンタンパク質である[151]。また、HSP-70はARDSや敗血症に対しても保護することが示されている[152,153]。
また、再灌流誘発性酸化ストレスおよび炎症から保護し、ミトコンドリア機能を維持し、子宮灌流圧低下ラットモデルの子癇前症における高血圧を減少させることにより、エルゴチオネインが胎盤虚血をもたらす妊娠中の高血圧性疾患である子癇前症において保護されることが研究により示唆されている[65,66,154]。
逆に、OCTN1(その組織はエルゴチオネインの完全に欠落している)で欠損したマウスは、野生型動物[101]と比較して、より高い炎症性マーカーと死亡率と、腸の虚血と再灌流傷害に影響を受けやすいである。これらの研究は、エルゴチオネインの抗酸化、抗炎症、および他の細胞保護機能の以前の主張を補強し、さらに、それがCOVID-19における敗血症、虚血、および多臓器不全から保護するのに役立つ可能性があることを示唆している。
3.6. 脳を保護する
COVID-19が神経学的症状を引き起こすメカニズムは複数あると考えられるが、その中には、低酸素につながる呼吸困難、中枢神経系(中枢神経系)へのサイトカインストーム誘発性炎症性損傷、脳静脈血栓症または脳卒中につながる高凝固状態、またはSARS-CoV-2の脳への直接的な浸潤などがある。
以前のSARS-CoV [155,156]と同様に、COVID-19患者の中枢神経系においてSARS-CoV-2の存在が確認されている [157]。COVID-19による神経学的症状の証拠は、中国での研究によると、約36%の患者で報告されており、頭痛、めまい、意識消失、運動失調、急性脳血管障害、発作、神経痛、および脳症を含む症状を呈している [157,158,159]。
ウイルスの侵入機構は最終的にはまだ確立されていないが、SARS-CoV-2が末梢神経または嗅覚神経を介して中枢神経系に侵入できることを示唆する証拠が蓄積されている[160,161,162]が、これは血管系[163]またはリンパ系[164]からの侵入を排除するものではない。
ヒトACE2受容体またはジペプチジルペプチダーゼ4(DDP4)受容体(MERS-CoV感染を促進する受容体)を発現するトランスジェニックマウスにSARS-CoVまたはMERS-CoVをそれぞれ経鼻投与した研究では、これらのコロナウイルスは嗅覚神経を介して脳に侵入し、神経細胞に浸潤し、脳の他の部位、特に視床、大脳、および脳幹に拡散することが明らかになった [162,165]。
トランスクリプトームデータベースを解析すると、ACE2は黒質、脳室、中側頭回、後帯状皮質、その他の様々な領域で高発現しており、SARS-CoV-2は実際に脳に浸潤して神経症状を引き起こす可能性があることが示唆されている[166]。
実際、感染した被験者における嗅覚および味覚機能の喪失を示す報告が増加している[18,159]。鼻腔内に位置する嗅覚上皮もまたACE2受容体を発現しており、SARS-CoV-2による感染の主要部位である可能性が高い。このことは、これらの細胞への感染が、嗅覚機能の喪失の根本的なメカニズムであり、中枢神経系へのウイルスの侵入の手段である可能性を示唆している[161]。
このことは、軽度から中等度の重症度のCOVID-19患者の約86%(417人の患者を対象としたヨーロッパの研究)が嗅覚機能障害を報告しており、そのうち35%の患者がCOVID-19の他の一般的な症状の前または同時に無嗅覚を報告しているという事実によって裏付けられている[167]。
嗅覚機能障害はまた、95%以上の症例でパーキンソン病(PD)の早期前臨床指標であり、運動機能障害に数年先行する可能性がある[168,169,170]。
PDの場合、非ドパミン作動性神経伝達物質系(コリン作動性、セロトニン作動性、ノルアドレナリン作動性)の損傷が嗅覚障害を引き起こし、さらにミクログリアの調節障害による局所的な脳炎症および酸化的損傷の誘発をもたらすと考えられている[169,171]。
メカニズムは異なると思われるが、嗅覚系への根本的な損傷は、結果的に脳の炎症と酸化ストレスの誘導にもつながる可能性がある。確かに、例えば細菌性髄膜炎[174]やウイルスに関連したHIV誘発性神経認知障害[175]では、脳は酸化ストレス[172,173]のレベルが上昇しやすい。
COVID-19の神経学的症状の根底にある病理学的メカニズムはまだ十分に理解されていない。中国のCOVID-19患者からの剖検報告では、脳内の神経変性および浮腫の存在が確認されている [159]。
Liら[176]は、心肺機能を調節する脳幹へのSARS-CoV-2の浸潤が、一部のCOVID-19患者における急性呼吸不全の病態生理に関与している可能性を示唆しているが、この仮説はまだ検証されていない。実際、SARS-CoV-2感染による感染のメカニズム、および直接的・間接的(例えば、低酸素、サイトカインストーム)な影響と損傷を理解するためには、さらなる研究が非常に必要である。
さらに、COVID-19による中枢神経系への根本的な損傷またはホメオスタシスの乱れは、ウイルスが根絶された後も持続的な神経障害をもたらす可能性があり、これらの障害を緩和する可能性のある治療法についての更なる調査が必要である。実際、中枢神経系のウイルス感染はPD [177](特に、嗅覚障害がPDの初期指標の1つであることを考慮すると)およびアルツハイマー病、ダウン症候群、レビー小体型認知症などの他の神経変性疾患の危険因子であることが示唆されている [169]。実際、以前の研究では、PD患者の脳脊髄液を調べてコロナウイルス抗原の存在を確認し、コロナウイルス感染とPDとの関連性を示唆している[178]。
したがって、SARS-CoV-2による感染および嗅球の損傷は、パーキンソン病などの神経変性疾患のリスクを高める可能性がある。さらに、フランスでの研究によると、ICUに入院した患者の約20%に見られる脳症や脳虚血性脳卒中などの重度の神経学的イベントは、永久的な脳損傷につながる可能性がある。ほとんどの神経変性疾患 [76,173,179,180] および脳卒中 [76,181,182] は、酸化ストレスが関与していることがよく知られている。
アミロイドβ [58,59,183]、シスプラチン [184]、D-ガラクトース誘発性認知症 [185]、ラット網膜ニューロンにおけるN-メチル-D-アスパラギン酸誘発性細胞毒性 [186]など、試験管内試験(in vitro)と生体内試験(in vivo)の両方のモデルにおいて、エルゴチオネインは様々な神経毒に対して防御的であることが示されている。さらに、前臨床研究では、6-ヒドロキシドパミンを用いたPDマウスモデルにおいて、エルゴチオネインがドーパミン作動性ニューロンと運動機能を保存することが明らかにされている(準備中の原稿)。
また、パーキンソン病 [74] と軽度認知障害 [60](認知症の初期段階)の患者では、年齢をマッチさせた対照群に比べてエルゴチオネインの血中濃度が有意に低いことが示されており、エルゴチオネインの血中濃度の低下が神経変性の危険因子である可能性が示唆されている。
これらの神経変性モデルにおけるエルゴチオネインによる保護機構には、神経炎症や酸化損傷からの保護、ミトコンドリア機能障害の予防、金属キレート、またはまだ明らかにされていない他の神経保護機構が関与している可能性がある[59,61,184,185]。
エルゴチオネインは、これらおよびおそらく他のメカニズムを標的とすることにより、脳のSARS-CoV-2感染に対して保護的である可能性がある。さらに、前述したように、エルゴチオネインによる高凝固状態の予防および虚血再灌流傷害に対する組織の保護は、COVID-19の多くの重症例で報告されている脳虚血性脳梗塞中の損傷の予防または軽減に意味を持つ可能性がある。エルゴチオネインは、脳損傷後の修復に関与する可能性のある神経細胞の分化および成熟に役割を果たすことが示唆されている[51,52,53]。
研究では、培養海馬ニューロンをエルゴチオネインに曝露すると、シナプス形成マーカーであるシナプシン-1、ニューロトロフィン-3、-5の発現が上昇することが示されており、マウスへのエルゴチオネイン補給は、学習と記憶(物体認識テスト)を強化し、海馬の成熟した棘の数を増加させることが示されている[51]。この能力は、ウイルスの浸潤や脳内ニューロンの損傷に続いて有用である可能性がある。
もう一つの重要な要因は、エルゴチオネインが血液脳関門を通過し、経口摂取後に脳内に蓄積される可能性があることである。数多くの報告では、齧歯類の脳の海馬、視床下部、小脳、および運動野領域のニューロンにおけるOCTN1の存在が確認されている[187]。
前述のように、エルゴチオネインは、他のいくつかの薬や栄養補助食品のように急速に体内からクリアされず、動物[32,188,189]と死後のヒトサンプル[24,190]での研究から立証されたように、脳への高いバイオアベイラビリティを持っている。COVID-19の神経症状の根底にある病態はまだ完全には解明されていないが、特に病態が酸化的損傷や炎症を伴う場合には、エルゴチオネインが保護的役割を果たす可能性が高いと考えられる。
確かに、エルゴチオネインがSARS-CoV-2に対する神経保護作用を有するかどうかを評価するためには、さらなる研究が必要であり、これらのメカニズムおよび他のメカニズムを介して評価する必要がある。
3.7. 機能不全の鉄代謝の回復
COVID-19の病態における鉄の役割はまだ明らかにされていない。しかしながら、鉄は多くのウイルスによるゲノム複製およびタンパク質翻訳において役割を果たすことが示されており、実際に鉄をキレートすることは、HIV、ヒトサイトメガロウイルス、ワクシニアウイルス、単純ヘルペスウイルス1、およびB型肝炎ウイルスなどのウイルスの伝播を試験管内試験(in vitro)で制限することが実証されている[191]。
鉄、活性酸素、および炎症が相互に関連していることはよく知られており、鉄の調節障害または鉄金属タンパク質の破壊によって生成される過剰な遊離鉄は、フェントンが生成する活性酸素(つまり、H2O2からの-OHのFe2+依存的な生成)を介して疾患の進行と重症度を悪化させ、さらに炎症を促進させる可能性がある[76]。
鉄の恒常性の崩壊は、脳、肝臓、腎臓、特に肺の多くの障害(ARDSを含む)の一因であることが知られており、過剰な遊離鉄が酸化ストレスとさらなる炎症を助長している[76,90,192,193]。実際、ARDS患者の気管支肺胞洗浄液では、健常対照者と比較して総鉄および非ヘム鉄のレベルが上昇していることが確認されている[90]。
LiuとLi [194]は、SARS-CoV-2ウイルスに含まれる特定のタンパク質が赤血球中のヘモグロビンと結合してヘムから鉄を解離させ、肺のガス交換障害に寄与しながら損傷を引き起こすのではないかとさえ推測している。しかし、この仮説を支持する証拠はまだない。
フェリチン(鉄貯蔵タンパク質)のレベルの上昇は、サイトカインストームおよび敗血症と関連しており、高い死亡率とリンクしている [195,196,197]。実際、高フェリチン血症はCOVID-19患者で観察されている(無症状の症例であっても)[198]。
これが、重篤なCOVID-19患者におけるサイトカインストームおよび敗血症を引き起こす根本的な病理学的メカニズムの一つである可能性が示唆されており[199]、初期の報告では、フェリチンレベルが極めて高いことが死亡率と相関していることが実証されている[115]。
研究は、高フェリチンレベルがマクロファージ活性化(ウイルス感染症で見られるマクロファージ活性化症候群)の指標であることを示しており[200]、フェリチン自体が炎症促進性サイトカインとして機能する可能性があり[201]、それゆえにサイトカインストームをもたらす炎症の悪循環の伝播に役割を果たす可能性があることを示している[197,202]。
遊離鉄は、特定の活性酸素に曝露されるとフェリチンから放出されることがある[76]。これは、COVID-19の死亡率の最も一般的な3つの促進因子であるARDS、サイトカインストーム、および敗血症による症状の重症度を軽減するための鉄のキレーションの事例を提示している。
実際、以前の研究では、エルゴチオネインは、Fe2+およびCu2+を含む2価の金属イオンを高い安定性定数でキレートすることができることが実証されている[40,42,203]。この金属イオンのキレート化は、エルゴチオネインとレドックス不活性複合体を形成し、それによって生体分子の損傷を防止する[33,41]。
このことは、遊離鉄がARDSの病態やSARS-CoV-2感染に関連した他の臓器の合併症を悪化させる場合、エルゴチオネインがさらなる酸化ストレスの促進を防ぐ役割を果たし、肺や他の組織や臓器(特に脳)へのダメージを軽減することを示唆していると思われる。前述のように、エルゴチオネインは、プロ炎症性サイトカインの発現を調節することが示されており、したがって、マクロファージの活性化および高フェリチン血症に関連する高炎症の連鎖を断ち切る役割を果たす可能性がある。
3.8. 急性腎・肝障害からの保護
中国からの初期報告では、COVID-19による腎障害の有病率は比較的低い(入院患者の0.5~7%)ことが示されている[111]。
しかし、最近の報告では、発生率が当初示されていたよりもはるかに高いことが示唆されており、ニューヨークのCOVID-19入院患者5449人を対象とした最近の研究では、1993人の患者、すなわち入院患者全体の36.6%が急性腎障害(AKI)を発症し、そのうち14%が透析を必要としていたことが示されている[204]。
AKI(血清クレアチニン値と尿素値の上昇、および尿中蛋白質の高値を伴う)は一般的に、より重篤な症状、特に人工呼吸を必要とする症状と関連しており、予後不良の予後因子である。ACE2が腎尿細管細胞 [207] および上皮細胞 [208] で高度に発現していることは研究で実証されているが、AKIが腎系への直接的なウイルスの侵入によるものか、呼吸障害、腎静脈の血栓性イベント、サイトカインストームによる巻き添え損傷の二次的な犠牲として間接的に発生するものかはあまり明らかではない。
しかし、研究ではAKIと呼吸不全の間に強い相関関係があることが明らかにされており、機械換気を行っている患者の90%近くがAKIの症状を示していることから、エビデンスは後者であることを示唆している [204]。
これは他の研究でも観察されており、さらに、AKIの最初の発生は、ほとんどの呼吸不全患者の挿管と機械換気の時間に密接に追随しており、腎管上皮の壊死につながる虚血を示唆している[204,209]。
サイトカインストームの間のIL-6の上昇もまた、腎尿細管上皮の損傷を介したAKIの一因であることが示唆されており、その結果、IL-6がさらに上昇し、肺-腎臓の両方向の損傷を示唆している[210]。
腎代替療法を必要とする重症例を除いて、AKIには特異的な治療法はなく、COVID-19療法はARDSおよび敗血症の管理のための大部分の補助的な役割を果たしている[205]。
実際、エルゴチオネインはこの治療的役割に適している。げっ歯類を用いた研究では、エルゴチオネインが活性酸素生成物質であるニトリロトリ酢酸第二鉄による腎臓と肝臓の酸化的損傷を減少させることが実証されている[104]。対照的に、慢性腎臓病のマウスモデルでエルゴチオネイントランスポーターをノックアウトすると、腎臓の損傷と線維化が増加し、酸化的損傷が上昇した[105]。
さらに、慢性腎臓病患者ではエルゴチオネインの血中濃度が低下していることが明らかになり、エルゴチオネインの低濃度が腎障害の進行に役割を果たしている可能性があり、逆に補充が防御的である可能性があることを示唆している[105]。病院に入院した患者の約3分の1は肝機能検査にも異常があり、これは疾患の長期化と関連していた [211]。
COVID-19患者から採取した肝生検では、そのメカニズムはまだ明らかになっていないが、確かに肝障害の存在が明らかになった [112]。腎臓と同様に、根本的な機序としては、直接のウイルス感染によるもの、免疫介在性の損傷によるもの、呼吸不全や薬剤誘発性肝障害による低酸素性肝炎などが考えられる[212]。再利用される薬物試験の急増と新規治療法の開発により、治療法の選択は腎臓または肝障害にも役割を果たしている可能性がある。
肝細胞は通常、ACE2受容体を発現しないが、いくつかの研究では、肝損傷後にACE2発現がアップレギュレートされる可能性が示唆されている[215]が、他のグループでは、胆管上皮細胞におけるACE2の発現がSARS-CoV-2の肝臓への侵入を促進する可能性が示唆されている[216]。いずれにしても、肝障害の指標である肝酵素の上昇が多くの報告で示されている[211]。
腎臓と同様に、エルゴチオネインは肝臓でも有益である可能性があり、以前の研究では、マウスへの経口投与後にエルゴチオネインが急速に蓄積される最初の部位であることが実証されている[32]。
さらに、肝臓は損傷に反応してエルゴチオネイントランスポーターをアップレギュレートし、組織のエルゴチオネインレベルをさらに上昇させ、酸化的損傷、炎症、および線維化形成から保護する可能性があることが示されている[56,104]。
同様に、Tangらの研究[55]では、ジメチルニトロサミン(DMN)を投与した後、ヒトの肝細胞が酸化損傷とα平滑筋アクチンの両方のレベルを増加させる肝毒素であるジメチルニトロサミン(DMN)を投与した後、OCTN1をアップレギュレートしたことを確認した。逆にOCTN1をノックアウトすると、マウスの肝線維化マーカー、酸化損傷、炎症の有意な上昇をもたらした[55]。
COVID-19が持続的な腎または肝障害をもたらすのか、あるいは病変が線維化を促進するのかどうかは不明である。しかしながら、損傷の重症度および病変の持続期間を短縮することで、長期的な影響の可能性を大幅に減少させることが明らかになってきている。実際、透析を必要としないAKI患者のほとんどは、通常、ウイルスのクリアランス後に回復する[217]。さらに、肝障害が明らかな場合には、肝障害性薬物の使用に注意しなければならない。
逆に、これらの薬剤をエルゴチオネインと組み合わせて投与することは、実行可能なアプローチであるかもしれない。ここでのエビデンスは、エルゴチオネインの投与が腎および肝組織を保護し、重篤な転帰を防ぎ、線維化の形成を抑制し、それによってCOVID-19による持続的な損傷の可能性を減少させる可能性があることを示唆している。
3.9. 消化器疾患からの保護
SARS-CoV-2感染による吐き気、嘔吐、および下痢の例が報告されており、典型的にはより重篤な転帰と関連している [218]。消化器症状の発生率に関する報告は非常にばらつきがあり、初期の報告では1~4%[15,111]の頻度であったのに対し、後期の研究では約10%[16]および60%[219]の発生が報告されており、消化器症状はしばしば見落とされている可能性があり、それゆえに過小報告されていることが示唆されている。
中国とシンガポールの両方の研究では、患者の約50%で消化管内にウイルスが存在することが確認され、さらに、これらの患者の約43%では、呼吸器サンプルからウイルスが検出された後も、便サンプル中にウイルスが陽性であることが確認された[220,221]。
鼻咽頭スワブからウイルスが検出されなかった後も、便サンプル中のウイルスの脱落が継続していることは、他の研究でも確認されている[222,223]。
COVID-19に関与する他の組織や臓器と同様に、ACE2の発現は食道、胃粘膜、小腸、および結腸に豊富であり[224]、COVID-19患者の内視鏡検査中に撮影された消化管上皮のウイルス核カプシドタンパク質の免疫蛍光染色により、SARS-CoV-2が胃、十二指腸、および直腸の上皮に侵入できることが実証された[221]。
腸症状の発現につながる根本的なプロセスはまだ明らかにされていないが、ACE2は腸内炎症の重要な調節因子であり[225]、したがって、ウイルスの結合が腸内炎症および下痢につながることが示唆されている[226]。
ある患者では、内視鏡検査で食道の出血と潰瘍化が認められ、損傷部位にSARS-CoV-2 RNAが存在していた[219]。腸症状の根本的な原因、消化管内でのウイルスの長期的な存在、および長期的な影響の可能性はまだ明らかにされていないが、これまでのところ、腸症状の主な誘因は炎症であるようである。
先に述べたように、エルゴチオネインは虚血再灌流後のマウスの腸内の炎症性傷害を制限することができ、この保護はエルゴチオネイントランスポーターのノックアウトによって除去された[101]。
さらに、エルゴチオネインの血清レベルの低下は、腸の炎症性疾患であるクローン病と関連しており、これらのエルゴチオネインレベルの低下は、この炎症性腸疾患(IBD)を悪化させることが示唆されている[227]。研究は、実際に、高レベルのエルゴチオネインが消化管の様々な部分に到達することができ、経口投与後に上皮を通して吸収されることを実証している[32]。
さらに、マウスを用いたIBDの研究では、大腸炎モデルの消化管でOCTN1の発現およびエルゴチオネインの取り込みがコントロールと比較して上昇したことが実証されている[131]が、炎症後に組織のエルゴチオネインレベルを上昇させる適応反応の可能性を示唆している[57]。
著者らはまた、大腸炎マウスモデルから分離された扁平上皮単核細胞(LPMCs)にエルゴチオネインが入ることを示したが、OCTN1ノックアウト動物ではエルゴチオネインの取り込みはなく、炎症が悪化していることが示された[131]。これらのデータは、エルゴチオネインがCOVID-19患者の消化器系を保護する役割を果たしている可能性を示唆している。
3.10. 性腺症状からの保護
COVID-19感染が中国武漢の男性の精巣機能に及ぼす長年の影響についての研究が開始されている [229]。mRNAデータベースのバイオインフォマティクス研究は、精巣が体内で最も高いACE2受容体、特にライディッヒ細胞および精管内の細胞の発現量を有していることを示している[207]。
同じ受容体を標的としたSARS-CoVの先行研究では、多数の患者に精巣炎(睾丸炎)の証拠があることが明らかにされている [230]。実際、HIV、おたふくかぜ、B型肝炎、ヒトパピローマウイルスなどの他のさまざまなウイルス感染症は、男性不妊、ホルモン発現の変化を引き起こし、さらには精巣がんのリスク増加と関連している可能性があることが示されている [231,232,233,234,235]。
ある研究では、血清黄体化ホルモンに対するテストステロンおよび卵胞刺激ホルモンの比率が、対照(n = 100)と比較して若年成人男性COVID-19患者(n = 81)で有意に減少したことが示された[229]。数多くの報告で、精巣 [101,236] および精巣小胞 [237] に エルゴチオネイン トランスポーターが存在すること、および エルゴチオネイン が精巣に蓄積し、精巣分泌物に豊富に存在することが実証されている [238,239,240]。
抗腫瘍剤であるシスプラチンは、精巣障害やライディッヒ細胞機能障害を引き起こし、不妊症を引き起こすことが示されている[241]。しかし、ラットにエルゴチオネインを補充すると、シスプラチン誘発性生殖毒性から保護され、精子数が回復し、精巣の酸化的損傷および組織学的損傷が減少することが示された[242]。
精巣におけるエルゴチオネインの蓄積の理由は明らかではないが、これらの組織におけるエルゴチオネインの存在は、COVID-19による睾丸炎またはその他の持続的な損傷からの保護に役立つと考えられる。
3.11. 高齢者や病人における減少の回復
前述したように、年齢および基礎となる併存疾患は、COVID-19による疾患の重症度および死亡率の上昇と強く関連している。なぜ高齢化が死亡率の最も高い危険因子として際立っているのかについては、複数の説がある。
年齢の上昇に伴い、基礎となる併存疾患および加齢に伴う障害を有する可能性がはるかに高くなる [243]。さらに、高齢になると肺機能の低下 [244]、免疫機能の低下 [245]、GSH [76,246]などの特定の内因性抗酸化防御のレベルの低下、および基礎となる慢性炎症の増加 [247] も見られる。
これらはすべて、SARS-CoV-2感染を中和する能力の低下と、ARDS、サイトカインストーム、敗血症などの重要な症状の悪化に寄与していると考えられる。
最近の研究では、SOD3(細胞外環境でO2の分解を触媒する細胞外Cu/Znスーパーオキシドディスムターゼ-抗酸化酵素をコードする[76])が、高齢者と若年成人との間の肺の肺胞II型細胞で最もダウンレギュレーションされた遺伝子であることが明らかになり、これが高齢者におけるCOVID-19の重症度の増加の理由の一部である可能性が示唆された[248]。
さらに、我々や他の研究者は、加齢とともにエルゴチオネインの血漿中濃度が低下することを明らかにしており、これが加齢に伴う障害や虚弱性の危険因子である可能性があることを明らかにしている[60,72]。
実際、年齢を一致させた健康な対照者と比較して、血漿中エルゴチオネイン値が有意に低いことが、さまざまな障害において確認されている [60,64,73,74]。
血漿中エルゴチオネイン値の低下の理由は不明であるが、これは慢性疾患の結果としての枯渇によるものではないかと推測できる [246,249]。これは、エルゴチオネインの補給が加齢に伴う障害のリスクを軽減したり、潜在的に酸化ストレスや炎症などの根本的な病態を打ち消すように作用する可能性があるという根拠を提供することになる。
実際、Smithらによる最近の研究[64]では、エルゴチオネインの血漿中濃度の高さが心血管疾患や死亡率のリスクを低下させる独立したマーカーであることを発見したが、他の研究では、エルゴチオネインのサプリメントは健康的な老化と長寿[71]を促進し、虚弱体質[72,73]を予防する可能性が示唆されている。
以前に提示されたエビデンスは、エルゴチオネインが症状の重症度と死亡率の低下に寄与する可能性があることを示唆しているが、我々は、エルゴチオネインはまた、老化と虚弱性に関連する因子を減少させることにより、それによって重篤な感染症の可能性を減少させることにより、予防的な役割を果たす可能性があることを提案している。
3.12. 併存疾患からの保護
糖尿病、心臓病、高血圧、肥満、喘息、慢性閉塞性肺疾患(COPD)、PD、腎疾患または肝疾患、および喫煙者、免疫不全者、または特定の遺伝的因子(例えば、グルコース-6-リン酸デヒドロゲナーゼ(G6PD)欠損症[250,251,252,253,254,255]を含む(ただし、これらに限定されない)COVID-19による合併症および死亡の高いリスクと、多数の基礎となる併存疾患または因子が関連している。グルコース-6-リン酸デヒドロゲナーゼ(G6PD)欠損症 [250,251,252,253,254,255]。
これらの基礎となる危険因子のほとんどについて、疾患症状の激化の原因は、体内の慢性炎症性および不均衡な酸化還元状態、および喘息、COPD、肺高血圧症などの肺疾患における呼吸機能の低下、または喫煙によるものである可能性が高い。
しかし、いくつかの他のあまり明らかではない状態は、基礎となる病態についての洞察を提供し、COVID-19のための新しい治療法につながる可能性がある。そのような例として、G6PD欠損症の患者が挙げられるが、これはコロナウイルス感染に対する脆弱性の原因となることが示唆されている[254,255]。
これは、内因性抗酸化物質とプロオキシダントプールのバランスが崩れ、後者に有利な状態になっているためであるとの報告がある;したがって、G6PD欠損者は、活性酸素と炎症のフラックスにうまく対処できない可能性がある[76,256]。
さらに、以前の研究では、G6PD欠損による酸化ストレスの上昇が、コロナウイルス感染に対して細胞がより脆弱になる原因となったこと(取り込みおよびウイルス複製の増加)、および抗酸化物質(α-リポ酸など)の補充が、ウイルス感染からG6PD欠損者を保護するのに役立つ可能性があることが実証されている[257]。
実際、エルゴチオネインは、抗酸化剤として作用する能力だけでなく、このレビューで説明したCOVID-19の様々な他の病理学的メカニズムから保護する能力も実証しており、COVID-19の間、G6PD欠損者にとってより大きな利益をもたらす可能性があり、別の可能性の高い候補となるであろう。
別の例は、肥満である。フランスのある医療施設での研究では、ICUに入院した124人のCOVID-19患者のうち、約48%が肥満範囲、すなわち≧30(kg/m2)のBMIを有しており、重度の肥満者の約90%が侵襲的な機械換気を必要としていることが実証された[258]。Kassらの報告 [259] では、入院したCOVID-19患者の年齢とBMIの間に逆相関があることが明らかにされており、BMIが高い若年者ほど重篤な転帰を示している。
肥満は多くの代謝性疾患 [260] および心血管系疾患 [261] の主要な危険因子であり、したがって、これらの患者の多くは前述の併存疾患の1つまたは複数にも苦しんでいる可能性がある。
肥満自体もまた、慢性炎症[262]、酸化ストレス[263]の上昇、および免疫機能の低下[264]に関連した状態である。COVID-19のこのような症状および他の症状から保護することにより、エルゴチオネインは、これらの個人における感染の重症度および死亡率を減少させるのに役立つかもしれない。
前述のように、研究では、高い血中エルゴチオネインは肥満と一般的に関連している心代謝性疾患のリスクの低下と独立して関連していることが明らかになった[64]。
3.13. COVID-19感染後の長期的な影響からの保護
驚くべき数の報告が、SARS-CoV-2が身体の大部分の領域に広がり、複数の組織や臓器に損傷を与える能力を明らかにし始めている[265]。呼吸器系感染時の咳、発熱、呼吸窮迫などの典型的な肺炎様症状に加えて、眼症状 [266,267]、精巣感染および損傷 [229,268]、腎損傷 [269]、下痢およびその他の消化管障害、肝障害、心血管系合併症などの他の症状が報告されており、感染後に長期的な臨床的影響があるかどうかが疑問視されている [111]。
現在、肺がウイルスの主要標的である一方で、体内の様々な組織でACE2受容体が発現することで、脳、心臓、血管、腎臓、精巣、腸など、体の他の多くの領域にウイルスが感染することを可能にしているという証拠が出てきている[265]。これは、特に血管系およびリンパ系への浸潤によるものである[164]。
経口投与であっても、全身の組織および重要な器官におけるエルゴチオネインの広範な分布および蓄積は、これらの領域へのダメージを軽減しうる高いバイオアベイラビリティーを保証する[32,101]。
SARS-CoV-2が広範囲の組織や臓器に感染する能力は、ウイルスが除去された後も、引き起こされた損傷が持続的な傷害や疾患リスクの上昇につながるかどうかという問題を提起している。SARS-CoVに感染した患者を対象とした先行研究では、病気の持続期間および重症度は、感染後の持続的損傷の可能性と相関があることが示唆されている[270]。したがって、症状の重症度と持続時間を短縮することを目的とした治療法は、持続性傷害を予防する上で非常に重要である。
多くの研究者は、損傷についてより明確な理解を得て、これらの臓器の回復を促進する薬剤を開発することが緊急に必要であることを強調している[271]。
SARS-CoV-2が出現してまだ数ヶ月しか経っていないため、このウイルスが癌、神経変性疾患、心血管疾患、脳卒中、高血圧などの後の人生における障害の発症リスクを高めるかどうかについては、現在のところほとんど知られていない。しかし、他の特定のウイルスに感染すると、がんや心血管疾患などの障害のリスクが大幅に上昇することが研究で明らかになっている。
例えば、B型肝炎やC型肝炎、ヒトパピローマウイルスはそれぞれ肝臓がんや子宮頸がんと関連しており[272]、サイトメガロウイルス感染は心血管疾患のリスクを有意に増加させることと関連している。酸化的損傷は、これらのウイルス関連の危険因子のすべてに関与している [76,273,274]。これは、再び、エルゴチオネインの投与による潜在的な利益を強調している。
もう一つの長期的な効果は、肺線維化であろう。これは、組織のリモデリング、間質壁の肥厚、および損傷を受けた肺組織の瘢痕化から生じ、肺胞間の組織の硬化による呼吸機能の喪失につながる可能性がある。
2003年に行われた薄切片コンピュータ断層撮影(CT)スキャンを用いた先行研究では、SARS患者の約62%に線維化の証拠があることが明らかになっており、これは高齢の患者やより重篤な疾患症状を持つ患者に多く見られた [253]。
SARS-CoV感染生存者を対象とした1年間の追跡調査では、中等度の患者の3分の1が持続性の肺機能障害を有していたことが明らかになった [275]。別の研究では、11人中9人の患者がSARS-CoV感染後7年経っても軽度から中等度の肺機能障害を有しており、薄切開CTスキャンでは間質肥厚が明らかになっていることが明らかになった[276]。
中国からの最初の報告では、入院したすべてのCOVID-19患者の肺のCTスキャンで「パッチ状の影や地面ガラスの不透明度」が明らかになったが、これは線維化につながる間質肥厚の初期の兆候である可能性を示唆するものもあった[16]。実際、COVID-19患者の肺組織の死後組織学的解析では、線維化の証拠が明らかになり、それは罹患期間と正の相関を示していた [270]。このことは、肺損傷およびARDSの罹患期間が長期化すると、肺組織の長期的な瘢痕化の可能性が高まることを示唆している。
したがって、呼吸器疾患の重症度と期間を短縮することは、長期的または恒久的な肺損傷を軽減する上で極めて重要である。
肺線維症につながる間質性肺疾患の研究では、これらの病態の発症と進行に酸化還元剤の不均衡が強く関与していることが示唆されている。特定の酸化還元剤、特にN-アセチルシステインは、線維増殖イベントを減衰させることが示唆されている[277,278]。したがって、エルゴチオネインは、複数のメカニズムを介して作用し、肺線維症の予防における主要な候補となる可能性がある。
実際、研究では、エルゴチオネインだけでなく、タバコの煙の有害な影響から肺上皮細胞を保護するだけでなく、肺上皮間葉転換、肺線維症の重要なイベントを阻害したことが示されている、それにより、エルゴチオネインは肺の線維腫形成を防ぐことができることを示唆している[54]。
4. エルゴチオネインの安全性
エルゴチオネインは天然に存在する化合物で、高濃度に含まれるキノコ類を除いて多くの食品に低濃度で含まれている[24,279]。文献には多くのエルゴチオネインに関する研究があるにもかかわらず、高濃度であっても、その投与による毒性を報告したものはまだない。
ラットを対象とした毒性試験では、2000 mg/kg/日の単回急性用量または725 mg/kg/日の連続用量を92日間投与しても副作用は報告されていない。さらに、725mg/kg/日では、受胎可能性、妊娠、および分娩に観察可能な影響は見られず、また、子 供には臨床的または生理学的に有害な適応は見られなかった [280]。Schauss ら [281,282] はまた、エルゴチオネイン 投与による突然変異原性及びクローン原性の影響がないことを立証している。
米国FDAは「一般的に安全と認められた」(GRAS)のステータスを承認し、さらに、欧州食品安全局は、乳児、幼児、妊娠中および授乳中の女性であっても、食品補助食品としてエルゴチオネインを使用することを承認している[283,284]。
私たち自身の研究では、健康な若年成人(30歳未満)に1日25mgを7日間投与しても、臨床的および心理的に有害な影響はないことが明らかになった[29]。さらに、現在実施中の高齢者を対象とした臨床試験では、25mg/日を週3回、1年間投与しても、これまでのところ臨床上の有害事象は観察されていない(NCT03641404)。
私たちの知る限りでは、エルゴチオネインの禁忌は知られていないし、すべての人が体内にエルゴチオネインを持っているので(そのレベルは食事に依存する)、この可能性は低いように思われる。
まとめると,このことは,臨床使用におけるエルゴチオネインの安全性を示しており,その潜在的な有効性の証拠とともに,COVID-19の患者にエルゴチオネインを治療に応用するための説得力のあるケースを提供している。
5. 最後に
COVID-19パンデミックの世界的な影響は、控えめに言っても壊滅的である。COVID-19による感染症の総数と死者数(死亡率ははるかに低いにもかかわらず)は、以前のSARSとMERSを合わせたものをはるかに超えている。SARS-CoV-2が肺以外の広範囲の細胞や組織に侵入する能力により、症状の範囲が広がり、重症度は無症状から多臓器不全に至るまで極端なものとなっている。
早期の指標や患者の一貫したモニタリングがなければ、特定の症状の治療が手遅れになることが多い。また、特定の臓器への長期的な損傷の可能性や、後の人生で障害のリスクが高まることで、医療制度への負担が増大する可能性があることも懸念されている。
現在のところ、治療法はほとんどが探索的なものであり、特に症状の多様性、集団、および基礎となる併存疾患を考慮すると、不明確な定義がなされていない。ワクチンや薬剤の再利用のための多大な努力にもかかわらず、臨床評価には時間がかかり、安全で実行可能な選択肢が表面化するまでには数ヶ月から数年かかるかもしれない。
このレビューでは、COVID-19に関連する重症度と死亡率を低下させ、患者の予後を改善する治療法として、安全で天然に存在する多面的な化合物であるエルゴチオネインのケースを紹介する(図1)。
このユニークな化合物に関するかなりの数の研究で、広範囲の組織における損傷や基礎となる病態を軽減する可能性が実証されている(図2)。
実際、エルゴチオネインは体内のほとんどの(すべてではないにしても)組織に容易に吸収され、蓄積されることが示されている。
いくつかの証拠は、エルゴチオネインがいくつかのウイルスの浸潤と伝播を緩和する直接的な役割を果たすことを示唆しているが、これが実際にSARS-CoV-2の場合に当てはまるかどうかを確認するための研究を行う必要がある。
COVID-19に対する治療や予防のためのエルゴチオネインの応用を検討した研究はまだないが、これはさらなる調査が必要である。
エルゴチオネインの考えられる作用機序の概要
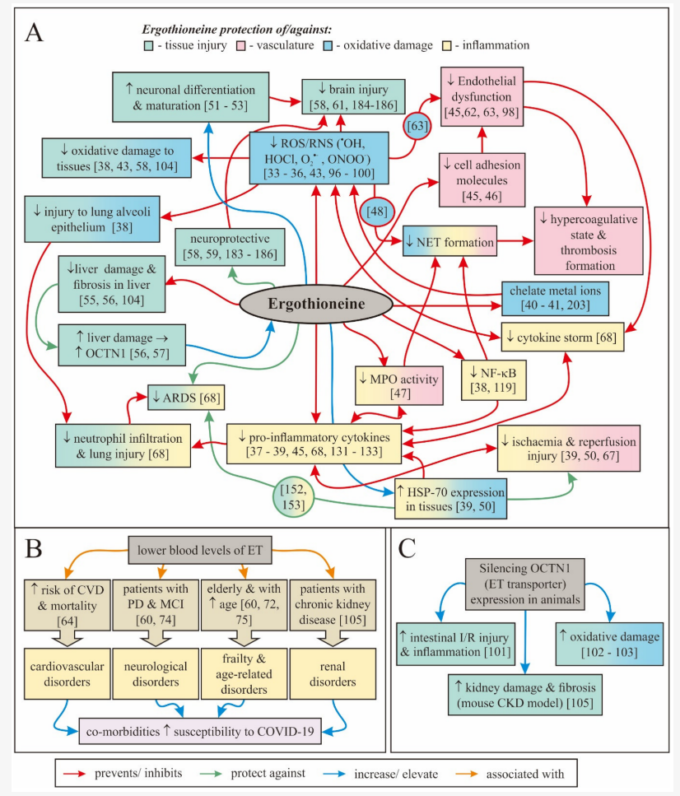
A)エルゴチオネインがCOVID-19患者の症状の重症度を軽減し、それによって死亡率を減少させる可能性のある直接的および間接的な機序の概要 [33,34,35,36,37,38,39,40,41,43,45,46,47,48,50,51,52,53,55,56,57,58,61,62,63,68,96,97,98,99,100,104,119,131,132,133,152,153,184,185,186,203] (B) 母集団研究は、COVID-19患者の症状の重症度を軽減し、それによって死亡率を減少させることを示している。
(B) 母集団研究では、エルゴチオネインの血中濃度の低下が幅広い障害および虚弱性と関連していることが示されており、補充がこれらの疾患のリスクを補助または低減する可能性があることが示唆されている。
これらの障害はまた、おそらくCOVID-19による死亡のリスクを増加させる併存疾患であり、おそらくこれらの個人のためのエルゴチオネインのより大きな治療的価値を強調している[60,64,72,74,75,105]。
(C) 逆に、動物実験でエルゴチオネイントランスポーターをサイレンシングすることは、疾患に対する感受性を高め、これらのモデルでは酸化的損傷および炎症を上昇させる可能性がある[101,102,103,105]。
図2. エルゴチオネインによる組織保護の概要
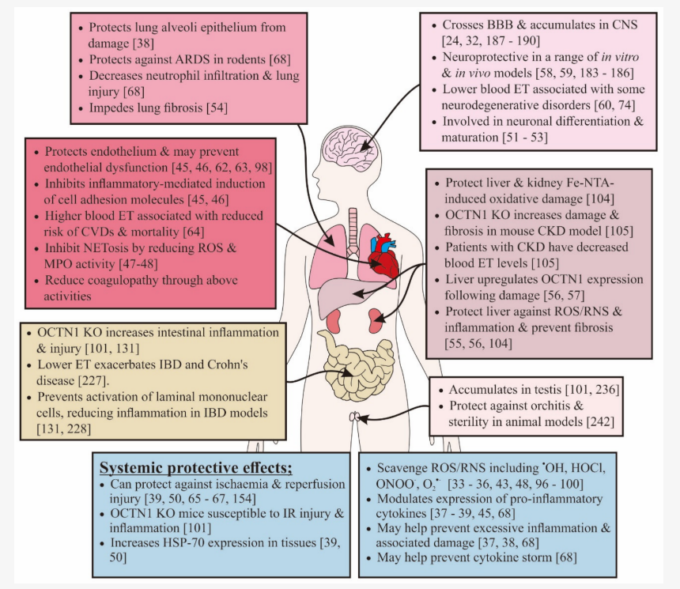
[24,32,38,45,46,47,48,51,52,53,54,55,56,57,58,59,60,62,63,64,68,74,98,101,104,105,131,183,184,185,186,187,188,189,190,227,228,236,242]。
エルゴチオネインは、体内のほとんど(すべての組織ではないにしても)、特に以下に示すような組織に蓄積することができることを示唆する証拠がある。
現在の知見に基づき、以下の図は、COVID-19患者における他の細胞保護効果の中で、エルゴチオネインがどのように様々な器官および組織を酸化的損傷および炎症性傷害から保護するかを強調している。
青色のボックスは、身体のすべての組織に対する全身的な利点を強調している[33,34,35,36,37,38,39,43,45,48,50,65,66,67,68,96,97,98,99,100,101,154]。
専門家は、SARS-CoV-2の完全な根絶には予想をはるかに超えた時間がかかると推測しており、世界中のさまざまなコミュニティで再燃が起こっているため、おそらく数年はかかるだろうと推測している。したがって、COVID-19に関連する重症度、持続期間、後遺症、および死亡率を減少させる可能性のある安全で新しい治療法の試験が緊急に必要とされている。

