SARS-CoV-2 spike protein-induced platelet activation: Mechanism for virus and vaccine-induced thrombotic thrombocytopenia
www.researchsquare.com/article/rs-746765/v1
概要
Covid-19パンデミックは、効果的なワクチンの開発を非常に早く促した。最近の研究では,Covid-19の患者とワクチンによる血栓性血小板減少症(ワクチン誘発性血栓性血小板減少症)の患者の両方で,血小板活性化抗体が検出された。ここでは、様々なツールを用いて、SARS-CoV-2スパイク糖タンパク質(スパイクプロテイン)とPF4との結合反応を同定し、免疫原性のある血小板活性化PF4/スパイクプロテイン複合体を形成することを明らかにした。この結合は、水晶振動子型マイクロバランス、酵素免疫測定法、力スペクトルでそれぞれ観察される質量、光学強度、安定した結合力の増加によって証明された。
スパイクプロテインは,PF4のサイズを増大させ,動的光散乱法で評価したPF4の表面ゼータ電位を正から負の値に切り替えた。スパイクプロテインによって誘発された血小板の凝集は,ファンクショナルアッセイとフローサイトメトリーによって確認されたが,濃度依存的であった。
この結果から、形成されたPF4/スパイクプロテイン複合体は、一方ではPF4抗体の形成を誘発し、他方では血小板を媒介・活性化して血栓イベントを誘発することが可能であり、これがCovid-19患者に観察される過剰な血液凝固活性のメカニズムであることがわかった。
ベクターベースのワクチンでは、転写過程で可溶性スパイクプロテインが産生され、抗原性のあるPF4/スパイクプロテイン複合体を形成することで、Ad26.COV2.SやChAdOx1nCoV-19ワクチンを接種した人に高い確率で血液凝固作用が現れることが示唆される。現行のワクチン誘発性血栓性血小板減少症診断ガイドラインにPF4/スパイクプロテイン複合体を追加考慮することで、患者の治療が改善されると考えられる。今回の結果は、Covid-19患者の治療に効果的な方法を開発し、Covid-19ワクチン接種の安全性を向上させることが求められている。
はじめに
Covid-19パンデミックは、現在(2021年7月24日)までに世界で約1億9,500万人の感染者と約420万人の死亡者を出している1,2。入院中のCovid-19患者は、脳卒中、四肢虚血、静脈血栓塞栓症などの血栓性合併症を発症するリスクがある3。院内死亡のリスクが高い重症肺炎患者の血栓塞栓症の発生率は約25%です5。死亡者の約71.4%に凝固プロファイルの異常が認められた6。ヘパリンは、予後を良くすると考えられているため、高用量/2倍量であっても凝固障害の管理に推奨されている7。しかし、重症のCovid-19患者では、ヘパリン誘導性血小板減少症(HIT)抗体が確認されている9-12。これらのヒト抗体は、血小板、単球、好中球を架橋して活性化し、PF4/H複合体を介して内皮細胞(EC)に結合し、生命を脅かす合併症を引き起こす14。典型的なHIT抗体は、PF4/H複合体のみを認識するが、PF4-auto抗体は、PF4単独およびPF4/H複合体の両方と相互作用し、血小板の活性化を引き起こす15。集中治療室でのCovid-19患者のHIT発生率は、Covid-19を使用していない重症患者(0.18%)よりも高い(1.16%)16 パンデミックに対抗するために、様々な種類のCovid-19ワクチンが広く投与されている17-18。しかし、複製不能なアデノウイルスベクターを組み込んだワクチン(ChAdOx1 nCoV-19、AstraZeneca社)を接種した個体は、PF4抗体を発現し、これが血小板を活性化して血栓性血小板減少症を引き起こした19-23。 mRNAワクチン(BNT162b2, mRNA-1273)の被曝体もこの副作用に悩まされていた24-25が、上記のワクチンに比べて低率であった26。Covid-19の患者とワクチン被曝者の両方から血小板を活性化するPF4抗体が検出されているが、これらの抗体が発現するメカニズムはまだ解明されていない。一般に、血小板活性化抗体の発現には、炎症状態と凝固カスケードの活性化が関与していると言われている。
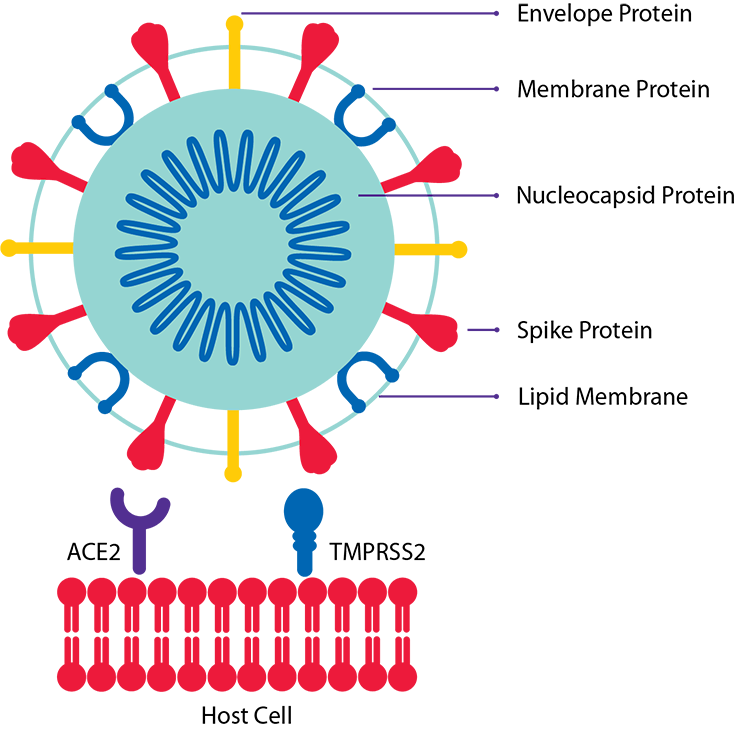
SARS-CoV-2のスパイクタンパク質は、S1サブユニットとS2サブユニットから構成され、受容体認識と細胞膜融合プロセスにおいて重要な役割を果たしている27。ウイルスはまず、S1サブユニットを介して細胞受容体であるアンジオテンシン変換酵素2(ACE2)と結合し、細胞内に侵入する28-29。この過程で、S2サブユニットの疎水性融合ペプチドが露出し、ウイルスが細胞膜に融合する30。一方、血漿由来の精製PF4タンパク質は、正電荷を帯びた残基が環状に並んでいるため、異なる分子と静電的に結合することができ、その結果、生体内で明らかな炎症促進作用を示す32。健康なドナーの血清に含まれるPF4の量は0.5μg/ml以下であるが、重症および非重症のCovid-19患者では、PF4の血漿レベルが30μg/mlまで強く上昇する33。PF4は、負に帯電したポリアニオン35、血小板上の細胞外グリコサミノグリカン(GAG)14、内皮細胞上のヘパラン硫酸36-37と強く結合し、局所のアンチトロンビン(AT)活性を阻害することで凝固を促進する。
SARS-CoV-2のスパイクタンパク質サブユニット2(スパイクプロテイン)がPF4をクラスター化し,免疫原性複合体を形成することで,免疫細胞,特にB細胞が血小板活性化PF4抗体を分泌し,血栓性血小板減少症を引き起こすという仮説を,タンパク質の特徴から導き出した。
ここでは、スパイクプロテインがPF4をクラスター化していることを、複数のナノ生物物理学的手法と分析手法を用いて証明した。動的光散乱(DLS)を用いて,スパイクプロテインによるPF4のサイズとゼータ電位の変化を追跡した。一方,水晶振動子マイクロバランス(QCM)を用いて,スパイクプロテインとPF4の結合による質量変化を追跡した。また、単一分子力顕微鏡(SMFS)を用いた原子間力顕微鏡により、相互作用の結合力を確認し、酵素結合免疫吸着法(ELISA)を用いて96ウェルプレート上で結合を確認した。その結果、スパイクプロテインはPF4をクラスター化し、生成した複合体の表面ゼータ電位を負の値に切り替え、PF4/スパイクプロテイン複合体の最大サイズは、PF4とスパイクプロテインの濃度が狭い範囲でのみ得られることがわかった。重要なのは、スパイクプロテインが血小板の凝集を強く誘導することである。これは、機能的HITアッセイでテストされ、共焦点レーザー顕微鏡(CLSM)で可視化された。スパイクプロテインによる血小板の活性化はフローサイトメトリーで確認された。これらの結果と最近の知見に基づいて、我々は、結果として生じる抗原性のPF4/スパイクプロテイン複合体が免疫B細胞に血小板活性化PF4抗体の産生を促し、血小板の凝集/活性化を大量に誘発するというメカニズムを提案する。これにより、Covid-19患者とワクチン接種者の両方における異常な血液凝固障害が説明できる。
考察
SARS-CoV-2のスパイクプロテインはPF4をクラスター化することを複数の分析手法を用いて明らかにした。それはPF4のコンフォメーション変化を誘発し、PF4の表面ゼータ電位を正から負の値に切り替えた。形成されたPF4/スパイクプロテイン複合体は、濃度依存的に血小板凝集を誘導した。 この観察結果から、我々はCovid-19患者におけるSARS-CoV-2による血小板減少症のメカニズムを提案した(図5)。正電荷を帯びたPF4分子にSARS-CoV-2ウイルスが結合すると、抗原性のあるPF4/ウイルス複合体が形成される(図5A)。HITシステムでは、数マイクロメートルにもなる超巨大な抗原性PF4/ヘパリン複合体に対する免疫反応により、HIT抗体が産生される51.41。SARS-CoV-2が60-140 nmの大きさであるように27、PF4分子とウイルスの架橋は、一方では血小板を媒介/活性化し(図5B)、他方では超大型抗原性PF4/H複合体と同様にB細胞にPF4抗体の産生を促す十分に大きな免疫複合体を形成することができる(図5C)。同様に、最近の報告では、血小板を活性化するPF4抗体がCovid-19感染者に検出されることが示されている9, 22。以前、我々は、低濃度のPF4抗体またはHIT自己抗体(〜5 µg/ml)のみで、ヘパリン非存在下でも大量の血小板活性化を引き起こすことを報告した27。これらの抗体は、ヒトの血小板、単球、好中球を活性化し、また、PF4/ポリアニオン複合体を介して内皮細胞に結合し、14, 35 生命を脅かす自己免疫性HITという形で、頻繁に免疫を介した薬物有害反応を誘発する52。これが、Covid-19患者に見られる過剰な血液凝固活性のメカニズムであると考えられる。
しかし、ユニークな生物学的背景を持つ個人では、PF4とスパイクプロテインの量に応じて合併症の程度が異なって起こる可能性がある。 さらに、スパイクプロテインとPF4の相互作用が、ワクチン接種を受けた患者が高い確率で血液凝固作用を示す根本的なメカニズムになる可能性を示唆している。
Ad26.COV2.SおよびChAdOx1 nCoV-19(AstraZeneca社およびJohnson Johnson社)のCovid-19ワクチンは、BNT162b2およびmRNA-1273ワクチン(Pfizer社、Moderna社)よりも高い血液凝固現象を引き起こした19。SおよびChAdOx1 nCoV-19ワクチンは、ウイルスのスパイクタンパク質をコードする、より耐性の高いチンパンジーのアデノウイルスベクターを使用している(ベクターベースのワクチンと呼ばれる)53。後者の2つのワクチンは、DNAからmRNAを生成するために追加のステップを必要とする54。このプロセスでは、野生型およびコドン最適化スパイクのオープンリーディングフレームの転写により、代替スプライスイベントが発生し、本来の細胞への接着に必要な部分を含まない、C末端が切断された可溶性/部分的なスパイクタンパク質が生成される。そのため、これらの可溶性スパイクタンパク質は、免疫細胞が抗スパイクプロテイン抗体を産生するきっかけにはならないが、血液循環に入り、PF4と複合体を形成してPF4抗体の形成を引き起こすことができる(図6)。
ワクチン誘発性血栓性血小板減少症患者の血清をHIPAで検査したところ,Greinacherらは,AstraZeneca社のワクチンを接種した初日から数えて,これらの血清が血小板の活性化を経時的に増加させたことを明らかにしている21。
この結果は,可溶性スパイクプロテインの濃度が経時的に上昇していることを示唆している。可溶性のスパイクプロテインに加えて、ワクチンに対する免疫反応の際に細胞の破壊や死滅によって生じたスパイクプロテインを持つ細胞断片がある。これらのスパイクプロテイン担体は、PF4をクラスター化し、抗原性のあるPF4/スパイクプロテイン-細胞断片複合体を形成し、血小板を接着・活性化させるとともに、PF4抗体の発現を誘発することもある。
さらに、アデノウイルスの等電点は〜pH6.2,55-56であり、このpHでは表面が中性に帯電していることになる。しかし、血液循環(pH7.35〜7.45)に入ることで、アデノウイルスの中性表面は負の正味電荷に切り替わる可能性がある。我々は、稀な生物学的特性を持つ一部のワクチン接種者において、ワクチン接種前に多量のPF4が分泌され、ワクチン接種後にさらに増加すると推測している。PF4の高い密度と正電荷の残基は、アデノウイルスワクチンの負電荷との結合を促進し、抗原性のあるPF4/ワクチン複合体を形成することができる。このワクチンが血液循環に入ると、形成されたPF4/ワクチンがPF4抗体の産生を引き起こす可能性もある。
このワクチンが血中に入ると,形成されたPF4/ワクチンがPF4抗体の産生を誘発し,これらの要因がワクチン誘発性血栓性血小板減少症を強力かつ迅速に誘発する。PF4/スパイクプロテイン、PF4/ワクチン複合体、PF4/スパイクプロテイン-cell-fragmentなどの様々な要因が、ワクチン接種後のPF4抗体の産生を誘発するため、これらの抗体が高濃度に産生されることになる。ワクチン誘発性血栓性血小板減少症患者の血清を用いたPF4/Heparin ELISAでは、OD〜3の高い値が得られたのに対し、HIT血清ではOD〜2の値が得られたことが示されている58。可溶性スパイクプロテインは、mRNAベースのワクチンによって引き起こされる基本的な副作用に加えて、付加的な合併症である。mRNAベースのワクチンは、細胞内に侵入してスパイクプロテインを産生し、それが拡散して細胞膜に付着すると、抗スパイクタンパク質抗体が産生されるという単純な仕組みになっている(図6)。このことは、mRNAベースのワクチンと比較して、ベクターベースのワクチンを接種した後に血栓性血小板減少症の頻度が高いことを説明している。しかし,スパイクプロテイン濃度が高すぎても低すぎても血小板凝集能が低下することから,副作用の発現頻度はワクチンのスパイクタンパク産生効率に依存すると考えられる。
PF4/スパイクプロテイン複合体の形成は血小板凝集を誘導するが、Covid-19患者の転帰はワクチン接種者とは異なる。Covid-19患者では、ウイルスに付着した制御不能な量のスパイクプロテインが主に肺で優勢であるため、この臓器で血栓が形成されて気道が塞がれ、重症の急性呼吸器症候群が誘発されて死に至る。ワクチン接種者の場合、血栓は主に注射部位に形成され、他の臓器にはほとんど見られない。そのため、血栓ができる場所によっては重篤な副作用が発生することは稀である。このことは、ワクチン接種者の重症率がCovid-19患者に比べてはるかに低いことの説明にもなる。
PF4/スパイクプロテイン複合体は血小板凝集も誘発するため、ワクチン(アストラゼネカ)誘発性血小板減少症(ワクチン誘発性血栓性血小板減少症)の患者の診断・治療アルゴリズムについて、GTH59およびISTH60のガイダンスに追加の検討を提案する。血清がHIT抗体のスクリーニング検査で陰性でもHIPA/SRAで陽性の場合、血小板を活性化するPF4/スパイクプロテイン複合体を形成するPF4:スパイクプロテイン濃度の臨界比に達している。この場合、ヘパリン、あるいは高用量ヘパリン治療が可能である(図7)。
