コンテンツ
Review of light parameters and photobiomodulation efficacy: dive into complexity
https://pubmed.ncbi.nlm.nih.gov/30550048/
2018年12月11日
ランダ・ゼイン、 ウェイン・セルティング、 マイケル・R・ハンブリン
Journal of Biomedical Optics, Vol.23, Issue 12, 120901 (December 2018). https://doi.org/10.1117/1.JBO.23.12.120901
要旨
バイオモジュレーション(PBM)療法は、以前は低レベルレーザー療法として知られていたが、50年以上前に発見された。あるグループは、出力密度100mW/cm2以下、エネルギー密度4~10J/cm2の使用を推奨している。また、組織表面で50J/cm2ものエネルギー密度を推奨するグループもある。適用できるパラメータ(波長、エネルギー、フルエンス、パワー、放射照度、パルスモード、治療時間、繰り返し)の範囲が広いため、矛盾した結果になっているケースもある。我々の総説では、PBMにおいて有効なパラメータと無効なパラメータの範囲を評価しようと試みている。培養細胞を用いたin vitroでの研究や、異なる組織を用いたin vivoでの研究は、ミトコンドリアの数が多いもの(筋肉、脳、心臓、神経)と少ないもの(皮膚、腱、軟骨)に分けられた。パワー密度に対するエネルギー密度のグラフがプロットされた。結果はばらつきが大きかったが、ミトコンドリア数の多い細胞/組織は、ミトコンドリア数の少ない細胞/組織よりも低用量の光に反応する傾向があった。ミトコンドリア活性の高い細胞における効果的でない研究は、投与量不足よりも過剰投与によることが多いようであった。
AI要約
実践的なポイント
この論文では、ミトコンドリア数の多い細胞・組織とミトコンドリア数の少ない細胞・組織に分けて、光バイオモジュレーション(PBM)の効果的なパラメータを検討している。
ミトコンドリア数の多い細胞・組織:
筋肉細胞、神経細胞、心筋細胞、肝細胞、腎細胞、脳細胞、マクロファージ、単球
- In vitro (表3より):
- 波長: 660nm, 780nm, 808nm, 810nm
- エネルギー密度(フルエンス): 0.05~7.5J/cm², ピークは3J/cm²
- In vivo (表5より):
- 波長: 635nm, 655nm, 660nm, 808nm, 810nm, 1064nm
- エネルギー密度(フルエンス): 0.3~60J/cm², 多くは3~36J/cm²
ミトコンドリア数の少ない細胞・組織:
皮膚細胞(ケラチノサイト)、骨細胞(骨芽細胞)、軟骨細胞、線維芽細胞、腱細胞、幹細胞
- In vitro (表4より):
- 波長: 420nm, 540nm, 628nm, 660nm, 830nm, 915nm, 930nm, 940nm, 980nm
- エネルギー密度(フルエンス): 0.3~39J/cm², 多くは3~15J/cm²
- In vivo (表6より):
- 波長: 632nm, 670nm, 790nm, 830nm
- エネルギー密度(フルエンス): 1~140J/cm², 多くは5~50J/cm²
結論として、
- 1. ミトコンドリア数の多い細胞・組織はPBMによく反応し、in vitroでは7.5J/cm²以下の低いフルエンスが有効。
- 2. ミトコンドリア数の少ない細胞・組織では、in vitroでより高いフルエンス(〜15J/cm²)が有効。
- 3. In vivoでは、ミトコンドリア数に関わらず、より高いフルエンスが必要(〜50J/cm²)。
- 4. 最適な波長は、赤色光(600-700nm)と近赤外光(780-940nm)の範囲。
その他のポイント
- 1. 波長の選択:より短い波長(600~700nm)は表層組織の治療に最適で、より長い波長(780~950nm)はより深部の組織の治療に適している。
- 2. レーザーとLEDの比較:他のすべての光パラメータが同じであれば、PBM用途におけるレーザーとLEDの間に実質的な違いはない。
- 3. 照射モード:パルス光は創傷治癒や脳卒中後の管理に有効である可能性が高く、一方、神経再生にはCW光(連続波)がより有益である可能性がある。パルス周波数と病態との間に明確な相関関係はない。
- 4. 照射時間:照射時間が非常に重要であり、最良の効果を得るためには、光が組織に照射される最短時間(数分)が存在する。
- 5. 組織の光学的特性:散乱は波長に依存し、短波長の方が長波長よりも強いミー散乱を受ける。また、ヘモグロビン、ミオグロビン、メラニンによる光の吸収も考慮する必要がある。
- 6. 照射部位のスポットサイズ:組織表面と実際の標的組織に到達するビームのスポットサイズが、最適な線量を決定する上で重要である。
- 7. Bunsen-Roscoeの相反則:低い入射パワー密度では成立しない。
- 8. 過剰照射と過小照射:in vitroでは過剰照射が、in vivoでは過小照射が効果的でない原因となる可能性が高い。
- 9. 複数の波長の組み合わせ:2つの波長を組み合わせることで、PBMのさらなる効果が得られる可能性がある。
これらのポイントを考慮し、適切なパラメータを選択することが、PBMを効果的に適用するために重要である。
1. はじめに
1968年にMester1,2がルビーレーザー光がマウスの発毛と創傷治癒に好影響を与えることを偶然発見して以来、研究者たちはこの現象の科学的根拠を明らかにするとともに、臨床結果を成功に導く光照射パラメーターの範囲を確立しようとしてきた。幅広い細胞を刺激して創傷治癒や細胞増殖を改善する可能性があることから、低レベルレーザー治療(LLLT)または光バイオモジュレーション治療(PBMT)と呼ばれる科学が生まれた。基本的な概念が理解されるにつれ、良い結果をもたらすケースもあれば、悪い結果をもたらすケースもあり、その要因は非常に多岐にわたっているため、決定的なプロトコルの開発が妨げられている。
考慮すべき変数の数は膨大である。波長、エネルギー密度、出力密度、総エネルギー、総出力、パルス構造、スポットサイズ、組織吸収特性、治療反復レジメンなど、さまざまな要因が明らかに成功の可能性に影響することが1000以上の研究論文で報告されている。さらに、波長の組み合わせ、照射方法(コンタクト、パンクチュアル、ブロードビーム)、治療時間、不注意による組織の加熱、さらには光源がレーザーか発光ダイオード(LED)かランプからのブロードスペクトル光かどうかなど、コントロールと研究の両方が必要な重要度の低いパラメータもある3,4。
PBMで良好な結果を得るためには,これらの線量パラメータをそれぞれ限られた値の範囲内で制御しなければならないことが明らかになってきた。過去50年間に実施された多くの研究の中で、成功した結果に対する個々のパラメータの相対的な寄与を決定しようとしたものが数多くある。
PBMにおける最も重要な概念のひとつについて、(ほぼ)コンセンサスが得られた。いわゆるアーントシュルツの法則は、19世紀末に提唱されたものである。この法則は、「あらゆる物質について、少量は刺激し、適量は抑制し、大量は死滅させる」5というもので、CalabreseとMattson7がレビューしているように、この概念6は「ホルミシス」という科学の基礎にもなっている。
治療用量で使用される薬理学的薬剤は非常に有益である一方、同じ薬剤を高用量で投与すると破滅的な結果をもたらすことがある。長年にわたり、このArndt-Schultzの法則は、細胞や組織と光との相互作用を説明するのに便利な概念として使われてきた。
簡単に説明すると、この法則をPBMに適用すると、非常に低レベルの照射では、光子は細胞内小器官(特にミトコンドリア)内に存在する細胞内発色団によって吸収される。ミトコンドリア呼吸鎖のシトクロムCオキシダーゼ(CCO)によるエネルギーの吸収が、PBM効果を引き起こす主な相互作用である8。このため、一酸化窒素(NO)レベルの変化、二次メッセンジャー経路の活性化、転写因子の活性化、成長因子の産生が起こる可能性がある9。このように非常に低いレベルでは、エネルギーは細胞に吸収されるが、そのエネルギー量は非常に低いため、観察可能な総体的変化(温度や光化学的損傷)は見られない。
吸収される光子の数が増加するにつれて、上述したような細胞代謝の 刺激が細胞活動に影響を及ぼし始め、PBMにプラスの効果をもたらす。光子の数と照射速度の両方が反応に大きく影響する10,11。
光子の数が特定のレベルを超えて増加すると、細胞への刺激は消失し、光子の数がさらに増加すると、抑制と細胞損傷が起こる。現在の理論では、最適な光量で最大に達したミトコンドリア膜電位はベースラインまで低下し、過剰な光量によってベースライン以下に低下することが示唆されている12。毒性のある過剰な活性酸素種(ROS)の産生、細胞を損傷させる過剰な遊離NOの放出、アポトーシスにつながる細胞毒性ミトコンドリア・シグナル伝達経路の活性化も、考えられる理論である。照射レベルがさらに高くなると、細胞内のエネルギー貯蔵量の枯渇、あるいは上述の因子の過剰レベルが顕著になり、細胞代謝が正常な内在レベル以下に低下し、機能が実際に阻害され、最終的に細胞死に至る。
二相性線量反応のArndt-Schultzの法則に代表されるこの概念は、PBMの基礎概念となっている。しかし、このような重要な遷移が起こるフルエンスと放射照度の適切な値の範囲は、広く合意されているわけではない。多くの研究が、細胞レベルで3からJ / cm 2の範囲のフルエンスが、望ましい代謝活性の刺激をもたらすことを示唆している13,14。
このプロトコールは広く受け入れられているが、いくつかの研究では、開放創に対しては0.5~1 J / cm 2の範囲で、重層皮膚を通して標的に対しては2~4 J / cm 2の範囲で生体刺激が起こることを示唆している。
多くの研究がPBMの肯定的な効果を示しているが17,18,21、多くの研究が有益性を示せず22,23、事実、他の肯定的な研究と同じ照射パラメータで否定的な結果を示した報告もある。残念なことに、歴史的研究の多くでは、重要なレーザーパラメーターが省略されていたり、間違って表示されていたりした。
多くの場合、レーザー出力の総出力は、標的組織表面におけるスポット径を考慮せずに報告されている。したがって、最も重要なパラメータである出力密度は報告されず、結果は予想通り一貫していない。
発表された研究では、組織表面全体のエネルギー分布が記載されていないことがあり、重大な誤差を生んでいる。一例として、ほとんどのレーザーはTEMモードで照射するように設計されており、ビームプロファイルのガウス分布が生じる。数学的定義によれば、ビームの正確な中心にある細胞には、指示された平均出力の2倍の出力が正確に照射されるが、照射スポットの周辺にある細胞には、その出力の約13%しか照射されない。仮に30秒間照射した場合、ビーム中心部の細胞は6J/cm2のエネルギー線量を受けるが、周辺部の細胞は0.39J/cm2のエネルギー線量を受けることになる。明らかに、Arndt-Schultzの法則を考慮すると、細胞応答はそれぞれの組織で異なる。その結果、研究の分析段階でどの細胞が観察されたかによって、効果なし、効果あり、効果なしという結論になる可能性がある。
PBMの適用を成功させるために関連することが示唆されているもう一つの基本的概念は、Roscoe-Bunsenの互恵性の法則である24。この概念は、PBMにおいて最も重要なパラメータは、標的細胞に吸収される光子の総量であり、これらの光子がどの程度速く、あるいは遅く照射されるかは重要ではないというものである。つまり、6 J / cm 2の線量で60秒間mW / cm 2を照射しても、1. W / cm 2を6秒間照射した場合(6. J / cm 2)、または6. W / cm 2を1秒間(6. J / cm 2)照射するのと同じ効果を、同じスポットサイズで得ることができる。
多くの研究が、この法則はパラメータ範囲の多くの部分で有効であるが、全範囲では当てはまらないことを示している。ある範囲のパラメータ、おそらく1~J / cm 2、および1~mW / cm 2の出力密度では、この線形相互作用が適用される。しかし、この範囲を超えると、相互性は適用されないようである。例えば、それ以下の閾値(おそらく0.5 mW / cm 2 )が存在し、それ以下では照明時間は無限大となり、昼光と変わらなくなる。同様に、パワー密度が大きすぎる場合、光熱効果の可能性によって上限閾値が固定される。組織に許容できない加熱をもたらす放射照度値は波長に支配され、800~900nmでは約750mW / cm 2、600~700nmでは約300mW / cm 2、400~500nmでは100mW / cm 2と低い。さらに、照射時間も重要である17。最良の効果を得るためには、光が組織に照射される最短時間(数分)が存在する17。
PBMにおいて最も重要なパラメータは、mW / cm 2で測定されるパワー密度(放射照度)と、J / cm 2で測定されるエネルギー密度(フルエンス)である。ここで議論されている研究の多く、また実際、研究文献の多くで は、レーザー出力をワット単位で表した不正確な記述に基づいている。この光子ビームが照射される領域によって、出力密度と生じる細胞効果は大きく異なる。
一例として、直径μ mの光ファイバーを通して照射される1 Wのパワー密度はW / cm 2であるが、直径8 mmの治療用ハンドピースを通して照射される同じ1 Wのパワー密度はわずか2 W / cm 2である。
エネルギー密度は研究文献で頻繁に報告されているが、組織におけるスポット面積はしばしば省略されている。この誤りのために、研究結果を検証したり、重要なエネル ギー密度情報をどのように計算したかを確認することができない。これらのパラメーターの報告における矛盾は、矛盾した研究結果の主な原因であり、PBM効果の受容を大いに妨げている。
考慮しなければならないもう一つの重要な因子は、組織自体の光学的特性である27。光は一般に、皮膚に照射される表面スポットとして照射されるため、実際に組織内を透過して病変部に到達する光子の数は、非常にばらつきがある28。散乱は波長に依存し、短波長の方が長波長よりも強いミー散乱を受ける31。第3の問題は、生物学的に活性でない発色団による光の吸収である。これらの非活性な発色団は、主にヘモグロビン(オキシヘモグロビンとデオキシヘモグロビンの両方)、ミオグロビン、メラニンである27 。しかし、ヘモグロビンからの酸素の光解離32 やミオグロビンからのNOの光解離33 が、PBMに関連するメカニズムである可能性を示唆する著者もいることに留意すべきである。PBMの研究者の間では、モンテカルロ法34や組織ファントムを用いた組織光学特性のモデリングを行う傾向が高まっている35。
1.1.
ミトコンドリアと細胞
ミトコンドリアは非常に重要な細胞内小器官であり、その主な機能は細胞の「発電所」として働き、細胞活動と代謝の主なエネルギー源であるATPを生成することである。さらにミトコンドリアは、酸化ストレス、カルシウム代謝、アポトーシス、および多くのシグナル伝達経路の制御において重要な役割を果たしている36。ミトコンドリアは、地球上で「大酸素化現象」が起こった頃、原始的な真核細胞が原核細菌を「捕獲」したときに誕生したと考えられている37。
ミトコンドリアには、NADHから複合体I、II、III、IVを介して電子を伝達する電子伝達鎖がある38。
細胞に光を照射すると、ミトコンドリアが最初に光を吸収する部位となり、CCO(特にCuAとCuBの金属中心)が光受容体となると考えられている39。光子の吸収により、細胞シグナル伝達経路として知られる反応のカスケードが動き出し、NOの解離、活性酸素の産生、ATP合成の増加につながる9。
細胞内のミトコンドリアの数は千差万別で、細胞の代謝要求量(細胞がどれだけの化学反応を行わなければならないか)と強く相関しており、個々のオルガネラの数は数個から数千個に及ぶこともある。骨芽細胞、ケラチノサイト、線維芽細胞などの細胞はミトコンドリアの数が少ないが、筋肉細胞、神経細胞、内臓を構成する細胞(肝臓、腎臓、脾臓など)、心筋細胞はミトコンドリアの数が多い。大まかに言えば、組織の種類に占めるミトコンドリアの割合は、(血液を含まない)組織の色を観察することで知ることができる。例えば、色の濃い組織(肝臓、心臓、腎臓、灰白質脳)は、CCOおよび他のシトクロムが最も重要な細胞色素であるため、ミトコンドリアの濃度が高いが、色の薄い組織(皮膚、骨、腱)にはミトコンドリアがほとんどない。以下の報告では、さまざまな細胞や組織でミトコンドリア数やミトコンドリア活性がどのように測定されてきたかを論じている40-43。
さらに、幹細胞や人工多能性幹細胞のミトコンドリアは発育が悪く、数も少ない。ミトコンドリアの機能と構造は、幹細胞の能力を示す指標として示唆されているほどである44。
本総説の仮説は、異なる組織に対するPBMの効果は、2つの主な要因を考慮することで説明できるというものである。第一に、組織の大部分を構成する細胞におけるミトコンドリアの含有量はどの程度か?第二に、深さはどのくらいか?試験管内の細胞は非常に表面的であり、皮膚やいくつかの結合組織は中程度に表面的であるが、他の組織はより深く、骨、関節、脳、臓器などである。さらに、ミトコンドリア数が多い組織は、少ない組織よりも深い傾向がある。
そこで、細胞レベルのミトコンドリアの数と組織レベルの深さに基づいて、研究を2つのグループに分けた。
ミトコンドリアの数が多い組織の細胞はあるグループ(脳細胞、筋肉細胞、神経細胞、マクロファージ、単球)に集まり、ミトコンドリアの数が少ない細胞は別のグループ(ケラチノサイト、骨芽細胞、軟骨細胞、線維芽細胞、幹細胞)に集まった。ミトコンドリアが豊富な組織は、筋肉、心臓、肝臓、腎臓、細胞などの臓器に存在する。
このレビュー論文の目的は、各グループの細胞や組織について、効果的な研究と効果的でない研究を比較することである。たとえ論文に明示されていなくても、関連するパラメーターを見つけたり計算したりするよう、あらゆる努力を払った。
2. 材料と方法
本研究は、Preferred Reporting Items of Systematic reviews and Meta-analysisに従って行われた。
研究課題PBMまたはLLLTの実用的なプロトコルを提案することは可能か?さまざまな状況において、肯定的な結果をもたらす最良のパラメーターは何か?
2.1.
記事識別のための調査戦略
調査は以下の電子データベースを用いて行った:Springer、PubMed、Google Scholar、Cochrane Database。
使用キーワードLLLT、PBM、LLLTとオッセオインテグレーション、LLLTと骨移植、LLLTと細胞、LLLTと骨再生。
データ収集後、タイトル、抄録、結論をチェックし、関連性のない、明らかに偏った論文は除外した。また、症例報告や文献レビューもすべて除外した。2007年から2016年までの研究のみを対象とした。
論文の評価は2名の査読者が独立して行った。最初の検索で250の論文が得られた。関連性のない論文を除外した結果、190件だけが残った。表1に示した除外基準を用いて、この数を34の論文に減らした。
表1
適格基準はCericatoら45を参考にした。
| 除外理由 | パブコメ | シュプリンガー | グーグル・スカラー | コクラン | 合計 |
|---|---|---|---|---|---|
| 文献および/またはシステマティックレビュー | 8 | 8 | 11 | 6 | 33 |
| 英語以外の言語による記事 | – | – | 15 | – | 15 |
| 編集者からの手紙、オピニオン記事 | – | – | 8 | – | 8 |
| フルエンスは言及されていない | 3 | 2 | 30 | 8 | 43 |
| 非常に高いフルエンスの使用:500J/cm2500 J/cm2以上の密度 | 4 | 2 | 8 | 8 | 22 |
| 記事にはパワーやフルエンス率については触れられていない | 5 | 2 | 16 | 6 | 29 |
| その他(本の章、付録、書誌、索引 | – | – | 4 | 2 | 6 |
| 除外 | 20 | 14 | 92 | 30 | 156 |
2.2.
研究の評価
関連する34の論文の全文を入手した後、表1に示したCericatoら45の適格性基準を用いて、チェックリストに従って評価し、点数をつけた。点数が0~8点の論文は質が低いとみなされ、除外された。13点から15点の論文は質が高く、9点から12点の論文は質が中程度とみなされた。表2は、最終的にこのレビューに含まれた34の研究の詳細を示している。
表2
Cericatoスコアとともに組み入れられた研究の最終リスト。
| 著者紹介 | スコア(Cericatoら)17 |
|---|---|
| フェルナンデスら46 | 12 |
| メンデスら21 | 12 |
| Barbosaら20 | 11 |
| 黄ら47 | 11 |
| 黄ら48 | 12 |
| シャルマら49 | 11 |
| オロンら50 | 10 |
| チェンら26 | 12 |
| ソウザら51 | 11 |
| Ferraresiら52 | 12 |
| Zhangら53 | 12 |
| Wangら54 | 12 |
| アマロリ19 | 10 |
| Tschonら55 | 11 |
| Pyoら56 | 12 |
| Migliarioら57 | 12 |
| カドラら32 | 11 |
| スコピンら58 | 12 |
| Salehpourら59 | 11 |
| Wuら58 | 12 |
| Lopes-Martinsら18 | 11 |
| Bozkurtら60 | 12 |
| Wangら61 | 11 |
| Alvesら25 | 11 |
| Oronら62,63 | 11 |
| Castanoら17 | 12 |
| Salehpourら64 | 11 |
| Leal juniorら65,66 | 12 |
| 安藤ら13 | 11 |
| Zhangら67 | 12 |
| バローニら68 | 11 |
| レアル・ジュニオールら69 | 11 |
| ブランコら70 | 12 |
| ディズナーら71 | 12 |
3. PBMの有効性に対する単一パラメータの変化の効果
3.1. I-波長の変化がPBM効果に及ぼす影響
3.1.1. 試験管内試験
CCOが光を吸収する最も重要な発色団であることは、多くの研究によって明らかにされている。DelpyとCope72は、800~850nmの光吸収の50%以上がシトクロムcオキシダーゼによるもので、ヘモグロビン(オキシとデオキシ)の役割は小さいことを示した。CCOには2つの吸収帯があり、1つは赤色スペクトル領域(∼660nm∼660nm )、もう1つは近赤外スペクトル領域(∼800nm∼800nm )である。
Wangら54の研究によると、810nmと980nmのレーザーの作用機序には大きな違いがあるようである。PBM効果はどちらの波長でも起こるが、発色団は波長によって異なっていた。810nmのような近赤外波長は、ミトコンドリア活性とATP産生を刺激する。より長い波長では、980nmの作用機序は、熱(または光)ゲートイオンチャネルの活性化につながる水による吸収に依存し、TRPV1カルシウムイオンチャネル経路を介して細胞増殖を促進する。
同じ研究で、これら2つの異なる波長、810nmと980nmの幹細胞分化に対する効果が比較された。それぞれの波長について、0.03~10J/cm2 、スポットサイズ 4 cm2 、放射照度16mW/cm2 、パワー 64 mW、照射時間 ( 3J/cm2 、188秒)および( 0.3J/cm2 、18.8秒)。放射照度は、レーザーとターゲット細胞間の距離を変えることで調整した。
どちらの波長も二相性の線量反応を示した。980nmでは0.03と0.3J/cm2に線量反応のピークが見られたが、810nmでは 3J/cm2にピークが見られた。さらに、0.3J/cm2 980nmレーザーの照射量は、他のどのグループよりも優れた効果を示した。
Wang氏による2番目の研究では、4つの異なる波長(420、540、660、810nm)を、同じパラメータ(3J/cm23 J/cm2 16mW/cm216 mW/cm2 )で照射した場合の、ヒト脂肪由来幹細胞の骨芽細胞への分化に対する効果を比較した。その結果、420nmと540nmの波長は、660nmと810nmの波長と比較して、骨芽細胞分化を促進する効果が高いことがわかった。細胞内カルシウムは420nmと540nmの後に高くなり、TRPチャネル阻害剤であるカプサゼピンとSKF96365によって阻害された。研究者らは、青と緑の波長を用いると、CCOよりもむしろ光ゲートカルシウム・チャネルが活性化されると結論づけた61,73。
3.1.2. In vivo試験
Mendezら21は、2つの異なる波長(GaAlAs 830 nmとInGaAl 685 nm)を用いた場合のラットの皮膚創傷の修復効果を組織学的に比較した。対照群には治療を行わず、II群にはスポット径0.6mm、フルエンス20J/cm2で685nmを照射し、III群には20J/cm2で830nmを照射し、IV群には合計20J/cm2で830nmと685nmの両方を照射し、V群には50J/cm2で830nmを照射し、VI群には50J/cm2で685nmを照射し、VII群には50J/cm2で830nmと685nmを照射した。レーザー治療は48時間間隔で7日間に4回繰り返された。研究者らは、830nmと685nmの両方の波長を併用した方がより良い結果が観察され、この利点は吸収と浸透の違いに起因すると結論づけた。2つの波長を別々に使用した場合を比較すると、830nmの方が良い結果を示した。波長を組み合わせることで貴重な情報が得られるが、有効性の表に含めるのは適切ではなかった。
Barbosaら20は、赤色波長と赤外波長を用いて、ラットの骨治癒に対する光照射の効果を比較した。大腿骨骨切り術後のラット45匹を3群に分けた: GrⅠは対照群、GrⅡは赤色波長(660~690 nm)を用いたレーザー治療群、GrⅢは赤外レーザー(790~830 nm)を用いた治療群である。レーザー治療は骨切り術直後に行い、48時間ごとに週3回、21日間で計9回繰り返した。出力は100mW、エネルギーは4J、スポットサイズは0.028cm2、パワー密度は3.5W/cm2に設定され、40秒間で140J/cm2のフルエンスを発生させた。動物を犠牲にして大腿骨を摘出し、7日後、14日後、21日後に光学的デンシトメトリー分析に供した(各群5匹)20。7日後、レーザー治療群はいずれも対照群と比較して平均骨光学密度が有意に高かったが、2つのレーザー群間に有意差は認められなかった。14日後、赤外線エネルギーで治療したGr IIIのみが、対照群より有意に高い骨密度を示した。21日後、3群間の平均骨密度に有意差は認められなかった。彼らは、PBMは初期段階での骨修復を促進すると結論づけ、骨修復におけるPBMはタイミングと波長の両方に依存することを示唆した。
Al-WatbanとZhang16は、糖尿病ラットの創傷治癒を促進する効果を、可視および近赤外ダイオードレーザーの波長を用いて比較した: 532、633、670、810、980nmである。各波長の照射量は5、10、20、30J/cm2で、633nm(使用放射照度:15.5mW/cm2)と532nm(10mW/cm2)を除き、すべての波長で同じ出力密度22mW/cm2を使用した。その結果、NIR波長と可視波長の間には有意な差があり、可視波長の方がNIRよりも効果が高いことが示された。また、最適波長は633nm、最適線量は10J/cm2であると結論づけた。
これらの研究は、波長とフルエンスの関係が重要であることを示唆している。ターゲットがCCOである場合、赤色光(630~670 nm)または近赤外光(780~940 nm)が、3~10 J/cm2の刺激範囲のフルエンスを用いて、プラスの効果をもたらすことはよく知られている16。
しかし、発色団が細胞内のイオンチャネ ルである場合、カルシウムチャネルに最も効果的な波長 は420~540nmである54,61。より高い波長の980nmを使用することも、発色団として水をターゲットにするのに有益な効果をもたらす可能性がある54。
Disnerら71は、うつ症状が上昇した51人のヒト患者を対象に、PBMTを頭部(右前頭前皮質上)に照射し、注意バイアス修正(ABM)療法を併用した場合の効果を研究した。PBMTは、1064nm、3.4W、照射量250mW/cm2(3,400mW/13.6cm2=250mW/cm2)を4分間、累積フルエンス60J/cm2(0.25W/cm2×240秒=60J/cm2)を用いて、ABMのブロックの前後に行われた。彼らは、PBMTが、特にABMに反応する注意力のある参加者において、より大きな症状改善につながることを発見し、ABMの有益な効果は、右前頭前野PBMTなどの補助的介入によって改善される可能性があると結論づけた。
3.2. エネルギー密度とパワー密度の変化がPBM効率に及ぼす影響
3.2.1. ミトコンドリア数の多い細胞を用いたin vitro研究
Fernandezら46は、2つの異なるレーザーパラメーターセットを用いて、マクロファージのM1プロファイル(マクロファージは、産生するサイトカインの種類によって、M1およびM2と呼ばれる2つの異なる表現型を持つことがある)を刺激した: 660nm、15mW、0.375W/cm2、20秒、7.5J/cm2、および780nm、70mW、1.75W/cm2、1.5秒、2.6J/cm2である(入手可能な情報から現在の著者らが算出したスポット面積は0.04cm2)。結果は、どちらのレーザーもTNFαとiNOSの発現を減少させることができたが、780nmのパラメーターはさらに減少させた。また、660nmのパラメーターはIL-6の発現と産生を増加させた。780nmを高出力、低エネルギー密度で使用した場合と、660nmを低出力、高エネルギー密度で使用した場合では、同様の結果が得られ、780nmを使用したパラメータによるさらなる減少は、この波長が細胞を非刺激状態に戻したことを示唆していると結論づけた。
Lopes-Martinsら74は、異なるエネルギー密度(1、2.5、5J/cm2)で処理したマウスから分離した好中球で、2.5J/cm2で最大の効果を示す、真の二相性の反応が起こることを発見した。
Huangら47は、810nm. 20mW/cm2、3J/cm2、スポットサイズ5cm、150秒のダイオードレーザーを皮質ニューロン細胞に照射した。
良好な結果を報告した、ミトコンドリア数の多い細胞に対してin vitroでPBMを用いた研究を表3にまとめた。ミトコンドリア数の多い細胞におけるin vitroでの効果的でないパラメーターは表7に報告されている。著者らがパラメーターを変化させた場合、同じ研究が表3と77(有効なパラメーターと無効なパラメーター)の両方に含まれるケースもある。
表3
PBMの効果的な治療:ミトコンドリア数の多い細胞を用いたin vitro試験。
| 著者紹介 | 波長 (nm) | フルエンス | 照度 | セルタイプ |
|---|---|---|---|---|
| フェルナンデスら46 | 780 | 2.6J/cm22.6 J/cm2 | 1.75W/cm21.75W/cm2; 70 mW, 0 .04cm20.04cm2, 1.5 s | マクロファージ |
| 黄ら47 | 810 | 3J/cm23 J/cm2 | 20mW/cm220mW/cm2; 150秒、スポットサイズ5cm | 神経細胞 |
| 黄ら48 | 810 | 3J/cm23 J/cm2 | 25mW/cm225mW/cm2 、2 分、スポットサイズ 5 cm | 神経細胞 |
| シャルマら49 | 810 | 0.03、0.3、3、10、ピーク 3 J/cm23 J/cm2 | 25メートルダブリュー/cm225 メートルダブリュー/cm2 | マウス皮質神経細胞 |
| オロンら50 | 808 | 0.05J/cm20.05 J/cm2 | 50メートルダブリュー/cm250 メートルダブリュー/cm2 | ヒト神経細胞 |
| チェンら26 | 808 | 1J/cm21 J/cm2 | 44.7mW/cm244.7mW/cm2
170 mW, 3 .8cm23.8cm2, 22.4 s |
単球 |
| ソウザら51 | 780 | 3J/cm23 J/cm2 | 275mW/cm2275 mW/cm2[Power=70mWPower=70mW 、
1.5 s (2×2×) 有効電力53.9 mW] 。 面積=0.196cm2面積=0.196cm2 ビームスポット面積=0.04cm2ビームスポット面積=0.04cm2 |
マクロファージ |
| Ferraresiら52 | クラスターLED 40個(赤外850nm 20個、赤外630nm 20個) | 2.5J/cm22.5 J/cm2 | 28mW/cm228mW/cm2
50 mW(赤外線)および25 mW(赤色) クラスター1000 mW (IR)、500 mW (赤) 45cm245cm2 、90秒、距離:156 mm |
マイオチューブ C2C12 |
| アマローリら19 | 808 | 3.0J/cm23.0 J/cm2 | 100mW/cm2100mW/cm2
100 mW スポット面積:1cm2スポット面積:1cm2 |
ゾウリムシ |
| アマロリ19 | 808 | 64J/cm264 J/cm2 | 1000mW/cm21000mW/cm2
100 mW,スポット面積=1cm2スポット面積=1cm2 |
ゾウリムシ |
| チェンら26 | 660 | 1J/cm21 J/cm2 | 0.8mW/cm20.8mW/cm2
6 mW、7.5cm27.5cm2 1250 s |
単球 |
| チェンら26 | 660 | 2J/cm22 J/cm2 | 0.8mW/cm20.8mW/cm2
6 mW、7.5cm27.5cm2 2500 s |
単球 |
| ソウザら51 | 660 | 7.5J/cm27.5J/cm2有効フルエンス 1 .15J/cm21.15J/cm2 | 57.4mW/cm257.4mW/cm2
パワー=15 mWパワー=15mW, 20 s 有効パワー11.25mWEffectivepower11.25mW 照射面積=0.196cm2照射面積=0.196cm2 ビームスポット面積=0.04cm2ビームスポット面積=0.04cm2 |
マクロファージ |
| フェルナンデスら46 | 660 | 7.5J/cm27.5 J/cm2 | 0.375W/cm20.375W/cm2
15 mW, 0 .04cm20.04cm2, 20 s |
マクロファージ |
3.2.2. ミトコンドリア数の少ない細胞を用いたin vitroでの研究
Tschonら55は、915nmのダイオードレーザーを用いて、骨芽細胞様細胞に以下のパラメーターを照射した: レーザーエネルギーは、成長領域(1.91 cm2)を19 mmの距離でカバーするように、凹レンズを用いたデフォーカス・モードで照射された(現在の著者らが入手可能な情報から計算した出力密度は150 mW/cm2)。レーザーは48、96、144秒間照射され、照射線量は5、10、15 J/cm2(エネルギー密度は、入手可能な情報から現在の著者らが算出したもので、7.2、14.4、21.56 mJ/cm2)であった。5J/cm2および10J/cm2で処置したin vitroのスクラッチ創傷は、72時間後に最初に完全被覆に達し、次いで15J/cm2が96時間後に完全治癒に達した。
Pyoら56名は、低酸素とPBMが骨形成蛋白質-2(BMP-2)、トランスフォーミング増殖因子-β-1(TGF-β1)、I型コラーゲン、オステオカルシン、低酸素誘導因子-1(HIF-1)およびAKTの発現に及ぼす影響について研究した。骨芽細胞を酸素濃度1%下で培養し、低酸素に曝した。これらの細胞に、808nmのダイオードレーザー(1000mW、連続波(CW))を15秒間照射し、1回のエネルギー密度を1.2J/cm2とした(現在の著者らが入手可能な情報から計算したパワー密度は80mW/cm2)。他の細胞は低酸素下でさらに24時間培養し、2回目、3回目と照射し、合計エネルギー密度は1.2、2.4、3.6J/cm2とした。最後に、照射後の細胞にさらに低酸素処理を施した。その結果、低酸素状態は、骨芽細胞の生存率(コントロール群)およびBMP-2には影響を与えなかったが、オステオカルシン、TGF-β、I型コラーゲンの発現には減少をもたらした。しかし、低酸素状態の骨芽細胞にPBMを適用すると、BMP-2、オステオカルシン、TGF-βの発現が増加し、骨芽細胞の分化と増殖が刺激された。さらに、PBMはHIF-1の発現を阻害し、Aktの産生を抑制した。
Migliarioら57は、活性酸素マーカーで標識した細胞の活性酸素に対するPBMの効果を評価するために、マウス前骨芽細胞(MC-3 T3 -E1)に放射線を照射した。930nm、1W、照射時間1、5、10、25、50秒のダイオードレーザーを用い、照射フルエンスは1.57、7.87、15.74、39.37、78.75J/cm2であった(現在の著者らが入手可能な情報から計算したスポット面積は0.63cm2、放射照度は1.57W/cm2)。レーザー照射は、0時間、24時間、48時間の3回行われた。彼らは、活性酸素の発生は線量に依存し、高いフルエンス(25から50J/cm2)では2倍になることを見出した。また、レーザー照射は5 J/cm2のフルエンスから前骨芽細胞増殖を増加させることができた。照射量を増やすと、25 J/cm2までは細胞増殖が増加し、50 J/cm2では減少した。細胞増殖のピークは10 J/cm2で生じた。これらの結果は、1~5J/cm2が細胞増殖に最適であることを示唆する他の研究結果とは部分的に不一致である。矛盾する結果は、照射パラメーター(波長、出力、エネルギー密度)の違いによるのかもしれない。
Zhangら53は、線維芽細胞に628nmを照射した。出力は15mWで一定、放射照度は11.46mW/cm2、照射距離は0.75cmであった。最終的なエネルギー量は0.44、0.88、2.00、4.40、9J/cm2であった。彼らは、フルエンス0.88 J/cm2でヒト線維芽細胞増殖が最大に増加し、9 J/cm2で増殖が減少することを見出した。
Khadraら75は、ヒト線維芽細胞の接着と増殖に対する単回照射と複数回照射の効果を調べた。細胞はチタンインプラント上で培養され、3つのグループに分けられた:グループIはコントロールとして使用され、グループIIはGaAlAs 830nm、出力84mW、細胞までの距離9cm、3J/cm2、360秒の単回線量を受けた(現在の著者らが入手可能な情報から計算したスポット面積は10cm2、放射照度は0. 0084 W/cm2)、III群は3つのサブグループに分け、0.75、1.5、3 J/cm2の複数回(連続する3日間に各1回)、90、180、360秒の照射時間(入手可能な情報から現著者らが算出したスポット面積は10 cm2)で照射した。その結果、1.5J/cm2および3J/cm2の複数回照射を受けたサンプルは、有意な増殖を示した。彼らは、チタンインプラントへのヒト線維芽細胞の付着はPBMによって促進されたと結論づけた。多回照射と単回照射の両方が、細胞接着を有意に増加させた。最終的に、0.75 J/cm2では増殖と細胞接着は促進されなかった。
SkopinとMolitor58は、980nmのダイオードレーザーを用いて、線維芽細胞培養における創傷治癒に対する異なる線量と照射量の効果を研究した。彼らは、以下の照度を適用した: 26、49、73、97、120mW/cm2、3.1、5.9、8.8、11.6、14.4J/cm2の照射量で、それぞれ2分間一定に照射した。26、73、97mW/cm2を使用した場合、細胞分裂が有意に増加した。この効果は120mW/cm2では否定された。
Al-WatbanとAndres76は、ハムスター卵巣とヒト線維芽細胞の増殖に対するHe-Neレーザーの効果を研究した。照射量は1.25mW/cm2で一定とし、60~600mJ/cm2の照射量を3日間連続して照射した。その結果、180mJ/cm2で反応のピークが見られた。この研究から、180mJ/cm2をピークとする2mJ/cm2からの低線量で活性化があることが示唆された。300mJ/cm2以上の高線量では、生体抑制が見られた。
良好な結果を報告した、ミトコンドリア数の少ない細胞に対するin vitroでのPBMを用いた研究を表4にまとめた。ミトコンドリア数の少ない細胞を用いたin vitroでの効果的でないパラメータは表8に報告されている。著者らがパラメーターを変化させた場合、同じ研究が表3と表77(有効なパラメーターと無効なパラメーター)の両方に含まれるケースもある。
表4
PBMの効果的治療:ミトコンドリア数の少ない細胞を用いたin vitro試験。
| 著者紹介 | 波長 (nm) | フルエンス (J/cm2) | 照度 | セルタイプ |
|---|---|---|---|---|
| Wangら54 | 420 | 3 | 16mW/cm216mW/cm2
4cm24cm2, 188 s |
脂肪幹細胞 |
| Wangら54 | 540 | 3 | 16mW/cm216mW/cm2
4cm24cm2, 188 s |
脂肪幹細胞 |
| Zhangら53 | 628 | 0.88 | 11.46mW/cm211.46mW/cm2
出力15 mW、表面までの距離0.76 cm、面積=9.6cm2面積=9.6cm2 |
線維芽細胞 |
| Zhangら53 | 628 | 2.0 | 11.46mW/cm211.46mW/cm2
出力15 mW、表面までの距離0.76 cm、面積=9.6cm2面積=9.6cm2 |
線維芽細胞 |
| Zhangら53 | 628 | 4.4 | 11.46mW/cm211.46mW/cm2
出力15 mW、表面までの距離0.76 cm、面積=9.6cm2面積=9.6cm2 |
線維芽細胞 |
| カドラら32 | 830 | 1.5 | 8.4mW/cm28.4mW/cm2
84 mW,10cm210cm2, セルまでの距離9 cm |
線維芽細胞 |
| カドラら32 | 830 | 3.0 | 8.4mW/cm28.4mW/cm2
84 mW,10cm210cm2, 360 s, セルまでの距離 9 cm |
線維芽細胞 |
| Tschonら55 | 915 | 7.2 | 150mW/cm2150mW/cm2, 100 Hz, 50% デューティサイクル、
パワー0.575 W、48秒 |
骨芽細胞 |
| Tschonら55 | 915 | 14.4 | 150mW/cm2150mW/cm2
50%デューティ・サイクル、パワー0.575 W、96秒 |
骨芽細胞 |
| Migliarioら57 | 930 | 7.8 | 1580mW/cm21580mW/cm2
1W、5秒、0.63cm20.63cm2 |
前骨芽細胞 |
| Migliarioら57 | 930 | 15 | 1580mW/cm21580mW/cm2
1W、10秒、0.63cm20.63cm2 |
前骨芽細胞 |
| Migliarioら57 | 930 | 39 | 1580mW/cm21580mW/cm2
1W、25秒、0.63cm20.63cm2 |
前骨芽細胞 |
| Pyoら56 | 808 | 1.2 | 80mW/cm280mW/cm2
15秒、1 W |
骨芽細胞 |
| スコピンら58 | 980 | 3.1 | 26.7メートルダブリュー/cm226.7 メートルダブリュー/cm2 | 線維芽細胞 |
| スコピンら58 | 980 | 8.8 | 73メートルダブリュー/cm273 メートルダブリュー/cm2 | 線維芽細胞 |
| スコピンら58 | 980 | 11.6 | 97メートルダブリュー/cm297 メートルダブリュー/cm2 | 線維芽細胞 |
| Bozkurtら60 | 940 | 18 | 0.3W/cm20.3W/cm2
0.3 W、60秒、距離0.5~1 mm |
セメントブラスト |
| Wangら73 | 810 | 3 | 16mW/cm216mW/cm2
4cm24cm2, 188 s |
脂肪幹細胞 |
| Wangら61 | 980 | 0.3 | 16mW/cm216mW/cm2
4cm24cm2, 18.8 s |
脂肪幹細胞 |
3.2.3. ミトコンドリアの多い組織におけるin vivo研究:
心臓、脳、筋肉、炎症 Oronら62は、810nmのレーザーを用いたLLLTで心筋梗塞を治療した。フルエンスは0.9J/cm2で一定とし、照射量は2.5、5、25mW/cm2と変化させた。ピークは5mW/cm2であったが、2.5mW/cm2と25mW/cm2では治療効果は低かった。
Castanoら17は、ラットを用いて炎症性関節炎を研究し、高照度および低照度(5~50mW/cm2)で照射された高フルエンスおよび低フルエンス(3~30J/cm2)の効果を比較した。効果的な治療が観察されたのは 30 J/cm2、50 mW/cm2で10分間、30 J/cm2、5 mW/cm2で100分間照射した場合である。3 J/cm2, 5 mW/cm2, 10分間の低フルエンスも有効であった。50mW/cm2で3J/cm2を1分間照射した場合のみ効果がなかった。彼らは、より高いフルエンス(30 J/cm2)では、高照度と低照度の両方が有効であったため、関節炎に対するPBM効果は照射量に依存しなかったが、より低いフルエンス(3 J/cm2)では、低照度のみが有効であったと結論した。従って、光照射時間が非常に重要であると結論づけた。いくつかの研究では(3J/cm2、50mW/cm2)が有効であったが、この研究ではそうではなかった。彼らは、照射時間がわずか1分であったため、細胞代謝を十分に活性化するのに十分な時間がなかったことを示唆している17。
Salehpourら77は、うつ病の原因となる慢性的な軽度のストレスを与えたラットを用いて、NIR(810nm)および赤色(630nm)レーザーの10Hzパルス波とシタロプラムの治療効果を比較した。ラットにストレスを与えた後、NIR 810nmを用いたPBMを投与するグループIと、630nmのコヒーレント光を同一パラメータで照射するグループIIに分けた: 10Hzゲート波(デューティーサイクル50%)、フルエンス1.2J/cm2/回、出力35mWと240mW、照射時間2ms、ビーム径3mm、コンタクトモード、スポットサイズ0.07cm2である。レーザー出力は赤色波長で6.2W、赤外波長で39.3Wとし、照射量はそれぞれ89mW/cm2と562mW/cm2とした。各セッションの平均フルエンスは1.2J/cm2で、12セッションの治療全体では合計14.4J/cm2であった。最後に、III群にはコルチゾールレベルを低下させる抗うつ薬シタロプラムを投与した。その結果、10HzのパルスNIRレーザーを用いたPBMは、赤色レーザーよりも優れた効果を示し、シタロプラムと同じ効果を示した。
Salehpourら59は、マウスにD-ガラクトースを投与してミトコンドリア機能障害を誘発し、脳のミトコンドリア機能を研究した。このモデルは加齢に伴う認知機能障害のモデルと考えられている。動物に660nmと810nmの波長を2種類のフルエンスで照射した: 4J/cm2と8J/cm2、10Hz、4.75W/cm2、88%デューティサイクル、200mW、接触式、週3回、セッション間は48時間、直径7mmのパワーメーターセンサーを使用した。彼らは、4J/cm2の両波長では結果が悪く、8J/cm2では老化によるミトコンドリア機能障害が改善することを発見した。
Wuら78は、マウスに外傷性脳損傷(TBI)を誘発し、660nm、730nm、810nm、980nmのいずれかの波長を用い、15mW/cm2の放射照度で36J/cm2の単回照射を、損傷4時間後に4分間行った。660nmと810nmを用いた場合のみ、中等度から重度の傷害を有するマウスに有意な改善が認められた。最も望ましい効果が見られたのは810nmで、730nmと980nmでは効果が見られなかった。
Lopes-Martinsら18は、ラットの四頭筋収縮時の筋肉疲労に対するPBMの効果を調べた。32匹のラットの4群に、655nm、スポット面積0.08cm2、25mW、2.5mW、31.25mW/cm2のパラメータを用いて、異なる用量のPBMT(0.5、1.0、2.5J/cm2)を照射した。グループ:0.5J/cm2(32秒)、1J/cm2(80秒)、2.5J/cm2(160秒)。0.5J/cm2と1J/cm2の群のみが、反復四頭筋収縮中のラットの筋疲労の発生を防止した。
Lopes-Martinsら74は別の研究で、マウスの急性炎症性胸膜炎に650nmの波長を用いた。同じ出力2.5mWで、フルエンスは3、7.5、15J/cm2と変えた。この条件下では、7.5J/cm2が3J/cm2または15J/cm2よりも効果的であった。
De Almeidaら79は、30匹のラットで筋収縮を誘発した後の筋パフォーマンスを研究した。904nm、平均出力15mW、異なるエネルギー(0.1、0.3、1.0、3.0J)を用い、1.0Jと3.0Jのグループが総仕事量において有意な増加を示した(P<0.01)。彼らは、1.0Jが運動後の筋損傷を減少させ、筋パフォーマンスを向上させたと結論づけた。
ミトコンドリア数の多い組織においてin vivoでPBMを使用し、良好な結果を報告した研究を表5にまとめた。ミトコンドリア数の多い組織において生体内でPBMを使用した研究で、効果がなかったパラメータは表9に報告されている。著者らがパラメーターを変化させた場合、同じ研究が表5と99(有効なパラメーターと無効なパラメーター)の両方に含まれるケースもある。
表5
効果的なPBM治療:in vivoではミトコンドリア数の多い組織で行う。
| 著者紹介 | 波長 (nm) | フルエンス | 照度 | 組織タイプ |
|---|---|---|---|---|
| Alvesら25 | 808 | 142.4J/cm2142.4 J/cm2 | 1.78W/cm21.78W/cm2
4 J, 50 mW, 0 .028cm20.028cm2, 80 s per point |
関節炎 |
| Oronら62,63 | 810 | 0.3J/cm20.3 J/cm2 | 5mW/cm25mW/cm2
5 mW、面積 1 .1cm21.1cm2 、60秒 |
ハート |
| Oronら62,63 | 810 | 0.9J/cm20.9 J/cm2 | 5メートルダブリュー/cm25 メートルダブリュー/cm2 | 心筋組織 |
| Castanoら17 | 810 | 30J/cm230 J/cm2 | 50メートルダブリュー/cm250 メートルダブリュー/cm2 | 関節炎 |
| Castanoら17 | 810 | 30J/cm230 J/cm2 | 5メートルダブリュー/cm25 メートルダブリュー/cm2 | 関節炎 |
| Castanoら17 | 810 | 3J/cm23 J/cm2 | 5メートルダブリュー/cm25 メートルダブリュー/cm2 | 関節炎 |
| Salehpourら59 | 810 | 1.2J/cm21.2 J/cm2 | 560mW/cm2560mW/cm2
39.3 W、スポットサイズ 0 .07cm20.07cm2 |
脳 |
| Salehpourら64 | 810 | 8J/cm28 J/cm2 | 89mW/cm289mW/cm2
6.2 W、スポットサイズ 0 .07cm20.07cm2 |
脳 |
| Wuら78 | 810 | 36J/cm236 J/cm2 | 15メートルダブリュー/cm215 メートルダブリュー/cm2 | 脳 |
| ブランコら70 | 1064 | 250メートルダブリュー/cm2250 メートルダブリュー/cm2 | 60J/cm260 J/cm2 | 脳(ヒト) |
| ディズナーら71 | 1064 | 250メートルダブリュー/cm2250 メートルダブリュー/cm2 | 60J/cm260 J/cm2 | 脳(ヒト) |
| 安藤ら13 | 810 | 36J/cm236 J/cm2 | 50メートルダブリュー/cm250 メートルダブリュー/cm2 | TBI |
| Zhangら67 | 810 | 大脳皮質に到達する放射照度 1.8~2.5J/cm22.5J/cm2
平均放射照度36J/cm236 J/cm2 |
150mW/cm2150mW/cm2
パルス周波数10Hz、パルス時間50ms、4分 |
TBI |
| Salehpourら68 | 810 | 1.2J/cm21.2 J/cm2 | 89 および 562 mW/cm2562 mW/cm2
35および240 mW 10 Hz、デューティサイクル50%; 0 .07cm20.07cm2 |
脳 |
| バローニら68 | 69個のLEDによるクラスター 660/850 nm | 206.89J/cm2206.89 J/cm2 | 6.89W/cm26.89W/cm2
200 mW; 6 J/ダイオード(30秒); 0 .02cm20.02cm2 印加点あたり 30 J(5×6J)6(5×6)6印加点:総エネルギー 180 J |
大腿四頭筋 |
| Zhangら80 | 635 | 0.96J/cm20.96 J/cm2 | 6.37mW/cm26.37mW/cm2
5 mW、レーザービーム幅10 mm、150秒 |
心筋のプレコンディショニング |
| Salehpourら59 | 660 | 8J/cm28 J/cm2 | 4.75W/cm24.75W/cm2
88%デューティサイクル、200mW、週3回接触、直径7mm |
脳 |
| Wuら78 | 660 | 36J/cm236 J/cm2 | 15メートルダブリュー/cm215 メートルダブリュー/cm2 | 脳 |
| Lopes-Martinsら18 | 655 | 0.5J/cm20.5 J/cm2 | 31.25mW/cm231.25mW/cm2
2.5 mW、スポット面積 0 .08cm20.08cm2 、25 mW、32 s |
筋肉 |
| Lopes-Martinsら18 | 655 | 1J/cm21 J/cm2 | 31.25mW/cm231.25mW/cm2
2.5 mW、スポット面積 0 .08cm20.08cm2 、25 mW、80 s、2.5 mW |
筋肉 |
3.2.4. ミトコンドリアの数が少ない組織(皮膚、骨、軟骨)におけるin vivo研究
Lanzafameら15は、670nmのダイオードレーザーでマウスの褥瘡を治療した。一定のフルエンス5J/cm2を維持し、異なる照射量(0.7、2、8、40mW/cm2)を使用したところ、8mW/cm2で有意な改善が見られた。
Prabhuら81は、He-Neレーザー(632nm、7mW、4mW/cm2)を異なる照射量(1、2、3、4、6、8、10J/cm2)で使用した場合、マウスの切除創傷治癒に二相性の用量反応があることを発見した。フルエンス2J/cm2で効果がピークに達し、10J/cm2の高用量で抑制効果が現れるという、明確な二相性線量反応が生じた。
Galら82は、ラットの創傷の引張強さを670nmの異なる出力密度で比較した。4 mW/cm2を20分50秒間(5 J/cm2)照射した場合にはプラスの効果が見られたが、同じ波長で15 mW/cm2を5分33秒間(5 J/cm2)照射した場合には、この効果は見られなかった。このことは、同じフルエンスでより低い放射照度をより長い時間照射した方が効果的であることを示唆している。
Al-WatbanとDelgado83は、ラットの熱傷創傷治癒に対するレーザー照射の効果をin vivoで研究した。彼らは、面積1.534cm2の表層熱傷を作り、670nm. 200mWのダイオードレーザーを、1、5、9、19J/cm2の異なる線量で、週3回、12週間照射した。低用量の1J/cm2と5J/cm2を照射したグループのみが、コントロールと比較して創傷治癒が有意に良好であり、最大の効果は1J/cm2で得られた。
ミトコンドリアの数が少ない組織でPBMをin vivoで使用し、良好な結果を報告した研究を表6にまとめた。ミトコンドリア数の少ない組織において、生体内でPBMを使用した効果のないパラメータは表10に報告されている。著者らがパラメーターを変化させた場合、同じ研究が表6と表10(有効なパラメーターと無効なパラメーター)の両方に含まれるケースもある。
表6
効果的なPBM治療:in vivoでミトコンドリア数の少ない組織に対して。
| 著者紹介 | 波長 (nm) | フルエンス (J/cm2) | 照度 | 組織タイプ |
|---|---|---|---|---|
| メンデスら21 | 830 | 50 | 125mW/cm2125mW/cm2
35 mW 0.6 cm径 |
創傷治癒 |
| Lanzarfaneら15 | 670 | 5 | 8mw/cm28 mw/cm2 | 潰瘍 |
| Prabhuら21 | 632 | 2 | 4.0mW/cm24.0mW/cm2
7 mW、1.75cm21.75cm2 |
創傷治癒 |
| Galら21 | 670 | 5 | 15mw/cm215 mw/cm2 | 創傷引張強さ |
| Al-Watbanら21 | 670 | 1と5 | 130mW/cm2130mW/cm2
200 mW、1.534cm21.534cm2 |
創傷治癒 |
| メンデスら21 | 830 | 20 | 125mW/cm2125mW/cm2
35 mW、直径0.6 cm |
創傷治癒 |
| Barbosaら20 | 790 | 140 | 3500mW/cm23500mW/cm2
100 mW、4 J、スポットサイズ 0 .028cm20.028cm2 |
骨 |
| Barbosaら20 | 830 | 140 | 3500mW/cm23500mW/cm2
100 mW、4 J、スポットサイズ 0 .028cm20.028cm2 |
骨 |
3.3. III-PBM効率に及ぼす照射モードの変化の影響: CWかパルスか
包括的な文献レビュー84において、Hamblinは33の研究を取り上げたが、そのうち9つはパルス波とCWを直接比較したものであった。これらの研究のうち6件では、パルス波の方がCWよりもよい結果を示した。1件の研究では、どちらのモードも同等の効果を示し、CWの方がよい結果を報告した研究は2件のみであった。Hamblinらは、このレビューから、特に創傷治癒と脳卒中後の管理においては、パルス光はCW光より優れている可能性があり、一方、神経再生が必要な患者ではCWの方がより有益である可能性があると結論づけた。加えて、パルス周波数と病態との間に相関関係を描くことは不可能であると結論づけた。その結果、特定の周波数が他の周波数より有効であるとか、有効でないとかいうことはないようである。670nm. 20mW、エネルギー密度2J/cm2)、100Hz(808nm、37.5mW/cm2、0.9J/cm2)、292Hz(800mW/cm2、21. 6 J/cm2)、(670 nm、10 mW、5 J/cm2)使用時600 Hz、(808 nm、7.5 mW/cm2、0.9-1.2 J、デューティ・サイクル、30%)使用時1000 Hz、(5 mW/cm2)使用時1500 Hz、(10 mW/cm2)使用時3000 Hz、8000 Hz(該当なし)。
Gigo-Benatoら14は、808nm(CW)と905nm(PW)を使用したCWとパルスレーザーの併用(CW+PW)の効果を、CW(808nm)またはPW(905nm)レーザーを別々に使用した場合と比較した。CWレーザーは29J/cm2、パルス波レーザーは40J/cm2で照射した。その結果、複合レーザーはCW単独やPW単独よりも神経再生に有効であることが示唆された。
Al-WatbanとZhang16は、ラットの創傷治癒において、パルス波とCW PBMの両方を使用した場合の効果を評価した。楕円形の創傷を形成した後、動物に635nmダイオードレーザー(平均出力3.4mW、スポットサイズ3.8cm2、創傷サイズ1.04cm2、放射照度0.89mW/cm2、治療時間18.7分、フルエンス1J/cm2)を週3回照射した。照射はCWまたはパルスモードで行った: 100、200、300、400、500Hzである。その結果、パルスレーザーよりもCWレーザーの方が効果的であり、異なる周波数を比較した場合、100Hzの方が他の周波数よりも創傷治癒効果が高いことが判明した。
この論文は、創傷治癒においてパルスモードがCWよりも効果的であると結論づけたHamblinと矛盾する。おそらくAl-Watbanは、パルスモードと同じフルエンスをCWに使用しなかったため、CWの方が効率的であると判断したのであろう。さらに、彼は真のパルス波ではなくゲーテッドCWを使用した16。
安藤ら13は、パルスとCWの810nmレーザー照射を比較して、マウスのTBIを治療した。使用したパラメータは以下の通りである: 810nmダイオードレーザー、放射照度50mW/cm2、損傷頭部へのスポット径1cm、照射時間12分、フルエンス36J/cm2である。彼らは、100Hzや連続モードよりも10Hzの方が良い結果が得られることを発見した。
el SayedとDyson85は、4つの異なる周波数(2.5、20、292、20,000Hz)の効果を比較し、20Hzと292Hzのみが有益であることを発見した。
Sushkoら86は、5%ホルマリン水溶液20mlを皮下注射し、マウスに誘発される痛みを調べた。640nmと880nmのLEDを連続またはパルスモードで10分間マウスに照射した。彼らは、パルスモードはCWよりも効果的であり、10Hzと8000Hzの周波数が最も効果的であったのに対し、200Hzと600Hzのパルス反復率はあまり効果的でなかったことを発見した。
上田と清水87は、CWモード(830nm、500mW、0.48~3.84J/cm2)とパルスモード(1、2、8Hz)のパラメータを用いて、ラットの骨芽細胞様細胞に対する3つの異なるパルス繰り返し率の効果を研究した。その結果、1Hzと2Hzが細胞増殖、ALP活性、ALP遺伝子発現、骨結節形成を著しく刺激し、2Hzが骨結節形成を刺激する最適なパルス繰り返し周波数であることが判明した。
4. 効果的なPBMTと非効果的なPBMTはどのようなパラメータによってもたらされるかの検討
異なるパラメータ、プロトコール、治療目的、生物学的標的組織で行われた研究を比較することは難しい。パラメータが完全に提示されていなかったり、正確性に疑問がある場合も多い。レビュー分析のこの部分では、表3-10に示されたデータから少なくともいくつかの一般的推論を試みる。
4.1. 波長
波長は組織透過性に影響する。より短い波長(600~700nm)は表層組織の治療に最適と考えられ、より長い波長(780~950nm)はより深い組織の治療に好まれる。赤色の波長は0.5~1mmを透過し、近赤外線エネルギーは37%の強度を失う前に2mmを透過する。
赤色光は赤外レーザーに比べ透過能力が低いため、赤外波長は赤色波長に比べ骨修復に優れた効果を示す。
Karuによると、700~770 nmの波長には有意な活性はないという。Wuら78は、マウスのTBIに730nmのレーザーを使用し、660nmと810nmのレーザーが有効であったのに対し、効果がないことを明らかにした。Guptaら92は、マウスの創傷治癒について同様の比較を行い、やはり660nmと810nmのレーザーが有効であるのに対し、730nmのレーザーは効果がないことを明らかにした。
Barbosaら20は、NIRのPBM効果は14日以上有効であるのに対し、赤色波長の効果は14日後に失われると結論づけた。
2つの波長を組み合わせることで、PBMのさらなる効果が得られる。830nmと685nmを比較したところ、Mendezら21は、830nmの方が良い結果をもたらすことを発見した。最適な波長を定義するには、まだ多くの課題が残っている。とはいえ、深部組織や相当量の光を必要とする体内のターゲットには、NIR波長が望ましい。
4.2. レーザーとノンコヒーレント光
PBMTでは、コヒーレントレーザーとノンコヒーレントLEDの両方が使用される。レーザー光は平行光であるため、平行光でないLED光よりも組織内で前方に散乱しやすい5。さらに、レーザーはコヒーレントな光を発するが、LED光は非コヒーレントである。コヒーレンス長は、帯域幅が小さいほど長くなる。例えば、He-Neレーザーのようなガスレーザーはコヒーレンス長が非常に長い。ダイオードレーザーの帯域幅はやや広く、その結果コヒーレンス長は短くなる。コヒーレントなレーザー光が組織と相互作用するとき、組織構造の小さな欠陥によって、個々の波面に異なる位相が生じ、相互干渉パターンが生じる。これらの干渉パターンは「レーザースペックル」と呼ばれ、スペックルの大きさは光の波長に関係している。可視光領域では、その大きさは1μm以下である。細胞内小器官(ミトコンドリアなど)はこのオーダーの大きさを持っており、ある理論では、レーザーの斑点は、非コヒーレントなLED光よりもミトコンドリアを刺激するのに適していると提唱されている93-95。最近のレビューでは、他のすべての光パラメーターが同じであれば、PBM用途におけるレーザーとLEDの間に実質的な違いはないと結論付けられている96。
4.3. フルエンスと放射照度
光子強度、すなわち放射照度(W/cm2 または分光放射照度)は適切でなければならない。高い強度を用いると、光子エネル ギーは標的組織内で過剰な熱に変換され、低い強度を用いると光子の吸収が不十分となり、目的を達 成することができない。
線量も適切でなければならない(J/cm2)。理想的なフルエンスや線量を達成するために低い放射照度を使用し、照射時間を長くしても、最終的に十分な結果は得られない。光生物学の第二法則と呼ばれるBunsen-Roscoeの互恵則97 は、低い入射パワー密度では成立しない。
常に正のPBM効果をもたらす線量やフルエンスの固定値は存在しない。同じ動物モデルを用いた異なる研究であっても、矛盾する所見が存在することがある。例えば、3つの論文がPBM後のインプラント周囲骨再生について検討し ている。Menezesら98は、20J/cm2が最良の照射線量であることを発見したが、Massottiら22とMayerら23は、20J/cm2が最悪の照射線量であることを発見した。
最適な線量はさまざまな因子に直接関係している:
- 波長
- 波長 -照射する治療の種類:疼痛緩和、創傷治癒、組織再生。
- 出力密度または放射照度
- エネルギー密度またはフルエンス
- 治療対象組織の深さ
- 組織表面と実際の標的組織に到達するビームのスポットサイズ。
照射されたフルエンス(J/cm2)が放射照度(mW/cm2)よりも重要であるか否かを判断するため、表2-9の研究の分類に従って、有効な研究と無効な研究の散布図(図1-4)を作成した。
表7
PBMの無効な治療:ミトコンドリア数の多い細胞を用いたin vitro試験。
| 著者紹介 | 波長 (nm) | フルエンス (J/cm2) | 照度 | セルタイプ |
|---|---|---|---|---|
| シャルマら49 | 810 | 30 | 25メートルダブリュー/cm225 メートルダブリュー/cm2 | マウス皮質ニューロン |
| チェンら26 | 660 | 3 | 0.8mW/cm20.8mW/cm2
6 mW、7.5cm27.5cm2 3750 s |
単球 |
| チェンら26 | 660 | 2 | 0.8mW/cm20.8mW/cm2
6 mW、7.5cm27.5cm2 2500 s |
単球 |
| アマローリら19 | 808 | 3.0 | 1000mW/cm21000mW/cm2, 1 W, 1 cm21cm2スポット面積 | ゾウリムシ |
| アマローリら19 | 808 | 64 | 100mW/cm2100mW/cm2, 1 W, 1 cm21cm2スポット面積 | ゾウリムシ |
表8
ミトコンドリア数の少ない細胞での試験管内研究では、PBMの効果的な治療法はない。
| 著者紹介 | 波長 (nm) | フルエンス (J/cm2) | 照度 | セルタイプ |
|---|---|---|---|---|
| Tschonら55 | 915 | 20.56 | 150mW/cm2150mW/cm2
100 Hz、デューティサイクル50%、パワー0.575 W 144 s |
骨芽細胞 |
| Migliarioら57 | 930 | 1.57 | 1580mW/cm21580mW/cm2
1 W,1 s, 0 .63cm20.63cm2 |
前骨芽細胞 |
| Migliarioら57 | 930 | 78.7 | 1580mW/cm21580mW/cm2
1W、50秒、0.63cm20.63cm2 |
前骨芽細胞 |
| スコピンら58 | 980 | 5.9 | 49メートルダブリュー/cm249 メートルダブリュー/cm2 | 線維芽細胞 |
| スコピンら58 | 980 | 14.4 | 120メートルダブリュー/cm2120 メートルダブリュー/cm2 | 線維芽細胞 |
| Zhangら53 | 628 | 9.0 | 11.4mW/cm211.4mW/cm2
15 mW、距離0.75 cm |
線維芽細胞 |
| カドラら75 | 830 | 0.75 | 8.4mW/cm28.4mW/cm2
84 mW,10cm210cm2, 360 s, セルまでの距離 9 cm |
線維芽細胞 |
| Wangら73 | 980 | 20 | 16mW/cm216mW/cm2
4cm24cm2, 1 W |
脂肪幹細胞 |
表9
ミトコンドリア数の多い組織では、in vivoでのPBM治療は効果がない。
| 著者紹介 | 波長 (nm) | フルエンス (J/cm2) | 照度 | 組織タイプ |
|---|---|---|---|---|
| Oronら62,63 | 810 | 0.3 | 2.5mW/cm22.5mW/cm2
5 mW、照射面積 1 .1cm21.1cm2 |
ハート |
| Oronら62,63 | 810 | 0.3 | 25mW/cm225mW/cm2
5 mW、照射面積 1 .1cm21.1cm2 |
ハート |
| Salehpourら59 | 660 | 4 | 4.75W/cm24.75W/cm2
10 Hz、 4.75W/cm24.75W/cm2 、88%デューティサイクル、200 mW |
脳 |
| Salehpourら59 | 810 | 4 | 4.75W/cm24.75W/cm2
10 Hz、 4.75W/cm24.75W/cm2 、88%デューティサイクル、200 mW |
脳 |
| Wuら78 | 980 | 36 | 15メートルダブリュー/cm215 メートルダブリュー/cm2 | 脳 |
| Alvesら25 | 808 | 142.4 | 3.57W/cm23.57W/cm2
4 J, 50 mW, 0 .028cm20.028cm2, 80 s per point |
関節炎 |
| Lopes-Martinsら18 | 655 | 2.5 | 31.25mW/cm231.25mW/cm2
2.5 mW、スポット面積 0 .08cm20.08cm2 、25 mW、160 s、2.5 mW |
筋肉 |
表10
ミトコンドリアの数が少ない組織では、in vivoでのPBM治療は効果がない。
| 著者紹介 | 波長 (nm) | フルエンス (J/cm2) | 照度 | 組織タイプ |
|---|---|---|---|---|
| Lanzafameら15 | 670 | 5.0 | 0.7メートルダブリュー/cm20.7 メートルダブリュー/cm2 | 潰瘍(創傷治癒) |
| Lanzafameら15 | 670 | 5.0 | 2.0メートルダブリュー/cm22.0 メートルダブリュー/cm2 | 潰瘍(創傷治癒) |
| Galら82 | 670 | 5.0 | 15メートルダブリュー/cm215 メートルダブリュー/cm2 | 創傷治癒 |
| Lanzafameら15 | 670 | 5.0 | 40メートルダブリュー/cm240 メートルダブリュー/cm2 | 創傷治癒 |
| Prabhuら81 | 632 | 10 | 4.0mW/cm24.0mW/cm2
7 mW、1.75cm21.75cm2 |
創傷治癒 |
| Al-Watbanら83 | 670 | 9.0 | 130mW/cm2130mW/cm2
200 mW、1.534cm21.534cm2 |
創傷治癒 |
| Al-Watbanら83 | 670 | 19 | 130mW/cm2130mW/cm2
200 mW、1.534cm21.534cm2 |
創傷治癒 |
| キリクら88 | 636 | 5 | 1mW/cm21mW/cm2
プローブから傷まで10cm |
創傷治癒 |
3.3. III-PBM効率に及ぼす照射モードの変化の影響: CWかパルスか
包括的な文献レビュー84において、Hamblinは33の研究を取り上げたが、そのうち9つはパルス波とCWを直接比較したものであった。これらの研究のうち6件では、パルス波の方がCWよりもよい結果を示した。1件の研究では、どちらのモードも同等の効果を示し、CWの方がよい結果を報告した研究は2件のみであった。Hamblinらは、このレビューから、特に創傷治癒と脳卒中後の管理においては、パルス光はCW光より優れている可能性があり、一方、神経再生が必要な患者ではCWの方がより有益である可能性があると結論づけた。加えて、パルス周波数と病態との間に相関関係を描くことは不可能であると結論づけた。その結果、特定の周波数が他の周波数より有効であるとか、有効でないとかいうことはないようである。670nm. 20mW、エネルギー密度2J/cm2)、100Hz(808nm、37.5mW/cm2、0.9J/cm2)、292Hz(800mW/cm2、21. 6 J/cm2)、(670 nm、10 mW、5 J/cm2)使用時600 Hz、(808 nm、7.5 mW/cm2、0.9-1.2 J、デューティ・サイクル、30%)使用時1000 Hz、(5 mW/cm2)使用時1500 Hz、(10 mW/cm2)使用時3000 Hz、8000 Hz(該当なし)。
Gigo-Benatoら14は、808nm(CW)と905nm(PW)を使用したCWとパルスレーザーの併用(CW+PW)の効果を、CW(808nm)またはPW(905nm)レーザーを別々に使用した場合と比較した。CWレーザーは29J/cm2、パルス波レーザーは40J/cm2で照射した。その結果、複合レーザーはCW単独やPW単独よりも神経再生に有効であることが示唆された。
Al-WatbanとZhang16は、ラットの創傷治癒において、パルス波とCW PBMの両方を使用した場合の効果を評価した。楕円形の創傷を形成した後、動物に635nmダイオードレーザー(平均出力3.4mW、スポットサイズ3.8cm2、創傷サイズ1.04cm2、放射照度0.89mW/cm2、治療時間18.7分、フルエンス1J/cm2)を週3回照射した。照射はCWまたはパルスモードで行った: 100、200、300、400、500Hzである。その結果、パルスレーザーよりもCWレーザーの方が効果的であり、異なる周波数を比較した場合、100Hzの方が他の周波数よりも創傷治癒効果が高いことが判明した。
この論文は、創傷治癒においてパルスモードがCWよりも効果的であると結論づけたHamblinと矛盾する。おそらくAl-Watbanは、パルスモードと同じフルエンスをCWに使用しなかったため、CWの方が効率的であると判断したのであろう。さらに、彼は真のパルス波ではなくゲーテッドCWを使用した16。
安藤ら13は、パルスとCWの810nmレーザー照射を比較して、マウスのTBIを治療した。使用したパラメータは以下の通りである: 810nmダイオードレーザー、放射照度50mW/cm2、損傷頭部へのスポット径1cm、照射時間12分、フルエンス36J/cm2である。彼らは、100Hzや連続モードよりも10Hzの方が良い結果が得られることを発見した。
el SayedとDyson85は、4つの異なる周波数(2.5、20、292、20,000Hz)の効果を比較し、20Hzと292Hzのみが有益であることを発見した。
Sushkoら86は、5%ホルマリン水溶液20mlを皮下注射し、マウスに誘発される痛みを調べた。640nmと880nmのLEDを連続またはパルスモードで10分間マウスに照射した。彼らは、パルスモードはCWよりも効果的であり、10Hzと8000Hzの周波数が最も効果的であったのに対し、200Hzと600Hzのパルス反復率はあまり効果的でなかったことを発見した。
上田と清水87は、CWモード(830nm、500mW、0.48~3.84J/cm2)とパルスモード(1、2、8Hz)のパラメータを用いて、ラットの骨芽細胞様細胞に対する3つの異なるパルス繰り返し率の効果を研究した。その結果、1Hzと2Hzが細胞増殖、ALP活性、ALP遺伝子発現、骨結節形成を著しく刺激し、2Hzが骨結節形成を刺激する最適なパルス繰り返し周波数であることが判明した。
4. 効果的なPBMTと非効果的なPBMTはどのようなパラメータによってもたらされるかの検討
異なるパラメータ、プロトコール、治療目的、生物学的標的組織で行われた研究を比較することは難しい。パラメータが完全に提示されていなかったり、正確性に疑問がある場合も多い。レビュー分析のこの部分では、表3-10に示されたデータから少なくともいくつかの一般的推論を試みる。
4.1. 波長
波長は組織透過性に影響する。より短い波長(600~700nm)は表層組織の治療に最適と考えられ、より長い波長(780~950nm)はより深い組織の治療に好まれる。赤色の波長は0.5~1mmを透過し、近赤外線エネルギーは37%の強度を失う前に2mmを透過する。
赤色光は赤外レーザーに比べ透過能力が低いため、赤外波長は赤色波長に比べ骨修復に優れた効果を示す。
Karuによると、700~770 nmの波長には有意な活性はないという。Wuら78は、マウスのTBIに730nmのレーザーを使用し、660nmと810nmのレーザーが有効であったのに対し、効果がないことを明らかにした。Guptaら92は、マウスの創傷治癒について同様の比較を行い、やはり660nmと810nmのレーザーが有効であるのに対し、730nmのレーザーは効果がないことを明らかにした。
Barbosaら20は、NIRのPBM効果は14日以上有効であるのに対し、赤色波長の効果は14日後に失われると結論づけた。
2つの波長を組み合わせることで、PBMのさらなる効果が得られる。830nmと685nmを比較したところ、Mendezら21は、830nmの方が良い結果をもたらすことを発見した。最適な波長を定義するには、まだ多くの課題が残っている。とはいえ、深部組織や相当量の光を必要とする体内のターゲットには、NIR波長が望ましい。
4.2. レーザーとノンコヒーレント光
PBMTでは、コヒーレントレーザーとノンコヒーレントLEDの両方が使用される。レーザー光は平行光であるため、平行光でないLED光よりも組織内で前方に散乱しやすい5。さらに、レーザーはコヒーレントな光を発するが、LED光は非コヒーレントである。コヒーレンス長は、帯域幅が小さいほど長くなる。例えば、He-Neレーザーのようなガスレーザーはコヒーレンス長が非常に長い。ダイオードレーザーの帯域幅はやや広く、その結果コヒーレンス長は短くなる。コヒーレントなレーザー光が組織と相互作用するとき、組織構造の小さな欠陥によって、個々の波面に異なる位相が生じ、相互干渉パターンが生じる。これらの干渉パターンは「レーザースペックル」と呼ばれ、スペックルの大きさは光の波長に関係している。可視光領域では、その大きさは1μm以下である。細胞内小器官(ミトコンドリアなど)はこのオーダーの大きさを持っており、ある理論では、レーザーの斑点は、非コヒーレントなLED光よりもミトコンドリアを刺激するのに適していると提唱されている93-95。最近のレビューでは、他のすべての光パラメーターが同じであれば、PBM用途におけるレーザーとLEDの間に実質的な違いはないと結論付けられている96。
4.3. フルエンスと放射照度
光子強度、すなわち放射照度(W/cm2 または分光放射照度)は適切でなければならない。高い強度を用いると、光子エネル ギーは標的組織内で過剰な熱に変換され、低い強度を用いると光子の吸収が不十分となり、目的を達 成することができない。
線量も適切でなければならない(J/cm2)。理想的なフルエンスや線量を達成するために低い放射照度を使用し、照射時間を長くしても、最終的に十分な結果は得られない。光生物学の第二法則と呼ばれるBunsen-Roscoeの互恵則97 は、低い入射パワー密度では成立しない。
常に正のPBM効果をもたらす線量やフルエンスの固定値は存在しない。同じ動物モデルを用いた異なる研究であっても、矛盾する所見が存在することがある。例えば、3つの論文がPBM後のインプラント周囲骨再生について検討し ている。Menezesら98は、20J/cm2が最良の照射線量であることを発見したが、Massottiら22とMayerら23は、20J/cm2が最悪の照射線量であることを発見した。
最適な線量はさまざまな因子に直接関係している:
- 波長
- 波長 -照射する治療の種類:疼痛緩和、創傷治癒、組織再生。
- 出力密度または放射照度
- エネルギー密度またはフルエンス
- 治療対象組織の深さ
- 組織表面と実際の標的組織に到達するビームのスポットサイズ。
照射されたフルエンス(J/cm2)が放射照度(mW/cm2)よりも重要であるか否かを判断するため、表2-9の研究の分類に従って、有効な研究と無効な研究の散布図(図1-4)を作成した。
図1ダウンロード
ミトコンドリア数の多いin vitro細胞のPBMに関する研究。(a)効果的(ポジティブな研究)、(b)効果的でない(ネガティブな研究)、(c)効果的(ポジティブな研究)と効果的でない(ネガティブな研究)の組み合わせ。
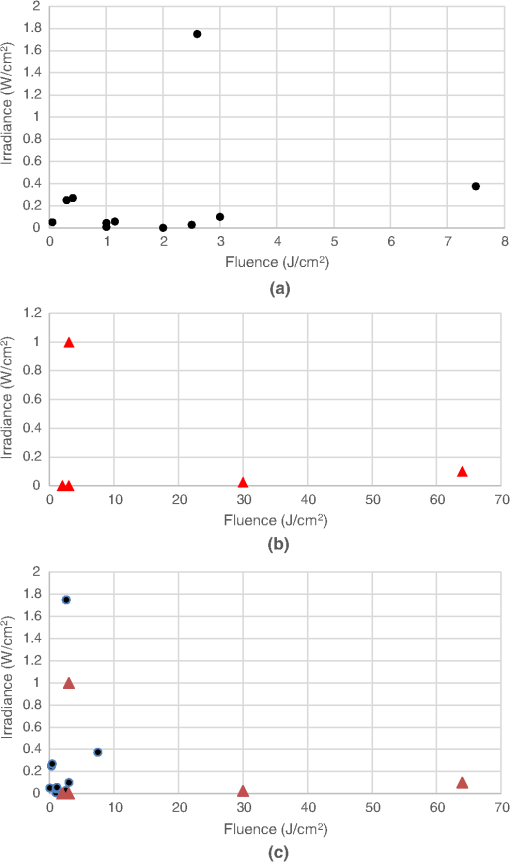
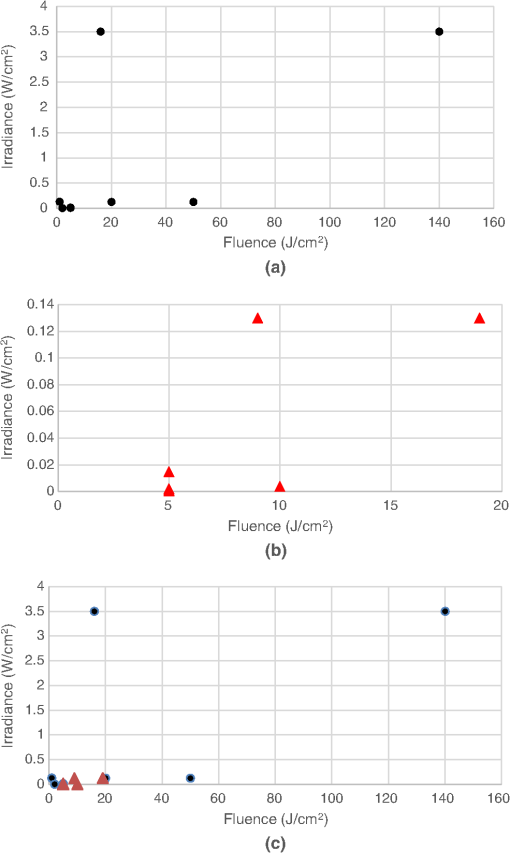
図2ダウンロード
試験管内でミトコンドリア数の少ない細胞のPBMに関する研究。(a)効果的(肯定的研究)、(b)効果的でない(否定的研究)、(c)効果的(肯定的研究)と効果的でない(否定的研究)の組み合わせ。
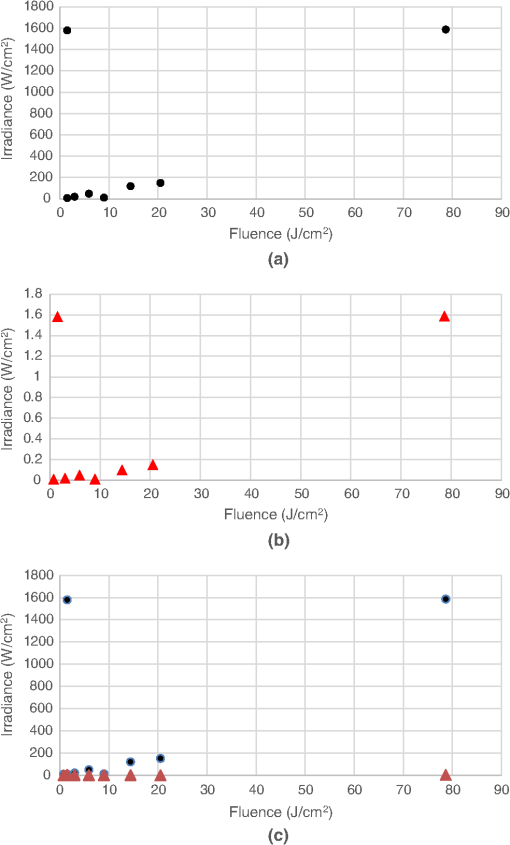
図3ダウンロード
ミトコンドリア数の多い生体内組織のPBMに関する研究。(a)有効(ポジティブな研究)、(b)無効(ネガティブな研究)、(c)有効(ポジティブな研究)と無効(ネガティブな研究)の組み合わせ。
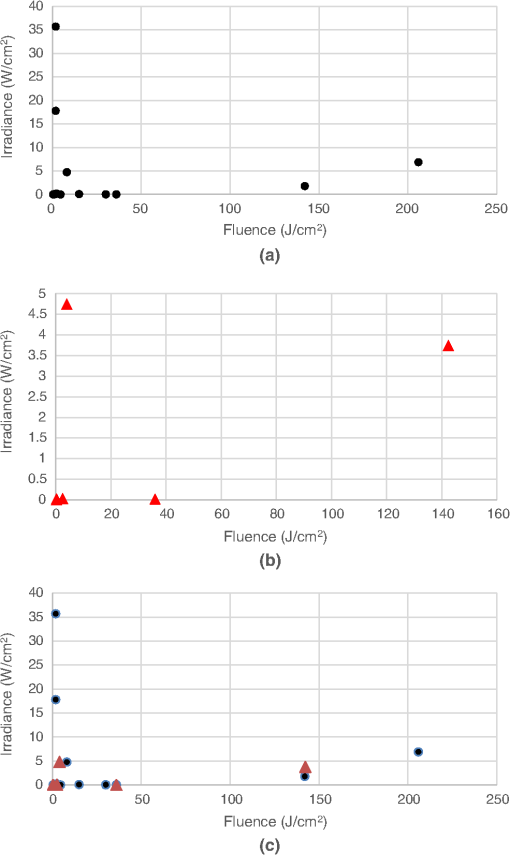
図4ダウンロード
ミトコンドリア数の少ない生体内組織のPBMに関する研究。(a)有効(ポジティブな研究)、(b)無効(ネガティブな研究)、(c)有効(ポジティブな研究)と無効(ネガティブな研究)の組み合わせ。
4.3.1. in vitro試験
図1(a)はミトコンドリア数の多い細胞でのin vitro試験のプロットを示し、図1(b)はミトコンドリア数の少ない細胞での対応するプロットを示す。次のような観察ができる。すべての効果的な研究では、フルエンスは比較的低く(7.5 J/cm2未満)、いくつかのケースでは1 J/cm2未満であった。しかし、効果のない研究では、フルエンスの値は大きく(すべて3 J/cm2以上)、2つのケースでは非常に大きな値(30 J/cm2と65 J/cm2)であった。効果のある群(11件)では、効果のない群(5件)よりも多くの研究があった。このことは、高ミトコンドリア細胞はPBMによく反応し、効果のない研究は投与不足よりも過剰投与による可能性が高いことを示唆している。
図2(a)は、ミトコンドリア数の少ない細胞における効果的なin vitro研究を示している。ここでも肯定的な研究が否定的な研究[図2(b)]を上回っている(15対8)。低ミトコンドリア数のサブグループにおける陽性研究のフルエンス値は、高ミトコンドリア数のサブグループにおける陽性研究で使用されたフルエンスよりも全体的に高いようである。ミトコンドリア数が少ないサブグループの否定的な研究で使用されたフルエンスは、肯定的な研究で使用されたフルエンスより少し高かっただけであり、過剰投与はミトコンドリア数が多いサブグループほど大きな問題ではないことが示唆された[図1(b)]。比較的高い照射量(>1.5 W/cm2)を用いた陽性研究が3件あったのに対し、高ミトコンドリア数陽性サブグループでは1件のみであった。
4.3.2. In vivoでの研究
図3(a)は、ミトコンドリア数の多い細胞で構成された組織におけるin vivoでの効果的または陽性の研究のプロットを示し、図3(b)は、ミトコンドリア数の多い細胞で構成された組織における非効果的または陰性の研究の対応するプロットを示す。ここで、この2つのプロットをin vitroの研究から得られた類似の2つのプロットと比較すると、違いが見られる。in vivoの場合、有効試験サブグループ[図3(a)]のフルエンス値は、無効試験サブグループ[図3(b)]のフルエンス値よりも高い。これは培養細胞を用いたin vitroの場合とは逆の結果である[図1(a)と1(b)を比較]。したがって、これらの観察結果は、in vivoでの失敗は投与量不足によるものであり、in vitroでの失敗は同様に投与量過多によるものである可能性を示唆する傾向がある。in vivoでは組織の深さが重要であるが、in vitro培養では細胞は一般に単層である。ミトコンドリアの数が多い組織(脳、心臓、筋肉、炎症細胞)は、ミトコンドリアの数が少ない組織(皮膚、腱、軟骨)よりも体内の深部に存在する傾向があることは事実である。もちろん、ミトコンドリアの数が少なくても体の奥深くにある例外(骨や骨髄)もある。
図4(a)はミトコンドリアの数が少ない組織での有効な治療のプロットを示し、図4(b)はミトコンドリアの数が少ない組織での無効な治療のプロットを示している。
次のような観察ができる:
陽性の研究で用いられたフルエンス値は、特に組織が深い場合(骨など)、陰性の研究で用いられたフルエンス値よりもはるかに高い。さらに、表在組織(創傷治癒)の治療に1J/cm2未満の非常に低いフルエンスを使用し、良好な結果を得た研究もある。
否定的な研究で使用されたフルエンスは一般的に10J/cm2未満で、そのほとんどは低照度であった。より低いフルエンスと高い放射照度を併用し、良好な結果を得た研究が3つある。
このことは、ミトコンドリアの少ない組織に対して効果のない研究は、過剰照射よりもむしろ過小照射による可能性が高いことを示唆している。フルエンスと放射照度の両方が、in vivo研究の成功を決定する上で重要である。
5. 結論
この解析の限界は、除外基準に合格した研究の数が比較的少なかったことである。それにもかかわらず、この分析からいくつかの暫定的な結論を導き出すことができた。それは、今後数年間、より多くの十分に立証された研究が発表され続ける中で、少なくとも他の研究者が確認したり反論したりするために提案できるものである。
- 1.ミトコンドリアの数が多い細胞は、少ない細胞よりもPBMによく反応する
- 2.ミトコンドリアの数が多い細胞で効果のない研究は、過剰投与によるものである可能性が、過小投与によるものである可能性と同じくらい高い
- 3.ミトコンドリア数の少ない細胞での効果的でない研究が、過剰投与によるものである可能性は低い
- 4.in vitro研究の成否を決定する上で、照射されるフルエンスは採用される放射照度よりも重要である
- 5.ミトコンドリア数の多い組織は、ミトコンドリア数の少ない組織よりも体内の深部に存在する傾向があるため、過剰投与の可能性は低い
- 6.ミトコンドリアの数に関係なく、in vivoでの効果的でない研究は、投与量不足が原因である可能性が高い
謝辞
M.R.H.は米国NIHグラント番号R01AI050875およびR21AI121700の支援を受けた。

