コンテンツ
Pathogenesis of Coronaviruses Through Human Monocytes and Tissue Macrophages
pubmed.ncbi.nlm.nih.gov/34297627/
2021年7月23日
概要
コロナウイルス(CoV)は、上気道感染症をはじめとする呼吸器系疾患の原因となっている。ここ数十年の間に新たなコロナウイルスが出現したことで、これらのウイルスに関連する潜在的な感染、疾病、死亡率が浮き彫りになっている。この文献では、ヒトの単球やマクロファージを介したウイルスの発病メカニズムを探ってみたい。一般的な株も取り上げるが、本レビューでは、パンデミックの原因となっているコロナウイルス、すなわち重症急性呼吸器症候群コロナウイルス(SARS-CoV)-1および-2,中東呼吸器症候群コロナウイルス(MERS-CoV)を中心に取り上げる。マクロファージは、免疫系の重要な役割を担っており、致死的なコロナウイルスの発症にも関与していることがわかっている。生理学的には、細胞の破片や異物、微生物などを取り込み、消化する白血球である。自然免疫において重要な役割を果たし、適応免疫の開始を助ける。ヒトコロナウイルスは、マクロファージや単球との相互作用を通じて、自然免疫反応を弱める様々なメカニズムを利用している。コロナウイルスは、DPP4(ジペプチジル・ペプチダーゼ4)受容体や抗体依存性増強を介して免疫細胞に侵入し、初期のインターフェロン反応を遅らせてウイルスの強固な複製を支えている。病因としては、圧倒的な炎症性サイトカインの産生を誘発し、他の免疫細胞を感染部位に引き寄せ、炎症性反応を長期に渡って伝播させることが挙げられる。また、このウイルスは、IL-10などの抗炎症メディエーターの放出を抑制し、異常な炎症反応を引き起こすことがわかっている。血清サイトカインの上昇は、凝固障害、急性肺障害、多臓器不全などの重篤な疾患に見られる病理学的特徴にも寄与していると考えられる。
はじめに
コロナウイルス(CoV)は、一本鎖のポジティブセンシティブなRNAをゲノムに持つエンベロープ型ウイルスである。現在確認されている7種類のコロナウイルスはすべてコウモリなどの動物を起源とし、呼吸器系の疾患を引き起こす(102)。ほとんどのウイルスは、風邪などの軽い病気を引き起こし、年間の呼吸器感染症の15〜30%を占めている。しかし、重症急性呼吸器症候群コロナウイルス(SARS-CoV)-1,中東呼吸器症候群コロナウイルス(MERS-CoV)そして現在パンデミック中のSARS-CoV-2のように、より重篤な疾患を引き起こす可能性のあるものもある。これらは人獣共通感染症であり、高病原性コロナウイルスであるため、地域的、世界的な大パンデミックを引き起こしている。
ヒトのコロナウイルス感染症は、一般的には発熱、倦怠感、咳などの症状を伴う上気道感染症で、一部の患者は下気道感染症を発症することもある。一方、SARS-CoV-1,MERS-CoV、SARS-CoV-2は、初期段階では無症状のまま、重度の肺炎、呼吸不全、敗血症などを発症し、死に至ることもある。SARS-CoV-1の致死率は約9.5%、MERS-CoVは約34.4%、SARS-CoV-2は約2.5%と言われている。50歳以上の高齢者や免疫不全患者など、特定の危険因子を持つ人は、致死率がはるかに高くなるとされている(76)。
マクロファージは、病原体に対する宿主の防御に重要な役割を果たす細胞であり、人体のあらゆる組織に豊富に存在している。したがって、ヒトコロナウイルスの病態に関する最新の文献を、ヒト単球およびマクロファージを介したウイルスの発病メカニズムに焦点を当ててレビューすることが重要である。これらのウイルスは自然免疫反応を変化させることがわかっており、このことは病気の予後や治療介入の可能性に大きな影響を与える。この総説では、SARS-CoV-1,MERS-CoV、SARS-CoV-2といった死亡率の高いヒトコロナウイルスについて、その臨床的な影響を考慮しながら、より深く掘り下げていく。
単球とマクロファージ
単球は、自然免疫系の重要な細胞であり、単球と他の2つの主要なサブタイプ、すなわち樹状細胞とマクロファージからなる単核食細胞系の一員である。単球は、骨髄の血液前駆体から血液循環に入り、そこから全身の組織に集められる。これらの単球は、組織内で単球由来のマクロファージに成熟することができる(49)。組織マクロファージに関する現在の理解では、多くの組織常駐マクロファージは、胎児の前駆細胞から発生した自己再生集団であり、健康な環境下では循環する成人単球からの入力は最小限で済むことがわかっている(55,94)。
マクロファージの主な機能には、抗原提示、貪食、サイトカイン(炎症促進および/または抗炎症メディエーター)の放出などがある。微小環境に応じて、いくつかの要因が単球の分極を促進する。具体的な刺激としては、サイトカイン、成長因子、プロスタグランジン、病原体由来の分子などがある(5)。単球の表現型は幅広い活性化状態を示し、その中には古典的なM1(古典的にはインターフェロン[IFN]-γ活性化)とM2(代替的にはIL-4活性化)の分極状態が含まれる(56,84)。M1偏極マクロファージは、高いレベルの食細胞活性と炎症性サイトカインおよびケモカインの分泌を特徴としており、Th1活性化を誘導し、補体を介した食作用およびI型炎症を促進する。また、M1極性マクロファージは、治癒の初期段階で微生物やマトリックスデブリの貪食を行い、高い抗原提示能力を持つ。M2マクロファージは、腫瘍関連マクロファージ、治癒マクロファージ、慢性炎症状態に見られるマクロファージなど、幅広いマクロファージのサブタイプを構成しており、そのため、発がんや炎症依存性疾患(神経変性疾患など)において重要な役割を果たしている(5,6)。M2極性マクロファージは、抗炎症メディエーターを産生することでTh2応答を調節し、好中球、単球、Tリンパ球のリクルートを引き起こす。M2極性マクロファージは、高いエンドサイト性を持ち、修復機構、恒常性、代謝プロセス、病因など、さまざまな機能に関与している。
マクロファージは高い可塑性を持っている。マクロファージは、環境条件の変化に応じて、その極性をM1からM2へ、あるいはその逆へと変化させることが、いくつかの研究で示されている(6,66)。呼吸器疾患においては、肺胞マクロファージ(AM)は、肺の恒常性を守る重要な存在であり、炎症の抑制や組織の修復に重要な役割を果たしている(46)。C型レクチン受容体やToll様受容体などのパターン認識受容体による損傷や病原体関連の分子パターンの認識により、病原体や損傷の産物の存在を認識し、炎症性サイトカイン(IFN-γやTNF-α)を放出して、マクロファージの表現型をM1極性へと移行させる(70)。病原体の認識による保護は、T細胞への抗原提示の促進によって補完される(4)。マクロファージの枯渇に対応して、末梢血単球は肺に集められ、微小環境によってM1極性肺胞マクロファージへの分化が促進される(57,71)。炎症が制御されると、正常な組織構造を回復するために組織修復が行われなければならない。M2極性肺胞マクロファージは、IL-10やTGF-βなどの抗炎症性サイトカインを放出し、制御性T細胞の反応を促進することで、組織の修復を指揮するのに不可欠である(4,38)。
現在、急性肺損傷(ALI)の病因には、常駐する肺胞マクロファージと血液中からリクルートされたマクロファージが重要な因子であることを示唆する証拠が次々と見つかっている(26,51,68)。ALIは、著しい低酸素血症、両側性のびまん性肺浸潤、肺コンプライアンスの低下、および機能的残存能力の低下によって分類される。病理学的変化としては、肺胞-毛細血管膜機能不全による血管伝染性の亢進、肺胞出血、フィブリン沈着などが挙げられる(99)。病態生理学的には、肺傷害に対する過剰な炎症反応が関与している。蓄積した好中球は、細胞傷害性および炎症性メディエーターを過剰に放出し、肺胞マクロファージsの枯渇は炎症の制御を低下させる(44)。ALIの特徴である肺胞低酸素症は、血管伝染性の増加、活性酸素種の発生、白血球-血管間相互作用などの微小血管合併症と関連している。その原因は、低酸素状態の肺胞マクロファージから単球化学誘引蛋白質1(MCP1)やケモカインリガンド2(CCL2)が血中に放出されるためである。MCP1/CCL2は、血管周囲のマスト細胞の脱顆粒を誘発し、微小血管の炎症カスケードを開始するとともに、単球のさらなる動員を促す(12,13,15,34)。
ヒトコロナウイルス
CoVサブファミリーは、遺伝子型および血清学的に、α、β、γ、δコロナウイルスの4つの属に分類されている。βコロナウイルスは、さらにA、B、C、Dの4つのウイルス系統に分類されている。ヒトのCoV感染症(hCoV)は、α-およびβ-CoVによって引き起こされる(36)。一般的な病原性コロナウイルスを表1にまとめた。
表1 ヒトコロナウイルス間の潜伏期間,共通感染者数,致死率,標的細胞と受容体,症状,病理学的血液学的所見の比較
| 歪み | HCoV 229E | HCoV OC43 | SARS-CoV-1 | MERS-CoV | SARS-CoV-2 |
|---|---|---|---|---|---|
| 属 | アルファコロナウイルス | ベータコロナウイルス、系統A | ベータコロナウイルス、系統B | ベータコロナウイルス、系統C | ベータコロナウイルス、系統B |
| 潜伏期間 | 2〜5日 | 2〜5日 | 2〜11日 | 2〜13日 | 2〜14日 |
| 影響を受ける一般的な人口 | 子供達 | 子供達 | 若い健康な個人 | 50歳以上の人 | なし |
| 致死率 | 穏やかで自己制限的 | 穏やかで自己制限的 | 9.5% | 34.4% | 2.5% |
| 侵入のための細胞受容体標的 | APN TMPRSS |
9-O-アセチル化シアル酸 | ACE2受容体 TMPRSS |
DPP4 | ACE2受容体 CD147受容体 TMPRSS DPP4 |
| 主要な標的細胞 | II型肺胞細胞 樹状細胞 |
II型肺胞細胞 神経細胞 |
II型肺胞細胞 免疫細胞 |
免疫細胞(T細胞、樹状細胞) 上皮細胞(肺胞、腎臓、肝臓、小腸など) |
II型肺胞細胞 免疫細胞 |
| 一般的な 症状 |
倦怠感 発熱 呼吸器症状 あまり一般的ではないが、消化器症状 |
倦怠感 発熱 呼吸器症状 あまり一般的ではないが、消化器症状、脳炎 |
前駆期:筋肉痛、悪寒、発熱に 続いて呼吸器および胃腸の症状 約20%が悪化し、呼吸不全を発症します |
筋肉痛、悪寒、発熱 呼吸器症状および胃腸症状 急性腎不全 |
筋肉痛、悪寒、発熱 無嗅覚症、味覚消失に 続いて呼吸器および胃腸の症状 |
| 一般的な病理学的所見 | リンパ球減少症 | リンパ球減少症 | リンパ球 減少 症血小板減少症白血球減少症 肝酵素の上昇 |
リンパ球 減少症血小板減少症 貧血 白血球増加症 好中球増加症 クレアチニン 低アルブミン血症 |
リンパ球減少症 、血小板減少症 白血球増加 好中球 を上げるD -ダイマー 低アルブミン血症 歪ん血管分布 |
| 参考文献 | (3、88) | (45、88) | (14、37、88) | (3、37、73、77、87、88) | (1、14、59、77、88、95) |
ACE2はアンジオテンシン変換酵素2,2APNはアミノペプチダーゼN、DPP4はジペプチジルペプチダーゼ4,MERS-CoVは中東呼吸器症候群コロナウイルス、SARS-CoVは重症急性呼吸器症候群コロナウイルス。
コロナウイルスは、その膜にあるスパイク状のタンパク質が王冠のような特徴的な外観を持つことから、その名が付けられた。ウイルスの構造は、ゲノムRNAとリン酸化されたヌクレオカプシド(N)タンパク質からなるヌクレオカプシドがリン脂質二重膜に包まれ、その上に、すべてのCoVに存在するスパイク糖タンパク質トリマー(S)と、β型コロナウイルスの一部にのみ存在するヘマグルチン・エステラーゼという2種類のスパイクタンパク質が散在している。膜(M)タンパク質とエンベロープ(E)タンパク質は、ウイルスのエンベロープ内のSタンパク質の中に位置する(28)。Sタンパク質は宿主細胞の受容体へのウイルスの接着に重要な役割を果たしており、Eタンパク質はSARS-CoV-1の病原性を促進することがわかっている(74)。
ヒトコロナウイルスの病原性
抗体依存的増強によるコロナウイルスの単球およびマクロファージへの侵入
ヒトコロナウイルスでは、Sタンパク質とその受容体との相互作用を介して、ウイルス粒子が宿主細胞に最初に付着する。Sタンパク質と受容体の相互作用は、コロナウイルスがある種の宿主に感染するための主要な決定要因であり、ウイルスの組織特異性をも支配している。多くのα-コロナウイルスはアミノペプチダーゼNを受容体として利用し、SARS-CoV-1とSARS-CoV-2はアンジオテンシン変換酵素2(ACE2)を受容体として利用し、MERS-CoVはジペプチジルペプチダーゼ4(DPP4)と結合してヒトの細胞に侵入することが表1にまとめられている。
しかし、免疫細胞への侵入方法は、抗体に依存していると考えられる。末梢の単球や組織のマクロファージには、SARSウイルスの侵入に必要なACE2受容体が存在しないが(89)、DPP4受容体はこれらの細胞に見られる(2,79)。SARS-CoV-1のマクロファージへの侵入メカニズムは、抗体依存性の増強によるもので、特に抗スパイクタンパク質抗体と、免疫細胞上のFcγRII(CD32)受容体や補体受容体との相互作用が重要である(50,96,98,104)。抗スパイクタンパク質抗体は、ウイルスと免疫複合体を形成し、Fc受容体や補体受容体への付着を仲介することで、単球やマクロファージへのウイルスの侵入を可能にする。
現在、SARS-CoV-1は単球やマクロファージに感染しても増殖しないが、MERS-CoVはこれらの細胞に感染して増殖する能力が高いことが文献で裏付けられている(50,60,92)。SARS患者の血液サンプル中の単球とリンパ球の両方でウイルス粒子とゲノム配列が確認されたことから、SARS-CoV-1は両方の細胞タイプに感染する能力があることが示唆された。循環血液中のリンパ球の約50%(大部分はT細胞)と単球の30%がSARS-CoV-1に感染していた(37)。HCoV 229Eも同様に、単球に効率的に感染し、アポトーシスを誘導し、高力価の感染性ウイルスを放出することがわかったが、OC43は単球への感染力が弱く、アポトーシスの増加を誘導できなかった(103)。単球やマクロファージに感染する能力は、hCoVが宿主の自然免疫を回避し、組織的に拡散するメカニズムとなりうる(63)。
抗スパイクタンパク質抗体はマクロファージの偏りを歪める
最近、中国のアカゲザルを用いて行われた研究では、SARS-CoV-1の場合、ウイルス除去前にS-IgGが存在すると、創傷治癒反応が抑制され、MCP1やIL-8の産生、炎症性の単球・マクロファージの動員と蓄積が促進されることが明らかになった(62)。この研究では、死亡したSARS患者も同様に肺に炎症性細胞が蓄積し、創傷治癒マクロファージが不足していることも明らかになった。また、彼らの血清は、SARS-CoVによって誘発されたヒトM2極性マクロファージによるMCP1およびIL-8の産生を増強した(62)。M1極性マクロファージへの影響はほとんど見られなかった。他の研究でも、抗S特異抗体が様々な動物モデルにおいて病原性を持つことが示唆されている。複数のCoVワクチンは、免疫動物へのチャレンジ時に好酸球性の炎症性肺反応の増加と関連していた(8,40,47)。
また、別の研究では、SARS-CoV-1患者の抗スパイクタンパク質抗体レベルと疾病転帰の間に時間的な関係があることを発見した。死亡したSARS患者の抗体活性は、発症後15日間は回復した患者に比べて高く、急速に発達していたが、その後の感染期間中に急速に低下した。これらの死亡したSARS患者には重度の炎症が見られ、炎症を引き起こすサイトカインのレベルが著しく高かった(106)。このことは、ウイルス除去前のS-IgG反応が抗炎症反応を低下させるという先の発見と一致している。
スパイクタンパク質によるB細胞のマクロファージ様細胞への表現型変換の誘導
B細胞の炎症型マクロファージへの転換は、転写因子CCAAT-エンハンサー結合タンパク質(C/EBP)を異所性に発現させることで、高効率で機能的なマクロファージへの転換を容易に誘導することができ、内因性のC/EBPαおよびβの活性化によってさらに増強することができる(9,20,25,100)。
あるマウスの研究では、B細胞のマクロファージ様細胞への変換は、病態生理学的な反応と同様に、ウイルスのリガンド、特にSARS-CoV-1のスパイクタンパク質によって媒介される可能性があると結論づけている(17)。また、SARS患者の罹患した肺でしばしば観察される局所的な重度の低酸素状態も、この現象を促進する(17)。この研究では、導入されたB細胞の一部が、活性化された単球/マクロファージ特異的なマーカーであるMac-1,CD19,CD68を発現し、形態的には単球/マクロファージに類似し、拡大した馬蹄形の核を持つようになることがわかった(17)。このことは、CoV患者の肺にマクロファージが大量に蓄積し、ウイルス感染後短時間で患者の骨髄から供給される単球の量を超える傾向があることの一因となっている可能性がある(17)。
インターフェロン応答の遅延
マクロファージは、タイプI IFNやその他の炎症性サイトカインを強力に産生し、抗ウイルス作用を誘導する。IFNは、PKRやRNaseLを含むいくつかの明確な抗ウイルスエフェクターをアップレギュレートすることにより、ウイルスの複製を制限する直接的な抗ウイルス作用を媒介する一方で、IFN誘導性遺伝子の広範な誘導を通じて自然免疫応答および適応免疫応答の他の側面を調節する(31)。
SARS-CoV-1やMERS-CoVに感染したマクロファージは、IFNやその他の炎症性サイトカインのレベルが遅延しながらも上昇している(11,54,91)。これらのサイトカインやケモカインの産生が遅れる一方で過剰になることで、CoV感染に対する自然免疫応答の調節不全が引き起こされると考えられている。このような知見は、マウスモデルでも一貫して得られている(10)。いくつかのCoVタンパク質がIFN反応の拮抗に関与している。非構造タンパク質(NSP)は、NSP1やパパイン様プロテアーゼなどのIFN経路に拮抗する(43,91)。SARS-CoV-1のNSP7とNSP15は、ともにIFNアンタゴニストとして同定されている(32)。SARSやMERS CoVのNタンパク質のような構造タンパク質は、IFNタイプをブロックする能力があり(64)、膜(M)タンパク質はIFN-βの転写をブロックする(11,22,86)。しかし、hCoV HKU1はMタンパク質も保有しているが、IFN反応を抑制する能力は持っておらず、この能力はすべてのCoV株で保存されているわけではないことが示唆された(85)。この研究は、SARS-CoVに感染したマクロファージではIFN-βの誘導がほとんどないという知見と一致する(16)。
hCoVのもう一つの病原性の特徴として、dsRNAセンサーの阻害が挙げられる。マクロファージは、ウイルスの感染を検出し、生得的な抗ウイルス反応を増幅するための複数のdsRNAセンサーを持っている。コロナウイルスはポジティブセンスRNAウイルスであるため、複製中にdsRNA中間体を生成する。これらのdsRNAセンサーが活性化されると、IFNが早期に誘導され、マクロファージのアポトーシスが急速に進行し、その結果、防御的な免疫反応が起こる。しかし、MERS CoVのように、dsRNAセンサーを活性化せずにマクロファージに感染して増殖するhCoVも存在する(83)。NSP4a、NSP4b、NSP15は、dsRNAセンサーを阻害することがわかっているいくつかのコード化されたタンパク質である(23,54,83)。hCoVは感染後ごく早期に高力価に達し(19,75,90)、IFN反応を遅延させる複数のタンパク質を産生することがわかっている。このことは、IFN反応の早期の拮抗が、hCoVが自然免疫反応を遅延または回避するのに役立っている可能性を示唆している-この初期の高ウイルス量は、SARSのより重篤な予後とも関連している(19)。
SARS-CoV-2は、感染した単球由来の樹状細胞(moDC)やマクロファージ(MDM)からのI型IFN反応は限られているか、全く活性化しないが、MDMでは炎症性サイトカインの発現が顕著であることがわかっている(7,101)。MoDCでは、STAT1のリン酸化を阻害することで、抗ウイルスIFNと炎症反応が抑制された。SARS-CoV-1でも同様の現象が見られたが(7,42,72)、SARS-CoV-2ではより強い阻害作用が見られた(101)。
サイトカイン・ストーム
hCoV患者では、サイトカインやケモカインが上昇しているという病理学的所見がよく知られている。炎症性サイトカイン(IFN-γ、IL-1,IL-6,IL-12,MCP1,TGF-β)とケモカイン(CCL2,CXCL10,CXCL9,IL-8)の高い血清レベルが、重症のSARS-CoV-1患者では、合併症のないSARS患者と比較して見られた(11,91)。MERS-CoVやSARS-CoV-2でも同様のことが見られる(65,82)。逆に、重症の患者は、抗炎症性サイトカインのレベルが非常に低かった。IL-10,MCP1,CXCL10は、単球/マクロファージ、T細胞、急性炎症細胞を傷害部位に強く化学的に引き寄せることで注目されている。SARSやMERSの患者の肺組織を病理組織学的に調べると、好中球やマクロファージが多く見られ、このことを裏付けている(14,88)。新規のSARS-CoV-2もまた、サイトカインストームと関連している(97)。最近のSARS-CoV-2の研究では、NLRP3インフラマソームの活性化を利用した感染単球のパイロトーシス現象が明らかにされており、溶解性単球死による炎症性サイトカインの放出に寄与している(29,80)。また、単球関連のケモカインであるCCL2とCCL8,さらに好中球の走化性因子として機能するCXCL2とCXCL8の有意な上昇が観察されており(7)、重症のSARS-CoV-2患者で好中球のレベルが上昇したという臨床データと一致している(58)。
サイトカインストームは、上皮細胞や内皮細胞の損傷に始まり、血管漏れや血栓形成を促進し、播種性血管内凝固症候群(DIC)や長期の凝固障害へと進展するなど、複雑な一連の事象を引き起こす可能性がある(27,35)。また、マクロファージ活性化症候群が起こり、赤血球貪食症や貧血を引き起こすこともある(35)。前述の病態が重なると、多臓器不全を引き起こす可能性がある。図1は、SARS-CoV-2の致死的な病態の重要な側面をまとめたものである。
図1. SARS-CoV-2が単球/マクロファージに感染し、異常な炎症反応を引き起こす様子を示した図
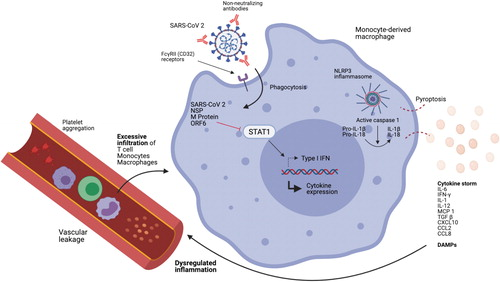
ウイルスはADEを介して単球・マクロファージに侵入する。ウイルスのNSPとMタンパク質は、STAT1の核転位を阻害する能力があり、I型IFN反応を遅らせ、ウイルスの複製を強固にする一方で、他のサイトカインの発現(すなわち、CXCL10,CXCL5,TNF-α、IL-6,CCL2)が上昇する。感染した単球・マクロファージでは、NLRP3インフラマソームが活性化され、溶解細胞が死滅するとともに、過剰な炎症性サイトカインやD肺胞マクロファージPsが放出される。これらの走化性物質が炎症細胞や血小板を引き寄せ、SARS患者に見られる炎症細胞の過剰な凝集や凝固障害を引き起こす。ADE(antibody-dependent enhancement)CCL2(chemokine ligand 2)D肺胞マクロファージP(d肺胞マクロファージage-associated molecular pattern)IFN(interferon)NSP(nonstructural proteins)SARS-CoV(severe acute respiratory syndrome coronavirus)。
考察
ヒトコロナウイルスは、マクロファージや単球との相互作用を介して自然免疫反応を弱める多くのメカニズムを利用している。このウイルスは、免疫細胞に侵入してIFNの反応を遅らせ、それによってウイルスの強固な複製を支えることができる。また、ウイルスは圧倒的な炎症性サイトカインの産生を誘発し、その一部は好中球や単球などの他の免疫細胞を引き寄せ、正のフィードバックループを形成して、異常な炎症反応を引き起こす。血清サイトカインの上昇は、DIC、ALI、多臓器不全などの重篤な疾患に見られる病理学的特徴にも寄与している。
単球やマクロファージとSARS-CoV-2との相互作用を調べたレビューがいくつかあり、このウイルスは科学界で大きな注目を集めている(48,69)。さらに、自然免疫反応が一体となって、ウイルスにどのように反応するかを調べたレビューもある(93)。新型のSARS-CoV-2や以前の株の病原性を理解することは、現在のパンデミックに対する治療的介入の可能性を示唆するものである。SARS-CoV-2患者では、クロロキンやヒドロキシクロロキンなどの実験薬が注目されている。クロロキンはエンドソームのpHを上昇させることがわかっており、ウイルスの侵入に必要なウイルススパイクタンパク質の切断に不可欠な酵素であるカテプシンLを阻害することで、ウイルス感染を制限できる可能性があるからである(24)。MERS CoV患者では、クロロキンが試験管内試験で複製を阻害することが示されている(21)。クロロキンのCoVに対する作用に加えて、クロロキンがグルココルチコイド受容体を安定化させることにより、グルココルチコイドのシグナル伝達との相乗効果を示す証拠がある(39)。グルココルチコイドは重症のSARS患者に推奨される治療法の1つであるため、クロロキンをCOVID-19の治療にグルココルチコイドと併用する可能性があり、そのような併用療法の有効性を判断するための試験が必要である。
グルココルチコイド療法は、SARS-CoV-1やMERS-CoVのパンデミック時に主に使用され、現在ではSARS-CoV-2の免疫調節療法の選択肢としてよく使われている。特に、デキサメタゾンは、SARS-CoV-2において抗炎症作用が検討されている。しかし、副腎皮質ホルモンは免疫抑制作用があることが知られており、そのため、SARS-CoV-1患者に早期に投与するとウイルス量が増加し、病状が悪化することがわかっている(11)。また、高用量ステロイドパルス療法を受けたSARS-CoV-1患者では、骨壊死が副作用として観察された(107)。このことから、薬物療法のタイミング、投与量、投与期間は、患者と病気の管理に非常に重要であることがわかる。ステロイドの使用に関する最近のエビデンスには大きな期待が寄せられており(105)、今後もSARS-CoV-2患者の治療には欠かせない選択肢であると考えられる。
サイトカインストーム現象は、SARS患者の間でも注目されている分野である。SARS-CoV-2患者のインフラマソーム活性を調査した新しい研究では、ヒト単球におけるNLRP3インフラマソームの関与とパイロトーシスが示唆され、炎症性サイトカインの放出を悪化させることがわかった(29,80)。さらに、ロピナビル、リバビリン、アタザナビルの効果を比較した研究では、アタザナビルがウイルス抗原の初期のタンパク質分解処理を阻害することで、単球の溶解死を防ぐ可能性が示されている(29)。このことは、シトクロムP450 3A4アイソザイムを阻害し、プロテアーゼ阻害剤の代謝を阻害するリトナビルを低用量で投与し、アタザナビルを増量して検討する価値があることを示唆している(52)。アタザナビルと試験管内試験のVero細胞およびヒト肺上皮細胞を用いた初期の研究では、有望な結果が得られた。アタザナビルは、SARS-CoV-2の複製を阻害し、感染した単球におけるIL-6とTNF-αのウイルス誘発性の増強を抑制することが判明し(30)、臨床試験に向けた別の薬剤の可能性を示唆している。しかし、ロピナビルは、試験管内試験での有効性と前臨床試験の結果から、同様に臨床試験を提案されていたが、臨床試験では患者の臨床的改善が見られなかったことが重要な制限となっている(41)。しかし、アタザナビルは、肺組織でのバイオアベイラビリティーが高く、組織親和性も高いことが示されている(33)。
IL-6受容体拮抗薬であるトシリズマブは、様々な国で臨床試験が行われており、免疫病理や疾患の重症度に関連する炎症性のIL-6の過剰な上昇を管理し、患者に見られるサイトカインストーム症候群を抑制するための治療オプションとして期待されている(53,61)。IL-6は、病原体に対する自然免疫反応と適応免疫反応の統合に重要な役割を果たしていることから(18)、最近行われたSARS-CoV-2の前向きコホート研究(67)でも裏付けられているように、IL-6を阻害すると、かえってウイルスの排出が遅くなる可能性がある。慢性的な線維性疾患を促進するIL-6の役割と、急性疾患の段階でのIL-6の抑制が、SARS-CoV-2患者に見られる長期的な呼吸器障害を軽減できるかどうかは、今後の課題である(78)。重症のSARS-CoV-2による長期的な組織回復のための治療法はまだ検討されておらず、最近では生体材料が損傷した組織の再生に大きな可能性を示している(81)。
結論
コロナウイルスは、歴史的に多くの伝染病や現在のパンデミックの原因となってきた。この総説では、既存のコロナウイルスの病原性をめぐる既存の文献を整理し、単球やマクロファージを介して異常な免疫反応を引き起こすウイルスの能力についてまとめた。ウイルスは、免疫細胞に感染してその拡散を促進し、IFN反応を遅らせてウイルスの強力な複製を可能にし、サイトカインストームを引き起こして重篤な臨床症状を引き起こす能力がある。これは、現在のパンデミックに関連しており、患者の自然免疫反応がどのように歪んで様々な臨床症状を引き起こすかについての洞察を与えるとともに、新たな治療法を検討する機会を提供するものである。過去は未来を予測するのに適している。様々なコロナウイルス株を見ることで、このウイルスファミリーの病原性の類似性について貴重な洞察を得ることができ、将来の新しい株に備えることができる。
