コンテンツ
Pathogen Evolution During Vaccination Campaigns
投稿履歴
[v1] Tue, 28 Sep 2021 12:52:08 UTC (957 KB)
[v2] Mon, 31 Jan 2022 16:21:43 UTC (7,024 KB)
Troy Day1、David A. Kennedy2、Andrew F. Read2,3、Sylvain Gandon4
- 1. Department of Mathematics and Statistics, Department of Biology, Queen’s University, Kingston, K7L 3N6, Canada. day@queensu.ca
- 2. ペンシルバニア州立大学生物学部、ユニバーシティ・パーク、ペンシルバニア州16802、米国
- 3. ペンシルバニア州立大学昆虫学部、ユニバーシティパーク、ペンシルバニア州、16802、アメリカ
- 4. CEFE, CNRS, Univ Montpellier, Eイングランド公衆衛生サービス, IRD, Montpellier, France
SARS-CoV-2に対する前例のない世界的なワクチン接種キャンペーンにより、この大規模な介入がウイルスの進化に与える潜在的な影響に注目が集まっている。ここでは、SARS-CoV-2の将来の進化を視野に入れながら、他の病原体種の研究からワクチン接種に伴う進化について現在わかっていることをまとめる。
SARS-CoV-2のような新規病原体の進化の時間的ダイナミクスは、2つの段階を通過すると考えるのが有効である。第一段階では、宿主集団は免疫的にナイーブであり、淘汰はこの豊富なナイーブ宿主への適応を強く支持する。第二段階では、自然感染やワクチン接種によって病原体との免疫学的な付き合いがある集団の割合が増えるため、選択はこれらの宿主への適応にますます有利に働くように変化する。本稿では、主にワクチン接種に対する病原体の進化に焦点を当てるが、結論においては、自然感染によって獲得された免疫による進化の問題に立ち戻ることにする。
ナイーブおよびワクチン接種を受けた宿主に対する病原体の適応は、新しい変異株の出現と、それぞれの宿主タイプにおける適応度によって決まる。ある変異株による感染の一人当たりの絶対成長率と、現在優勢なタイプ(野生型と呼ばれることもある)の成長率に対する相対的な成長率の両方を考慮することで、適合度を定量化することができる。絶対成長率は変異株が集団内で広がるかどうかを決定し、相対成長率は変異株が頻度を増し、現在優勢な型を置き換える可能性があるかどうかを決定するものである。
変異株が集団の中で広がるには、その絶対成長率が正でなければならない(同等に、その再生産数が1より大きくなければならない)。
絶対成長率は次のように近似できる(Appendix 1)。
![]()
変異株が相対的に増加し、野生株を置き換えるためには、その成長率と野生株の成長率の差として定義される選択係数sが正でなければならない。上記のモデルでは、この選択係数は次式で与えられる。
![]()
はそれぞれ完全ナイーブ集団と完全ワクチン集団における変異株と野生型の成長率の差である。
これによって、変異株がワクチン接種済みあるいはナイーブな宿主集団に適応していることの正確な定義を与えることができる。もし∆ᵅ$ > 0ならば、変異株はワクチン接種された宿主の集団において野生型よりも適合している(すなわち、高い成長率を有する)ので、ワクチン接種された宿主集団に適応している(同等に、それはワクチン適応型である)と言うことができる。同様に、∆Ņ# > 0であれば、変異株はナイーブな宿主の集団において野生型よりも適応度が高い(すなわち、高い成長率を有する)ので、ナイーブな宿主集団に適応していると言う。したがって、発生の第一段階では、ワクチン接種を受けた宿主の割合ᵅが小さいとき、選択は∆ᵅ# > 0の変異株を強く支持し、第二段階では、ᵅが大きいとき、∆ᵅ$ > 0の変異株を強く支持することになる。感染宿主の内部には変異株をワクチン適応させる多くの分子的・細胞的メカニズムが存在するが(Box 1)、変異株が広がるかどうかは、これらのメカニズムが感染宿主の人口増加率に与える影響であることに注意されたい。
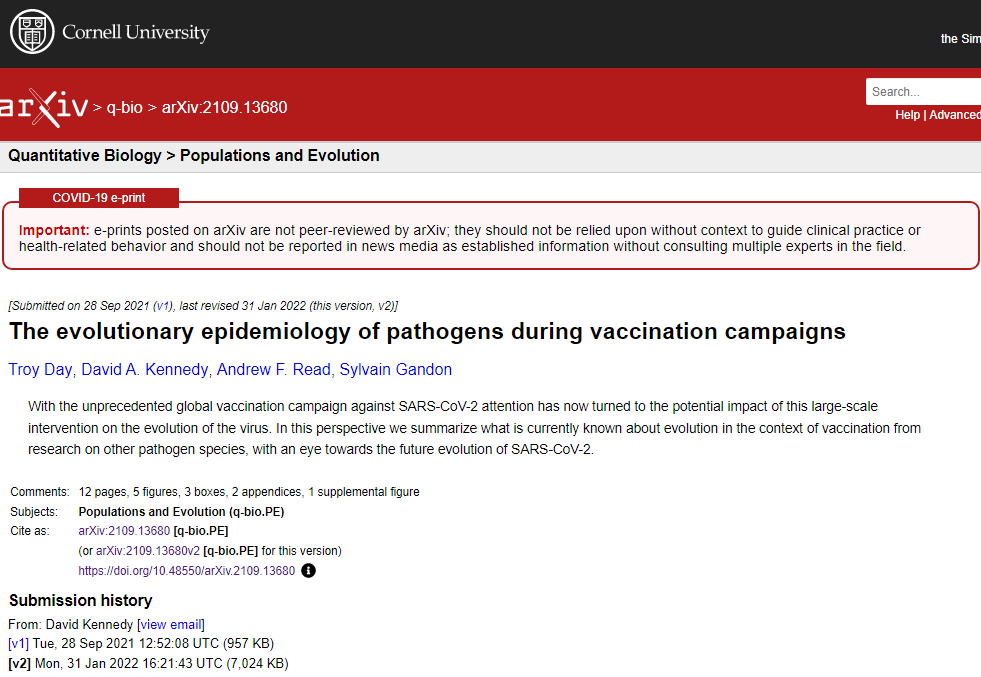
以上の考えから、ワクチン適応変異株を分類するのに有効な方法が2つある。まず、ワクチン適応型変異株がナイーブな宿主集団にも適応している場合(すなわち、∆ᑟ# > 0)、宿主の種類に関係なく野生型よりも拡散に優れていることから、「generalist」型と呼ぶことにする。逆に、ワクチン適応変異株がナイーブな宿主集団に不適応な場合(すなわち、∆Ņ<0),それはワクチン接種した宿主集団でのみ野生型よりも高い適応度を持つように特化されているので、「スペシャリスト」変異株と呼ぶことにする。この分類は、ワクチン適応変異株では、ジェネラリストはワクチン接種率に関係なく頻度が増加し野生型に取って代わるが、スペシャリストはワクチン接種率が臨界閾値以上でないと頻度が増加しないので、有用である(図1).
変異株を分類する第二の方法は、その変異株が引き起こす感染症の絶対増殖率が、ワクチン接種によって抑制されるのか促進されるのかを評価することである。ワクチン接種が抑制された変異株の絶対増殖率は、ワクチン接種率が高くなると減少し、ワクチン接種が促進された変異株の絶対増殖率は、ワクチン接種率が高くなると増加する(図1)。この分類は、ワクチン接種とその後のワクチンによる病原体の進化によって、最終的に感染の広がりが小さくなるか大きくなるかを物語っており、有用である。変異株の成長速度がワクチン接種によって抑制される場合、ワクチン接種率を上げると、たとえ変異株が最終的に野生型に取って代わったとしても、全体の感染拡大が常に減少する(図1a,c)。しかし、変異株の成長速度がワクチン接種によって促進される場合、ワクチン接種によって変異株が野生型に置き換わると、全体の感染拡大が増加する可能性がある(例えば、図1b)。
図1における変異株の分類は、一人当たりの成長率に基づいているため、このようなプロットは疫学的な状況に特有のものである。例えば、アウトブレイクの初期には通常、感染者数は指数関数的に増加するが、アウトブレイクが進行するにつれて、そして/または、非薬物介入 (NPI)が導入されると、感染力は最終的に低下し、すべての成長率Ņ!,#とᑟ!,$が減少する。最終的には、病原体が常在化すれば、すべての変異株の平均成長率はゼロとなる。しかし、図1の変異株の分類は相対的な成長率にのみ依存しているので、まったく同じ枠組みがどのような疫学的状況 (例えば、指数関数的な成長中の発生の初期段階や、病原体が蔓延した後の平衡状態)にも適用できることに注意されたい。さらに、変異株の相対的な順序が疫学的な状況によって変化しないのであれば、疫学的に何が起こっているかにかかわらず、4つのカテゴリーのいずれかに分類することで一貫性を保つことができる(付録1)。
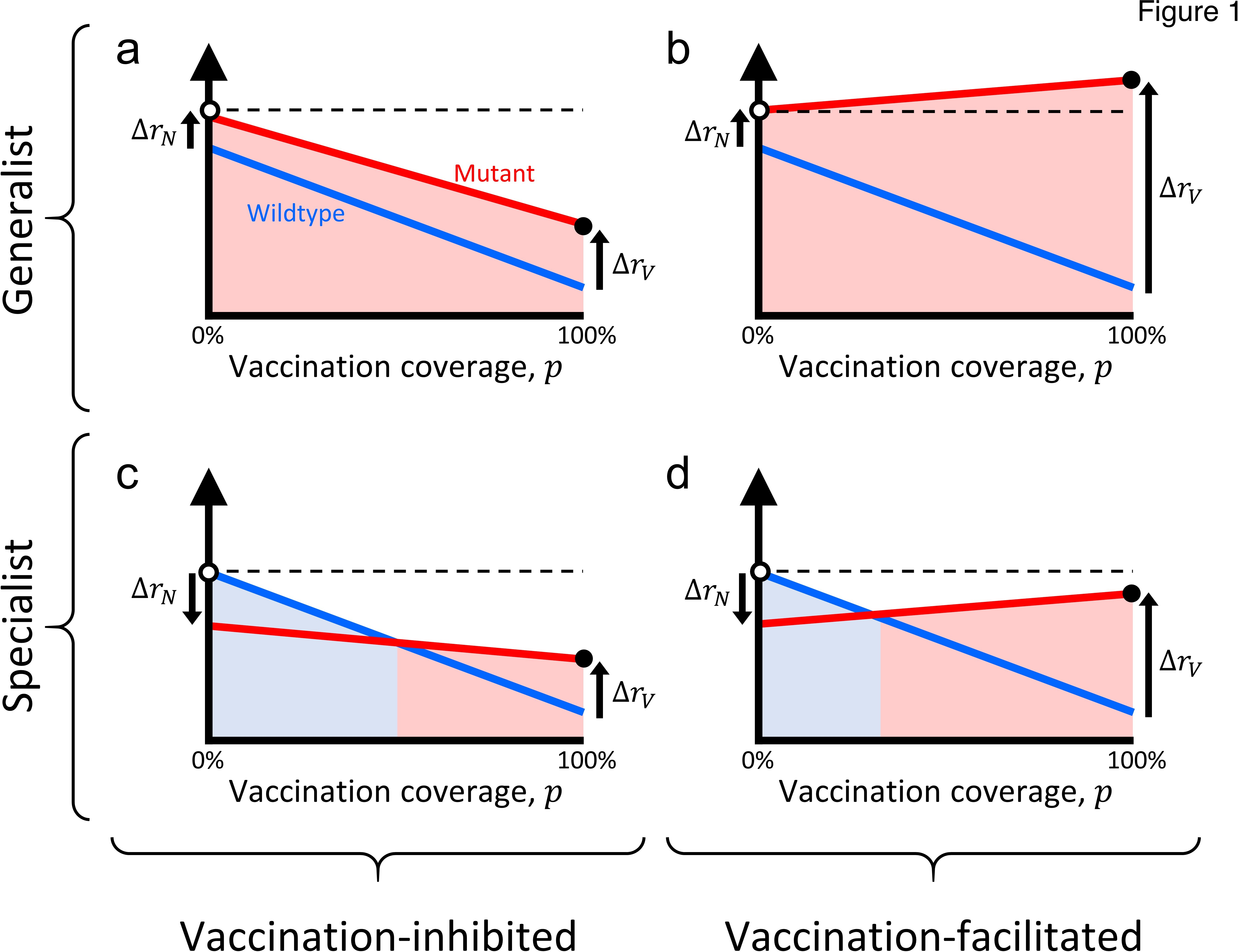
ワクチン接種キャンペーン中の進化的変化を概念化するために、図1の4つのタイプの変異株のそれぞれをプロットして、各宿主タイプにおけるさまざまな可能性のある変異株の絶対成長率をプロットすることができる(図2;変異株のプロットの別の方法については付録2に記載されている)。
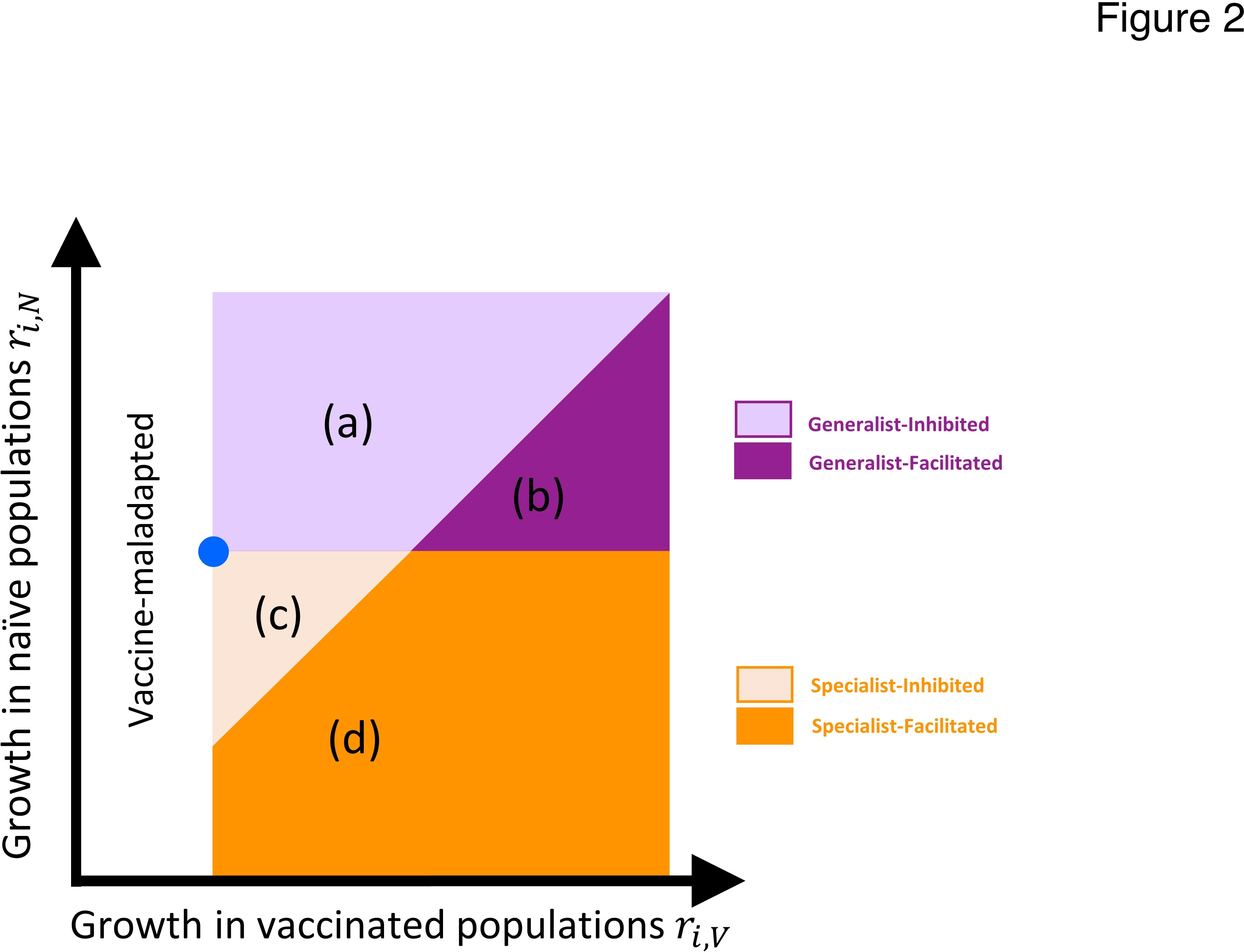
このようなプロットを使って、ワクチン接種キャンペーンが進むにつれて選択の性質がどのように変化するかを説明することもできる。第1段階では、ほとんどの宿主がナイーブである(すなわち、pが小さい)とき、選択は主としてナイーブな宿主でより大きな成長率を持つ変異株を好む(図3a)。しかし、第2段階(図3b)に移行すると、ワクチンを接種した宿主の割合が増加し(すなわち、pが増加し)、選択は主にワクチンを接種した宿主でより大きな成長率を持つ変異株を好むように移行する(図3c)。この移行期間中、出現する変異株はスペシャリストかジェネラリストか、またワクチン接種が抑制されたものか促進されたものかのいずれかになる。
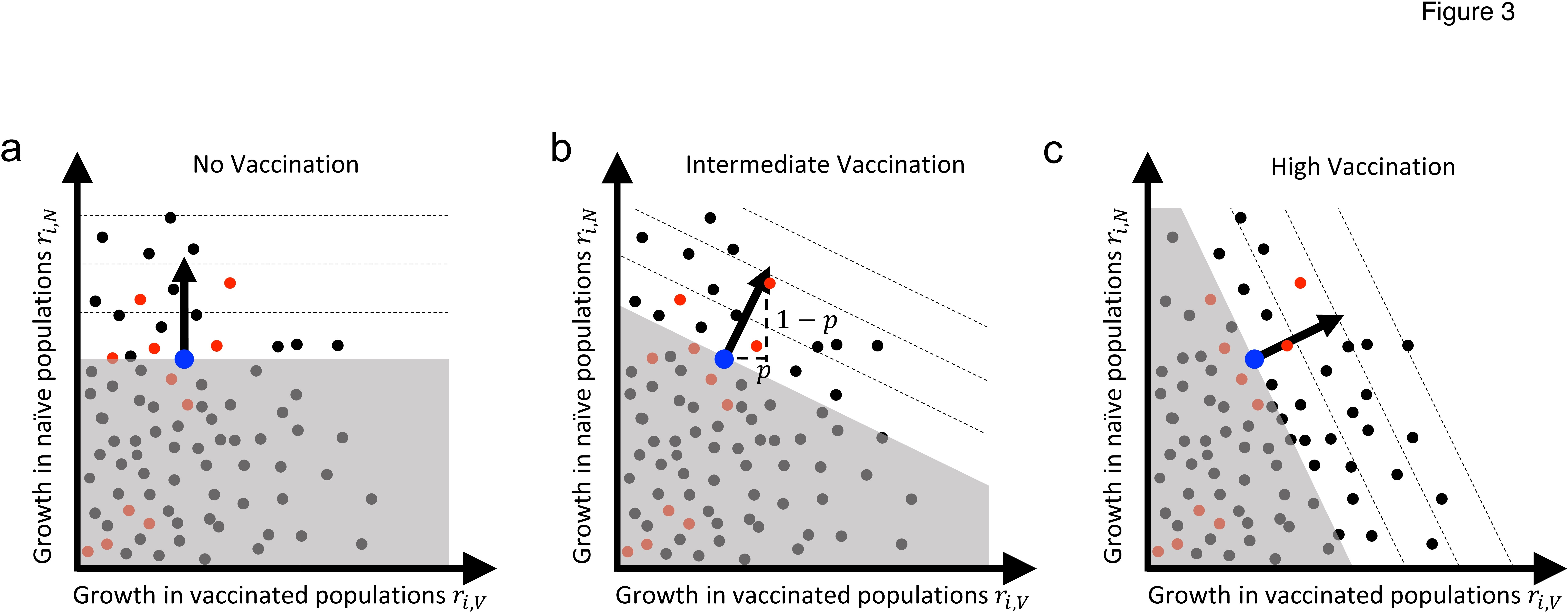
このような枠組みから、進化論は、ワクチン接種キャンペーン中に新規病原体の適応がどのように展開するかを予測することができる。病原体が適応していく過程で、新しい変異株が野生株を駆逐して新しい野生型になるような淘汰的な動きが時折起こるだろう。選択的スイープが起こる順序は、選択の方向(図3の矢印)と、たまたま現れた変異株(ボックス2)の両方によって決定される。SARS-COV-2のような新しい宿主-病原体の組み合わせでは、当初は通常、ナイーブな宿主にもワクチン接種を受けた宿主にも適応する余地が十分にあり、したがって、発生し支配的になる変異株の多くはジェネラリスト変異株となるだろう(図4a)。やがて、病原体が新規宿主への適応が進み、ワクチン接種率が上昇すると、両方の宿主の適応度を高めるような新しい変異株は少なくなり、さらなる適応のための変異源は主にスペシャリスト変異株となる(図4b)。このように、病原体が新しい宿主に適応していくにつれて、ワクチン接種への適応は、未熟な宿主への適応をある程度失っていく傾向がある。
変異株がワクチン接種を阻害するのか、それともワクチン接種を促進するのかについて予測することは、より困難である。ワクチン接種を促進する変異株は存在するのだろうかと思われるかもしれないが、次節で詳述するように、いくつかの感染症でそのような変異が記録されている。さらに、SARS-CoV-2でもそのような変異株が発生する可能性は想像に難くない。例えば、症状がある人は他人に感染させないように隔離したり、社会的に距離を置いたりすることが多い。もしワクチン接種によって病気の重症度が下がり、その結果、隔離や社会的距離を置く割合が減れば、感染力の点でワクチンによる免疫を回避する変異株が、完全にワクチン接種を受けた集団では完全にナイーブな集団よりも急速に広がる可能性がある(すなわち、ワクチン接種が促進されることになる)。この仮説的な例は、変異株をワクチン接種促進型と分類することは、単にその適応度(すなわち、拡散する能力)に関する記述であり、そのような変異株の拡散が、個々の感染において、あるいは集団全体において、最終的に病気の量を多くするか少なくするかについて、先験的に示唆するものではないことを強調するのに役立っている。
ワクチン接種に対する病原体の適応の例
ワクチン接種に対する適応の例を考える前に、多くのワクチンが病原体の適応によって損なわれていないことを強調することが重要である(天然痘、麻疹、ポリオなど)。この適応の欠如は、ワクチン接種に共通する2つの特徴に起因すると仮定されている[3]。第1に、ワクチン接種は予防的な介入であるため、ワクチン接種を受けた宿主内の病原体の数を少なく保つことができ、新規変異株の生成と伝播を制限することができる。第2に、ワクチンは通常、病原体の複数の標的に対して免疫反応を引き起こすため、ワクチンによる免疫を回避するためには、複数の遺伝的変化が必要になる可能性がある[4]。この2つの特徴は、変異株へのアクセスを妨げることにより、病原体がワクチン接種に適応する能力を制限することが予想される(図3、ボックス2の赤丸の数が少ない)。しかし、感染宿主の大部分で病原体密度を感染可能レベル以下に抑えられない、あるいは複数の標的に対する免疫を誘導できない一握りのワクチンについては、進化的適応が起こっている[3]。このことから、われわれは、SARS-CoV-2におけるワクチン接種への適応がもたらしうる結果について、これらの過去の例に指針を求める。
ワクチンが病原体の適応にどのように影響するかを判断する最も直接的な方法は、実験的な進化を通じて行うことであるが、このアプローチをとった研究は1件しかない。それは、実験用マウスにおけるマラリア寄生虫の新しい宿主-病原体間の関連性に関わるものである[5]。寄生虫は、ワクチン接種済みマウスと未投与マウスを20世代にわたって連続的に継代し、これらの異なる処理に対応して進化するようにされた。寄生虫は、進化している宿主のタイプで徐々に複製能力が向上したが、もう一方の宿主のタイプでも同様に複製速度が向上した。さらに、ワクチン接種は進化したすべての病原体の複製を阻害し、進化の過程で生じた変異株はワクチン接種を阻害するジェネラリストであることが示された。
その他のデータのほとんどは観察的なもので、宿主との関わりが長い病原体種に焦点を当てている。先に述べた考察から予想されるように、多くのワクチン適応型変異株は、野生型と比較してスペシャリスト型変異株であるようである。例えば、B型肝炎ウイルスのワクチン適応変異株は、表面抗原が変化しているため、ワクチンの効果が低くなっている[6]。これらの変異株は散発的なブレイクスルー感染を引き起こするが、ワクチン接種率が上昇しても、集団レベルでの全体数は増加していない [7,8]。このことは、ワクチン接種を受けた宿主内では野生型よりも適応度が高いが、ワクチン接種を受けた宿主からの伝播が抑制され、ワクチン接種が阻害された専門家であることが見て取れる。百日咳菌では、PRNを標的とした細胞ワクチンが、PRNを発現しないワクチン適応変異株の拡散を引き起こしている[9]。これらの変異株は、ワクチンを接種した宿主では野生型よりも適応度が高いようだが、ナイーブな宿主では適応度が低く、スペシャリスト変異株となる[10]。また、免疫抑制性のPTX分子を過剰発現する変異株も生じ、これらはナイーブおよび細胞ワクチン接種された宿主の両方で非過剰発現変異株より適応度が高いようである[30]。注目すべきは、全細胞ワクチン接種された宿主での適合度が測定されていないため、変異株をスペシャリストとジェネラリストに決定的に分類することができないことである。しかし、いずれの百日咳変異株も、ワクチン接種を受けた集団での拡散能力はナイーブな集団よりも低いようであり[10,11],これらはすべてワクチン接種が阻害された変異株であるといえる。
家畜に使用されるワクチンでも同様のパターンがしばしば発生するが、スペシャリスト変異株とジェネラリスト変異株を区別するために必要なデータは、しばしば決定的なものではない。例えば、鳥メタニューモウイルスのワクチン接種は七面鳥のウイルス排出を抑制するが、最近のウイルス分離株では過去の分離株よりも抑制効果が低く、ワクチンを接種していない七面鳥では分離株間の差は検出されなかった[12]。この違いは、2つの遺伝子におけるアミノ酸の分岐に起因するとされている[12]。同様に、魚類細菌病原体Yersinia ruckeriのワクチンに対するブレークスルーは、細菌鞭毛の喪失と関連している[13]。しかし、試験されたすべての変異株に対して、部分的なワクチン保護が持続しており [14]、これらの変異株はワクチン接種が阻害されていることが再び示唆されている。
顕著に異なる例として、ニワトリの病原体であるマレック病ウイルス (MDV)がある。MDVは、麻痺と高い死亡率を引き起こす発癌性ウイルスであり [15]、継続的なワクチン駆動型の進化に対応して、次々とワクチンが開発・配備されてきた [16]。分析されたワクチン適応変異株は、祖先のウイルスと比較して、ナイーブなニワトリでは不利なようだ[17]。とはいえ、上記の例とは異なり、MDVのワクチン適応変異株は、ナイーブなニワトリよりもワクチン接種したニワトリからよく感染する[17]。したがって、これらの変異株は、ワクチン接種によって促進されたスペシャリスト変異の例である。注目すべきは、この進化にもかかわらず、養鶏業における病気の全体的な有病率は、ワクチン接種によって減少したことである[18](図1dのように)。
ワクチン接種に反応して進化した他の例としては、複数の血清型が共存し、ワクチンがそれらの血清型の一部のみを標的としている宿主-病原体の関連付けがある。このような状況はより複雑で、血清型が共存していることから、複数の宿主型が存在し、おそらく異なる血清型による自然感染を通じて、異なる免疫学的履歴が生じたと考えられる。その結果、図2および図3の枠組みは、異なる種類の宿主に対応する軸を追加して拡張する必要がある。とはいえ、ワクチンの標的となる血清型群を「野生型」、標的とならない血清型群を「変異株」と見なすことで、これまでの例と類似性を持たせることができる。野生型と変異型の血清型が共存しているということは、予想通り、それらは専門の変異株であることを示唆している。ワクチン接種阻害型、ワクチン接種促進型と分類するのはより難しいが、われわれが知る限り、すべての例で、ワクチン展開後、感染総量が減少したか、横ばいになっている。例えば、肺炎球菌に対するワクチン接種では、ワクチン接種後に非標的血清型がワクチン標的血清型に完全に取って代わったため、細菌キャリッジの総有病率に変化がないことが多かった[19-21]。一方、ヒトパピローマウイルスでは、ワクチン接種により非標的血清型の有病率が変化せず、ワクチン標的血清型が少なくなったため、総感染者数が減少した[22]。百日咳菌[23]、インフルエンザ菌[24]、髄膜炎菌[25]、ロタウイルス[26]など、血清型が共存する他の例は、この両極端の中間に位置するように思われる。
ヒトインフルエンザウイルスは、抗原ドリフトと呼ばれる過程を経て、宿主の免疫に対応しながら絶えず進化し、長い時間をかけて多くのインフルエンザ変異株を順次生み出している[27]。抗原ドリフトに対応するため、インフルエンザワクチンは頻繁に更新されている。ここでも、新しいワクチンが導入されたり、新しい免疫学的なタイプの宿主が現れたりするたびに、図2や図3に新しい軸を導入することで、このことを概念化することができる。インフルエンザの変異株がジェネラリストとスペシャリストのどちらの傾向があるのかについて、決定的なデータは見つからなかった。いずれにせよ、既存のデータは、抗原ドリフトによって生じるほとんどの新規変異株は、ワクチン接種によって部分的に抑制されることを示唆している[28]。
したがって、ワクチン適応が観察された一握りのケースでは、スペシャリスト変異株が関与している。このことは、宿主と病原体の新しい関連がより確立されるにつれて、ジェネラリスト変異株は最終的にスペシャリスト変異株に取って代わられるというわれわれの理論的予想と一致する(図4)。さらに、これらの事例のほとんどは、ワクチン接種によって抑制されたスペシャリスト型である。その結果、ワクチン接種によって変異株が進化的に優位に立った場合でも、一般に感染拡大の全体的な抑制につながった。われわれは、ワクチン接種によって促進されたスペシャリスト変異株の例を同定しているが、これらの例でさえ、そのようなワクチンによる全体的な感染流行の増加が記録されたことはないようであることが注目される[29]。
私たちは、どのような感染症においても、ワクチン接種によって促進されたジェネラリストの変異株の例を知らない。そのような変異株は、ワクチンの接種率に関係なく広がるだろうし、その特定のワクチンを使って感染を制御する能力も必然的に損なわれるだろう(図1c)。このような変異株がないように見えるのは、このカテゴリーの変異株がほとんどないからなのか(ボックス2)、それとも宿主と病原体の関連が新しい場合を除き、ジェネラリスト型変異はまれだからなのかは不明である。上に述べたように、そのような変異株を想像することは可能であるが、たとえそれが生じたとしても、その拡散が必ずしも感染者や集団レベルでの病気の総量を大きくするとは限らないことを再度強調する。
SARS-CoV-2
SARS-CoV-2がヒトに初めて出現して以来、急速な適応進化を遂げてきたことを示す十分な証拠が現在得られている。最初の説得力のあるデータは、野生型に対する適性上の優位性から、アルファとデルタの変異株が広がったというものであった[30-32]。われわれの枠組みは、SARS-CoV-2のワクチン接種への適応の可能性について何を教えてくれるのだろうか?数カ国の疫学データから、予想通り、これまでに現れた主なワクチン適応変異株は、ワクチン接種を阻害するジェネラリストであることが示唆された(図5)。
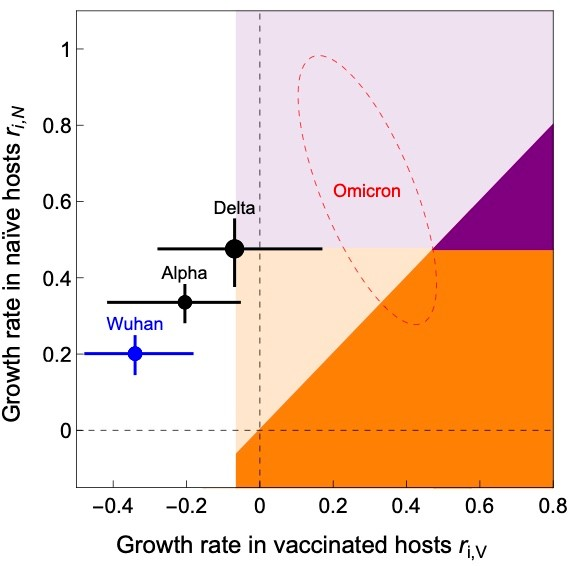
しかし、デルタの進化的優位性は、ワクチン時代に出現したにもかかわらず、ワクチン接種によってもたらされたものではないことを強調することが重要である。デルタ変異株は、ワクチン接種率が非常に低い国でも、比較的高い国でも頻度が増加し、ジェネラリストであることが示唆された。デルタがワクチン接種を阻害することを示すデータはあまり直接的ではなく、疫学的研究[33]と中和アッセイ[34]の両方から得られている。これらのデータは、適応度の3つの要素のうちの1つだけを定量化しているが(下記の「病原体の適応度と感染特性の関係」のセクションを参照)、デルタがワクチン適応である一方で、現在のワクチン (BNT162b2ファイザー-バイオNTech、mRNA-1273モデルナ、およびChAdOx1 nCoV-19 オックスフォードアストラゼネカ)がそれでもなおかなりのレベルの保護を提供していることを示す [35, 36]。アルファ型がワクチンに適応しているというケースは、さらに直接的ではない。なぜなら、アルファ型は広まり、ほとんどの国でワクチンが十分に普及する前に、デルタ型に大きく取って代わられたからだ。したがって、疫学的データは、アルファがナイーブな宿主において野生型に比べて有利であることを明確に示している[32, 37, 38]が、ワクチン接種された宿主におけるその適応度の推定は、再びワクチン効力を用いたプロキシから得られる。両変種にとって重要な点は、両変種はジェネラリストであるため、ワクチンが配備されたかどうかに関係なく優勢になったであろうということである(図5).
上記の進化の例はワクチン接種によって引き起こされたものではないが、現在、いくつかの国ではワクチンの普及率が十分高いレベルに達しており、ワクチンによる適応の可能性が現実的な懸念となってきている。先に述べたように、ワクチンによる進化は、予防の効果が小さい場合 (例えば、ワクチンがウイルスの複製を感染可能なレベルまで十分に抑制できない場合)、あるいは少数のウイルスのエピトープを標的とする場合に、他の病原体で起こる傾向がある[3, 39]。少なくともこれらのうち最初のものはSARS-CoV-2について当てはまることを示唆するデータが増えている[40-43]。したがって、SARS-CoV-2がヒトにさらに適応するにつれて、ワクチン接種を受けた集団でより高い繁殖成功を収めるが、このワクチンへの適応の増加は、ナイーブな集団での繁殖成功の減少という犠牲を伴う専門家変異株が現れ始めると予想される。実際、本稿執筆時点では、懸念される別の新しいSARS-CoV-2変異株 (オミクロンと命名)が世界の一部で淘汰されつつあるようである。現在の推定では、その選択係数は0.2/日〜0.4/日と非常に大きいことが示唆されている[44]。さらに、オミクロンはデルタ変異株よりも現在のワクチンスケジュールでうまく制御できないことを示唆する証拠が増えているが、オミクロンを決定的に分類するのはまだ早い(図5)。
私たちが知る限り、SARS-COV-2のワクチン接種促進変異株はまだ報告されておらず、利用可能な遺伝的変異(ボックス2)によっては、今後発生しない可能性もある。変異株がワクチン接種を促進するためには、ワクチンは、変異株が新たな感染を引き起こす割合を増加させるか、または変異株による既存の感染が回復、隔離、または死亡によって循環から失われる割合を減少させるかのいずれかでなければならないだろう。原理的には、抗体による細胞感染性の増強 (ADE)を含む分子プロセスが、ワクチンによる促進が起こるメカニズムを提供する可能性がある[34, 45, 46]が、われわれはADEがいかなる感染症においても感染を増加させたという証拠を知らない。また、ワクチン接種を受けた人々がより危険な行動 (例えば、コンサートやバーへの入場を許可された場合[47])に従事した場合、変異株が新たな感染を引き起こす割合が増加する可能性もある。ワクチン接種によって促進される可能性のあるもう一つのタイプの変異株は、それが引き起こす疾患の深刻さのために伝播が抑制される(例えば、隔離につながる)変異株である。病気の重症度を下げることを目的としたワクチン接種は、マレック病に対する第一世代のワクチンによって促進された変異株[17]に直接類似した方法で、そのような変異株の無声または半無声の拡散を促進することができる(ボックス2))。
長期的には、上記の仮説のような変異株が出現・拡散し、それによってワクチンの有用性が損なわれた場合、ブーストや新しいワクチンが導入される可能性がある。さらに、SARS-CoV-2がヒト集団に広がり、風土病ウイルスになると推測されるため、自然感染による免疫学的履歴を持つ人の数も大幅に増加するだろう。いずれの場合も、ここで紹介した枠組みを拡張して、複数の宿主タイプを考慮する必要がある。このような場合、可能な遺伝的変異の性質に大きく依存するため、現段階でより長期的な予測を立てることは困難である(Box 2)。
病原体の適応度と感染特性との関係
上記の分析では病原体の適応度のみに着目している。この議論に欠けているのは、ワクチン接種がワクチン効果や病気の重症度のような感染特性の進化をどのように促進するかという点である。変異株の適性(それが引き起こす感染症の成長率で測定)と感染症の特性の関係をよりよく説明するために、変異株の絶対成長率Ņ!を適性の3つの主要な要素に分解することができる(Box 1と3)。(i)感染性:変異株が曝露されたとき、いずれかのタイプの宿主に感染する確率 (ii)伝達性:変異株が感染したとき、その宿主に感染する率。
– (ii)感染性:変異株が感染性伝播体を産生し、それが非感染個体に接触する速度、(iii)感染期間:回復、隔離、または死によって感染期間が終了するまでに変異株がいずれかのタイプの宿主に感染性伝播体を産生する時間。他の条件がすべて同じであれば、感染力が強い変異株、感染力が強い変異株、感染期間が長い変異株は、増殖率が高くなる。
感染に対するワクチンの効果 – 変異株の感染力は、ワクチンがどの程度変異株に対して有効であるかを決定するための重要な特性である。変異株の感染性をᵰ#と$とすると、ワクチン効果 (VE)は、ワクチン接種によってもたらされる感染性の比例的減少であり、ᵰE = 1 – ᵰ$/#によって与えられる。このことは、ワクチン適応変異株の進化疫学を理解するためのVEの有用性について、2つの重要な点を浮き彫りにしている。第1に、VEはワクチンを接種した宿主と非接種宿主における変異株の相対的な感染力の指標であるため、Ű$の増加やŰ#の減少の結果として変異株のVEが減少する可能性がある。第2に、VEは適応度の3つの異なる要素のうちの1つにしか関与しないので、変異株の運命や定着に至った場合にそれがもたらす結果を決定するための部分的な情報しか提供しない。例えば、SARS-Cov-2のベータ変異株とガンマ変異株は共にVEを低下させるようですが[48]、現在までのところ、どちらも優勢な変異株にはなっていない。ワクチン接種された宿主に対する病原体の適応の他の構成要素を捕らえるVEの測定法は存在する[49]。
いわゆる「エスケープ変異株」を中心としたワクチン接種の議論では、関連する問題が発生する。この用語は必ずしも正確に定義されていないが、エピトープが異なるため、試験管内試験の阻害アッセイで測定されるような特定の免疫反応から逃れることができる変異株に関してしばしば用いられる[48, 50-53]。例えば、SARS-CoV-2変異株は、その伝達性(その全体的な成長率および/またはR0によって測定)と阻害アッセイにおけるその性能の両方によって特徴付けられることがある。このアプローチは、変異株がワクチン接種された宿主に適応する可能性のあるメカニズム(すなわち、特異的免疫から逃れるため、個体内で複製する能力が高まる)と、変異株を好む選択源 (例えば、感染力の増加)を混同するため、ここではあえてそうしないことにしている。変異株がワクチン接種を受けた宿主に適応するメカニズムには多くの種類があり(ボックス1)、そのそれぞれが適応度に関する3つの主要な疫学的要素(すなわち、感染力、伝播力、感染期間)のいずれかに影響を与えうるため、これらの概念を区別しておくことは有用である。したがって、変異株を特徴付ける最も一貫性があり、一般的で、不可知論的な方法は、図2に記載されているような方法であると考える。理想的には、この適性の定量化とともに、生じた変異株の複数の感染特性(感染性、伝播性、感染期間)を定量化することである(付録2)。SARS-CoV-2では、遺伝学的に解決されたリアルタイムの疫学データがかつてないほど利用可能になったことを利用して、このようなアプローチが可能である(Box 3および図5)。
疾患の重症度
人間の健康という観点から見て、間違いなく最も重要な感染特性は、変異株によって引き起こされる疾患の重症度である。重症度のほとんどの定義では、感染によって引き起こされる罹患率と死亡率の両方を捉えている。そのため、重症度は適応度の3つの要素すべてに影響を与えることができる。例えば、高い重症度は死亡率の増加によって感染期間を短縮するかもしれないし、活動レベルの低下によって感染個体の接触率を低下させ、感染性を低下させるかもしれない [54]。ほとんどの場合、重症度そのものが病原体にとって不利であり、それ故に選択されない [55]。しかし、重症化する変異株は、他の構成要素の違いによって野生型よりも適応度が高くなる可能性があるため、重症度の進化を予測することは困難である[56]。例えば、SARS-CoV-2のアルファ変異株は武漢の野生型よりも重症化する可能性があることを示唆するデータがあるが[57,58]、それでも感染力が高いので適合度が高い。また、重症化は部分的に宿主の免疫反応によって媒介される可能性があり、最近の研究では、いくつかの抗体がウイルスの複製を「強化」し、より多くの症状を誘発する可能性が示唆されている[45, 59]。中和抗体から逃れ、この増強効果を利用できるSARS-CoV-2変異株は、ワクチンを接種した宿主や以前に感染した宿主において、より大きな病気の重症化につながる可能性がある[46]。このことは、ナイーブホストとワクチン接種済みホストにおける病原体の適応度の進化については、かなり頑健で信頼できる予測が可能であるが、適応度や疾患の重症度の基礎となる成分については、3つの適応度成分の値が非常に異なる変異株が、それでも全体として同じ適応度を持つことがあるので、予測が難しいことを示している(ボックス1および3).つまり、これらの感染特性における進化のパターンは、やや特異的である可能性が高い。これが、感染特性に関する進化の軌跡を、ある病原体から別の病原体へ外挿できない主な理由である。
重症度に関する確実な理論的予測ができないにもかかわらず、他の感染症から得られたいくつかの観察がSARS-CoV-2に関連する可能性がある。第1に、ワクチンによる防御は、感染に対してよりも疾病に対して進化的に強固である傾向がある。この結論は、過去にワクチンに対して病原体が進化したとき、病原体に感染したワクチン接種者は、ワクチン非接種者よりも良い結果を得る傾向があるという観察から生じる[29]。潜在的な懸念は、COVID [45,46,59]のように、疾患の重症度に対する抗体の増強効果がある場合である[60,61]。第2に、血清型が共存する病原体の場合、異なる血清型が病気を引き起こす傾向がしばしばあるように(例えば、[62])、ワクチン駆動型の血清型置換は、原理的に全体の病気負担を増加または減少させる可能性がある。したがって、変異型に基づくワクチンの合理的な設計は、各変異型の現在の有病率と、感染した場合に疾患を引き起こす可能性の両方を考慮する必要がある。第3に、特定の条件下では、ワクチンは強毒性変異株の進化をもたらす可能性がある。この最も良い例がMDVで、このウイルスの強毒性変異株は、宿主を非常に迅速に殺すため、ワクチン接種がない場合は持続することができない[17]。ワクチンは、MDVの重症度を改善するため、これらの強毒性変異株に感染した宿主を生存させることはできるが、感染を防ぐことはできない。しかし、この効果にもかかわらず、これらの強毒性変異株にさらされたワクチン接種済みのニワトリは、元の野生型にさらされたワクチン非接種のニワトリよりも良好な状態にある。一方、ワクチンを接種していないニワトリは、より重篤なマレック病を引き起こす変異株に感染するリスクが、ワクチン導入以前よりも高まっている。SARS-CoV-2がこのような経過をたどるかどうかにかかわらず(図5)、MDVの場合と同様に、ワクチン接種は流行を軽減するための最も有効な手段であることに変わりはない[63]。ワクチン接種はまた、新しい突然変異の流出を遅らせ、その結果、ウイルスの適応の確率を低下させるかもしれない症例数を減少させる(Box 2)。
意味合い
もしSARS-CoV-2がワクチン接種に反応してさらなる適応が起こるならば、われわれの枠組みおよび過去の実験的・経験的事例の検討から、長期的にはスペシャリストな変異株を生み出す可能性が高いことが示唆される。そこに至る道筋は、ワクチン接種が抑制された変異株を含む可能性が高く、短期的には第一世代のコビッドワクチンによるワクチン接種の利点を少なくとも部分的に保持する可能性がある。一方、ウイルスの疫学と進化をモニタリングすることが急務である[39]。これによって、新しく発生した変異株(ボックス3)の特徴が明らかになり、インフルエンザのように、ウイルスの適応に対抗するために新しいワクチンが必要かどうかを判断することが可能になる。
将来起こりうるウイルスの進化に関する懸念は、現在利用可能なワクチンを差し控える理由にはならないことを強調することも重要である。第1に、ワクチンは、現在、疾病負担を大幅に軽減し、命を救っている。第2に、上に述べたように、SARS-CoV-2で現在起こっている進化の多くは、ジェネラリストの変異株を含んでいるので、既存のワクチンを配備しているかどうかに関係なく起こっていることである。第3に、自然感染から生じる免疫もまた、進行中のウイルスの進化に影響を与える。現在のところ、自然免疫とワクチンによる免疫のどちらが進化の原動力になるかはわからない。第4に、デルタ変異株であっても、現在のmRNAワクチンは、ナイーブな個体における感染と比較して、感染の確率と感染期間を大幅に減少させる[42, 43, 48]。このこと自体が、進化の可能性を非常に大幅に減少させる(ボックス2)。
今後、SARS-CoV-2の進化に対処するために、新しいワクチンスケジュール (例:高用量、ブースター、既存ワクチンの組み合わせ)または次世代ワクチン (例:新しいRNA配列、粘膜ワクチン)が必要となる可能性は十分にあり得る。すでに世界中で多様な種類のワクチンが使用されており、多くの地域でワクチンスケジュールが継続的に調整されている。この多様性が集団内および集団間で適切な免疫学的不均質性を生み出すとすれば、自然淘汰は異なる場所において異なる時期に異なるウイルス変種を支持し、おそらく複数の変種が共存することになるかもしれない。その場合、農業におけるコロナウイルス対策に必要なように、ワクチン接種プログラムを国または地域レベルで継続的に調整する必要があるかもしれない[65, 66]。ワクチン接種が感染を抑制し、複数のエピトープを標的とし、感染と宿主内複製、したがって突然変異と組換えをより効果的に抑制すればするほど、適応速度を遅らせ(ボックス2)、長期的に持続可能な効果をもたらすことができる[39]。
まとめ
ヒトや動物のワクチン接種の歴史において、ワクチン主導の進化が記録されたケースはほとんどない。ワクチンへの適応が、ワクチン接種そのもの、あるいは自然感染による免疫によって起こる場合について、われわれは、ナイーブおよびワクチン接種された宿主集団における適合度に基づく、ワクチン適応変異株の類型を提案する(図1)。
適応は、新規変異株がその前任者よりも適合度が高い場合に起こる。変異株の適合度は、その変異株が引き起こす感染症数の一人当たりの増加率(すなわち、単位時間当たりの感染症当たりの新規感染症数)で測られる。
パンデミックの初期には、ナイーブな宿主でも免疫のある宿主でも、祖先よりも拡散に優れた変異株(ジェネラリスト)が台頭すると予想される。その後、ウイルスの進化は、免疫のある宿主への特殊な適応を伴い、ナイーブな宿主への適応がある程度減少するはずだ。
ジェネラリストとスペシャリストの両変異株はワクチン接種によって抑制される可能性があり、ワクチン接種率が高くなると感染症の増加率は低下する。このような状況では、たとえワクチン接種の効果がウイルスの進化によって損なわれたとしても、全体的な感染の広がりはワクチン接種によって減少することになる。
ワクチン接種によって促進された変異株が発生することもある。この場合、ワクチン接種率が上がれば、理論的には全体の感染拡大が進む可能性があるが、だからといって、個々の感染者でも集団全体でも、必ずしも全体の発病レベルが上がるとは限らない。
進化は淘汰以上のものである。私たちのフレームワークは選択の方向と強さを予測するが、ウイルスが遺伝的に(突然変異や組み換えによって)どのような表現型を利用できるかを事前に知る方法がないため、続く進化の軌跡を正確に予測することはできない (Box 2)。
進化とは突然変異以上のものである。たとえ実験室のアッセイで特定の次元で有利であったとしても、特定の突然変異が適応度・ランドスケープの多様な次元とどのように関係しているかを事前に知る方法はない (Box 1)。
これまでのところ、SARS-CoV-2の懸念される変異株は、ワクチン接種が抑制された一般型であり、ワクチン接種に関係なく広がったであろうものである。私たちは、変異の供給がなくなるまで、より多くのジェネラリストの変異株が生まれ、広がっていくと考えている。一旦枯渇すると、特殊な変異株が拡散することによって、さらなる適応がもたらされると予想される。これらの変異株がワクチン接種によって抑制されるか、あるいはワクチン接種によって促進されるかは、変異の利用可能性に依存する。
これらの予想を超えて、SARS-CoV-2の将来のワクチン効果や病気の重症度を先験的に予測することは不可能である。分子疫学的サーベイランスは、ウイルスの適応を検出し、その特徴を明らかにするために不可欠である(Box 3)。
ボックス1
ワクチン適応のメカニズム 私たちの関心は変異株が宿主間で拡散する能力にあるが、この能力は感染した個体内で働くいくつかの異なるメカニズムから生じる可能性がある。病原体は自然免疫に対する多様な対抗手段を進化させてきたが、その多くはワクチン誘導免疫に対しても高い効果を示すため、ワクチン接種への適応に関与することが予想される。以下のリストは、包括的なものではなく、考えられる宿主内適応の多様性を例示することを意図している。 免疫回避(抗病原体反応の回避)。
- 抗原性の変化
- 抗原性の消失 宿主応答が標的とする分子の不活性化または削除。例として、毒素の消失(ジフテリア、百日咳)。
- 抗原性レパートリー。病原体が新規抗原を生成し、暴露する速度を制御する遺伝子の変化 (例:トリパノソーマ、マラリアなど)。
- 無細胞感染を脅かす抗ウイルス体液性免疫を回避するための細胞-細胞感染の増加 [53].
- 免疫に有利な部位への組織トロピズムの変化。
免疫抑制(抗病原体反応の減衰または誤った方向への誘導)。
- エフェクター分子を分解する酵素のアップレギュレーション (例えば、百日咳のptxP3など)。
- サイトカイン模倣物質 (例:ポックスウイルス)や免疫拮抗物質 (例:SARS-CoV-2のα変異型におけるOrf9bおよびOrf6、[67])などの免疫制御分子の産生。
- 不適切な反応を引き起こす物質の生産 (例:蠕虫)。
- 免疫エフェクター分子の注意をそらす「煙幕」分子の産生 (例:マラリア、[68])
免疫の利用(宿主の反応を利用する)
- 抗体依存的な増強 (例:[45,46])
生命誌を介した免疫への対抗策 上記のような免疫に対する直接的な対抗策は、ワクチン適応の宿主内メカニズムとして考えられる唯一のものでない。病原体がいつ、どこで、どのくらいの速度で複製されるかに関係する、非常に異なった一連の潜在的メカニズムが存在する。
- より早く複製される変異株は、少なくとも初期には免疫反応を圧倒することができる。
- ゆっくり増殖する変異株は、長期間にわたって免疫反応を低下させる可能性がある (例えば、多くの慢性ウイルス感染症)。
- 宿主細胞の侵入経路の変化を利用する変異株は、宿主免疫によって主要経路が遮断された場合に優位に立つことができる。
このようなメカニズムには、宿主受容体への高い結合親和性、大きなバーストサイズ(宿主細胞から放出される病原体子孫の数)、潜伏期間の変化(宿主細胞内での休眠)、感染段階の生産に対する宿主内複製の投資の変化 (例えば、マラリア)などが含まれることがある。
最後に、感染経路が疾患の重症度によって制限される場合(例えば、宿主の死亡や入院によって)、ワクチン接種によって疾患の重症度を下げることで病原体の感染を促進できる(例えば、マレック病など)。
上記の形質のほとんどは、ネイティブな病原体や偽ウイルスのような新しい発現系を用いて、様々なin vitroおよびin vivoモデルで研究することができる。多くの場合、動物モデルや、場合によってはヒトを対象としたin vivo研究も可能である。多くの場合、個々の形質がせいぜい感染性、伝播性、感染期間(これらは適合度の3つの重要な要素である)の相関関係や部分的な決定因子であるため、宿主内メカニズムを宿主間適合度に結びつけることは非常に困難である。また、それ自体の適性(すなわち感染数の増加率)や適性の他の構成要素は、異なる変異株がヒト集団内で拡散する速度からリアルタイムで推測することができる(ボックス3)。
図のボックス1
宿主集団内での変異株iの運命は、適応度の3つの重要な要素によって決まり、それぞれが宿主内適応のいくつかのメカニズムに影響される可能性がある。他の条件がすべて同じであれば、感染力が増加した変異株、感染力が増加した変異株、感染期間が増加した変異株は、適応度(集団内での伝播率)が増加する。式(1)で示されるように、適応度はナイーブな宿主とワクチン接種を受けた宿主の両方への適応度に依存する。宿主内のプロセスは、適応度のこれら3つの要素に様々な程度で影響を与え、さらに、個々のウイルスの突然変異は、これらのプロセスに様々な程度で影響を与えることができる。宿主内適応のメカニズムの一部は、in vitroのアッセイで直接測定することが可能である。ウイルスの適応力のいくつかの要素は、進化疫学的研究から推測することができる(Box 3)。
Box 2 – 変異とワクチン接種への適応
病原体の適応には、変異株間の適応度の変動が必要である。新しい変異株は複製中の突然変異と、異なる変異株が同じ宿主に感染したときの組換えから生じる。新しい変異株が生じる速度と、その変異株の適応度が野生型とどのように異なるかを区別することが重要である。
変異株の発生速度
変異株は、感染した宿主の中でウイルスが複製される過程で絶えず生成される。この発生速度は、複製中にゲノムに変化が起こる速度、および複製量に比例する。ワクチン接種は、2つの方法で行われている複製の量を減少させる。第1に、宿主内レベルでは、ワクチンを接種した宿主が感染した場合、ワクチンで活性化された免疫反応によってウイルス量が減少し、感染が早く治まることが期待される。第2に、宿主間レベルでは、ワクチン接種の普及によって、感染宿主(ナイーブとワクチン接種済みの両方)の数が減少することが期待される。しかし、不完全な(あるいは漏れのある)ワクチンの場合、病原体の複製を抑え、感染を防ぐ能力が低いため、これらの効果は緩和される。
変異株の適応度効果
新しい変異株の運命は、それが引き起こす感染数の変化率が、ナイーブ集団とワクチン接種集団の両方において野生型とどのように異なるか(すなわち、野生型と比較して図3のどこに位置するか)によって決定される。このため、可能性のある変異株の集合(図3のすべての点)と、野生型から容易にアクセスできる変異株の集合(図3の赤い点のサブセット)を区別することが有用である。つの宿主タイプで可能な成長速度の大きさには生物学的な制約があるので、図3のすべての点は、平面のある特定の領域に入ることになる。ほとんどの突然変異は破壊的であるか、ほとんど影響を与えないと予想されるが、一部は野生型より大きな成長率をもたらすかもしれない[69, 70]。したがって、両方の宿主タイプで適応度を増加させる表現型の密度に比べて、適応度の低い表現型の可能性(図3の黒い点)が高い密度になることが予想される。このような変異株群の中には、いくつかの理由により、現在の野生型から容易にアクセスできるものがある。第1に、いくつかの変異株は、野生型から何段階もの変異や組み換えを経ているため、発生する可能性が極めて低くなっているかもしれない。例えば、数十年にわたる世界的なワクチン接種にもかかわらず、麻疹ウイルスがワクチンに適応しないのは、ポリクローナル抗体反応を回避できる変異株が、H糖タンパク質に少なくとも5つの新たな変異を必要とするからだと考えられる[4]。第2に、変異株と野生型との感染内における競争は、変異株が伝播に十分な密度に達することを促進(あるいは阻害)する可能性がある。例えば、新しい宿主と病原体の関連では、宿主内競争に有利な変異は、他の点でも有利である可能性が高く、宿主間レベルで拡散する能力もある。これは、野生型が宿主への適応が不十分な場合、より一般的な変異型にアクセスできるからである(ただし軸が宿主内および宿主間の適性の場合を含む)。しかし、宿主との関連性が強くなると、宿主内で成功した変異株は宿主間レベルでは成功率が低下する傾向がある。宿主内淘汰が宿主間淘汰の対象となる変異株群を偏らせるこの効果は、ワクチンの漏出性によっても調節されると思われる[71]。
ワクチン接種と病原体の適応速度
より迅速なワクチン展開とより効果的なワクチンは、他の条件がすべて同じであれば、新しい変異株の出現を制限する。したがって、漏出性ワクチンの使用(および免疫不全宿主における慢性感染の発生)は、漏出性のないワクチンの使用と比較して突然変異のフラックスを増加させるため、およびワクチン適応型変異株の宿主内上昇を促進するため、病原体の適応を加速させる可能性がある。いったんワクチン適応した変異株が集団で流通すると、変異によって生じる速度が進化的適応に与える影響は、その変異株に作用する選択に比べれば無視できる (例えば、英国における2020年末のSARS-CoV-2のα変異株の動態は、変異のフラックスではなく、選択によってもたらされた)。この場合,病原体の適応の速度は主に選択によって駆動され、異なる標的のワクチン接種戦略は、この適応を遅らせる方法を提供する可能性がある[72-74]。
ボックス3 – SARS-CoV-2の変異株の適性をどのように評価するか?
現在進行中のSARS-CoV-2のパンデミックは、これまでにないほどリアルタイムで発生率やシークエンスデータを入手できることを特徴としている。このデータは、ナイーブホストとワクチン接種済みホストへの適応に関連するウイルスの適性(感染力、伝播力、感染期間)の基本的な構成要素を定量化するユニークな機会を提供する。3つの主要な動的変数が、これらの適応度の構成要素について有用な情報を持っている(付録1)。
第1に、ワクチン接種中の一人当たりの流行増加率は、新しい変異株の出現と伝播の可能性に関する情報を提供する。ワクチン接種率の上昇によって野生型の発生率が低下するという予測から外れる場合は、ワクチン適応型の変異株が広がっている可能性がある(∆ᑟ$ > 0).
第2に、変異株の頻度変化を解析することで、ワクチン接種に適応するための体力がどのような要素から構成されているかを推測することが可能である。付録1では、変異株の頻度変化の大きさは、その変異株が感染性ǖまたは感染力ǖの増加によって優位に立った場合には、感受性宿主の有無に比例し、その変化は、感染期間の長さによって優位に立った場合には感受性宿主とは無関係であることを示している。したがって、感染しやすいホストがロックダウンや他のNPIによって変化する場合、これが変異株頻度の変化にどのように影響するかを追跡すれば、変異株の成功の根底にあるメカニズムについて知ることができる[56, 75]。
第3に、ワクチンを接種した宿主における変異株の過剰発現は、その変異株がワクチンに適応しているという初期のシグナルとして用いることができる。付録1では、ナイーブ宿主とワクチン接種宿主の変異株頻度の差(すなわち、2種類の宿主におけるウイルス集団の遺伝的分化)は、主にワクチン接種宿主における変異株の相対的感染力によって支配されており、その感染力には支配されていないことを示している。したがって、これら3つの動的変数の解析は、適応度の3つの主要な構成要素を分離し始める方法を提供するものである。
