Contents
New-onset autoimmune phenomena post-COVID-19 vaccination
pubmed.ncbi.nlm.nih.gov/34957554/
初出:2021年12月27日
概要
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)を原因とするコロナウイルス感染症2019(COVID-19)パンデミックは、世界の経済と健康に未曾有の後退をもたらした。ワクチン接種は、SARS-CoV-2の感染による重症化や死亡を大幅に減少させる最も効果的な介入方法の一つである。ワクチン接種プログラムは世界中で展開されているが、これらのワクチンのほとんどは、その副作用や有効性に関する広範な研究が行われることなく承認されている。近年、COVID-19ワクチン接種後に新たに発症する自己免疫現象の報告が増えている(免疫性血小板減少症、自己免疫性肝疾患、ギラン・バレー症候群、IgA腎症、関節リウマチ、全身性エリテマトーデスなど)。分子模倣、特定の自己抗体の産生、特定のワクチンアジュバントの役割は、自己免疫現象に大きく寄与しているようである。しかし、COVID-19ワクチンと自己免疫現象との関連が偶然のものなのか、それとも因果関係があるのかは、まだ解明されていない。ここでは、ある種のCOVID-19ワクチンに反応して起こる自己免疫症状に関する新たな証拠をまとめた。ワクチン接種の結果としての自己免疫疾患のリスクに関する情報は議論の余地があるが、我々は単にCOVID-19ワクチンに関連する自己免疫症状についての我々の現在の理解を提案するに過ぎない。実際、我々はCOVID-19の罹患率や死亡率を防ぐためのCOVID-19大量接種の圧倒的なメリットを否定することを目的としているわけではない。これらの報告は、COVID-19ワクチン接種後の自己免疫症状の臨床評価と管理の指針となるだろう。
略語
- ACE2 アンジオテンシン変換酵素阻害剤2(angiotensin-converting enzyme inhibitor 2
- AIH 自己免疫性肝炎
- ALP アルカリホスファターゼ
- ALT アラニンアミノトランスフェラーゼ
- ANA 抗核抗体
- ARDS 急性呼吸困難症候群(acute respiratory distress syndrome
- AST アスパラギン酸アミノ基転移酵素
- COVID-19 コロナウイルス感染症2019
- CT コンピュータ断層撮影
- CVST 脳内静脈洞血栓症
- GBS ギラン・バレ(Guillain-Barr)症候群
- HIT ヘパリン起因性血小板減少症
- IL-6 インターロイキン-6
- ITP 免疫性血小板減少性紫斑病
- IVIg 静脈内免疫グロブリン
- NF-κB 核内因子カッパB
- NLRP3 NLRピリンドメイン含有3
- PBC 原発性胆汁性胆管炎
- PEG ポリエチレングリコール
- PF4 血小板因子4
- PSC 原発性硬化性胆管炎
- SARS-CoV-2 重症急性呼吸器症候群新型コロナウイルス
- SLE 全身性エリテマトーデス(Lupus erythematosus
- SVT 脾臓静脈血栓症
- TLR Toll-like レセプター
- VITT ワクチン誘発性免疫性血栓性血小板減少症
イントロダクション
2019年末、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)をきっかけに、中国の武漢でコロナウイルス感染症2019(COVID-19)が初めて報告され、瞬く間に世界中に広がっている。2021年9月6日現在,ジョンズ・ホプキンス大学のCenter for Systems Science and Engineeringが公開しているCOVID-19 Open Datasetsに基づくと,COVID-19による死亡確認数は400万~5,700万人,発症確認数は2億2,100万人となっている[1]。COVID-19の特徴は、発熱、乾いた咳、疲労、頭痛、味覚・嗅覚の喪失などを引き起こす無症状またはflulikeな病気から、重度の肺炎を引き起こし、急性呼吸窮迫症候群(ARDS)に至り、その後、人工呼吸を必要とする呼吸不全に至るまで、幅広い症状を呈することである[2-4]。SARS-CoV-2によるサイトカインストームは、IL-1β、IL-6,IL-18,TNF-α、マクロファージの炎症性タンパク質などの炎症性サイトカインやケモカインの産生を誘導し[5]、最終的に呼吸不全や多臓器不全による死亡に至るという主要なメカニズムに関与している[6, 7]。さらに、これまでの研究では、COVID-19はVirchowが記述した内皮機能障害、血小板活性化、血流異常を介した血栓症の危険因子であるようだと指摘されており、妊娠中のCOVID-19患者にも同様のシナリオが認められている[8-10]。現在までのところ、COVID-19の治療は、主に対象となる対症療法と支持療法である。現在、COVID-19のパンデミックを軽減するための最も効果的な戦略の1つは、SARS-CoV-2の感染の速度と範囲を弱めるために住民の間に免疫バリアを作ることができる世界規模のワクチン接種である。2021年9月6日現在、全世界の人口の40~4%が少なくとも1回のCOVID-19ワクチン接種を受けており、全世界で50~450億回の接種が行われている[11]。現在使用されているCOVID-19ワクチンのプラットフォームは、mRNA(Pfizer-BioNTech社、モデルナ社など)とアデノウイルスベクター(Johnson & Johnson社、AstraZeneca社など)の2種類があり、強固な体液性応答を誘発し、接種した集団の大部分で安全性が確認されている[12]。
しかし、ワクチン接種プログラムが世界的に展開されるにつれ、最近では、軽度の局所症状(例:注射部位の痛み)から全身症状(例:発熱および/または頭痛)まで、COVID-19ワクチンに関連する多くの副作用が報告されている[13, 14]。COVID-19ワクチンを6回接種した後の自己免疫疾患および炎症性リウマチ疾患の患者では、局所的な痛み、疲労、頭痛、筋肉痛が最も多く見られた副作用である[16]。これまでの研究では、ヒトパピローマウイルス、B型肝炎、インフルエンザワクチンが、自己免疫を誘発する分子模倣によって、自己免疫疾患の発症や増悪の引き金になる可能性が指摘されていた[17-19]。心筋炎[20]、ワクチン誘発性免疫性血栓性血小板減少症(VITT)[21, 22]、IgA血管炎[23]、自己免疫疾患などがCOVID-19ワクチンの潜在的な結果であることを示す証拠が増えてきている。特に、副作用は被接種者の年齢や性別によって大きく異なり、男性よりも女性、高齢者よりも若年者の方が重篤な影響を受ける[24]。しかし、COVID-19ワクチンと自己免疫症状との関連性が偶然のものなのか、それとも因果関係があるのかは、まだ解明されていない。
特定のCOVID-19ワクチンと自己免疫疾患との間に新たな証拠があることから、予防接種によって引き起こされる自己免疫疾患のリスクは、社会的な関心を呼んでいる。ここでは、現在使用されているCOVID-19ワクチンの主な種類とその作用機序について説明する。次に、COVID-19ワクチンによって引き起こされる免疫活性化のもっともらしいメカニズムを仮定する。最後に、VITT、自己免疫性肝疾患、ギラン・バレー症候群(GBS)IgA腎症など、COVID-19ワクチンに反応して発生した自己免疫症状を呈した一連の症例をまとめた。これらの報告は、COVID-19ワクチン接種後の自己免疫症状の臨床評価や管理の指針となる可能性がある。
検索戦略
MEDLINE/PubMed、Embase、Scopusの電子データベースを使用し 2021年10月31日までに発表されたCOVID-19ワクチン接種と新たに発症した自己免疫現象に関する文献を検索した。メッシュと関連するフリーテキストの両方の用語を以下のように使用した。(“COVID-19 Vaccine*” OR “SARS-CoV-2 vaccine*”) AND (“autoimmune diseases” OR “autoimmunity” OR “autoimmune hepatitis” OR “thrombocytopenic idiopathic purpura” OR “Guillain-Barre Syndrome” OR “systemic lupus erythematosus” OR “IgA glomerulonephritis” OR “vaccine induced thrombotic thrombocytopenia”). 表1は、文献検索で使用した用語の詳細である。
表1 対象文献の検索方法
原文参照
COVID-19 ワクチンと有害事象の背景にある免疫活性化のメカニズム
代表的なCOVID-19ワクチンの概要
COVID-19 vaccine tracker(https://www.COVID-19vaccinetracker.org)によると 2021年9月1日現在、268種類のワクチンが開発中、97種類が臨床試験中、20種類が実用化されている。COVID-19ワクチンで使用されているプラットフォームには、ウイルスベクター(複製および非複製)タンパク質ベース(タンパク質サブユニット、ウイルス様粒子)核酸(RNA、DNA)全ウイルス(不活化または弱毒化)など、古典的なプラットフォームと新規のプラットフォームがある[25]。現在使用されている最も一般的なワクチンは、mRNAベース(Pfizer-BioNTech社とモデルナ社)とアデノウイルスベクター(Johnson & Johnson社とOxford-AstraZeneca社)のワクチンである。
mRNAワクチンが注射されると、mRNAが筋肉細胞に入り、リボソームが細胞内翻訳を行い、宿主の受容体であるアンジオテンシン変換酵素2を認識して結合するウイルスの受容体結合ドメインであるスパイクタンパクを産生する。その後、CD8+およびCD4+T細胞を介した強固な反応が引き起こされ、最終的には中和抗体やメモリーTおよびB細胞の産生が誘導される[26]。アデノウイルス・ベクター・ワクチンの場合、SARS-CoV-2抗原は、細胞に侵入するためにウイルス・ベクターによって送達された。ウイルスベクターは物理的または化学的に弱体化されているため、病気を引き起こすことはない[27]。宿主細胞内では、SARS-CoV-2スパイクタンパク抗原が発現し、T細胞を介した免疫反応を誘発する[28, 29]。現在使用されている代表的なウイルスベクターワクチンには、ヤンセン社のアデノウイルスベースのワクチンとアストラゼネカ社のアデノウイルスベースのワクチン(ChAdOx1 nCoV-19)がある。現在、臨床開発中のSARS-CoV-2ワクチンは、非複製型が17種類、複製型が2種類のウイルスベクター候補がある[30]。前者は緊急用として世界中の規制当局から承認されている[31]。
しかし、インドやデルタ型(B.1.617.2)イギリスやアルファ型(B.1.1.7)など、数十種類の異なるSARS-CoV-2の変異株が世界的に広がっている。SARS-CoV-2変異株の拡散は、ウイルススパイクエピトープからの抗体の逃避と関連しており、おそらく再感染につながり、すべてのタイプのワクチンの効果を減衰させる[32, 33]。
COVID-19 ワクチンが引き起こす免疫活性化の潜在的メカニズム
COVID-19ワクチン接種後に新たに発症する自己免疫症状は広く報告されている[34-36]。COVID-19ワクチンが自己免疫を誘発する主なメカニズムとしては、分子模倣、特定の自己抗体の産生、特定のワクチンアジュバントの役割などが挙げられている。
以前の研究では、SARS-CoV-2感染が自己免疫を引き起こす可能性があることが明らかになっているが[37]、COVID-19ワクチンと自己免疫現象との関連性はいまだに不明である。呼吸器系はSARS-CoV-2に最初に侵された臓器であり、SARS-CoV-2スパイク糖タンパク質と肺サーファクタントタンパク質が24個のペンタペプチドのうち13個を共有していることから、SARS-CoV-2感染後の免疫反応と肺サーファクタントタンパク質との間の相互反応に関与している可能性がある[38]。さらに、SARS-CoV-2タンパク質と様々な組織抗原との間の交差反応は、結合組織や心血管、胃腸、神経系に対する自己免疫を引き起こす可能性がある[39]。感染症は、ワクチンによって引き起こされる自己免疫疾患の原因となる環境上のトリガーとして作用し、微生物抗原は、自己抗原に対する交差反応性の免疫反応を誘発することがある[19]。特定のワクチン成分とヒトの特定のタンパク質との間の類似性によって引き起こされる免疫交差反応は、病原性抗原に対する免疫システムを、感受性の高い集団の類似のタンパク質を攻撃するように仕向け、自己免疫疾患を引き起こす可能性があり、このプロセスは分子模倣として知られている。インフルエンザワクチン、B型肝炎ワクチン、ヒトパピローマウイルスワクチンは、分子模倣によって自己免疫を引き起こすことが疑われている[18, 39]。また,ワクチンを接種した被験者のうち,その後に自己免疫現象を発症したのは少数であり,ワクチンによって誘発される自己免疫に対する遺伝的素因があることが示されている。
ワクチンは、適応免疫反応を引き起こして防御効果を発揮させ、炎症性亢進状態を刺激する可能性がある。ワクチン接種後の健常者は、血液単核細胞におけるI型IFNの発現、酸化ストレスおよびDNA損傷の蓄積が急性に増加し、抗SARS-CoV-2中和抗体が効果的に産生されることを示している[40]。SprentとKingは、COVID-19ワクチンの副作用は、効果的な免疫反応の誘導に伴うIFN-I生成の一過性のバーストの単なる副産物であると考えている[41]。しかし、特定の自己抗体の産生がこれらの有害事象の原因となっている可能性もある。VITT現象は広く報告されており、これはIgG-FcγR相互作用を介した血小板因子4(PF4)抗体による血小板の活性化に起因すると考えられている[42]。また、抗PF4抗体によって引き起こされる補体の活性化もVITTに関与していると考えられる[43]。しかし、Greinacher Aらは、ワクチン接種によって誘導されたPF4抗体は、SARS-CoV-2のスパイクタンパクとは交差反応しないことを明らかにしている[44]。さらに、核酸による接触系の活性化、ワクチンを活性化するアレルギーエフェクター細胞の補体認識、ポリエチレングリコール(PEG)に対する既存の抗体認識、およびマスト細胞の直接活性化が、過敏症の潜在的な遺伝的または環境的素因と相まって、COVID-19 mRNAワクチンに対するアナフィラキシーを説明している[45]。
ワクチンアジュバントは、NLR pyrin domain containing 3 (NLRP3) inflammasomeを誘発することでワクチンの免疫原性を低下させる可能性がある[46]。mRNAワクチンに含まれるmRNAは、抗原とアジュバントの両方の役割を果たし、エンドソームのToll様受容体(TLR)と細胞質のインフラマソーム成分によって識別され、炎症と免疫を誘発する[47]。NLRP3インフラマソームは、自然免疫系および適応免疫系において重要な役割を果たしており、関節リウマチ、全身性エリテマトーデス(SLE)シェーグレン症候群、全身性硬化症、強直性脊椎炎などの自己免疫疾患にも寄与している[48]。mRNAを含む脂質ナノ粒子(LNP)をベースにしたワクチンは、COVID-19に対する2つの主要なワクチンで使用されている有望な新しいプラットフォームである。強力なアジュバント活性を持つLNPは、mRNAを分解から保護し、細胞内送達とエンドソーム脱出を助けるキャリアビークルとして選ばれた。LNPは、リン脂質、コレステロール、PEG化された脂質、カチオン性またはイオン化可能な脂質の混合物で構成されている。COVID-19ワクチン接種後のアナフィラキシー反応には、原因物質として特定されているPEGに関連するIgE媒介反応が関与している可能性がある[49, 50]。アデノウイルスベースのAstraZenecaワクチンに含まれる緩衝剤/酸化防止剤(ヒスチジン)や非イオン性界面活性剤(ポリソルベート80)など、PEG以外の他の賦形剤も、ワクチン接種後のアナフィラキシーや重篤な過敏症反応に関与している可能性がある[51]。マウスモデルでは,LNPが炎症反応を引き起こす可能性があり,好中球の大量浸潤,多様な炎症経路の活性化,IL-1β/IL-6やマクロファージ炎症性タンパク質-α,マクロファージ炎症性タンパク質-βの分泌など,さまざまな炎症性サイトカインやケモカインの産生を特徴としている[52](図1)。
図1 ワクチンアジュバントによる自己免疫誘導の潜在的メカニズム
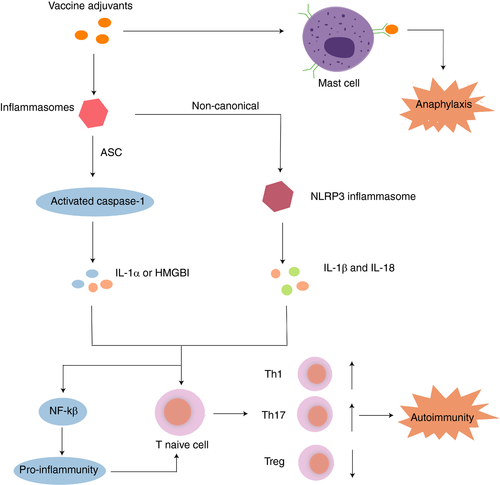
ワクチンアジュバントは、インフラマソームを活性化する。正準型のインフラマソームは、アダプター分子であるASCを介してカスパーゼ-1をリクルートし、カスパーゼ-1の活性化とIL-1αやHMGB1などの炎症性DAMPsの放出を引き起こす。非正規のインフラマソームは、NLRP3インフラマソームを活性化し、非正規ルートで間接的にIL-1βやIL-18の成熟・分泌を誘導し、それらが受容体に結合してNF-κBシグナル経路を活性化し、最終的にNLRP3,pro-IL-1β、pro-IL-18の発現を上昇させる。さらに、ポリエチレングリコール(PEG)に対する既存の抗体認識やマスト細胞の直接的な活性化に加え、遺伝的または環境的な過敏症の素因があることから、COVID-19 mRNAワクチンによるアナフィラキシーが説明されている。ASC: apoptosis-associated speck-like protein containing a CARD; HMGB1: high-mobility group box 1; IL-1α: interleukin-1α; IL-1β: interleukin-1β; IL-18: interleukin-18; NF-κB: nuclear factor kappa B; PEG: polyethylene glycol
COVID-19ワクチン接種後の自己免疫症状
ワクチンによる血栓性血小板減少症
ワクチン起因性血栓性血小板減少症(VITT)は、血小板減少症を伴う血栓症症候群としても知られており、臨床的には自己免疫性のヘパリン起因性血小板減少症(HIT)の特徴に似ているが、ヘパリン曝露の既往歴や血栓症の既知の危険因子はない。患者はいずれも若く、以前は健康であったが、COVID-19ワクチン接種後に血小板減少症と同時に、脳静脈洞血栓症(CVST)脾静脈血栓症(SVT)肺塞栓症など、主に非典型的な部位に広範な血栓が認められた。COVID-19ワクチンの接種プログラムが世界的に展開されている中、新たなエビデンスにより、COVID-19ワクチン接種後の有害事象が報告されている。
非典型的な場所でのワクチン接種に伴う血小板減少症や血栓症の初期合併症は、主にアデノウイルスベースのCOVID-19ワクチンで見られた。62歳の女性がChAdOx1 nCoV-19ワクチンを接種した後、VITTを発症し、関節の痛み、中程度の頭痛、点状出血、血腫が見られたという事例である。臨床検査では,血小板減少症,フィブリノゲン低下,D-ダイマー上昇,血小板因子4陽性が認められた。彼女は高用量の静脈内免疫グロブリン(IVIg)とプレドニゾロンによる治療によく反応した[53]。27歳の健康な男性は、ワクチン接種の2日後に断続的な頭痛、眼球浮腫、嘔吐があり、Dダイマーの上昇、血小板とフィブリノゲンの低下、PF4抗体の陽性、著しいCVSTを伴ってた[54]。ノルウェーの医療従事者492名を対象とした観察研究では、AZD1222によるワクチン接種後に血小板減少症とPF4/ポリアニオン複合体に対する抗体の両方が低頻度で見られたと報告している[55]。Seeらは、血小板減少症を伴う脳静脈洞血栓症の患者12名を報告しており、これらの患者はすべて60歳未満の女性で、入院を必要とするワクチン接種後6日から15日の間に症状が現れた[56]。最近、Scullyらは、急性血小板減少症および血栓症を発症した22人の患者の臨床および検査プロファイルを詳細に記述している。この22例のうち、14例は女性で、年齢は21~77歳(年齢中央値46歳)21例はDダイマー値の上昇、PF4抗体の陽性、フィブリノゲン値の異常を示していた。また、この22人のうち13人がCVSTを発症しており、4人が肺塞栓症、1人が深部静脈血栓症と両側の副腎出血、2人が中大脳動脈領域に影響を及ぼす虚血性脳卒中、2人が門脈血栓症を発症していた[57]。Schultzらは、32~54歳の5人の患者がワクチン接種の7~10日後にCVSTと血小板減少症を起こしたと報告している。すべての患者は高レベルのPF4-ポリアニオン抗体を持ち、ヘパリンへの曝露歴はなかった[58]。Greinacherらは、オーストリアとドイツ出身の11例がCOVID-19ワクチン接種後に血栓症または血小板減少症を起こしたことを報告している。11例中9例が女性で、年齢の中央値は36歳(範囲22~49歳)であった。これら11名の患者のうち、9例がCVST、3例がSVT、3例が肺塞栓症、4例がその他の血栓症であった[59]。静脈血栓塞栓症の個人歴や家族歴がなく、避妊もしていない50歳の女性が、ワクチン接種の10日後に激しい腰痛と頭痛を発症した。臨床検査では、重度の血小板減少症、血清Dダイマー濃度の上昇、鉄欠乏性貧血が認められた[60]。1例目は、オーストラリアの44歳の男性医療従事者であった。彼は、発熱、疲労、腹部の不快感、排便回数の増加を呈する8日前にCOVID-19ワクチンの1回目の接種を受けてた。検査結果は、血小板数の低下、D-ダイマーの著しい上昇、PF4抗体の陽性、門脈と脾静脈の完全閉塞を伴う血栓症を示した[61]。ワクチン接種後にCVSTと血小板減少症を発症した症例が2例あった。1例目は、頭痛、左側の協調性の欠如、片麻痺があった。もう1例は、原発性硬化性胆管炎(PSC)と片頭痛の既往がある25歳の男性で、より重度の頭痛、羞明、首のこわばり、視覚障害を発症し、PF4抗体が陽性であった。2例とも神経学的に悪化し、死亡した[62]。これとは逆に、全国規模の前向きコホートに基づいて、Simpsonらは、COVID-19ワクチン接種と血小板減少性、出血性、血栓塞栓性のイベントとの間に正の関連は見られないことを発見した[63]。ChAdOx1 nCoV-19の初回接種を受けたデンマークの148 792人とノルウェーの132 472人を含むコホートでは、静脈血栓塞栓症イベントの発生率が一般集団よりも高いことが分かった[64]。41歳の男性は、頭痛、重度の血小板減少症、Dダイマーの増加、門脈全体の広範な血栓症を呈する11日前に、ChAdOx1 nCoV-19の初回接種を受け入れた[65]。健康状態が良好な50歳の白人男性が、悪化した頭痛に悩まされた。脳のCTスキャンでは、左大脳半球に実質内出血が認められ、CTアンギオでは複数の小さな出血部位が認められた[66]。55歳の女性は,結膜充血,後眼窩痛,複視を呈し,著明な血小板減少症とIgG抗血小板抗体陽性を伴ってた。彼女は、両側のSOVT、免疫性血小板減少性紫斑病(ITP)虚血性脳卒中と診断された[67]。51歳の女性が、重度の血小板減少症、D-ダイマーとCRPの上昇、中心性肺塞栓症、静脈血栓と相まって、呼吸困難、疲労、咳を発症した[68]。片頭痛と肥満のある40歳の女性のケースでは、突然の頭痛、体の痛み、発熱、悪寒があった。臨床検査の結果、血小板減少症、Dダイマー上昇、PF4抗体陽性、肺塞栓、硬膜静脈洞血栓症が認められた[69]。さらに、Muirらは、軽度の貧血、重度の血小板減少、フィブリノゲン値の低下、Dダイマーの上昇を呈し、びまん性血管内凝固様の状態を示唆した48歳の白人女性の症例を報告している。追加検査の結果、CVSTと広範なSVTが認められた[70]。しかし、2種類のアデノウイルス・ベクター・ワクチン(Ad26.COV.2.SおよびChAdOx1 nCoV-19)によるVITTイベントの違いは解明されていない。Hwangらは、Ad26.COV.2を接種した後のCVTは、ChAdOx1 nCoV-19を接種した場合よりも遅く発生し、血栓症や脳出血が多く、D-ダイマーや活性化部分トロンボプラスチン時間値が低いにもかかわらず、死亡率は同程度であると結論づけている[71]。
アデノウイルスベクターワクチンに加えて、他のワクチンに関連した血栓症が接種範囲の拡大に伴って発生している。Welshらは、COVID-19ワクチン(モデルナ)の16 260 102回接種とCOVID-19ワクチン(Pfizer-BioNTech)の18 841 309回接種において、それぞれ15例と13例の血小板減少症を報告している[72]。39歳の女性患者が、疲労、筋肉痛、体幹・脚・腕の点状発疹、深在性血小板減少症が発症する3日前に、BNT162b2 COVID-19ワクチンの2回目の接種を受けた[73]。Fueyo-Rodriguezらは、41歳の女性が発熱、頻脈、吐き気を呈する12時間前にBNT162b2 COVID-19ワクチンを接種したことを報告している。血液検査では、著しく中等度の血小板減少、C反応性タンパク質およびIgEの上昇が認められた[74]。
COVID-19ワクチンが免疫性血栓性血小板減少症(ITT)を誘発するメカニズムはいくつか考えられる。まず、Greinacher らは、COVID-19 ワクチンの接種により、Fcγ受容体を介して血小板を刺激する PF4 に対する抗体の活性化を媒介とした稀な ITT が起こると考えている。このまれな副反応は、ヘパリン曝露後に発症する古典的な免疫介在性HIT疾患の臨床症状に酷似している。驚くべきことに、これらの患者の誰もが発症前にヘパリンにさらされていなかった[59]。さらに、このプロセスは、複数のウイルスに関連した自己免疫を引き起こす可能性のある確立されたメカニズムである分子模倣に関与していると思われ、ウイルスの相同成分に対する抗体介在性反応を誘発し、自己抗原と交差反応して自己免疫疾患を引き起こす可能性がある[75-78]。しかし,Greinacher Aらは,ワクチンによって誘導されたPF4抗体とSARS-CoV-2スパイクタンパクとの間に交差反応がないことを発見し,SARS-CoV-2スパイクタンパクに対するワクチン誘導免疫反応がVITTによって引き起こされていないことを示唆している[44].また、アデノウイルス-血小板-白血球の複合体は、p-セレクチンとvon Willebrand因子を介する血小板の活性化をもたらし、その結果、肝臓での血小板のクリアランスが促進される可能性があり[79]、アデノウイルスワクチン接種後の血小板減少症が頻繁に起こることが示唆されている[80]。血栓性疾患のVITTは、通常、ワクチン接種後少なくとも1週間後に始まる。しかし、ウイルスは複製できず、循環しているウイルスはワクチン接種後1-2週間で消失するため、ウイルスの中枢神経系や腸への局在化がこれらの部位での血栓症を引き起こす可能性は低いと考えられている[81]。ポリソルベート80は、一般的に利用されている非イオン性界面活性剤および薬剤安定化剤であり、ナノ粒子と複合化すると脳内皮細胞への侵入や血液脳関門の通過に有効であることが知られている[82]ため、血栓症を中枢神経系に局在化させ、病原性カスケードを引き起こす可能性がある[83]。しかし、Eichingerらは、VITTが発生するワクチン接種後1週間以上経ってからポリソルベート80が存在する可能性は低いと主張している[81]。抗リン脂質抗体(APL)は、COVID-19ワクチン接種後の血栓イベントの原因の一部となっている可能性があり、APLの産生に関連するI型インターフェロン反応を引き起こす可能性がある。自然免疫細胞、サイトカイン、補体カスケード反応が関与する異常に活性化された免疫反応と関連していると思われる[84]。また、抗PF4抗体によって引き起こされる補体活性化もVITTに関与しているようである[43](図2)。
図2 COVID-19ワクチン接種後のワクチン誘発性免疫性血栓性血小板減少症を誘発するメカニズムを模式的に示したもの
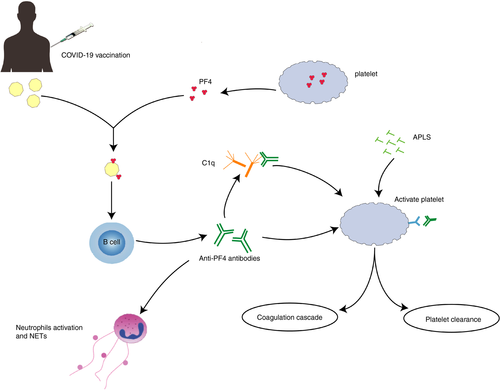
APLはCOVID-19ワクチン接種後の血栓イベントの危険因子である可能性がある。APLはI型インターフェロン反応を誘発する。APLはプロテインCの抗凝固経路を阻害し、血小板と直接結合して凝固カスケードを引き起こす可能性がある。また、自然免疫細胞、サイトカイン、補体カスケードが関与する免疫反応の異常な活性化にも関与していると考えられる。さらに、COVID-19のワクチン接種は、Fcγ受容体を介して血小板を刺激するPF4に対する活性化抗体を媒介とした免疫性血栓性血小板減少症のまれな発症に寄与する可能性がある。このまれな副作用は、古典的な免疫介在性HIT疾患の臨床症状に極めてよく似ている。VITTには、抗PF4抗体による補体活性化が関与していると考えられる。PF4を含む免疫複合体はC1qによって認識され、C1qはIgG分子のFc部分に結合してC3を活性化し、補体反応を増幅させ、下流で強力な炎症性メディエーターやエフェクターを生成し、最終的にはトロンボイン炎症を促進することになる。APL(抗リン脂質抗体)PF4(血小板因子4)IgG(免疫グロブリンG)VITT(ワクチン誘発性免疫性血栓性血小板減少症)HIT(ヘパリン誘発性血小板減少症)COVID-19(コロナウイルス感染症2019)。
COVID-19ワクチン接種後のVITTに関連するエビデンスが多数あることから、以下のような臨床的特徴をまとめた。第一に、大多数の患者は健康で、血栓塞栓症の個人歴や家族歴がないこと。第二に、ワクチン接種後の症状発現までの平均期間は8日である。年齢や性別に関係なく発症する可能性があり、特に若い女性が多く、年齢は27歳から62歳までとなっている。第三に、ヘパリン投与歴のない患者のほとんどが、血清Dダイマーの上昇、フィブリノゲンの低下、PF4抗体の陽性を示し、血小板減少を伴うCVST、SVT、肺塞栓を含む非定型部位の広範囲な血栓を伴ってた。VITT患者の主要な治療法は、ヘパリンを使用しない抗凝固剤とIVIgである[85]。
免疫性血小板減少性紫斑病
ITPは自己免疫疾患で、血小板レベルの低下を特徴とし、粘膜皮膚などの出血を引き起こす。近年、COVID-19ワクチン接種後に新たなITPが発生したという証拠が増えている。ITPの最初の症例は28歳の女性で、AZD1222投与後に発熱、倦怠感、頭痛を呈し、体幹、四肢の紫斑、口腔内の出血性病変を併発した[86]。2人目の患者は72歳の女性で、モデルナ COVID-19ワクチンを接種した1日前に、血小板の減少、発疹、自発的な口腔内出血、頭痛、腕・脚・腹部にわたるびまん性の点状出血、歯肉粘膜の出血性水疱を呈した[87]。ワクチン接種の2週間後に血小板減少を伴う点状の発疹が見られた26歳の女性。彼女の肝機能検査ではITPと急性肝障害が認められた[88]。ヒスパニックの67歳の患者は、COVID-19ワクチン(Pfizer-BioNTech)の1回目の接種を受けた2週間後に、足と胸に点状の発疹が出た。その後、2日前に同ワクチンの2回目の投与を受けたところ、歯茎に出血、全身を覆う急激な発疹、右目に結膜下出血を発症した[89]。急性ITPの2例は、ChAdOx1の投与後に原因不明の重篤な血小板減少症を発症した[90]。Perriconeらは以前、ワクチン接種に関連する一連のITP症例をまとめてた。これは、病原性抗体が血小板や巨核球と結合し、オプソニン化、補体活性化、アポトーシス経路を経て血小板減少症を引き起こすという分子擬態に関与している可能性がある[91]。
自己免疫性肝疾患
自己免疫性肝疾患は、自己免疫性肝炎(AIH)原発性胆汁性胆管炎(PBC)PSCの3つの異なる臨床症状を含む、慢性炎症性肝胆道疾患のグループを表している[92, 93]。環境的な誘因(ウイルス、薬剤、ハーブ製品など)は、肝臓の自己抗原に対する自己寛容性の喪失を引き起こす可能性がある。以前の研究では、インフルエンザワクチンやA型肝炎ワクチンがAIHを引き起こす可能性が示唆されていた[94, 95]。しかし、新たな証拠により、COVID-19ワクチン接種後の自己免疫性肝疾患の発症に関するいくつかの症例が明らかになった。
最初の症例は、産後3カ月目の35歳の白人女性であった。彼女はCOVID-19ワクチンを接種した13日後に全身性の痒み、胆汁、黄疸を発症し、抗核抗体と二本鎖DNA抗体が陽性となった[96]。しかし、Capecchi PLらは、COVID-19ワクチンではなく、最近の妊娠がAIHの発症に関連する多大な交絡因子であると疑問を呈している[97]。しかし、さらに2例の男性症例では、妊娠が交絡因子として除外されている。1例目は、イラク出身の36歳の男性医師で、ChAdOx1 nCoV-19のワクチン接種後26日目に軽度の発熱反応と顕著な肝機能検査の異常が見られた。肝生検では、著しい線維化はなく、リンパ球が主体の混合炎症細胞浸潤を伴う間歇性肝炎が認められた。生検後の治療前の自己免疫性肝炎の改訂オリジナルスコアは15である[98]。もう1例は63歳の男性で、SARS-CoV-2自然感染や自己免疫の既往歴はなく、急性重症自己免疫様肝炎を呈する7日前にSARS-CoV-2ワクチンの初回接種を受け、プレドニゾンで良好な治療を受けてた。興味深いことに、この患者はPBCに対する保護遺伝子を持ち、HLA対立遺伝子DRB1*03とDRB1*04の感受性遺伝子を持っていなかった[99]。アルコール摂取も喫煙もしていない80歳の女性が、BNT162b2 mRNAワクチン接種の1週間後に、肝酵素値の上昇、黄疸、高クロム尿、インターフェイス肝炎を呈し、プレドニゾンによる治療によく反応した。検査所見では、アスパラギン酸アミノトランスフェラーゼ(AST)アラニンアミノトランスフェラーゼ(ALT)ビリルビン、アルカリホスファターゼ(ALP)γ-グルタミルトランスフェラーゼ、抗核抗体(ANA)総IgGが陽性であった[100]。既述の症例と同様に、71歳の白人女性がCOVID-19 mRNAの接種を受けた4日後に黄疸を発症し、ビリルビン、ALP、ALTが陽性となった(McShaneら[101])。また、41 歳の女性が mRNA-1273 ワクチンを接種後、上腹部痛、吐き気、嘔吐に加えて、胆汁、黄疸を呈し、最終的にワクチン誘発性 AIH と診断された。検査結果は、ANA、抗平滑筋抗体、抗可溶性肝抗原、抗肝細胞質が陽性であり、高用量プレドニゾン(1mg/kg)による副腎皮質ステロイド治療が開始され、肝酵素が急速に正常化した[102]。76歳の女性は、抗平滑筋抗体陽性、免疫グロブリンG上昇を伴う自己免疫性肝炎を呈する前にCOVID-19ワクチン接種を受けており、典型的な組織学的所見を呈していた[103]。Relaらは、コビッドワクチン接種(Covishield)によって引き起こされたAIHの患者2名を報告している。1例は38歳の女性医療従事者で、深い黄疸、足の水腫、濃い尿を発症し、肝機能検査で総ビリルビン、AST、ALTが著しく上昇した。もう1例は62歳の糖尿病患者で、ワクチン接種後に発熱、食欲不振、黄疸が見られた。肝機能検査のALT、AST、総ビリルビンも上昇していた。肝生検では、門脈中心部の橋状壊死と軽度の門脈線維化が認められ、最終的には肝疾患で死亡した[104]。
現在の症例報告によると、自己免疫性肝炎を引き起こすタイプのワクチンは、主にPfizer-BioNTech社とモデルナ社が製造したmRNAワクチンである。ワクチン接種後の症状発現までの平均期間は13日で、4日から26日の幅がある。主な臨床症状は、黄疸、インターフェイスの肝炎、肝機能検査の異常などである。SARS-CoV-2ワクチンとAIHの因果関係は明確には証明できないが、これらの症例報告は、この関連性が偶然のものではない可能性を示唆している。ワクチン接種と典型的な症状の発現と検査結果との間には妥当な時間差があり、また治療に対する反応も良好であることから、AIHとSARS-CoV-2ワクチン接種との関連性はさらに検証されている。しかし、妊娠や薬物使用が、この関連性を誇張する交絡因子となっている可能性がある。正確な因果関係を明らかにするためには、さらなる証拠が必要である。
ギラン・バレー症候群(Guillain-Barré syndrome
ギラン・バレー症候群(GBS)は、サイトメガロウイルス、エプスタイン・バールウイルス、ジカウイルスなどの特定の感染症によって誘発される、末梢神経および神経根を侵すまれな自己免疫性神経疾患である[105]。これまでの研究では、GBSは狂犬病、A型およびB型肝炎、インフルエンザのワクチンと関連があることが示されていた。新たな証拠により、COVID-19ワクチン接種後にGBSが発生する可能性が示された。
最初の症例は82歳の女性で、ワクチン接種後の最初の1週間に全身の不快感と体の痛みがあった。脳脊髄液の分析では、アルブミン細胞の分離と馬尾神経根の強化が認められ、GBSの診断と互換性があった[106]。COVID-19のワクチン接種においては、二顔面の脱力がGBSの初期症状である可能性がある[107]。62歳の女性は、COVID-19ワクチンの初回接種を受けた11日後に、両下肢の漸次的な脱力感に加えて、パラエジアとしびれが生じ、顕著な脱髄性感覚運動性多発神経炎を併発した[108]。73歳の男性は、COVID-19ワクチンの2回目の投与を受けた20日後に進行性の両下肢の脱力感を発症した。両側の腓腹筋のH反射の欠損、タンパク質とアルブミンの上昇は、初期の重合性神経障害と一致していた[109]。Patelらは、COVID-19 ChAdOx1ワクチンの初回投与を受けた3週間後に、急速に進行する上行性の筋力低下と背部痛を呈し、最終的にGBSと診断され、IVIgによく反応した症例を報告している[110]。48歳の男性は、ワクチン接種後に左側の下肢運動ニューロンの顔面脱力と重度の腰痛を発症し、多巣性感受性運動脱髄性多発ニューロパチーを示した。House Brackmannグレードは両側の麻痺がIIIからVに進展し、IVIgと経口プレドニゾロンによる治療で症状が改善した[111]。Allenらは、SARS-CoV-2ワクチン接種後に発症したGBSの知覚異常 variantを伴うbifacial weaknessの4例を報告している。この症状は、ワクチン接種後11~22日目に発生しており、これはワクチンが最大の免疫反応をもたらす時点である[112]。著しく類似した5例は、ヴァクセチアのワクチン接種後7~12日目に手足の知覚麻痺を伴う二顔面脱力を発症している[113]。さらに、インドのケララ州の3つの地区では、100~500万人のうち7人が、ワクチンの初回接種後2週間以内に重度のGBSを発症しており、これは集団として予想される1~4~10倍の発症率であった[114]。Vaccine Adverse Event Reporting Systemによると 2021年7月24日時点でAd26.COV2.Sのワクチン接種後に130例の推定GBSが確認されており、18~29歳の個人を除くすべての年齢層で、観察された対予想率が上昇していた[115]。しかし、BNT162b2 mRNAワクチンを接種したヒスパニック系の3,890,250人のコホートでは、1回目のワクチン投与後30日以内に7例のGBSが発見され、2回目の投与後には症例が発生せず、観察された発生率は0-18/100,000投与量であったことから、GBSとBNT162b2ワクチンとの関連性はまだ遠いものであることが示唆されている[116]。同様に、Lunnらは、より楽観的な40億人規模の予防接種計画を1年間にわたって実施した場合、どのような予防接種計画にもかかわらず、この期間中にGBSの68,000例が自然に発生することが予想されると提案しており、これは因果関係があるとは考えられない[117]。
前述の証拠を考慮すると、GBS症例の大部分はある種の類似した臨床的特徴を持っていた。第一に、ワクチン接種と症状の発現との間に1~3週間の間隔があることから、一時的な因果関係があると考えられる。第二に、手足の麻痺を伴う両顔面の脱力感、腰痛、脱髄性多発神経炎は、ワクチン接種後にGBSが発症した場合の共通の症状である。最後に、ほとんどの患者は予後がよく、IVIgによく反応する。
IgA 腎症
IgA 腎症は、世界的に最も一般的な原発性糸球体腎炎であり、診断後 20 年以内に 20~40%の患者が腎不全に至る。最近、COVID-19ワクチンの接種がIgA腎症の引き金になることを示唆する症例報告がいくつかある。例えば、腎臓病の家族歴のない30歳の男性は、ワクチン接種の1日後に発熱、頭痛、褐色尿を発症し、新たに血尿と蛋白尿が現れ、最終的にIgA腎症と診断された[118]。2人の健常者が、巨視的血尿を呈する直前にCOVID-19のワクチン接種を受け、それぞれIgA腎症と半月体性糸球体腎炎と診断された。1例目は、頭痛、全身の筋肉痛、新たに発症した巨視的血尿に加え、蛋白尿と血清クレアチニンの上昇が認められた。腎生検では、線維細胞性および線維性半月体を伴うIgA腎症が認められた。もう一人の患者は60歳の女性で,巨視的血尿,蛋白尿,急性腎不全を呈していた。両患者ともIgA腎症とCOVID-19感染の既往はなかった[119]。さらに、IgA腎症の患者は、ファイザーのCOVID-19ワクチン接種後、24時間以内の巨視的血尿と肉眼的血尿に悩まされており、COVID-19ワクチンが既存の自己免疫疾患の再発を悪化させる可能性も示唆されている[120, 121]。mRNAワクチンとIgA腎症の因果関係については、これまで評価されていない。COVID-19ワクチンとIgA腎症の因果関係については、まだ早急に結論づけることはできない。世界中の症例を登録した多施設共同研究や縦断的研究のみが、関連性を真に検証することができる。
炎症性関節炎
関節痛は、イランでスプートニクVのCOVID-19ワクチン接種後、30~3%の人で報告されている[122]。リウマチや筋骨格の疾患を持つ724人の患者を対象とした横断的研究では、そのうち4人がChAdOx1やBBV152のワクチン接種後に関節炎のエピソードを報告している[123]。1つ目は、慢性関節疾患とSARS-CoV-2感染の既往歴のない患者で、スプートニクVワクチン接種後に左肘窩と肩肘に中程度の胸水と小関節滑膜炎を呈し、関節炎が確認されたケースである[124]。2人目は23歳の女性で、コロナ・バック・ワクチン接種後に左膝関節の腫れと痛みを発症し、反応性関節炎と診断され、複合ベタメタゾンによる治療によく反応した[125]。3人目は38歳のアジア人女性で、他の潜在的な誘因はなく、スプートニクVワクチンの初回接種後に両膝関節と肩の痛み、こわばり、腫れを呈し、リウマチ因子、抗シトルリンタンパク質抗体、C反応性タンパクが陽性を伴ってた。彼女は初期の関節リウマチと診断され、メトトレキサート、非ステロイド性抗炎症薬、メチルプレドニゾロンで治療された[126]。4人目は49歳の男性で、ワクチンの初回接種の3日後に両側の手の痛み、腫れ、こわばりが生じ、ワクチンが引き金となった自己免疫性多発性関節炎と診断され、プレドニゾンによる治療によく反応したが、C反応性タンパク質と抗シトルリンタンパク質抗体がわずかに上昇した[127]。同様に、米国食品医薬品局(FDA)も、COVID-19ワクチン(mRNA-1273)の接種が関節リウマチの発症ともっとも関係があると認識している[128]。
その他の自己免疫疾患の症状
上述の合併症に加えて、SLE、全身性エリテマトーデス腎炎、バセドウ病などの他の自己免疫症状が報告されているケースもある。22歳の女性がCOVID-19の接種後、15日前から右膝の痛みと発熱があり、その後、10日後に多関節痛、両足浮腫、指先の皮疹、下肢の点状出血を発症し、抗核抗体陽性、免疫グロブリン値の上昇も相まって発症した。彼女はSLEと慢性疾患による貧血と診断され、プレドニゾンとヒドロキシクロロキンによる治療に良好な反応を示した[129]。23歳の女性が、AZD1222(ChAdOx1-S)ワクチンの初回接種の1週間後に、突然の眼瞼浮腫、泡状尿、ネフローゼ症候群を呈し、最終的にクラスVの全身性エリテマトーデス腎炎を伴うSLEと診断された[130]。亜急性皮膚エリテマトーデスの症例がAZD1222接種後にSLEに転換した[131]。また、SARS-CoV-2ワクチン接種後にバセドウ病が発症することがいくつかの報告で明らかになっているが、これはワクチンのアジュバントによって引き起こされる病原性免疫反応が関係していると考えられている[132, 133]。さらに、尋常性白斑と2型糖尿病の既往歴を持つ症例が、SARS-CoV-2ワクチン投与の4週間後に発熱、体重減少、無力症、甲状腺中毒を起こし、バセドウ病と1型糖尿病と診断された[134]。ワクチン接種プログラムが世界的に展開されるにつれ、新たな自己免疫現象が徐々に表面化してきている。ワクチン接種後のモニタリングプログラムと継続的なフォローアップは、因果関係を評価するためにこれらの関連性に関するデータ収集を確実に行うために必要である。
視点
さらに、我々の知る限り、COVID-19ワクチン接種後に新たに発症した自己免疫現象を体系的に検討したのは今回が初めてである。ワクチン接種の結果としての自己免疫疾患のリスクに関する情報は議論の余地があるが、我々は単にCOVID-19ワクチンに関連した自己免疫症状に関する我々の現在の理解を提案しているに過ぎない。しかし、我々はまだ多くの厳しい問題や未解決の問題を抱えている。例えば、初回のワクチン接種後に自己免疫症状が現れた患者に対して、その後のワクチン接種を継続するかどうかは議論の余地がある。さらに、ワクチンによって誘発された自己免疫疾患の診断には一般的な基準がなく、ケースバイケースで評価しなければならない。現在の課題は以下の通りである。第一に、臨床医はCOVID-19ワクチンの投与と自己免疫現象との間の因果関係を評価するために、関連性の一貫性、強さ、特異性、時間的関係などの4つの基本原則を適用する必要がある[19]。第二に、集団全体または特定のサブグループについて、ワクチン関連のリスクの程度を、対応する自然感染関連のリスクと比較する必要がある。第三に、正確な因果関係を特定し、基礎となる生物学的メカニズムを解明するために、適切な疫学研究や動物モデルが必要となる。これらの影響を受けやすい集団では、ワクチンによる自己免疫疾患のリスクと、SARS-CoV-2感染のリスクを比較検討する必要がある。以上の情報は、COVID-19ワクチン接種後の自己免疫症状の臨床的評価と管理の指針となり、予防策を講じたり、ワクチンを躊躇する気持ちを抑えたりする上で極めて重要である。
結論
上述の情報に照らし合わせると、VITT、自己免疫性肝疾患、GBS、IgA腎症などの自己免疫症状の新たな発症は、COVID-19ワクチンと関連しているようだという新たな証拠が示された(表2)。COVID-19ワクチンが自己免疫症状を引き起こすメカニズムとしては、分子模倣、特定の自己抗体の産生、特定のワクチンアジュバントの役割などが考えられている。根本的な生物学的メカニズムを解明し、正確な因果関係を特定するためには、さらなる研究が必要である。
表2 COVID-19ワクチン接種後に発生した様々な自己免疫現象
| 自己免疫現象 | ワクチンの種類 |
|---|---|
| ワクチン誘発性免疫性血栓性血小板減少症 | アデノウイルスベクターワクチンとmRNAワクチン |
| 免疫性血小板減少性紫斑病 | mRNAワクチン |
| 自己免疫性肝疾患 | mRNAワクチンとアデノウイルスベクターワクチン |
| ギランバレー症候群 | mRNAワクチンとアデノウイルスベクターワクチン |
| IgA腎症 | mRNAワクチン |
| 自己免疫性多発性関節炎 | mRNAワクチン |
| 関節リウマチ | mRNAワクチンとアデノウイルスベクターワクチン |
| バセドウ病 | mRNAワクチン |
| 1型糖尿病 | mRNAワクチン |
| 全身性エリテマトーデス | アデノウイルスベクターワクチン |
治療法に関しては、ワクチンによる自己免疫の標準的な治療法は現在のところ定義されていない。前述のエビデンスに基づき、特定の自己免疫疾患の診断が確定したら、リウマチ性疾患には疾患修飾性抗リウマチ薬(DMARD)非ステロイド性抗炎症薬(NSAID)グルココルチコイド、ギラン・バレー症候群には免疫グロブリン静注、自己免疫性肝疾患やSLEにはプレドニゾンなどの対症療法を行うべきである。なお、VITTの患者には、ヘパリンを含まない抗凝固剤や免疫グロブリンの静注が推奨されている。
ワクチンに対するアレルギー反応はまれであるが、ワクチン接種プログラムが世界的に展開されているため、ワクチンに関連する多くの副作用が報告されている。重要なのは、COVID-19による大量のワクチン接種が、COVID-19のパンデミックを抑制し、COVID-19の罹患率や死亡率を予防する上で、圧倒的な効果を発揮することを否定することではない。我々は、国民の間に免疫の壁を作るために、COVID-19のワクチン接種を世界的に奨励し、支持する。自己免疫事象の体系的なモニタリングと継続的なフォローアップは、自己免疫症状とCOVID-19ワクチン接種との間の潜在的な関連性、特定の診断メカニズム、および将来のワクチン接種のためのリスク層別化を特定する上で非常に重要だ。また、収録された文献のほとんどは症例報告または横断的研究で、一時的な関連性しか示されなかった。このレビューの限界にもかかわらず、これらの報告はCOVID-19ワクチン接種後の自己免疫症状の臨床評価と管理の指針となる可能性がある。
利害の衝突
著者らは、競合する利益がないことを宣言する。
著者の貢献
HFPとDQYが本レビューを構想した。PWが文献検索を行った。XMLとZWSが監修を行った。YCとZXは第1稿を作成し、原稿を編集した。著者全員が前のバージョンの原稿にコメントし、最終原稿を読んで承認した。
