Contents
Neuroanatomical spread of amyloid β and tau in Alzheimer’s disease: implications for primary prevention
www.ncbi.nlm.nih.gov/pmc/articles/PMC7048875/
要旨
アルツハイマー病は、症状発現の何年も前から始まる連続的な病態生理学的変化の理解が進んでおり、臨床的には個別の臨床段階では十分に説明できないが、臨床的にはそれに先立つ生物学的変化の連続性も含めて説明すべきであることが明らかになってきている。利用可能なバイオマーカーと臨床的評価の縦断的な変化を共同で考慮することで、個人内での変化を一つの連続した疾患進行の指標に統合し、初期の病態生理学的変化を特定することが可能となる。
疾患の重症度の指標である疾患時間は、画像データ、バイオマーカー、神経心理学的データの配列に適用したベイジアン潜在時間共同混合効果モデルを用いて推定された。アミロイドβおよびタウのPET取り込みの軌跡は、疾患時間の関数として推定された。初期にアミロイドβの上昇の兆候がみられた領域は、初期の局所的な複合体を形成するために使用され、別の検証サンプルでは一般的に使用されているグローバル複合体と比較された。アミロイドβおよびタウPETデータを用いて、279人(認知機能障害者183人、軽度認知障害61人、アルツハイマー病認知症患者35人)を対象に疾患時間を推定した。
アミロイドβPET値は後帯状体と前帯状体で高い値を示し、病期が長くなるとすぐに上昇する。
タウPET値の初期上昇は、下側頭葉、扁桃体、上側頭溝堤、内耳皮質、中側頭葉、下側頭頂葉および房状回で認められた。
認知障害のない188人の別の検証サンプルにおいて、初期の局所アミロイドβPET複合体は、グローバル複合体と比較してアミロイドβの蓄積率が120%増加し(P < 0.001)一次予防試験デザインにおける治療効果を検出する力が60%増加した。
連続的な疾患時間スケールで参加者をオーダーすることで、アミロイドβおよびタウ病理の初期徴候の検査が容易になる。アミロイドβ病理学の早期変化を検出するためには、アミロイドβ蓄積の初期の部位に焦点を当てることで、初期のアルツハイマー病におけるより強力で効率的な試験デザインが可能となる。特に、一次予防と二次予防に焦点を当てた研究分野へと移行する中で、アミロイドβに関連した研究の対象となるしきい値を再検討するために、標的複合体を使用することが可能である。また、アミロイドβ治療薬の臨床試験では、アミロイドβおよびタウの病態が最小限であり、短期的な蓄積が限られている集団において、アミロイドβおよびタウの変化に対する薬剤効果を推定する際に、焦点を絞ったコンポジットを用いることが有益であると考えられる。
キーワード:アミロイドβ、タウ、アルツハイマー病、一次予防
グラフィカルアブストラクト
序論
伝統的に、アルツハイマー病は、主に離散的な臨床段階の観点から説明されていた。しかし、症状発症の何年も前から始まる連続的な病態生理学的変化の理解が最近進歩したことにより、アルツハイマー病は臨床段階によって適切に記述することはできないが、疾患の臨床的表現に先行し、その下敷きとなる生物学的変化の連続体を取り入れるべきであることが明らかになってきた(Aisen et al 2017)。アルツハイマー病の進行を重なり合う病理学的変化とその後の臨床的変化の連続体として概念化することは、疾患の時間経過の現実的な検討を容易にするであろう。初期のバイオマーカーの変化から重度の機能障害に至るまでのこのタイムコースを明確にすることは、正確な早期診断、臨床試験への登録、疾患のモニタリング、そして最終的な疾患の予防と管理に不可欠である。
アルツハイマー病治療を成功させる可能性が最も高いのは疾患の初期段階であり、初期のバイオマーカーの変化を詳細に理解する必要がある。かなりの証拠は、フィブリル性アミロイドβ(アミロイドβ)の蓄積と、病理学的病変である高リン酸化タウの凝集体が、初期のアルツハイマー病バイオマーカーの変化として確認されていることを示している。本研究では、アルツハイマー病における初期の神経病理学的変化の時間的経過についてより詳細な情報を提供するために、アミロイドβとタウの病理学的発達の初期段階に焦点を当てている。神経心理学的、イメージング、バイオマーカーデータの配列の縦断的変化を共同で考慮することで、個人内の変動と複数の転帰間の関連性が同時に、疾患進行の単一の連続的な尺度に統合される(Donohue et al 2014; Li et al 2017,2018)。疾患連続体上の各参加者の位置、すなわち「疾患時間」の推定値を用いて、脳全体のアミロイドβおよびタウ病変の空間的変化の時間的順序を推定しようとした。病的変化を示す最も初期の領域を特定した後、別の検証サンプルで、仮説的な一次予防と二次予防の臨床試験の設定で、これらの初期領域の性能を検証した。
材料と方法
参加者
データはAlzheimer’s Disease Neuroimaging Initiative(アルツハイマー病NI)データベース(adni.loni.usc.edu, www.adni-info.org)から入手した。この研究は、参加しているすべての機関の機関審査委員会によって承認された。インフォームドコンセントは、各施設のすべての参加者から書面による同意を得た。本研究の対象者には、アミロイドβとタウPETの両方を測定したアルツハイマー病NIの参加者が含まれている。ベースライン時に認知障害なし(CU)アミロイドβ+軽度認知障害(MCI)またはアミロイドβ+アルツハイマー病認知症であった利用可能なすべての参加者が含まれ、ここでアミロイドβ+は以前に確立された閾値(SUVR=1.10)(Joshi et al 2012)を用いて定義された。障害のあるアミロイドβ-の参加者は、表向きにはアルツハイマー病とは無関係な障害のため除外された。
別の検証サンプルには、タウPET情報が欠落しているため解析の最初の部分に含まれていなかったアミロイドβの測定値を持つCU アルツハイマー病NI参加者が含まれていた。
PET画像および脳脊髄液 アミロイドβ
アミロイドβ(18F-florbetapir)PET画像データおよび処理方法は以前に述べた(Landau er al )20のアミロイドβPET関心領域(ROI)を分析した:下側頭葉、中側頭葉、上側頭葉、前庭、辺縁上回、下側頭頂葉、上側頭頂葉、帯状体前庭、後側頭葉、尾側頭葉、吻側頭葉、前帯状体前野、オペキュラーパーズ、三角パーズ、眼窩パーズ、尾側頭葉と吻側頭葉の中前頭葉、内側頭頂葉と外側頭頂葉、前頭極と上前頭葉である。
タウ(18F-flortaucipir)PET画像データを取得し、処理する方法は、以前に記載されていた(Maass et al 2017)。30個のタウROIを分析した。扁桃体、内耳皮質、傍海馬、房状部、上側頭溝(BSTS)のバンク、横側頭葉、側頭極、下側頭葉、中側頭葉、上側頭葉;帯状帯状島、前庭、辺縁上回、下側頭頂葉、上側頭頂葉。眼窩静脈、三角静脈、オペキュラー静脈、前頭葉の外側と内側、前頭葉と傍頭葉、吻側、尾側、中頭葉と上前頭葉、およびクネリアス、舌側、腓骨周囲、および外側後頭葉。PET取得および解析の詳細については、http://adni.loni.usc.edu/methods/ を参照のこと。
脳脊髄液サンプルは、xMAP Luminexプラットフォーム上のAlzBio3アッセイ(Fujirebio, Ghent, Belgium)を用いて脳脊髄液 アミロイドβ42について分析され、以前に記載されている(Olsson er al)。 脳脊髄液 アミロイドβ<192 ng/Lは脳脊髄液 アミロイドβ+と定義された。
統計解析
以前に記述され、推定されたような離散的な診断カテゴリーに代わる連続的な疾患時間(Donohue et al 2014;Li et al 2017,2018)を、アミロイドβおよびタウPET(疾患時間の推定には使用されていない)における局所的な取り込みの広がりをモデル化するために使用した。疾患時間は、ベイズ潜時共同混交効果モデル(LTJMM)から推定された疾患重症度の尺度である。簡単に言えば、被験者i(i = 1, …., n)アウトカムk(k = 1, …., p)時刻t[ijk](j = 1, …., qik)の場合、モデルは次のような形式である。
![]()
ここで、yijkは観察結果、x′t[ijk]は予測因子のベクトル、βkは固定効果、γkは疾患時間の傾き、t[ijk]+δiはシフトした疾患時間、αはランダム効果、εは多変量ガウス残差である。共同モデル化されたアウトカムには、認知データ(13項目のアルツハイマー病評価スケール、認知サブスケール、ミニ精神状態検査、機能活動質問票、Rey聴覚視覚学習テスト、CDR Sum of Boxes、Preclinical Alzheimer Cognitive Composite)が含まれていた。脳脊髄液データ(アミロイドβ、リン酸化タウ、総タウ)MRIボリューム(海馬、内嗅野、海綿体、中側頭回、脳室、全脳ボリューム)脳内のグローバルなアミロイド負荷とグルコース代謝のPETイメージング。LTJMMは、異なるマーカー間の依存性を考慮しながら、疾患の重症度を推定する。モデリングに先立って、アウトカムはクオンタイルに変換され、その後、逆ガウス累積分布関数を介して再びZスコアに変換される。詳細はLi et al 2018)を参照のこと。
PET ROIにおける縦断的取り込みと疾患時間との関係を、ランダム切片を用いた混合効果モデルを用いて検討した。疾患時間に関する直線性からの逸脱を捕捉するために、自然スプラインを使用した。スプラインノットは疾患時間の中央値と境界に配置され、赤池情報基準によってノット数が選択された。PET反応は、年齢、性別、アミロイドβROIについては小脳全体の平均アミロイドβPET取り込み量、タウROIについては下小脳灰白質の平均タウPET取り込み量を共分散した。
我々は、位置分散図を使用して、ROIの時間的順序を表現した。疾患時間軸上の特定のポイントについては、ROIはPETの取り込みによって順序付けられた。位置分散図は、特定のROIが中央の順序の特定の位置に現れる500個のブートストラップサンプルの割合を示している。位置的分散は、アルツハイマー病認知症診断の推定時期の15年、10年、5年前に評価した。
アミロイドβとタウ病理の早期発症をさらに調べるために、疾患時間の小さな増加に伴う平均取り込み量の変化(取り込み曲線の初導関数)をプロットし、疾患時間の経過とともに蓄積の地域的な傾きがどのように加速されるかを示した。疾患時間のスペクトルの初期に平均取り込み量が高く、疾患時間の進行に伴って増加し続けるアミロイドβ領域を、検証サンプルでさらに評価した。脳脊髄液 アミロイドβ-CU参加者と脳脊髄液 アミロイドβ+CU参加者のサンプルにおいて、初期取り込みを有する領域の複合体のベースラインおよび縦方向の変化を、一般的に使用されているグローバル複合体(前頭葉、頭頂葉、側頭葉および帯状回全体の領域から構成される;Landau et al 2012)と比較した。初期推定値とグローバル推定値の間のベースラインおよび蓄積率の差は、ブートストラップ推定標準誤差を用いたt検定を用いて検定した。
仮説的な一次予防試験および二次予防試験におけるアミロイドβ PETエンドポイントの検出力を推定するために、混合モデル推定値を用いて、サンプルサイズの範囲、アミロイドβ蓄積率の100%低下、12ヵ月の受診間隔、脱落率30%を仮定した24ヵ月の臨床試験の検出力を算出した。
診断と人口統計学の間の関連は、連続変数についてはWilcoxonの順位和検定を用い、カテゴリカル変数についてはFisher’s Exact検定を用いて評価した。すべての解析はR v3.5.1 (www.r-project.org)で行われた。
データの利用可能性
すべてのデータは adni.loni.usc.edu/ で公開されている。
結果
コホートの特徴
CU 130名(アミロイドβ-102名、アミロイドβ+81名)アミロイドβ+ MCI 61名(追跡期間中にCUからMCIに進行した10名を含む)アミロイドβ+ アルツハイマー病 35名(MCIからアルツハイマー病に進行した28名を含む)を解析対象とした。平均追跡期間は4.0年(SD=2.6)であった。77名の参加者がアミロイドβPETスキャンを1回、25名が2回、77名が3回、100名が4回以上のスキャンを受けた。19人の参加者にタウPET検査が1回、52人に2回、8人に3回の検査があった。参加者の平均年齢は72歳(55~90歳)145人(52%)が女性で、平均教育年数は16.5年(12~20歳)114人(42%)がAPOEε4キャリアであった。人口統計を表1にまとめた。
表1人口統計学とベースライン疾患時間
| 特性 | CU | pCU | EMCI | LMCI | 広告 | |
|---|---|---|---|---|---|---|
| (N = 183) | (N = 10) | (N = 30) | (N = 21) | (N = 35) | P値 | |
| 年齢 | 71.5(5.9) | 77.0(6.3) | 69.9(6.6) | 70.5(7.6) | 74.0(7.3) | 0.01 |
| 性別、女性、n(%) | 105(57.4) | 6(60.0) | 7(23.3) | 10(47.6) | 17(48.6) | 0.01 |
| 教育(年)、n(%) | 16.9(2.4) | 16.4(2.8) | 15.9(2.9) | 16.2(2.6) | 15.6(2.6) | 0.03 |
| APOE ε4+、N(%) | 59(32.8) | 5(50.0) | 20(66.7) | 13(61.9) | 17(50.0) | <0.01 |
| 病気の時間(年)、n(%) | -11.5(3.0) | −8.4(1.7) | −9.3(3.0) | −4.4(4.0) | −3.4(3.9) | <0.01 |
疾患時間
疾患時間は、各個人について推定された(Li er al)。 疾患時間は、アルツハイマー病認知症診断への進行の平均観察時間を中心にしており、疾患時間=0で解釈可能な指標とした。 平均疾患時間は-10であり、-18から6までの範囲であった。診断別の疾患時間の分布を図1に示し、表1にまとめた。アルツハイマー病への進行が観察された28人の参加者において、推定疾患時間とアルツハイマー病への進行との相関は0.74(P<0.001)であった。
図1 疾患時間の分布
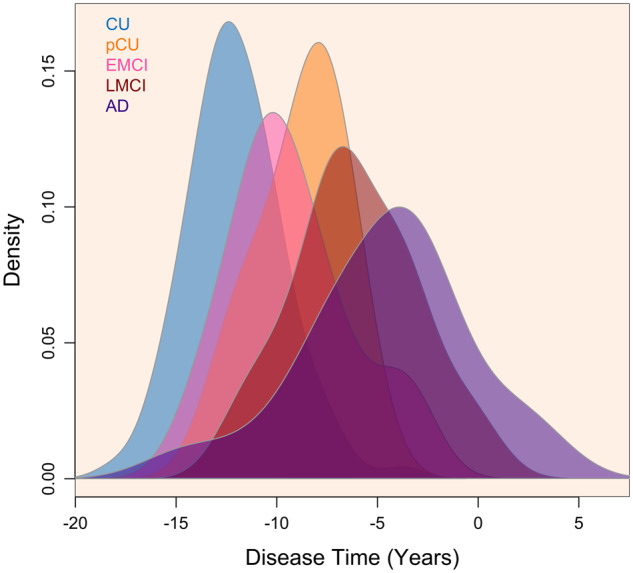
ベースラインの疾患時間の分布を診断別に示す(pCU:CUからMCI進行者、EMCI:早期MCI、LMCI:後期MCI、アルツハイマー病. アルツハイマー病:アルツハイマー病認知症)。) 疾患時間は、時間0がMCIから認知症への進行の平均時間に対応するように再中心化した。
局所アミロイドβとタウPET
図2は、すべてのアミロイドβとタウのPET ROIの軌跡を病変時間に対してプロットしたものである。以下に詳述するように、いくつかのパターンが現れている。いくつかのアミロイドβPET領域では、疾患時間に対して初期に高い上昇を示し、疾患時間がアルツハイマー病診断時に近づくにつれて上昇を続けているという同様のパターンを示している。これらの領域の初期の変化を特徴づけるためには、より若いサンプルが必要である。このパターンは後帯状体と前帯状体で最も顕著である(図2AとB)。高レベルの取り込みは、最初は帯状帯状島、下頭頂部、外側眼窩前頭前皮質にも見られたが、増加はより緩やかであった。タウのPET領域では、初期レベルが高く、急激な増加を示すこのパターンを示すのは、側頭葉下部であった。内嗅野もまた、房状葉、中側頭葉、下側頭頂葉と同様に急峻なタウの増加を示した。扁桃体とBSTSでは、初期のタウ取り込み量は高いが、増加は緩やかであった。
図2 アミロイドβおよびタウPET ROI
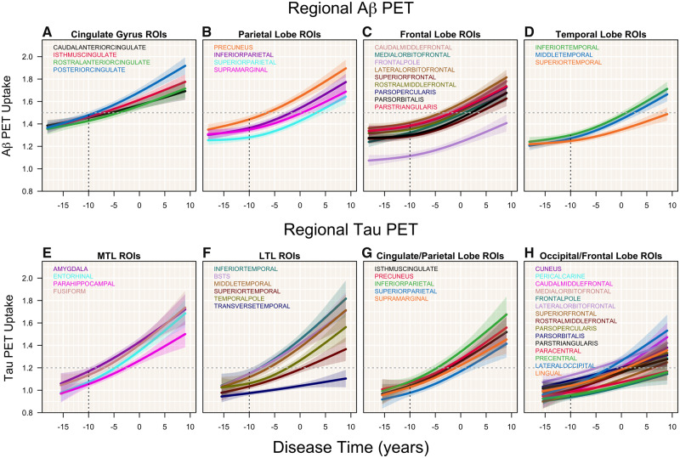
アミロイドβおよびタウPET ROIの平均取り込み軌跡を、網掛けの領域で示された95%信頼区間とともに疾患時間に対してプロットした。アミロイドβのROIはA-Dに示され、各葉の個別のプロットで示されている。タウのROIはE-Hに示されている。
いくつかの選択されたROIの取り込みのスパゲッティプロットを図3に示す。疾患時間の経過とともに蓄積がどのように加速されているかをより詳細に調べるために、図4に疾患時間に対する取り込み曲線の最初の導関数をプロットした。これらのプロットは、疾患時間がわずかに進んだ場合の取り込みの変化を示している。後帯状体と帯状体基底部は、疾患時間に対するアミロイドβ取り込みの初期増加率が最も高いことを示している。しかし、帯状回島胸部の増加率は時間の経過とともに最小になる。同様のパターンが尾部前帯状体で見られる。他の領域、特に前楔前野、中間側頭葉、外側眼窩前頭前皮質では、大きな率の増加が見られる。
図3 アミロイドβおよびタウPET ROIを選択する
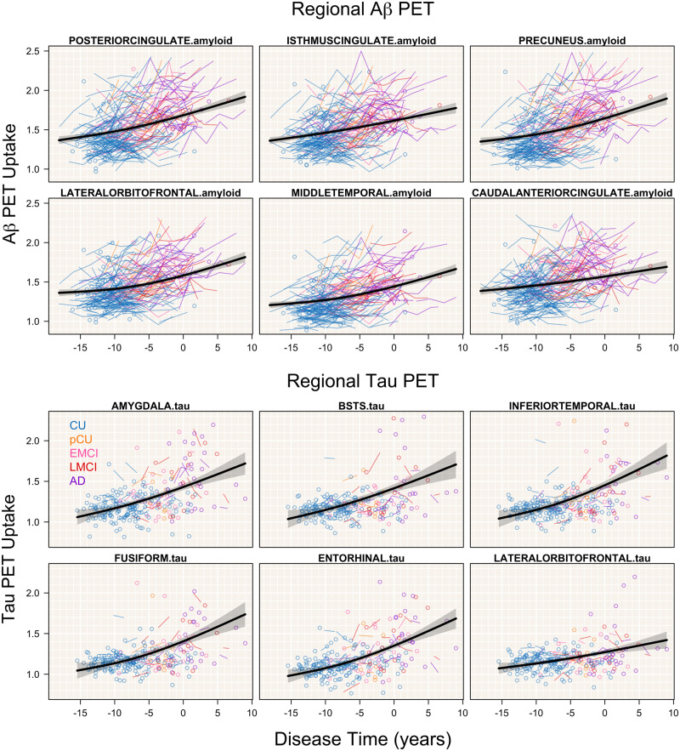
主要なアミロイドβおよびタウPET ROIの平均取り込み軌跡が、診断ごとに色分けされた観察された被験者レベルのデータとともに、疾患時間に対してプロットされている。95%信頼区間は網掛けの領域で示されている。
図4 PET取り込みの変化
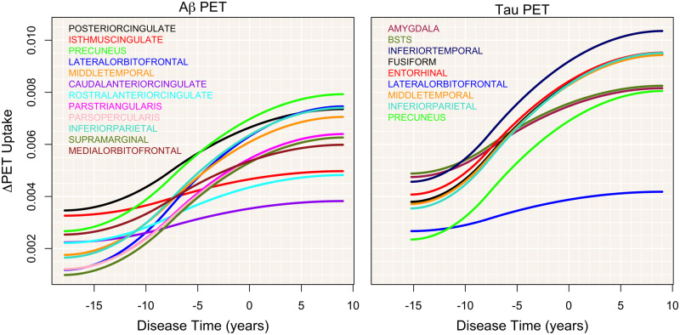
PET 吸収曲線の初導関数は、いくつかの主要なROIについて、疾患時間に対してプロットされている。疾患時間のわずかな増加に伴う平均取り込み量の変化は、蓄積の傾きが疾患時間の経過とともに加速することを示している。アミロイドβのROIは左に、タウPETのROIは右に示されている。
初期のタウ取り込み勾配は、扁桃体、BSTS、下側頭葉で最も急峻である。しかし、下側頭葉ではすぐに加速し、扁桃体とBSTSの両方でプラトーが始まる。内耳皮質、海綿状回、中側頭葉では初期の傾斜が緩やかであるのに対し、下側頭葉と同様にすべてが加速し始める。
順番
図5は、アルツハイマー病診断10年前(疾患時間=-10)の全PET ROIの取り込み順の位置分散図を示したものである。アルツハイマー病診断の10年前、平均取り込み率が最も高かったアミロイドβPET ROIは、後帯状体、帯状体島、帯状体尾部前帯状体、前帯状体前部であった。また、平均取り込み量が最も多かったタウのPET ROIは扁桃体、下側頭葉、BSTS、房状回であった。内耳皮質は疾患時間の経過とともに傾きが増加したため、アルツハイマー病診断5年前には順位の上位半分に移動したが、それ以外は15年前とアルツハイマー病診断5年前には順位は安定していた(補足図1,2)。
図5 位置分散図
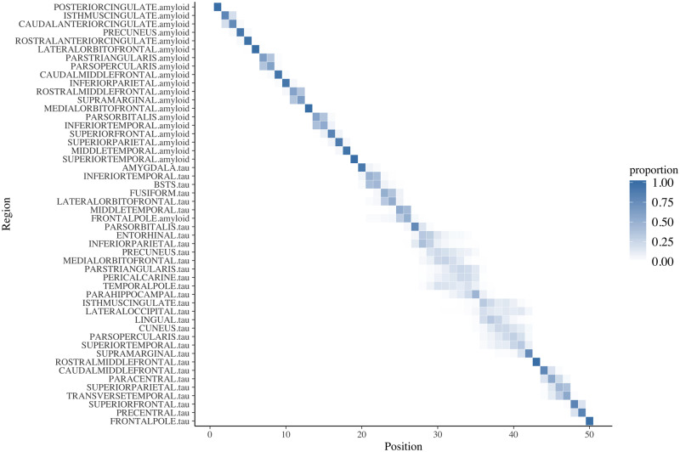
疾患時間(疾患時間 = -10)に対するすべてのROIの順序が、ダイアグラムの対角線上に示されている。位置分散図は、500個のブートストラップサンプルのうち、特定のROIが中央の順序の特定の位置に現れる割合を示しており,0(白または網掛けなし)から1(青網掛け)までの範囲である。ROI は,陰影の透明度によって不確実性を捉えた上で,最も頻繁に推定された位置から順番に並べられている.初期のアキュムレータは左上に、最新のアキュムレータは右下に表示されている。青色の実線は、順番の位置に関して確実性が高いことを示し、透明度が高いほど確実性が低いことを示し、ブートストラップで推定されている。
検証サンプルにおける初期のコンポジット性能
LTJMMモデルで選択した領域の性能を評価するために、脳脊髄液 アミロイドβ-群111名と脳脊髄液 アミロイドβ+群77名の外部検証サンプルを用いた。検証サンプルの平均追跡期間は2.7年(アミロイドβ-群2.8年、アミロイドβ+群2.5)であった。参加者は平均74歳、女性51%、平均学歴16年、APOEε4+が23%であった。
初期の取り込みパターンに基づいて、後帯状体と楔前部の体積加重平均を用いて初期のアミロイドβ PET複合体を作成した。検証サンプルのアミロイドβ-CU参加者では、グローバル複合体と比較して、ベースライン時の初期複合体でのアミロイドβ取り込みが有意に多かった(1.25対1.19,SE = 0.005,P < 0.001)。アミロイドβ-CUでは、グローバル複合体では0.003/年(95%CI:-0.0001~0.006,P=0.06)であったのに対し、初期複合体では0.006/年[95%信頼区間(CI):0.003~0.09,P<0.001]の割合でアミロイドβ取り込みが蓄積されていた。初期複合体における蓄積率は、アミロイドβ-CU参加者ではグローバル複合体の2倍以上(120%増、P<0.001)であった。
アミロイドβ+CUでは、ベースライン時の初期複合体の蓄積率はグローバル複合体と比較して有意に高かった(1.65対1.50,SE=0.01,P<0.001)。初期複合体の蓄積率は0.013/年(95%CI:0.003,0.023,P = 0.01)であり、グローバル複合体の蓄積率0.012/年(95%CI:0.003,0.020,P = 0.01)と有意差はなかった。ベースライン推定値と変化推定値のプロットを図6A-Dに示す。
図6 初期およびグローバル複合体の推定値と臨床試験力
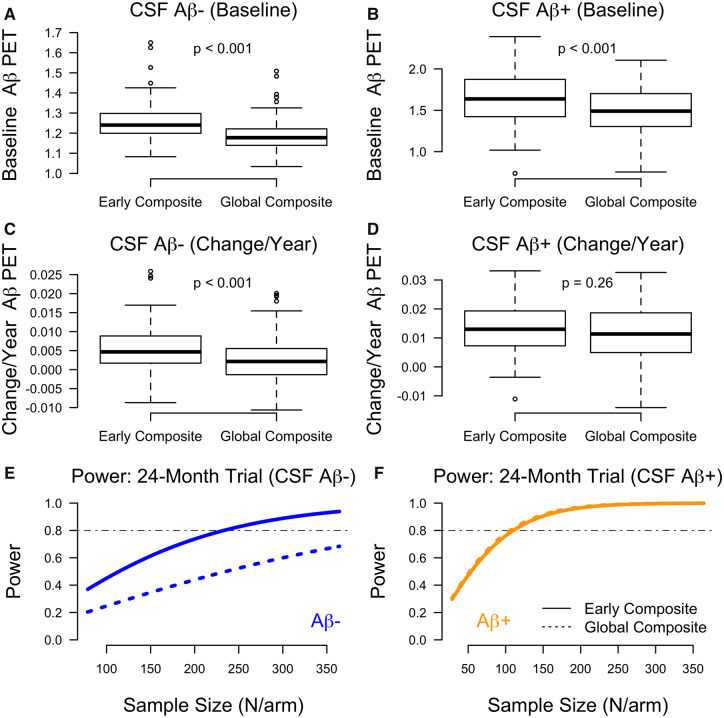
バリデーションコホートにおける初期およびグローバル複合体におけるアミロイドβPET取り込み量の推定値のボックスプロット。AおよびBは、それぞれ脳脊髄液 アミロイドβ-および脳脊髄液 アミロイドβ+のベースライン推定値を示す。CおよびDは、脳脊髄液 アミロイドβ-および脳脊髄液 アミロイドβ+参加者のアミロイドβ PET取り込み率推定値(アミロイドβ PET取り込み率の変化/)を示す。一次予防(アミロイドβ-、E)および二次予防(アミロイドβ+、F)について、早期およびグローバル複合体についてのサンプル数別の臨床試験力のプロット。
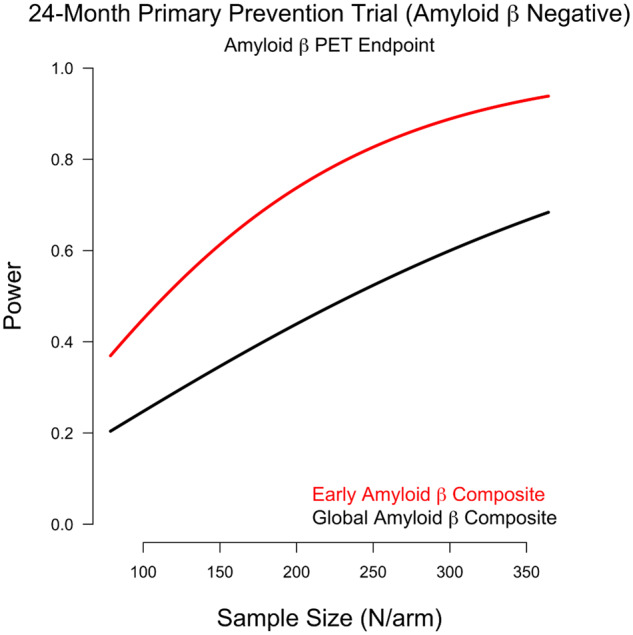
一次予防および二次予防試験の検出力計算
アミロイドβ-CU参加者を対象とした24ヵ月間の一次予防試験において、アミロイドβ沈着の遅延を検出するために80%の検出力を得るためには、初期複合体を用いて233人/群の被験者が必要である。233 人/群の被験者でグローバル複合体を使用すると検出力は 50%となり、80%の検出力を得るためには 481 人/群の被験者が必要である。
アミロイドβ+CU参加者を対象とした24ヵ月間の二次予防試験でアミロイドβ沈着の遅延を検出するために80%の検出力を得るためには、初期複合体を用いて110人/群の被験者が必要である。同様に、グローバル複合体を用いて80%の検出力を得るためには、106人/腕が必要である。仮説的な治療試験のために必要なサンプル数による検出力のプロットを図6EとFに示す。
議論と結論
アルツハイマー病における初期のバイオマーカー変化の詳細が明らかになるにつれ、人工的な境界を持つ離散的な段階に頼ることなく、病気の進行を自然な連続体で考えることで、病気の早期発見と診断が改善される可能性がある。バイオマーカーと臨床データを統合して、病理学的なタイムライン上の各個人の位置を決定することで、病気の進行における初期の変化を正確に検出し、調べることができる。図1では、疾患時間分布のピークが臨床段階と一致しているが、個人をバラバラにグループ化した場合には無視できない大きなばらつきが重なっていることがわかる。図2に示すように、後帯状体と前帯状体ではアミロイドβPETの取り込みレベルが高く始まり、病期の進行に伴ってすぐに上昇し、次いで前頭葉の複数の領域、特に外側前頭葉眼窩野、そして頭頂部のいくつかのROI(PET関心領域)で、軌道の交差はほとんど見られない。これらの領域は、後帯状体、前帯状体、上前頭葉、前頭前野、下側頭葉、中側頭葉に一貫して見られる初期のアミロイドβ蓄積の最近の複数の独立した報告と一致する(Villemagne er al 2011; Vlassenko et al 2011; Mormino et al 2012; Villain et al 2012; Sojkova et al 2013; Cho et al 2016; Palmqvist et al 2017,Mattsson et al 2019c)。)
同様に、下側頭葉、扁桃体、BSTS、房状回、さらには内耳皮質、下頭頂葉、中側頭葉、前庭でもタウPET取り込みの早期上昇と増加が認められた。内側側頭葉の複数のROIでの取り込みがわずかに高く始まり、早期に加速し、その後、外側側頭葉と頭頂葉のROIが続いている(図2と3)。これらの領域は、タウPETの早期上昇を示しており、主に下側頭葉、房状皮質、内嗅皮質、扁桃体、傍海馬、中側頭葉で一貫して上昇していることを示すいくつかの報告と一致している(Cho et al 2016; Johnson et al 2016; Schöll et al 2016; Vemuri et al 2017; Schultz et al 2018; Mattsson et al 2019b)。
アミロイドβおよびタウPETの両方のROIの順序は、疾患時間スケールの異なる断面においてほぼ安定しており、内耳皮質での取り込みが疾患時間を越えて急速に加速され、順序が上に移動することを除いては、ほとんど変化しない。いくつかのROIでは、最初は上昇しているが、疾患の重症度が進むにつれて緩やかに上昇している。これは馬尾前帯状体や吻側前帯状体を含むいくつかの前帯状体領域のアミロイドβ取り込みに関しても同様である。同様に、側方眼窩前頭前野や三角広場などの前頭前野のいくつかの領域では、早期にタウ取り込みの上昇を示すが、側頭前野や頭頂前野のように同じ速度では上昇しない。
観察された初期の取り込みパターンは、ターゲットとなるアミロイドβ複合体の候補となるROIとして、後帯状体と前帯状体を示唆している。検証サンプルでは、初期の複合体におけるアミロイドβ取り込み率は、脳脊髄液 アミロイドβ-参加者のグローバル複合体で観察された率の2倍以上であった。一般的に使用されているグローバル複合体を後帯状突起と前帯状突起のみを含むように合理化することで、アミロイドβ取り込み率が2倍になったことで、一次予防臨床試験における仮説的な治療効果を検出する推定力が60%向上した。脳脊髄液 アミロイドβ+の参加者では、アミロイドβ PET取り込み率に差はなく、初期複合体から除外された領域が、現在、初期複合体で観察されたのと同様の速度で蓄積されていることが示唆された。このような初期複合体を用いて、特に二次予防および一次予防に焦点を当てる分野へと移行する中で、アミロイドβ関連試験の対象となる閾値を再検討することが可能である。抗アミロイドβ治療薬の臨床試験では、アミロイドβの沈着が少なく、短期的に予想される蓄積が限られている集団におけるアミロイドβの変化に対する薬物効果を推定する際に、初期のアミロイドβ複合体を使用することが有益であろう。
同様に、下側頭葉、内耳皮質、扁桃体、BSTS、中側頭葉、下頭頂葉および房状回からなる初期のタウ合成物は、初期のタウ変化を検出するのに役立つ可能性がある。このような複合体のさらなる証拠を提供し、初期のアミロイドβ変化、神経変性、認知症状の発症と相関するように最適化できるかどうかを確認するためには、追加の縦断的タウPETデータが必要となるであろう。
この研究は、65歳未満の参加者を対象とした追跡調査という点で制限されている。初期変化を正確に推定するには、より若いコホートに焦点を当てた追加の縦断的追跡調査が必要である。アミロイド調節障害の血液ベースの測定(Nakamura et al 2018;Schindler et al 2019)や神経変性(Mattsson et al 2019a)などの新たなバイオマーカーをこの取り組みに組み込むことは、アルツハイマー病の経過をさらに明らかにすることになるだろう。
バイオマーカー、画像データおよび認知データから共同で推定された連続的な疾患時間スケールで参加者を順序付けることは、最も健康な参加者におけるアミロイドβおよびタウ病理の最も早い徴候の検査を容易にし、疾患の根底にある病態生理学的プロセスの概念化を通知する。沈着が開始される脳領域の順序を特定することは、病気の進行を検出し、モニターするために最適化されたアミロイドβとタウの複合体の設計に役立ち、アルツハイマー病における実行可能な予防研究の設計を容易にする。
