コンテンツ
‘Methodolatry’, RCTs, and the Limits of Reductionism: Part 1

はじめに
“Methodolatry”(方法崇拝):調査をする唯一の有効な方法としてのRCTの崇拝は、他の情報ソースからの貴重な提供を却下したり割り引いてしまう。オックスフォード英語辞典の検索による、methodolatryでは残念なことに、うまくいっていないことがわかる。
新語の提案 「Methodolatry」(方法崇拝)
刻々と変化していく詳細と過去の否定的な結果を無視し、手法を無批判に採用し崇拝すること
生物医学モデルでは、無作為化、二重盲検、プラセボ対照試験は「ゴールドスタンダード」の試験デザインであり、結論を出すための理想的な研究方法論と考えられている。これが現状として疑う余地なく受け入れられていることを考えると、そのような説明さえ冗長に聞こえる。
しかし、科学的調査の目的とは何であろうか?
確実に、どのような分野かに関係なく、研究者からの一般的な答えは次のようなものであろう:
「私たちを「真実」に近づけるが近似的であることを理解し、実践的な情報を提供するためにその情報を使用すること」
栄養学のエビデンス周辺の会話の多くは、RCTが適用される方法として、それは奇妙な二重エージェントの役割を担っている。一方で科学的な調査の対象としての栄養に関する純粋に説明的なRCTデザインの限界が認められており分野内で多くの議論の対象となっている。
分野の外では、このことは完全にひっくり返される:RCTの適用による科学的調査の対象としての栄養学の限界は多くの不満の対象となっており、その分野のすべては「ノイズ」だと生物医学の純粋主義者は主張している。[参照:Ionnidis、ジョン]。
これはやや奇妙な議論だ。問題は主題にあり主題を調査する方法ではないということだ。これは明らかにドグマ的症状であることを明示している。
生物医学のドグマが健康と生物科学の中の他の分野に投影されたのは、これが初めてではない。1970年代には、生物医学的モデルと精神医学的調査との間に断絶があったことから、ジョージ・L・エンゲルは、精神医学の調査パラダイムとしての生物精神社会モデルの進化を呼びかけた画期的な論文(1)を発表した。
エンゲルは、生物医学的モデルを次のように特徴づけた。
広く定義すると、モデルとは自然現象を説明するために利用される信念体系以外の何物でもない。
私たちが直面しなければならない歴史的事実は、現代の西洋社会において、生物医学は病気を科学的に研究するための基礎を提供してきただけでなく、病気に対する私たち自身の教養的な特定の視点にもなってきたということだ…
このようにして、生物医学的モデルは教養的に必要不可欠なものとなり、その限界は容易に見過ごされるようになった。要するに、このモデルは今ではドグマの地位を獲得してしまっているのだ。科学では、モデルがすべてのデータを適切に説明できない場合、モデルは修正されたり、放棄されたりする。一方で、ドクマは、矛盾したデータがモデルに適合するように強制的に要求されるか、または除外されることを要求する。
我々は、今日の栄養科学の多くの問題において、明らかにエンゲルの論文が正しいことを理解している。食事と病気の関係を調査するための生物医学モデルの限界は、しばしば見落とされている。それは、このモデルは、食事-病気の関係を含むすべての健康科学の研究のための教養的な必須事項であると仮定されている。
生物医学的純粋主義者は、データに適合するようにモデルを修正するのではなく、モデルに適合するようにデータを強制的に修正することを要求する。調査のための「教養的な必須条件」はRCTだ。他の形態のエビデンスは割引きされ、しばしばRCTが自動的に因果関係を証明すると仮定され、RCTの所見が観察研究と異なる場合、後者は「間違っている」に違いないという意味合いで、デフォルトではRCTからのいかなる所見も正しくなければならないと仮定されている。
還元主義と栄養科学(2-4)の過度のRCT崇拝の方法論的偏見の意義申し立てが増加しているが、これらの仮定はめったに挑戦されることはない。網羅的ではないが、この誤解されたモデルで生じるいくつかの重要な問題に焦点を当ててみよう。
1) 生物医学的RCTは説明的だ
調査の生物医学的モデルは、還元主義の指導原理と、標的レベルで介入するための分子メカニズムの解明に基づいている。二重盲検化、厳格なプラセボ対照、無作為化を強調することは、試験が強い内部妥当性を持つため、すなわち介入が結果を引き起こしたと確信するためには満たされなければならない前提条件と仮定に基づいている。
これはモデルの主な目的である薬物介入の試験を反映している。このモデルでは、ある化合物が特定の薬物動態および薬力学的プロファイルを持ってデザインされ、生理機能の特定の側面に標的を絞った効果を持つようにデザインされている。特定の経路に作用する単一の化合物で、特定の結果を得ることができる。
強い内部妥当性を持つRCTの特徴の全範囲が絶対的なものとして考えられているが、実際には無作為化試験は純粋に説明的なもの(生物医学的RCT)から実用的なもの(生物心理社会モデルでしばしば使用される)まで連続して存在している(5)。実践的試験は「外部妥当性」を重視し、定義上は盲検化されておらず、実生活の条件下で実施される。二重盲検プラセボ対照無作為化試験は内部的妥当性を重視しており、より確信を持って実証可能な因果関係が得られるように、これらのデザイン条件に強く準拠することが望まれている。
:Aは原因Bの原因となる。このデザインでは、単一のエンドポイントに対する単一の栄養素の効果を、多因子疾患のプロセスに対する複数の食物成分や全体的な食事パターンからなる複雑な食物マトリックスの効果を正確に反映したものに変換することは必ずしも適切ではない。
食事のコンテキスト
このような複雑さにもかかわらず、生物医学的モデルは栄養学と重ね合わされている。多くの場合、これにより、疾患や生理機能の特定のバイオマーカーに対する単離された化合物を試験するRCTが行われ、その関係が因果関係にあるかどうかを判断することになる。このアプローチは確かに冗長ではないが、コンテキストが不足している可能性がある:全体としての食事パターンのより広いコンテキストと、現代の非伝染性疾患は、孤立した栄養素の欠乏の病気ではないというコンテキストの両方だ。
微量栄養素と特定の疾患状態との関連性の発見は、特定の時期に短い潜伏期間を持つ単一栄養素欠乏性疾患が一般的である場合には公衆衛生の栄養管理に役立ち、国民からこれらの病状を根絶するのに役立つ。しかし、現在、食事と病気の関係の調査に必要不可欠なものとして、すべての病気を分子生物学を通じて単一の一次ソースにまで蒸留できるという原理と還元主義には明らかな限界がある。
共変量のバランス
研究の対象である薬と食品の問題はさておき、内部妥当性の仮定と栄養への適用で他の問題が発生する。ランダム化の前提条件の一つは、介入群と対照群の間で既知と未知の共変量のバランスをとっているということだ。しかし、これは、無作為化後に変化または他の共変量が導入されないという前提に基づいており、すなわち、グループ間の2つの既知および未知の変数の交換可能性は、介入の過程で変化しない。これが達成されれば、無作為化の真の目的が明らかになる:平均治療効果のより正確な推定値、統計的有意性、および誤差の余裕(すなわち、結果の信頼性)を提供することだ。介入の期間中、導入される介入薬以外の因子が群間で一定であるという仮定は、自由生活条件下で実施された栄養学的試験では事実上不可能だ。これは、対象集団でのより大きな適用可能性を持つ結果を得るために内部妥当性の程度をデザイン上妥協した実用的なRCTが利用可能であるため、手に負えない問題ではない。
盲検化・アドヒアランス
RCT の妥当性の前提となるもう一つの問題は、研究バイアスと盲検化の関係である。二重盲検化は、ほとんどの栄養介入におけるもう一つの実際的な不可能性であり、研究は介入者によって与えられた特定の指示を必要とし、参加者によって続いて、その後、介入へのアドヒアランスを要求する。研究者が対照群が比較研究に参加していることを認識していないことを確認しなければ、対照群を含めて参加者の食生活が変化する。栄養科学におけるこの問題への取り組みの優れた例として、リヨン・食事・ハート研究(Lyon Diet-Heart Study)(6)がある。
プラセボ
説明的RCTにおける内部妥当性を支える最後の前提条件は、介入がプラセボと比較して明確に定義されていることである。これは、介入が習慣的に消費される化合物ではないので、薬物試験のために容易に達成可能であり、簡単にゼロ曝露と比較される:プラセボ。栄養学では、「栄養のない状態」は存在しない(7)。仮にサプリメントの試験で、あるサプリメントの栄養素と「何もない状態」のプラセボを比較したとしても、プラセボ群は食事だけでその栄養素を少なくとも推奨される1日の摂取量の前後のレベルまで摂取している可能性が高い。現実には、食事のプラセボは存在しないのである。
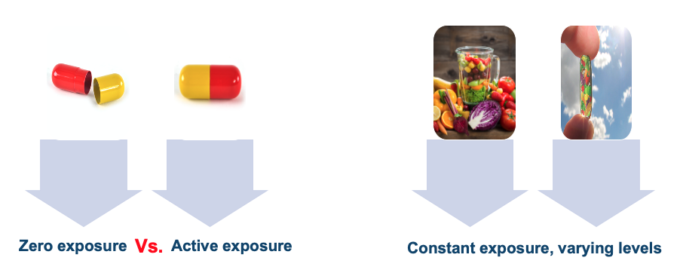
もちろん、高いレベルの内部妥当性が得られる状況はある。メタボリック病棟研究、または特定の変数に焦点を当てた研究問題[例えば、異なるレベルの多量栄養素を食事間で比較するなど]である。しかし、説明的な生物医学的RCTと相対する研究結果の問題点を無視すべきではない。特に、栄養学の研究は常にこれらの基準を満たしているわけではないので、モデルの適用可能性よりもむしろ調査対象に誤りがあるというある種のコメンテーターの主張は懐疑的に扱われるべきだ。
エンゲルについて語ろう。「ドグマ…矛盾したデータがモデルに適合するように強制されるか、または除外されることが必要とされる」 したがって、そのドグマに注意してほしい。必要なのは、調査対象の特定の特性を考慮に入れるために、現在のモデルを修正することである。
2) 説明的な生物医学的RCTは、医学的証拠の階層をよりよく知ることができる。
生物医学モデルでは、化合物の効果は一般的に非常に顕著であるため、試験では被験者の数を少なくしても、効果が偶然ではないことを証明することができる。薬物(1日1回服用)は投与が容易であるため、介入試験は何年にもわたって何千人もの参加者を用いて実施することができ、かなりの統計的なパワーを得ることができる。特定の化合物とプラセボでは、無作為化と盲検化は簡単である。再現性を求める科学的欲求は容易に達成され、大きな効果サイズは最終的にメタアナリシスで、介入の有効性について自信を持って結論を導き出すことができる。
現代の栄養科学は、長引く慢性生活習慣病によって定義されており、寿命の早い時期の食生活は、診断のずっと前から病態の自然史に影響を及ぼす可能性がある。この点で、長期の観察研究は、観察研究に対する生物医学的懐疑論との摩擦を生み出す物流上の要件であり、この分野の礎となる調査ツールだ。
しかし、エビデンスに基づいた医療(EBM)の領域では、「ゴールドスタンダード」のドグマは、偶然にも第二の問題、上述の「方法崇拝」の問題を生み出した。栄養疫学に対する厳しい批判の多くは誇張されすぎている。問題は経験的モデルが実用的な結論を導き出すかどうかだ。それは困難な科学ではあるが、客観的な現実は、栄養疫学は、改善された人口の健康につながっている多数の実用的な知見を提供しているということだ。
栄養科学の批評家は、信じられているよりも栄養疫学と介入研究の間の不一致がないという事実を無視することによって、多くの認知的不協和を抱えている(8)。皮肉なことに、疫学の厳しい批評家のほとんどはまた、観察研究と様々な研究課題にRCTsからの結果を直接するヘッド・トゥ・ヘッド比較では調査結果が一致を示している、という事実を無視している(9)。
機械論的研究と強い生物学的妥当性が組み合わされている場合、RCT は利用可能な全体像に基づいて安易な結論を出す必要性がないことはよくある。:加工肉と大腸がんとの因果関係を立証することは、この点を説明している。
説明的 RCT は生物医学的階層の「ゴールドスタンダード」を形成している。なぜならば、単離された化合物が疾患や生理機能の特定のバイオマーカーに及ぼす影響を解明し、その関係が結果の因果関係にあるかどうかを判断することが不可欠だからだ。
前述のように、このアプローチを栄養学に適用すると、全体としての食事パターンのより広い文脈、および単一の栄養欠乏によって影響を受けるのではなく、食事因子の多重性によって影響を受ける長期慢性状態の文脈を捉えることができない可能性がある。
介入研究については、介入研究に対する全食、食物ベースのアプローチは、意味合い的に還元主義と矛盾しているのが現実だ。さらに、倫理的な問題から、多くの食事-疾患研究の問題がRCTの文脈で検討されることはない。例えば、説明的RCTにおいて、認知機能をアウトカムとして長鎖オメガ3脂肪酸の欠乏した食事に参加者を割り当てることは、生涯にわたる認知健康におけるこれらの栄養素の役割についてわかっていることを考えると、倫理的ではないだろう。
栄養科学における因果関係の結論への説明的RCTの貢献は、生物医学モデルの場合よりもはるかに明確ではない。システマティックレビューやメタアナリシス、RCT、コホート研究など、エビデンスの階層の上位3層は、栄養科学においては明確な切り口ではなく、より流動的なものとなっている。
方法論的な質は必ずしも高いとは言えず、特定の状況下では、長期的な前向きコホート研究の方が、食事と病気の関係を評価するための情報提供のためのRCTよりも優れたエビデンスを形成している。
対照的に、生物医学モデルの理想は、与えられた研究問題に関する複数のRCTがメタアナリシスに組み合わされ、介入の有効性に関する強力な結論が得られることである。
しかし、この理想を栄養学に適用すると、しばしば矛盾や無効な結論が得られる。異なる方法論、栄養素または特定の食事介入の用量、介入の期間、母集団の特性、およびデータソースを持つ異種研究を組み込むことは、逆の効果を持つ。;弱められた検出力、および “ヌル “所見、メタアナリシスが概念的に意図されているものとは反対となる。
メタアナリシスはエビデンスのピラミッドの頂点に位置しているかもしれないが、栄養学的研究がしばしば説明的RCTの前提条件や仮定を満たしていないという事実は、メタアナリシスがほんの一握りの研究で実施されることが多く、無意味な答えをもたらすことを意味している。栄養学の質問に関する多くのコクランレビューは、この批判に該当する。

栄養学におけるメタアナリシス
ここでのキーポイントは、栄養学の証拠の階層は、常に複合体、証拠の総体を表示するためのレンズではあるが、単に証拠の階層内の歴史的な位置に起因する弾劾RCTとRCTのメタアナリシスを考慮することなく、ということだ。
栄養学における証拠の評価は、常に複数の証拠に依存する。このエッセイの第二部では、RCTと因果関係に関して一般的に行われている不正確な仮定の問題を議論し、「解釈、合成、外挿、および広範な結論を引き出すために」(10)を組み込んだ評価の真の科学的プロセスを介して、エビデンスのためのデザインタイプを支持することで問題を終える。
参考文献
1. Engel G. The need for a new medical model: a challenge for biomedicine. Science. 1977;196(4286):129-136.
2. Messina M, Lampe J, Birt D, Appel L, Pivonka E, Berry B et al. Reductionism and the Narrowing Nutrition Perspective. Journal of the American Dietetic Association. 2001;101(12):1416-1419.
3. Hébert J, Frongillo E, Adams S, Turner-McGrievy G, Hurley T, Miller D et al. Perspective: Randomized Controlled Trials Are Not a Panacea for Diet-Related Research. Advances in Nutrition. 2016;7(3):423-432.
4. Heaney R. Nutrients, Endpoints, and the Problem of Proof. The Journal of Nutrition. 2008;138(9):1591-1595.
5. Tosh G, Soares-Weiser K, Adams C. Pragmatic vs explanatory trials: the Pragmascope tool to help measure differences in protocols of mental health randomized controlled trials. Dialogues Clin Neurosci. 2011;13(2):209-15.
6. de Lorgeril M, Salen P, Caillat-Vallet E, Hanauer M, Barthelemy J, Mamelle N. Control of bias in dietary trial to prevent coronary recurrences: The Lyon diet heart study. European Journal of Clinical Nutrition. 1997;51(2):116-122.
7. Blumberg J, Heaney R, Huncharek M, Scholl T, Stampfer M, Vieth R et al. Evidence-based criteria in the nutritional context. Nutrition Reviews. 2010;68(8):478-484.
8. Satija A, Stampfer M, Rimm E, Willett W, Hu F. Perspective: Are Large, Simple Trials the Solution for Nutrition Research?. Advances in Nutrition. 2018;9(4):378-387.
9. Concato J, Shah N, Horwitz R. Randomized, Controlled Trials, Observational Studies, and the Hierarchy of Research Designs. New England Journal of Medicine. 2000;342(25):1887-1892.
10. Swales J. Evidence-based medicine and hypertension. Journal of Hypertension. 1999;17(11):1511-1516.
