コンテンツ
Infrared and Skin: Friend or Foe
pubmed.ncbi.nlm.nih.gov/26745730
2015年12月21日オンライン公開。doi:10. 1016/j.jphotobiol.2015.12.014
要旨
過去10年間、太陽のIR-A波長(近赤外線:760~1400nm)はヒトの皮膚に有害である可能性があり、日焼け止めは、UV-BとUV-Aから保護する望ましい効果に加えて、IR-A(そしておそらく可視光線)からも保護する必要があると提唱されてきた。いくつかの研究では、NIRはUVRで知られているのと同じように、MMP-1活性の増加を通じて皮膚のコラーゲン含有量に損傷を与える可能性があることが示された。残念ながら、このような研究で使用された人工的なNIR光源は、太陽放射照度を代表するものではなかった。
しかし、コインの裏側についてはほとんど語られていない。この記事では、実際の生活で人々が日常的に受ける日光浴と同じような適切な放射照度/線量のIR-Aを皮膚に照射した場合、IR-Aは有害であるよりも有益である可能性を示唆する重要な情報に焦点を当てる。
IR-Aは、早朝の太陽光に含まれるIR-Aの波長を浴びることで、日中の有害なUVRに対して皮膚を準備することができるため、進化の観点からは、光予防と呼ばれるプロセスで、皮膚のコンディションを整えることさえできるかもしれない。
その結果、IR-Aは問題ではなく、解決策であるように見える。IR-Aは肌に悪い影響を与えるよりも、良い影響を与えるのだ。本質的には、強度の問題であり、いかに太陽から学ぶかということである。
キーワード赤外線(IR)、IR-A、光生体調節、MMP-1、光予防、放射照度
1 はじめに
地球に届く太陽放射のスペクトルは、290~100万 nmにおよび、以下のように分けられる:6.8%が紫外線、38.9%が可視光線、54.3%が近赤外線(NIR)である[1]。赤外線は、760nmより長く、1mmまでの波長帯を構成する。海面で地上に到達する太陽放射の約40%を占める。赤外線は3つの帯域に分けられる:IR-A(760~1400nm)、IR-B(1400~3000nm)、IR-C(3000nm~1mm)である(図1)。IR放射は、表皮、真皮、皮下組織を伝染することができ、その程度は、研究される正確な波長範囲によって異なる。赤外線を浴びると、熱として感知される[2]。
図1 太陽スペクトルの構成。UVCより赤いXはオゾン層によって遮られていることを意味する。(NIR:近赤外線、FIR:遠赤外線)
電磁放射の強さは、個々の粒子や波のエネルギーと、存在する粒子や波の数に依存する。
電磁放射は、幅広い光子エネルギーを持つスペクトルをカバーし、それは波長の範囲としても表すことができる。スペクトルは大きく2つに分けられる:
-
非電離放射線
-
電離放射線
原子や分子から電子を完全に取り除くにはエネルギーが不十分な放射線は、非電離放射線と呼ばれる。この種の放射線の例としては、可視光線、赤外線、マイクロ波、ラジオ波などがある。電離放射線の範囲に入る放射線は、原子から固く結合した電子を取り除くのに十分なエネルギーを持つため、荷電イオンを生成する。この種の放射線には、X線やガンマ株が含まれる。
紫外線(UV)はこの2つの広い範囲の中間であり、短波長のUVは化学結合を切断し、光化学反応を起こすのに十分なエネルギーを持っている。
日焼けが皮膚に及ぼす影響については、長年にわたって広く研究されてきたが、皮膚がん、光老化、免疫抑制の原因としてよく知られている紫外線に比べ、赤外線の影響はあまり注目されてこなかった。
さらに、太陽光IR-A(NIRとも呼ばれる)の放射照度レベルは、皮膚に有益な効果をもたらすのに重要であり、それを超えると有害となる。IR-Aの有害作用(マトリックスメタロプロテアーゼ1またはMMP-1のアップレギュレーション)を報告しているほとんどの研究では、太陽光IR-A放射照度の閾値をはるかに上回る人工光源を使用している。この総説は、この論争の的となっているトピックに新たな視点をもたらすために、発表されたデータの食い違いに焦点を当てたものである。

2 近赤外&皮膚
2. 1 近赤外線による悪影響:熱
慢性的な赤外線被曝が皮膚に悪影響を及ぼすことは、皮膚科学では古くから知られていた。古典的には、囲炉裏の火の近くに座りすぎた人の脚に見られ、発赤と名付けられた。このような網状、紅斑または色素沈着性皮膚症は、比較的低レベルの赤外線に慢性的に繰り返し曝露されることによって生じ、一般に予後は良好であった。しかし、扁平上皮がんやメルケル細胞がんなどの皮膚悪性腫瘍を発症する長期的リスクがあったため、必ずしも自己限定的な診断ではなかった[3]。最近、ラップトップ・コンピューター誘発性紅斑[4]が報告され、この診断が復活した。さらに、高温のオーブンにさらされるパン職人の腕や、ガラス吹き職人の顔にも、重度の皮膚老化が生じることがある[5]。上記の例では、皮膚は対流(熱気流)、伝導(直接接触)、放射(赤外線)を介して大量の熱にさらされている。輻射によって伝わる熱の割合は不明だが、少なくとも火のそばに座っている人やパン職人にとっては、無視できるものではないと推定できる。最も重要なことは、対流や伝導による加熱効果とは別に、近赤外線の明確な効果が測定されていないことである。

発疹性紅斑の熱的性質は、被曝の放射照度が高く、累積線量(フルエンス)が非常に高いことを意味する。
NIRの有害作用を引き起こす上で、熱は本当に問題なのだろうか?比較的小さな温度上昇でコラーゲン分解と活性酸素発生が増加することを示した研究もある。Piazenaらは、対流冷却または加熱を併用した水濾過IR-A(wIRA)が、天然皮膚および生着皮膚の生存率、炎症、誘導性フリーラジカル、抗酸化酵素含量に及ぼす影響を研究した[6]。換気による対流冷却で皮膚温度を37℃に保ち、放射照度190mW/cm2で30分間皮膚に照射した水フィルターIR-Aは、皮膚の細胞生存率、炎症状態、フリーラジカル含量、抗酸化防御システムに有意な影響を与えなかった。この放射照度は、地表における太陽IR-A放射照度の最大値の5倍以上であったため、これは臨床的に重要である。逆に、約45℃まで対流加熱すると、フリーラジカルの生成はほぼ2倍になり、抗酸化力は約50%に低下した。これは、放射線量とともに直線的に増加する温度依存的なポリマーの光分解にも関連している可能性がある。
比較的低い放射照度の赤外線でも、皮内温度の上昇(インサイド・アウト加熱)につながる可能性がある。田中らによる他の研究では、NIRはDNA損傷応答経路の活性化の結果として、がん細胞において非加熱的に殺細胞効果を誘発することが報告されている[8,9]。彼らは、1100~1800 nmを放射する広帯域NIR光源(Titan; Cutera, Brisbane, CA, USA)を使用し、太陽光のNIR放射をシミュレートするために水フィルタリングを行った。放射照度については言及されていないが、彼らは試験管内で20J/cm2、生体内では40J/cm2までのNIRを1~10ラウンド照射し、組織の温度モニタリングを行わなかった。広帯域のNIR光源(表皮の損傷を保護するために20℃の接触冷却チップを備えた強力パルス光(IPL)の使用は、本質的に非常に高いピークパワーパルスで真皮の温度を上昇させることによって発色団を破壊するために構築された熱技術であるため、全く無関係だ。その結果、太陽からのNIR光線をシミュレートすることはできず、発生した熱の結果として起こるこの人工光源の細胞殺傷効果について説明することはできない。
私たちは、皮膚内熱電対T型温度測定により、この発見を報告した。970nmのNIR LED光源を用い、15分間で80mW/cm2(72J/cm2)の照射で44℃までの温度を観測した(図2)[10]。
図2 80mW/cm2の970nm発光ダイオードによる温度上昇を、患者の皮膚-表皮(DE)接合部において時間(分)の関数として測定した。データモニタリングにより、温度は照射15分後に45℃でピークに達し、その後ゆっくりと低下することが示された[10]。
単純な非IR加熱パッドでさえ、43℃、15分間でコラーゲンの分解につながる可能性がある[11]。この実験では、ヘアレスマウスの背部皮膚を週に3回、6週間にわたって熱に曝した。彼らは、皮膚を慢性的に熱にさらすと、マトリックスメタロプロテアーゼ13(MMP-13)の発現が増加し、抗酸化酵素活性が低下し、その結果、酸化的損傷を受けることによって、皮膚のシワを引き起こす可能性があることを示した。MMP-13は皮膚創傷の閉鎖を促進する[12]。ニワトリ胚性腓腹筋腱の摘出物を異なる温度(37℃対43℃)で使用したHalperらの別の研究では、43℃において、いくつかのコラーゲン制御因子、トランスフォーミング成長因子β(TGF-β)、熱ショックタンパク質47(Hsp47)、結合組織成長因子(CTGF)を表すmRNAの増加が報告されている[13]。
2. 2 NIRによる光老化と酸化ストレス
別のタイプの人工光源からのIR-A放射が人間の皮膚細胞に与える影響を調べる研究も行われている:ハイドロサン500は、平均360mW/cm2(760-1400nm)という非常に高い放射照度を出しているが、これは天頂条件(熱帯地方の正午)においてさえ、太陽の放射照度とはかけ離れたものである。Schiekeらによる2002年の論文では、ヒトの皮膚線維芽細胞にこの線源を照射した。細胞は760-1400nmのIR-A放射線を10分と60分照射され、フルエンスは200-1200J/cm2であった。これは333-2,000mW/cm2の放射照度に相当する。皮膚コラーゲンの正常なターンオーバーに関与するコラゲナーゼであるマトリックスメタロプロテアーゼ1(MMP-1)は、照射された細胞でアップレギュレートされることが判明した[14]。
これらの観察結果の生体内試験での妥当性を評価するために、Schroederら[15] は23人の健康なヒトボランティアの正常な臀部皮膚を研究した。彼らは全員、同じ人工線源(Hydrosun 500)、360J/cm2または720J/cm2のIR-A放射線を単回照射され、その後MMP-1の発現を評価された(RT-PCRによるmRNA、ウェスタンブロッティングまたは免疫組織化学によるタンパク質)。皮膚が照射された放射照度の測定値は105 mW/cm2であった。Schiekeら[14]の研究と同様に、IR-A照射後にMMP-1の発現が上昇することが判明した。著者らは、ヨーロッパ中央部の夏の日に数時間で照射可能なIR-A放射線の線量に相当する線量を選択したと述べている。とはいえ、太陽の下でこれだけの総線量を浴びるには、熱帯地方のさらに南では、夏の午前6時から午後6時まで浴びなければならない。現実には、日中の太陽IR-Aの平均放射照度は約20 mW/cm2で、ピーク放射照度は40mW/cm2に達する[16]。
IR-A照射に続いてUVBを数ヵ月にわたって照射した場合の長期的影響を調べるために、生体内試験マウスモデルが用いられた[17]。780~1400nmの波長域をカバーするIR-Aを放射する人工光源を用い、毛刈りしたマウスの皮膚に135J/cm2のフルエンスで照射した(放射照度や処理時間については言及されていない)。2時間後、皮膚にUVB光を照射した。この処理を週に3回、何週間も繰り返し、UVBの照射量を徐々に増加させた。IR-A照射はUVR照射による皮膚腫瘍の発生頻度を増加させなかったが、発生した腫瘍はより攻撃的になったことが観察された。つまり、IR-Aを照射したマウスの腫瘍はより早く成長したのである。
これらの研究はすべて、自然の太陽光とは異なる性質を持つ人工放射線を用いたものであり、IR-Aの短期および長期的な悪影響に関する結論の実生活への適用性には疑問が残る。すべての波長を考慮すると、太陽放射照度の最大値は130mW/cm2である。大気による吸収により、この値は(約100mW/cm2に)減少する。太陽から放射される全照射量のうち、赤外線A、B、Cが約40%を占め、その約40%がIR-Aである。つまり、自然太陽光のIR-A放射照度は100mW/cm2の20%、つまり20mW/cm2である。Schiekeら(2002)では、細胞は最小333mW/cm2のIR-A放射照度に曝され、Schroederら(2008)では、IR-A放射照度は105mW/cm2であった。Jantschitschら(2011)では、放射照度の値は得られなかったが、IR-Aフルエンスの値135J/cm2は不自然に高かった。
Kimらは、赤外線による熱への慢性的な反復曝露も皮膚のしわにつながることを示した[7]。残念なことに、使用された赤外線人工放射源(Infrared-300、Daekyoung Co.、Kyungki、Korea)は、2020mW/cm2(ピーク1100-1200nm)という不自然に高い放射照度で赤外線を照射するように設定されており、1212J/cm2の線量(フルエンス)を週5日、15週間照射した[7]。
2010年、Piazenaらは、IR-A(またはIR)の影響を試験管内試験または生体内試験の実験環境で評価した研究を概説した。彼らは、invivo条件への現実的な外挿を可能にするためには、試験管内試験実験における入射放射照度と標的細胞を含む曝露培地の光学的特性の両方を注意深く選択し特性化すること、また曝露中の培地の温度制御の重要性を強調した[16]。彼らは、利用可能な研究から得られた結果は矛盾しており、IR-Aの有害な影響について首尾一貫した結論を導き出すことは困難であると指摘している。
2. 3 NIRによる光若返り
組織工学的に作製したヒト再建皮膚(HRS)モデルを用いて、50mW/cm2以下の放射照度で660nmを照射すると、MMP-1がダウンレギュレーションされ、I型プロコラーゲンがアップレギュレーションされることが実証されている[18]。これらの結果を関連付けるために、660nmで治療した皮膚でシワの有意な改善を示した分割顔単盲検試験が実施された。同じ試験管内試験実験の一環として、805nm(NIR)も試験され、11回の治療で同等のMMP-1減少が認められた(未発表データ)図3。
図3 LED治療後のHRS(Human Reconstructed Skin)におけるELISA(酵素結合免疫吸着法)によるMMP-1レベルの低下。11回の連続治療(T1-T11)により、MMPレベルの高低を交互に繰り返す周期的パターンが観察された。数値は、各処理後の上清中のMMP-1レベルの平均値における、処理したHRSサンプルと未処理のコントロールHRSサンプル間のパーセント差±SEM(n=9)である。
Leeらは、光老化した皮膚に対する赤外線の効果を報告した[19]。軽度から中等度の顔のしわを持つ20人の患者に、遠赤外線(9-10 X106nm)を6カ月間毎日照射した。ほとんどの患者(51~75%)が、肌のきめと粗さが改善したと報告した。さらに、25~50%の患者が肌の色調の改善を認めた。さらに、830nmのLEDを使用した前向き研究でも、同等の臨床結果が示された[20]。組織学的には、すべての治療群でコラーゲンと弾性線維の顕著な増加が観察された。超微細構造検査では、高度に活性化した線維芽細胞が、豊富な弾性線維とコラーゲン線維に囲まれていることが示された。免疫組織化学的検査では、TIMP-1とTIMP-2の増加が認められた。RT-PCRの結果、IL-1ss、TNF-α、ICAM-1、Cx43のmRNAレベルはLED光線療法後に増加したが、IL-6のレベルは減少した。
3 相互作用の法則:放射照度が鍵
相反性の法則(ブンゼン・ロスコーの法則)とは、生物学的効果は、投与体制に関係なく、総エネルギー線量に正比例するというものである[21]。したがって、照射時間を短くして放射照度を上げても同じ被ばく量になるはずであり、その逆もまた然りである。しかし、光生物学における組織反応を考慮する場合、相互作用を支持する科学的根拠が常に適用されるわけではない。Van Breughelは、線維芽細胞培養にヘリウムネオン(HeNe)レーザー(波長632.8nm)を一定の線量で照射し、照射量と照射時間を変化させた。その結果、中程度の照射量と照射時間(1.2mW/cm2,145秒)でのみ、増殖とコラーゲン産生が促進されることがわかった[22]。また、単色UVA放射線に対するヒト皮膚の即時色素沈着閾値は、放射照度に依存することが示されている[23]。創傷治癒モデルにおいて線量の相互作用が検討され、一定のエネルギー密度を達成するために放射照度と照射時間を変化させると、フォトバイオモジュレーション(PBM)の治療成績に影響することが示された[24]。実際には、照射照度がある標的に対する生理的閾値より低いと、照射時間を延長しても有益な効果は得られない。さらに、照射照度が高くなると、光阻害による悪影響が生じることもある。このような二相性のパターンにより、人工IR-Aの照射量が高すぎる場合(100mW/cm2以上)にMMP-1が増加し、皮膚温熱が誘発されるという報告が説明できるかもしれない。このことは、正確なパラメーターを用いて実際に有益な細胞反応を活性化できる機会は限られているというArndt-Schulzの法則のさらなる証拠となる[25]。この二相性効果については、Huang et al.Lanzafame et al. 2007は、マウスの褥瘡のレーザー誘発治癒について、照射量と照射間隔を変化させた研究を行った。エネルギー密度(5J/cm2)は一定に保たれたが、4つの異なる照射パラメータ(0.7~40mW/cm2)が比較され、8mW/cm2でのみ有意な改善がみられた[27]。
より低い放射照度(<50mW/cm2)は、潜在的な有害作用につながる皮膚温熱症を誘発しにくい。
4 IRの治癒力
4. 1 NIR(近赤外線)
可視光線や近赤外線波長への低エネルギー照射が、治癒プロセスの促進を通じてヒトに有益であることは、50年近く前から知られている。この低レベル光治療(いわゆるLLLTまたはPBM)は、1968年以来、何千もの査読付き論文で報告されている[28,29]。可視光線から近赤外光線までの波長範囲内で、特定の低エネルギー(非熱)光パラメーターを使用するPBMは、創傷の治癒を早める必要がある患者や抗炎症目的の患者に代替療法を提供する。PBMは、真核細胞のミトコンドリアに存在する既知の光受容体分子(シトクロムcオキシダーゼ)を用いた植物の光合成と比較されている。
PBMのパラメーターはここ10年で改善されてきており、現在では、皮膚の炎症を治療したり、切除処置後の創傷治癒を早めたり、あるいは日焼けを予防したりするための補完的な治療手段として、皮膚科における治療手段の一部となっている[30]。It is also used as a photodynamic therapy light source to photoactivate a photosynthetizer (Protoporphyrin IX or PpIX) when treating actinic keratosis, basal cell carcinoma and acne[31].さらに、低強度赤外線はβ-エンドルフィンの鎮痛作用を誘発することが示されている[32]。
組織病変のNIR光生物学的調節は、特定の細胞の増殖の増加、抗炎症性サイトカインの遺伝子発現、炎症性メディエーターの合成抑制と関連している[33]。
4. 2 FIR(遠赤外線)
IR放射のもう一つの下位区分(遠赤外線、FIR、3~25μm)も、試験管内試験と生体内試験の両方の研究で、細胞や組織を刺激することが観察されている[34]。さらにFIR療法は、特定の病状に対する有望な治療法と考えられている。技術の進歩により、FIR放射線を人体に照射するための新しい技術が提供されている。特殊ランプ[36]やサウナ[37] は、純粋なFIR放射(近赤外線と中赤外線の帯域を完全に除去)を照射するもので、安全で効果的な、治療効果を生み出す源として広く利用されるようになった。FIR放射セラミック・ナノ粒子を含浸させた繊維を織物に織り込むことで、着用者の体温を動力源とするFIR放射を発生させる衣服やラップとして使用されており、これらの衣服は健康に多様な利益をもたらしている[38,39]。
5 PBMの作用機序
皮膚は他のどの臓器よりも自然に光にさらされているが、それでも赤色や近赤外線にはよく反応する[29]。作用機序をよりよく理解することは、臨床医の治療アプローチを方向づけることになる。
PBMの細胞および分子作用機序は、近年ある程度解明されてきており、図4に要約した。
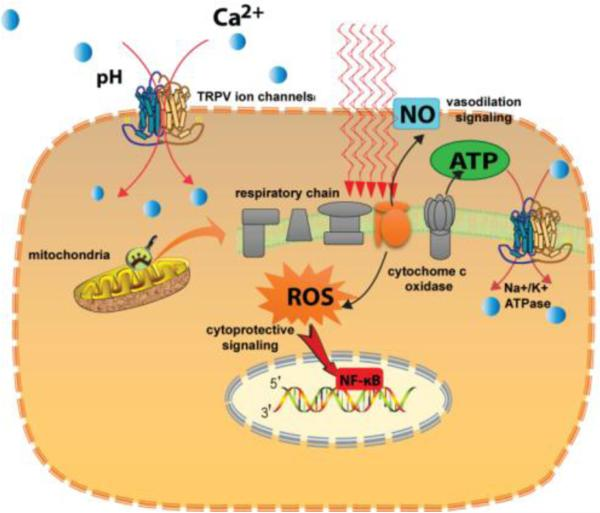
図4 PBMの作用機序。つの主要な発色団は、ミトコンドリア呼吸鎖のユニットIVであるシトクロムcオキシダーゼ(CCO)とTRPVイオンチャンネルである。光子が吸収されると、抑制性の一酸化窒素がCCOから解離し、酵素活性の上昇、ATP産生の増加、活性酸素種のバーストへとつながる。産生された余分なATPはNa+/K+ ATPaseポンプを活性化する。一過性受容体電位バニロイド」(TRPV)と呼ばれる別のタイプのカルシウムイオンチャネルは、可視光線と赤外線の両方で活性化される。カルシウム・シグナル伝達は、複数の細胞タイプにおいて非常に重要な経路である。
重要な発見は、NF-kB(核内因子κB)細胞シグナル伝達経路が、ミトコンドリアのシトクロムcオキシダーゼ(COX)によって活性化されると考えられている、活性酸素(reactive oxygen species)の発生源として重要な役割を果たしていることを示している[40]。ミトコンドリア膜の酸化還元状態を変化させると、転写因子NF-kBの形成が活性化される。細胞質では、NF-kBはその特異的阻害タンパク質であるIkB(I kappa B)と複合体を形成しているため不活性である。活性酸素はIkBキナーゼ(IkK)を刺激し、IkBのリン酸化を引き起こし、その結果IkB複合体は崩壊してNF-kBが放出される。NF-kBは核内に輸送され、150以上の遺伝子の発現を引き起こすが、その多くは細胞ストレスに対する防御機構に関与している。NF-κBの刺激と活性酸素の蓄積との相関は、試験管内試験の胚線維芽細胞に赤外線(810nm)を照射した後に見いだされた。NF-κBの最大活性化と活性酸素の蓄積は、0.3J/cm2の線量で観察されたが、高線量ではあまり顕著な効果は見られなかった[26]。
ミトコンドリアの活性酸素は、2つの異なるピークを持つ三相性の用量反応を示す。活性酸素のヤヌス的性質は、低濃度では有益なシグナル伝達分子として働き、高濃度では有害な細胞毒性物質として働くというものである。このことが、生体内試験で観察された反応を部分的に説明しているのかもしれない[26]。
6 エイジング肌へのポリクロマティック光とモノクロマティック光の効果
PBMでは通常、単色波長が使用されるが、組み合わせ波長も成功している。
一部の著者は、最適な肌の若返り効果を得るためには、異なる波長が重要であると強調している[20]。ある研究では、臨床結果および患者の満足度におけるポリ-(570-850nm、42.8-54.8mW/cm2,49.3-51.4J/cm2)対モノ-(630nm、5.9-23.4mW/cm2,15.5-16.6J/cm2)の有彩色光治療の差は有意ではなく、スペクトルの違いにもかかわらず、老化した皮膚を減少させるという研究目的においては、どちらの光源も相応に有効であったことを示している[41]。
7 太陽をエミュレートする:赤外光防止
プレコンディショニングは 2005年にDecreaneらによってUVを用いて報告されている。低紫外線量により、保護的なp53依存性遺伝子機構が誘発され、将来のUVB照射に対するケラチノサイトの回復力が増加した。しかしながら、UVB電離放射線を皮膚損傷の予防に使用することは、特に長期的には、危険性が高すぎる。
最近になって、PBM(可視光線と近赤外光線)は、実際の傷害や外傷の前に、プレコンディショニングモードで正常細胞や組織に投与された場合にも有効であることが明らかになってきた[44]。
光予防と呼ばれるこのような皮膚PBMの応用は、紫外線による日焼けのような来るべき障害に対して皮膚をよりよく準備するために、可視光線と、大部分はIR-A放射線を使用する。有害なUVR波長にさらされる前に、このような放射線を皮膚に照射するプロセスは、自然界に見られるプロセスを忠実に模倣している。早朝の太陽光に含まれる赤色やIR-Aの波長を浴びることで、日中の有害なUVRに備えることができる。
いくつかの試験管内試験研究では、線維芽細胞をNIRでプレコンディショニングすることで、p53細胞シグナル誘導による抗アポトーシス作用を介して、近日中のUVBダメージから保護できることが示されている[45,46]。最初の生体内試験研究では、UVBを浴びる前に被験者に660 nmの光を照射し、照射しなかった対照群と比較した[30]。UVB照射後の紅斑の進展が、UVBに対する有害反応の指標として用いられた。研究の結果、前処理をした被験者のかなりの数で、UVB誘発紅斑反応の減少が見られた。また、SPF-15のような日焼け止め効果や、炎症後の色素沈着の減少も観察された。複数の波長を使用したその後の実験(未発表データ)では、NIRスペクトルの方が紅斑の減少に優れていることが示された(図5)。
図5 MED1、MED2、MED3の24時間前に可視光から近赤外の波長を照射したところ(Oriel社製ソーラーシミュレーター)、近赤外の波長の方が紅斑が減少した。
Sayreら(1978)は、サンスクリーンのSPF(Sun Protection Factor:紫外線防御指数)を測定するために、サンシミュレーターで太陽光を再現できることを示したブレイクスルー生体内試験研究において、SPFに対する皮膚温度の影響を調べるために赤外線ヒートランプを使用した。サンスクリーンを塗布した後、太陽シミュレーター照射前に皮膚温を33~35℃まで上昇させる熱を加えた。対照のMEDは、この処理によってほとんど変化しなかったが(元の2.11;加熱した2.05)、日焼け止めで保護された領域の平均MEDは、加熱処理後に25%以上低くなり(元の7.93;加熱した5.83)、太陽の下で測定されたSPFに近づいた[47]。1988年、Chardonらは、16人の白人ボランティアの背中に、4台のPhilips-IR250Sランプによる70mW/cm2の現実的な総照射量を15分と30分照射し、その影響を6時間にわたって追跡した。照射5時間後と24時間後に、UVBとIRの反応とIR*UVの相互作用を定量化した。IR*UVB相互作用は、5時間後に1.5MEDと2MEDで有意に陽性となり、24時間後に強く減少することがわかった[48]。
最近、ブタモデルにおいて、UVB照射の4時間前または24時間前にパルス940 nmを照射すると、コントロールと比較して、UVB誘発性急性光障害からブタ皮膚を有意に保護することが示された[49]。さらに同じ研究では、UV照射の24時間前に940nmのパルスLEDを照射した場合、定量的PCR(ポリメラーゼ連鎖反応)により、プロコラーゲンタイプIと抗アポトーシスBax遺伝子の発現のアップレギュレーションと、MMP-1(コラゲナーゼ)とSOD2(酸化ストレスマーカーであるスーパーオキシドジスムターゼ2)のダウンレギュレーションが示された[49]。
光予防を最適化するために必要な放射照度の指標は、朝の太陽光の測定と定量化によって得られる。熱帯地方で測定されたUVとIR-Aの比率は、その日の紫外線による肌への影響の前兆として、朝と一日の終わりに低くなる(図6)。朝の気温が低いことと、それに比例してUV/IR-A比が低いことは、潜在的な紫外線障害(正午にUV/IR-A比が高くなる)の前に、皮膚温熱を起こさずにIR-Aの有益な効果を誘発する理想的な条件を提供する。同じことが、紫外線によるダメージが生じた場合、PBM組織の修復を伴う午後の遅い時間にも当てはまる。その結果、IR-Aは、有益な生理的放射照度の範囲内で、日中のUVRによる皮膚損傷を予防・回復する(図7)。
図6 UVR/IR-A太陽放射照度比、海面レベル、頭上に雲なし、熱帯間帯(天頂太陽が発生する場所)で利用可能。計算は、NRELから入手可能なSimple Model of the Atmospheric Radiative Transfer of Sunshine (SMARTS)、2.9.5モデルを用いて行われ、2015年7月にwww.nrel.gov/rredc/smarts/about.html。
図7 早朝(午前6時)の太陽の相対放射照度は、真昼(正午)の放射照度に比べ、可視および近赤外スペクトルにおいて高い。計算は、NREL(国立再生可能エネルギー研究所)から入手可能なSimple Model of the Atmospheric Radiative Transfer of Sunshine(SMARTS)、2.9.5モデルを使用し、2015年7月にwww.nrel.gov/rredc/smarts/about.html。
太陽の発光スペクトルに基づくと、光防止に有効な波長は630~940nmとなる(図8)。さらに、大気は選択的な赤外波長の通過を阻止し、950nm以上の赤外放射の一部だけが地表に到達する。大気中の水蒸気が残りを吸収するのだ。
図8 太陽角は、正午(影なし)にピークを持つ、一日を通して異なる時間帯の放射照度を決定する。曲線は、紫外-可視-赤外(290-4000 nm)およびそのIR-Aセグメント(760-1400 nm)の全球太陽放射照度を表し、影がなく雲のない水平面で収集したものである。SMARTS 2.9.5ソフトウェアに入力したパラメータは、水蒸気 = 2、オゾン = 3,500 nmにおけるエアロゾル光学的深度 = 0.2、アルベド = 0.2である。午前8時15分頃から午後3時45分頃まで、全球の太陽放射照度は65mW.cm-2以上に上昇する。しかし、IRA放射照度は正午に35mW.cm-2でピークに達し、日中は安全な治療(PBM)の範囲内にとどまる(平均:20mW.cm-2)。点線は平均放射照度を表す。
特定のパラメーターでLED(発光ダイオード)装置を用いて太陽をエミュレートする光線予防は、多形日光疹の患者や光線過敏症患者にとって、冬に日差しの強い目的地に出発する前のエキサイティングな治療の選択肢となる。
8 考察
8. 1 投与量依存効果
可視光線と近赤外線の波長の効果は用量依存的である。これは、赤ワインを1日1杯飲むことによる長期的な健康効果と、1週間に1度、1日1本丸ごと飲むことによる有害効果の比較に似ている。可視光線と近赤外線は、それぞれ太陽の放射スペクトルの約45~50%を占める。しかし、UVR(太陽のスペクトルの2~3%)と比較すると、相対的な効力(電離放射線)は比較的低い。そのため、最近までNIRの皮膚への影響に注目することはなかった。いくつかの研究により、NIRはUVRで知られているのと同じように、MMP-1活性の上昇を介して皮膚のコラーゲン含有量を損傷する可能性があることが示された。残念ながら、このような研究で使用された人工的なNIR光源は、太陽放射照度を代表するものではなかった[50]。Schaubergerら(2004)は、人工光源からの分光放射照度を太陽放射照度と比較して評価する方法を発表した。この方法は、UVRについて提案されたものだが、論理的に拡張することができ、他の波長帯にも適用することができる[51]。Grotthus-Draperの法則によると、生体内で真皮に吸収されるのは入射放射照度のわずか10-12%である。このことは、試験管内試験の実験状況を生体内試験の条件と相関させることをさらに困難にする。この点で、試験管内試験で使用された放射照度は、皮膚表面(生体内試験)での入射照度210~300mW/cm2[50]に相当する。試験管内試験と生体内試験の状況のもう一つの相違は、生体内試験における血流を介した吸収エネルギーの効果的な放散と、正午前後や夏以外の季節の太陽高度角が小さいため、太陽IR-A放射照度が一般的にはるかに小さいという事実を考慮すると、さらに大きくなる[52]。したがって、IRの有害な影響を示す試験管内試験実験で使用された放射照度は、不自然に高いと考えなければならない。実際、観察された影響は、(細胞の温度上昇による)熱影響である可能性が高く、IR-A放射線の特定の特性とは関係がない。
慢性的な日光暴露は、光老化や皮膚がんなどの長期的な臨床的皮膚変化の主な原因である[53]。これらの影響は、UVB(280-320 nm)とUVA(320-400 nm)の波長を組み合わせた紫外線(UV)の有害な影響に起因することがほとんどである。太陽紫外線の影響を実験的に評価するために、特に日焼け止め業界では標準的な紫外線スペクトルが定義されている。これらの発光スペクトルは、高いUVBレベルを代表する準天頂日射量による極端な太陽紫外線暴露条件を表している[54]。しかし、地球に到達する太陽スペクトルは、緯度、季節、気象条件、オゾン層の厚さ、特に時間帯を含む多くのパラメータに依存する。そのため、熱帯地方で夏の正午の太陽光に相当するような、天頂付近の太陽光暴露条件は、めったに見られない[53]。したがって、皮膚への有害な影響を報告する人工的なNIR光源を用いた極端な条件を用いた研究は、日常的な日光暴露の実生活条件を適切に反映したものではないだろう。
可視光線と赤外線A波長を含む、より現実的な全太陽線照射条件を評価するためには、天頂以外の太陽分光放射照度を使用すべきである。このようなスペクトルは、CIE(国際照明委員会)によって計算され、公表されている[55]。その後、CIEは、より新しく正確な太陽分光放射照度データにアクセスできるようになったため、公表を取りやめた。これらは現在、国立再生可能エネルギー研究所のウェブサイトから自由に入手できる[56]。
可視光線と赤外光線は、波長、フルエンス、放射照度の適切な組み合わせによって、皮膚に有益な影響を与える。一日のある時間帯に自然の太陽光によって生成されるこれらの好都合な条件は、真昼の紫外線による有害な影響に対して皮膚を準備する可能性がある。
水でろ過された人工IRA光源からの放射照度と、太陽から放射される自然のIR-Aからの放射照度という点で、リンゴとオレンジを比較している。ほとんどの研究で、使用されたHydrosun 500は高照度に設定されていた[14,17,57]。その他の研究では、Cutera社のパルス高ピークパワー広帯域(IPL)[8,9]や、Daekyoung社のInfrared-300[7]が、不自然に高いパワー密度(放射照度)で使用されている。
100mW/cm2を超えると組織温熱が起こり、真皮でマトリックスメタロプロテアーゼ(MMP)の発現が誘導される可能性があるため、これらの照射量は非常に高いものであった[11]。このようなデータは、マウスの創傷治癒におけるNIR光バイオモジュレーションの有益な効果を支持する生体内試験の実験データと整合させる必要がある[58]。もちろん、特定の波長、典型的にはIRAスペクトルの短波長側に焦点を合わせたレーザーを用いた照射では、IR-Aスペクトル全体に及ぶ光を発するIR-Aランプから照射された結果発現した遺伝子と比較して、異なる遺伝子が発現することが予想される。IR-A波長の違いによるトランスクリプトームの違いは、さらなる研究の興味深いテーマであろう。しかし、IR-Aの皮膚に対する相反する効果が報告されているのは、実質的に光バイオモジュレーションのあらゆる側面で観察されている、よく知られた二相性の用量反応曲線が主な原因である可能性が高い[26,59]。数十 J/cm2の範囲のフルエンスは皮膚を保護し、全体的に有益である可能性が高く、数百 J/cm2の範囲のフルエンスは皮膚にダメージを与え、全体的に有害である可能性が高い。放射照度パラメータも同様である。
9 結論
波長、強度、照射量において自然太陽光の条件をエミュレートした可視光線および赤外光線への光バイオモジュレーション照射は、皮膚にとって有益である。このような光照射は、皮膚をプレコンディショニングし、来るべき(真昼の天頂)UVR照射に備える可能性さえある。一方、人工的なIR-A放射の範囲や強度・線量が広すぎると、既存の有害な影響を助長したり、それ自体による悪影響(MMP-1の増加)を引き起こしたりする可能性がある。いくつかの研究(2, 13, 14, 43, 49, 51-55)は、試験管内試験および生体内試験の両方で、IR-A放射線の皮膚へのダメージ効果を実証している。しかし、それらは高強度の人工IR-A光源を用いたもので、現実の日常的な日光暴露を再現したものではない。太陽から放射され皮膚に到達するIR-Aは、それほど高強度ではない。IR-Aを防ぐ日焼け止めの開発を提案する研究者もいる。このような主張は、消費者や医療専門家にとっては無関係だ。なぜなら、生理学的に現実的な強度で証明されたIR-Aによる損傷の評価が前提条件だからだ。しかし、現実的な照射量/線量では、IR-A照射はコラーゲン代謝と今後のUVRダメージに有益な影響を及ぼすことが示されている。PBMのパラメータと同様に、IR-A放射線を毎日浴びると、強力な人工光源(760-1450nm)よりもはるかに低い放射照度とフルエンス(線量)が得られる。
したがって、早朝の「太陽礼拝」(スルヤ・ナマスカール)と午後遅くのビーチでの先延ばしは、それぞれ予防と修復のための自然なPBM治療であると考えることができる。その結果、(早朝と午後の遅い時間に)自分の影が自分より背が高ければ、有害な紫外線のピーク(天頂)を避けながら、IR-Aの有益な効果を利用していることになる[60,61]。結局のところ、これはサン・スマートのもう一つの方法なのである。

ハイライト
-
皮膚におけるIRの影響に関する現状への挑戦。
-
太陽のIR-Aは皮膚に有害であるという現在の考えに立ち向かう。
-
太陽のIR-Aは、ほとんどの研究で使用されている人工的な放射源よりも放射照度が低い。
-
現実的な放射照度では、IR-AはコラーゲンとUVRダメージに有益な効果をもたらす。
-
IR-Aは悪い影響を与えるよりも良い影響を与える。







