コンテンツ
Gut microbiota and neurological effects of glyphosate
pubmed.ncbi.nlm.nih.gov/31442459/
ハイライト
- 環境汚染物質の殺虫剤やグリホサートとしての除草剤は、腸内環境を悪化させる。
- 糖質は、善玉菌に直接作用することで、腸内の微生物の組成を変化させる。
- グリホサートは、腸-脳軸に起因する中枢神経系および他の神経生物学的障害に影響を与える。
要旨
現在、ある種の環境毒素とそれらが発達障害に与える影響については、様々な懸念がある。グリホサート(グリホサート)は、農業で最も利用されている除草剤であるが、その普及した使用は、人間の細胞に発がん性がある可能性があることから、科学の世界では論争を巻き起こしている。
グリホサートは、植物だけでなくバクテリアにおいても、5-エノールピルビルシキメート-3-ホスフェート合成酵素(EPSP合成酵素)の阻害剤として作用する。腸内細菌叢からのEPSP合成酵素の阻害作用が報告されており、主に善玉菌に影響を与えている。
逆に、Clostridium spp.やSalmonella株はグリホサートに対して耐性があることが示されている。その結果、研究者たちは、グリホサートが有益な微生物と病原性微生物の間の不均衡によって特徴づけられる現象である腸内細菌叢の異常を引き起こす可能性があることを示唆している。クロストリジア菌などの細菌の過剰増殖は、脳内に高レベルの有害代謝物を発生させ、神経学的障害の発生に寄与する可能性がある。
本研究では、グリホサート誘発性腸内細菌異常症が中枢神経系に及ぼす影響を、情動障害、神経学的障害、神経変性障害に焦点を当てて検討した。遺伝的異常、妊娠に関連した問題、食事、感染症、ワクチン、重金属を強調するなど、脳に関連した変化に関連して、さまざまな要因が調査された。
しかし、最も国際的に使用されている除草剤であるグリホサートの行動障害への含意を決定するために、より多くの研究が必要とされている。
1. はじめに
気分調節、うつ病や認知機能に対するマイクロバイオームの影響は、長年にわたって実証され、受け入れられていた(Mangiola et al 2016; Naseribafrouei et al 2014)。消化器系内に存在する腸管神経系は、神経叢を形成するニューロンのネットワークで構成されており、中枢神経系(中枢神経系)と相互に接続されている(Furness er al)。微生物と中枢神経系との間を結ぶ経路は、迷走神経性情動と循環系(神経伝達物質、ホルモン、サイトカイン、代謝物)によって確立されている(Forsythe et al 2014)。
腸内マイクロバイオームを構成する微生物(細菌、真菌、ウイルス)のうち、細菌は、FirmicutesとBacteroidetesを中心に、ActinobacteriaとProteobacteriaの系統が最も重要である(1014)(Thursby and Juge、 2017)。それらの間の調和は、ビタミンの生産、病原体に対する保護、および免疫システムの変調を含む宿主個体に有益な効果を有する(Shreiner et al 2015)。
Firmicutes属の増加およびBacteroidetes属の減少を伴う腸内微生物の不均衡は、不利な宿主反応を引き起こし、ジスビオシスとして知られる現象を誘発する(Shreiner et al 2015)。腸内細菌叢のジスビオシスは、腸、心血管系および神経系の病態に対する感受性の増加と関連している。
したがって、過敏性腸症候群(IBS)は、腸内微生物に対する不適切な炎症反応の結果である(Bonaz、 2013)。同様に、IBS患者は、健康な被験者と比較して、ラクトバチルスおよびビフィズス菌が少なく、Firmicutes/Bacteroidetesの関係において2倍の比率が増大している(IcazaChávez、 2013; Kassinenら、 2007; Rajilić-Sttojanovićら、 2011)。
細菌膜の特定の化合物への全身暴露によって生じる代謝性エンドトキシン血症は、心血管系の危険因子として浮上している(Manco er al)。、 2010)。説得力のある証拠は、Firmicutesの過剰なレベルと、うつ病、双極性障害および認知症などの神経精神疾患との間の相関関係を支持している(Huang et al 2018;Naseribafrouei et al 2014)。
現在、プレバイオティクス、プロバイオティクス、糞便移植を含む微生物ベースの戦略は、代謝を促すためにユービオシスを促進することを目的としており、https://doi.org/10.1016/j.neuro.2019.08.006 Received 31 January 2019; Received in revised form 18 July 2019; Accepted 16 August 2019 ⁎ Corresponding author. Edificio de Ciencias de la Salud、 Universidad de Almería、 Ctra. Sacramento s/n、 04120、 La Cañada de San Urbano、 Almeria、 Spain. メールアドレス:pablo.roman@ual.es(P.ローマン)。Tメンタルヘルス(Jia et al 2018; Vigvári et al 2018)。
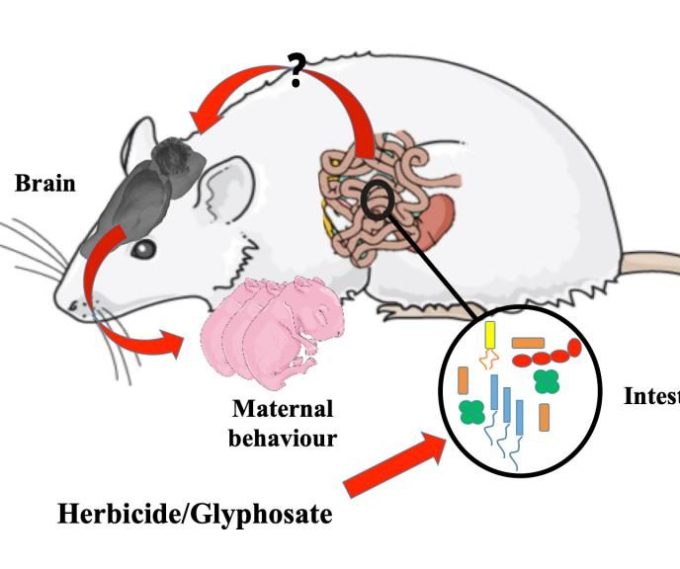
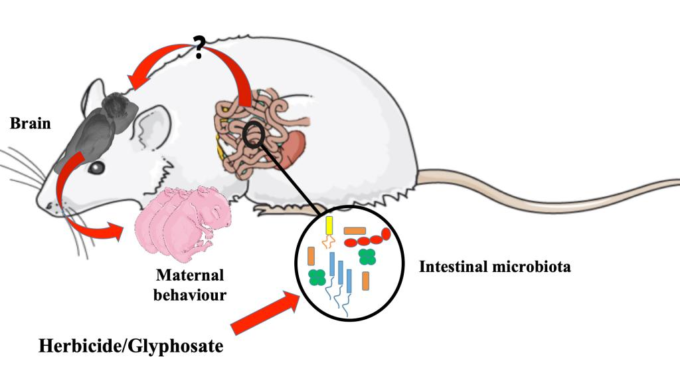
さらに、バイオシスは、いくつかの環境汚染物質、殺菌剤、殺虫剤、またはグリホサートのような除草剤を含む様々な要因によって引き起こされる可能性があり、これは本研究の焦点である。
N・(ホスホノメチル) グリシンは、一般的にグリホサート (グリホサート) として知られており、グリホサート ベースの除草剤 (GBH) と呼ばれる界面活性剤を用いたいくつかの製剤に含まれる活性化合物であり、例えばラウンドアップ® などが挙げられる。ラウンドアップ®は、農作物の雑草や低木を除去するための広範囲な全身性除草剤として1970年代に開発された。
この有機リン化合物は土壌中に浸透し、土壌微生物生態系に脅威を与える(Helander et al 2018年;Liu et al 2018)。さらに、グリホサートが水生生態系を汚染する能力を有することが確認されている(Peruzzo et al 2008; Van Stempvoort et al 2016)。
さらに、その後の研究では、水面および地下水の成長、移動範囲および動物の行動に有害な影響が示されている(Bridi er al)。グリホサートの経路を遮断する哺乳類のシキミ酸経路が存在しないため、グリホサートはヒトの健康に対するリスクの低い化合物であると論じられている。
それにもかかわらず、最近、グリホサートが細胞の変化を誘発する可能性があることが実証されているため、現在進行中の論争がある(Gasnier et al 2009; International Agency for Research on Cancer、 2015)。ヒトへの暴露は、農業由来のいくつかのグリホサート汚染食品の摂取によって可能であるかもしれない。最近、除草剤の痕跡が粉ミルク、蜂蜜、穀物または大豆から発見されていることを考えると、グリホサートへの暴露に続いてヒトの健康が損なわれる可能性がある(Rubio er al)。 2014)。
現在の報告では、ビールやワインなどの農作物から、人間が消費するほとんどの飲料に、51ppbから3.5ppbの濃度でグリホサート(95%)が存在することが示されている(Cook、 2019)。消化管は、摂取量のごく一部(0.7%未満)であるグリホサートの限られた部分を吸収することができる。
それはその後、加水分解によってその主要代謝物であるアミノメチルリン酸(AMPA)に代謝され、残りは尿および糞便を介して急速に除去される(Brewster et al 1991年;Williams et al 2000)。にもかかわらず、グリホサート含有食品のヒト消費のリスクは、特に小児および妊娠中に評価され続けている。
本研究では、グリン誘発性バイオシスと、自閉症スペクトラム障害(ASD)などの神経変性および神経発達病理における認知および運動の悪化との間の可能性のあるリンクを述べている。ここでは、グリホサートinduced dysbiosisがうつ病・不安症、自閉症、アルツハイマー病、パーキンソン病に及ぼす悪影響について検討する。
グリホサートの作用モード 前述したように、GBHの主成分であるグリホサートは、農作物の雑草を除去することができるため、一部の著者によると、パフォーマンスを向上させ、より大きな経済的利益を提供することができるため、農業界にとって不可欠な化合物である(Kraehmer et al 2014)。植物において、芳香族アミノ酸の一次代謝に関与する原始芳香族化合物は、すべてシキミ酸経路によって生成される。
1956年にBernhard Davisらによって発見されたグルコースからのシキミ酸の経路は、フェニルアラニン、チロシン、トリプトファンなどの基本的な芳香族アミノ酸の生合成を担っている(Herrmann and Weaver、 1999)。グリホサートに関しては、阻害作用の部位は経路の第6段階にあり、5-エノールピルビルシキメート-3-リン酸合成酵素(EPSP合成酵素)がシキメート-3-リン酸(S3P)とホスホエノールピルビン酸(PEP)との反応を触媒している。
5-エノールピルビルシキメート-3-リン酸(EPSP)を生成し、3つの芳香族アミノ酸の前駆体であるコリスメートの形成につながる中間体である(Meda and Dudareva、 2012)。Zhan er al)。、 2018)の研究成果を発表した(図1)。
また、3種類のアミノ酸はいずれも植物の二次代謝物の多くの種類の前駆体であり、シキメート経路の主枝の中間体は二次生成物の生合成の出発点としても機能している(Herrmann、 1995)。
酵素EPSP合成酵素は、単量体構造を有し、分子量は46Kdaに近い。さらに、精製により得られ(Shuttleworth et al 1992)、大腸菌におけるX線結晶構造解析により立体形成が確認されている(Schonbrunn et al 2001)。EPSP合成酵素は2つのドメインを持ち、その交差またはインタードメインはグリホサートの作用部位に位置している。
反応はCeO結合の開裂を介して行われ、POeの開裂は、基質としてPEPを有するほぼすべての酵素において正常である。グリホサートは構造的にPEPに類似しており、ゆっくりと可逆的な反応でEPSP合成酵素を阻害するためにそれと競合する。この酵素は、2つのほぼ等しいドメインに折り畳まれており、それぞれがβαβαβ折り畳みユニットの3つのコピーから構成されている(Ribeiro Marques et al 2007)。
EPSP合成酵素の2つのドメインは、互いに接近し、ドメイン間の空洞を生成する。グリホサートは、活性部位の空洞をほとんど乱すことなく、S3Pの近くで結合し、酵素-S3P複合体に非常によく似ている。S3Pの5-ヒドロキシル基とグリホサートの窒素との間には水素結合の相互作用がある。さらに、基質と阻害剤の間には、Lys-22の側鎖と水分子W2を介した2つのさらなる相互作用がある。グリホサート結合部位(両方の酵素ドメインにおいて)では、PEP結合に関与するLys-22、Arg-124およびLys-411のような電荷を帯びた残基が優勢に存在する。
Asp-313は、おそらくプロトンアクセプターとして作用し、一方、Lys-22は、無機リン酸塩の形成をサポートするために、シスタイル結合の酸素をプロトン化することができる(Schonbrunn et al 2001)。開放状態と閉鎖状態の間のコンフォメーションの変化は、このように、第一段階でS3Pが結合し、空洞内に正電荷の蓄積を生じさせ、酵素の活性部位(PEPまたはグリホサート)に負電荷を帯びた分子を引き付ける能力を有することに起因している。
その結果、グリホサートは酵素にアロステリックに結合するのではなく、競争的な方法でPEPの結合部位を占有する(Herrmann and Weaver、 1999; Ribeiro Marquesら、 2007)、3.グリホサートの主な毒性効果 グリホサートとGBHの効果の大部分が哺乳類で観察されていることを考えると、ヒトにおけるグリホサートの毒性についての懸念が浮上している。
豚の不妊や奇形と、肝臓や腎臓での高濃度のグリホサートへの曝露との間には直接的な関係があることが示されている(Krüger et al 2014b、2014a)。十分な証拠は、グリホサートの使用の増加と多種多様なヒトの疾患との間の相関関係を確認している。
研究では、腎臓障害、様々な種類の癌、注意欠陥多動性障害、自閉症、うつ病、不安症、アルツハイマー病、パーキンソン病などの神経学的・情緒的疾患を含む有害な結果が示されている(Van Bruggen et al 2018)。
世界保健機関(WHO)のがん専門機関である国際がん研究機関(IARC)は、実験動物における発がん性の十分な証拠と、ヒトにおける限られた証拠に基づいて、グリホサートをヒトに対する発がん性の可能性のある物質(グループ2A)に再分類した(国際がん研究機関、2015)。
この発がん性分子としての潜在的な役割は、研究者の間で大きな議論を呼んでいる。実際、2016年、FAO/WHO合同残留農薬会議(JMPR)は、マウスでの発がん性は、ヒトでは不可能なほどの高用量で産生されるため、そのようなリスクは存在しないと投稿した(FAO/WHO合同残留農薬会議、2016)。
それにもかかわらず、いくつかの知見は、グリホサートおよびGBHが、400mg/kgで処理されたげっ歯類、および0、5μg/mlの許容可能な1日摂取量でのヒト細胞株においてDNA損傷を誘発することを支持し、確認している。例えば、グリホサートの存在下で、ヒトリンパ球における小核細胞および染色体異常の量の増加および細胞増殖の刺激がある(Guyton et al 2015; Kašuba et al 2017; Mañas et al 2006; Santovito et al 2018)。
グリホサートが腫瘍の発生に関連した変化を引き起こす可能性があるという考えは、グリホサートへの職業的曝露が非ホジキンリンパ腫の有病率を大幅に増加させ、多発性骨髄腫のリスクを示唆する疫学研究によって補強されている(De Roos er al)。、 2005; Eriksson er al)。、 2008)。
さらに、多様な研究が、ヒト細胞株およびラット精巣におけるグリホサートおよびGBHのアロマターゼ活性および生殖変化に対する影響を確認しているように、出生前の期間から成人期までのその暴露は、内分泌作用を誘導する(Manservisi et al 2019)。同様に、グリホサートの存在下でのホルモン依存性T47D細胞株に対する増殖効果は、エストロゲン経路の活性化を介して見出された(Thongprakaisang et al 2013)。
それにもかかわらず、欧州食品安全局(EFSA)は、グリホサートがホルモン阻害特性を有するという主張を拒絶した(欧州食品安全局、2017)。さらに、欧州連合は、今後5年間の使用を承認した(欧州委員会、2017)。この論争に加えて、グリホサートは、シキメート経路に関与する腸内細菌酵素に有害な影響を与える可能性があることも示唆されている(Aitbali et al 2018)。グリホサートは、EPSP合成酵素を競合的に阻害し、細胞の生存に不可欠なフェニルアラニン、チロシンおよびトリプトファンなどの芳香族アミノ酸の形成を阻害する(Schonbrunn et al 2001)。
グリホサートは、EPSPを発現する草や雑草を除去するために特別に設計された。同様に、酵母、藻類、細菌株および真菌もまたEPSPを発現し、したがってグリホサートはそれらにも影響を及ぼす(Bode et al 1984年;Cao et al 2012年;Du et al 2000年;Hellander et al 2018年;Smedbol et al 2017)。
逆に、この酵素は、哺乳類では、食事から3つのアミノ酸を得るので、哺乳類には存在しないので、シキメート経路を介したグリホサートの毒性効果は考えられないことを意味している。
このルートでEPSP合成酵素の活性を妨害する化学物質は、合理的な濃度で処理された場合、ヒトのための “安全 “と考えられている。しかしながら、動物モデルにおける腸内細菌叢への有害な影響の新たな証拠があり、グリホサートがヒトのホメオスタシスにおいて有害な役割を有することが示唆されている。主に、グリホサートが有益な細菌によって腸内の微生物の組成を変更し、腸内微生物の不均衡またはジスビオスを発生させることが提案されている(表1)。
マウスに慢性および亜慢性のGBHを繰り返し経口摂取すると、腸内細菌数が減少することが報告されている。彼らの腸内細菌叢は、対照動物と比較して高いレベルのFirmicutesおよびCorynebacterium phylumを示した(Aitbali et al 2018)。
同様の研究は、主に雌ラットに影響を与えるラクトバチルスよりもバクテロイデスの増加によって特徴づけられる、グリホサートによって誘導される性とジスビオシスとの間の関係を提案している(Lozano et al 2018)。さらに、Firmicutes属の変化もまた、飲料水を介したGBHへの母体曝露後のラットの仔で見られている(Mao er al)。
ミツバチの腸内マイクロバイオータもまた、グリホサートに対して脆弱であり、有益な細菌組成の弱体化をもたらす。細菌群集はグリホサートの存在下では減少し、ミツバチは死亡率を促進する日和見病原体であるセラチアによる感染を受けやすくなる(Motta er al 2018)。
同様に、高レベルのボツリヌス神経毒が、グリホサート処理水の摂取後の牛の微生物のルーメン液中に見られ、Entodinium spp、Epidinium sppの減少と同様に、図1に示されている。
シキミン酸経路を阻害するグリホサートの作用機序
表1 グリホサートおよびGBH曝露後の腸内細菌叢の変化。
モデル名 マイクロバイオータ組成の変化 参考文献 マウス グリホサート および GBH の経口摂取 ↑ Firmicutes spp. ↑ Corynebacterium spp. 2018) ネズミの子ネズミの母体経口摂取 グリホサート と GBH ↑ Prevotella 属 ↑ Muscispirillum 属 ↓ Lactobacillus 属 ↑ Aggregatibacter 属 (Mao er al)。
ミツバチ 経口摂取 グリホサート ↑ Guilliamella apicola ↓ Snodgrasella alvi ↓ Bifidobacterium ↓ Lactobacillus (Motta er al)。
牛の経口摂取 グリホサート ↓ Entodinium ↓ Epidinium ↓ Ophryoscolex ↓ Dasytricha (Ackermann er al)。
Enterococcus 株 グリホサート と GBH とのインキュベーション ↓ Enterococcus spp. (Krüger er al)。
家禽微生物群 試験管内試験(in vitro) GBH とのインキュベーション ↑ Echerichia coli ↑ Salmonella enteriditis ↑ Salmonella typhiminium ↑ Salmonella gallinarum ↑ Clostridia spp ↓ Enterococcus faecalis ↓ Enterococcus faecium ↓ Bacillus badius ↓ Bacillus cereus (Shehata er al)。
L. Rueda-Ruzafa、 er al)。
神経毒性 75 (2019) 1-8 3 Ophryoscolex sppおよびDasytricha spp(Ackermann er al)。
しかし、牛のルーメンにおける微生物組成の変化は、別の研究では発見されていない(Riede et al 2016)。
馬および牛から単離された腸球菌株上のグリホサートの存在は、下痢または偽膜性大腸炎などの疾患を引き起こし、Clostridium botulinumに対する抑制的役割の変化に関連して、低レベルのEnterococccus spp.を誘導した(Krugreger et al 2013)。
Enterococcus faecalis、E. faecium、Bacillus badiusおよびB. cereusのような有益な腸内細菌はグリホサートに対して感受性であることが判明したが、Escherichia coli、Salmonella enteritidis、S. typhimurium、S. galliarumおよびClostridia種のような病原性細菌は、家禽のマイクロバイオータを用いた実験でグリホサートに対して顕著な抵抗性を示している(Shehata er al)。
しかし、これらの耐性の根底にあるメカニズムはまだ解明されていない。
ここでは、EPSP合成酵素の種類の違い(クラスIとII)が注目される。
クラスIの酵素は多くの細菌や植物に存在するのに対し、クラスIIの酵素は一部のグリホサート耐性菌でしか発見されていない。
どちらも構造は似ているが、アミノ酸配列が異なる。
様々なアミノ酸残基の違いにより、クラスIのEPSPSではグリホサートに対する感受性が、クラスIIの酵素ではこの除草剤に対する耐性に関与する可能性が示唆されている(Li et al 2009)。さらに、クラスII EPSP合成酵素の変異や、アクチノバクテリアの抗生物質、重金属または芳香族化合物の解毒に関与する分子であるマイコチオールの産生も、グリホサート耐性に関与する可能性があることが報告されている(Van Bruggen et al 2018)。
グリホサートを自発的に摂取した印象的な事例が報告され、腸管粘膜への影響とともにヒトにおけるクロストリジウム・テルティウム菌血症の発症素因を示唆している(You er al)。哺乳動物の微生物相に対するグリホサートまたはGBHの研究はほとんど行われていないが、これまでのところ、すべての知見は、Clostridium sppおよびおそらくいくつかのSalmonella株のようなグリホサート耐性微生物の過剰増殖を示している(Krüger et al 2013; Shehata et al 2013)。
4. グリホサートと微生物関連疾患
グリホサートは中枢神経系の神経毒性を直接誘導することを強調する価値がある。例えば、グリホサートおよびGBHは、モノアミン作動性神経伝達物質のレベルの変化(Martínez et al 2018)、酸化環境の生成(El-Shenawy、2009)、グルタミン酸興奮毒性(Cattani et al 2017)および奇形(Paganelli et al 2010)などの生化学的、神経生理学的および発達脳の障害を生成する。
これらの変化は、以下にレビューする前臨床研究と臨床研究の両方で示されているように、腸脳軸の混乱に関連している可能性がある。
4.1. 前臨床所見
腸内微生物の多様性や豊かさの乱れが、腸脳軸による抑うつ・不安と強く関係していることが明らかになってきている。実際、うつ病患者の糞便微生物叢をげっ歯類に移植すると、うつ病様症状を誘発する可能性がある(Kelly et al 2016; Zheng et al 2016)。
菌を含まないマウスは、特定の病原体を含まないマウスと比較して、海馬の扁桃体および歯状顆粒層における神経化学的シフトを伴う抗不安行動を示した(Neufeld et al 2011)。さらに、ネズミをエンロフロキサシンで7日間処理した後、微生物組成物の変化が誘導され、攻撃的行動を引き起こした(Sylvia et al 2017)。
そのようなCampylobacter jejuni、Citrobacter rodentiumまたはTrichuris murisなどの病原体への感染は、動物における不安のような行動を増加させた(Bercik et al 2010; Goehler et al 2008; Lyte et al 2006)。さらに、GBHへの経口曝露は、Firmicutes、Corynebacterium、BacteroidetesおよびLactobacillusの豊富さを減少させ、マウスにおける不安誘発性および抑うつ性行動の出現と関連していた(Aitbali et al 2018)。
抑うつ性および不安様障害は、ラットにおける腸内微生物の多様性および豊かさの変化と、プロ炎症性サイトカインの増加とともに関連している(O’Mahony et al 2009)。さらに、ラットの子孫におけるGBHへの亜慢性曝露に続いて、神経化学的変化が発見され、そのようなグルタミン酸過活動および海馬における酸化的損傷は、成体子孫における抑うつ行動と関連していた(Cattani et al 2017)。
蓄積された証拠は、細菌壁化合物がASDの神経病理学的変化に関与していることを示している。例えば、リポ多糖類(LPS)は、グラム陰性腸内細菌の外側細胞壁に固定された糖脂質エンドトキシンであり、増殖または溶解プロセス中に腸管腔内に放出される(Alexander and Rietschel、 2001)。
LPSはLPS結合タンパク質(LPB)やCD4と結合してTLR4を活性化し、NF-KB活性の上昇を誘発し、それによって炎症性シグナルや免疫関連遺伝子の転写が異なる組織で誘導されることがよく知られている。サイトカインの作用以外にも、LPSは血液脳関門を通過することにより(Banks and Robinson、 2010; Zhouら、 2014)、あるいは求心性迷走神経線維を刺激することにより、脳への到達が最小限に抑えられることが示唆されている(Hansenら、 2000)。
今回の検討では、Clostridiumはグリホサートに対して耐性を有しており、グラム陽性菌に属しているため、LPSによる脳毒性には関与していないと考えられる。家禽の腸内でグリホサートの存在下で有意に上昇する大腸菌、S. enteritidis、S. typhimuriumおよびS. galliarumは、それらの細胞壁におけるLPSによる脳機能障害の素因に関与している可能性がある(Shehata et al 2013)。
LPSの経口摂取を受けたラットでは、不安様行動の増加が発見された(Fields et al 2018)。
その結果、ラクトバチルス・ロイテリ(Lactobacillus reuteri)およびビフィドバクテリウム・アドレセンティス(Bifidobacterium adolescentis)の処置による腸内細菌叢の再構成は、不安/抑うつ症状を呈するストレス誘発マウスにおける抑うつ症状および不安様行動を減少させた(Jang et al 2019年;Kantak et al 2014)。
ロテノンによって誘導された糞便粘膜の破壊は、パーキンソン病(パーキンソン病)のマウスモデルにおいて、対照群よりも低いFirmicutes/Bacteroidetesの比率で見出された(Perez-Pardo et al 2018)。別の研究では、細菌代謝物の顕著な増強とともに、パーキンソン病マウスにおいてFirmicutes属が減少し、Proteobacteria属が増加することが示された。
これらのパーキンソン病動物において、糞便性微生物叢移植は、運動障害および黒質のミクログリア活性を減少させた(Sun et al 2018)。腸内細菌叢の役割は、主に神経炎症性機序によるアルツハイマー病(アルツハイマー病)の病態形成にも関連していた。
Aβ前駆体タンパク質(APP)トランスジェニックマウスでは、細菌の糞便組成が変化し、リケネルラセア属の増加とAkkermansiaとAllobaculumの割合の減少が見られた(Harach et al 2017)。ラクトバチルスやビフィズス菌などのプロバイオティクスの投与は、記憶力、行動障害を改善し、アルツハイマー病のげっ歯類モデルにおけるAβプラーク形成を緩和した(Athari Nik Azm et al 2018年;小林 et al 2017)。
すべてのすべてにおいて、これらの知見は、腸内細菌叢に関連する組成の問題が行動障害の引き金となる可能性があることを示唆している。
4.2. 臨床所見
うつ病/不安症に関しては、これまでの臨床データは、腸内細菌叢とこれらの障害との関係について動物で観察された結果と一致している。うつ病患者では、治療抵抗性、非抵抗性を問わず、健常者と比較してFirmicutes、Bacteroidetes、Proteobacteriaの著しい減少を伴う腸内組成の変化が認められた(Jiang er al)。
ラクトバチルス・ヘルベティカス(Lactobacillus helveticus)およびビフィドバクテリウム・ロングム(Bifidobacterium longum)を含むプロバイオティクスの併用投与は、非投与群と比較して抗うつ効果および抗不安効果を示した(Messaoudi et al 2011)。
第2節に示されているように、グリホサートは、腸内のジスビオーシスだけでなく、いくつかの情動性疾患を誘発し得る(Van Bruggen et al 2018)。一つの可能性として、腸内細菌組成物のこれらの変化は、腸管腔内の短鎖脂肪酸(SCFA)の産生に変化を生じさせる可能性がある。
このような酪酸(BA)、プロピオン酸(PPA)または酢酸(AA)などのSCFAsは、食物繊維の細菌発酵に由来する代謝物であり、L. Rueda-Ruzafa、他の神経毒性75(2019)1-8 4だけでなく、トランジットを改善するエネルギー源として腸自体にだけでなく、免疫システムをサポートする上で、健康維持に様々な役割を果たしている(Wichmann et al 2013)。
また、SCFAの不適当なレベルは、神経精神疾患に苦しむことに素因因子として示唆されている(MacFabe et al 2007; Zhang et al 2017)。また、グリホサートが植物のマンガン(Mn)レベルを著しく低下させることも判明した。
グリホサートのMnホメオスタシスの破壊は、乳酸菌に選択的に影響を与え、パーキンソン病などのいくつかの障害を引き起こす可能性がある(Samsel and Seneff、 2015)。実際、マンガンの工業的放出が多い都市部ではパーキンソン病の発生率が増加しており(Willis et al 2010)、グリホサートへの偶発的な曝露によりパーキンソン病に関連した症状を引き起こすものもある(Barbosa et al 2001)。
メカニズムは不明のままであるが、腸内環境異常に関連している可能性がある。パーキンソン病患者における腸管の腸内環境異常および透過性の亢進は、免疫学的刺激を引き起こすが、微生物由来の代謝物による腸管ニューロンの活性化は、誤ったα-シヌクレインフォールディングの開始に寄与する可能性がある(Caputi and Giron、 2018; Poirierら、 2016)。
さらに、腸内微生物由来の代謝物と、ジスビオシスの状況下での自閉症患者の症状の発現との間に相関関係が見出された(Roman er al)。 2018)。この点で、クロストリジウム菌の腸管へのコロニー化と自閉症との間の相互関係が示されている(Argou-Cardozo and Zeidán-Chuliá、 2018)。
ヒトの腸内細菌組成の不均衡があるグリホサートに曝露された動物のアルツハイマー病の病因には、ヒトの腸内細菌異常も関連している。アルツハイマー病患者は、FirmicutesとBifidobacteriumの両方のレベルの低下とBacteroidetesの増加を示した(Vogt et al 2017)。
さらに、アルツハイマー病患者の腸内のEscherichiaおよびShigellaの豊富さと脳アミロイドーシスおよび行動障害との間に相関関係が指摘された(Cattaneo et al 2017)。さらに、LPSの上昇したレベルは、脳内およびアルツハイマー病患者の血漿中で発見されている(Zhan et al 2016;Zhang et al 2009)。
さらに、グリホサート曝露は最近、おそらく乳酸菌およびビフィズス菌のレベルの低下およびp-クレゾールの毒性のために、セリアック病の増加と関連している(SamselおよびSeneff、2013)。また、p-クレゾールと3-[3-ヒドロキシフェニル]-3-ヒドロキシプロピオン酸(HPHPA)は、ASD-子供の尿中マーカーとして使用されている別のクロストリジア属フェノール代謝物(Shaw、 2010; Xiongら、 2016)が、ドーパミンをノルアドレナリンに変換するドーパミン-β-ヒドロキシラーゼを阻害することも明らかにされた(DeWolfら、 1988; Goodhartら、 1987)。その結果、グリホサートの使用とASDとの間の正の相関が提案された。
提案されたメカニズムは、Clostridium spp.からの代謝物の過剰生産がドーパミンとその代謝物の過剰生産を誘発し、ドーパミンキノン種の形成を介して活性酸素を発生させ、ミトコンドリアの機能不全と酸化ストレスを導くという点で、パーキンソン病に類似していた(Shaw、 2017)。発達途上の健康な集団は、免疫系、消化器系、神経系が完全に発達していないため、環境汚染物質に対して最も脆弱な集団の一つであると考えられている。
空気、水、または土壌からの任意の汚染物質への曝露は、彼らの身体的または精神的な発達に損傷を与える可能性があり、これはグリホサートに起因するものである。子供が朝食のシリアルに含まれるグリホサートを摂取すると、腸内微生物のバランスを崩す可能性がある。
グリホサートが若い個体に腸内細菌の異常を誘発するという考えは、哺乳類の実験でも複合的に見られている。研究は少ないが、腸内微生物レベルの乱れは、グリホサートへの暴露後に不安や抑うつに関連した行動の増加を誘発することが指摘された(Aitbali et al 2018)。
自閉症児に見られる消化器症状は、高レベルの病原性細菌および消化器問題を示す腸内マイクロバイオームの変化に関連している(Roman et al 2018)。神経発達障害とグリホサート周産期暴露との間の相関の証拠は、グリホサートで処理された妊娠齧歯類において報告され(Yu et al 2018)、ここで、酵素的混乱のプロセス(Daruich et al 2001; Gallegos et al 2018)およびグルタミン酸放出の誘導が子孫に出現した(Cattani et al 2014)。
自閉症児の腸内微生物密度が健常児と異なり、有益な細菌群であるビフィズス菌が減少していることはよく知られている(De Angelis et al 2013)。最近の知見では、腸内細菌叢からの代謝物と自閉症障害との間に密接な関係があることが示されている。
したがって、LPSへの周産期暴露は、子孫におけるASDの存在の危険因子として明らかにされ(Knuesel et al 2014)、糞便または尿中のp-クレゾールの存在はASDのマーカーとして使用されている(Altieri et al 2011; Gabriele et al 2016)。しかし、ASDの出現後に細菌の不均衡が生じるのか、それともこの病理学的症状の引き金となるのかはまだ不明である。
最後に、ほとんどの研究に関連して、主な制限は、高用量のグリホサートまたはGBHを使用することであり、これは哺乳類の組織で取得することが困難であり、臨床的な妥当性に疑問を呼んでいる。さらに、グリホサートの有害な影響は、特にRoundup®などのGBH製剤中のアジュバントに起因する可能性が示唆されている。
例えば、グリホサートが植物細胞に浸透するためには、強力な細胞毒性効果を示すポリオキシエチレンアミンなどの界面活性剤の存在が不可欠です(Defarge er al)。これに伴い、多くの研究が、グリホサートに基づく市販の製剤の代わりにグリホサートを用いて実施されてきた。
私たちの知る限りでは、情報の不足、矛盾するデータ、および研究の独立性により、ヒトに対するグリホサートの安全性に関する論争が生じている。グリホサートの使用が許可されているにもかかわらず、その無差別な使用は人の健康に有害な影響を及ぼす可能性がある。
我々は、グリホサートによる腸内マイクロバイオーム障害が情動障害やASDなどの神経疾患に関与している可能性のあるメカニズムを評価していた。しかし、腸内細菌群におけるグリホサートの役割と神経行動疾患におけるその結果を明らかにするためには、さらなる研究が必要とされている。
さらに、既存の文献の不足により、今後の研究では、除草剤中毒を治療するためのNAC、ビタミンC、ビタミンE、シクロホスファミドまたはプロバイオティクスの利用などの革新的なアプローチの役割を評価する必要がある(Cherukuri et al 2014)。