コンテンツ
Immunological co-ordination between gut and lungs in SARS-CoV-2 infection
https://www.sciencedirect.com/science/article/pii/S0168170220308649
ハイライト
- SARS-CoV-2は現在、COVID-19と呼ばれる大規模なパンデミックを引き起こしている。
- SARS-CoV-2は ACE2受容体の存在により あらゆる臓器に影響を与える
- 腸と肺の間の免疫学的調整は SARS-CoV-2がGI管に感染するのを容易にする
- SARS-CoV-2のウイルスRNAがCOVID-19患者の便サンプルから検出された。
- SARS-CoV-2 の糞便経口感染の可能性がある。
要旨
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、前例のない世界的な健康危機を生み出したコロナウイルス病2019(COVID-19)と呼ばれる大パンデミックに発展し、ヒトからヒトへの感染に強い能力を持つことから、深刻な脅威として浮上した。
報告によると、SARS-CoV-2は、アンジオテンシン変換酵素2(ACE2)として知られる受容体が全身に存在するため、ほぼすべての臓器に影響を及ぼす能力があることが示されている。ACE2受容体は、肺の繊毛細胞および肺胞上皮Ⅱ型細胞とともに、腸管腸球のブラシ境界に主に発現している。ACE2のアミノ酸輸送機能は、消化管(GI)における腸内微生物の生態と関連しており、それによりCOVID-19は、ある程度のレベルで腸内微生物叢と関連している可能性が示唆されている。
COVID-19患者のかなりの数は、GI管内で肺外症状を示す。その後の多くの研究で、COVID-19患者の糞便サンプルからSARS-CoV-2のウイルスRNAが検出された。このことは,COVID-19感染症の診断と管理において,適切な衛生管理に注意を払うという新たな課題を提示している.ここでは、炎症性腸疾患(IBD)患者および非IBD患者において、SARS-CoV-2の感染・増殖を促進する腸と肺の免疫学的な調整について議論することを目的とする。
1. 序論
ヒトの腸は、腸の恒常性を維持するためにいくつかの代謝物を産生するBacteroidetesおよびFirmicutes(Foster and Neufeld, 2013)が主に支配する巨大な腸内微生物の集団のための生態学的ニッチである(Carabotti er al)。 腸内微生物は、ビタミン合成(Rowland et al 2017)、病原体に対する保護(Hillman et al 2017)、宿主免疫系の発達および成熟(Proctor、2019)、腸管血管新生(BaumgartおよびCarding、2007)、および腸管上皮の分化および増殖(O’HaraおよびShanahan、2006)などの重要な役割を果たしている。
腸内微生物のプロフィールは、健康な人の間では相対的な豊富さや分散性が似ているなど、個人差がある。また、人の腸内細菌叢は生涯を通じて変化し続け(Carabotti et al 2015)、成人期に最も安定している(Nicholson et al 2012)。
そのような、正常な腸内微生物組成からの任意の偏差は、病原菌のブルームとBacteroidetesおよびFirmicutesのような「重要な」分類群の不安定性または減少によって特徴付けられる「微生物の異常生物」として定義される(Ahlawat et al 2020年; Duboc et al 2013)。目的のために、腸内細菌叢異常症の概念は、(Brüssow, 2020)によって発表されたミニレビューで議論されている。
また、健康な人の肺には、主な菌種として、フソバクテリウム属、ヘモフィルス属、プレボテラ属、ストレプトコッカス属、ヴェイロネラ属が生息しており、これらは腸内微生物叢と比較して比較的小さな菌種である(He et al 2017)。肺微生物叢の出現と維持は、上気道からの微生物の移動と宿主防御システムによる微生物の除去との間の平衡によって支配され、在来微生物の増殖による寄与は少ない。
低濃度であっても、気道マイクロバイオームは、微生物の移動と除去の間の不均衡が、その宿主を呼吸器疾患の進行および増悪に向けて素因とするような宿主免疫にとって極めて重要である(He et al 2017; Wypych et al 2019)。例えば、嚢胞性線維症の患者は、Burkholderia spp.、緑膿菌、および黄色ブドウ球菌のような種を有する下気道における細菌の負担が増大している。
喘息も多因子性呼吸器疾患の一例であり、放線菌、Firmicutes、Proteobacteriaの多様性が高い(Marri er al)。 最近、腸内細菌叢とコロナウイルス疾患との関連性の可能性についての報告がある(COVID-19)(Dhar and Mohanty, 2020)があるが、胃腸(GI)症状に関する臨床データの急速な生成により、最新の評価がまだ必要である。
したがって、本レビューでは、COVID-19感染の経過を通して、2つの重要な器官、すなわち、腸と肺の間に免疫学的な調整が存在することを示唆する、最も更新されたエビデンスを要約する。
2. SARS-CoV-2とCOVID-19の発生
コロナウイルス感染症(COVID-19)は、世界的に確認感染者数が1,050万人に迫り、死亡者数が60万人を超える現在進行中のパンデミックである。本疾患は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)、コロナウイルス科コロナウイルス属、ベータコロナウイルス属のポジティブセンス一本鎖RNAウイルスによって引き起こされる(Wong et al 2020)。SARS-CoV-2のプロテオームは、4つの構造タンパク質(膜(M)、エンベロープ(E)、ヌクレオカプシド(N)、スパイク(S))から構成されている。
He et al 2020)、15個の成熟非構造タンパク質(nsp1-10およびnsp12-16)、および9個の付属タンパク質(Prates et al 2020)。一般に、コロナウイルスは、エンベロープ型、ポジティブセンス型、非分割型、および一本鎖RNAウイルスであり、ヒト疾患を引き起こすことが知られている6種のウイルスである。
SARS-CoV-2は、ヒトに感染することが知られている7番目の種として登場した。その大部分は軽度の呼吸器疾患を引き起こす。しかし、2002年の重症急性呼吸器症候群コロナウイルス(SARS-CoV)や2012年の中東呼吸器症候群コロナウイルス(MERS-CoV)のように、過去数十年の間に致死的なコロナウイルスが散発的に出現しており、同じくBetacoronavirus属に属する(Zaki et al 2012)。
ごく最近の2019年12月に、中国湖北省武漢市で原因不明の肺炎の症例が診断された。その後、様々な患者の下気道のサンプルから新しいコロナウイルス、すなわちSARS-CoV-2が得られた(Repici et al 2020)。この疾患は、軽度の呼吸器から抜本的な肺損傷、高炎症および「サイトカインストーム」症候群によって駆動される多臓器不全(Neurath、2020)、および死亡(Lamers et al 2020)に至るまでの症状を有する、インフルエンザのような疾患であることが指摘されていた。
幸いなことに、SARS-CoV-2は、エボラ、SARS、およびMARSのような他の人獣共通感染症と比較して、より低い(〜4%)死亡率を有しており、15〜90%の範囲でより高い死亡率を有している。しかし、SARS-CoV-2が他のコロナウイルスのように感染を抑制できなかったのは残念なことである。
また、ゲノムの比較研究により、380アミノ酸からなる小さなフラグメントの変異が、様々なSARS様コロナウイルスとSARS-CoV-2の間で発見されている。報告された変異は、COVID-19の病原性発散を決定するために重要であると考えられている(Prates et al 2020)。
さらに、呼吸器疾患、心血管疾患、高血圧、糖尿病、および患者の年齢のような併存疾患は、COVID-19の発現を悪化させる可能性がある。加齢は、後天的な免疫系の障害と関連しており、免疫老化および炎症老化、または慢性的な不顕性炎症のゆっくりとした発生によって特徴づけられる。
したがって、制御されていない高炎症、Bリンパ球主導の後天性免疫の大幅な低下、形質細胞様樹状細胞(DC)のI型インターフェロン(IFN)経路の障害、およびACE2発現の低下を伴う高齢男性におけるSARS-CoV-2感染は、高い死亡率を誘導することが提案されている(Gubernatorova et al 2020)(図1)、また、病気の病因のパンドラの箱を開くことにもなる。
図1

図1. 様々な年齢層における腸内細菌叢の変化とCOVID-19関連死亡率のグラフ化。出典は以下の通り。Ahlawat et al 2020年;Novel、2020年。
3. SARS-CoV-2はどのように人体に影響を及ぼすのか?
現在、病理医や臨床医は、SARS-CoV-2が人体に伝播する際にどのようなダメージを与えるのかを必死で解明しようとしている。彼らは、私たちの肺が最も危険な状態であっても、ウイルスは驚くほど、破壊的な動機で腎臓、心臓や血管、脳、腸などの他の臓器に移動することができることを発見した(Wadman er al)。
新型コロナウイルスが感染者から排出されたウイルスを含んだ液滴の吸入によって鼻や喉に侵入すると、アンジオテンシン変換酵素2(ACE2)として知られる受容体の存在により、鼻の粘膜によって前例のない歓迎を受ける。この受容体は全身に存在し、宿主の血圧を調節する働きをしている(図2)。
しかし、COVID-19感染の場合、ウイルスが細胞内に入るためには受容体を必要とするため、宿主組織は潜在的に感染しやすい状態になる。その後、ウイルスは細胞の機械を引き継いで複製し、新しい細胞に侵入する。この初期段階では、免疫システムがSARS-CoV-2に抵抗しなければ、ウイルスはその後、肺に侵入するために下に移動し、致命的なレベルにまで成長することができる。
侵略者との戦いの免疫システムは、空気嚢から体の残りの部分への酸素の移動を混乱させる。さらに、前頭の戦士、すなわち白血球(WBC)はケモカインを放出し、その結果、より多くの免疫細胞にウイルス感染細胞を標的にして殺すように指示し、それによって肺炎の基本的な病理学、すなわち、死細胞と膿を含む体液で満たされた嚢を残す。剖検では、WBC、粘液、および損傷を受けた肺細胞のデトリタスを含む肺胞に液体が充填されていることが示された(Wadman et al 2020)。
また、一部の患者は二次的な細菌性および真菌性気道感染症にも罹患する(Tay et al 2020)。しかし、重症患者における疑われる原動力は、「サイトカインストーム」と呼ばれるヒト免疫系の壊滅的な過剰反応であり、特定のサイトカインのレベルが一般的に体内で必要とされるレベルをはるかに超えて上昇し、免疫細胞が宿主の健康な組織を攻撃し始めるようなものである。
図2
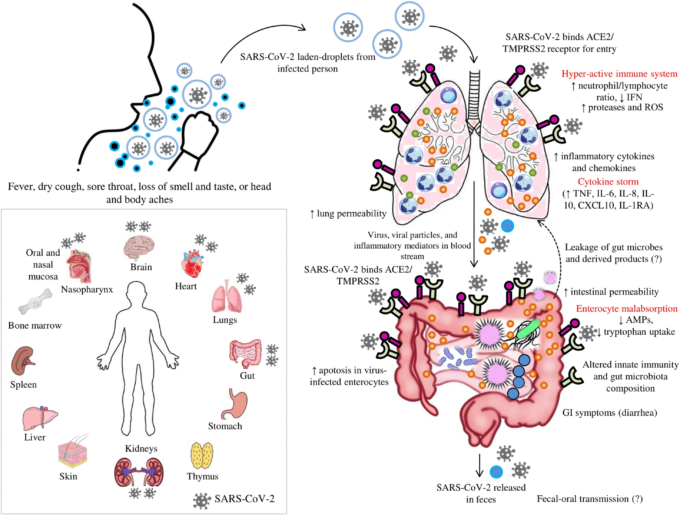
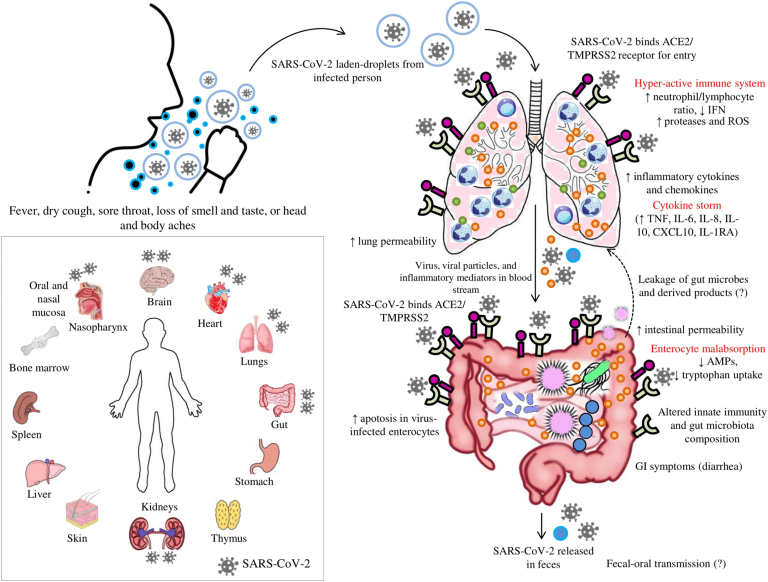
図2. SARS-CoV-2によるCOVID-19病における「腸-肺軸」を表したもの。感染者から排出されたSARS-CoV-2を含む液滴を吸入すると、SARS-CoV-2がアンジオテンシン変換酵素2(ACE2)や他の受容体に結合して宿主細胞に侵入する。宿主免疫系が亢進すると、炎症性メディエーターが放出され、「サイトカインストーム」を引き起こす。
炎症性メディエーターの増加は、肺の過疎化を引き起こし、循環を介して炎症性メディエーターとともにウイルスが腸に移動し、腸球上で高度に発現したACE2受容体と結合することになる。SARS-CoV-2はACE2受容体の発現を低下させ、微生物の構成や宿主免疫系に影響を与える。炎症性メディエーターは腸管の透過性を乱し、腸内微生物や関連代謝物の循環への漏出を引き起こする。
循環を介して漏出した微生物や産物は、肺を含む臓器に移行し、異常を生じさせる。また、COVID-19病患者の主な消化器症状として下痢が観察されていることから、「微生物異常症 」が疑われている。
インセット:ACE2受容体を発現しているヒトの臓器を、SARS-CoV-2が到達している臓器で表現したもの。ACE2受容体、TMPRSS2受容体、好中球、リンパ球、粘液、炎症性メディエーター。*ACE2とTMPRSS2は、宿主細胞の筆界に発現している。図では、ACE2とTMPRSS2の局在を筆界ではなく、腸や肺の外に示しているが、これは読者にわかりやすく表現するためである。
研究は、入院したCOVID-19患者の血液中のこれらのサイトカインの濃度の増加を報告している(Wadman et al 2020年;Lin et al 2020)。重篤なCOVID-19症例の大部分は、TNF、IL-1b、およびIL-6の高い全身レベルに関連しており(Gubernatorova et al 2020)、ここで、C反応性タンパク質(CRP)、d-ダイマー、フェリチン(MeradおよびMartin、2020)、およびIL-6は、COVID-19に関連した死亡率の最も有意な臨床的予測因子として発見された。
IL-6は、感染発症時の粘膜部位における主要な炎症性サイトカインであり、造血、炎症への調節、自己免疫、急性期応答などの様々な機能を実行し、いくつかの免疫刺激機構を介して宿主防御を調節する(Gubernatorova et al 2020)。
そのアップレギュレーションは、(特に男性において)老化の典型的な特徴であり、IL-6の連続的な上昇は、ウイルスの複製を促進し、肺組織の炎症および損傷を促進することが知られている。したがって、IL-6の慢性的な上昇は、特に高齢の男性において、高いSARS-CoV-2関連の死亡率につながることが知られている(Bonafè et al 2020)。
さらに、サイトカイン濃度とT細胞(CD4+およびCD8+)数との間の負の相関は、「サイトカインストーム」が実際に感染に対する宿主の適応免疫を減衰させることを示唆している(Gubernatorova et al 2020)。
これを支持して、マルチオミクスデータの最近の分析は、肺における宿主免疫系の特定の細胞の抑制または破壊に起因する機能的免疫不全症候群を示唆している(Prates et al 2020)。さらに、CD4 + T細胞によるIFN-γ産生の減少(Chen et al 2020b)、好中球の増加、ナイーブ/記憶T細胞比の上昇(Neurath、2020)、炎症性単球由来マクロファージの増強、および組織常駐型肺胞マクロファージの枯渇も、重度のCOVID-19患者において観察された(MeradおよびMartin、2020)。
全体として、多くの研究は、好中球/リンパ球比の上昇を、重症COVID-19症例の独立した主要な危険因子として示している(Liu et al 2020a; Kuri-Cervantes et al 2020; Zhang et al 2020)。これに関して、COVID-19患者におけるIL-6受容体とIL-1b遮断を統合した臨床試験が、初期の有望な結果をもって開始されている(図3)。さらに、他の合併症により免疫調節生物学的製剤を使用している患者におけるCOVID-19の有病率と重症度を明らかにすることは、COVID-19の病態生理に関するさらなる知見を提供することになるだろう。
それは、疾患の重症度を制御するために特定の免疫経路をブロックするための潜在的な候補として探索され、使用される可能性がある(MeradおよびMartin、2020)。
ごく最近、インド医薬品規制局(DGCI)は、中等度から重度の急性呼吸窮迫を有するCOVID-19患者の治療薬としてイトリズマブの緊急承認を取得した(https://www.hindustantimes.com/india-news/dcgi-approves-limited-use-of-psoriasis-injection-for-covid/story-bkVPzdJ7Y9oaCiX2NJkypO.html)。
イトーリズマブは、ヒト化組換え抗CD6モノクローナル抗体であり、T細胞の増殖や炎症性サイトカインの産生を抑制することにより、慢性プラーク性乾癬の治療に一般的に使用されている(https://www.biocon.com/biocon_products_bio_BF_alzumab_pa.asp)。
図3
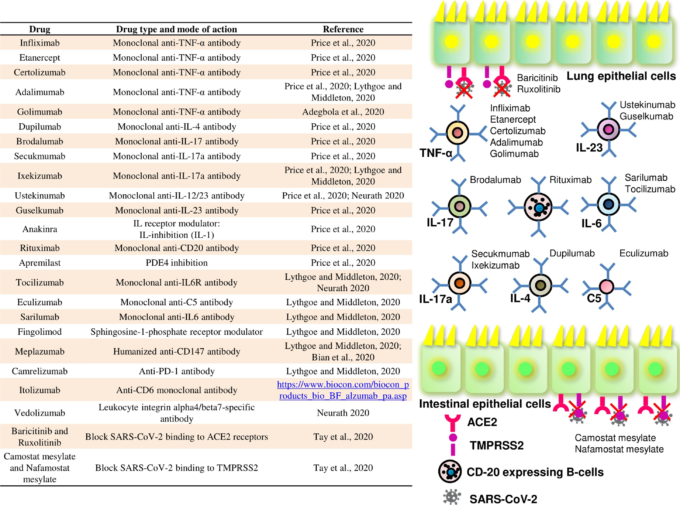
図3:SARS-CoV-2に起因するCOVID-19病の治療薬として提案されている各種免疫調節薬とその作用機序を表した図。SARS-CoV-2によるCOVID-19病の治療に提案されている様々な免疫調節薬とその作用機序を表したもの。
4. 双方向性腸肺軸:COVID-19発症前の評価
腸内細菌叢の変化は、最終的には重篤な疾患症状を引き起こすいくつかの重要な人間の臓器と腸との関係の双方向性の逸脱と関連している。最近、私たちの腸内マイクロバイオームグループは、肺を除く、腸内微生物と重要な人間の臓器との間の双方向のコミュニケーションネットワークを見直した(Ahlawat et al 2020)。
興味深いことに、気道を含む肺微生物群集の変化はまた、腸微生物叢の組成に影響を与える。他の方法では、いくつかの消化器疾患は呼吸器に症状が現れ、例えば、腸内細菌叢の組成に変化があることが知られている炎症性腸疾患(IBD)患者の約半数は肺機能が低下している。したがって、多くの呼吸器感染症がしばしばGI症状を伴う(Wypych et al 2019)、または腸管機能障害または二次的な腸管機能障害の合併症を伴う(Gao et al 2020)双方向のコミュニケーションネットワークとしての「腸-肺軸」を示唆している。
例えば、動物モデルにおけるニューモシスティス・ムリナまたはインフルエンザウイルスによる呼吸器感染またはリポポリサッカライド(LPS)の気管内注入は、その腸内マイクロバイオータの変化を駆動する(Wypych et al 2019)。マウスモデルにおけるインフルエンザウイルスによる呼吸器感染は、その腸内マイクロバイオータにおけるEnterobacteriaceaeを上昇させ、LactococciおよびLactobacilliを減少させる。
また、マウスのLPS投与による気道微生物叢の異常は、肺から血液中への細菌の移動を介して腸内細菌叢に障害を与えている。肺におけるP. aeruginosaまたは多剤耐性S. aureusによる肺炎の発現は、P. aeruginosa誘発性肺炎が腸管上皮増殖の減少をもたらすため、腸傷害を誘発すると考えられている(Anand and Mande, 2018)。
さらに、急性肺損傷は、気道マイクロバイオータを乱し、細菌の血流中への一過性の転座を誘発し、盲腸での細菌負荷を急性に上昇させる。慢性閉塞性肺疾患(COPD)患者では、腸管過透過性が高く、IBDの有病率が高いことが知られている。逆に、健康なマイクロバイオータは、腸内の耐性免疫調節効果を維持し、全身性炎症性疾患に対するセーフガードとなる(He et al 2017)。
別の言い方をすれば、腸内マイクロバイオータの異常は、呼吸器疾患や感染症と関連している。例えば、腸内のクロストリジア菌の増加とビフィズス菌の減少は、早期の喘息と関連している(Anand and Mande, 2018)。さらに、「腸-肺軸」は、腸から循環を介して呼吸器管への免疫細胞の移動にも関与しており、そこで宿主の感染症との戦いの能力を促している。
しかし、同様の相互作用は病気でも起こる。さらに、腸は循環中の宿主が獲得した炎症性メディエーターを介して肺の反応を調節している。腸疾患を有する患者の血清中に検出されるこれらの炎症性メディエーターの上昇したレベルは、免疫応答に影響を与え、それにより、肺における局所的な微小環境を決定する別の方法を示唆している(Wypych et al 2019)。
また、呼吸器ウイルス感染は、腸内マイクロバイオームを変化させることができ、ここで、腸内マイクロバイオームは、呼吸器病原体に対する適応免疫応答を決定し、肺感染に対する自然免疫応答のプライミングに必要である。
呼吸器ウイルス感染症の間、呼吸器ウイルスに対するマクロファージ応答のレベルは、腸内微生物の存在に依存する(Hanada er al)。 このことは、肺と腸が、それらの間の免疫学的な調整を介してお互いの恒常性に影響を与える密接にリンクされた器官であることを示唆している(図2)。不可欠なことに、微生物は(環境因子の中でも)肺と腸の両方で正常および病理学的な免疫応答を形成する上で中心的な役割を果たしている(He er al)。
腸と肺の間の同様のクロストークは、COVID-19の症例でも起こる。8人の患者のサンプルサイズが小さい研究では、COVID-19患者の気管支肺胞洗浄液サンプル中の肺微生物組成が、一般的に口腔および上気道に見られる細菌によって支配されていることが明らかになった。これは市中肺炎患者と同様であった。
肺における微生物のシグネチャーは、COVID-19による最も一般的な合併症である急性呼吸窮迫症候群(ARDS)や、アウトブレイクの長期転帰を予測する可能性がある。腸内細菌叢が抗ウイルス免疫の改善に果たす役割が明らかになってきている(He er al)。 そのように、肺上皮におけるインフルエンザウイルスの複製を回避するために、腸炎、人工呼吸器関連肺炎の軽減、抗生物質の副作用の逆転などにおいて、腸内細菌叢の変調の重要性を示唆する様々な報告がなされている。
しかし、現在のところ、COVID-19の治療薬としての腸内細菌叢の変調についての臨床的なエビデンスはないが、新たな治療選択肢やアジュバント治療の選択肢として、腸内細菌叢を標的とする役割を推測している新興の報告はほとんどない。
このようにして、プロバイオティクスは、腸内マイクロエコロジーのバランスを維持することによって有利にGI症状を変化させ、二次的な細菌感染を防止することによって呼吸器系を保護するために使用することができる;したがって、進行中のCOVID-19疾患における腸内マイクロバイオータの重要な役割を示唆している(Gao et al 2020年;Tiwari et al 2020)。
5. COVID-19病発生後の腸-肺軸
この新規ウイルスのゲノム解析により、SARS-CoVとの高い相同性[72%](受容体結合ドメインの構造に関して)が示されたことから、スパイクタンパク質S2を介した新規ウイルスがACE2を結合し、ヒト細胞に感染する可能性が示唆された(D’Amico et al 2020; Gao et al 2020)。
スパイクタンパク質S1とS2のうち、S1はウイルスの宿主細胞膜への付着を媒介し、S2は細胞膜の融合を促進する。このプロセスは、Sタンパク質の切断を可能にする細胞性セリンプロテアーゼ(TMPRS2)によるプライミングを必要とし、それによってメカニズム全体を制御する(D’Amico et al 2020)。
証拠は、ACE2受容体が保護的な抗炎症作用を有し、ウイルスのSタンパク質が、プロ炎症性ケモカインおよびサイトカインの放出の増加を介してその発現をダウンレギュレートし、それによって炎症、血管透過性、および肺への好中球のリクルートを誘発することを示唆している(Bonafè et al 2020)。これと一致するように、他の多くの研究は、SARS-CoVやH1N1、H5N1、およびH7N9のようなインフルエンザウイルスなどの肺ウイルス感染症におけるACE2発現の低下を支持していた(Cole-Jeffrey et al 2015)。
このように、SARS-CoV-2を含むコロナウイルスは、レニン-アンジオテンシン系(RAS)のプロテアーゼを細胞侵入に利用するように進化してきた。また、ACEやANPEPなどのACE2以外のRASプロテアーゼも、生得的な抗ウイルス応答の構成要素であるプロ炎症遺伝子を活性化する能力があるため、COVID-19病では重要な役割を果たしている可能性がある。最近の研究では、プロテオーム構造解析とマルチオミクスデータを統合することで、COVID-19はSARS-CoV-2とACE2との直接的な結合が細胞侵入に関与しているだけでなく、RASの他の様々な構成要素のアンバランスにも関与していることが示唆された。
COVID-19患者の気管支肺胞ラバージサンプルの細胞からのRAS遺伝子の発現プロファイルは、有意にアップレギュレーションされたアンジオテンシン、レニン、MAS、ACE、およびACE2を示唆した。さらに、いくつかのソースおよび組織からの発現データは、SARS-CoV-2が宿主GI系を標的とするように進化したことを示唆している(Prates et al 2020)。
最近の研究では、GI上皮細胞においてACE2受容体を発現していることが同定された。このことは、2003年の前身と同様に、SARS-CoV-2がGI管内で活発に感染し、増殖し得ることを示唆している(Wong et al 2020)、特に下部消化管のACE2受容体に富んだ裏地(Wadman et al 2020年;Li et al 2020)。
研究は、新しいウイルスが、そのいとこであるSARSよりもヒトACE2に10〜20倍強く結合することを示した。多くの研究は、肺および食道とともに腸球においてTMPRS2およびACE2が高レベルで共発現していることに起因して、コロナウイルスがGI管に感染する可能性があるという追加の証拠を提供した。
提案されているメカニズムは、新規ウイルス感染により腸管透過性が変化し、腸球の吸収不良を引き起こすことである(図2)。食事性アミノ酸取り込みへの関与を介した腸内ACE2は、抗微生物ペプチド(AMP)の発現を調節し、腸の恒常性を促進する(D’Amico et al 2020;Hashimoto et al 2012)。
証拠は、ACE2が腸内生物学および腸内マイクロバイオーム組成の調節において重要な非触媒的役割を果たしていることを示唆しており、それにより、ACE2の有益な効果が腸内マイクロバイオームの変化を介して部分的に媒介されているとの推測につながる。例えば、ACE2-KO 動物は、腸内微生物組成の変化、AMP の発現の低下、およびトリプトファン(Trp)の取り込みに特異的な障害を伴う血清中の中性アミノ酸レベルの低下を示し、これは Trp の投与によって回復することができる。
これと一致して、プロバイオティクスは酸化ストレスを減少させ、コレステロールレベルを積極的に変化させ、血管障害性ACE阻害ペプチドを放出し、ストレス誘発性の過灌流性を減衰させることが示された(Cole-Jeffrey et al 2015)。さらに、ACE2は、自然免疫応答を調節し、宿主腸内細菌叢の組成に影響を与える(PerlotおよびPenninger、2013)。
メラトニン、セロトニン、キヌレニンなどの宿主Trp代謝物や、インドール、インドール酸、トリプタミン、スカトールなどの細菌Trp代謝物は、腸内微生物組成、微生物代謝、宿主免疫系、宿主-マイクロバイオームインターフェース、宿主免疫系-腸内マイクロバイオータ相互作用に影響を与える。
このように、ACE2 は腸内アミノ酸のホメオスタシス、AMP の発現、自然免疫、腸内微生物の生態、感染性大腸炎の発症率を制御する役割を担っている。また、ACE2 の欠損は、上皮障害による腸内炎症への感受性が非常に高くなる(Hashimoto er al)。
予備的なデータによると、SARS-CoV-2のSタンパク質は、別の表面分子であるCD147と結合することができ、ウイルスの宿主細胞内への侵入経路として考えられている。CD147は、主に赤血球(RBC)、神経細胞、上皮細胞を含む造血細胞に存在している。また、SARS-CoV感染にも関連しており、SARS-CoVタンパク質はシクロフィリンAと結合してCD147に結合し、ACE2を発現する感染宿主細胞ではSARS-CoVのNタンパク質がシクロフィリンAに結合していることが明らかになった。
さらに、彼らは、ヒト肺上皮細胞をSARS-CoV-2で試験管内試験(in vitro)接種すると、細胞病理学的効果が生じ、上皮細胞の繊毛の拍動が停止することを示唆した(Gubernatorova et al 2020)。これに関して、SARS-CoV-2に対する治療薬を開発するための1つの戦略は、ACE2のためのバリシチニブおよびルキソリチニブ、ならびにTMPRS2のためのカモスタットメシル酸塩およびナファモスタットメシル酸塩のような化合物を使用して、ACE2またはTMPRS2をブロックすることによってである(図3)。
APN01は、おそらく宿主細胞へのウイルスの侵入を減少させることができる。さらに、SARS-CoV-2のSタンパク質を標的とするモノクローナル抗体もまた、ウイルスの侵入または膜融合を阻害し得る(Tay et al 2020)。
標的細胞型を決定するために実施された別の非常に最近の研究は、SARS-CoVおよびSARS-CoV-2の両方が、分化した気道培養物中の繊毛細胞およびヒト小腸オルガノイド(hSIO)中の腸球前駆細胞に感染し、ウイルスの先端分泌を有することを明らかにする(Lamers et al 2020)。
SARS-CoV-2は、アポリポ蛋白質A1(APOA1)で標識された分裂後の腸球とK167陽性分裂細胞の両方に感染し、それにより、ApoA1+腸球表現型および増殖性腸球前駆細胞表現型を表示する。最初は24時間後に単一のウイルス感染細胞が観察されたが、その後は小さな感染クラスターが形成され、60時間後にはウイルス感染細胞数とウイルス感染腸球のアポトーシスが顕著になり、オルガノイド全体に広がっていった。
SARS-CoV-2感染したhSIOの透過型電子顕微鏡(TEM)分析では、無傷のオルガノイドにおけるウイルス感染の開始は、ウイルス複製領域としての初期二重膜小胞(DMV)、ゴルジ装置におけるウイルスの初期産生、膜内システムにおけるウイルス粒子の完全な占有など、ライフサイクルの様々な段階であることが示された。
これは、コロナウイルス(CoV)ウイルスが宿主細胞から効率的に放出するためには、小胞体-ゴルジ中間コンパートメント(ERGIC)で分泌経路の内腔に芽生え、ゴルジ体をナビゲートし、膜内系を前向的に移動しなければならないという事実を裏付けるものである(Westerbeck and Machamer, 2019)。
さらに、mRNAシーケンスを介して研究された遺伝子発現の変化は、SARS-CoV-2感染が、SARS-CoVよりも強いI型およびIII型インターフェロン応答の特異的なサイトカインおよびインターフェロン刺激遺伝子(ISG)を誘発することを示唆している(Lamers et al 2020)。
興味深いことに、ある研究は、健常者の異常な炎症状態への事前ディスポジショニングにおける腸内マイクロバイオータの確率的役割を明らかにしており、これは重度のCOVID-19を説明している。
識別されたOTUのうち Bacteroides、Streptococcus、Clostridialesはほとんどの炎症性サイトカインと負の相関を示したが、Blautia、Ruminococcus、Lactobacillusは正の相関を示した。また,アルギニン生合成,アミノアシルtRNA生合成,分岐鎖アミノ酸(BCAAs)生合成の3つの経路からアミノ酸,胆汁酸,脂肪酸に分類された45種類の糞便代謝物は,選択されたOTUの半数以上と有意な相関を示した。
これらの代謝物は、腸内細菌叢が宿主の代謝や炎症に及ぼす影響を媒介する上で重要な役割を果たしている可能性がある。したがって、これは、COVID-19の進行および重症度における腸内細菌叢の蓋然的な役割を示唆している(Gou et al 2020)。
新たなデータは、上気道からのウイルスのクリアランス後も、COVID-19患者の糞便検体(Zhou et al 2020年;Li et al 2020)および肛門/直腸スワブ(Gao et al 2020)において、SARS-CoV-2のウイルスRNAを同定している(Wong et al 2020)。サンプリングされた患者の約53%が便サンプル中のウイルスRNAを報告し、患者の最大半数が下痢を起こしている。最近の研究では、COVID-19患者からの生検で十二指腸、直腸および胃細胞に局在するSARS-CoV-2タンパク質が同定された。
さらに、パンデミックの進化および拡大に伴うデータの蓄積は、消化器症状がCOVID-19患者において有意に一般的であることを示唆している(Pan et al 2020)。世界中での多数の報告は、COVID-19患者における消化器症状の発生を示唆しており(表1)、驚くべきことに、当初は消化器症状のみを呈していた患者のサブセットも報告されている(Song et al 2020)。
しかしながら、様々な研究間でのばらつきの理由は不明であり、考えられる理由としては、報告の違い、異なる患者集団およびウイルス株の違いなどが挙げられる。さらに、GI症状を有するCOVID-19患者は、GI症状を有しない患者に比べて発病期間およびウイルスクリアランス時間が有意に長いようである。GI症状は優性ではないかもしれないが、IBDのような基礎的な消化器疾患を有する患者を保護し、治療する必要性が高まっている早期の段階でCOVID-19を特定し、拡散を防止するのに役立つであろう(Li et al 2020)。
したがって、消化器症状がCOVID-19疾患の臨床的表現を支配しているにもかかわらず、典型的な呼吸器症状に対して消化器症状が過小に表現されることはあり得ないという事実を示唆している。さらに、GI管内のSARS-CoV-2の存在は、感染者の糞便を介して感染する可能性が高いという憂慮すべき危険性を強めている。
そのため、開発途上国のほとんどの国では、排泄物を介して感染する可能性があることが懸念されている。しかし、現在までに糞便感染の証拠は報告されておらず、糞便に無傷のウイルスが含まれているのか、感染性のウイルスが含まれているのか、あるいはウイルスのRNAやタンパク質だけが含まれているのかは明らかになっていない(Wadman et al 2020)。
また、糞便中のウイルスが呼吸器管の細胞片から獲得されたものなのか、それとも消化管からの複製物から構成されているのかは不明である。いずれにしても、糞便-口腔感染を予防するための予防措置を講じることは理にかなっている(Li er al)。
表1. SARS-CoV-2感染者の胃腸(GI)症状を報告した様々な研究のまとめ
Sr. No. 分析された COVID-19 患者の数 GI 症状を有する COVID-19 患者の数 平均年齢
(年) 消化器症状 国 コメント 参照
1 204:男性107名、女性97名 38名(18.6%) 52.9±16名 下痢(34%)、嘔吐(3.9%)、腹痛(1.9%) 中国湖北省 6名は呼吸器症状を伴わない消化器症状を呈していた;消化器症状は重症度に応じて強まる(Pan er al)。
2 651 74(11.4%)で少なくとも1つ(吐き気、嘔吐または下痢)の症状があった 46.14 ± 14.19 下痢(53)、嘔吐(11)、吐き気(10)、吐き気・嘔吐(4)、および吐き気・嘔吐・下痢(3) 浙江省、中国 COVID-19の患者でGI症状を有する患者は、家族性のクラスタリング、重度・重症傾向、および発熱>38.5℃を示した(Jin et al 2020)。
3 138:男性75名、女性63名 _ 56 吐き気(10.1%)、下痢(10.1%)、嘔吐(3.6%)、腹痛(2.2%) 中国 武漢市 ICU患者36名では、GI症状の発現頻度が高かった(下痢(16.7%)、吐き気(11.1%)、嘔吐(8.3%)、腹痛(8.3%))。 (Wang et al 2020)
4 73 39(53.42%):男性25名、女性14名が便中にSARS-CoV-2のRNAを有していた 43 下痢(26名)、消化管出血(10名) 中国 間質性浮腫を伴うリンパ球や血漿細胞の浸潤が内視鏡検査で観察された;23.29%の患者では、呼吸器検体が陰性であっても便検体が陽性であった(Xiao et al 2020)。
5 10:男性6名、女性4名 50±18 下痢(60%)、腹痛(30%)、嘔吐(10%) イタリア・ピアチェンツァ _(Poggiali er al)。
6 95:男性45名、女性50名 58名(61.1%):男性27名、女性31名 45.3±18.3 下痢(24.2%)、悪心(17.9%)、嘔吐(4.2%)、上部消化管出血(2.1%) 中国 珠海市 入院患者65名のうち、以下の患者が含まれている。
GI症状のある42人およびGI症状のない23人では、それぞれ22人(52.4%)および9人(39.1%)にSARS-CoV-2陽性の糞便が認められた(Lin er al)。
7 206 117(48:消化器症状のみ、69:消化器・呼吸器症状) 62.5 下痢(32.5%)、嘔吐(11.7%)、腹痛(4.4%) 中国・武漢 消化器症状のある患者は、症状発現からウイルスクリアランスまでの期間が長かった(Han er al)。
8 42:女性27名、男性15名 8(19.05
51 下痢(16.67 %)、腹痛(11.95 %)、吐き気(9.52 %)、および嘔吐(7.14 %) 中国・武漢 18 例(64.29 %)の患者は、咽頭スワブが陰性になった後も、糞便中のウイルス RNA が陽性のままであった(Chen er al)。
9 254:女性139名、男性115名 66(26%) 50.6 下痢(18.1%)、悪心(8.3%)、嘔吐(5.9%)、腹痛(1.2%) 消化器症状は女性の方が男性より高かった(62.8% v/s 37.2%)。
↓ ヘモグロビン、↑ CRP、↑ アラニンアミノトランスフェラーゼ
GI症状群では、非GI症状群よりもGI症状群の方が優れている(Zhou er al)。
10 412:男性241名、女性171名 3.2% 57 腸壁異常。
腸の異常な黄色変色(3)、腸梗塞(2) 米国ボストン市 腸の異常はICU患者の方が多かった(Bhayana et al 2020)
11 116:男性62名、女性54名 31.9% 50名 吐き気・嘔吐(12%)、下痢(12%)、腹痛(8.8%) 米国カリフォルニア州-(Cholankeril er al)。
12 232 21 % 47.5 下痢(21 %) 中国湖北市 下痢をした患者は、下痢をしない患者に比べて肺炎の重篤な症状を示した(Wan er al)。
13 1099:男性640名、女性459名-47名 吐き気または嘔吐(5%)、下痢(3.8%) 中国-(Guan er al)。
14 41:男性30名、女性11名 3% 49下痢(3%) 中国・武漢-(Huang et al 2020)
15 1141 183(16%):男性102名、女性81名-食欲不振(98%)、吐き気(73%)、下痢(37%)、びまん性腹痛(25%)、吐き気または嘔吐(20%)、腹痛または下痢(9%)、これらの症状のすべて(7%)中国・武漢-(Luo er al)。
16 52:男性35名、女性17名-59.7±13.3 GI出血(4%)、嘔吐(4%) 中国武漢市 重症患者にGI出血が発生した(Yang er al)。
17 305 ・57 下痢(49.5%)、食欲不振(50.2%)、吐き気(29.4%)、嘔吐(15.9%)、腹痛(6%) 中国・武漢市 22.2患者は非薬物関連(Fang et al 2020)
18 99:男性 67 名、女性 32 名-55.5 下痢(2%)、悪心・嘔吐(1%) 中国・武漢 ↓ リンパ球、ヘモグロビンが多く、Acinetobacter baumannii、Klebsiella pneumoniae、Aspergillus flavus が 1 名、Candida glabrata が 1 名、Candida albicans が 3 名と診断された(Chen et al, 2020c)。
19 142 7(4.9%):男性4名、女性3名 35-75 食欲不振(7)、下痢(6)、上腹部不快感(6)、悪心(4)、嘔吐(2)、胸やけ(1) 中国 消化器症状を呈した患者は全員が発熱し、呼吸器症状を示さなかったり、後期に発症したりしていた(Ai er al)。
20 157: 男性74名、女性83名 63名(40.1%):男性24名、女性39名 49.3±14.5 食欲不振(74.6%)、下痢(39.7%)、吐き気(33.3%) 中国のGI症状はCOVID-19で頻発するが、疾患の重症度や転帰の悪化とは関連していない(Cao et al 2020)。
21 1320:男性579名、女性741名 192(14.5%):男性90名、女性102名 50 下痢(55.7%)、食欲不振(32.3%)、悪心・嘔吐(29.7%)、腹痛(5.7%) 中国武漢市 消化器症状のある患者は臨床的に悪化するリスクが高い(Zheng er al)。
22 17 17:男性8名、女性9名 14 8 腹痛、嘔吐、下痢;1名が急性胆嚢炎を呈した ニューヨーク、米国 炎症性マーカーのレベルはすべての患者で上昇していた(Cheung er al)。
23 58:男性25名、女性33名 すべての患者が1つまたは他のGI症状を呈している 9 腹痛(53%)、下痢(52%)、嘔吐(45%) イギリス ・(Whittaker et al 2020)
24 318 195 (61.3 %) が少なくとも 1 つの消化器症状を有していた 成人以上 18 歳 食欲不振 (34.8 %)、下痢 (33.7 %)、吐き気 (26.4 %)、嘔吐 (15.4 %)、および腹痛 (14.5 %) 米国 ・(Redd et al 2020)
25 278:男性145名、女性133名 97(35%) 成人≧18歳 下痢(56名)、悪心・嘔吐(63名) 米国 消化器症状のある患者では、COVID-19が陽性である可能性が有意に高かった(Nobel et al 2020)。
26 1992 年:男性 1128 人、女性 864 人、1052 人(53%)に少なくとも 1 つの消化器症状があった 60.1 ± 16.3 下痢(34%)、吐き気(27%)、嘔吐(16%)、腹痛(11%) 米国およびカナダ 入院患者の中で消化器症状は一般的であった。大半は軽度であり
重度の臨床経過と関連している(Elmunzer et al 2020年
27 29,393 2289 (7.8 %) 47 1785人が発熱を伴うGI症状を有していた 中国 発熱とGI症状の両方を有する患者では、重症化のリスクが85%高かった (Liu et al 2020b)
28 150:男性83名、女性67名 31名(20.6%)に少なくとも1つのGI症状があった 57.6±17.2 下痢(14.7%)、吐き気または嘔吐(10.7%)、腹痛(2%) 米国 入院時のGI症状の有無は、特になし
二次的転帰の増加と関連している(Ramachandran et al 2020年
*GI症状を有するCOVID-19患者のサンプルサイズが小さい(<5)研究は、表中では考慮されなかった。
6. COVID-19投与中のIBDに関する推奨事項
IBD(Queiroz et al 2020)のような既存の消化器疾患を持つ患者の管理に関する意識を高める必要がある。COVID-19の症状の中には、IBDの増悪に類似したものもあり、現在のところ、SARS-CoV-2感染がIBDフレアの原因であるという証拠はないため、フレア診断を行う前にSARS-CoV-2の検査を行うことが推奨されている。免疫抑制患者は、宿主免疫サーベイランスの低下がウイルス負担を増加させるという理論的事実にもかかわらず、しばしばウイルス性疾患の非典型的な症状を示している(Estevinho and Magro, 2020Queiroz er al)。
IBD患者の炎症を起こした腸内ではACE2の発現と宿主細胞トリプシン様プロテアーゼの活性が増加していることから、これらの患者はCOVID-19の合併症を発症するリスクが高いと推測されていた(Queiroz et al 2020)。しかし、炎症もIBD薬の服用もACE2およびTMPRSS2の腸内発現を増加させないため、IBDを有することはCOVID-19を発症するリスクを増加させないことが報告されている(;MonteleoneおよびArdizzone、2020年;EstevinhoおよびMagro、2020)。
さらに、ACE2には全長ACE2と可溶性ACE2の2つの形態があり、特に後者の形態はIBD患者で発現が上昇している。可溶性ACE2は、ウイルスの競合的インターセプターとして働くことで、完全長ACE2との結合を防ぎ、COVID-19の感染を制限する可能性を高めている(Monteleone and Ardizzone, 2020)。一方、COVID-19の重症化の要因として全身性の炎症があることを考えると、免疫抑制剤を投与されている患者の方が軽症化する可能性があると考えられる(図3)。
COVID-19に対する防御は、IBDの継続的な治療によるものである可能性があり、それを中止すべきではない(Aziz et al 2020)。したがって、フレアのリスクはSARS-CoV-2感染症に感染する確率を上回るため、IBD寛解の維持を優先しなければならない。さらに、糞便-口腔経路を介した感染の可能性を考慮すると、手術や選択的内視鏡検査のような侵襲的な処置はすべて延期しなければならないが、緊急処置の場合は患者にSARS-CoV-2の検査を行うべきである(Estevinho and Magro, 2020)。
結論として、SARS-CoV-2によるCOVID-19病における可能性の高い「腸-肺軸」は、感染者から排出されたSARS-CoV-2含有液滴の吸入を伴う。これにより、SARS-CoV-2のスパイクタンパクがACE2などの受容体に結合して宿主細胞内に侵入する。その結果、過活動性の免疫系は炎症性メディエーターを放出して肺の過透過性を引き起こし、その結果、循環を介して炎症性メディエーターとともにウイルスは腸管に移動し、腸球上で高度に発現しているACE2受容体と結合する。これにより、腸管の透過性が障害され、腸内微生物や関連代謝物が循環に漏れ出すようになる。
循環を介して流出した微生物や産物は、肺などの臓器に移動して障害を引き起こす。したがって、COVID-19病の患者さんでは主な消化器症状として下痢が観察されていることから、「微生物異常症」も疑われている(図2)。
7. 結論
現在のパンデミックの状況では、本疾患のGI症状を呈するCOVID-19患者の症例は重要であり、無視できないという事実を強調する必要がある。中にはGI症状のみを示す患者もおり、軽度の症状を示す患者では正しい評価ができない可能性があるため、COVID-19の過小評価につながっている。
COVID-19患者の糞便サンプルからウイルスが検出され、長期にわたって持続していることから、経口糞便感染の可能性があることが示唆され、糞便、嘔吐物、その他の体液などの汚染源への曝露を避けるために、さらなる予防措置が必要となる。
糞便-経口ルートを介したウイルス感染の可能性があるため、開発途上国や貧困国では、適切な手洗い、公衆トイレ使用時の追加予防措置、野外排便の管理が重要視されている。COVID-19病の死亡率は、高齢者や重症者、腸内細菌叢が変化している人で最大であることが報告されている(図1)。
このことから、腸内細菌叢の異常、免疫系の変化、SARS-CoV-2感染からの回復力の低下が関連している可能性が示唆される。さらに、両臓器の細菌叢が免疫システムの機能を駆動し、重篤な感染症に対抗することはよく知られた事実である。
そのため、腸内マイクロバイオーム、マイコバイオーム、ビクロームの変化を網羅的に調べるマルチオミクス研究が必要とされている。腸内マイクロバイオームは、COVID-19感染者の免疫応答を調節し、肺を含む重要な臓器の損傷を防ぐために重要な役割を果たしていると考えられる。
したがって、COVID-19感染者の疾患管理において、腸内細菌叢の再形成は、栄養療法、プロバイオティクス、または糞便微生物叢移植(標準的なガイドラインを用いて)を用いた新たな治療標的として浮上してくる可能性がある。