Why are we vaccinating children against COVID-19?
www.sciencedirect.com/science/article/pii/S221475002100161X
Author links open overlay panelRonald N.KostoffaDanielaCalinabDarjaKanduccMichael B.BriggsdPanayiotisVlachoyiannopouloseAndrey A.SvistunovfAristidisTsatsakisg
ハイライト
- COVID-19の一人当たりの死亡者数の大部分は、高い合併症を持つ高齢者である。
- 子供のCOVID-19一人当たりの死亡はごくわずかである。
- これらの予防接種の臨床試験は非常に短期間であった。
- 臨床試験では、子供に最も関係のある長期的な影響を扱っていなかった。
- VAERSで接種後の死亡例が多く報告されている(非常に短期間)。
概要
本稿では、子供に対するCOVID-19の接種に関する問題点を検討する。COVID-19に起因する一人当たりの公式死亡数の大部分は、合併症の多い高齢者で発生しており、COVID-19に起因する一人当たりの死亡数は小児ではごくわずかである。また、接種後に正規化された死亡者数の大部分は、合併症の多い高齢者で発生しており、小児では無視できない程度に少ない。これらの予防接種の臨床試験は、非常に短期間(数カ月)で、サンプルも全人口を代表するものではなく、また、青年/小児については、規模が小さいため予測力が低いものであった。さらに、これらの臨床試験では、重篤な疾患への罹患率の上昇を示す早期警告指標となり得るバイオマーカーの変化については検討されなかった。最も重要なことは、これらの臨床試験では、深刻な事態に陥った場合、子供や若者が数十年にわたって負担する可能性のある長期的な影響を考慮していないことである。
斬新なベストケースシナリオによる費用対効果の分析では、最も脆弱な65歳以上の層において、それぞれの接種に起因する死亡者数とCOVID-19に起因する死亡者数が5倍になることが非常に控えめに示された。COVID-19による死亡リスクは、年齢が下がるにつれて急激に減少し、低年齢層に対する接種の長期的な効果により、そのリスク・ベネフィット比はおそらく大幅に増加すると考えられる。
グラフの概要
キーワード
COVID-19SARS-CoV-2接種mRNAワクチンウイルスベクターワクチン有害事象ワクチンの安全性
1.はじめに
現在、我々はWHOが宣言したCOVID-19の世界的大パンデミックから15ヶ月目に入っている。世界各地でさまざまな規模の規制がまだ行われている[1]。COVID-19の世界的な大量接種は8ヶ月目に入っている。この記事を書いている2021年6月中旬の時点で、全世界で800,000,000人以上が少なくとも1回の接種を受けており、その約半数が完全に接種されている[2]。米国では、約1億7,000万人が少なくとも1回の接種を受けており、そのうち約80%が完全に接種されている[87]。
また、アメリカではCOVID-19が原因で60万人近くが死亡したと公式に発表されている。2021年5月下旬までに約5,000件の接種後の死亡例がVAERSに報告されており、具体的には「2020年12月14日から 2021年5月24日までに米国で2億8,500万回以上のCOVID-19ワクチンが接種された。この間、VAERSはCOVID-19ワクチンを接種した人の死亡報告を4,863件(0.0017 %)受け取った。” [3](VAERS(Vaccine Adverse Events Reporting System)は、CDCとFDAが共同で管理するパッシブサーベイランスシステムである[3])。歴史的に見て、VAERSは実際のワクチン/接種の有害事象の約1%を報告することが示されている[4]。その結果を第一原理的に確認したものが付録1である)。) 6月中旬には、COVID-19の接種後の死亡者数が〜6000人のレベルに達していた。
ワクチンとは、法的には「1つ以上の病気の予防のために人間に投与されるように設計された物質」と定義されている[5]。例えば、ワクチンを「動物の循環系に導入されると、病原体に対する防御反応を引き起こす組成物または混合物」と定義した2000年1月の特許出願は、「ワクチンによって生じる免疫反応は、単に何らかの免疫反応以上のものでなければならず、防御的でなければならない」という理由で、米国特許庁によって拒絶された。前のOffice Actionで述べたように、当技術分野では、「ワクチン」という用語は、感染を予防する化合物であると認識されている」[6]としている。本記事の残りの部分では、ワクチンではなく「接種」という用語を使用しているが、これは、現在のCOVID-19の接種における注射物質がウイルスの感染も伝播も防止しないためである。実際のところ、その主な機能は症状の抑制であると思われるので、運用上は「治療」である。
米国では、優先的に接種が行われた。当初は、第一応答者や第一線の医療従事者、体の弱い高齢者が最優先されていた。その後、より低い年齢層にもキャンペーンが適用されるようになった。現在、12歳から17歳までの年齢層への接種が承認されており、秋の学校開始までにできるだけ多くの接種を行うことが目標となっている。5~11歳の層への接種スケジュールは 2021年後半のどこかで開始されるよう前倒しされており 2021年末までに生後6カ月の乳児が接種を開始する可能性もある[7]。
この記事の残りの部分では、アメリカの状況に焦点を当て、主に18歳未満の子供に接種することの是非について取り上げる。本稿の構成は以下の通りである。
第1節(現在のセクション)では、問題を紹介する。
第2節(背景)。
- 今回の接種につながったCOVID-19の「パンデミック」が宣言された背景を説明している。
- より多くの人々に接種を行うために、FDAから緊急使用許可(EUA)を得ることを正当化する根拠となった臨床試験について説明している。
- これまでに発生した有害事象の深刻さ(VAERSで報告されている)や、予防接種の結果として発生した潜在的な症状の程度を、臨床試験で予測できなかった理由を説明する。
セクション3(大量接種)では、大量接種によってすでに(VAERSでの報告によって)発生した有害事象をまとめ、中長期的にはこれらの接種によってさらに多くの有害事象が発生する可能性を裏付ける生物学的証拠を提示する。
セクション4(考察)では、これらの影響についてさらに検討する。
セクション5(まとめと結論)では、本研究の結論を示する。
この論文には4つの付録がある。
付録Aでは、接種後の有害事象のVAERSへの過少報告の程度を把握し、VAERSの結果を実世界の経験に外挿することで、実際の接種後の死亡者数を推定している。
付録Bでは、現在米国で投与されている接種剤のEUAを正当化するために用いられた主要な臨床試験の詳細な分析を行っている。
付録Cでは、過去のワクチンに起因するとされる潜在的な副作用をまとめているが、これらはすべて現在の接種の結果として発生する可能性がある。
付録 D では、米国で実施されている COVID-19 接種の新しいベストケースシナリオの費用便益分析を示す。
2. 背景
2.1. パンデミックの歴史
2019年12月、中国の武漢でウイルス感染症の発生が報告され、原因となったコロナウイルスはSevere Acute Respiratory Syndrome Coronavirus 2(SARS-CoV-2)と呼ばれた[8,9]。関連する病気は、「新型コロナウイルス感染症」(COVID-2019)と呼ばれた。このウイルスは世界中に広がり 2020年3月にWHOによって世界的なパンデミックが宣言された[10,11]。重大度の異なる制限措置が世界各国で実施され、社会的距離を置く、隔離する、フェイスマスクを着用する、頻繁に手指を消毒するなどの措置がとられた。[12,13]. 米国でも、州ごとに異なるこれらの措置がとられた[14]。同時に、COVID-19を制御するためのワクチン開発が開始された[15]。米国では、連邦レベルではワクチン以外の治療は推奨されなかったが、個人レベルでは一部の医療従事者によって異なる治療レジメンが追求されていた[11,16,17]。
2021年5月末までに、COVID-19に起因するCDCの公式死亡数は、前述のように60万人に近づいていた。この数字には多くの理由で異論がある。第一に、COVID-19の検査が始まる前、または検査がない場合は検査が可能になった後、(米国では)COVID-19の診断は、COVID-19が存在するという医療従事者の推定によって行うことができた[4,18]。次に、検査が始まってから、主に使用された診断はRT-PCR検査であった。この検査は、最大で45回という非常に高い増幅サイクルで行われた[[19], [20], [21]]。この範囲では、非常に多くの偽陽性が発生する可能性がある[22]。
第三に、COVID-19に起因する死亡者のほとんどは、合併症の多い高齢者であった[1,22]。以前の研究[22]で示したように、多くの可能性のある併存疾患や特に有害な曝露の組み合わせの1つに死亡を帰属させることは[23]、非常に恣意的であり、医学的な判断というよりも政治的な判断と見なすことができる。CDCは最近、COVID-19に起因する死亡の約94%は、同じように簡単に併存疾患の一つに起因する可能性があることを認めた[24]。したがって、米国におけるCOVID-19に基づく実際の死亡者数は、穏やかなインフルエンザシーズンに特徴的な3万5千人以下のオーダーであったかもしれない。
35,000人という数字も過大評価である可能性がある。併存疾患は、バイオマーカーの閾値と対象疾患に関連する症状を用いて、特定疾患の臨床的定義に基づいている[25,26]。しかし、多くの人は、前臨床状態と呼ばれる状態にある。バイオマーカーは正式な疾患診断のための閾値には達していないが、その異常性は、基礎的な機能障害をある程度反映している。COVID-19ウイルスのトリガーに対する免疫系の反応(前臨床状態を含む)は、健康な免疫系の反応と同じであると期待すべきではない[27]。もし、前臨床状態が考慮され、さらに偽陽性も考慮されていれば、CDCの94%という誤診率はかなり高くなっていたと思われる。
2.2. 臨床試験
2.2.1. FDAの緊急使用許可(EUA)を得るための臨床試験
Operation Warp Speedと名付けられたアメリカでのCOVID-19ワクチンの前例のない加速開発により 2020年半ばまでに臨床試験に利用できる物質が一握りになった[28]。これらの臨床試験は、潜在的なワクチン(先に述べたように治療・接種であることが判明している)の安全性と有効性を予測し、それによって広く一般の人々に接種するための承認を得るために行われた[29]。ファイザー社の臨床試験の概要はこのセクションで紹介されており、主な臨床試験のより詳細な説明は付録Bに示されている。
米国では、mRNAベースの接種剤とウイルスベクターベースの接種剤の2種類の接種剤がFDAのEUAを取得しており、これまでのところ、mRNAの接種剤が最も広く流通している。ComirnatyはPfizer/BioNTech社が開発したmRNAベースの接種剤の商品名であり、Moderna COVID-19 VaccineはModerna社が開発したmRNAベースの接種剤の商品名である[30]。どちらの接種剤にも、COVID-19に対する防御免疫反応の発現を促すウイルスタンパク質S(スパイク)の産生に必要な遺伝情報が含まれている[31]。Janssen COVID-19 Vaccineは、Johnson and Johnson社が開発したウイルスベクターベースの接種剤のブランド名である。ヤンセンCOVID-19ワクチンは、アデノウイルスを用いてコロナウイルスの遺伝子をヒトの細胞に運び、その細胞がコロナウイルスのスパイクタンパクを産生する。このスパイクタンパクは、潜在的なコロナウイルスの感染を撃退するために、免疫系の働きを活発にする[32]。
FDAによるEUAの許可を得たこれらの試験の結果は、接種物の添付文書に記載されている。例えば、ファイザー社の接種試験の結果は、ワクチンを投与する医療従事者(ワクチネーションプロバイダー)向けのファクトシートに記載されている[33]。
ファイザー社のFDA EUAを取得するために行われた臨床試験は、小規模なフェーズ1/2試験と、大規模なフェーズ1/2/3試験の2つであった。大きい方の臨床試験の年齢層は以下の通りである(ファイザー社の折り込みチラシより)。「試験2のPfizer-BioNTech COVID-19 Vaccine受診者総数(N=20,033)のうち、21.4%(n=4,294)が65歳以上、4.3%(n=860)が75歳以上であった。」 さらに。「カットオフ日である2021年3月13日までのデータに基づく試験2の解析では、12歳から15歳の青年2,260名(ファイザー・バイオエヌテックCOVID-19ワクチン1,131名、プラセボ1,129名)が参加した。このうち、1,308名(ファイザー・バイオエヌテックCOVID-19ワクチン660名、プラセボ648名)の青年が、ファイザー・バイオエヌテックCOVID-19ワクチンの2回目の投与後、少なくとも2カ月間の追跡調査を受けている。試験2の安全性評価は継続中である。」
関連する人口統計は、ファイザー社の添付文書のp.31にある表7に示されている。それらの人口統計のうち、年齢成分を以下の表1に示する。
表1 人口統計(有効性の主要評価項目のための集団)。ワクチンとプラセボを投与した被験者の数を年齢で層別したもの
| 年齢層 | ファイザー-BioNTechCOVID-19ワクチン(N = 18,242)n(%) | プラセボ(N = 18,379) n(%) |
|---|---|---|
| ≥12〜15年b | 46(0.3%) | 42(0.2%) |
| ≥16〜17歳 | 66(0.4%) | 68(0.4%) |
| ≥16〜64歳 | 14,216(77.9%) | 14,299(77.8%) |
| 65歳以上から74歳 | 3176(17.4%) | 3226(17.6%) |
| 75歳以上 | 804(4.4%) | 812(4.4%) |
記号:b:「無作為化集団の中で追跡調査が限られている12歳から15歳の参加者100名が少なくとも1回の投与を受けた(ワクチン群49名、プラセボ群51名)。これらの参加者の一部は、解析した集団に応じて有効性評価に含まれた。彼らは曝露情報に貢献したが、COVID-19症例は確認されておらず、有効性の結論には影響しなかった」、N:被験者数、n:対照者数。
上の表のほとんどのデータと、先に示した説明文との間には、非常に細かい違いがあり、それらはおそらく時間軸の違いによるものである。大きな違いは、使用した青年の数であり、報告時期がかなり遅くなったことに起因すると思われる。
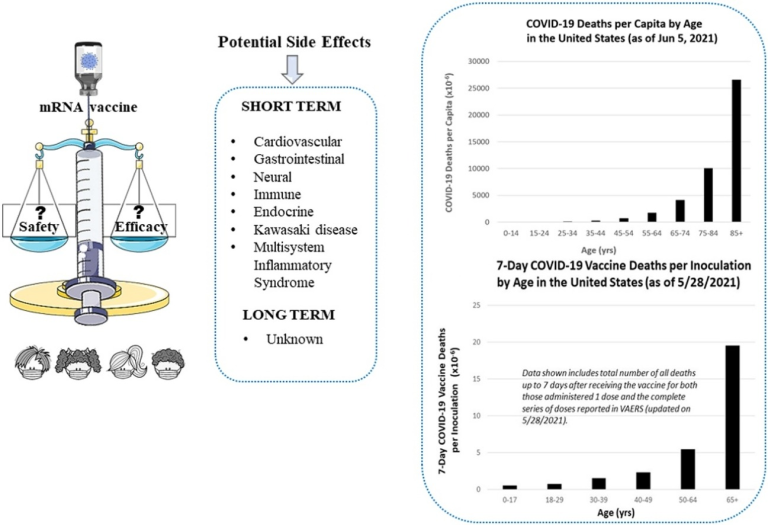
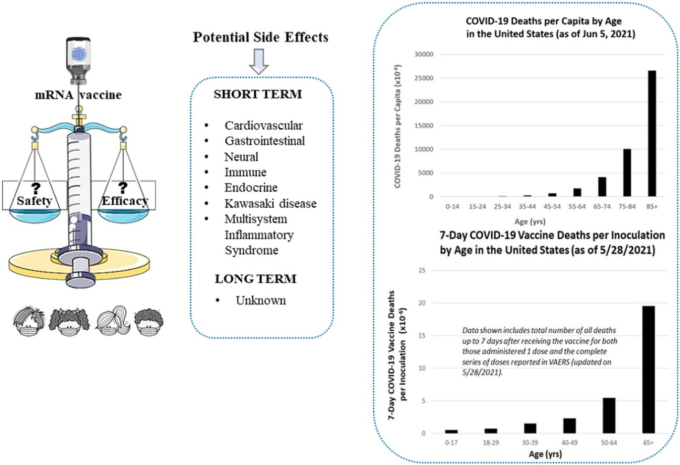
図1は、CDCの公式の大規模な数字(CDC Wonderによる米国の国勢調査データの推定値と合わせて)を用いて 2021年6月初旬頃のCOVID-19による一人当たりの死亡者数を年齢の関数として示している。残念ながら、最も重要な範囲である85歳以上は最も解像度が低い。死者のほとんどは55歳から100歳以上の範囲で発生しており、その他の範囲の人々(特に35歳以下)はこの病気で死亡するリスクはごくわずかであることがわかる。
図1:COVID-19 COVID-19 米国における年齢別一人当たりの死亡者数(2021年6月5日現在)
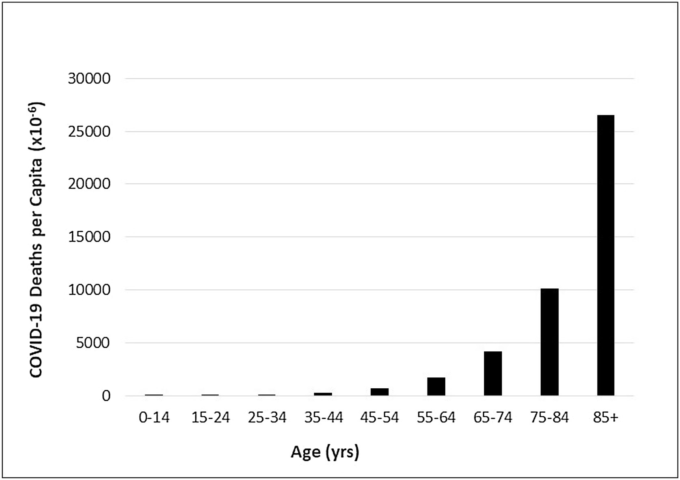
U.S. CDC WONDER Bridge-Race Population Estimate 2019に基づく母集団。2021年6月15日にhttps://wonder.cdc.gov/bridged-race-v2019.html から入手したデータ。2020年1月1日~2021年6月5日の期間、National Center for Health Statisticsが提供するCDCデータに基づくCOVID-19の暫定的な死亡者数。https://data.cdc.gov/NCHS/Provisional-COVID-19-Deaths-by-Sex-and-Age/9bhg-hcku から 2021年6月10日に入手したデータ。
図1の年齢分布は、表1の年齢分布と大きく異なる。なぜこれが重要なのか?潜在的な治療法の有効性と安全性に関する試験を計画する際には、その治療法から恩恵を受ける可能性のある対象者に焦点を当てるべきである。治療が必要とされない人を試験に参加させる理由はほとんどない。
COVID-19ファイザー試験では、図1のデータに基づいて、試験対象者を最大でも45-100歳以上の年齢層に限定し、一人当たりの死亡数が最も多い高年齢層に適切な重み付けをすべきであった。これは、ファイザー社の臨床試験で行われたこととはほとんど正反対のことであった。図1では、死亡者の約58%が75歳以上の年齢層で発生しているが、ファイザー社の臨床試験では75歳以上の参加者は4.4%であった。このように、COVID-19による死亡の影響が最も大きい年齢層は、ファイザー社の臨床試験にはほとんど含まれておらず、COVID-19による死亡の影響が最も小さい年齢層は、ファイザー社の臨床試験には最大限に含まれてた。このような偏ったサンプリングは、臨床試験で予想される対象者の死亡数を予測する上で大きな意味を持つ。
COVID-19による死亡者数を決定する上で、年齢以外に重要な指標は併存疾患の有無である。併存疾患が多いほど、また併存疾患の程度が高いほど、COVID-19による死亡や重篤な有害事象が発生する可能性が高くなる。臨床試験サンプルの併存疾患の数と重症度が、図1に反映されているものとどの程度一致しているかは明らかではないが、添付文書には、試験に参加できなかった疾患が多数あったことが記載されている。つまり、SARS-CoV-2に感染しても、臨床試験対象者の大部分が影響を受けなかったことを考えると、臨床試験の結果は、一般市民への大量接種によって生じる可能性のある(そして実際に生じた)結果を反映しているとは考えられない。
臨床試験に関するこれまでの議論では、接種剤の有効性と安全性、および試験対象集団と全対象集団との関係に焦点を当ててきた。これらはEUA承認のためにFDAに提出された資料の中核をなすものであったため、これまでは安全性と有効性の問題に焦点を絞ってきた。また、早期警戒指標の観点からの試験には注目していない。
ここでは、ファイザー社の試験に関連する科学/早期警告指標の問題と、これらの問題の無視が大量接種の展開においてどのように悲惨な結果をもたらしたかをまとめて説明する。新しい技術(mRNA「ワクチン」など)がシステムに与える影響を判断し、理解するための標準的な方法は、新しい技術の介入前にシステムの状態と変化変数を測定し、新しい技術の介入後にシステムの状態と変化変数を測定し、介入に起因する状態と変化変数の変化の種類と大きさを特定することである。これは、介入の前後におけるパフォーマンス指標の評価に加えて行われる。
ファイザー社が提案したmRNA「ワクチン」の臨床試験(Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candates Against COVID-19 in Healthy Individuals – …clinicaltrials.gov/ct2/show/NCT04368728)では、1)有害事象・症状、2)SARS-CoV-2血清�
しかし、症状や病気は通常、表面化するまでに数ヶ月、数年、数十年かかるプロセスの最終地点である。このような症状/疾患の発生期間中、多くのバイオマーカーの早期警告指標は、最終的な症状/疾患の素因の増加を反映した異常を示す傾向がある。そのため、通常であれば発症までに長期間を要する重篤な症状や疾患が、接種直後に発症した場合には稀なケースになることが予想される。もし、ファイザー社とモデルナ社が行った臨床試験が、有効性を重視し、安全性の指標として症状レベルの副作用のみを記載するように設計されていたとしたら、試験結果は稀な事象の特定に限定され、その試験結果は、接種による実際の症状レベル以前の被害を過小評価する可能性があるであろう。
この実験に適用された信頼できる安全科学は、重篤な症状や病気の可能性の早期警告指標として機能し、この初期段階では稀な重篤な症状よりもはるかに高い頻度で発生する可能性のある、多種多様な状態や変化の指標に対する影響を決定するための、より広範なアプローチを必要とするであろう。上記の提案の中で、これらの他の指標について言及しているのは、第1相試験の説明文のみである。投与1および投与2の7日後に発生する「血液学的および化学的検査値に異常のある第1相参加者の割合」である。
2020年12月にNEJMに掲載された論文[34]では、フェーズ1の結果がまとめられている。焦点は、局所および全身の有害事象と有効性の指標(抗体反応)であった。これら以外の指標として報告されたのは、一過性のリンパ球数の減少のみであった。
我々は、以下の理由から、このようなレベルの報告は、安全性科学としては不十分であると考える。臨床試験が開始される前に、多くの発表論文が、炎症亢進、凝固亢進、低酸素症など、SARS-CoV-2ウイルスの存在に関連した深刻な影響を報告していた。SARS-CoV-2にはS1サブユニット(スパイクタンパク)が含まれており、被害のうちどの程度がSARS-CoV-2のスパイクタンパク成分に関連しているのかは分かっていなかった。信頼できる質の高い安全科学実験を行うためには、これらの異常な一般バイオマーカーのそれぞれに関連する特定のバイオマーカーの状態を、接種の前後に測定することが必要であった。例えば、d-ダイマーは凝固/血液凝固の亢進の証拠、CRPは炎症の亢進の証拠、トロポニンは心臓の損傷の証拠となる。バリア伝染性の亢進を示すオクルーディンおよびクローディン、低酸素症の亢進を示す血中酸素濃度、アルツハイマー病の素因の亢進を示すアミロイドベータおよびリン酸化タウ、自己免疫疾患の素因の亢進を示す血清HMGB1,CXCL13,Dickkopf-1などが挙げられる。信頼できる質の高い安全科学実験であれば、汗腺、糞便、唾液、呼気などから排出される、mRNAの相互作用、LNPシェルの相互作用、mRNAが生成したスパイクタンパク質によって刺激された可能性のある休眠ウイルスなどから生じる生成物のフラックス測定が必要となるであろう。
最も重要なことは、これらのタイプの測定では、症状の発現レベルには達していないものの、将来のある時点で深刻な症状や病気になる確率が高くなるような、宿主の異常の一般的なレベルを上げるような宿主の変化が示されたことであろう。しかし、これらの実験には質の高い安全科学が反映されていないため、判断できるのは短期的な副作用や死亡例だけである。このように症状に焦点を当てたことで、mRNAによる介入の真のコストが隠されてしまった。これらのバイオマーカーの異常値の増加によって証明されるように、介入によって健康状態が悪化した可能性のある人々の数は、おそらくもっと多いはずである。例えば、臨床試験やVAERSでは、重篤な症状や死亡に至った血栓が報告されているが、mRNAによる介入によって、将来的に微小な血栓が形成される可能性が高くなったことについては何も示されていない。後者は、これらの接種の結果、複数の血栓に基づく(およびその他の)重篤な疾患に罹患する素因が高まることで深刻な影響を受ける可能性のある、長い未来を持つ子供たちに特に関係がある。
3. 集団予防接種
3.1. 成人に報告された有害事象
本項では、米国でのCOVID-19集団接種後に発生した有害事象について述べる。使用した有害事象データの主な情報源はVAERSである。VAERSは他の多くの国でも有害事象情報の推定に使用されているため、VAERSの簡単な概要とその本質的な問題点を付録1にまとめた。
報告された接種の対象となる本研究の期間は 2020年12月中旬から 2021年5月末までである。この期間に接種された人口は主に成人である。子どもの接種が始まったのは5月中旬からである。異なる年齢層が優先順位に基づいて異なる時期に接種を開始したため、接種後の経過時間が異なり、年齢層間で有害事象を比較する場合には、何らかの形で接種後の経過時間を正規化する必要があると考えられる。
我々は、VAERSに報告された年齢層別の死亡者数を正規化して調べた。
- 予防接種の回数
- 接種後7日以内の期間。
これにより、すべての年齢層において、接種後の非常に短期的な副作用を信頼できる形で比較することができる。この期間、つまり接種後8日間(0日は接種日)には、接種後の死亡例の60%がVAERSに報告されている。
下の図2は 2021年5月下旬頃の結果である[3]。年齢帯の範囲が図1と異なるのは、CDCが接種後効果の年齢帯をCOVID-19の死亡年齢帯とは異なる形で提供しているためである。一般に、接種者1人当たりの年齢別死亡数は、COVID-19の1人当たりの年齢別死亡数とほぼ平行している(曲線構造は非常に似ている)が、1つの例外がある:0~17歳の層である。正規化されたCOVID-19の死亡グラフ(図1)では,0-17人口層の一人当たりの死亡者数は無視できるほど少ないが、正規化された接種剤の死亡グラフ(図2)では、無視できないほど少ないのである。図1,図2で死亡者の大部分が発生している65歳以上の層の人々は、約5ヶ月間予防接種を受けているのに対し、最も若い層の人々は、わずか数週間しか予防接種を受けていない。最も若い層について、またその層の人々が接種後にどのような悪影響を受けているかについて、より明確な結論を出すためには、さらに時間をかける必要がある。
図2 接種剤1回あたりの接種後の死亡者数
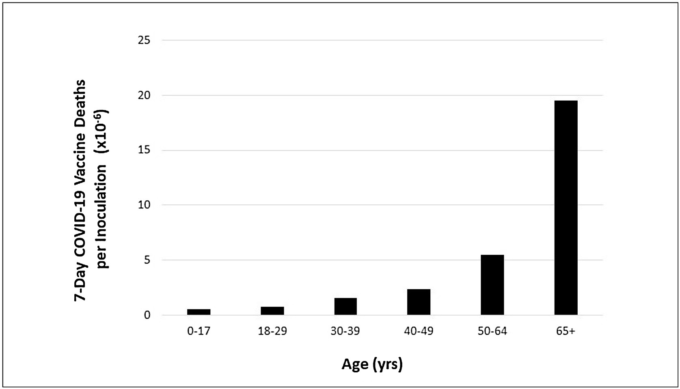
米国における年齢別の接種ごとのCOVID-19ワクチンによる7日間の死亡者数(2021年5月28日現在)。表示されているデータは、VAERSで報告されている米国における年齢別の1回接種者および一連の完全接種者の両方について、ワクチン接種後7日までの全死亡数の合計を含んでいる(2021年5月28日更新)。COVID-19 Vaccinations (Inoculations)は、ISSInfoが提供する2021年5月28日までのCDCデータに基づいている。データは data.cdc.gov/Vaccinations/COVID-19-Vaccination-Demographics-in-the-United-St/km4m-vcsb から 2021年6月10日に取得。COVID-19 Vaccinations Deaths based on CDC WONDER VAERS Database as 5/28/2021, obtained from wonder.cdc.gov/controller/datarequest/D8;jsessionid=4B5522C8D1DA68F1A364646B0DA5 on 6/9/2021.
65歳以上の層におけるCOVID-19と予防接種の両方による高い死亡率は驚くべきことではない。どちらのケースでも、免疫系に負荷がかかり、複数の合併症を持つ多くの高齢者に特徴的な免疫系の機能不全が、その負荷に十分に対応できないのである。
3.1.1. VAERSで報告された特定の短期有害事象
VAERSに報告された有害事象(主にCOVID-19「ワクチン」の成人受給者)について、我々が目にした最も包括的な単一評価は、Ray Sahelian博士による可能性のある副作用の非査読コレクションである[35]。すでに報告されている大まかな種類の事象について、これらの事象が非常に短期的なものであることを踏まえた上で、この短いデータの豊富な要約を読むことをお勧めする。Sahelian博士は、これらの事象のほとんどに責任があると考えている5つのメカニズムを特定しているが、研究によって他のメカニズムが明らかになる可能性もある。この5つのメカニズムとは
- 「過剰に反応する炎症反応は、全身性炎症反応症候群(SIRS)として知られている。このSIRS反応は、おそらくサイトカインストームと呼ばれ、非常に軽度なものから重度なものまで様々である。注射の初日に始まることもあれば、数日後、数週間後に遅延反応として始まることもある。」
- 「スパイクタンパク質と細胞膜上のACE2受容体との相互作用。このような細胞は、皮膚、肺、血管、心臓、口、消化管、腎臓、脳など、体内に広く存在する。」
- 「スパイクタンパク質が血小板や血管内皮細胞と相互作用すること。これにより、血栓や出血(血流中の血小板の数が少ない状態)が起こる。たとえ小さな血栓でも、神経への血液供給が損なわれると、特定の神経症状を引き起こすものもある。」
- 「マスト細胞および好塩基球からのヒスタミンの即時または遅延放出(マスト細胞活性化症候群、MCAS)」
- 「体の様々な部位のリンパ節の腫れは、血流を妨げ、痛みを引き起こす神経を圧迫したり、本来の機能を損なう可能性がある。」
これらの反応は、VAERSが示しているように、Hyperinflammation(高炎症)、Hypercoagulation(高凝固)、Allergy(アレルギー)、Neurological(神経系)に分類され、多くの症状や疾患の原因となる可能性がある。
COVID-19の接種に起因する急性および潜在的な長期の病態に関する優れたレビュー[36]では、血液疾患、神経変性疾患、自己免疫疾患との関係の可能性が示されている。このレビューでは、スパイクタンパク内のプリオンタンパク関連のアミノ酸配列の関連性が議論されている。
3.1.2. 過去のワクチンによる大人と子供の潜在的な中・長期的事象と重篤な疾患
3.1.2.過去のワクチンにより成人や子供に起こりうる中長期的なイベントや重篤な疾病の詳細な説明が付録Cに記載されている。これらのイベントや病気のほとんどは予測できないものであり、すべてではないにしても、COVID-19の接種では、大人と子供の中長期的なイベントが起こりうると考えられる。
3.1.3. 子供に対するCOVID-19大量接種の短期・中期・長期の潜在的リスク
3.1.3.1. 本質的な接種剤の毒性
子供はCOVID-19に対して特異な存在である。図1に示すように、本症による重篤な影響のリスクは無視できるほど小さい。COVID-19の接種剤は数ヶ月間しか試験されておらず、中長期的な悪影響が不明であることを考えると、中長期的な有害事象が発生した場合、数十年にわたって子どもたちに悪影響を及ぼす可能性がある。
我々は、COVID-19の接種剤による中長期的な悪影響の可能性を裏付ける証拠が最近出てきたことから、中長期的な悪影響の可能性があると考えており、以下のように考えている。
- スパイクタンパク質自体が毒素・病原性タンパク質である可能性がある。
- Sタンパク質は、ACE2をダウンレギュレートし、その結果、ミトコンドリア機能を阻害することで、血管内皮細胞(EC)にダメージを与えることができる[37]。
- ACE2と内皮の損傷はSARS-CoV2の病態の中心的な部分であり、スパイクタンパクだけで誘発される可能性があると結論づけている[38]。
- SARS-CoV-1のスパイクタンパク質(ウイルスの残りの部分を含まない)は、ACE2の発現を低下させ、アンジオテンシンIIレベルを上昇させ、肺傷害を悪化させ、肺血管リモデリングや肺動脈性肺高血圧症(PAH)さらには他の心血管合併症を促進する可能性のある細胞シグナル伝達イベントを誘発することがわかった[39]。
- 組換えSタンパク質単独で、心臓血管周皮細胞(PC)の機能的変化を誘発する[40]。と記録されている。
- 遊走(migration)の増加
- マトリゲル上でのECネットワーク形成をサポートする能力の低下
- サイトカインストームに典型的に関与する炎症性分子の分泌
- ECを死に至らしめるアポトーシス促進因子の産生 さらに、Sタンパク質は、心筋PCにおいて、ACE2ではなく、CD147受容体を介して細胞外シグナル調節キナーゼ1/2(ERK1/2)のリン酸化/活性化を刺激することから、Sタンパク質は血管細胞の機能障害を誘発し、コロナウイルス全体による被害を増幅、または永続させる可能性がある[40]。
- 「アンジオテンシン変換酵素2受容体が存在しない場合でも、SARS-CoV-2スパイクタンパク質のS1サブユニットが中性リン脂質膜に結合すると、膜の機械的不安定化と伝染性の低下を引き起こす。このタンパク質の同様の細胞毒性効果は、ヒト肺上皮細胞で見られた。」 [125].
- 接種剤のmRNAを内包するLNP層は、皮内接種でも鼻腔内接種でも炎症性が高い[41]、「ポリエチレングリコール(PEG)は、Pfizer/BioNTechのmRNA COVID-19ワクチンに対するアナフィラキシーの原因となっている」[42]。「人間は、PEGを含む日常製品にさらされているため、PEG抗体を作っている可能性が高い。したがって、mRNA-LNPワクチンの初回接種で観察される即時的なアレルギー反応の一部は、既存のPEG抗体に関連しているかもしれない。これらのワクチンはしばしばブースターショットを必要とするため、初回接種後には抗PEG抗体の形成が予想される。したがって、アレルギー事象は再接種時に増加する可能性がある」[43]。
また、接種後の甲状腺機能亢進症[44]や接種後の亜急性甲状腺炎[45]に関する研究で示されているように、LNPシェルの成分がASIA症候群(アジュバントによって誘発される自己免疫/炎症症候群)を誘発する可能性もある。 - スパイクタンパク質は、接種後の個人の血漿中に見出されており、体内のあらゆる部位に循環し、悪影響を及ぼす可能性があることを示唆している[46]。
- SARS-CoV-2のスパイクタンパクは、マウスの血液脳関門を通過し[47]、「SARS-CoV-2のスパイクタンパクは、脳内皮細胞に炎症反応を引き起こし、BBB機能の変化に寄与している可能性がある」とされている[48]。
- 今回のCOVID-19の接種によって生体内で製造されたスパイクタンパク質は、抗SARS-CoV-2タンパク質抗体が55種類の多様なヒト組織抗原のうち28種類と交差反応したという知見に基づき、潜在的に「感受性の高いサブグループにおいて自己免疫の発症を促進し、既存の自己免疫疾患を持つ被験者の自己免疫を悪化させる可能性がある」とされている[49]。
- 「ChaAdOx1[SARS-CoV-2に対するアストラゼネカ社の組換えアデノウイルスワクチン候補]のマウスにおける生体内分布により、脳組織へのワクチンの送達が確認された[50]。そのため、ワクチンが脳細胞に拍車をかけてCoViDスパイクタンパクを産生させ、脳細胞に対する免疫反応を引き起こしたり、スパイクタンパクによる血栓症を引き起こしたりする可能性がある。このことは、ウイルスベクターを用いたCoViD-19ワクチンで観察された致命的な脳静脈洞血栓症(CVST)の特異な発生を説明できるかもしれない」[51,52]。
アデノウイルスベースのワクチンによる血小板減少症を説明する補足的な視点は、「野生型およびコドン最適化されたSpikeオープンリーディングフレームの転写は、C末端が切断された可溶性Spikeタンパク質変異株につながる代替スプライスイベントを可能にする」というものである。これらの可溶性Spike変異株は、血管内のACE2を発現している内皮細胞に結合すると、重篤な副作用を引き起こす可能性がある」としている。[100]. - 日本で実施されたファイザーコンフィデンシャル社の研究では、「BNT162b2と同等のLNPに配合されたルシフェラーゼをコードするmodRNAを筋肉内に注射すると、注射部位に加えて多くの臓器・組織に濃縮される」ことが示された[53]。主に確認された臓器/部位は、副腎、肝臓、脾臓、骨髄、卵巣であった。これらの臓器・部位のいずれかが損傷を受けると深刻な事態になる可能性があるが、卵巣への悪影響は、出産可能な年齢または出産前の女性にとって壊滅的な事態になる可能性がある。
最終的にヒトに使用するための接種剤の)信頼できる生体分布研究の主な目的は、ヒトにおける実際の接種剤の時空間的分布を特定することである。すなわち、最終的な目的の製品(この場合は、発現したタンパク質抗原/スパイクタンパク質)が、時間の関数として異なるヒトの組織や臓器でどれだけ生成されるかを特定することである。これは、ファイザー社のコンフィデンシャル研究で報告された内容とは異なる。
生体内での研究にはラットが使用されたが、ラットの生体内分布とヒトの生体内分布との関係は不明である。後肢/筋肉内という異なる部位に注射されているが、ヒトの三角筋への注射との関係は不明である。BNT162b2と同等のLNPに配合されたルシフェラーゼをコードするmodRNA」を注射したが、なぜBNT162b2を注射しなかったのか、LNPの濃度ではなくスパイクタンパクの発現を評価しなかったのか、また、実際に実験に使用した接種剤の生体内分布とBNT162b2の生体内分布との比較が不明確である。
ラット1匹につき1回注入した。2回目の注射は1回目と同じ正確な場所ではなく、1回目の注射による凝固作用やその他の潜在的な血管合併症により循環系が変化している可能性があることを考えると、2回目の注射による生体分布の変化が1回目の注射と比較してどのようになるのかは不明である。変異に対抗するためにブースター注射を行った場合、先行する2回の注射の結果として、その生体分布がどのように変化するかは不明である。
血栓症は、血流が減少した場合に最も高い確率で発生する(LNP-内皮細胞の相互作用に利用できる時間が長くなる)。また、最初の注射で血栓形成が促進されることで低速度域の流れがさらに収縮し、その後の注射でこの血流低下による血栓形成の促進サイクルがさらに増幅されるような、正のフィードバック行動が起こるかどうかは不明である。
www.sciencedirect.com/science/article/pii/S221475001830622X
ラットは原始的な環境下で注射されたが、複数の有害物質に複合的に曝されてきた、あるいは曝されている、あるいは曝され続ける人間と比較してどうなのかは疑問が残るところである。これらの組み合わせが相乗的に作用して、全身の無数の臓器や組織に悪影響を及ぼすことがわかっている[23]。ヒトにおけるこれらの有害物質への曝露が、血液/組織関門の伝染性、特に注射された物質が血流中に拡散する能力(また、製造されたスパイクタンパク質が血流中から周囲の組織に拡散する能力)にどのような影響を与えるのかは分かっていない。
ヒトの臓器・組織における接種剤の生体内分布をより現実的に把握するためには、これらの短期実験にはより高度な霊長類を用いるべきであった。言い換えれば、これらの実験室での実験は、人間の重要な臓器や組織に集中する接種剤の量を推定するための氷山の一角に過ぎないかもしれない。
上記で言及した多くの研究は、mRNAを用いたCOVID-19の接種(米国でこれまでにCOVID-19に使用された最も多くの接種)が、スパイクタンパク質の指示書(mRNA)と、mRNAを内包する合成脂肪LNPという(少なくとも)2つの主要な毒素から構成されていることをまとめて示している。ワクチンは三角筋に注射されるが、その際、LNPが原因で注射部位に炎症を起こし、LNPのPEG-2000成分が原因でアナフィラキシーを起こす可能性もある。注射された物質の一部は注射部位に留まり、エンドサイトーシスによって細胞と結合して細胞表面にスパイクタンパクを発現させ、適応免疫系を刺激して最終的にスパイクタンパクに対する抗体を産生する[54]。
注射された残りの部分は、リンパ系や血流に入り、全身の組織や器官に分配される。例えば、「筋肉内(IM)ルートで投与された薬物は、血管筋組織に沈着し、循環系に速やかに吸収される」[55]。このプロセスの基本は、かさばる筋肉が良好な血管性を有しており、したがって、注射された薬物は、初回通過代謝をバイパスして、全身循環に迅速に到達し、その後、特定の作用部位に入ることである[56]。次のように、LNPのPEG-2000コーティングによって広範な分布が大幅に強化される。タンパク質をPEG化することで、全身循環時間を改善し、免疫原性を低下させることに成功している[57]。ナノ粒子上のPEGコーティングは、凝集、オプソニン化、およびファゴサイトーシスから表面をシールドし、全身循環時間を延長する。[57]. また、ナノ粒子上のPEGコーティングは、他の投与方法に伴う効率的な薬物および遺伝子送達に対する様々な生物学的障壁を克服するために利用されている。[57]
血流中では、LNPが血管の内側にある内皮細胞と合体し、エンドサイトーシスによってmRNAを細胞に転送するという結果が考えられる。そして、内皮細胞はその表面にスパイクタンパクを発現する。スパイクタンパク質によって流れてきた血小板は、その表面にACE2受容体を発現している。したがって、スパイクタンパク質によって血小板が活性化され、血液凝固が開始されることが一つの可能性である。もう一つの可能性は、改変された内皮細胞が自然免疫系の細胞に異物として認識されることである。そして、これらの免疫キラー細胞が内皮の一部を破壊し、血液器官のバリアーを弱めることになる。LNPは内皮にも炎症を起こし、バリアーの伝染性を高め、血管の直径を大きくする。このような血液器官のバリアーの弱体化は、無数の毒性のある要因が作用するため、あらゆる炎症に重なることになる[4]。新たに形成されたスパイクタンパク質を持つ細胞は、血液器官の障壁を突き抜け、ACE2受容体が発現している組織に結合する。内皮細胞と合体せずに無傷で残ったLNPも、伝染性のある血液器官関門を通過して、臓器細胞と直接合体する可能性がある。これにより、自然免疫系細胞による攻撃を受け、自己免疫の前兆となる可能性がある[4]。
前述のファイザー社の生体内分布研究では、複数回の接種による生体内分布の変化が問題となった。同様に、複数回の接種による上記のような効果の変化も考慮しなければならない。それぞれの接種にはプラス面とマイナス面がある。プラスの側面は、筋肉細胞やリンパ系での抗体の形成である。否定的な側面としては、血流に入る接種剤のその部分について、潜在的な凝固作用および伝染性の増加が挙げられるが、これらに限定されない。最初の接種剤の投与は、免疫系のプライミングとみなすことができる。免疫反応は比較的穏やかなものになるであろう。2回目の接種量では、より活発な免疫反応が期待できる。これにより、筋肉細胞やリンパ系での望ましい抗体産生が促進されるが、スパイクタンパクを発現している血管内皮細胞や血小板に対する免疫反応も促進され、より深刻なダメージを受ける可能性がある。ブースター接種が必要な場合は、2回目の接種によるプラスとマイナスの両方の免疫反応をさらに高める可能性がある。プラスの効果は可逆的であるが(抗体レベルは時間とともに低下する)マイナスの効果は累積的で不可逆的であるため、追加接種を行うたびに傷害率や死亡率が上昇する可能性がある[58]。
これらの影響は、VAERSの結果に見られるように、短期的には身体全体に生じる可能性がある。このような影響は、VAERSの結果に見られるように、短期的には全身に生じる可能性があるが、破壊的なプロセスが完全に作用するのに必要な時間や、さらに接種を行うことによって、中長期的にも生じる可能性がある。例えば、観察可能な症状を引き起こすには不十分な接種によって生じた微小血栓は、実質的に血栓症のベースラインを引き上げる可能性がある[92]。血液凝固の促進に寄与する生活習慣は、観察可能な症状を引き起こすまでの距離が短くなり、その結果、血栓症の深刻な影響が加速されたであろう[59,60]。例として、静脈血栓症のリスクは、航空機での移動後に約2~4倍に増加する[61]。一部の受診者に微小血栓が形成されている接種後に、この割合がどの程度増加するかは不明である。これらの潜在的なベースライン上昇効果は、付録1の最後に示すように、VAERSの結果の解釈に影響を与える可能性がある。
3.1.3.2. 子どもに対する接種剤の有害な影響
SARS-CoV-2ウイルスのスパイクタンパク成分だけでなく、毒性のあるLNPカプセル化シェルにもさらされることを考慮すると、COVID-19の接種が子どもたちに与える中長期的な健康への悪影響はどのようなものになるだろうか。この毒性のある組み合わせは、直接注射することで、(通常、自然免疫系によって提供される)多くの防御策を回避してしまうことになる[62]。これまで述べてきたように、SARS-CoV-2にさらされても病気にならないような子供でも、スパイクタンパクが有害であると考えられる主な理由は、1)接種による自然免疫系のバイパス、2)血流に入るスパイクタンパクの量の多さ、3)カプセル化されたLNP層による追加の毒性効果、であると考えられる。
3.1.3.2.1. 中期的な健康への悪影響の可能性
2021年6月中旬頃にVAERSに報告された0~17歳の年齢層に対するCOVID-19接種後の無数の症状/バイオマーカーの変化を調べると、非常に初期の被害を示すものがある[63]。悪影響を受ける主な領域・システム(VAERSの症状・バイオマーカーは括弧内に記載)は以下の通り。
- 循環器系(血中クレアチンホスホキナーゼ増加、心臓画像診断異常、心エコー図異常、心電図異常、心拍数増加、心筋炎、動悸、心膜炎、頻脈、トロポニンI増加、トロポニン増加、フィブリンDダイマー増加、血小板数減少、血圧増加、徐脈、脳性ナトリウム利尿ペプチド増加、駆出率減少、片頭痛)。
- 消化器系(腹痛、下痢、嘔吐、アラニンアミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加。
- 神経(歩行障害、運動能力低下、筋痙攣、筋肉の引きつり、痙攣、振戦、ベル麻痺、ジスキネジア)
- 免疫(C反応性タンパク質増加、赤血球沈降速度増加、白血球数増加、炎症、アナフィラキシー反応、そう痒、発疹、リンパ節腫脹)。
- 内分泌(月経多量出血、月経異常
さらに、さまざまな視覚障害や呼吸障害も大量に報告されている。
全身の主要なシステムが影響を受けており、主要な臓器の多くも影響を受けている。VAERSへのデータ入力にタイムラグがあることや、子どもへの接種がかなり最近始まったことを考えると、即時性のある症状やバイオマーカー反応が重視されると考えられる。臓器や器官の損傷が発生し、現れるまでには時間がかかる。スパイクタンパク/LNPの循環と損傷のモデルが予測しているように、心血管系の問題が大半を占めており、そのような問題がどの程度可逆的であるかは不明である。上記のVAERSの症状の多くは、COVID-19の成人患者にも見られた[64]。
MIS-C(Multisystem Inflammatory Syndrome in Children)の例を考えてみよう。これは、これまでに適度な頻度でVAERSに出現しており、COVID-19感染後約1カ月後にも発生している[65]。どちらのケースでも、スパイクタンパクの存在が共通の特徴であった。その特徴的な症状の多くは、VAERSから上に挙げたものである。MIS-Cは、川崎病(KD)毒素性ショック症候群(TSS)マクロファージ活性化症候群(MAS)/第二次血球貪食性リンパ組織球症(HLH)などの既知の疾患実体と類似している[66]。MIS-Cの一つの症状は青年期に見られ、疾患負担が大きく、ほぼ共通して心臓や消化器などの臓器が関与し、ショック、リンパ球減少、心筋炎を示す心筋バイオマーカーの上昇の発生率が高いことが明らかになっている[67]。MIS-Cを発症した子どもたちが初めて報告されて以来、よく知られている小児疾患であるKDの典型的な症状を呈する子どもたちがいることが明らかになった[68]。さらに、KDは通常、成人では信じられないほどまれであるにもかかわらず、MIS-Aの患者もKDのような特徴を持つことが報告されている。[このように、COVID-19の副作用をこれらの疾患で検証することで、今後の予防接種で何が期待できるのかを明らかにすることができるかもしれない。
以下のセクションでは、川崎病(KD)とMultisystem Inflammatory Syndrome in Children(MIS-C)を取り上げる[65]。
KDは急性の血管炎・炎症で、主に冠動脈を侵し、冠動脈瘤を引き起こす可能性がある。その他のKDの症状としては、動脈、臓器、組織の全身的な炎症、それに伴う肝炎や腹痛、肺の間質性肺炎、脳膜の炎症による無菌性髄膜炎、心筋炎、心膜炎、弁膜炎、尿路化膿症、膵炎、リンパ節腫大などが挙げられる[69]。一般的に、ほとんどすべての子供が完全に回復するものの、そのうちの何人かは後に冠動脈拡張や動脈瘤を発症する[70]。病因学的および病理学的には、KDは感染症による異常な自己免疫反応によって引き起こされることが多くの研究で示されている[71]。感染症仮説は、少なくとも出発点として感染症が関与していることを示す疫学データによって支持されている。これまでに提案された感染症の病原体には、ヘルペスウイルス科、レトロウイルス、パルボウイルスB19,ボカウイルス、ブドウ球菌、連鎖球菌、バルトネラ、エルシニア感染症などの細菌感染症がある[72]。
SARS-CoV-2は、これらの感染症に加えて、分子模倣や自己抗原との交差反応を介して自己抗体を誘発する可能性が高い[72,73]。
そして、抗原抗体免疫複合体の形成は、マスト細胞、好中球、マクロファージの受容体の活性化、それに伴う炎症性サイトカインの放出と血管伝染性の増加、補体系の活性化、好中球とマクロファージによるプロテアーゼとさらなる炎症性サイトカインの分泌の刺激[74]を経て、KD症状を引き起こし、MIS-Cを特徴づける「サイトカイン・ストーム」に統合される[75]。実際、KDの特徴は、インターロイキン(IL)-6,IL-8,IL-15,およびIL-17のレベルの上昇であり、サイトカインのレベルはKD患者の冠動脈瘤形成を予測している[76,77]。
3.1.3.2.2. 長期的な健康への悪影響の可能性
長期的には、SARS-CoV-2によって誘発されたKD血管炎は重篤な病態を引き起こす可能性がある。血管炎は冠動脈に好発する傾向があり、中~大規模な冠動脈瘤を持つ人は生涯にわたって高い合併症率を示する[78]。サイトカインによって誘発された炎症は、内皮の機能障害と血管壁の損傷を引き起こし、動脈瘤の拡張につながる。その後、血管のリモデリングが起こることもあるが、これは疾患の解決や将来の合併症のリスクの軽減を意味するものではない。心筋虚血や心筋梗塞につながる可能性のある進行性の狭窄、血栓症、内腔閉塞を検出するための厳密なフォローアップが必須となる[78]。虚血性心疾患だけでなく、自己免疫疾患やがん、さらには全死亡率の増加など、KD患者の子どもたちは長期的な転帰において、同様に重要なリスクを抱えている可能性がある[71]。
子供や青年への大量接種に関しては、以下のような疑問がある。
a)SARS-CoV-2の無症候性キャリアである小児は、ウイルスを媒介するのか?
b)SARS-CoV-2 に感染した、最近ワクチンを接種した人がウイルスを媒介するのか?
地域社会において、子供がSARS-CoV-2を伝播するという証拠があるが、成人と比較した場合の相対的な伝播率に関しては、既存の文献には異質なものがある[79]。
韓国とタイの研究では、二次感染者の数は非常に限られてた [80,81]。一方、インドで行われた大規模な接触者追跡調査では、感染の可能性が最も高いのは、年齢が近い症例と接触者のペアの間であり、感染リスクが高まるこのパターンは,0~4歳の子どもと65歳以上の成人で最も高いという結論が出ている [80]。
2つ目の疑問に関しては、ファイザーまたはアストラゼネカのCOVID-19のいずれかを単回接種した医療従事者の世帯員は、接種していない医療従事者の世帯員と比較して、接種から14日後にPCRで確認されたSARS-CoV-2感染のリスクが有意に低下したが、入院のリスクは統計学的に有意ではなかったことが示されている[82]。この所見は、重症化は感染者の特徴と関連しており、感染とは直接関連していないことを改めて強調しており、子供ではなく高齢者に接種すべきであることを示唆している。
3.2. 最も弱い立場にある人々へのCOVID-19の接種に関する新しいベストケースシナリオの費用便益分析
従来の費用便益分析は、提案されたプロジェクトの潜在的な価値を推定するために使用される一般的な財務ツールである。この分析では、時間の経過とともにコストの流れを作り、時間の経過とともに利益の流れを作り、これら2つの流れの正味現在価値(リスクを含む)を比較して、リスク調整後の割引された利益がリスク調整後の割引されたコストを上回るかどうかを確認する。付録Dでは、米国の65歳以上の人口層に予防接種を行う場合の、非伝統的なベストケースシナリオの疑似費用便益分析を詳細に示している。このコスト・ベネフィット分析では、コストは接種によって発生する死亡者数であり、ベネフィットは接種によって救われる命である。期間は 2019年12月から 2021年5月末までとした。割引は行わず、接種後すぐに発生した接種による死亡は、接種後数カ月経ってから発生した接種による死亡と同じ重要性/重み付けをした。
なぜこのような非伝統的なアプローチが費用便益分析に選ばれたのであろうか?予防接種に関する伝統的な非財務的費用便益分析では、予防接種によって防止される有害事象と、予防接種によって生じる有害事象を比較する。現在、米国では、COVID-19 とその接種剤の定義、試験基準、報告のインセンティブが時間とともに変化しており、標準的なアプローチでは信頼性のある結果が得られないと考えている。付録Daでは、上記の発言の根拠となったCOVID-19診断基準の問題点を紹介している。
COVID-19で死亡した多くの人が、医療界やCDCによってCOVID-19が原因で死亡したとされたパンデミックビルドアップ期とは対照的に、VAERSで報告された接種後の死亡者は、CDCによってほとんどが接種以外の原因によるものとされている。我々は、恣意的な基準や主観的な判断への依存度が低い、修正された費用対効果分析を使用したいと考えた。
ここで選択したアプローチは、ベストケースシナリオの疑似費用便益分析と見なすことができる。ここでは、COVID-19に起因するすべての死亡を予防接種によって防ぐことができたと仮定する(COVID-19に起因する総死亡数から、1)非常に高い増幅サイクルで実施されたPCR検査による偽陽性数、2)死亡者に典型的に見られる多くの併存疾患に起因する死亡数を差し引いたものである)。を 2019年12月から 2021年5月末までの期間で計算し、その数を、結果のセクションでの計算に基づいて、本当に接種に起因する死亡者数(2021年1月から 2021年5月末まで)と関連づける。その結果、保守的に見て、65歳以上の層では、各接種に真に起因する死亡数とCOVID-19に真に起因する死亡数は5倍であることがわかった。年齢が下がり、COVID-19のリスクが下がると、費用対効果は高まる。このように、予防接種の効果が低いと思われるベストケースのシナリオであれば、現実的なシナリオは非常に低いものになるであろう。子供の場合、COVID-19による死亡の可能性は無視できるが、毒性のある予防接種による生涯にわたる深刻な被害の可能性は無視できない。
4.考察
これらの結果から2つの問題が生じる。
第一に、子供や、ましてや40歳以下のほとんどの人への接種を正当化するデータはどこにあるのか?図1には見当たらないが、最も脆弱なのはほとんどが多くの併存疾患を持つ高齢者である[83]。しかし、アメリカでは、ファイザー社が12~17歳の子供への接種を承認しており、秋の学校年度開始までに達成することを目標としている。前述したように 2021年末までに開始される6ヶ月の子供への接種も計画されている。
リスクが実質的にゼロのグループに何を急いでいるのか?[84]。接種が数ヶ月しかテストされなかったことから、非常に短期的な悪影響しか得られなかった。臨床試験で得られたこれらの短期的な影響でさえ、VAERSで報告された最初の大量接種の結果から得られた短期的な影響をどの程度反映しているかは疑問である[84]。
図1、図2は、このような極めて短期的な結果のみを反映している。多くの研究者は、自己免疫、抗体依存性増強、神経学的、およびその他の潜在的に深刻な影響が、数ヶ月から数年のタイムラグを伴って、より長期的に現れる可能性を示唆している。もし、そのような影響が実際にあったとしたら、その苦しみを背負うのは子供たちである。子供や若者には予防接種のメリットはなく、コストだけがかかるようである。
2つ目の問題は、なぜ図2のような死亡例が臨床試験で予測されなかったのかということである。我々は、ファイザー社の試験結果(数ヶ月の試験に基づく)を検討したが、試験の死亡率の結果から、(潜在的に)何十万人もの死亡が予測されたとは思えなかった。なぜこのようなギャップが生じたのであろうか?
臨床試験のセクションで示したように、ファイザー社のサンプルメンバーの17.4%が65歳以上、4.4%が75歳以上であった。試験の後期フェーズが2020年7月下旬に開始されたとき、マネージャーは、図1の2020年7月のアナログから影響を受けたCOVID-19の年齢層を知ってた。最も影響を受ける年齢層からサンプリングするのではなく、主に最も影響を受けない年齢層からサンプリングした。また、非常に限られた年齢層からのサンプリングであっても、最も重篤な合併症を持つ人たちを選んだかどうかは不明である。我々の印象では、病人は試験から除外されているが、接種者は最初に選ばれている。
注射の中心となる成分であるスパイクタンパクのレシピでは、3つの効果をもたらす製品ができることが明らかになってきた。3つのうち2つは、スパイクタンパクに対する抗体の産生で起こる。これらの抗体は、ウイルスに対する保護を提供すると言われている(ただし、「ブレイクスルー」事例が多数報告されているため、その点は疑問である)し、重篤な症状をある程度抑えることができる。また、人間の組織抗原と交差反応して、自己免疫作用を引き起こす可能性もある。3つ目は、注入された物質が血流に入り、広く循環するときに起こる。これは、血管の多い注入部位とPEG-2000コーティングの使用によって可能になる。
これにより、スパイクタンパクが体内のあらゆる場所の内皮細胞で製造/発現され、血小板を活性化して血液凝固を引き起こすと同時に、血管障害を引き起こすことができる。この効果がメーカーに知られていないとは考えにくく、いずれにしても、VAERSデータを用いて体内の無数の場所で実証されている。最もリスクの高い高齢者層には接種によるわずかな利益があり、リスクのない若年層には利益がなく、どちらの層にも接種による害が生じる可能性が高いと考えられる。なぜこのような全集団への大量接種が行われ、許可され、推進されているのかは不明である。
5.全体的な結論
COVID-19による死亡者の多くが発生した年齢層の無数の合併症を持つ人々は、非常に健康状態が悪かった。彼らの死は、いくつかの研究で示されているように、全原因死亡率を増加させるものではなかったようである。もし彼らがCOVID-19で死亡していなかったら、おそらくインフルエンザやその他の併存疾患の多くで死亡していただろう。COVID-19で死亡した人が多かった/多かったと断言できないのは、以下の理由による。1)PCR検査が大量の偽陽性を出すように操作されていたこと、2)無数の併存疾患があるにもかかわらず、死亡原因が恣意的にCOVID-19とされていたこと。
この論文で紹介されているグラフは、体の弱い注射を受けた人が接種による恩恵をほとんど受けていないことを示している。彼らの基本的な問題は、免疫系の機能不全であり、これは生涯にわたる有害物質への暴露や有害な行動の一部または全体に起因している。彼らは、野生のウイルスが機能不全の免疫系を過剰反応または過小反応させて悪い結果をもたらすか、または注射が同じような結果をもたらすかのどちらかの影響を受けやすい。
これは次のような例えで説明することができる。裸の金属製の筐体の中に人が立っている。その人がマッチに火をつけて床に落とすとどうなるかは、床に何があるかによる。床が金属のままであれば、マッチは数秒間燃え続け、やがて消えてしまう。マッチの下に紙が敷かれていれば、マッチも紙もしばらく燃えて消えてしまう。しかし、床に硝酸アンモニウムなどの可燃性・爆発性の物質が敷かれていた場合は、大爆発を起こしてしまう。COVID-19の場合、野生のウイルスがマッチである。可燃物は有害な曝露と有害な行動である。有害物質への曝露や有害物質を使用した行動によるバイオマーカーの「痕跡」がなければ、何も起こらない。毒物への暴露や毒物を使用した行動によるバイオマーカーの「痕跡」が顕著であれば、悪い結果になる。
COVID-19の接種に関する十分な安全性試験が行われていれば、「マッチに火をつける」ことで予想される結果の分布が得られたはずである。十分なテストが行われなかったため、床にどれだけの可燃物があるのか、「マッチに火をつける」ことでどのような結果が予想されるのか、見当もつかない。
注射は、野生のウイルスよりも2段階進んでいる。
1)血管やその他の形態の損傷を引き起こす可能性があることがいくつかの実験で示されているスパイクタンパク質を作るための指示が含まれていること、
2)自然免疫系の多くの最前線の防御を迂回して、部分的に直接血流に入ることができること。
ウイルスの例とは異なり、この注射によって、他に毒性の暴露や行動がなくても、床には必ず可燃物が存在することになる。言い換えれば、スパイクタンパクとその周辺のLNPは、他の要因がない場合でも、短期、中期、長期にわたる無数の健康への悪影響を引き起こす可能性のある毒素なのである。これらの影響がいつ、どこで発生するかは、注入された物質の生体内分布による。ファイザー社が行った生体内分布調査では、注射された物質が全身の無数の重要な器官に存在し、多臓器不全を引き起こす可能性があることが示されている。また、これらの研究は1回の注射によるものである。複数回の注射やブースターショットは、接種剤の臓器分布に累積的な影響を与える可能性がある。
COVID-19で報告された死亡例は、COVID-19で死亡した人であり、必ずしもCOVID-19が原因ではない。同様に、VAERSの死亡例は、接種後に死亡した人であり、必ずしも接種が原因ではない。
前者については、CDCは報告された死亡者の約94%が1つ以上の併存疾患に起因する可能性があることを認めており、それによってCDCがCOVID-19に厳密に起因する数はすべての年齢層で約35,000人に減少している。増幅サイクルの高いPCR検査による偽陽性が多いことや、医療従事者が検査をしていない場合やPCR検査が陰性であってもCOVID-19による死亡とすることを厭わないことを考えると、この35,000人という数字もかなり誇張されているのではないかと思われる。
後者の問題については、Virginia Stoner [85]とJessica Rose [86]の両氏が、接種後の死亡は偶然ではなく、注射時に強く集中していることから接種との関連性が高いことを独自に示している。付録1で報告されているVAERSデータベースの我々の独自の分析では、これらのクラスタリングの知見が確認されている。
さらに、VAERSは歴史的に有害事象を約2桁過少に報告してきたため 2020年12月中旬から 2021年5月末までの期間、COVID-19の接種による短期的な死亡者数は米国で数十万人に達し、COVID-19の実際の死亡者数を押しのける可能性がある。最後に、これまでに報告されたVAERSの死亡者数は、非常に短期的なものである。臨床試験ではこれらのテストを行っていないため、中長期的な死亡数はわからない。
臨床試験では、代表性のない若くて健康なサンプルを使用して、注射のためのEUAを取得した。EUAを感染した後、最初は重病人(および第一応答者)に大量接種を行い、多くの人が急速に死亡した。しかし、COVID-19の接種後に死亡した高齢者は非常に虚弱で、複数の合併症を抱えていたため、彼らの死は容易に注射以外の原因に帰することができた(COVID-19の死亡例も同様であるはずです)。
現在の目的は、米国の全人口への予防接種である。これらの潜在的な重篤な副作用の多くは、少なくとも6ヶ月以上のタイムラグを持っているため、ほとんどの人口が接種されるまで、それがどのようなものであるかはわからず、是正措置を講じるには遅すぎるかもしれない。
CRediTの著者の貢献度に関する声明
Kostoff RN:着想、データ分析、原稿執筆で本論文に貢献。Calina D:データ解析、原稿執筆、編集に貢献した。Kanduc D:データ解析と原稿執筆に参加した。Briggs MB:データ解析、結果の検証、グラフィック作成に参加した。Vlachoyiannopoulos P: 原稿執筆に参加した。Svistunov AA: 原稿の編集とレビューに参加した。Tsatsakis A: 原稿の編集とレビューに参加した。
すべての著者が平等に貢献し、最終版の原稿を承認した。
著者の貢献
Kostoff RNは本論文の構想、データ解析、原稿執筆に貢献し、Calina Dはデータ解析、原稿執筆、編集に貢献し、Kanduc Dはデータ解析、原稿執筆に貢献し、Briggs MBはデータ解析、結果の検証、グラフィック作成に貢献した。Vlachoyiannopoulos Pは原稿執筆に参加した。Svistunov AAは原稿の編集とレビューに参加した。Tsatsakis Aは原稿の編集とレビューに参加した。全著者が平等に貢献し、最終版の原稿を承認した。
倫理的承認
該当しない。
競業利益の宣言
著者らは、競合する利益がないことを宣言する。
謝辞
該当しない。
付録A
65歳以上の人口統計上の予想死亡数とCOVID-19接種による死亡数の比較
この付録の目的は、VAERS [93,94,101]で報告された接種後の死亡数に基づいて、COVID-19の接種による実際の死亡数を推定することである。使用する手法は以下の通りである。
1)COVID-19の接種がなければ予想されるCOVID-19接種後の死亡数を特定する(すなわち、COVID-19接種前の死亡統計)。
2)VAERS予想死亡データを、過去の死亡統計に基づいて予想される実際の死亡数と関連付ける。
3)この比率を適用して、VAERSで報告されたCOVID-19の接種に起因する死亡者数を拡大し、COVID-19の接種に起因する実際の死亡者数を算出する。
例えば、COVID-19接種前の予想死亡者数を反映してVAERSに10人の死亡者を示すことができ、過去のデータから得られたCOVID-19接種前の予想死亡者数の実数が100人であった場合、VAERSで報告された死亡者数を実際の死亡者数に換算するために、死亡者数のスケーリング・ファクターは10となる。そして、VAERSで報告されたCOVID-19の接種に起因すると考えられる死亡者数に、予想死亡者数のスケーリングファクターである10を乗じて、COVID-19の接種に起因する実際の死亡者数を算出する。したがって、VAERSでCOVID-19の接種に起因する死亡者数が50人とされている場合、COVID-19に起因する実際の死亡者数は、これらの仮定により500人となる[3]。
我々のアプローチの根拠となるのは、米国連邦政府の次の声明である。”医療提供者は、COVID-19接種後の以下の有害事象[33]や、後にFDAによって改訂された場合のその他の有害事象をVAERSに報告する必要がある” [96,102,103]。”因果関係に関わらず重篤なAE。”死亡を含む[3,95]。
もしVAERSでこの要件が完全に遵守されていたならば、VAERSで報告された死亡数は以下の合計に等しかったはずである。
1)過去の統計に基づく)実際の予想死亡数
2)COVID-19の接種に起因すると考えられる予想死亡数以上の実際の死亡数。
この要件に基づいて、COVID-19の「パンデミック」がなかった場合に65歳以上の人口層で発生したであろう死亡数の概算を(可能な限り単純な形で)算出する。そして、この数を、65歳以上の人口層におけるCOVID-19の接種後にVAERSに報告された死亡数と関連付けることにする。これにより、VAERSに報告された実際の死亡者数の割合を推定するための「フロア」が得られる。続いて、COVID-19の接種に起因する潜在的な死亡数をパラメータ化し、報告された死亡数と実際の死亡数の比率に及ぼす影響を表示する。グローバル分析とローカル分析を行い、大きな違い、小さな違いが生じるかどうかを確認する。ローカル分析(セクションA1-a2)はグローバル分析よりも多少わかりやすいかもしれないが、どちらも似たような結論になる。
A1- VAERSに報告されたCOVID-19接種後の死亡者数と予想死亡者数との比較
A1-a . VAERSの問題点
VAERSで報告された有害事象の数を議論する前に、VAERSの潜在的な欠点や問題点を明らかにし、有害事象の数を適切な文脈で理解できるようにする必要がある。前述したように、VAERSはCDCとFDAが共同で運営するパッシブサーベイランスシステムであり、歴史的に見ても実際のワクチン・予防接種の有害事象の約1%が報告されていることが明らかになっている(本付録で後述する第一原理分析により確認されている)。報告された1%でさえ、無作為に選ばれたという証拠はない。
このような有害事象の大幅な過少報告の一部には、VAERSに関するCDCの大きな利益相反が反映されている。CDCは、COVID-19の接種を含む多くのワクチンの投与に資金を提供している。COVID-19以前は、CDCはVaccines for Children Programだけで年間約50億ドルを提供していた[102]。
COVID-19については、CDCはワクチンの配布を含む無数の活動のために、何十億ドルもの補助金を受け取っている。ワクチンの配布に利用できるCDCの資金を、他のCDCのCOVID-19関連活動から切り離すことは困難であるが、(多くの予算項目の中から)1つの予算項目を見れば、この取り組みの大きさがわかるはずである。2021年コロナウイルス対策・救済補助予算法(P.L.116-260)」である。P.L.116-260は、コロナウイルスワクチンの計画、準備、促進、配布、管理、モニタリング、追跡を行い、広範囲の配布、アクセス、ワクチン接種を保証するために、CDCに87.5億ドルを提供した」。[3]. VAERSにおける実際の有害事象の報告率が低いことは、驚くべきことではない。なぜなら、ワクチンの普及と投与のために毎年数十億ドルの資金を受け取っている同じ組織が、これらの製品の安全性をモニタリングする責任も負っているからである(その責任は放棄されている)。
さらに、1%の報告率は、30日間の追跡調査によるものであり[22]、したがって、非常に短期的な有害事象に限定して適用されている。中期的、特に長期的な事象については、接種と有害事象との関連性が明らかではないため、報告率ははるかに低くなるであろう。これは、これらの超短期的でない有害事象が存在しないということではなく、追跡調査が行われていないということである。証拠がないことはないことの証拠ではない。したがって、VAERSの数字は、リアルワールドに存在するCOVID-19の接種による有害事象の数と種類のうち、非常に低い「下限」と見なすべきである。
A1-a2 グローバル分析
分析を始めるにあたり、CDCの2019年の死亡統計を使用した。2021年6月11日に入手したCDC Wonder[104]の検索結果によると 2019年の米国における65歳以上の人の全原因による死亡者数は2,117,332人であった。年間を通して均一と仮定すると、年初の5か月間に発生した死亡者数は〜882,000人となり、その数を2021年の年初の5か月間の予想死亡者数として使用する。同じ情報源から、65歳以上の年齢層の人口推定値は〜54,000,000人である。CDC COVID-19データトラッカーより、少なくとも1回の接種を受けた65歳以上の人の数は〜44,000,000人[24]。
2021年1月1日から 2021年5月31日までの期間のどこかで接種した人については、接種から5月31日までの期間に死亡すると予想される人数は、この期間の長さの関数となる。例えば 2021年1月1日に44,000,000人全員が完全に接種されていた場合、接種後にCOVID-19以外の原因で死亡すると予想される数は、単純に(44,000,000/54,000,000)×882,000,つまり〜723,000人の死亡となる。逆に言えば 2021年5月31日に44,000,000人全員が完全に接種されていたとすれば、COVID-19の接種以外の原因で接種後に死亡すると予想される数は極めて少ないということになる[24]。
接種後にCOVID-19以外の原因で死亡すると予想される数を正確に推定するには、接種から5月31日までの時間を接種時間分布関数で積分する必要がある。現在の目的では、接種分布関数を平均的な時間的位置で発生するデルタ関数としてモデル化することで、非常に大まかな近似を行う。言い換えれば、個人が受けるすべての接種を1つに圧縮し、実際の接種分布関数から時間的な平均点を特定し、5月31日から時間的な平均点までの距離に基づいて予想死亡数を計算する。
CDCデータトラッカーの接種傾向のグラフ[101]を見ると、分布は非対称のピラミッド型で、4月中旬にピークを迎えているように見える。これは、対象となる5ヶ月の範囲では、2/3ポイントをわずかに超えている。ここでは、平均時間のポイントを距離の2/3として近似する。
表A1は、平均時間を5ヵ月の調査期間で正規化したものと、COVID-19の接種による潜在的死亡者(事前の国勢調査データからは予想されない)を事前の国勢調査データから予想される死亡者で正規化したものを示している。各セルは、総死亡数(事前の国勢調査データから予想される死亡数+予想される死亡群に含まれないCOVID-19接種後の死亡数)に対する、接種後にVAERSで報告された死亡数の割合を表している。この表の根拠となるモデルは以下の通りです:COVID-19接種後の期間には2つのクラスの死亡者が存在する。1つは過去の国勢調査データから予想される死亡であり、もう1つは主にCOVID-19の接種に起因する死亡である。この年齢層(おそらく他の年齢層も)では、この2つの間にはかなりの重複があると思われる。ここでは、過去の国勢調査データに基づいて死亡が予想される人たちをタグ付けできると仮定している。タグ付けされたグループに含まれないCOVID-19の接種に起因する残りの死亡者は、表A1ではCOVIDの潜在的死亡者として分類されている。
表A1. 接種者のCOVID-19以外の原因による予想死亡者数(千人)
表A1。COVID-19以外の原因による予想される死亡は、接種者(数千人)に発生します。
| 潜在的なcovidによる死亡/# 非covidが予想される |
平均時間の場所/ 5か月 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | %REP | 1/3 | %REP | 1/2 | %REP | 2/3 | %REP | 1 | %REP | |
| 0 | 723 | 0.5 | 482 | 0.74 | 362 | 0.98 | 242 | 1.47 | 4.77 | 75 |
| .5 | 1085 | 0.33 | 723 | 0.5 | 543 | 0.66 | 363 | 0.98 | 7.14 | 50 |
| 1 | 1446 | 0.25 | 964 | 0.37 | 724 | 0.49 | 484 | 0.74 | 9.51 | 37 |
セル(2/3,0)を考えてみよう。平均時刻は2021年4月中旬頃で、発生した死亡者は予想されたものだけである(接種したために死亡した人もいるかもしれないが、接種しなくてもその期間中に死亡していたであろう十分な病状であった)。予想された死亡者数は723,000人、報告された死亡者数は〜3560人で、VAERSで報告された死亡者数と実際の死亡者数の比率は1/2%となる。
セル(1/2,1)を考えてみよう。平均時刻は2021年3月中旬頃で、接種分布は二等辺三角形に似ていたと考えられる。発生した総死亡数は、予想された死亡数と、COVID-19の接種に起因するがタグ付けされた予想グループの死亡数と重ならない同数の死亡数である(後者のグループには、接種のために死亡したかもしれないが、接種しなくてもその期間中に死亡していたであろう十分な病気であった人がまだ何人か/多数いる可能性がある)。その期間中に発生した総死亡数は72万4,000人で、報告された数は約3560人、VAERSで報告された死亡数と実際の死亡数の比率は1/2%であった。[3]
つまり、表A1によると、実際の接種分布を最もよく反映しているパラメータ(2/3)に着目すると、全体に対する実際の報告割合は約1%となる。これは、全く異なる経験的アプローチで得られたハーバード・ピルグリム研究の結果(我々のワクチン安全性研究で参照されている)を反映している[4]。少なくとも死亡数の報告については、VAERSにおける実際の死亡数と報告された死亡数の間に約2桁の差があるようである。
表A1では、平均時間とCOVID-19の接種にのみ起因する死亡者数の2つのパラメータを用いて、考えられる結果を幅広く検討した。平均時間のパラメータは、経験的な接種分布関数に基づいているため、よく知られており、解釈には制約があった。COVID-19の接種のみに起因する死亡者数は全く不明である。
で示すように、VAERSで報告された死亡者数はクラスタリングにより接種日と強く関連しているが、死亡した人たちは、死亡することが予想されたためにいずれにしても死亡したであろう人たちでもあったかもしれない。そのグループにはそれぞれ何人かが報告されていたはずである。しかし、COVID-19の接種に直接起因すると考えられる死亡者で、死亡が予想されたグループに含まれなかった人の総数については、全くわからない。我々が知っている限りでは、そのグループには1,000万人がいた可能性があり、VAERSで報告されたのはその全体の中のごく一部に過ぎない。
例えば、VAERSで報告された実際の死亡者数が2つのグループに分かれていたとする。90%が接種による死亡グループ、10%が死亡予想グループだったとする。この2つのグループの間には重複がないと仮定する。その場合、VAERSが示すのは、実際の予想死亡数の1%が報告されたということではなく、予想死亡数の1%の1/10が報告されたということになる。この指標を総死亡数にスケールアップする基準とするならば、実際の接種起因性死亡群の数は、VAERSが報告した死亡数の100倍ではなく、VAERSが報告した死亡数の1000倍ということになる。要するに、VAERSで報告された死亡数を「逆算」して実際の接種起因性死亡数を求めることはできないということである。なぜなら、VAERSで報告された死亡数に対する2つのグループ(予想死亡数と接種起因性死亡数)のそれぞれの未知の貢献度に依存しており、それらを分離することはできないからである。
この分析からわかることは、せいぜい死亡すると予想される数の約1%しか報告されておらず、VAERSで報告された数には両方のグループからの死亡が含まれているため、実際に死亡した各グループからの割合は判断できないということである。現実的には、各年齢層の2021年の総死亡数が確定する2022年半ばまで、予防接種起因の死亡による全死亡率の増加を確認できるかどうかを待たなければならないかもしれない。
A1-a3 ローカル分析
VAERS報告の効率性を推定するもう一つの方法は、COVID-19の接種日に関するクラスタリングに焦点を当てたローカル分析を行うことである。65歳以上の人口統計では、接種後の死亡は接種日の近くに集まっており、接種との強い関連性を示す証拠となる。
この付録の最初のセクションのアプローチに従って、COVID-19接種前の2019年の死亡統計に基づいて、任意の10日間に予想される死亡数を計算する。接種群の場合、任意の10日間に予想される死亡者数は、(2,117,332人/)×(44,000,000/54,000,000 接種した年齢層の人口の割合)×(10/365年の割合)つまり〜47,270人となる。
ベストケースシナリオ
接種後の10日間(接種日を含む)を考える。VAERSでは約2,000人の死亡が報告された。仮にこれらの死亡例がすべて予想されたカテゴリーに入っていたと仮定すると、これはベストケースシナリオと見ることができる。この〜ベストケース・シナリオでは、死亡濃度が最も高く、COVID-19の接種以外の死亡(COVID-19の接種のみに起因する死亡を除く)の予想数に正規化されるが、実際の死亡(接種に関連するかどうか)の2,000/47,270 %、つまり4.23%がVAERSで報告される。したがって、VAERSではせいぜい20倍程度の過少報告がなされていることになる。
仮に、この10日間に、予想される死亡例に加えて、COVID-19の接種に直接起因すると思われる死亡例が1万件あったとする。この場合、2,000/57,270の割合で実際の総死亡数となり、VAERSで報告されている3.5%となる。この後者の方法は、前者の方法よりも仮定が少なくて済むが、それでもVAERSで報告された実際の死亡者数の数パーセントという結果になる。
2010年に実施されたVAERSに報告されたワクチン接種後のイベントに関するハーバード・ピルグリム社の電子追跡調査[4]では、30日間の報告率は1%であった。今回のケースでは、接種後30日以内に約2900人の接種後死亡がVAERSに報告されており、これは65歳以上の人口統計の総死亡数の約82%にあたる。上記の計算で30日を10日に置き換えると、30日の間に予想されるCOVID-19以外の接種後の死亡者数は14万1810人となり、VAERSに報告される死亡者数は2%となる。ハーバード大学の研究では、どんなに小さな出来事でも、発生したすべての事象を自動的に追跡する電子システムを使用していた。VAERSにイベントレポートを提出するための労力(時間とコスト)を考えると、死亡などのより深刻なイベントのみが報告され、その場合でも報告される数はごくわずかであると考えられる。
また、接種後60日目の解析も行った。今回のケースでは、接種後60日以内にVAERSに報告された接種後の死亡者数は約3300人で、65歳以上の人口層の総死亡者数の約93%にあたる。上記の計算で60日を10日に置き換えると、30日間の非COVID-19接種後の予想死亡者数は283620人となり、VAERSで報告される死亡者数の1.2%になる。この正規化は予想死亡数のみに基づいていることを忘れないでほしい。もし、この期間中にCOVID-19の接種を主な原因とする10万人の死亡者が予想されるグループと重なって発生した場合、分母を10万人増やす必要があり、VAERS報告率は0.86%となる。
このように、グローバル分析、ローカル分析、ハーバード・ピルグリムの実証分析のいずれも、米国で発生した実際の死亡者数とVAERSで報告された死亡者数との間に、同じ2桁の差があることに収束している。COVID-19の接種によって実際に死亡した人の数にもよるが、この報告率は数分の1になる可能性もある。
A1-a3a ローカルクラスタリング分析
この付録の最後に、ローカル分析のもう一つの例を紹介する。そのためにはいくつかの背景が必要である。パンデミックの準備段階では(増幅サイクル数の多いPCR検査で偽陽性が多いという問題はさておき)COVID-19で死亡した人は、致死的な合併症の数にかかわらず、ほぼ全員がCOVID-19で死亡したとみなされていた。CDCは後に、COVID-19に起因する死亡の約94%は通常、併存疾患の1つに起因するものであると認めた。
今回の例では、COVID-19の予防接種についても同様の考え方を採用している。接種後に死亡した65歳以上の人々を、接種が原因で死亡した人と、COVID-19接種前の死亡データに基づいて予想された通りに死亡した人の2つのグループに分ける。この2つのグループは、完全に分離しているものから完全に重なっているものまで様々である。ここでは、完全に別個のグループと完全に重なるグループの2つのケースを検討する。
各グループのメンバーはどのようにして決まるのか?接種による死亡群は、死亡が接種日の前後に集中している人で構成されている。予想死亡群は、COVID-19がなかったら死亡していたであろう人の数である。死亡した各人が二重に評価される(両方のグループのメンバーとなる)ことはあっても、二重にカウントされることはないというオーバーラップを考慮している。
予想死亡数の比較的正確な推定値を得るためには、分布関数が実質的に水平になっている時間の領域を選択したい。図A1からは、36日の範囲が妥当だと思われる。しかし、ここには時間の問題がある。VAERSから報告されるデータのタイムラグを考えると、この範囲のデータのほとんどは、1月、2月、3月上旬から中旬にかけての接種によるものと思われ、これは全接種数の約35%にあたる。したがって、36日間の平均死亡者数に〜3を乗じて、1日あたりの予想死亡者数を〜40人とすることができる。VAERSで報告された予想死亡数を推定するさらに簡単な方法は、示された15日から30日の平均値を使用することであり、これは範囲の大部分を占めることになる。この値は〜37で、上記の近似式で得られた〜40に近い値である。この分析は、3〜4ヶ月後、より多くの長距離データが埋まった時点で再実行する必要がある。
図A1 COVID-19の接種による死亡者数
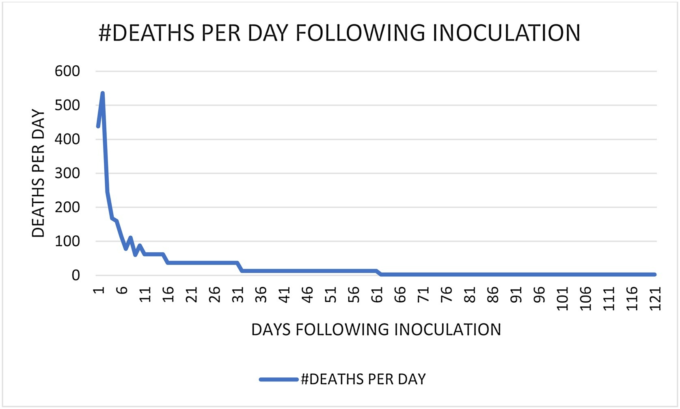
(VAERSに報告され、CDCの検索エンジンCDC Wonderから入手)を、接種からの日数の関数としてプロットしたものである(ゼロは接種当日を反映)。CDCやその他の公的な政府機関が主張しているように、接種による影響がないとすれば、曲線は基本的にまっすぐな水平線となり、COVID-19を使用していない年の通常の予想死亡数を反映することになる。10日目以降のデータはCDC Wonderから帯状に提供されているため、曲線は10日目以降は階段状になっている。曲線の膝は、1)接種による死亡数から2)予想される死亡数への移行の始まりを示すもので、10日目から30日目の間のどこかに現れる。
分析結果を表A2に示す。前述のように、完全に別のグループと完全に重複するグループという2つの別々のケースを分析した。1日あたりの予想死亡数の値は、前述の37と、VAERSのデータがより完全に埋まったときに予想死亡数の報告が少なくなる可能性を考慮した20の2種類を使用した。
したがって、COVID-19の接種後にVAERSで報告された死亡数に基づき、接種に関連した死亡が予想死亡数と同じ比率で報告されていると仮定すると、COVID-19の接種に強く関連した実際の死亡数は100~200倍にスケールアップする必要がある。CDC Wonderが提供するVAERSの対象範囲の最も広い定義(米国およびすべての領土、保護領、領有権を含む)では、COVID-19の接種後の総死亡数は 2021年6月初旬に〜5200人であった。当グループのスケーリングファクターを使用すると、これは50万人から100万人の死亡に相当するが、これにはVAERSへのデータ入力に伴うラグタイムは考慮されていない。CDCが発表した65歳以上のCOVID-19による死亡者数が約28,000人であり、関連する疾病がないことと比較すると、予防接種による死亡者数はCOVID-19による死亡者数よりも桁違いに多いのである。これらはあくまでも非常に短期的な予防接種に基づく死亡例であり、中長期的な悪影響が現実のものとなれば、劇的に増加する可能性があることを忘れてはならない。
この付録の最後に、さらに不安な可能性を書いておく。表A2の結果は、図A1に示した接種後の時間分布関数が2つの領域に分けられるということを主な前提としている。接種日を起点とした強い変動領域は、接種による死亡を反映しており、それに続く基本的に平坦な領域は、予想される死亡を反映している(この平坦な領域も接種日を起点としており、変動の大きい領域を配置するベースとなっている)。このモデルでは、接種による死亡が高変動領域の限界をはるかに超えているという可能性は除外されている。
表A2. COVID-19接種に基づく実際の死亡者数
| vaersの報告による実際のCOVID-19接種ベースの死亡 | ||||
|---|---|---|---|---|
| 別々のグループ | 重複するグループ | |||
| 報告された予想死亡数 | 37 | 20 | 37 | 20 |
| 接種による死亡日数の範囲 | 0〜30 | 0〜30 | 0〜30 | 0〜30 |
| 範囲を超えて報告された総死亡者数 | 2901 | 2901 | 2901 | 2901 |
| 範囲を超える予想死亡総数 | 1147 | 620 | 1147 | 620 |
| 接種による死亡が報告された | 1754年 | 2281 | 2901 | 2901 |
| 報告された予想死亡数/予想総死亡数 | .0077 | .0041 | .0077 | .0041 |
| 予想比率を使用した実際の接種ベースの死亡総数(上記) | 227792 | 556341 | 376753 | 707561 |
一般的に、これは真実ではないことがわかっている。秋のウイルスシーズンのADEのようなラグ効果や、自己免疫疾患のような長期的な効果があるかもしれない。我々は、予想死亡数と同じ平坦な死亡プロファイルになるような、接種による他の効果があると仮定している。
次のように考える。VAERSで接種後に見られた被害の中には、凝固・血栓作用やあらゆる種類の神経学的作用が含まれている[63]。これらの影響が最初は致死的でなくても、機能障害のレベルが上がる。したがって、血小板凝集は新たな基礎レベルにまで上昇し、微小血栓は他の生活習慣因子から深刻な血栓が形成される確率を高めている[105]。特定の神経細胞の死は、アルツハイマー病やパーキンソン病のリスクを高め、これらの病気や他の多くの病気の発症を早める可能性がある。したがって、COVID-19の接種による悪影響は、将来予想される死亡のレベルを引き上げていると見ることができる。VAERSで報告されたこのような性質の死亡例は、接種に起因するものと見なす必要があり、それに応じて計算に使用される予想死亡数は減少することになる。
以下の表A3を見てほしい。報告された予想死亡者数」を表A2の対応する値よりも減らし、このベースライン効果が作用する場合、VAERSで報告される接種ベースの総死亡者数がどのように変化するかをパラメトリックに示している。表A2では予想死亡者数に37人と20人の値を用いたが、表A3では10人と15人の値を用いている。
表A3. COVID-19の接種による死亡の可能性。
| vaersの報告によるCOVID-19接種に基づく死亡の可能性 | ||||
|---|---|---|---|---|
| 別々のグループ | 重複するグループ | |||
| 報告された予想死亡数 | 10 | 15 | 10 | 15 |
| 接種による死亡日数の範囲 | 0〜30 | 0〜30 | 0〜30 | 0〜30 |
| 範囲を超えて報告された総死亡者数 | 2901 | 2901 | 2901 | 2901 |
| 範囲を超える予想死亡総数 | 310 | 465 | 310 | 465 |
| 接種による死亡が報告された | 2591 | 2436 | 2901 | 2901 |
| 報告された予想死亡数/予想総死亡数 | .0021 | .0031 | .0021 | .0031 |
| 予想比率を使用した実際の接種ベースの死亡総数(上記) | 1233810 | 785806 | 1381429 | 935806 |
このように、血液凝固、炎症、低酸素症、神経変性などの宿主のベースラインが接種によって上昇し、予想死亡数や加速死亡数が増加したとすれば、VAERSの死亡数にCOVID-19の接種による100万人以上の死亡数が反映されているのは十分に納得できることである。これらは非常に短期的な効果に過ぎず、ADEによる死亡や自己免疫による死亡の大きな可能性の波が来るかどうかは、時間が解決してくれるであろう。
付録B
COVID-19接種剤の主な臨床試験の詳細分析
A2-a 主に成人を対象とした臨床試験
定義
有効性(Efficacy )とは、ワクチン接種群とプラセボ群を比較して、理想的に管理された状況下で、ワクチンが疾病を予防し、場合によっては感染も予防する度合いを意味する [106]。
有効性(Effectiveness)とは、現実の世界でワクチンがどれだけうまく機能するかを意味する [107]。
相対的リスク(RR)は、ワクチン群で疾病に罹患した患者の割合を、プラセボ群で疾病に罹患した患者の割合で割ることで算出される。
相対的リスク低減(RRR)は、RRを1から差し引くことで計算される。
絶対的リスク低減(ARR)は、ワクチン群で罹患した割合を、プラセボ群で罹患した割合から引くことで算出される。
絶対的リスク=確率=罹患率である。
累積罹患率は、一定期間に新たに発生した症例の数/リスクのある人口を表する。
発生率密度は、特定の集団における一定期間中の特定疾患の新規症例数であり、また、定義された集団において新たな事象が発生する割合でもある。
免疫原性とは、分子や物質が免疫反応を引き起こす能力、または免疫反応の強さや大きさのことである。免疫原性は、文脈に応じて正の効果(望まれる効果)と負の効果(望まれない効果)がある。
免疫反応とは、抗原(Ag)に対する統合的な全身反応であり、特にリンパ球を介するもので、特異的な抗体(抗体)または以前に感作されたリンパ球によるAgの認識を伴うものである[108]。
ファイザー社とモデルナ社の試験の安全性データ。
COVID-19の接種剤の臨床試験は主に2つあった。Pfizer/BioNTech社とModerna社である。
ファイザー社の臨床試験のタイトルは正式には「健康な個人におけるCOVID-19に対するsars-cov-2 rnaワクチン候補の安全性、忍容性、免疫原性、および有効性を評価するための第1/2/3相、プラセボ対照、無作為化、観察者盲検、用量設定試験」であった[98]。実際の試験開始日」は2020年4月29日、「推定一次終了日」は2020年11月2日、「推定試験終了日」は2023年5月2日。このように、これまでの大量接種展開は、ファイザー社の第3相臨床試験と並行して行われてきた。現実的には、ファイザー社の接種対象者への世界規模の大量接種は、臨床試験の第3相2.0期と考えることができる! 正式な第3相臨床試験の対象基準は、タイトルやプロトコル文書に記載されているように、健康な人を含んでったが、大量接種の基準は健康な人をはるかに超えてた。要するに、43,000人以上の健康な人を対象とした公式の第3相臨床試験と、幅広い健康レベルをカバーする何十億人もの人を対象とした非公式の第3相臨床試験があるのである[98]。
ファイザーの第3相臨床試験は2020年7月に開始され 2020年11月にEUA承認のために有効性データがFDAに提出され 2020年12月にFDAの承認が得られた。ファイザーの試験では6名の死亡者が出ており、接種したグループで2名、プラセボ(生理食塩水を投与した)グループで4名であった[33]。接種された2名は、ともに55歳以上で、心血管の原因で死亡した。1人は接種後3日目に死亡し、もう1人は接種後62日目に死亡した[109]。この2人の死亡は、プラセボ群の死亡と同等(頻度、原因とも)であり、おそらくさらに重要なことは、その年齢の一般人口と同様であった。Modernaの場合、接種後21~57日目に、接種群で6名、プラセボ群(通常の生理食塩水プラセボ、水に塩化ナトリウムを0.90 % w/v混ぜたもの)で7名の計13名が死亡した([103]b)。
2021年1月15日に発表されたノルウェー国立医薬品協会の報告書では、老人ホームに入所している23人の高齢者(いずれも75歳以上で虚弱体質)が、mRNA接種時から様々な間隔で死亡したとされている。 そして、報告書では、評価の結果、23人の死亡者のうち13人は、接種による副作用が直接の原因であったと考えられる。残りの10人の死亡者は、接種後に発生したものであり、副作用に直接関係していないため、必ずしも接種剤自体に関係していない可能性がある[109]。
体の弱い高齢者が、若年成人であれば軽微と考えられる接種後の炎症に関連した副作用によって致命的に不安定になることがあるのは当然のことである。また、合併症を持つ虚弱な高齢者が、若年成人や子供であれば軽微と考えられるCOVID-19感染によって致命的に不安定になることも当然のことである。体の弱い高齢者が、単なる咳で致命的な不安定状態に陥ることもあるのである。これは、これらの死亡例が非常に深刻に受け止める必要のない出来事であることを意味するのではなく、もし確認されれば、今後、このカテゴリーの患者への接種方針の指針となるはずである。具体的には、各症例を慎重に評価し、リスク・ベネフィット比に基づいて接種を決定すべきである[110]。
これらのデータを考慮すると、接種剤の臨床試験において、なぜ接種剤に起因する死亡例がなかったのかという疑問が生じるかもしれない。その答えは、ファイザーもモデルナも体の弱い患者を対象にしておらず、75歳以上の患者は、ファイザーでは試験全体の4.4%、モデルナでは4.1%と、ごく少数の超高齢者しか対象にしていなかったからである。接種と死亡との間の因果関係を断定することはできなかったが、接種によって患者の状態の悪化が促進された可能性も否定できなかった[33]。
有効性データ
先に定義したように、ワクチンの有効性は、特定の疾患を予防する能力にある。正しく設計され、試験され、投与された公認ワクチンは、病気を予防し、人々を守るために有効である。医薬品のように、ワクチンは接種したすべての人に100%効果があるわけではない。ワクチンの効果は、いくつかの要素に左右される。その要因とは、年齢、他の病気の可能性、ワクチン接種後の経過時間、過去の病気との接触などである。
COVID-19感染症に対するワクチンが安全かつ有効であると宣言されるためには、医薬品市場で承認された他のワクチンや医薬品と同様に、一連の試験に合格し、規制基準を満たさなければならない[111]。
ファイザー社とモデルナ社の試験について。
最初の重要な注意点は、免疫反応には時間が必要なので、最大の効率はすぐには得られないということである。
ファイザー社の場合、COVID-19を発症する確率が、接種群とプラセボ群でほぼ同じになるのは、最初の接種から12日後までは増加し、その後、接種した群では徐々に減少する。1回目の接種と2回目の接種の間の接種効率は52%であるが[106]、1回の接種でどの程度の長期的な保護が得られるかは不明である。2回目の投与後、有効性は91%に上昇し、2回目の投与後7日を超えて初めて95%に達する。しかし、後者の場合のARRはわずか0.7%である[112]。言い換えれば、1回目の投与から12日以内であれば、あたかも接種していないかのようにCOVID-19を得ることができる。もう一つの重要な点は、ファイザー社の接種剤が重症化を防ぐかどうか、まだわからないということである。2回目の投与から7日後、COVID-19の重症患者は4人で、接種群で1人、プラセボ群で3人であったが、これは統計的な評価をするにはあまりにも少なすぐ。接種剤の地域感染防止効果については、まだデータがない。現実的には、無症候性症例を予防するための接種剤の効果は検証されていない。
Modernaの場合、効果は初回投与後の14日間では50%しかなく、2回目の投与の端で最大92.1%に達する(ARRは1.1%で、ファイザーの場合の21日ではなく28日です)[46]。また、Modernaは、1回の投与での長期的な有効性を検証していない。そして、2回目の投与から14日後には、有効性が94.1 %に上昇しており、補正は平均的なものとなっている。このように、65歳以上では86.4 %であるのに対し、18~65歳では95.6 %となっている([103])。これは、すべての年齢層で同等の効率を宣言しているファイザーとは、わずかな違い。重要な観察事項は、Moderna社が、彼らの接種剤は重症例を予防するが、両方の投与後14日以上経過してからであると述べていることである[126]。30件の重症例はすべてプラセボ群であり、100%の有効性を示唆している。1回の投与では、接種した人の中で重症患者は2人、プラセボ群では4人であった[33]。最後になったが、ファイザー社とは異なり、モデルナ社は2回目の投与前にRT-PCRによる無症候性感染の有無を検査した。症例数が少ないため、確定的な結論を出すことは困難である。これらのデータは、接種剤は無症候性感染を減少させるが、防ぐことはできないことを示唆している[126]。
A2-b 小児を対象とした現在進行中の臨床試験
最近行われた小児を対象とした第3相試験では、SARS-CoV-2感染の臨床症状がなかった12~15歳の子ども2,260人を対象に、Comirnaty(Pfizer社)が試験を行った。彼らは、プラセボ群(978人)とComirnaty投与群(1005人)の2つのグループに分けられた。Comirnaty投与群では、血清を投与された1005人の子供のうち、COVID-19感染症を発症した子供はいなかったのに対し、プラセボ投与群では978人中16人の子供が臨床症状を示した。ファイザー社の研究では、子供たちの免疫反応は、16-25歳の年齢層における免疫反応(SARS-CoV-2に対する抗体のレベルで測定)と同等であることが示された。この研究では、コミルナティはSARS-CoV-2感染の予防に100%の効果があったと結論付けられるが、実際の率は75%から100%の間である可能性がある。[63]. この結果は、FDAとEMAによって評価される予定である。
12~15歳の子どもを対象としたComirnaty試験の(大量接種の結果に対する)予測値には疑問がある。コミルナティを接種した子どもは1005人。統計学の3の法則を用いると、1/xの予測結果を高い信頼性(例えば、1000分の1)で得るためには、試験サンプルに3倍の参加者が必要となる。Comirnaty社の1005人のテストサンプルでは、約1/340の有害事象を高い信頼性で検出することができる。
これは現実の世界ではどのような意味を持つのであろうか。米国では、思春期の各年齢に約400万人の子供がいます。したがって、12-15歳の年齢帯には約16,000,000人の子どもがいます。死亡を含む重篤な有害事象が1/800の割合で発生したとしても、1005人のサンプルでは高い信頼性で検出できないであろう。したがって、1005人の子どもを対象とした臨床試験の結果は、12~15歳のすべての子どもへの潜在的な接種に外挿すると、20,000人の子どもが死亡を含む臨床試験で検出されない重篤な有害事象に見舞われる可能性があるということになる この集団においてCOVID-19に感染して重篤な結果をもたらすリスクはごくわずかであることを考えると、実施された試験に基づいて12~15歳の子どもたちへの大量接種を進めることは、費用対効果の観点からも正当化できない。
また、6ヶ月から11歳までの小児に対する有効性の評価が最近始まり、継続されている[24]。ファイザー社は、COVID-19 mRNA接種剤を評価するために、12歳以下の子供の登録を開始した。また、コミルナティは、6カ月から11歳の子どもを対象とした新しい臨床試験で評価される。第1期では、144名を登録し、3つの年齢層(6ヵ月~2歳、2~5歳、5~11歳)に対する必要な投与量を明らかにする。6ヶ月間のフォローアップ期間の後、プラセボ群の子どもの保護者は、子どもに接種を受けさせるかどうかを選択する。結果は2021年の後半に出る予定である。
また、Moderna社は、生後6カ月から12歳までの子どもを対象に、mRNAの接種を評価する試験を開始した。両社とも、すでに14歳の子どもを対象としたワクチンの試験を開始している。米国では、子どもは人口の23%を占めている[113]。
子供や青年に可能な接種のリスクと利益に関するデータは現在のところ不十分であり、推奨はできない。具体的には、十分に大規模な試験で利益と予測される最小限のリスクが実証され、実証された利益と比較して大量接種による副作用が許容範囲内であるという確信が得られるまでは、子供の大量接種を推奨することはできない。一方で、子供たちはCOVID-19を無症状で経験することが多く、SARS-CoV-2の感染は無害に進行する。現在、接種能力が限られている中で、子どもへの緊急接種の必要性は指摘されていない。SARS-CoV-2感染症の発生率が低下し、COVID-19感染症による子供や青年への深刻な悪影響が少ないことが実証されている状況では、子供や青年への接種の問題はもはや最重要ではない。承認されたフォーラムでは、子供や青年にとって何が優先されるのか、つまり利益とリスクのどちらが優先されるのかを計算しなければならない。
A2-c その他のカテゴリーにおける臨床試験の問題点
EUAを取得するための臨床試験には、肥満や腫瘍などの重度の合併症を持つ人は当初含まれなかったが、その後の試験には含まれており、中には進行中のものもある。彼らの場合、健康な成人を対象とした当初の結果と比較して、有効性が低かったようである。
今回の前向き観察研究のデータの中間解析では、COVID-19に対してコミルナティを投与する場合、がん患者を優先して適時(それぞれ21日間)のブースター投与を行う必要があることが示された。本研究によると、がん患者におけるComirnatyの単回投与の有効性は低いが、固形がん患者の場合、1回目の接種から 21日後に2回目の接種を行うと、2週間後に免疫原性が上昇することがわかった。本試験は英国で実施されたため 2020年12月29日以前に接種した参加者は、21日間隔で2回のComirnatyの投与を受け、この日以降にレジメンを開始した参加者は、初回投与から12週間間隔で2回目のComirnatyの投与を受ける予定であった。したがって、本試験では、初回投与から12週間後にComirnatyを投与された被験者のデータを引き続き収集している。
コミルナティの単回投与から約21日後、抗S IgG抗体が陽性となった試験参加者の割合[114]。
健常者では94%。
固形がん患者では38%。
固形がん患者では38%、血液がん患者では18%であった。
21日間のブースター投与を受け、2回目の投与から2週間後に生体試料が入手できた参加者のうち、抗S IgG抗体の血清陽性が確認された割合は以下の通りであった[114]。
健康な参加者の100%(2回目の投与を受けなかった同じグループの参加者の86%と比較して)。
固形がん患者の95%が、2回目の投与を受けなかった同グループの30%と比較して、2回目の投与を受けた。
血液がん患者の60%は、2回目の投与を受けなかった同じグループの被験者の11%と比較して。
他の2つの研究では、血液がん患者へのComirnaty投与における免疫原性の低さが示唆されている。1つの研究では、慢性リンパ性白血病(CLL)の患者は、同年齢の健康な参加者と比較して、COVID-19の接種に対する免疫反応率が有意に低下した。CLL患者では、治療段階に応じて投与後の免疫反応にかなりの差があることが報告されている
また、高齢の多発性骨髄腫患者において、コミルナティ投与の有効性が評価された[115]。コミルナティ接種の1回目の投与から 21日後(2回目の投与を受ける前)に、SARS-CoV-2に対する中和抗体を保有していたのは、対照群の32.5%に対し、多発性骨髄腫患者の20.5%であった。これは、治療が抗体の産生に悪影響を与えているという説明が考えられる。しかし、2回目の投与は、これらの患者の免疫反応の発現に重要である[115]。
v-safeモニタリングシステム、v-safe妊娠登録、およびVAERS(Vaccine Adverse Event Reporting System)による予備データでは、妊娠第3期におけるCOVID-19に対するmRNA注射による妊娠やそれに伴う新生児への影響に関する明らかな安全信号は示されていない[3]。この研究では、35,691人の妊婦が対象となった[116]。非妊娠女性と比較して、妊娠女性は、mRNA COVID-19の接種に関連する有害事象として、注射部位の痛みをより頻繁に報告し、頭痛、筋肉痛、悪寒、発熱の報告頻度は低かった。メッセンジャーRNAを用いた接種剤の初期臨床試験では、妊娠中の女性における革新的な技術の有効性と安全性が評価されていないため、今回の第3期の予備データは、妊娠中の女性と医療従事者が接種を決定する際の情報として役立つに過ぎない。しかし、母親への抗COVID-19抗体の接種が、母親、妊娠、新生児期、小児期にどのような影響を及ぼすかを調べるためには、大規模な縦断的研究による継続的なモニタリングが必要である。
一方で、新しいウイルス変異株が流通しているため、接種の状況はさらに複雑になっている。当局は、(2019年末に検出された初期株とは異なる)新たな変異株に対して有効であるために、ゲノムサーベイランスと適応を推奨している。循環するウイルス変異株に対するコミルナティの有効性データは、イスラエルで行われたごく最近の研究で、変異株B.1.351(南アフリカで最初に確認された)に対するファイザー社の接種剤が提供する防御力が低いことを示したことで注目されている[112]。
この結果は、まだ専門家に提出されていない。この研究では、接種剤の1回または2回の投与を受けてから少なくとも14日後にCOVID-19と診断された約400人の成人と、同数の接種を受けていない人を比較した。その結果、B.1.351は調査対象となったCOVID-19症例の約1%に相当することが判明した。しかし、2回の接種を受けた患者では、この変異株の有病率は、接種を受けていない人の8倍であり,0.7%に対して5.4%であった。このことから、Comirnatyは、オリジナルの変異株や変異株B.1.1.7に比べて、変異株B.1.351に対する効果が低いことが示唆された。この研究の限界は、調査対象となった成人の数が少ないことに起因しているが、これらのケースをより詳細に調査するための警鐘となる。加えて、現在のところ、この変異株の有病率は低いようである。一方、4月上旬、ファイザー社は、成人を対象とした第3相試験の結果によると、コミルナティは、SARS-CoV-2の変異株B.1.351によるCOVID-19感染症の予防にも100%の有効性を示したと発表した(9例のCOVID-19感染症が記録されたが、すべてプラセボ群であり、シークエンスの結果、6例がB.1.351によって決定されたことがわかった)。[117].
付録C
先行ワクチンによる中・長期の副作用
過去のワクチンによる中長期的な副作用を重視した2020年の研究[4]では、ワクチンに関する中長期的な潜在的問題として以下の16項目が挙げられている。これらは以下の通りである。
3.1. 抗体依存性増強(多くの種類の細胞におけるウイルスの侵入や複製が、抗体によって強化されること)。
- 1a. 固有の抗体依存的増強(あるウイルスの自然感染によって生じた非中和抗体が、別のウイル スへの感染を増強する場合)。
- 1b. 免疫強化(免疫相互作用による二次感染の強化)。
- 1c. 交差反応性(ある特定の抗原に対して作られた抗体が、別の抗原に対して競合的に高い親和性を持つこと。)
- 1d. 交差感染促進(あるウイルスの抗体が別のウイルスの抗体によって感染を促進すること)。
3.2. ワクチン関連ウイルス干渉(ワクチンを接種した人は、自然感染に伴う非特異的な免疫を受けていないため、他の呼吸器系ウイルスのリスクが高まる可能性がある)。
3.ワクチン関連インポーチンティング減少(幼少期に感染を経験した子供に与えられる保護である「インポーチンティング」の効果が、ワクチン接種によって減少する可能性がある場合)。
4.免疫系に対する非特異的ワクチン効果(過去の感染により、個人の無関係な病気に対する感受性が変化する可能性がある)。
5.感染経路が免疫系に与える影響(免疫防御機能は曝露/伝達経路によって影響を受ける可能性がある)。
6.有害な刺激の組み合わせの影響(人々は生涯にわたって無数の有害な刺激にさらされるため、あらゆるワクチンの影響に影響を与える可能性がある)。
7.抗原性距離仮説(v1とv2の間の抗原性距離が小さく(v1≒v2)、v1と現在のパンデミック株(e)の間の抗原性距離が大きい(v1≠e)場合に、前シーズンのインフルエンザワクチン(v1)が今シーズンのワクチン(v2)の防御に悪影響を及ぼす可能性がある)。
8. Bystander Activation(抗原Yに対する免疫反応中に抗原Xに特異的なT細胞が活性化すること)。
9. Gut Microbiota(腸内細菌の組成がワクチン反応に与える影響)。
10. Homologous Challenge Infection Enhancement(試験アッセイで使用されるチャレンジウイルスの株は、被験者が受けたワクチンの製造に使用されたシードウイルスの株と非常に密接に関連している)。
11. Immune Evasion(ウイルス感染に対する宿主の反応を回避する)。
12.免疫干渉(ワクチンウイルスに対する循環抗体による干渉)。
12a.Original Antigenic Sin(異物(例:ウイルスや細菌)のわずかに異なる2つ目のバージョンに遭遇した際に、身体の免疫系が以前の感染に基づく免疫記憶を優先的に利用する傾向)。
13. Prior Influenza Infection/Vaccination(将来の病気の症状の重さに対する過去のインフルエンザ感染/ワクチン接種の影響)。
14. Timing between Viral Exposures(ウイルスにさらされるまでの経過時間)。
15. Vaccine-Associated Enhanced Respiratory Disease(ワクチン接種が呼吸器疾患を助長する場合);および
16. Chronic Immune Activation(継続的な自然免疫反応)。
これらの事象のほとんどは予測不可能であり、すべてではないにしても、COVID-19接種剤では、成人と小児の中長期的には可能性があるであろう。
3.3. 過去のワクチンによる大人と子供の中長期的な重篤な病気について
前述のワクチンの安全性に関する2020年の研究で述べられているように。「生物医学の文献では、長期的なワクチンの効果、特に長期的な副作用に関する研究は非常に少ない。このような有害事象を特定し、ワクチン接種と疾患との間に統計的に妥当な関連性を導き出すためには、大量の人々と長い期間が必要である。このような取り組みは非常に多くの資源を必要とするが、ワクチン生産者や規制当局には、このような研究のためにこれらの資源を利用できるようにする動機がほとんどないように思われる。したがって、以下の例は、長期的なワクチンの悪影響の極めて大きな氷山の極めて小さな一角を示している。[4]
「過去のワクチン接種が引き金となって生物医学文献に報告されている病気の2つの主なカテゴリーは、「自己免疫疾患(例:全身性エリテマトーデス、乾癬、関節炎、多発性硬化症、肝炎、ブドウ膜炎、偽リンパ腫、ギラン・バレー症候群、血小板減少性紫斑病など)」と「神経疾患(例:。中枢性脱髄疾患、発達障害、熱性痙攣、ナルコレプシー、脳脊髄炎、自律神経失調症など)がある。) その他には、糖尿病、消化器、関節関連、壊死性肉芽腫、好中球減少症、肺線維症などがある。」
「ワクチン接種も自己免疫のモザイクに寄与している可能性がある[118]。まれに報告されるワクチン接種後の自己免疫疾患には、全身性エリテマトーデス、関節リウマチ、炎症性ミオパチー、多発性硬化症、ギラン・バレー症候群、血管炎などがある」。
「研究では、HiBワクチン接種と糖尿病の間には数年の潜伏期間があり、HBVワクチン接種と脱髄イベントの間には数年の潜伏期間があることが実証されている[118] 感染後およびワクチン接種後の自己免疫については、潜伏期間が数日から数年に及ぶことがある」。
「IDDMの余分な症例のほとんどは、予防接種後約38カ月から約6~8カ月の期間に発生した統計的に有意なクラスターで現れた。小児用ワクチンの免疫は、NODマウスのインスリン糖尿病のリスクを増加させた。HiBの免疫への曝露は、IDDMのリスク増加と関連している」。[4]
このように、過去のまばらなワクチン研究でも、短期的なものに留まらず、接種後3年以上経過してから発生する重篤な疾患の潜伏効果が認められた。
付録D
COVID-19接種の費用便益分析
この付録では、米国の65歳以上の層を対象としたCOVID-19予防接種について、従来とは異なるベストケースシナリオによる擬似的な費用便益分析を行っている。このコスト・ベネフィット分析では、コストは予防接種による死亡者数であり、ベネフィットは予防接種によって救われた命である。期間は2019年12月から 2021年5月末までとした。
この最良のシナリオでは、COVID-19のみに真に起因するすべての死亡者は、与えられた接種によって排除できたと仮定している(現時点で米国の人口の約半分が接種されている)[88,119]。2019年夏にワクチンが入手でき、その後の投与でCOVID-19に真に起因する経験死がすべて解消されたと概念的に考えることができる。このベストケースのシナリオで費用対効果が悪ければ、リアルワールドのどのシナリオでも非常に悪くなる[120]。
ここでは、図1と図2を出発点として、最も脆弱な人口層である65歳以上の人々に対するCOVID-19の接種の費用便益分析を行う。まず、COVID-19と接種後の死亡者数に関する政府の公式発表を基にして、COVID-19と接種による実際の死亡者数を算出するために修正する。この2つの数字を(適切に正規化して)比較し、コストと利益を確認する。
図1が示すように、65歳以上の人口層には3つの年齢層がある。各年齢層におけるCOVID-19による一人当たりの死亡数をその年齢層の人口で加重平均し、これら3つの積の合計を65歳以上の総人口で割ると、65歳以上の総人口におけるCOVID-19による一人当たりの平均死亡数は0.0087人となる。
図2では、2つの正規化を行っている。まず、死亡者数は、接種した人や一連の予防接種を完了した人ではなく、接種した合計数で正規化した。推定のためには、最も保守的な結果(最大の分母)が得られるので、総接種数による正規化を維持する。第二に、死亡者を接種後7日以内に発生したものに正規化/制限した。この正規化は、接種開始時期が大きく異なる年齢層間で比較するために行った。65歳以上の年齢層に焦点を当てた今回の費用便益の目的では、この正規化を取り除き、接種後のすべての死亡を含めることにした。この正規化を削除すると、1回の接種あたりの死亡者数は約40%増加して0.000032となり、図1の数値と比較してより信頼性の高いものとなる。
このように、CDCの公式数値に基づくと、65歳以上の人口層におけるCOVID-19による一人当たりの平均死亡数は0.0087人、接種1回当たりの平均死亡数は0.000032人となる。このCDCの公式数値によると、65歳以上の人がCOVID-19で死亡する確率に対して、予防接種で死亡する確率は約0.0037,つまり約1/270となる。
しかし、先に示したように、この数字を実際の効果に換算するには、3つの補正が必要である。まず、ハーバード・ピルグリム大学の研究で明らかになったように、また付録1の我々の結果でも確認できるように、VAERSは実際の死亡数を約2桁過少に報告している。第二に、CDCが述べているように、COVID-19による死亡の約94%は、これらの患者が抱えていた併存疾患のいずれかに起因する可能性があり、実際にCOVID-19に起因する死亡はわずか6%であった。我々が指摘したように、もし前臨床の併存疾患が含まれていれば、この6%という数字はおそらくさらに減少するであろう。保守的な目的のために、我々は6%のままとする。この補正を1/3のリスク・ベネフィット比に適用すると、5/1になる。第三に、RT-PCR検査の偽陽性に関する包括的な調査では、次のように結論づけている。「外部の品質評価や実世界のデータから得られた証拠は、偽陽性率が十分に高く、広範囲のシナリオにおいて陽性結果の信頼性が非常に低いことを示している」[127]。米国では、COVID-19のスクリーニング/診断のために、異なるCt値や異なる手順で無数のRT-PCR試験が行われているため、現時点では偽陽性の具体的な数値を得ることはできない。繰り返しになるが、これらの偽陽性により、6%という数字は、おそらく大幅に減少するであろう。繰り返しになるが、保守的な目的のために、我々は6%という数字を維持する。
このように、極めて保守的に見積もったリスク・ベネフィット比は約5/1となる。分かりやすく言えば、65歳以上の人口層は、最も有利な仮定の下では、COVID-19による死亡率よりも予防接種による死亡率が5倍になるということである。この層は、COVID-19による悪影響を最も受けやすい層である。年齢層が約35歳以下になると、COVID-19による死亡の可能性は非常に小さくなり、18歳以下になると無視できなくなる。
なお、VAERSに掲載されている予防接種による死亡例は、短期的なもの(初回接種者は6ヶ月程度)であり、小児の場合は極めて短期的なもの(1ヶ月程度)であることを忘れてはならない[3]。中長期的な死亡例はまだ特定されておらず、時間をかけて発症するADE、自己免疫効果、更なる血栓症や血管疾患などが考えられる。このように、最良のシナリオでの長期的な費用対効果は、すべての人口統計で10/1,20/1,またはそれ以上のオーダーとなり、年齢が下がるにつれて増加し、現実のシナリオでは桁違いに高くなる可能性がある。以上のことから、COVID-19接種の価値は、最も脆弱な年齢層では費用対効果の観点から明らかではなく、最も脆弱でない年齢層ではいかなる観点からも明らかではない。
付録 Da
COVID-19 を判定するテスト基準の問題点
RT-PCR検査結果がSARS-CoV-2陽性であるかどうかの判定基準について考える。CDCの指示(2021年5月1日まで)では、RT-PCR検査を45回の増幅サイクルで実行することが規定されている。その後、データを解釈するために:すべてのコントロールが期待通りの性能を示したとき、すべてのSARS-CoV-2マーカー(N1,N2)のサイクル閾値成長曲線が40.00サイクル以内に閾値ラインを越えた場合(<40.00Ct)検体はSARS-CoV-2陽性とみなされる。上記のようにRNase Pが陽性になる場合とならない場合があるが、SARS-CoV-2の結果は有効である([103]a)。
このサイクル閾値範囲の上限では、特にパンデミックの少ない地域では多くの偽陽性が考えられる。特に、Ct値が33を超えるような症例では、ウイルス培養は不可能であることがわかっている。シンガポールで最初の100人のCOVID-19患者を対象とした前向きコホート研究でも、PCR陽性でCt値が30を超えるすべてのサンプルで、ウイルスの培養を試みても失敗した[121]。ドイツで行われた集団検査では、「PCR検査で陽性となった人の半数以上は、感染していた可能性が低い」ことが判明した [122]。別の研究では、特異性の低い検査(多くのサイクルを使用することに起因する)では、感染症の存在を示す強力な証拠を得ることができないとしている[123]。PCR検査のシステマティックレビューでは、「感染に必要なのは完全な生ウイルスであり、PCRで特定される断片ではない。基準検体と培養検体の前向きなルーチン検査と、症状、徴候、患者のコファクターとの関係を用いて、感染性の可能性を評価するためのPCRの信頼性を定義すべきである。サイクル閾値が高いものは、感染力があるとは考えにくい。” [89].
懐疑論者が主張しているように、パンデミックの立ち上がりにおいて、COVID-19の症例数が急激に増加したのは、検査で使用されたサイクル閾値の値が高かったことが一因であった。残念ながら、これらの値は検査結果とともに報告されていないため、監査を行っても偽陽性の真の数を知ることはできないだろう。現在入手可能なSARS-CoV-2の核酸検査はすべて定性検査としてFDAに認可されており、定性検査のCt値は、患者の管理上の意思決定を指示したり、情報を提供したりするために使用してはならない。したがって、検査室が患者の報告書にCt値を記載することは好ましくない[124]。
集団接種が開始された後、大量の「ブレイクスルー」症例が出現し 2021年4月30日時点で米国46州・準州から合計10,262件のSARS-CoV-2ワクチンによるブレイクスルー感染が報告されている[18]。COVID-19ワクチンによるブレイクスルー感染の報告数は、完全にワクチンを接種した人のSARS-CoV-2感染全体を大幅に下回っている可能性が高い。国のサーベイランスシステムは受動的かつ自発的な報告に依存しており、データは完全ではなく、代表的なものでもない可能性がある。ワクチンによるブレイクスルー感染者の多くは、特に無症状の人や軽症の人は、検査を求めないかもしれない [18]。
このような「ブレイクスルー」症例の増加という負の結果は、CDCが多くの報告や検査の手順を変更し 2021年5月1日から入院または死亡したワクチンブレイクスルー症例を特定し調査するための新しい規則を発行する動機となり、次のように述べている。「RT-PCRサイクル閾値(Ct)値が判明している症例については、Ct値≦28の検体のみをCDCに提出してシーケンスを行う。(それ以上のCt値ではシークエンスは不可能です)」と記載されている。このように、配列決定のためのCt値は、パンデミックの拡大期に認められていた高い偽陽性の範囲から、「ブレイクスルー症例」の同定段階でこれらの偽陽性の多くを排除できる限界まで下げられた[101]。