Contents
オンラインで公開2019年6月26日
要旨
キャッスルマン病(CD)は、特徴的なリンパ節の病理組織学によって定義される不均一な疾患のスペクトルを説明する。キャッスルマン病の病理組織学的特徴を示すリンパ節の拡大は、時に軽度の症状を伴う単発性のもの(単心性CD、UCD)や、全身の炎症やサイトカインによる多臓器不全を伴う多発性CD(多心性CD、MCD)などがある。カポジ肉腫ヘルペスウイルス/ヒトヘルペスウイルス(HHV)-8が一部の患者でMCDを引き起こすことが明らかになったことから、従来の方法でHHV-8が陰性であったUCDやMCD患者は偽陰性である可能性があるか、あるいはこれらの症例は既知または未知の別のウイルスによって引き起こされているのではないかという仮説が立てられていた。これらの仮説を調査するために、脊椎動物ウイルスのためのウイルス捕捉シーケンシング(VirCapSeq-VERT)プラットフォームを用いて、CD患者(12人のUCD、11人のHHV-8陰性MCD(特発性MCD;iMCD)2人のHHV-8陽性MCD)および関連疾患(3人のT細胞リンパ腫および3人のホジキンリンパ腫)の新鮮な凍結リンパ節組織中の既知および新規のウイルスのRNA転写物を検出した。このアッセイでは、両方のHHV-8陽性症例からHHV-8が検出されたが、臨床的にHHV-8陰性のiMCDやUCDではHHV-8は検出されなかった。また、新規ウイルスは発見されず、HHV-8陰性のCD症例との関連性が明らかな既知のウイルスも検出されなかった。特にエプスタインバーウイルス(EBV)を含むヘルペスウイルス科のウイルスは、UCD12例中7例、iMCD11例中5例で検出され、iMCDの重症度マーカーと明らかな相関が認められた。別のコホートのホルマリン固定パラフィン包埋リンパ節組織をIn situハイブリダイゼーションで解析したところ、UCDおよびiMCDでは、HHV-8陽性のMCDおよびEBV関連リンパ増殖性障害の組織と比較して、EBV陽性細胞の数が有意に少なかったことが明らかになった。別のコホートでは、疾患フレア時の末梢血中の PCR による EBV の定量検査では、全身性 EBV ウイルス血症は検出されなかったが、リンパ節組織の検出は、UCD および iMCD における潜伏性の局所的な再活性化によるものであることが示唆された。本研究は、UCDやiMCD患者にはHHV-8は存在しないことを確認した。さらに、HHV-8陰性例のCDと、新規か既知かにかかわらず、単一のウイルスとの間に明確な関連性を確立することはできなかった。CDは、ウイルス性と非ウイルス性の病因を持つ異なる形態のCDが存在することを考えると、CDは、さらなる研究の価値がある異質な原因を持つ別個の疾患群と考えるべきである。
はじめに
キャッスルマン病(CD)は、萎縮性または過形成性の生殖中心、突出した濾胞性樹状細胞、過血管化、多クローン性リンパ増殖、および/または多型性形質細胞症を含む、特徴的なリンパ節の病理組織学的特徴を共有する、異質で十分に理解されていないリンパ増殖性疾患のグループを記述する。この疾患は、1950年代に病理学者のBenjamin Castlemanによって最初に記述された [1,2]。この疾患は最初、CD病理学的に孤立性の肥大リンパ節を有する単心性CD(UCD)と、複数の身体部位に肥大リンパ節を有する患者の多心性CD(MCD)に分類された。UCD患者の多くは全身症状を伴わず、腫大リンパ節の切除により治療が成功する。対照的に、MCDでは、体質症状、細胞弁膜症、肝脾腫、体液の蓄積、および多臓器系の機能障害を伴う [3-5]。1990年代半ば、HIV/AIDSのパンデミックにより、免疫不全患者にMCDが観察されるようになった[6]。分子ウイルス学の進歩により、これらの症例はガンマヘルペスウイルスであるカポジ肉腫ヘルペスウイルス/ヒトヘルペスウイルス(HHV)-8との共感染に起因していると考えられている[7,8]。HHV-8陽性のMCD患者は、リツキシマブと免疫抑制の根本的な原因の改善に反応することが多い。最後に、現在の臨床検査や病理組織学的検査ではHHV-8感染が陽性ではないMCD患者も存在し、病因が不明であるため特発性MCD(iMCD)と呼ばれている[11,12]。iMCD患者の中には、血小板減少、アナザルカ、骨髄線維症、腎機能障害、および臓器肥大を特徴とする重篤な臨床症状を呈する患者もおり、現在ではTAFRO症候群と呼ばれている[13,14]。
HHV-8陽性のMCD[11,15]と臨床的および病理学的に類似していることから、iMCDおよびUCDは、現在の臨床診断法では検出されないHHV-8,新規ウイルス、またはCDとこれまで気付かれなかった関連性を持つ既知のウイルスのいずれかのウイルス感染によって引き起こされているという仮説が立てられてきた。この仮説は、寛解期と断続的なフレアを伴うiMCDのエピソード的な臨床経過によって支持されており、これは潜在的なウイルス感染と相関している可能性があり、再活性化によって疾患が再発する可能性がある。HHV-8はヘルペスウイルス科に属し、エプスタインバーウイルス(EBV)サイトメガロウイルス、HHV-6などの他のリンパ球増殖性ウイルスを含む。特に、ガンマヘルペスウイルスサブファミリーでHHV-8と結合するEBVは、いくつかの症例報告でiMCDおよびUCDとの関連が報告されている[16-18]。また、HHV-6とB型肝炎ウイルス(HBV)との関連の症例報告もある[17,19]。これらの小規模な研究では、限られたウイルス病因のレパートリーに焦点を当てているため、UCDやiMCDのウイルス病因は確立されていない。しかし、既知のウイルスの系統的研究も、iMCDやUCDにおける新規ウイルスの探索も報告されていない。さらに、iMCDやUCDとウイルスとの関連性を探ることは、診断や治療計画に大きな意味を持ち、CDの病態生理を理解する上で重要なフロンティアであり続けている。
最近のDNAおよびRNAシークエンシング技術の進歩は、感染症の臨床研究とウイルスの発見を容易にしており[20]、CDにおけるウイルスの関連性の問題を再検討する機会を提供している。ハイスループット法の出現以前は、臨床におけるウイルス検出は、既知の病原体に基づく鑑別診断と、感度の異なる検査の組み合わせを含む反復的なプロセスであった。対照的に、最新のハイスループットメソッドは、より偏りの少ないアプローチを提供する。すなわち、RNA増幅ライブラリを深く配列決定し、既知の病原体と同一性を共有する配列について参照ライブラリにアラインメントする[21,22]。このような戦略の適用は、鑑別診断の手動反復を必要とせず、代わりに、病原体ゲノムデータベースからの既知配列との相同性に基づいたアンバイアスなアプローチを可能にする。さらに、感染が疑われる一次組織を利用することで、病原体発見の感度を向上させることができる。
ここでは、CD患者のリンパ節組織を研究するために、ウイルス発見の最新技術を用いた結果を報告する。ウイルス発見のために設計されたRNAハイブリッドキャプチャー、ディープシーケンシング、バイオインフォマティクスパイプラインである脊椎動物ウイルスのためのウイルスキャプチャーシーケンシング(VirCapSeq-VERT)アプローチ(VirCapSeq-VERT)は、HHV-8,既知のウイルス、または新規ウイルスがCDと関連しているという仮説を検証するために適用された[24]。
材料と方法
すべての研究は、該当する場合には現地の倫理委員会の承認を受け、コロンビア大学またはアーカンソー大学の医療科学のための機関審査委員会の承認を受け、健康保険の移植性と説明責任法に準拠している。すべてのサンプルは分析前に非識別化され、匿名で分析された。
患者資料
iMCD(n = 11)UCD(n = 12)HHV-8陽性MCD(n = 2)およびHHV-8感染との関連が知られていない、または疑われていない、またはHHV-8感染が臨床的に疑われていない悪性リンパ腫(n = 6)の新鮮な凍結リンパ節サンプルを、診断時またはフレア時に、ルーチンの臨床治療の一環として、コアニードルまたは切除生検のいずれかで採取した。全く別のコホートから、iMCD(n = 12)UCD(n = 9)HHV-8陽性MCD(n = 4)およびEBV関連の移植後リンパ増殖性障害(n = 4)の患者から、ホルマリン固定パラフィン包埋リンパ節組織のアーカイバルサンプルを採取した。CD患者から採取した検体は、診断時またはフレア時のHHV-8感染の有無を、潜伏核抗原-1(LANA-1)染色、またはリンパ節生検組織のHHV-8 DNAのPCR検査のいずれかで測定した。すべてのiMCD症例は、最近発表された国際的な診断基準を満たしていた[13]。フレアとは、iMCD診断基準における少なくとも2つの軽度の基準(1つの異常な臨床検査を含む)および/またはCRP>10mg/dLの存在と定義される。すべての臨床検査値、治療法、およびサンプル採取日は、患者の医療記録から取得した。研究者は、すべてのサンプル分析について疾患タイプを盲検化した。
凍結リンパ節サンプル中のウイルス配列のVirCapSeq-VERT検出
VirCapSeq-VERT分析のために、滅菌メスを用いて各凍結組織サンプルから0.2gを切り出した。サンプルを計量する前に、固体の最適切断温度(OCT)化合物を切り取った。次に、組織サンプルをTissueLyser II(Qiagen)を用いて、5mmステンレス鋼ビーズ2個とリン酸緩衝生理食塩水(PBS)1mLを含む2mLのセーフロックチューブ(エッペンドルフ)中で30Hzの周波数で2分間ホモジナイズした。ホモジナートをプロテアーゼK(50μg)で50℃で1時間処理し、5,000gで2分間遠心し、上清を0.45μmフィルター(ミリポア)チューブに移し、10,000gで5分間遠心した。その後、ろ過液をQiagen All-Prep kitを用いて、メーカーのプロトコルに従って抽出した。単離されたRNAは、前記[24]に記載されているようにVirCapSeq-VERT用に調製した。簡潔に説明すると、RNA を、二本鎖および一本鎖 DNA と RNA、(+)および(-)RNA、脊椎動物に感染することが知られているすべての 207 種 類のウイルスから既知のウイルスに 90%以上の配列相同性を持つ円形、線形、およびセグメント化されたウイルスをカバーする約 2,000,000,000 個のオリゴヌクレオチドプローブと結合させた。トランスクリプト結合したプローブを捕獲し、ウイルスRNAを増幅した。シーケンシングは、HiSeq 4000プラットフォーム(イルミナ)で実施した。サンプルは、FastQファイルを生成するためにIlluminaソフトウェアを使用してデマルチプレックスされた。FastQファイルは、以前に記載されたプロトコル[24]に従ってマッピングされ、アセンブルされた。VirCapSeq-VERTによるウイルス配列の同定に続いて、直接配列からプライマーを設計し、診断用RNAライブラリ中のウイルス転写物の存在をPCRによって確認した。非多重化されたハイスループットシーケンシングデータは、BioProjectのアクセッション番号PRJNA543144の下、NCBI Sequencing Read Archiveに寄託されている。
臨床検査・病理検査
アーカイバルFFPEリンパ節組織および末梢血中のEBVの検査は、アーカンソー大学医療科学部において、標準的な臨床プロトコルに従って実施した。アーカイバルFFPEリンパ節組織については、リンパ節組織中の10HPFにわたるEBV-エンコードされた小RNA(EBER)陽性細胞の平均数/40倍ハイパワーフィールド(HPF)をin situハイブリダイゼーションによって評価し、病理医によってスコア化した。EBV DNAのPCR検査は、定量範囲が390〜39,000,000,000コピー/mLであるARUP Laboratories(ソルトレイクシティ、UT、米国)またはアッセイ範囲が49〜169,000,000コピー/mLであるViracorIBT Laboratories(リーサミット、MO、米国)により、iMCD患者からの末梢血を用いて実施した。
結果
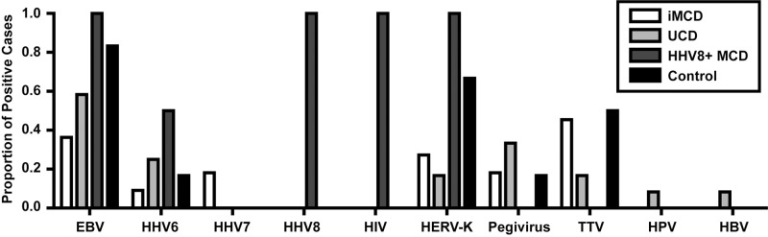
既知および新規のウイルス、ならびにiMCDおよびUCDにおける可能性のあるウイルス関連をアッセイするために、これらの条件を有する患者からの凍結リンパ節組織を対象にVirCapSeq-VERTを実施した。VirCapSeq-VERTで解析した全症例の臨床データおよび病理組織学的データを表1に示す。ポジティブコントロールとして、既知のHIV陽性、HHV-8陽性のMCDを有する2人の患者が含まれた。陰性対照として、HHV-8 感染の疑いのないホジキンリンパ腫および T 細胞リンパ腫の患者が含まれた。事前に行われたルーチン検査の結果と一致するように、HHV-8の転写物はどのiMCD症例からも検出されなかった。iMCD症例から検出された2つの最もパンデミックしているウイルスは、トルクテノウイルス(TTV)(5/11)とEBV(4/11)であった(図1)。また、ヘルペスウイルス科に属するHHV-6とHHV-7は、それぞれ1人と2人の患者から検出された。その結果、5/11例のiMCD患者にヘルペスウイルス科の転写産物が検出された。また、ヒト内在性レトロウイルスK(HERV-K)が3/11例、ペジウイルスが2/11例検出された。iMCDのいずれの症例からも、新規ウイルスと関連する可能性のある転写産物は検出されなかった。注目すべきは、2/11例のiMCDでは、いかなる種類のウイルス転写物も検出されなかったことである。参考までに、各症例で検出されたウイルスの完全なリストを表2に示する(ウイルスリード数、ゲノムカバレッジ、PCRによる確認を含む)。
図1 リンパ節組織で検出されたウイルス転写物
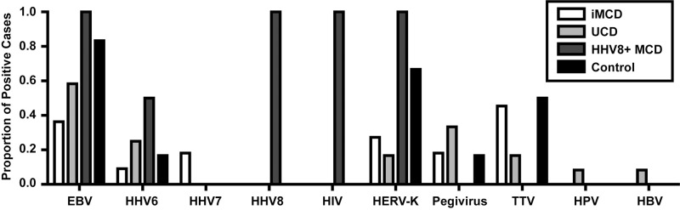
特発性多中心キャッスルマン病(iMCD)(n = 11)単中心CD(UCD)(n = 12)カポジ肉腫関連/ヒトヘルペスウイルス(HHV)-8陽性MCD(HHV-8+ MCD)(n = 2)およびリンパ腫(n = 6)患者から得られた新鮮な凍結リンパ節組織中のウイルス転写物のVirCapSeq-VERT検出。各疾患についてウイルスの転写物が検出された症例の割合をウイルス別に示した。トランスクリプトが検出されたすべてのウイルスを示した。EBV、エプスタインバーウイルス;HIV、ヒト免疫不全ウイルス;HERV-K、ヒト内在性レトロウイルスK;TTV、トルクテノウイルス;HPV、ヒトパピローマウイルス;HBV、B型肝炎ウイルス。
表1 病態別の臨床的特徴
| iMCD | UCD | HHV-8 + MCD | リンパ腫 | |
|---|---|---|---|---|
| サンプル数 | 11 | 12 | 2 | 6 |
| 診断時の年齢 | 48±20 | 40±14 | 45 | NR |
| 性別 | 64%男性 | 42%男性 | 100%男性 | NR |
| 再発性疾患 | 4/11 | 0/9 | 1/1 | NA |
| 組織病理学 | 6 PC、3 HV、2M | 11 HV、1M | 2 PB | NA |
| CRP(mg / L) | 113.2±106.3(n = 6) | 0.5±0.5(n = 5) | 17.5 | NR |
| ESR(mm / hr) | 81.6±31.4(n = 6) | 7.4±4.8(n = 5) | 57 | NR |
| TAFRO臨床サブタイプ | 3/11 | 0/7 | NR | NA |
臨床的特徴は、VirCapSeq-VERTで分析されたすべてのサンプルについて示されている。組織病理学は、特にキャッスルマン病組織病理学のサブタイプを指す。PC、形質細胞性;HV、ヒアライン血管性;M、PCとHVの混合;PB、形質細胞性。再発性疾患およびTAFRO症候群の存在は、キャッスルマン病に特異的である。TAFRO、血小板減少症、アナザルカ、発熱、網状筋線維症/腎機能障害、臓器巨大症、iCD、特発性多中心性キャッスルマン病、UCD、単中心性CD、HHV-8+ MCD、カポジ肉腫関連/ヒトヘルペスウイルス(HHV)-8陽性MCD、CRP、C反応性蛋白質、ESR、赤血球沈降速度。値は、平均±標準偏差として示されている。
表2 VirCapSeq-VERTで検出されたウイルス転写物の概要
| サンプル | 状態 | 読み取りの総数 | 識別されたウイルス | ウイルス読み取りの数 | ゲノムカバレッジ | 確認(PCR) |
|---|---|---|---|---|---|---|
| 1 | コントロール | 24561109 | ND | |||
| 2 | コントロール | 14554711 | ペギウイルス | 2 | 1.30% | ポジティブ |
| TTV | 3 | 7.70% | ポジティブ | |||
| HERV-K | 5 | 2.90% | ポジティブ | |||
| EBV | 374 | 11.00% | ポジティブ | |||
| 3 | コントロール | 6371838 | HERV-K | 5 | 2.40% | ポジティブ |
| EBV | ND | 0% | ポジティブ | |||
| 4 | コントロール | 18678639 | TTV | 1 | 2.60% | ポジティブ |
| HERV-K | 19 | 6.60% | ポジティブ | |||
| EBV | 2 | 0.10% | ポジティブ | |||
| 5 | コントロール | 24353211 | TTV | 1 | 2.60% | ポジティブ |
| EBV | ND | 0% | ポジティブ | |||
| 6 | UCD | 9523614 | TTV | 1 | 2.60% | ポジティブ |
| EBV | 1 | 0.10% | ポジティブ | |||
| 7 | UCD | 6325271 | HBV | 26 | 23.70% | ポジティブ |
| TTV | 4 | 8.00% | ポジティブ | |||
| 8 | HHV + MCD | 18307356 | HIV | 181 | 69.90% | ポジティブ |
| HERV-K | 3 | 1.90% | ポジティブ | |||
| EBV | 15 | 0.50% | ポジティブ | |||
| HHV-8 | 300 | 12.00% | ポジティブ | |||
| 9 | HHV + MCD | 8658011 | HIV | 29 | 26.30% | ポジティブ |
| HERV-K | 3 | 0.80% | ポジティブ | |||
| EBV | 17 | 1.00% | ポジティブ | |||
| HHV-6 | 5 | 0.20% | ポジティブ | |||
| HHV-8 | 519 | 25.60% | ポジティブ | |||
| 10 | iMCD | 17527148 | HERV-K | 2 | 2.40% | ポジティブ |
| 11 | UCD | 22909368 | ペギウイルス | 4 | 18.00% | ポジティブ |
| EBV | ND | 0% | ポジティブ | |||
| HHV-6 | ND | 0% | ポジティブ | |||
| 12 | UCD | 22383943 | EBV | 4 | 0.20% | ポジティブ |
| 13 | UCD | 8648752 | ND | |||
| 14 | iMCD | 15845224 | TTV | 47 | 59.30% | ポジティブ |
| EBV | 1 | 0.10% | ポジティブ | |||
| 15 | iMCD | 12844820 | TTV | 2 | 5.10% | ポジティブ |
| HERV-K | 5 | 3.20% | ポジティブ | |||
| EBV | 1 | 0.10% | ポジティブ | |||
| HHV-7 | 1 | 0.10% | ポジティブ | |||
| 16 | iMCD | 14440722 | TTV | 1 | 2.60% | ポジティブ |
| HHV-6 | ND | 0% | ポジティブ | |||
| HHV-7 | 5 | 0.10% | ポジティブ | |||
| 17 | コントロール | 9173387 | HERV-K | ND | 0% | ポジティブ |
| EBV | 1 | 0.10% | ポジティブ | |||
| HHV-6 | ND | 0% | ポジティブ | |||
| 18 | iMCD | 29439393 | HERV-K | 49 | 8.40% | ポジティブ |
| 19 | iMCD | 13550911 | ND | |||
| 20 | iMCD | 12295074 | ND | |||
| 21 | iMCD | 8819138 | ペギウイルス | 1 | 1.10% | ポジティブ |
| EBV | 7 | 0.10% | ポジティブ | |||
| 22 | iMCD | 11714699 | EBV | ND | 0% | ポジティブ |
| 23 | iMCD | 6553836 | ペギウイルス | 200 | 46.90% | ポジティブ |
| TTV | 35 | 14.80% | ポジティブ | |||
| 24 | iMCD | 9598180 | TTV | 2 | 5.10% | ポジティブ |
| 25 | UCD | 7986313 | ペギウイルス | 30 | 15.70% | ポジティブ |
| HHV-6 | 6 | 0.10% | ポジティブ | |||
| 26 | UCD | 15354108 | HPV | 5 | 2.25% | ポジティブ |
| 27 | UCD | 12142416 | EBV | ND | 0% | ポジティブ |
| 28 | UCD | 9606222 | HHV-6 | ND | 0% | ポジティブ |
| 29 | UCD | 12838304 | HERV-K | 32 | 9.10% | ポジティブ |
| EBV | ND | 0% | ポジティブ | |||
| 30 | UCD | 7522791 | ペギウイルス | 1 | 1.10% | ポジティブ |
| EBV | 2 | 0.10% | ポジティブ | |||
| 31 | UCD | 15599845 | ペギウイルス | 1 | 1.10% | ポジティブ |
| HERV-K | 34 | 12.70% | ポジティブ | |||
| EBV | 8 | 0.10% | ポジティブ |
各症例について、臨床状態、ウイルス転写物、ゲノムカバレッジ、および確認用PCR検査の結果が記載されている。症例のサブセットについては、いくつかのウイルス転写物が最初のVirCapSeq-VERTシーケンシングの実行では検出されなかったが、その後の確認用PCR検査で検出された。これらの例では、ウイルス転写物はND(Not Detected)と記載されており、ゲノムカバレッジは0%である。
iMCDと同様に、HHV-8はどのUCD症例からも検出されなかった。EBVは最も頻度の高いウイルスで、12例中7例で検出された(図1)。次に多く検出されたウイルスは、ペギウイルス(4/12)とHHV-6(3/12)であった。iMCDと比較すると、有病率は低いが、非ヘルペスウイルスが多く検出された。HERV-K(2/12)、TTV(2/12)、ヒトパピローマウイルス(1/12)とHBV(1/12)であった。新規ウイルスの可能性のある転写産物はUCD症例のいずれからも検出されなかった。
VirCapSeq-VERTでは、HHV-8陽性のMCD症例の両方でHHV-8とHIVの転写物が検出され、既知の臨床状態が確認された。EBVおよびHERV-K転写物も両症例で検出された。HHV-6は2例のうち1例で検出された(図1)。ホジキンリンパ腫とT細胞リンパ腫の対照例では、HHV-8は検出されなかった。ホジキンリンパ腫とT細胞リンパ腫の両方がEBVの潜伏感染と関連しているという以前の報告[25-27]と同様に、EBV転写産物は高い割合で検出された(5/6)。HERV-K (4/6)、TTV (3/6)、HHV-6 (1/6)、およびペギウイルス (1/6) の転写物もこれらのリンパ腫サンプルで検出された。これらのコホートは、HHV-8,HIV、EBV、その他の既知のウイルスからの転写物を検出するVirCapSeq-VERTの能力を実証している。
異なる疾患カテゴリーにまたがる個々のウイルスに対して陽性所見が認められた症例の割合を図 1 に示する。EBVは全群で一貫して検出され、最も多く検出されたウイルスであり、iMCD(36%)を除くすべての条件で50%以上の症例が陽性であった。他の2つのウイルスはHHV-6とHERV-Kであった。これらのウイルスは、iMCDとUCDではEBVよりも低い有病率で検出された。ペジウイルスとTTVの両方がiMCD、UCDおよびリンパ腫の条件で有病率50%未満で検出され、HHV-8陽性のMCDでは検出されなかった。上述のように、HIVとHHV-8の両方がHHV-8陽性MCD患者のみで検出され、他の条件では検出されなかった。
異なる疾患カテゴリーにまたがる各サンプルから検出された異なるウイルスの数は、図2に示されている。全体的に、iMCDは患者サンプルあたりの検出可能なウイルスの種類の数が少なく、Herpesviridaeファミリーのメンバー(0.64)とすべてのウイルス(1.55)の両方に当てはまりました(図2Aと2E)(図2Aと2E)。UCD群では、検出された異なるヘルペスウイルスの平均数(0.83)と全ウイルスの平均数(1.67)は、iMCD群と同様の数であった(図2B)が、主にEBVの頻度が増加したためにヘルペスウイルスの有病率が高くなった。ヘルペスウイルス科の検出数が最も多かったことに加えて、HHV-8陽性のMCDの2例は、検出された総ウイルス数が最も多かった(図2Cおよび2E)。リンパ腫では、iMCDやUCDに比べて平均的なウイルス関連数がわずかに増加したが、HHV-8陽性のMCDと比較すると、ウイルス関連数は約2倍に減少している(図2Dおよび2E)。
図2 VirCapSeq-VERTによる各疾患別のウイルス転写物検出頻度
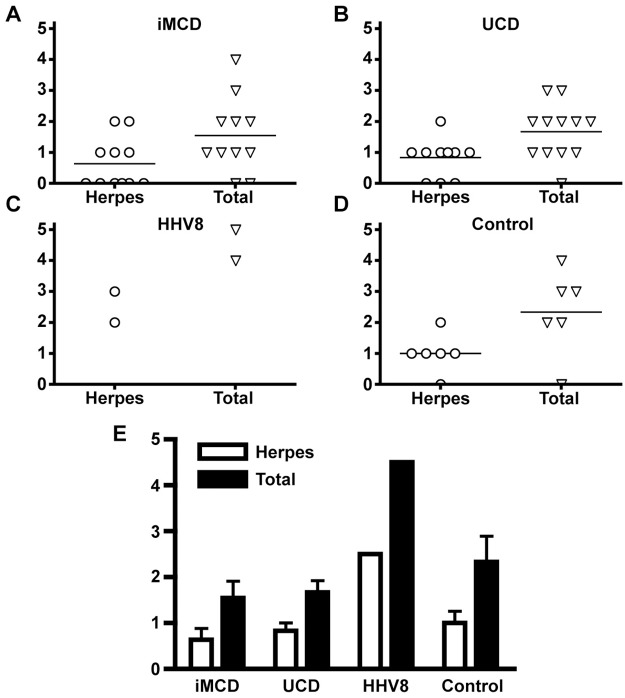
(A-D)各疾患について、症例別に検出されたヘルペスウイルス科の菌数と総ウイルス数、各疾患内で検出されたウイルス数。(E) 各疾患の平均的なヘルペスウイルス科の家族の数および各疾患内で検出された総ウイルス数。iCD、特発性多中心性キャッスルマン病、UCD、単中心性CD、HHV-8,カポジ肉腫関連/ヒトヘルペスウイルス(HHV)-8陽性MCD;値は平均±標準偏差として示されている。
2つのHHV-8陰性MCDコホートでは、単一のウイルスが一様に検出されたわけではないが、HHV-8陽性MCDと同様に、コホート内の症例のサブセットが特定のウイルスによって駆動されている可能性がある。EBV転写物は、4/11例のiMCDと7/12例のUCDで検出された。さらに、iMCDの1例はHHV-6陽性であった。また、iMCDのうち、Herpesviridaeファミリーが検出された症例(5/11)と検出されなかった症例(6/11)を比較したところ、Herpesviridae関連症例では、炎症性マーカーの上昇、再発性疾患およびTAFRO症候群との関連が認められた(表3)。ヘルペスウイルス科のメンバーの中で最もパンデミックしている EBV と TAFRO 症候群を含む CD サブタイプとの相関関係を調べるために、リンパ節組織を別のコホートに分け、EBV-エンコードされた small RNA(EBER)の in situ ハイブリダイゼーション(ISH)を行った。その結果、iMCD(1.7±2.8/HPF、図3A)およびUCDリンパ節組織(2±2.3/HPF、図3B)では、HHV-8陽性のMCD(182±201.9/HPF、図3C)に比べて、EBER陽性細胞が有意に少なかった。 9/HPF;図3C)およびEBV関連リンパ増殖性障害(LPD)(104 ± 60.2/HPF;図3D)のリンパ節組織(F-statistic = 7.99; p<0.0007)と比較した(図3E)。さらに、iMCD29例(うち8例はISHでも検査を受けた)の末梢血のPCRによる臨床的EBVウイルス負荷試験は、EBER ISHの結果と相関があった。
図3 リンパ節組織中のEBER陽性細胞のin situハイブリダイゼーション。

A-D)(A)iMCD(n = 12)(B)UCD(n = 9)(C)HHV-8陽性MCD(n = 4)および(D)EBV関連リンパ増殖性障害(n = 4)の症例から、リンパ節組織中のエプスタインバーウイルス(EBV)エンコードスモールRNA(EBER)陽性細胞を検出するためのin situハイブリダイゼーションアッセイからの代表的な画像。画像は10倍の倍率で示している。E)各診断の全症例に亘って、40倍での10個の高出力フィールド(HPF)を横断して、フィールド当たりのEBER陽性細胞の平均数を示す。値は、適宜、平均±標準偏差として示される。P値は、ボンフェローニ補正を用いた片側t検定から導出した。
表3 ヘルペスウイルス科の転写産物の検出に基づいて層別化されたiMCD症例
| ヘルペスウイルス科の家族: | ポジティブ | 負 |
|---|---|---|
| サンプル数 | 5 | 6 |
| CRP(mg / L) | 221.5(n = 2) | 66.9±70.5(n = 4) |
| ESR(mm / hr) | 94(n = 2) | 73.5±41.3(n = 4) |
| 組織病理学 | HV 2、M 1、PC 2 | HV 1、M 1、PC 4 |
| タフロ | 3/5 | 0/6 |
| 再発性疾患 | 4/5 | 0/6 |
| 抗IL-6療法に対する臨床反応 | 1/2 | 2/2 |
臨床的特徴は、Herpesviridaeファミリーメンバーのウイルス転写物の検出によって層別化されたVirCapSeq-VERTで解析されたすべてのiMCD患者について示されている。組織病理学的には、キャッスルマン病の組織病理学的サブタイプを指す。PC、形質細胞性;HV、ヒアライン血管性;M、PCとHVの混合;TAFRO、血小板減少症、アナザルカ、発熱、網状筋線維症/腎機能障害、臓器肥大;CRP、C反応性蛋白質;ESR、赤血球沈降速度。値は平均値±標準偏差として示されている。
議論
我々は、CDにおける新たなウイルスの関連性を評価するために、この研究を開始した。HHV-8陽性のMCDにおけるHHV-8の病原性の役割が確立されていることを考えると、この分野では、おそらくエピトープの突然変異や欠損によるHHV-8の臨床検査が偽陰性であるために、iMCDやUCDはHHV-8陰性と考えられているのではないかと推測している人もいる。また、iMCDやUCDでは、既知または未知の近縁のウイルスが病原体の原因となっているのではないかという仮説も立てられている。これらの仮説を、ハイスループットシーケンシングをベースとしたウイルス検出プラットフォームVirCapSeq-VERTを用いて検証したところ、これらの患者の治療に日常的に用いられているHHV-8検査でも陰性であったCD症例では、HHV-8を同定することはできなかった。これらの所見は、リンパ節組織のLANA-1陰性染色および末梢血のHHV-8 PCRが陰性であるという以前の臨床観察と一致しており、HHV-8陰性のMCDの存在を支持するさらなる証拠となった。さらに、この包括的なウイルスシークエンシング研究では、これまでに知られていないウイルスや既知のウイルスとの明確な関連性は確認されなかったため、HHV-8陰性MCDの原因となるウイルスの可能性は低いと考えられる。これらの結果は、臨床検査では検出されないにもかかわらず、HHV-8が病気の病因を推進しているという仮説、あるいは別の活性なウイルス感染が病因を推進しているという仮説を支持するものではない。
VirCapSeq-VERTで分析したサンプルでは、UCDとiMCDのサブセットでEBVが観察され、特にEBVをはじめとするヘルペスウイルス科のメンバーとiMCDの臨床重症度との関連性に興味をそそられたが、再発疾患とTAFROサブタイプによって決定された。VirCapSeq-VERTは、ウイルス発見のための高感度ツールである。しかし、活動的な EBV 感染の有無を判定するためには有効性が確認されておらず、確認用 PCR ベースの検査では VirCapSeq-VERT では確認できなかった EBV 配列が同定された例がいくつか見つかった(表2
)。HHV-6についても同様の結果が得られた。これらの知見は、PCRベースの検出方法がVirCapSeq-VERTに比べて感度が向上していることを示しており、これは潜在的な病原体が同定された後の確認検査において重要な考慮事項である。EBVとの関連性が日常的な臨床グレードの検査で維持されているかどうかを判断するために、我々は、EBER陽性細胞の割合と染色パターンを評価するために、別のコホートのアーカイバルFFPEリンパ節組織でEBER ISHを実施した。しかし、UCDまたはiMCDでは、特に、潜在的なEBV再活性化によって引き起こされた臨床的に関連した状態からの一次リンパ節組織の陽性対照として使用されたEBV関連リンパ増殖性障害の患者からのサンプルを参照して、意味のあるEBER染色は見られなかった。さらに、活動期に採取した末梢血のPCR検査を全身感染の追加指標として評価した。8人のiMCD-TAFRO症例を含む29人のiMCD患者の別のコホートでは、臨床的に有意なレベルのEBVは確認されなかった。末梢血分析で分析したこのコホートは、EBER ISHで分析したFFPEアーカイバルリンパ節組織コホートと部分的に重複していた(8/29人)。この二次解析では、臨床検査法を用いてUCD、iMCD、iMCD-TAFROサブタイプとの関連を確認できなかったため、潜在的なEBV感染はないことが示唆された。iMCDの希少性のため、また、新鮮な凍結組織またはFFPE組織と血液サンプルを同一の時点から収集する国際的な努力にもかかわらず、本研究のサンプル数は、CDの他の類似した分析と比較してもかなりの数である[17-19]。iMCD-TAFRO患者を対象としたより大規模な検証コホートが必要であるが、これらの解析結果から、EBVはCDの病原因子ではないことが示唆された。
VirCapSeq-VERTは、脊椎動物に感染することが知られている207種のすべてのウイルスから既知のウイルスと90%以上の配列相同性を持つウイルスを検出することができる、強力で感度の高いウイルス発見プラットフォームである。VirCapSeq-VERT の範囲は広いが、UCD および/または iMCD が VirCapSeq-VERT の指定パラメータの外にあるウイルス(例えば、既知の脊椎動物に感染するウイルスと 90%未満の相同性を共有する転写物を持つ新規ウイルス)によって駆動される可能性がある。HHV-8陽性のMCD症例では、UCDおよびiMCDと比較して、より多くのユニークなウイルスおよびHerpesviridaeファミリーのメンバーが検出された。この所見は、HHV-8陽性MCD症例のHIV感染の背景には、HIV感染の免疫不全があると考えられた。このような背景があるからこそ、HHV-8は免疫モニタリングを逃れ、HHV-8陽性MCDで観察されるサイトカインストームを起こすことができるのである。HHV-8陽性MCDとは対照的に、iMCDはHIV陽性であったり、免疫抑制下で発症した症例は報告されていない。この状況証拠は、日和見ウイルス感染によるiMCDの可能性が低いことを示唆している。
HERV-K、TTV、ペギウイルスなどの非Herpesviridaeファミリーウイルスとの関連性は不明瞭であった。HERV-Kはすべての条件で検出されたが、HERV-Kは感染性のウイルスを生成することができず、ヒトゲノム内の搭乗者であると広く考えられている[28]。HERV-K配列の検出頻度が最も高かったのは、HIV/HHV-8の同時感染やリンパ腫を特徴とする症例でしたが、これはおそらく、疾患病理学的な要因というよりは、増殖亢進状態での転写活性の増加を反映していると考えられる。TTVとペギウイルスにも同様の原理が適用され、これらはいずれも最近報告されたウイルスであり、ヒト組織内に広く存在し、疾患と関連することはほとんどない[29-31]。TTVはTリンパ球増殖ウイルスであり,免疫力の代用として注目されており,TTVウイルスの増加は様々な条件で免疫抑制と関連している.健康状態、CD、その他の疾患状態におけるヒトウイルスのさらなる特徴を明らかにすることで、CDにおけるTTVやペギウイルス感染の役割があるかどうかが明らかになると思われる。
我々の実験計画は、CDの原因となるウイルスが、これらの症例の診断に使用される肥大したリンパ節に存在するという仮定に基づいている。CDの特徴として、リンパ節腫大に特徴的な病理組織学的特徴があることを考えると、リンパ節はウイルス感染の証拠を見つけることが期待される中心的な場所であると考えられる。この原則は、HHV-8陽性のMCDの例で示されており、リンパ節組織のウイルスPCRとLANA-1染色がHHV-8の状態を評価するためのゴールドスタンダードと考えられており、血清学や血液中のウイルスPCRよりも感度が高いと考えられている[11,12]。さらに、HHV-8陽性のMCDにおいて、HHV-8がリンパ節以外でのみ検出されたという報告はない。しかし、UCDやiMCDに関連するウイルスを同定するには、骨髄などの別の組織区画がより適切であった可能性がある。さらに、我々の研究は、非ウイルス性病原体がUCDやiMCDの発症を促進している可能性を排除するものではない。CDにおける他のタイプの病原体の潜在的な役割を調べるためには、さらなる研究が必要である。
本研究で得られた知見は、ウイルス感染がUCDやiMCDの主要な病因ではないことを示唆しているため、これまでに仮定されていた他の病因、例えば、自己免疫、自己炎症、腫瘍学的メカニズムが関与している可能性がある。しかし、我々はウイルス感染の間接的な役割を排除することはできない。例えば、分子模倣はその後の自己免疫反応を引き起こす可能性があり、それによって自己免疫を開始する最初のウイルス感染は、サンプル分析時にはもはや存在しない。また、ウイルスDNAを宿主ゲノムに組み込むことで、CDの発症に重要な遺伝子が破壊されたり、機能を獲得したりする可能性もある。これらの領域は、今後の研究により、CDの病態生理を明らかにし、最終的には治療戦略や患者の転帰を改善する新たな知見につながる可能性がある。
本研究で得られた知見は、HHV8陽性のMCDとは対照的に、活動的なウイルス感染がUCDやiMCDの主な発症要因ではないことを示している。このように、CDはウイルス性と非ウイルス性の両方の病因を持つ、異なる形態のCDが存在する。これらの観察は、CDの異種性を強調し、治療戦略と患者の転帰を改善するために、UCDとiMCDの未知の病因の特徴を明らかにすることの重要性をさらに強調している。