Contents
pubmed.ncbi.nlm.nih.gov/33431578/
要旨
目的 COVID-19は主に呼吸器系の疾患であるが、消化管が本疾患に関与していることを示唆する証拠が増えつつある。我々は、COVID-19患者の腸内細菌が疾患の重症度と関連しているかどうか、また、もしあれば、マイクロバイオーム組成の乱れがSARS-CoV-2ウイルスの消失に伴って解消されるかどうかを調査した。
方法 この2病院のコホート研究において、実験室でSARS-CoV-2感染が確認された患者100人の血液、便、および患者記録を入手した。100人中27人の患者から、SARS-CoV-2が消失してから30日後までの便サンプルを連続的に採取した。便から抽出した全DNAのショットガンシーケンスにより、腸内細菌叢の構成を明らかにした。炎症性サイトカインと血液マーカーの濃度は、血漿から測定した。
結果 COVID-19患者では、投薬の有無にかかわらず、非COVID-19患者と比較して腸内細菌叢の組成が有意に変化していた(p<0.01)。Faecalibacterium prausnitzii、Eubacterium rectale、bifidobacteriaなど、免疫調節の可能性が知られているいくつかの腸内常在菌は、患者において存在感が低く、疾患治癒後30日まで収集したサンプルでも低いままであった。さらに、この乱れた構成は、炎症性サイトカインやC反応性タンパク質、乳酸脱水素酵素、アスパラギン酸アミノトランスフェラーゼ、γ-グルタミルトランスフェラーゼなどの血液マーカーの濃度上昇と一致して、疾患の重症度による層別化を示した。
結論 COVID-19患者における腸内細菌叢の構成、サイトカインおよび炎症マーカーのレベルとの関連は、腸内細菌叢がおそらく宿主免疫応答の調節を介してCOVID-19の重症度の大きさに関与していることを示唆している。さらに、疾患治癒後の腸内細菌叢の異常は症状の持続に寄与する可能性があり、腸内細菌が炎症とCOVID-19にどのように関与しているかを理解する必要性が強調された。
データの利用可能性に関する声明
データは公開のオープンアクセスリポジトリで利用可能である。https://www.ncbi.nlm.nih.gov/bioproject/PRJNA650244。生配列データは、Sequence Read Archive (SRA) の BioProject Accession PRJNA650244 で公開されている。
creativecommons.org/licenses/by-nc/4.0/
本論文は、Creative Commons Attribution Non Commercial (CC BY-NC 4.0) ライセンスに従って配布されるオープンアクセス論文であり、原著作物が適切に引用され、適切なクレジットが与えられ、変更があればそれが示され、使用が非商業的であるという条件で、他の人がこの作品を非商業的に配布、リミックス、適応、構築し、異なる条件でその派生物を許可するものである。参照: creativecommons.org/licenses/by-nc/4.0/.
dx.doi.org/10.1136/gutjnl-2020-323020
本研究の意義
このテーマで既に知られていることは?
- SARS-CoV-2は主に気道に感染するが、COVID-19の病態はウイルスを排除する免疫反応の異常に起因していると考えられる。
- ヒト腸管細胞におけるSARS-CoV-2の複製、糞便サンプルにおけるウイルスの検出、COVID-19患者の腸内細菌叢組成の変化など、いくつかの証拠が消化管の関与を示唆している。
- COVID-19の腸内細菌叢の調査は限られており、腸内細菌叢と疾患の病態生理との関連は検討されていない。
新しい知見は何か?
- COVID-19患者の腸内細菌叢の構成は、疾患の重症度、いくつかの炎症性サイトカイン、ケモカインおよび組織損傷の血中マーカーの血漿濃度の大きさと一致している。
- COVID-19患者では、Faecalibacterium prausnitzii、Eubacterium rectale、数種のビフィズス菌など、免疫調節能を持つことが知られている腸内細菌が枯渇していた。
- COVID-19患者の腸内細菌叢組成の異常は、ウイルスが消失した後も持続する。
- 腸内細菌叢組成はCOVID-19患者における疾患の重症度を反映する20
共有再生ビデオ
この研究の意義
当面の臨床診療にどのような影響を与える可能性があるか?
- これらの知見は、免疫調整腸内微生物の枯渇がCOVID-19疾患の重症化に寄与していることを示唆している。
- 病気が治った後も続く腸内細菌叢の異常は、ウイルスが治った後に一部の患者に起こる持続的な症状および/または多系統の炎症症候群を発症させる要因である可能性がある。
- COVID-19で枯渇した有益な腸内細菌種を増強することは、重症化を軽減するための新たな手段となり得るため、COVID-19発症中および発症後の患者の腸内細菌叢の管理の重要性が強調されることになった。
はじめに
SARS-CoV-2による感染は、ウイルスを排除するための免疫応答を引き起こすが、異常な応答が重症化、およびおそらくCOVID-19以外の他の炎症状態の原因であることを示唆する証拠が増えてきている。重症患者は、SARS-CoV-2感染による免疫反応と組織損傷を反映して、IL 6、8、10などの炎症性サイトカインや炎症性マーカー、CRP、乳酸脱水素酵素(LDH)の高い血漿レベルを示す1-3。さらに、一部の患者は回復後に自己炎症症状を起こし、特に小児の多系統炎症症候群や川崎様疾患は顕著である4-6。SARS-CoV-2のヒト小腸腸管細胞への感染・複製能力7、糞便サンプル中のウイルスRNAの一貫した検出8 9、SARS-CoV-2感染者の腸内細菌叢構成の変化10など、いくつかの観察は消化管の大きな関与を示唆するものである。11 消化管は体内で最大の免疫臓器であり、その常在微生物叢は宿主の免疫反応を調節することが知られているため12、我々はCOVID-19において腸内細菌叢が宿主の炎症性免疫反応と関連していると仮定した。本論文では、100名のCOVID-19患者の入院中および回復後30日までの腸内細菌叢と免疫反応の特徴を明らかにし、入院中の腸内細菌叢組成は、疾患の重症度およびいくつかのサイトカインおよび炎症マーカーの血漿濃度と関連していることが示された。さらに、回復した患者の腸内細菌叢組成は、COVID-19でない人と比較して有意に変化したままであり、これはCOVID-19以外の将来の健康問題にも重要な示唆を与える可能性がある。
材料と方法
被験者の募集とサンプル収集
本研究は、ヘルシンキ宣言に従って実施された。すべての患者は、書面によるインフォームドコンセントを提供した。我々の以前の研究で述べたように、COVID-19の患者10人を、2020年2月から5月の間に香港のプリンスオブウェールズ病院とユナイテッドクリスチャン病院から募集した。これらの患者は、病院スタッフが採取した鼻咽頭スワブに実施した定量的逆転写PCR(RT-qPCR)により、実験室でSARS-CoV-2陽性と確認された13。COVID-19以外の被験者は、広告で募集した香港の人口腸内細菌調査の一部としてCOVID-19以前に募集14、または結腸鏡試験15から非疾患対照として、被験者は通常の結腸鏡(腸管準備数日前の便を収集)であることが判明した。COVID-19の患者は、Wuらの報告16に基づき、症状に基づいて4つの重症度グループに分類された。簡単に言えば、患者は、肺炎のX線的兆候がない場合は軽度、発熱と呼吸器症状を伴う肺炎が検出された場合は中等度、呼吸数が毎分30呼吸以上、大気呼吸時の酸素飽和度が93%以下またはPaO2/FiO2が300 mm Hg以下、機械換気を要する呼吸不全または集中治療が必要となる内臓障害がある場合は重度に分類された。入院中の患者の血液と便は病院スタッフが採取し,退院した患者はフォローアップ日に便を提供するか,自宅で自己採取した。便は保存液(Cat. 63700, Norgen Biotek Corp, Ontario Canada)を含む採便管に採取し、処理まで-80℃で保存した。我々は以前、この保存培地で採取した便から生成された腸内細菌叢組成が、-80℃での即時凍結から得られた結果と同等であることを示した17。
便のDNA抽出と配列決定
詳細な方法は、Zuo et al.10に記載されている。簡単に言えば、製造者の指示に従って、Maxwell RSC PureFood GMO and Authentication KitおよびMaxwell RSC Instrument核酸抽出プラットフォーム(Promega、ウィスコンシン、米国)を用いて、0.1 gの均質化糞便試料からDNAが抽出された。Nextera DNA Flex Library Prep Kit (Illumina, California, USA) を用いて抽出したDNAから配列決定ライブラリーを調製し、香港中文大学腸内細菌研究センターでIllumina NovaSeq 6000 System (2×150 bp) を用いて配列決定した。この研究のために生成された生の配列データは、BioProjectアクセッションPRJNA650244の下、Sequence Read Archiveで入手可能である。
配列データの処理、腸内細菌叢組成の推定、統計解析
生配列データは、Trimomatic V.39を使用して、アダプター配列や低品質配列を除去する品質フィルタリングを行った。その後、MetaPhlAn218 V.2.7.7とV.20データベースを用いて、quality-filtered forward readsから微生物叢組成プロファイルを推論した。統計解析のため、部位別種数および相対存在量表をR19 V.3.5.1にインプットした。主成分分析(PCA)序列は、種レベルの組成プロファイルに基づくサンプルのクラスタリングを可視化するために使用された。腸内コミュニティ組成と患者のパラメータとの関連は、並べ替え多変量分散分析(PERMANOVA)およびプロクラステス分析を用いて評価した。特定の微生物種と患者パラメータの関連は、Huttenhower Lab Galaxyインスタンス(http://huttenhower.sph.harvard.edu/galaxy/)に実装された線形判別分析効果量(LEfSe)および線形モデルによる多変量解析(MaAsLin)統計フレームワークを用いて同定された。PCA、PERMANOVA、Procrustes解析は、vegan R package20 V.2.4-6に実装されている。
便検体中のSARS-CoV-2負荷量の測定
RNAは、QIAamp Viral RNA Mini Kit (QIAGEN, Hilden Germany) を用いて、0.1gのホモジナイズした便から製造者の指示に従って抽出された。SARS-CoV-2プライマーおよびプローブ配列は、米国疾病対策予防センターから提供されたとおりであった(2019-nCoV_N1-F:5′-GACCCCAAAATCAGC GAAAT-3’、2019-nCoV_N1-R:5′-TCTGTTACTGCCAGTTGAATCTG-3’、2019-nCoV_N1-P:5′-FAM-ACCCCATTACGTTTGGTGGACC-BHQ1-3’)。各ワンステップRT-qPCR反応は、20μLの最終反応容量中に、10μLの抽出RNA、4μLのTaqMan Fast Virus 1-Step Master Mix (Thermo Fisher Scientific, Massachusetts, USA)を含んでいた。プライマー濃度は0.5 μM、プローブ濃度は0.125 μMとした。サイクリング条件は、25℃ 2 分、50℃ 15 分、95℃ 2 分、95℃ 15 秒、55℃ 30 秒を 45 サイクルとし、StepOnePlus Real-Time PCR System (Thermo Fisher Scientific) で熱サイクルを行った。サイクル閾値(Ct)値は、完全なN遺伝子を含むプラスミド(2019-nCoV_N_Positive Control, Integrated DNA Technologies, USA)の既知のコピーの10倍連続希釈から作成した標準曲線に基づいて、ウイルスRNAコピーに変換された。Ct値が39.9サイクルを超えた場合、サンプルは陰性と判断した。検出限界は347copies/mLであった。
血漿中サイトカイン測定
抗凝固剤処理したチューブに採取した全血試料を2000×gで10分間遠心分離し、上清を採取した。Bio-Plex 200 System(Bio-Rad Laboratories, California, USA)上でMILLIPLEX MAP Human Cytokine/Chemokine Magnetic Bead Panel-Immunology Multiplex Assay(Merck Millipore, Massachusetts, USA)を用いてサイトカインおよびケモカイン濃度を測定した。N末端プロ脳性ナトリウム利尿ペプチド(NT-proBNP)濃度は、Human NT-proBNP ELISA kits (Abcam, Cambridge, UK) を用いて測定された。
患者および一般市民の参加
本研究のデザイン、実施、報告、普及計画には、患者や一般市民は関与していない。
結果
COVID-19患者コホート
2020年2月から5月にかけて、SARS-CoV-2 RT-qPCR陽性で確定したCOVID-19患者100人の血液と便のサンプルを採取した。これらの患者と、COVID-19以前に香港で募集した成人78人の非COVID-19対照コホートの人口統計学的および臨床的特徴を表1に報告する。COVID-19の患者は女性47人、男性53人で、平均±SD年齢は36.4±18.7歳であった。重症,重症,中等症,軽症16はそれぞれ3.0%,5.0%,45.0%,47.0%にみられた。一方、COVID-19以外のコホートは、女性45名、男性33名からなり、平均年齢±SDは45.5±13.3歳であった。COVID-19コホートにおける合併症は、高血圧、高脂血症、糖尿病、心疾患であったが、高血圧の11人を除いて、それぞれ5人以下であった。COVID-19以外のコホートでは、高血圧症が唯一の主要な併存疾患であり、11人であった。COVID-19患者100人のうち、41人は入院期間中および/または退院後のフォローアップのために複数の便サンプルを提供し、34人と46人は便の採取前にそれぞれ抗生物質と抗ウイルス剤を投与されていた。
表1COVID-19コホートと非COVID-19コホートの特徴
| COVID-19(新型コロナウイルス感染症) | 非COVID-19 | |
| 被験者数 | 100 | 78 |
| 性別(女性:男性) | 女性47名、男性53名 | 女性45名、男性33名 |
| 年齢、年(平均±SD) | 36.4±18。7年 | 45.5±13。3年 |
| 病気の重症度のカテゴリ | 軽度47、中程度45、重度5、重大3 | NA |
| 入院時の症状、n(%) | ||
| 熱 | 38(38.0%) | NA |
| 下痢 | 17(17.0%) | NA |
| 咳 | 40(40.0%) | NA |
| 喀痰 | 18(18.0%) | NA |
| 喉の痛み | 8(8.0%) | NA |
| 鼻漏 | 19(19.0%) | NA |
| 呼吸困難 | 9(9.0%) | NA |
| 併存疾患、n(%) | ||
| 高血圧 | 11(11.0%) | 11(11.0%) |
| 高脂血症 | 4(4.0%) | 0 |
| 糖尿病 | 2(2.0%) | 0 |
| 心臓病 | 2(2.0%) | 0 |
| アレルギー性疾患 | 7(7.0%) | 15(15.0%) |
| HIV | 3(3.0%) | 0 |
| 喘息 | 2(2.0%) | 2(2.0%) |
| 入院中に抗生物質を投与された疾患の重症度、n(%) | ||
| 軽度の病気 | 47の6(12.8%) | NA |
| 中等度の病気 | 45の21(46.7%) | NA |
| 重度の病気 | 4/5(80.0%) | NA |
| 重大な病気 | 3/3(100%) | NA |
| 入院中に抗ウイルス薬を投与された、n(%) | ||
| ロピナビル/リトナビル | 100の38(38.0%) | NA |
| リバビリン | 100の30(30.0%) | NA |
| オセルタミビル | 100の5(5.0%) | NA |
COVID-19患者における腸内細菌叢の組成の変化
合計274の便サンプルの塩基配列を決定し、サンプルあたり平均6.8 Gbp (47 386 950 reads)を得た。まず、入院中に採取した各COVID-19患者の最初の便サンプル(n=87、COVID-19患者100人のうち13人は回復後に便を提供しただけ)と非COVID-19被験者(女性40人対男性47人、35.6±18.8歳(平均±SD))と比較し、このCOVID-19コホートにおいて腸内細菌叢組成が変化しているかどうかを評価した。門レベルでは、COVID-19患者では非COVID-19患者と比較して細菌目のメンバーが相対的に多く(平均23.9%対12.8%、p<0.001、Mann-Whitney検定)、一方、非COVID-19患者では放線菌が相対的に多く(26.1%対19.0%、p<0.05、Mann-Whitney検定)なってた(図1A)。生物種レベルでは、疾患(COVID-19 vs 非COVID-19)および抗生物質(図1B)(p<0.05、PERMANOVA)との有意な関連を確認したが、便中SARS-CoV-2負荷、抗ウイルス剤(ロピナビル・リトナビル、リバビリン、87人中39人はオセルタミビル)、コルチコステロイド、プロトンポンプ阻害剤の使用は認められなかった(オンライン補足表 S1)。抗生物質の使用をコントロールしない場合、COVID-19の腸内細菌叢の組成の違いは、主にRuminococcus gnavus、Ruminococcus torques、Bacteroides doreiなどの種の濃縮とBifidobacterium adolescentis、Faecalibacterium prausnitzii、Eubacterium rectaleの枯渇(p < 0.05, LEfSe)によってもたらされた(表2、オンラインの補助的表 S2)。抗生物質の効果を調べたところ、コホート間の差は主にParabacteroides、Sutterella wadsworthensis、Bacteroides caccaeなどの分類群の濃縮と、非COVID-19と比較してCOVID-19ではADLERCTZIA equolifaciens、Dorea formicigeneransおよびClostridium leptumが枯渇していた(p<0.05、MaAsLin)。 05, MaAsLin)(オンライン補足表S3)。ただし、関与する分類群のほとんどは、これらのサンプルの平均相対存在量が0.1%未満であった。COVID-19被験者87人と非COVID-19被験者78人の間では、腸内細菌叢全体の組成は異なっていたが、種の豊富さとシャノン多様性に有意差はなかった(p>0.05、Mann Whitney検定)(オンラインの補足図S1)。COVID-19コホート内では、入院中に採取した腸内細菌叢組成(n=87)が疾患の重症度(軽症、中等症、重症、重症)と最も有意に関連し、次に効果の大きさが降順になる抗生物質が続いた(p < 0.05, PERMANOVA)(オンラインの補足表 S1)。重症度と関連する微生物種を同定したところ、F. prausnitziiとBifidobacterium bifidumは抗生物質の使用と患者の年齢で調整した後、重症度と負の相関を示した(p<0.05、順序回帰)。B. adolescentisやE. rectaleなど、ヒトの腸内に通常多く存在する他のいくつかの微生物種の相対量も、統計的に有意ではなかったものの、疾患の重症度の増加とともに減少が見られた(オンライン補足表S4)。
図1
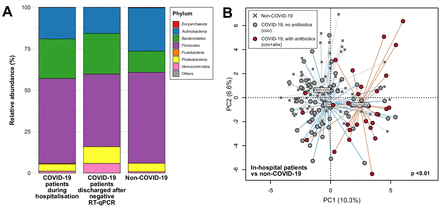
COVID-19患者と非COVID-19被験者の腸内細菌叢の組成の違い。(A) 院内のCOVID-19患者、鼻咽頭スワブのウイルスRNAのRT-qPCRが陰性で退院した患者、および非COVID-19者の便から検出された微生物フィラの平均相対存在量。(B)COVID-19患者の腸内細菌叢組成の主成分分析で、抗生物質の投与有無による比較を非COVID-19対象者と比較した。塗りつぶした円は入院患者の最初の便サンプル(連続サンプルがある場合)を表し、十字は非COVID-19対象者を表す。グループの中心は、グループのラベルで示されている
表2入院中のCOVID-19患者に関連する細菌種
| 種族† | 平均相対存在量(%)* | |||
| 門 | アソシエーションコホート | COVID-19(新型コロナウイルス感染症) | 非COVID-19 | |
| ルミノコッカスgnavus | Firmicutes | COVID-19(新型コロナウイルス感染症) | 4.64 | 1.82 |
| バクテロイデスドレイ | バクテロイデス門 | COVID-19(新型コロナウイルス感染症) | 3.03 | 0.74 |
| ルミノコッカスのトルク | Firmicutes | COVID-19(新型コロナウイルス感染症) | 4.44 | 2.27 |
| バクテロイデス尋常性 | バクテロイデス門 | COVID-19(新型コロナウイルス感染症) | 2.84 | 1.14 |
| バクテロイデス・オバタス | バクテロイデス門 | COVID-19(新型コロナウイルス感染症) | 1.92 | 0.62 |
| バクテロイデス属 | バクテロイデス門 | COVID-19(新型コロナウイルス感染症) | 1.46 | 0.41 |
| アッカーマンシア・ムシニフィラ | ウェルコミクロビウム | COVID-19(新型コロナウイルス感染症) | 1.06 | 0.77 |
| Bifidobacterium adolescentis | 放線菌 | 非COVID-19 | 3.94 | 7.78 |
| 真正細菌の直腸 | Firmicutes | 非COVID-19 | 3.14 | 6.78 |
| ルミノコッカスブロミ | Firmicutes | 非COVID-19 | 2.19 | 5.73 |
| 未分類のサブドリグラニュラム | Firmicutes | 非COVID-19 | 2.39 | 4.90 |
| ビフィズス菌pseudocatenulatum | 放線菌 | 非COVID-19 | 1.94 | 3.83 |
| Faecalibacterium prausnitzii | Firmicutes | 非COVID-19 | 3.69 | 5.89 |
| Collinsella aerofaciens | 放線菌 | 非COVID-19 | 2.58 | 4.49 |
| ルミノコッカスオベウム | Firmicutes | 非COVID-19 | 1.69 | 2.40 |
| ドレアロンギカテナ | Firmicutes | 非COVID-19 | 1.09 | 1.50 |
| コプロコッカスが来る | Firmicutes | 非COVID-19 | 0.99 | 1.37 |
| Dorea formicigenerans | Firmicutes | 非COVID-19 | 1.35 | 1.53 |
炎症性サイトカイン、ケモカイン、組織損傷マーカーの血漿濃度は腸内細菌叢の構成と相関している
COVID-19感染症では、免疫系がウイルス感染に反応して炎症性サイトカインを産生する。1 COVID-19患者では腸内細菌叢が変化していること(図1)、およびいくつかの細菌種が疾患の重症度と関連していること(オンライン補足表S4)に基づいて、これらの組成変化が免疫応答の調節障害に寄与して疾患を悪化させる役割を果たすと仮定した。入院中のCOVID-19患者87人のコホートにおける腸内細菌叢組成のPCA可視化により、軽症、中等症、重症、重症群に沿った連続性が明らかになり(図2)、疾患の重症度に関連する腸内細菌叢組成の層別化が示された。次に、血漿中のサイトカイン濃度(入院時に測定。C-X-C motif ligand 10(CXCL10)、IL-10、腫瘍壊死因子-α(TNF-α)、aspartate aminotransferase(AST)、γ-glutamyl transferase(GGT)、CRP、LDH、NT-proBNPおよび赤血球沈降速度は微生物相の構成と有意に関連している(図2)(p<0.05、プロクラステス解析)。 05、Procrustes解析)。特に、これらの測定値は、より重篤な疾患状態を表す微生物叢の構成と同時に増加した。CXCL10、IL-10、TNF-α、AST、GGT、CRP、LDHおよびNT-proBNPは、より重症のCOVID-19で一般的に上昇するので2 21-23 これらの結果は、腸内細菌叢組成がCOVID-19に対する免疫反応の大きさとその後の組織損傷に関連しており、したがって疾患の重症度を調節する役割を果たす可能性を示唆している。次に、COVID-19患者で濃縮または枯渇している特定の生物種がサイトカイン濃度とどのように相関しているかを評価した。表2の最も相対的に豊富な種のリストから、COVID-19コホートで枯渇した6種がCXCL10と、5種がIL-10と、2種がTNF-αおよびC-Cモチーフリガンド2(CCL2)とそれぞれ負の相関があった(図3A-D)(p<0.05、スピアマン相関)。逆に、COVID-19コホートで濃縮されたB. doreiとAkkermansia muciniphilaの2種は、IL-1β、IL-6、C-X-C motif ligand 8(CXCL8)と正の相関を示した(図3E-G)。他の比較的少ない腸内細菌との相関は、オンライン補足表S5に示す)。
図2
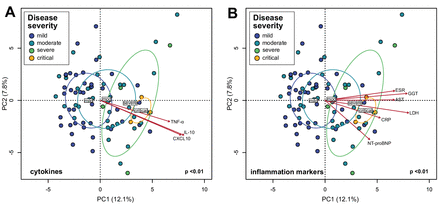
COVID-19を発症した院内患者の腸内細菌叢組成と炎症性サイトカインおよび血中炎症マーカーの血漿濃度との関連。(A)腸内細菌叢組成の主成分分析(PCA)とサイトカイン/ケモカインの血漿中濃度との関連性。(B)腸内細菌叢の構成と血中炎症マーカーとの関連性をPCAで解析。統計的相関はProcrustes検定を用いて決定した。腸内細菌叢の組成と有意に相関するサイトカインおよび炎症マーカーのみを示す。赤い矢印は、対応するサイトカイン/炎症マーカー濃度の勾配を表し、これらの指標の最大増加の方向を指す。円の色は疾患の重症度グループを表し、楕円はグループセントロイドのSDを表す。グループのセントロイドはグループのラベルで示されている。AST、アスパラギン酸アミノトランスフェラーゼ、CRP、C反応性蛋白、ESR、赤血球沈降速度、GGT、γ-グルタミルトランスフェラーゼ、LDH、乳酸脱水素酵素、NT-proBNP、N-末端-pro-脳ナトリウム利尿ペプチド、TNF、腫瘍壊死因子
図3
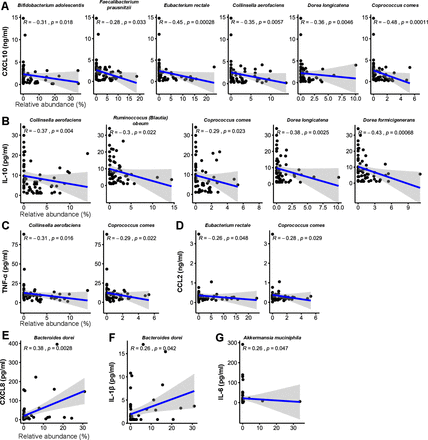
COVID-19濃縮/欠失腸内細菌分類と血漿中の(A)CXCL10、(B)IL-10、(C)TNF-α、(D)CCL2、(E)CXCL8、(F)IL-1βおよび(G)IL-6の濃度間の相関関係。統計的に有意な相関関係のみを示す。線形回帰線は各散布図に青色で示され、斜線領域は95%CIを表す。CCL, C-C motif ligand; CXCL, C-X-C motif ligand; TNF, tumour necrosis factor(腫瘍壊死因子).
SARS-CoV-2が消失した後も腸内細菌叢の異常は持続する
COVID-19患者の中には、回復後も症状が持続したり、その後、多系統の炎症を発症する者がいることから27、COVID-19患者に見られる腸内細菌叢の異常が回復後も続き、これらの症状に寄与している可能性があると仮定した。COVID-19からの回復後の腸内細菌叢の構成を評価するために、鼻咽頭吸引またはスワブがRT-qPCRによってSARS-CoV-2陰性と判定されてから30日(中央値6日、IQR14日)までの患者27人(女性13人から男性14人、45.6±17.6歳(平均±SD))の便サンプル42を収集した。非COVID-19被験者と比較して、回収された27名の腸内細菌叢の組成は、抗生物質の投与の有無にかかわらず、有意に異なっていた(p<0.05、PERMANOVA)(14名が抗生物質を投与、13名が非投与)、ただし、抗生物質を投与した患者の方が投与しなかった患者より非COVID-19被験者と類似の組成であった(図4)。回復した患者の腸内細菌叢は、抗生物質の投与の有無にかかわらず、Bifidobacterium dentiumやLactobacillus ruminisなどの種に富み、E. rectale、R. bromii、F. prausnitzii、Bifidobacterium longumに枯渇していた(p<0.05、LEFSe)(表3;オンライン補足表S6)。抗生物質がCOVID-19患者の疾患転帰の改善と関連しているかどうかを明らかにするために,抗生物質の投与を受けた/受けていない患者数が同程度である中等症コホートでの使用を検討した(中等症患者45人中21人が抗生物質を投与されていた).その他の病態における使用状況は,あまりバランスが取れていなかった(表1)。COVID-19の症状発現から退院までの日数については,抗生物質の有無による差は認められなかった(p>0.05,Mann-Whitney検定).また,45名の患者には菌血症や血液培養の記録がなく,入院中のプロカルシトニンは1名を除き0.2ng/mL以下であったことから,細菌性の併発がないと仮定すると抗生物質は患者の予後改善につながりにくく,逆にCOVID-19患者の腸内細菌叢異常を悪化させ長引かせる可能性が示唆された.
図4
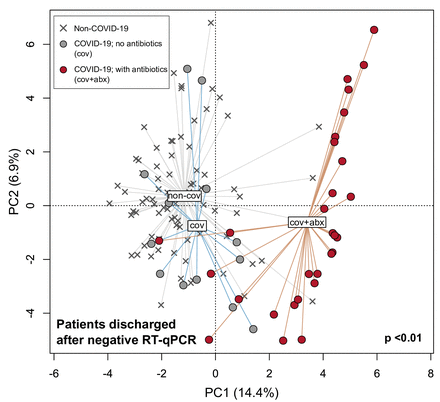
抗生物質の投与を受けたCOVID-19回復患者と受けていない非COVID-19患者における腸内細菌叢組成の主成分分析。患者は、鼻咽頭スワブ中のSARS-CoV-2 RNAの定量的逆転写PCR(RT-qPCR)検査が陰性だった場合に回復したとみなされた。塗りつぶした円は退院後に採取したすべての便を表し、十字は非COVID-19患者を表す
表3 回復後のCOVID-19患者に関連する細菌種
| 種族† | 平均相対存在量(%)* | |||
| アソシエーションクラス | 非COVID-19 | COVID-19(新型コロナウイルス感染症; 抗生物質なし | COVID-19(新型コロナウイルス感染症; 抗生物質で | |
| ビフィズス菌デンティウム | COVID-19(新型コロナウイルス感染症) | 0.03 | 0.42 | 3.27 |
| ラクトバチルス・ルミニス | COVID-19(新型コロナウイルス感染症) | 0.00 | 0.93 | 2.56 |
| Parabacteroides distasonis | COVID-19(新型コロナウイルス感染症) | 0.17 | 0.51 | 2.51 |
| エンテロコッカス・フェカーリス | COVID-19(新型コロナウイルス感染症) | 0.21 | 0.00 | 3.19 |
| 未分類のパラバクテリオ | COVID-19(新型コロナウイルス感染症) | 0.11 | 0.25 | 2.25 |
| クロストリジウム・ボルテエ | COVID-19(新型コロナウイルス感染症) | 0.08 | 0.16 | 1.69 |
| クロストリジウムシンビオサム | COVID-19(新型コロナウイルス感染症) | 0.02 | 0.15 | 1.16 |
| ベイロネラparvula | COVID-19(新型コロナウイルス感染症) | 0.01 | 0.02 | 1.24 |
| 真正細菌の直腸 | 非COVID-19 | 6.78 | 4.73 | 0.19 |
| ルミノコッカスブロミ | 非COVID-19 | 5.73 | 2.66 | 0.25 |
| Faecalibacterium prausnitzii | 非COVID-19 | 5.89 | 4.71 | 1.12 |
| ビフィズス菌pseudocatenulatum | 非COVID-19 | 3.83 | 0.77 | 0.11 |
| 未分類のサブドリグラニュラム | 非COVID-19 | 4.90 | 1.78 | 1.09 |
| Collinsella aerofaciens | 非COVID-19 | 4.49 | 2.90 | 0.61 |
| ビフィドバクテリウムロンガム | 非COVID-19 | 5.82 | 5.60 | 2.01 |
| ルミノコッカスsp51 39BFAA | 非COVID-19 | 3.90 | 5.40 | 0.63 |
| ルミノコッカスオベウム | 非COVID-19 | 2.40 | 1.48 | 1.00 |
| プレボテラコプリ | 非COVID-19 | 1.99 | 3.48 | 0.01 |
| コプロコッカスが来る | 非COVID-19 | 1.37 | 0.80 | 0.13 |
| Dorea formicigenerans | 非COVID-19 | 1.53 | 1.19 | 0.23 |
| ドレアロンギカテナ | 非COVID-19 | 1.50 | 1.79 | 0.14 |
| Alistipes putredinis | 非COVID-19 | 1.19 | 0.97 | 0.18 |
| ストレプトコッカスサリバリウス | 非COVID-19 | 1.27 | 2.53 | 0.45 |
| ユーバクテリウム・ハリイ | 非COVID-19 | 1.08 | 1.77 | 0.23 |
考察
SARS-CoV-2感染の病態は、一部の患者に見られる多臓器不全の原因に強く関与する攻撃的な炎症反応によって特徴付けられるため、疾患の重症化は、ウイルス感染だけでなく、宿主免疫反応にも起因していると考えられる1。21 28-30 ここで我々は、入院中のCOVID-19患者の腸内細菌叢組成が、いくつかのサイトカイン、ケモカインおよび炎症マーカーの血漿濃度と相関することを示し、腸内細菌叢が宿主免疫反応を調節する役割を果たし、疾患の重症度と転帰に影響を及ぼす可能性があることを示唆している。特に、COVID-19コホートにおけるいくつかの細菌種の枯渇は、TNF-α、CXCL10、CCL2およびIL-10の濃度上昇と関連しており、COVID-19患者に関する免疫学的研究2とも一致することから、これらの枯渇した分類群が過剰な炎症の予防に役割を果たす可能性があることが示唆される。この推測を裏付けるように、B. adolescentis、F. prausnitzii、E. rectale、R. (Blautia) obeum、D. formicigeneransなどの枯渇した腸内常在菌は、他の炎症関連疾患における宿主炎症反応の抑制と別々に関連していた24-26。例えば、F. prausnitziiは、抗炎症サイトカインIL-10を分泌するヒト大腸制御性T細胞のプライミングを誘導することが示されており31、E. rectaleの腸内の相対量が高いとアルツハイマー病における炎症の軽減と関連しており32、B. adolescentisは炎症性サイトカインの発現を促進する核因子κBの活性化を抑制できることが示されている33。さらに、COVID-19にRuminococcus gnavus、Ruminococcus torques、Bacteroides dorei、Bacteroides vulgatusが濃縮されていることも、微生物を介した免疫調節異常の推論と一致する。しかし、COVID-19に豊富に含まれる炎症関連腸内細菌が、実際に疾病に積極的に関与しているのか、あるいは単に他の腸内細菌の枯渇により日和見的に繁殖しているのかは、まだわかっていない。
COVID-19において腸内細菌が果たす潜在的役割は、小児における重症化または多系統炎症および川崎様疾患などの下流炎症症状のリスクを有する個人を特定するために、微生物に基づくリスクプロファイルを用いることができるかもしれない4 6 37。本研究で調査したSARS-CoV-2治癒後最大30日間の複数の患者から、COVID-19からの回復後も腸内微生物相は大きく変化する可能性が高いと考えられる。COVID-19の回復した患者の一部は、疲労、呼吸困難、関節痛などの症状が持続し、中には最初の症状発現から80日以上経過しているという報告に照らして、27 38 39腸内細菌叢の異常がCOVID-19後の免疫関連の健康問題に寄与している可能性を我々は仮定している。我々の短い追跡期間では、腸内細菌叢の組成を長期的に持続する症状に外挿することはできない。したがって、COVID-19患者のより長い追跡調査(例えば、ウイルス除去後3カ月から1年)が、回復後の腸内細菌叢異常の期間、細菌叢異常と長期持続的症状との関連、特定の腸内微生物の異常または濃縮/欠乏が回復者に将来の健康問題を誘発するかどうかに関する疑問を解決するのに必要とされる。
本研究には、COVID-19と関連する微生物シグネチャーを混乱させる可能性のある異種患者の臨床管理など、いくつかの欠点がある。適切に管理された研究のためには、各疾患重症度グループに十分な代表者がいて、治療間の変動が最小である均質なケースコントロールコホートが必要であるが、これらの理想は現実世界では不可能であろう。そのため、COVID-19のアウトカムとしての腸内細菌叢組成が、臨床管理によってどの程度影響を受けるかは不明である。さらに、観察された腸内細菌叢組成は、疾患の重症度に直接関与するというよりも、単に患者の健康状態や免疫状態に対する反応である可能性があり、そのためCOVID-19以外の被験者の疾患感受性を予測するのに直接適用できない可能性がある。抗生物質の使用に関連する患者の転帰を解釈する際にも注意が必要である。COVID-19患者の半数から4分の3は、細菌感染症が7%未満であるにもかかわらず、経験的に抗生物質を投与されていると推定される40 41。我々は、抗生物質の有無による転帰の差を認めず、COVID-19患者の管理における不必要な抗生物質を抑制するよう求める声を支持するが、このサブ集団の患者数がより同等であるために比較対象を軽症患者に限定している。抗生物質が患者の予後を改善しないことを示唆しているが、重症患者や重篤な患者において抗生物質投与が多いことが炎症を悪化させる可能性もある42。最後に、腸内細菌叢の組成はヒト集団間で非常に不均一であり、今回報告した組成の変化が他の生物地理的地域のCOVID-19患者に必ずしも反映されない可能性がある。しかしながら、免疫調節障害に関連する腸内細菌叢の変化に関するこの調査により、COVID-19における宿主の炎症反応の調節に腸内細菌が関与している可能性が高いことが明らかになった。腸内細菌が腸内外の炎症性疾患と関連していることを示す証拠が増えてきており、12 43 これらの知見は、ヒトの免疫機能や全身性炎症における腸内細菌の特異的な役割を理解することが急務であることを強調している。
