Contents
ncbi.nlm.nih.gov/pmc/articles/PMC7458798/
The Antitumor Potentials of Benzimidazole Anthelmintics as Repurposing Drugs
Immune Netw.2020 Aug; 20(4): e29.
2020年8月4日オンライン公開。
PMCID: PMC7458798
PMID:32895616
要旨
難治性腫瘍細胞の発生は、細胞増殖、遊走、浸潤、転移、生存を促進するメカニズムを活性化することにより、癌の治療効果を制限する。ベンゾイミダゾール系駆虫薬は、ヒトおよび獣医学の両分野で寄生虫を駆除する広範な作用を有する。
ベンゾイミダゾール系駆虫薬は抗寄生虫薬であるだけでなく、微小管重合阻害作用、アポトーシス誘導作用、細胞周期(G2/M)停止作用、血管新生阻害作用、グルコース輸送阻害作用などの抗がん作用を示すことが知られている。これらの抗腫瘍効果は、承認された治療法に耐性を持つがん細胞にまでおよび、従来の治療薬と併用することで、抗がん作用を高め、アジュバントとして有望視されている。とりわけ、これらの駆虫薬は、抗寄生虫薬として使用されてきた長い歴史が示すように、癌を治療するための広範で安全なスペクトルを提供する可能性がある。
本総説では、アルベンダゾール、パルベンダゾール、フェンベンダゾール、メベンダゾール、オキシベンダゾール、オキシフェンダゾール、リコベンダゾール、フルベンダゾールなどのベンズイミダゾール系駆虫薬の抗癌効果について、癌細胞株、動物腫瘍モデル、臨床試験における中心的な文献を要約した。この総説は、治療の選択肢を増やし、従来の治療による副作用を減らすことによって、がん患者のQOLを改善する方法について貴重な情報を提供している。
キーワード ベンズイミダゾール、駆虫薬、がん、治療薬
はじめに
ベンゾイミダゾール系駆虫薬は、ベンゾイミダゾールという化学構造を持ち、幅広い駆虫活性を有することから、ヒトおよび獣医学の両分野において、体内寄生虫の駆除に広く使用されている。ベンゾイミダゾール系駆虫薬は安価で効能が高いため、1960年代に導入されて以来、世界中で使用されている(1)。ベンゾイミダゾール系駆虫薬は重篤な副作用がなく忍容性が高く、数十年にわたる使用実績からヒトにおける安全性の根拠が得られている。ベンゾイミダゾール系駆虫薬は寄生虫のβ-チューブリンに選択的に結合し、寄生虫を動けなくして死に至らしめる。ベンゾイミダゾール系駆虫薬と線虫のチューブリンとの結合は、哺乳類のそれと比較して250-400倍の阻害率を示し(2)、寄生虫に対する選択的毒性を示している。微小管と選択的に相互作用することから、ベンゾイミダゾール系駆虫薬は、薬剤の再利用を目的として、チューブリンの重合を阻害する抗腫瘍剤として広く研究されている。本総説では、ヒトまたは動物用の以下のベンズイミダゾール系駆虫薬の抗腫瘍効果に焦点を当てる:アルベンダゾール、パルベンダゾール、オキシベンダゾール、リコベンダゾール、メベンダゾール、フェンベンダゾール、オキシベンダゾール、フルベンダゾール(図1)。
図1 ベンズイミダゾール系駆虫薬の構造。
化学療法や放射線療法を含む従来のがん治療は、正常細胞死、神経毒性、心毒性、消化管毒性、免疫抑制などの重篤な毒性作用を有し、その結果、がん患者のQOLを低下させるようである(3)。さらに、化学療法薬には耐性があり、最終的には細胞毒性作用が回避されることがほとんどである。
ベンズイミダゾール系駆虫薬は、パクリタキセルやドキソルビシン耐性のがん細胞を阻害し(4)、多剤耐性を克服する効果があることが知られている。ベンゾイミダゾール系駆虫薬は、がん細胞に対する抗腫瘍活性に基づき、従来の治療法と併用することでアジュバント療法やネオアジュバント療法を提供し、治療の成功率を高め、再発リスクを低下させる可能性がある。
ベンズイミダゾール系駆虫薬は安全性が高いので、併用療法では化学療法薬の投与量を調節してこれらの駆虫薬を高用量投与することにより、従来療法の毒性作用を減少させることができる。
しかし、すべてのベンズイミダゾール系駆虫薬は水溶性が低く、消化管からの吸収が悪い。ベンズイミダゾール系駆虫薬のバイオアベイラビリティが低いため、脂肪分の多い食事と併用することで吸収が著しく改善する可能性がある(5)。ベンズイミダゾール系駆虫薬のバイオアベイラビリティの低さを克服するための戦略として、リポソーム、ナノ粒子、シクロデキストリンなどの様々な製剤を採用することで抗腫瘍効果を高めることができる。この総説では、細胞株、動物腫瘍モデル、臨床試験におけるベンズイミダゾール系駆虫薬の抗腫瘍活性について取り上げている。最後に、ベンゾイミダゾール系駆虫薬の薬物動態学的特性および副作用について、総説やウェブサイトに基づいて簡潔にまとめ、がん領域におけるベンゾイミダゾール系駆虫薬の使用を改善するための基本的理解を提供する。なお、抗がん剤,抗菌剤,抗糖尿病剤など、他の目的で開発されたベンゾイミダゾール誘導体については、スコープ外であるため、本総説では除外した。
ベンゾイミダゾール系駆虫薬の癌細胞に対する抗腫瘍効果
Supplementary 表Table (4,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80)は、ベンゾイミダゾール系駆虫薬のがん細胞株に対する抗腫瘍原性をまとめている。ベンゾイミダゾール系駆虫薬は様々な機序で癌の進行を阻害する。ベンゾイミダゾール系駆虫薬の最も一般的な抗腫瘍効果としては、細胞生存率、遊走、浸潤の阻害、コロニー形成の減少、チューブリン重合の阻害、アポトーシスおよびオートファジーの誘導、サブG1、G2/M細胞周期停止の増加、分化および老化の誘導、多核化、血管新生の減少、薬剤耐性およびトランスポーターの阻害、グルコース利用障害などが挙げられる。ベンズイミダゾール系駆虫薬は、様々な癌細胞株において細胞生存率を阻害することが示されており、有望な薬剤として注目されている(14)。フルベンダゾールの半量最大阻害濃度(IC50)は、461の癌細胞株でよく報告されている。フェンベンダゾールの5μM以上の細胞増殖阻害は以下の通り:乳がんの肝細胞がん(HCC)70、HCC1143、HCC1937、MCF-7細胞、神経膠腫のLN405、TU132、U138MG、U87MG細胞、肝細胞がんのHUH6 clone5、HUH7、SK-HEP-1細胞;白血病ではP12-ICHIKAWA細胞、肺がんではDMS79、H2228、NCI-H146細胞、髄芽腫ではONS76細胞、横紋筋肉腫ではRh28細胞、尿路上皮がんではT24細胞であった(14)。これらの結果は、一部の癌細胞株はベンズイミダゾール系駆虫薬に対して感受性が低い可能性を示している。同じ細胞株であっても、ベンズイミダゾール系駆虫薬によってIC50に違いがあり、またIC50を評価した研究室にも違いがある(補足表1)。耐性および感受性のがん細胞を同定することは、がん種におけるベンズイミダゾール駆虫薬の治療応用にとって極めて重要である。正常なヒト肺線維芽細胞やヒト臍帯静脈内皮細胞は、肺癌細胞に比べてメベンダゾールに対する感受性が低い(56,57)。メベンダゾールは、副腎皮質がん細胞と比較して、正常線維芽細胞には影響を及ぼさなかった(79)。フルベンダゾールの阻害効果は、大腸がん細胞と比較して、正常ヒト肝細胞と心筋細胞では限定的であった(34)。フェンベンダゾールは、正常ヒト気管支上皮細胞、正常不死化ヒト前立腺細胞、およびマウス初代線維芽細胞では、肺がん細胞と比較してほとんど効果を示さなかった。フェンベンダゾールのIC50値は、がん細胞株と比較して、これらの正常細胞では数倍高かったからである(38)。これらの結果は、ベンズイミダゾール系駆虫薬は正常細胞には比較的無毒であり、がん細胞に対する特異的感受性を高めることを示している。ベンズイミダゾール系駆虫薬は通常、リン酸化(p)HER2/3、PI3K/プロテインキナーゼB(AKT)、急速加速線維肉腫(3つのセリン/スレオニン特異的プロテインキナーゼのファミリー)(RAF)/MEK/ERK、mTOR、Ki-67など、細胞の増殖と生存に関連するシグナル伝達タンパク質を減少させた。興味深いことに、フェンベンダゾールはキルステンラット肉腫ウイルス癌遺伝子相同体(KRAS)変異肺癌細胞においてPI3K/AKTとRAF/MEK/ERKを阻害したが、KRAS野生型H-1650肺癌細胞では細胞生存率は阻害されたものの効果はなかった(53)。フェンベンダゾールはまた、いくつかのp53変異型肺がん細胞では細胞生存率に影響を及ぼさなかった(55)。これらの所見は、癌細胞における突然変異の状態がベンズイミダゾール系駆虫薬の感受性に異なる影響を与える可能性を示している。
MAPKシグナルのうち、ベンズイミダゾール系駆虫薬はERKの活性化を抑制したが(14,51)、p38とc-Jun N末端キナーゼ(JNK)の活性化を増加させた(38,55)。ベンズイミダゾール系駆虫薬はELK1/血清反応因子(SRF)を増加させてFosファミリーを活性化したため、AP-1も活性化されたが、これは活性化されたFosファミリーによってpJNKが増加し、Junファミリーが活性化されたためと考えられる(45)。
ベンズイミダゾール系駆虫薬は、上皮間葉転換(EMT)に関連する細胞の遊走と浸潤を阻害した。ベンズイミダゾール系駆虫薬は、N-カドヘリン、ビメンチン、FAK、マトリックスメタロプロテアーゼ(MMP)2を減少させ、間葉期の阻害に続いて転移の抑制につながった。ベンズイミダゾール系駆虫薬はがん細胞のβ-チューブリンを減少させた。寄生虫のチューブリンは哺乳類のチューブリンに比べて250-400倍阻害されるが(2)、ベンズイミダゾール系駆虫薬はがん細胞で広くチューブリン重合を阻害し、急速に分裂する細胞で致死的効果をもたらした。チューブリンの重合阻害は、がん細胞に多核化と分裂の破局をもたらす。興味深いことに、アルベンダゾールはHCT116結腸直腸癌細胞において、細胞生存率が阻害されたにもかかわらず、チューブリン重合阻害作用を示さなかった(36,37)。
ベンゾイミダゾール系駆虫薬は、微小管関連タンパク質1軽鎖3(LC3)やベクリン-1などのオートファジータンパク質を増加させるため、オートファジーを誘導する。メベンダゾールは内皮細胞でオートファジーを誘導し(81)、Wnt/β-カテニン軸とVEGFR-2レベルの減少を介して血管新生活性を損なう可能性が高い(82)。オートファジーは腫瘍形成制御において二重の役割を担っている(83)。オートファジーは腫瘍形成初期には細胞の生存を促進するが、腫瘍形成後にはmTORとROSのダウンレギュレーションを通じて腫瘍の促進を抑制する(83,84)。オートファジーは、TGF-1β依存性の上皮間葉転換を通じて、がん幹細胞の浸潤を促進する(85)。しかしながら、オートファジー阻害剤は、臨床試験において生存率の改善を示していない(86)。ベンゾイミダゾール系駆虫薬がオートファジーを誘導するメカニズムを明らかにするためには、さらなる研究が必要である。
とりわけ、ベンズイミダゾール系駆虫薬は、サブG1期、カスパーゼ-3/7/8/9活性および切断ポリ(ADP-リボース)ポリメラーゼ(PARP)、B細胞リンパ腫2(Bcl-2)関連Xタンパク質(Bax;プロアポトーシス)、シトクロムc、p53 upregulated modulator of apoptosis(PUMA)、γH2AXを減少させ、Bcl-2(抗アポトーシス)、切断型Bid(プロアポトーシス)、pBAD(抗アポトーシス)、骨髄細胞因子-1(Mcl-1)、X-linked inhibitor of apoptosis protein(XIAP)、サバイビンを減少させた(14,46)。
ベンズイミダゾール系駆虫薬は、細胞周期において、ホスホ-ヒストンH3(pH3)、サイクリンB1、p27Kip1を増加させ、サイクリンA、サイクリンD1、サイクリンE、CDC25c、プロテインホスファターゼ2A(PP2A)cαを減少させることにより、G2/M期を特異的に停止させた(68)。パルベンダゾールはG2/M期を停止させたが、膵がん細胞ではサイクリンB1を減少させた(68)。ベンズイミダゾール系駆虫薬は、低酸素誘導性因子(HIF)-1αやVEGFなどの血管新生関連タンパク質を減少させた(54)。ベンズイミダゾール系駆虫薬は分化と老化を誘導し、ケラチン18とp53癌抑制因子を増加させた。p53野生型癌細胞はp53変異細胞と比較して、ベンズイミダゾール駆虫薬に対して高い感受性を示す(38)。ベンズイミダゾール系駆虫薬はpp53、p53、p21を増加させたが、変異型p53、マウス二重分2ホモログ(Mdm2;時に増加)、マウス二重分4(MdmX)、CDK4、CDK6、pRBを減少させた(22,23,58,59)。
ベンズイミダゾール系駆虫薬は、小胞体ストレスマーカーとして、ユビキチン化タンパク質の蓄積や活性酸素レベルの上昇、C/EBP相同タンパク質(CHOP)、活性化転写因子(ATF)4、カスパーゼ-4/12を介した細胞ストレスを誘導する(72)。
また、ウイルス遺伝子v-myc(c-MYC)とのヒト相同性、OCT4、SRY(性決定領域Y)-box 2(SOX2)、NANOG、アルデヒド脱水素酵素1(ALDH1)活性、幹様細胞としてのCD24low/CD44highおよびCD24high/CD49high亜集団、幹細胞マーカーとしてのCD44の減少に起因して、がん細胞のコロニー形成を減少させ、幹細胞性を阻害した(20)。
ベンズイミダゾール系駆虫薬はグルコース利用を阻害し、グルコーストランスポーター(GLUT)-1、ATP産生、低酸素誘導解糖、GLUT-4、ヘキソキナーゼIIを減少させた。これらの減少は、ベンズイミダゾール系駆虫薬が癌におけるワールブルグ効果を阻害する可能性を示している。さらに、ベンズイミダゾール系駆虫薬は、ワールブルグ効果を負に制御するAMP活性化プロテインキナーゼ(AMPK)の活性化を増加させた(15)。しかしながら、フェンベンダゾールはOCI-AML2白血病細胞のグルコース取り込みに変化を示さなかったことから(30)、グルコース代謝に対するベンズイミダゾール系駆虫薬の作用は細胞型特異的であることが示された。ベンズイミダゾール系駆虫薬は、MDR1、ABCB1、ABCC1、SLC47A1、p62などの薬剤耐性やトランスポーターに関連する遺伝子を阻害した(41,42,43)。
ベンゾイミダゾール系駆虫薬は、NF-κBのphospho-p65と核内移行を減少させ、Nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor, alpha (IκBα)の半減期を増加させることにより、NF-κBシグナルを阻害した。しかしながら、アルベンダゾールによって誘導されたサーチュイン3(SIRT3)の分解は、活性酸素を介したp38 MAPKの活性化を引き起こし、ピルビン酸キナーゼM2を介したトリステトラプロリン(TTP)の分解を引き起こし、続いてヒト白血病細胞におけるTNF-αのアップレギュレーションを引き起こした(46)。ベンズイミダゾール系駆虫薬はヘッジホッグシグナル伝達を阻害し、転移の減少、血管新生の阻害、アポトーシスの増加につながったと考えられる。ベンズイミダゾール系駆虫薬は、pSTAT3とSTAT3の核内移行を阻害し、その結果、増殖の減少、アポトーシスの増加、血管新生の減少、幹細胞性のダウンレギュレーション、化学感受性の増加、免疫監視をもたらした(34,38)。一方、STAT1/2を増加させ、細胞死を誘導する。ベンズイミダゾール系駆虫薬はc-Srcの活性化を阻害し、腫瘍の増殖と転移を抑制した。フルベンダゾールはメラノーマ細胞のPD-1を減少させ(76)、腫瘍の増殖を抑制したと考えられる。
ベンズイミダゾール系駆虫薬はβ-カテニンを減少させ、Wnt-off状態を維持する。メベンダゾールは新規のTRAF2およびNCK相互作用キナーゼ(TNIK)阻害剤である(87)。TNIKはT細胞因子-4(TCF4)とβ-カテニン転写複合体の活性化キナーゼであることから(88)、ベンズイミダゾール系駆虫薬はTNIKを阻害することでWntシグナル伝達を阻害すると考えられる。ベンズイミダゾール系駆虫薬はAMPKの活性化を増加させ、その結果mTORが阻害され、サイクリンD1が減少し、p53とp21が増加したと考えられる。オキシベンダゾールは、前立腺ガン細胞においてマイクロRNA(miR)-24aとmiR-204を増加させた(71)。miR-24aは発達中の神経網膜においてアポトーシスを抑制したが(89)、miR-204は食道癌の浸潤とEMTを阻害した(90)。癌におけるmiRNAシグネチャーに対するベンズイミダゾール系駆虫薬の効果は、まだ未熟である。フェンベンダゾールは、シスプラチンやタキソール(IC50濃度)と比べてより効果的な細胞毒性剤であり、食品医薬品局(FDA)認可のプロテアソーム阻害剤ボルテゾミブとも同様の効果を示した(38)。ベンズイミダゾール系駆虫薬はプロテアソーム活性を低下させ、プロテアソーム阻害剤として作用した。
メベンダゾールは、非活性化PBMCではクラスター形成とサイトカイン放出にほとんど影響を与えなかったが、CD3/IL-2活性化PBMCではクラスター形成を増加させ、TNF-α、IL-1β、IFN-γ、IL-6などの炎症性サイトカインを放出し、腫瘍細胞の減少とアポトーシスを促進した(91)。メベンダゾールは、ERK1/2およびTLR8依存性のインフラマソーム活性化を介して、単球細胞(THP-1)の炎症性(M1)表現型を誘導した(48)。分化したTHP-1マクロファージは、白血病細胞におけるメベンダゾールの抑制効果を増強した。これらの結果は、ベンズイミダゾール系駆虫薬の抗がん作用を説明するのに関連するかもしれない。
ベンゾイミダゾール系駆虫薬は、化学療法や放射線療法などの従来療法に対して癌細胞を感作し、併用することで抗腫瘍効果を増強する。ベンゾイミダゾール系駆虫薬は、テモゾロミド、ビンブラスチン、フルオロウラシル、ドキソルビシン、ドセタキセル、ゲムシタビン、パクリタキセル、シスプラチン、トラメチニブとの併用で相乗的な抗腫瘍効果を示す。
エポチロン-パクリタキセル耐性の白血病細胞はアルベンダゾールに感受性である(49)。これらの事実は、ベンズイミダゾール系駆虫薬が従来の化学療法に抵抗性のがん細胞に対する補助的治療薬となる可能性を示している。しかしながら、フェンベンダゾールはEMT6マウス乳腺腫瘍細胞においてドセタキセルと併用しても細胞毒性に変化はなかった(29)。アルベンダゾールは、HCT-116結腸直腸癌細胞およびDU145前立腺癌細胞において、パクリタキセルおよびビンブラスチンとの併用で拮抗作用を示した(36)。メベンダゾールは、STU(BRAFV600K/NRASWT)メラノーマ細胞において、トラメチニブとの併用で用量依存的に拮抗的・相加的な細胞毒性を示した(75)。これらの事実は、ベンゾイミダゾール系駆虫薬の感受性のがん細胞型特異的な違いを示しており、ベンゾイミダゾール系駆虫薬と従来の化学療法との併用には注意が必要である。
動物腫瘍モデルにおけるベンゾイミダゾール系駆虫薬の抗腫瘍効果
動物腫瘍モデルにおけるベンズイミダゾール系駆虫薬の抗腫瘍原性をまとめた(補足表2)(4,8,11,12,13,14,15,16,17,20,27,28,29,30,34,35,36,37,39,45,51,52,54,55,56,57,61,63,64,65,66,69,70,71,74,75,76,78,79,80,92,93,94)。ベンゾイミダゾール系駆虫薬は動物の腫瘍増殖を抑制することが示されており、実験期間中、大きな副作用もなく忍容性も良好であった。補足表2に基づくと、動物腫瘍モデルにおけるベンズイミダゾール駆虫薬の最も一般的な抗腫瘍効果は以下のように思われる:
全生存期間および無増悪生存期間の延長;腫瘍増殖の抑制;血管形成の減少;腫瘍体積および重量の減少;転移の減少。動物腫瘍モデル(補足表2)におけるベンズイミダゾール系駆虫薬の抗腫瘍効果は、癌細胞(補足表1)におけるものと同様のメカニズムを共有している。動物腫瘍モデルにおけるベンズイミダゾール系駆虫薬の作用機序は以下の通り:ヒト上皮増殖因子受容体(HER)2、pMEK、pERK1/2、pmTOR、線維芽細胞増殖因子(FGF)2、Ki-67、増殖細胞核抗原(PCNA)の減少による腫瘍増殖抑制、LC3とベクリン-1の増加によるオートファジーの誘導;アポトーシスを誘発するために、カスパーゼ-3/9、Bax(プロアポトーシス)、DNA断片化、アポトーシス細胞(transferase dUTP nick end labeling [TUNEL]染色)、p53+細胞を増加させ、アポトーシスを誘発するためにBcl-2(抗アポトーシス)、XIAPを減少させ、細胞周期を停止させるためにpH3を増加させ、サイクリンD1を減少させ、血管新生を抑制するためにHIF-1α、VEGF、血管内皮増殖因子受容体(VEGFR)2キナーゼ活性、FGF2、CD31を減少させた;ヘキソキナーゼ(HK)、ピルビン酸キナーゼ(PK)、LDHの活性低下によるグルコース利用障害;ビメンチン、TGF-β、MMP2、MMP9、MMP2/組織メタロプロテアーゼ阻害剤(TIMP)1比の低下による間葉期抑制による転移抑制;幹細胞マーカーであるMYC、ALDH1A1、CD49f、CD44を減少させて幹細胞性を抑制し、ケラチノサイト分化マーカー、p53、p21を増加させて分化と老化を誘導し、シクロオキシゲナーゼ-2(COX-2)、TNF-α、IL-6、IL-1Bを減少させてNF-κBシグナルを抑制する。癌細胞で示されたように、動物腫瘍モデルのベンズイミダゾール系駆虫薬はpSTAT3を阻害し、腫瘍増殖の減少、アポトーシスの増加、血管新生の減少、幹細胞性のダウンレギュレーションをもたらした。また、ヘッジホッグシグナル伝達を低下させ、転移を抑制し、血管新生を阻害し、アポトーシスを増加させた。ベンズイミダゾール系駆虫薬は、G-CSF、GM-CSF、PD-1、CD11b+Gr1+骨髄由来抑制細胞(MDSC)レベルを低下させ、予後良好な腫瘍増殖を抑制した。
ベンゾイミダゾール系駆虫薬は、卵巣がんモデル(65)ではがん抗原125(CA125)、前立腺がんモデル(71)では前立腺特異抗原(PSA)などのがんマーカーを減少させたが、他のがんマーカーについてはさらなる研究が必要である。メベンダゾールは、N-ニトロソジエチルアミン(DEN)誘発肝細胞がんにおいて血清アラニンアミノトランスフェラーゼ(ALT)とα-フェトプロテイン(AFP)を減少させ(51)、肝機能、炎症、線維形成を改善した。オキシベンダゾールは前立腺がんにおいてmiR-24aとmiR-204を増加させたが(71)、がんにおけるmiRNAシグネチャーに対するベンズイミダゾール系駆虫薬の効果はまだ未熟であり、ベンズイミダゾール系駆虫薬はがんの予後に影響を与える特異的なmiRNA調節因子として作用する可能性がある。
チアベンダゾール、フルベンダゾール、オクスフェンダゾール、フェンベンダゾールなど、ある種の製剤化されたメベンダゾールおよびベンズイミダゾール系駆虫薬は、脳腫瘍細胞の頭蓋内移植モデルにおける生存に影響を及ぼさなかった(92)。テモゾロミド耐性多形性膠芽腫の頭蓋内異種移植モデルは、メベンダゾールによく反応したが、アルベンダゾールには反応しなかった(8)。これらの事実は、ベンズイミダゾール系駆虫薬の構造依存性を示している。EMT6マウス乳腺腫瘍細胞の皮内モデルは、フェンベンダゾール単独でも放射線との併用でも反応しなかった(28,29)。この結果は、ベンズイミダゾール系駆虫薬が細胞型特異的に作用し、感受性と抵抗性のがん細胞を同定することを示している。BSA-アルベンダゾール(BSA-ABZ)およびアルベンダゾールのナノアルブミン製剤(Nab-ABZ)は、卵巣がんモデルにおいて腫瘍重量、腹水、VEGFを抑制したが、遊離のアルベンダゾールは効果を示さなかった(63)。アルベンダゾールの製剤依存的な有効性は、ベンズイミダゾール系駆虫薬の低い生物学的利用能を克服する手がかりとなる。さらに、フルベンダゾールはMDA-MB-435細胞マウスに腹腔内注射すると腫瘍体積を減少させたが、腫瘍内注射では減少させなかった(76)。この結果は、ベンズイミダゾール系駆虫薬の投与経路が治療応用に重要であることを示している。
ベンズイミダゾール駆虫薬は、テモゾロミド、エラクリダール、放射線、スリンダク、ビンクリスチン、ソラフェニブ、トラメチニブ、およびドセタキセルとの併用で、担癌動物の生存期間を延長した。これらの所見は、ベンズイミダゾール系駆虫薬が従来の化学療法と併用した術後補助治療薬となりうることを確認するものである。さらに、アルベンダゾールは卵巣癌モデルにおいてパクリタキセルとの相乗効果を示さなかったことから、ベンズイミダゾール系駆虫薬は治療の可能性を最大化するために通常の化学療法と慎重に併用する必要があることが示された(94)。フェンベンダゾールは、トラスツズマブ耐性JIMT-1細胞の乳腺脂肪パッドにおける腫瘍重量を減少させ、従来の化学療法に抵抗性の癌や再発癌を克服するためのベンズイミダゾール駆虫薬の可能性を示した(20)。
ベンズイミダゾール系駆虫薬の安全性プロファイルにもかかわらず、メベンダゾール単独およびビンクリスチンやエラクリダールとの併用によるいくつかの動物実験では、体重減少や神経障害などの副作用が認められた。C57BL6マウスではメベンダゾール100mg/kg連日投与で体重減少がみられたが、50mg/kg投与では副作用はみられなかった(8)。メベンダゾールとビンクリスチンの併用は、急激な体重減少を伴う神経障害の出現を増加させるようであった(11)。エラクリダールとメベンダゾールの長期投与は、体重減少と死亡率から明らかなように、マウスの毒性を増加させた(92)。これらの所見から、ベンズイミダゾール系駆虫薬の単独あるいは抗がん剤との併用については、さらなる安全性のモニタリングが必要である。以下にベンズイミダゾール系駆虫薬の副作用について述べる。
ベンズイミダゾール系駆虫薬の抗腫瘍効果に関する臨床的考察
ベンゾイミダゾール系駆虫薬の抗腫瘍性を臨床的側面からまとめた(表1)(95,96,97,98)。ベンズイミダゾール系駆虫薬の臨床試験では、がん治療への使用を評価するのに十分なデータが得られていない。ベンズイミダゾール駆虫薬は、難治性固形腫瘍、転移性腫瘍、および従来の化学療法が無効な患者に投与されていることから、原発性腫瘍に対するベンズイミダゾール駆虫薬の抗腫瘍効果を明らかにする価値がある。
表1ベンズイミダゾール系駆虫薬の臨床的抗腫瘍性
| ステージ | がんの種類 | 目的 | 方法 | 結果と現在進行中 | 参照 |
|---|---|---|---|---|---|
| フェーズ1 | 難治性固形がん患者36例 | 最大耐容量 | アルベンダゾール:1日400mg~1,200mgを3週間周期の1~14日目に経口投与。 | 1,200mg/日から2,400mg/日。 | (95) |
| 血漿中VEGFの減少 | |||||
| 腫瘍マーカーが50%以上低下した患者は16%であった。 | |||||
| 副作用:骨髄抑制、疲労、軽度の胃腸障害 | |||||
| 症例報告 | 74歳男性、転移性結腸癌 | 肺と腹部リンパ節に著明な進行が認められ、部分的に新たな肝転移が認められる場合。 | メベンダゾール:100mgを1日2回、6週間投与。 | 肺とリンパ節への転移はほぼ完全寛解、肝臓への転移は良好な部分寛解。 | (96) |
| 48歳男性、副腎皮質癌 | マイトタン、5-フルオロウラシル、ストレプトゾトシン、ベバシズマブ、放射線療法による従来の治療が無効または不耐容である場合の治療 | メベンダゾール:100mg/日、19カ月間 | 肝転移病変は退縮し、その後19カ月間安定したが、24カ月後に進行した。 | (97) | |
| 臨床的副作用はなく、QOLは満足のいくものであった。 | |||||
| フェーズ1 | 転移を伴った肝細胞癌の患者 | アルベンダゾールの評価 | アルベンダゾール:10mg/kg/日を2回に分けて28日間経口投与。 | 病状は安定したが、好中球減少のため19日目に治療を中止した | (98) |
| 転移を有する大腸癌患者8名 | カルチノエンブリオニック抗原(CEA)が2例で低下、3例で安定、2例で初期安定(5-10日)。 | (98) | |||
| 肝機能検査および腎機能検査に有意な変化はなかったが、2人の患者で好中球減少がみられた | |||||
| フェーズ1 | 高悪性度神経膠腫24例 | テモゾロミド投与を受けている新規診断高悪性度神経膠腫患者におけるメベンダゾール投与 | メベンダゾール:500mgのチュアブル錠を食事と一緒に、28日周期で毎日3回p.o.。 | 調査期間2013年4月4日~2025年9月 | |
| 場所ジョンズ・ホプキンス病院(米国メリーランド州ボルチモア | |||||
| 21 高悪性度神経膠腫 | 再発/進行性小児脳腫瘍に対するメベンダゾール療法の第I相試験 | メベンダゾール:500mgのチュアブル錠、3回に分けて食事と一緒に服用する。 | 研究期間2016年5月~2022年6月 | ||
| 場所ジョンズ・ホプキンス小児疾患院 | |||||
| 米国フロリダ州セントピーターズバーグ | |||||
| ジョンズ・ホプキンス大学医学部 | |||||
| 米国メリーランド州ボルチモア | |||||
| フェーズ1/2 | 低悪性度および高悪性度神経膠腫36例 | 小児神経膠腫に対するメベンダゾールの第I相試験 | メベンダゾール:50,100,200mg/kg/日を、低悪性度神経膠腫患者には70週間、高悪性度神経膠腫患者には48週間、p.o.およびb.d.投与する。 | 研究期間2013年10月22日~2020年4月 | |
| 所在地コーエン・チルドレンズ・メディカル・センター・オブ・ニューヨーク(米国ニューヨーク州ニューハイドパーク | |||||
| フェーズ2 | 治療不可能、進行性、致死的と考えられる悪性疾患患者250名 | 原始的変態の原理に基づく新しいがん治療(原始的化学療法)の臨床評価 | 抗菌・抗真菌・抗原虫剤:アルベンダゾールとメベンダゾールの抗がん作用 | 調査期間2011年7月から2023年12月31日まで | |
| 場所フランク・アルゲーロ癌クリニック | |||||
| メキシコ、バハ・カリフォルニア・スル、サンホセ・デル・カボ | |||||
| ゲノム医科学研究所 | |||||
| メキシコ、コアウィラ州トレオン | |||||
| フェーズ3 | ステージ4の大腸癌患者40人 | 結腸癌の補助療法としてのメベンダゾール | メベンダゾール | 研究期間2019年4月1日~2028年12月 | |
| 場所エジプト、カイロ、シェリーフ・アブド・エルサラーム | |||||
| がん患者207人 | がんに対する代謝併用療法の安全性、忍容性および有効性に関する研究(METRICS) | メベンダゾール:試験期間中、100mgをp.o.およびu.i.d.投与。 | 研究期間2017年5月22日~2022年5月22日 | ||
| 場所ケアオンコロジークリニック、ロンドン、イギリス |
b.d.は1日2回、p.o.は経口投与、u.i.d.は1日1回投与。
難治性固形癌患者36人はアルベンダゾールに耐容性を示し、2,400mg/日投与でも血漿中VEGFと腫瘍マーカーが16%減少した。骨髄抑制、疲労、軽い胃腸の不調などの副作用を経験した患者もいた(95)。
ある転移性結腸癌患者はメベンダゾールによく反応し、肺とリンパ節の転移はほぼ完全に寛解し、肝臓の部分寛解も良好であった(96)。
従来の治療が無効または不耐容の副腎皮質癌患者がメベンダゾールを19カ月間服用した。肝転移病変が退縮した患者は19カ月間安定していたが、24カ月後に進行した。臨床的副作用は認められず、QOLも満足できるものであった(97)。
転移性肝細胞癌の患者は、アルベンダゾール投与後も安定していたが、好中球減少のため19日目に治療を中止した(98)。転移性大腸癌患者8人におけるアルベンダゾールの抗腫瘍効果は以下の通りであった:2人の患者でカルサイノエムブリオニック抗原(CEA)の減少;3人の患者で安定化;2人の患者で初期安定化(5〜10日);全患者で肝機能検査および腎機能検査に有意な変化なし;2人の患者で好中球減少症(98)。ClinicalTrials.gov(https://clinicaltrials.gov)に基づき、アルベンダゾールとメベンダゾールの第1相、第2相、第3相の進行中の臨床試験をまとめた。低悪性度、高悪性度の神経膠腫、治療不可能な進行性で致死的な状態の悪性疾患、ステージ4の大腸がんなどである(表1)。肺癌のサバイバーであるジョー・ティペンズは、犬の駆虫薬としてフェンベンダゾールを使用し、末期の小細胞肺癌を消滅させた(https://www.dailymail.co.uk/health/article-6965325/Oklahoma-grandfather-claims-drug-DOGS-cured-cancer-tumor-free.html)。動物用フェンベンダゾールはヒトへの安全性はまだ確立されていない。アルベンダゾールとメベンダゾールは、他のベンズイミダゾール系駆虫薬よりもヒトへの使用が承認されているため、優先的に臨床試験が行われている。近い将来の臨床試験により、ベンゾイミダゾール系駆虫薬が癌治療のアジュバントおよびネオアジュバント治療薬として使用できるかどうかが明らかになるだろう。
ベンズイミダゾール系駆虫薬の薬物動態学的特性と副作用
ベンゾイミダゾール系駆虫薬はヒトおよび動物用として長い歴史があり、その薬物動態学的特性および副作用は多くの研究により確立されている。表2(5,99,100,101,102,103,104,105,106,107,108,109,110)は、抽出した文献レビューやwww.drugs.com、PARASITIPEDIA.netなどのウェブサイトを用いて、ベンズイミダゾール系駆虫薬の薬物動態学的特性と副作用を簡潔にまとめたもので、これらの駆虫薬をがん治療に再利用する場合のいくつかの問題点を強調している。
表2ベンズイミダゾール系駆虫薬の薬物動態学的特性と副作用
| 医薬品 | 投与量 | 薬物動態学的特性 | 副作用 | 参考までに。 |
|---|---|---|---|---|
| アルベンダゾール FDA承認(1996):カテゴリーC | ヒトおよび動物用、エキノコックス感染症に400mg/日を1~6カ月間、p.o.およびb.d.投与。 | 吸収:溶解性と吸収性が悪い(ヒトで5%未満、ウシで50%未満);脂肪分の多い食事と一緒に投与すると5倍まで増加する。 | 一般的:頭痛、肝酵素上昇を伴う肝毒性 | (5,99,100,101,102) |
| 分布:尿、胆汁、肝臓、嚢胞壁、嚢胞液、髄液など全身に広く分布する。 | 少数:腹痛、吐き気、嘔吐、発熱、じんましんやそう痒症などの過敏反応 | |||
| 代謝:肝初回通過効果;活性代謝物アルベンダゾールスルホキシドと最終的に不活性アルベンダゾールスルホンへの急速なスルホキシド化、加水分解、酸化 | まれ:脱毛症、毛細血管拡張症 | |||
| 排泄:尿(活性代謝物として1%未満)および糞便、肝クリアランス=18.2 ml/分/kg | その他:白血球減少、貧血、血小板減少、汎血球減少 | |||
| 血清中のアルベンダゾールスルホキシドのピークまでの時間=2-5時間 | 妊娠中は避けること:ラットの子孫に催奇形作用が認められたが、妊娠中の患者にアルベンダゾールを投与しても催奇形性リスクの増加は認められなかった。 | |||
| アルベンダゾールスルホキシドのt1/2 = 8-12 h | ヒトにおけるアルベンダゾールの通常の治療使用には異数性のリスクはない。 | |||
| タンパク質結合=70 | ||||
| 1974年に米国で承認されたメベンダゾール | ヒトおよび動物用 | 吸収:溶解性と吸収性が悪く、ヒトでは5%~10%、高用量投与後は1%~2%:Vd = 1-2 L/kg | メベンダゾールの駆虫スペクトラムと副作用プロファイルはアルベンダゾールとほぼ同じである。 | (5,101,103,104) |
| 専門家の中には、次のように勧めている人もいる:トリコシドーシスに対しては、200 ~400mgを3日間、p.o.およびt.i.d. で投与し、その後400 ~500mgを10日間、 p.o.およびt.i.d. で投与する。 | 代謝:ケト還元と脱カルバミル化を伴う肝第一通過代謝が広く行われ、その後抱合代謝が行われる。 | 比較的毒性が低く、忍容性が高い。 | ||
| 排泄:主に糞便(未変化体および一次代謝物として)および尿(2%未満) | 副作用はまれで、胃腸の不調、発熱、下痢、腹痛、不快感、鼓腸、下痢、発疹、蕁麻疹、血管浮腫などの過敏性反応などがある。 | |||
| t1/2 = 3-6 h | 高用量は貧血と肝毒性を誘発し、まれに好中球減少症、骨髄形成不全、脱毛症を起こすことがある。 | |||
| タンパク質結合 = 90%-95 | げっ歯類は高用量で胎児毒性および催奇形性を示したが、ウサギ、ウマ、ヒツジ、ブタなど他の動物種には見られなかった | |||
| 血液脳関門を通過する | 妊娠禁忌 | |||
| 試験管内試験および生体内試験の実験では異数性であったが、従来の治療を受けているヒトに対するリスクとは考えられていない。 | ||||
| フェンベンダゾール | 動物用 | 代謝:広範な肝ファーストパスにより、活性代謝物フェンベンダゾールスルホキシド(活性型)、最終的にフェンベンダゾールスルホンに至る。 | げっ歯類では無毒の薬剤:LD50は10g/kgを超える(治療レベルの1,000倍量) | (105,106) |
| 排泄:主に糞便と尿 | ラットを用いた生涯試験:発がん性なし、母体および生殖毒性なし | |||
| ラットにおける肝細胞肥大と過形成の形態学的変化 | ||||
| マウスでは副作用は観察されなかった | ||||
| イヌと鳥類では骨髄抑制が見られるが、げっ歯類では見られない | ||||
| リコベンダゾール(アルベンダゾールスルホキシド) | 吸収:生物学的利用能が低く、水溶性が高い | リコベンダゾールはアルベンダゾールの主要代謝物であり、アルベンダゾールと同様の副作用がある。 | (5,105) | |
| 牛と羊のVd = 0.67-1.2 L/kg | ||||
| 代謝:吸収されたオックスフェンダゾールは、肝臓とルーメンの両方でアルベンダゾールに部分的かつ可逆的に還元される。 | ||||
| 排泄:便と尿 | ||||
| t1/2 = 8-12時間(男性 | ||||
| タンパク質結合=70 | ||||
| 血液脳関門を通過 | ||||
| リコベンダゾールのエナンチオマーは薬物動態プロファイルに種差がある | ||||
| オキソフェンダゾール(フェンベンダゾールスルホキシド) | 動物用 | 水溶性の向上 | ほとんどの種で耐性がある | (105,107) |
| 全身への分布 | 大量経口投与後の中毒の主な症状:食欲不振、下痢、発熱、けいれん、吐き気、嘔吐、痙攣 | |||
| 代謝:吸収されたオクスフェンダゾールは、肝臓とルーメンの両方でフェンベンダゾールに部分的かつ可逆的に還元される。 | 肝血栓や心外膜血栓も起こりうる。 | |||
| 排泄:反芻動物では80%が胆汁と糞便を通じて排泄される。 | マウスにおける変異原性、胚毒性、催奇形性 | |||
| ヒトでt1/2=8~12時間)。 | ||||
| オキソフェンダゾールのエナンチオマーは薬物動態プロファイルに種差がある | ||||
| フルベンダゾール | 動物用 | 吸収:低い生物学的利用能 | 副作用なく忍容性良好 | (108) |
| 代謝:カルバミン酸加水分解およびケトン還元による不活性代謝物への広範なファーストパス | 妊娠中または授乳中の女王や、1歳未満の子犬には使用しない。 | |||
| 排泄:p.o.投与量の80%以上が糞便中に排出され、未変化体の尿中への排出はごく微量(0.1%未満)である。 | ||||
| 組織中のt1/2 = 1~2日 | ||||
| オキシベンダゾール | 動物用 | 吸収:バイオアベイラビリティは低いが、ヒツジとヤギでは治療用量を3日連続で分割投与することでバイオアベイラビリティが向上(各日とも推奨用量の1/3) | ほとんどの種で耐性がある | (109) |
| 代謝:情報は少ないが、肝臓で分解され、駆虫活性のない代謝物になると予想される。 | マウス(体重4~32 g/kg)、ヒツジ(230~600 mg/kg)、ウシ(600 mg/kg)の単回経口投与による急性毒性はない。 | |||
| ウシ(30~75 mg/kg/日)およびヒツジ(10~50 mg/kg/日)において、5日間の反復投与で亜急性毒性なし | ||||
| ラットおよびイヌで3~30mg/kg、98日間投与しても慢性的な影響はない | ||||
| 妊娠中のマウス、ラット、ヒツジには 30 mg/kg で、ウシには 75 mg/kg で催奇形性はない | ||||
| 大量経口投与後の主な症状:嘔吐、抑うつ、震え | ||||
| パルベンダゾール | 動物用 | 血中濃度のピーク=投与6~8時間後 | 妊娠中の動物には禁忌:催奇形性は主に骨格系である。 | (110) |
| 緩下(軟便/下痢)、食欲不振、無気力 |
LD50:致死量(50%);p.o.:経口投与;t1/2:半減期時間;t.i.d.:1日3回;Vd:分布容積。
ベンズイミダゾール系駆虫薬の一般的な薬物動態学的特性は以下の通り:
吸収が悪い;体内分布が広い;肝代謝が多い;糞便および尿から排泄される(表2)。ベンズイミダゾール系駆虫薬は吸収が悪く、バイオアベイラビリティが低い。アルベンダゾールの経口吸収率はマウスとラットで約20%~30%、ウシで約50%、ヒトで約1%~5%未満である(5)。ベンズイミダゾール系駆虫薬は水溶性が低く、腸管吸収率も低いため、ヒトのがん治療に有効な全身循環濃度を達成するのは困難であろう。脂肪分の多い食事はヒトや動物において吸収を5倍まで高める。ベンゾイミダゾール系駆虫薬の投与においては、微小乳化送達システムと脂質の溶解度の増加が治療効果を最大化するのに役立つ。絶食状態の子牛におけるアルベンダゾールのバイオアベイラビリティは、自由摂食の子牛のバイオアベイラビリティよりも顕著に高かったことから(111)、絶食状態でのバイオアベイラビリティが優れていることがわかる。
有機共溶媒、リポソーム、界面活性剤、ナノ粒子、マイクロスフェア、シクロデキストリンなどの使用により、ベンズイミダゾール系駆虫薬の溶解度の低さとバイオアベイラビリティの低さを回避しようとする様々な製剤戦略が試みられている。アルベンダゾールのナノ製剤やアルベンダゾールをナノ担体と結合させた製剤は溶解性を改善し、腫瘍細胞への薬物送達を増加させる(112)。このようなバイオアベイラビリティの向上により、ベンゾイミダゾール系駆虫薬の抗腫瘍効果が高まる。
ベンゾイミダゾール系駆虫薬の一般的な副作用は以下の通り:
一般的に頭痛と肝毒性;時に白血球減少と貧血;緩下剤や食欲不振などの消化管における問題(表2)。アルベンダゾールには肝毒性があるが、患者の肝機能はアルベンダゾールの休薬により急速に回復した(113)。ベンゾイミダゾール系駆虫薬は、肝機能が低下している患者、肝硬変や肝がんの患者では慎重に使用しなければならない。アルベンダゾールは転移性肝細胞がん患者のがん状態を安定させたが、好中球減少症のため治療を中止した(98)。アルベンダゾールはげっ歯類では催奇形性と胎児毒性があることが知られており(114)、妊娠中は禁忌である。アルベンダゾールのプロドラッグであるネトビミンは、妊娠ラットにおいて吸収と骨格奇形を増加させ、胎児の体重を減少させた(115)。しかし、妊娠中に投与された女性であっても、ヒトでは催奇形作用は誘発しないようである(5)。ベンズイミダゾール系駆虫薬の毒性が種によって異なることは、種特異的な影響を示している。フェンベンダゾールはげっ歯類では無毒の薬剤と考えられるが(106)、動物用ベンゾイミダゾール系駆虫薬はヒトへの安全性については十分なエビデンスが得られておらず、さらなる研究が必要である。
まとめ
ベンゾイミダゾール系駆虫薬は正常細胞では最小限の細胞毒性を示すが、腫瘍細胞では高い細胞毒性を示し、癌細胞特異的な選択性を発揮する。
ベンゾイミダゾール系駆虫薬の抗腫瘍効果は、細胞生存率、遊走、浸潤の阻害、コロニー形成の減少、チューブリン重合の阻害、アポトーシスとオートファジーの誘導、G2/M細胞周期の停止、分化と老化の誘導、血管新生の抑制、薬剤耐性とトランスポーターの阻害、グルコース利用障害など、様々な生物学的作用を介して発揮される。
これらの化合物のこれらの生物学的作用に関連する特異的なシグナル伝達経路が、ベンズイミダゾール系駆虫薬の抗腫瘍性を裏付けている(図2)。
試験管内試験のがん細胞株に加えて、ベンズイミダゾール駆虫薬は生体内試験の動物腫瘍モデルにおいても、全生存期間および無増悪生存期間の延長、腫瘍増殖の抑制、血管形成の抑制、転移の抑制などの抗腫瘍効果を示しており、これらにはすべてがん細胞モデルで示されたシグナル伝達経路が共通している(図2)。
ほぼすべての動物が、重大な副作用なしにベンズイミダゾール系駆虫薬に耐容性を示した。これらのベンゾイミダゾール系駆虫薬は、従来の化学療法や放射線療法との併用で相乗的な抗腫瘍性の増強が示され、低コストでアジュバント療法やネオアジュバント療法の有望な候補となりそうである。
一部の癌細胞はベンズイミダゾール系駆虫薬に抵抗性を示す傾向があり、その原因を解明するためのメカニズム研究が必要である。
ベンズイミダゾール系駆虫薬の抗腫瘍効果に関する臨床試験では、ヒトの癌治療に使用可能であることを証明するには十分なデータが得られていない。限られたデータにもかかわらず、転移性の末期癌患者の一部はアルベンダゾールやメベンダゾールに良好な反応を示し、腫瘍マーカーや転移が減少し、病状が安定した。
現在進行中の臨床試験により、近い将来、原発性および転移性癌の治療に対するベンズイミダゾール系駆虫薬の知見が得られるであろう。ベンズイミダゾール系駆虫薬は幅広い安全スペクトルを有するが、バイオアベイラビリティの低さが大きな障害となっており、より優れた製剤戦略や溶解度を高めるための脂肪食が必要とされている。ベンズイミダゾール系駆虫薬の生物学的利用能の向上は抗腫瘍効果を改善し、全生存期間を延長する可能性がある。動物用ベンゾイミダゾール系駆虫薬の安全性はよく知られているが、ヒトに対する安全性は確立されておらず、さらなる研究が必要である。
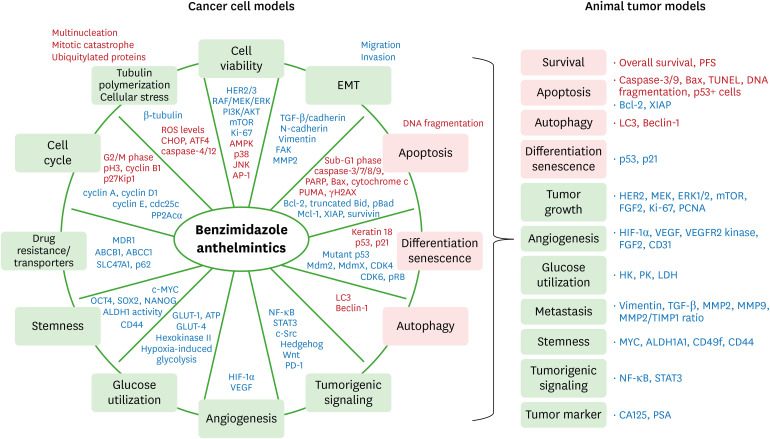
図2 ベンズイミダゾール系駆虫薬の癌における抗腫瘍原性についての要約。薄緑のボックスは生物学的側面の抑制、ピンクのボックスは生物学的側面の誘導、赤文字はシグナル伝達と反応のアップレギュレート、青文字はシグナル伝達と反応のダウンレギュレート。遺伝子とタンパク質については表1と表22を 参照。
謝辞
本研究の全部または一部は、米国国立衛生研究所(NIH)より以下の助成を受けた:NCI SC1CA200519(D.S.)およびU54CA163069(S.E.A.およびD.S.);RCMI 5U54AMD007586(S.E.A.);およびR01ES024756(E.L.)。研究内容は著者らの責任によるものであり、必ずしもNIHの公式見解を示すものではない。編集はMeharry Office of Scientific Editing and Publications(NIH S21MD000104)が担当した。
略語
| エービーゼット | アルベンダゾール |
| AFP通信 | α-フェト蛋白質 |
| AKT | プロテインキナーゼB |
| ALDH1 | アルデヒド脱水素酵素1 |
| ALT | アラニンアミノトランスフェラーゼ |
| AMPK | AMP活性化プロテインキナーゼ |
| AP-1 | アクチベーター・プロテイン1 |
| ATF | 活性化転写因子 |
| 悪い | Bcl-2に関連した細胞死のアゴニスト |
| バックス | Bcl-2関連Xタンパク質 |
| Bcl-2 | B細胞リンパ腫 2 |
| BSA-ABZ | BSA-アルベンダゾール |
| CA | がん抗原 |
| 内頸動脈内膜剥離術 | カルチノ胚性抗原 |
| チョップ | C/EBP相同タンパク質 |
| c-MYC | ウイルス遺伝子v-mycとヒトの相同性 |
| COX-2 | シクロオキシゲナーゼ-2 |
| デン | ニトロソジエチルアミン |
| 救急救命士 | 上皮間葉転換 |
| ER | 小胞体 |
| 食品医薬品局 | 食品医薬品局 |
| 筋萎縮性側索硬化症 | 線維芽細胞増殖因子 |
| グルート | グルコーストランスポーター |
| HCC | 肝細胞癌 |
| HER | ヒト上皮成長因子受容体 |
| ハイフ | 低酸素誘導因子 |
| 香港 | ヘキソキナーゼ |
| i.p. | 腹腔内注射 |
| i.t. | 腫瘍内注射 |
| i.v. | 静脈注射 |
| IC50 | 半最大阻害濃度 |
| IκBα | B細胞におけるκライトポリペプチド核内因子遺伝子エンハンサー阻害因子α |
| JNK | c-ジュンN末端キナーゼ |
| KRAS | キルステンラット肉腫ウイルスがん遺伝子ホモログ |
| LC3 | 微小管関連タンパク質1軽鎖3 |
| Mcl-1 | ミエロイド細胞因子-1 |
| Mdm2 | マウスダブルミニッツ2ホモログ |
| エムディーエムエックス | マウスダブル分4 |
| MDSC | 骨髄由来抑制細胞 |
| miR | マイクロRNA |
| MMP | マトリックスメタロプロテアーゼ |
| ナブABZ | アルベンダゾールのナノアルブミン製剤 |
| p | リン酸化 |
| 私書箱 | 経口投与 |
| PARP | ポリ(ADPリボース)ポリメラーゼ |
| ピーシーエヌエー | 増殖細胞核抗原 |
| ピーエフエス | 無増悪生存期間 |
| pH3 | リン酸化ヒストンH3 |
| PK | ピルビン酸キナーゼ |
| PP2A | プロテイン・ホスファターゼ2A |
| PSA | 前立腺特異抗原 |
| プーマ | p53はアポトーシスを制御する。 |
| 空軍 | 急速に加速する線維肉腫(3つのセリン/スレオニン特異的プロテインキナーゼのファミリー) |
| RB | 網膜芽細胞腫タンパク質 |
| S. C. | 皮下注射 |
| サート | サーチュイン |
| SOX2 | SRY(性決定領域Y)-Box2 |
| SRF | 血清反応因子 |
| TCF4 | T細胞因子-4 |
| ティンプ | 組織メタロプロテアーゼ阻害剤 |
| TMZ | テモゾロミド |
| TNIK | TRAF2およびNCK相互作用キナーゼ |
| TTP | トリステトラプロリン |
| チューネル | 転移酵素dUTPニックエンドラベリング |
| VEGFR2 | 血管内皮増殖因子受容体2 |
| エックスイアップ | X連鎖性アポトーシス抑制タンパク質 |
利益相反:著者らは利益相反の可能性がないことを表明している。

