Contents
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4737249/
オンライン版2015年6月4日掲載
Neil Vargesson(ニール・ヴァルゲソン)corresponding author 1
概要
約60年前、サリドマイドが妊婦のつわりの治療薬として処方された。その結果、1万人以上の子供たちが重度で衰弱した奇形を持って生まれてくるという、史上最大の人災となった。しかし、この薬は現在、多発性骨髄腫やハンセン病の合併症など、さまざまな成人病の治療に使用されている。しかし、ブラジルでは、サリドマイドの影響を受けた子どもたちが新たに見つかっている。だが、サリドマイドが胎児にどのような影響を与えたのかは不明である。しかし、ここ数年の研究により、サリドマイドの分子メカニズムについての理解は大きく深まっている。
この総説では、サリドマイドの歴史、サリドマイドが引き起こした被害の範囲と種類、サリドマイドの作用機序について、最近の分子的進歩と新しい知見を含めて概説する。また、サリドマイドの生物学者が直面している残された課題についても議論する。
キーワード:血管新生、活性酸素、細胞死、セレブロン、アクチン細胞骨格、四肢の発達、Fgf8,Shh、フォコメリア、血管の変遷
前編 歴史とサリドマイド胎児症
サリドマイドは、1950年代後半にドイツの製薬会社ケミー・グルネンタール社から、非中毒性の非バルビツール系鎮静剤として発売された(図(1)1)。サリドマイドは非常に効果的で、すぐに制吐剤としての効果も発見され、妊婦のつわりの治療に使われた。サリドマイドは、世界46カ国でさまざまな名前で販売・流通された。例えば、イギリスとオーストラリアではDistavalと呼ばれてたが、ヨーロッパではSoftenon、ドイツではConterganと呼ばれてた(Vargesson, 2009, 2013)。サリドマイドは世界で最も売れた薬の一つとなり、1961年11月に最終的に禁止されるまで、大々的に販売され、完全に安全であると宣伝されていた(Vargesson, 2009; 図 実際、この薬のサンプルパックは医師に配られ、つわりに苦しむ患者に自由に配布されていた(図1B)。何人の女性が投与されたのか、正確なことはわからない。
図1 サリドマイドのエナンチオマーの構造とパッケージ
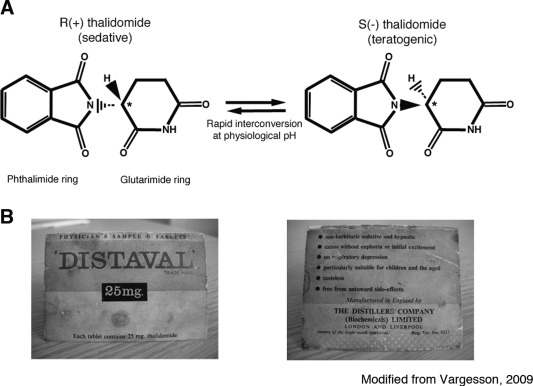
A: サリドマイドは立体異性体であり、不斉炭素(アスタリスク参照)の状態に応じて2つのエナンチオマー状態が存在し、それぞれの形態がわずかに異なる構造部分を持つことができる。RとSの両方のエナンチオマーは、体液や組織中で急速に相互変換(ラセミ化)し、それぞれの形態が同じ濃度で形成される。B:サリドマイドは両エナンチオマーのラセミ混合物として販売/流通しており、英国では「Distaval」と呼ばれていた。これらの画像は、妊娠初期の女性に投与された医師用サンプルである「ディスタバル」の実際のパッケージからのものである。パッケージに記載されている安全性に関するアドバイスに注目してほしい。Vargesson, BioEssays, 2009,31,1327-1336より転載。
サリドマイドが発売されて間もなく、服用後に末梢神経障害を発症した患者の報告が相次いだ。また、サリドマイドとは関係ない、あるいはサリドマイドが原因ではないと否定された、全身に影響を及ぼす重度の先天性欠損症の発生も報告された。1961年になって、ドイツのレンツ氏とオーストラリアのマクブライド氏という2人の独立した臨床医によって、サリドマイドが、1万人を超える膨大な数の子供の重度の先天性欠損症という史上最大の人災の原因であることが確認された(マクブライド、1961年、レンツ、1962)。さらに、この時期に流産率が上昇したという報告もあった(Lenz, 1988; Vargesson, 2009, 2013; McCredie, 2009; Stephens, 2009)。
その後、サリドマイドは1961年11月に英国で、1962年までに世界のほとんどの国で販売中止となった。その結果、これらの重篤な先天性欠損症の発生・発症は見られなくなった。
この災害が防げたかどうかは不明である。医薬品の包装や禁忌の情報は、現在の医薬品の販売方法に比べて最小限であった(図1B)。さらに重要なことは、1950年代、1960年代の薬物検査の状況は、現在の基準とは異なっていたということだ。グルネンタール氏によると、サリドマイドの検査は当時の基準で行われていたそうである(http://www.contergan.grunenthal.info/grt-ctg/GRT-CTG/Die_Fakten/FAQ/152700081.jsp)。しかし、どのような試験が行われたのか、また、グルネンタールがいつサリドマイドがヒトの催奇形性を持つことに気づいたのか、そして、この惨事をもっと早く防ぐことができたのかについては、いまだに論争の的となっている。
サリドマイドは、1957年から 1962年の間、米国内での使用が求められていたにもかかわらず、承認も認可もされなかった。医薬品の認可を担当するFDAの医師フランシス・ケルシーは、この薬を服用した患者に末梢神経障害の報告があったことから、薬の安全性について懸念を抱いていたが、妊娠中の影響についても懸念していた。ケルシー博士はその後、米国でのサリドマイド禍を回避した功績により、ジョン・F・ケネディ大統領から「連邦政府特別功労賞」を授与された(Vargesson, 2009, 2013)。
サリドマイド災害は、医薬品の試験方法を完全に変えてしまった。実際、フランシス・ケルシー博士が書いた記事は、現代の薬物検査の基礎となった(Kelsey, 1988; Vargesson, 2013)。さらに、サリドマイド事件は、薬物の反応・応答に種差があることを初めて証明した。薬物作用のスクリーニングに伝統的に使用されてきたマウスは、非ヒト霊長類やウサギなどの他の種に比べてサリドマイドに対する感受性が低い。(Merker et al 1988; Stephens et al 2000; Vargesson, 2013)。なぜマウスが薬剤に対して感受性が低いのかは不明のままである。惨事以降、薬物スクリーニングの方針が変わり、試験管内試験だけでなく、いくつかの動物種を取り入れるようになり、惨事の再発はなかった。
サリドマイドが先天性異常を引き起こすという証拠は、今や疑いの余地がない。人間以外の霊長類、ウサギ、アルマジロ、ゼノパス、有袋類、ハムスター、ニワトリ、ゼブラフィッシュ、海産魚、ヒドラ、さらにはバクテリアなど、複数の動物種がサリドマイドの被害に遭いやすいことが示されている(Fort et al 2000,Vargesson 2013,Hartmann et al 2014)。1957年から61年にかけて起きたサリドマイド災害は、薬物への反応に種差が存在することを初めて浮き彫りにした。
奇妙なことに、この事故では個人もグルネンタール社も起訴されなかった。グルーネンタール社は、ドイツ政府およびドイツ連邦検察庁との間で、自分たちに対する刑事訴追を取り下げる合意をしたのではないかという報道もある(http://www.theguardian.com/society/2014/nov/14/-sp-thalidomide-pill-how-evaded-justice)。グルネンタール社は2012年になってようやく「お詫び」を表明したが、責任を認めるには至らなかった。しかし、ドイツ国外でサリドマイド被害に遭った生存者への補償はまだほとんど行われていない(http://www.contergan.grunenthal.info/grt-ctg/GRT-CTG/Stellungnahme/Rede_anlaesslich_Einweihung_des_Contergan-Denkmals/224600963.jsp)。グルーネンタール社は現在、サリドマイドを製造していないが、痛み止めの薬を製造する世界最大級の製薬会社となっている。
サリドマイド被害の生存者には重度のハンディキャップがあり、生存者の多くは変形性関節症や関節可動域の問題、冠状動脈性心臓病などの早期発症の加齢関連問題を経験しており、生活が困難になっている(Miller and Stromland, 1999; Newman, 1999; Smithells and Newman, 1999; McCredie, 2009; Vargesson, 2009, 2013)。いくつかの国では、例えばイギリスとオーストラリアのDistillers社(現Diageo社)のような薬剤の販売業者が、遺族から賠償を求めて訴えられている。このような販売業者からは補償金が支払われている。また、政府は遺族に対して支援を行っている。しかし、支援の額は国によって異なる。
現在、サリドマイドは、ハンセン病、多発性骨髄腫、がん、クローン病、HIVなど、さまざまな疾患の治療に使用されている。サリドマイドの使用は、S.T.E.P.S.(System for Thalidomide Education and Prescribing Safety_program (Zeldis et al 1999; Uhl et al 2006))のような成功したスキームを使って慎重にモニタリングされているが、治療を受けている間に患者が妊娠していないかどうかをモニタリングしている。
しかし、悲惨なことに、ブラジルでは新世代のサリドマイド生存者が発生している(Castilla et al 1996年、Schuler-Faccini et al 2007,Vianna et al 2013)。サリドマイドは、ブラジルでは悲しいことに一般的で衰弱しやすいハンセン病の合併症の治療に使用されている。残念なことに、この薬は他の人と共有している患者に投与され、危険性を理解していなかったり、知らされていなかったりして、ダメージを受けた子どもたちが生まれる。この子どもたちの被害は、1957年から 1962年の間に子どもたちに見られた被害と似ている。
サリドマイド胎児症
1957年から 1962年の間に、サリドマイドは10,000人以上の子供たちに重度の先天性障害を引き起こした。サリドマイドの影響は、ほとんどすべての組織・器官に及ぶ。実際、1964年に英国政府が主催した詳細な報告書(UK Government Report, 1964)では、体のほとんどすべての組織や器官がこの薬の影響を受ける可能性があることが詳述されている。ドイツ、イギリス、オーストラリアの医師によって、いくつかの特徴的で一貫性のある特徴が確認された(Lenz and Knapp, 1962; Smithells, 1962; Spiers, 1962; Taussig, 1962; Nowack, 1965; Smithells, 1973; McBride, 1976; Ruffing, 1977; Newman, 1985; Newman, 1986; Smithells and Newman, 1992; McCredie, 2009)。被害は主に四肢(下肢よりも上肢の方が多い)顔、目、耳、生殖器、心臓、腎臓、消化管などの内臓に見られた。また、一部の生存者では脊椎にも影響があり、顔面神経麻痺の発生も報告されている。
サリドマイドへの曝露が引き起こす被害や症状は多岐にわたるため、被害は通常、サリドマイド胎児症またはサリドマイド症候群と総称されるが、被害の一部はサリドマイド胎児症に特有のものではなく、デュアン症候群など他のヒトの症状にも見られるものである(Smithells and Newman 1992; Miller and Stromland, 1999)。サリドマイド胎芽症は重篤な疾患であり、多くの組織に影響を及すが、これらの組織はすべてヒトで独立して発生することはあっても、一緒に発生することはほとんどない。
重度のサリドマイド胎芽症で生まれた赤ちゃんの乳児死亡率は40%と高く、内臓の損傷が原因である可能性がかなり高い(Smithells and Newman, 1992; Vargesson, 2013)。さらに、これらの奇形を持つ赤ちゃんの多くは、子宮内で死亡した可能性が高く、流産または死産している。サリドマイドの影響を受けた赤ちゃんの本当の数は、おそらくわからないであろう。
サリドマイド胎児症の特徴/一貫した特徴は、最も重篤な影響を受けた子供たちを検査することで特定され、現在も使用されている診断基準が決定された(Smithells and Newman, 1992)。最近、世界保健機関(WHO)主催の諮問委員会で診断基準が再検討され、より広範な新しい診断システムが提案されている(www.who-umc.org/graphics/28280.pdf )。
四肢の欠損
四肢の障害は、サリドマイド胎児症の最も一般的で研究されている特徴の一つである。
上肢のフォコメリアは、サリドマイドによる最も顕著な四肢の変形であり、サリドマイド胎児症の典型的なイメージでもある。フォコメリアは、近位要素(長骨)が減少または欠損し、遠位要素(手甲)が残っているために、四肢の重度の短縮によって発生する。フォコメリアの重症度には幅があり、長骨が欠損して指や手板が体と関節するフリッパーのような構造になっている重症のものから、長骨が短縮して遠位の骨が正常な軽症のものまである。橈骨形成不全(橈骨と親指の欠損)もサリドマイド生存者に見られる(Lenz and Knapp, 1962; Spiers, 1962; Taussig, 1962; Ruffing, 1977; Smithells, 1973; Newman, 1985; Smithells and Newman, 1992)。サリドマイドへの曝露によって誘発される上肢の変形の範囲と種類には、特徴的なパターンがある。最初に影響を受けるのは親指で、次に橈骨、上腕骨、最後に尺骨である(Lenz and Knapp, 1962; Nowack, 1965; Smithells and Newman, 1992; McCredie, 2009; Miller et al 2009)。サリドマイド生存者の大多数は、何らかの形で四肢の変形を示するが、それらは通常、縮小欠損であり、ほとんどの場合、左右対称である。実際、左右対称の四肢欠損は、サリドマイド胎児症の診断における特徴の1つとなっている。しかし、いくつかの研究によると、サリドマイド生存者に片側性の四肢欠損が生じることがあり、重症度に左右差が生じることもあるので、必ずしも左右対称である必要はない(Lenz and Knapp, 1962; UK Government Report, 1964; Schmidt and Salzano, 1980; Schmidt and Salzano, 1983)。
下肢 下肢にもサリドマイドに起因する障害が現れることがある。フォコメリアやアメリアが見られ、長骨の長さが短くなることもある。しかし、下肢の異常は上肢の異常に比べてあまり見られず、下肢の奇形は単独で発生するが、非常にまれである。大腿骨は下肢で最もよく冒される骨であり、尺骨と同様に腓骨も通常は最終的に正常な状態を保つ骨である(Nowack, 1965; Hamanishi, 1980; Lenz, 1988; Smithells and Newman, 1992; Miller and Stromland, 1999; McCredie, 2009)。
多指症(余分な指)は、サリドマイド生存者の手や足に、四肢が減少している場合や、小指症との組み合わせでも観察された(英国政府報告書、1964年、McBride、1961年、Smithells and Newman、1992年、Vianna er al 2013)。サリドマイドが重度の四肢減少または近位要素の喪失を引き起こすが、その後遠位桁が重複するという能力は、サリドマイド誘発性胚病の謎を深めるものである。
なぜサリドマイド生存者の上肢がより影響を受けるのかは不明である。下肢は上肢よりもわずかに後に形成されること、サリドマイドの活性半減期が短いことがわかっている。したがって、妊娠初期に1回の投与で上肢に影響を与えることができるが、後に形成される下肢に影響を与えるには、数日間にわたる複数回の投与が必要になる可能性がある。
サリドマイド生存者に見られる四肢障害の重症度は、個人の左右で異なる場合がある。両側性の障害を示すケースもあれば、片側の手足に重度の障害があるケースもある。さらに顕著なのは、サリドマイド生存者の片側の手足の障害の報告がいくつかあることであるが、このようなケースはまれである(Lenz and Knapp, 1962; Somers, 1962; UK Government Report, 1964; Schmidt and Salzano, 1980; Schmidt and Salzano, 1983)。
肩と股関節
サリドマイド胎児症では、特徴的な肩関節および股関節の障害が発生する。例えば、肩の肩鎖関節は、サリドマイド暴露によって肩が損傷すると、より突出し、外観が鋭くなります(Newman, 1977)。股関節は、恥骨と同様に、低形成または場合によっては完全に欠如していることがある(Newman, 1977)。
目と耳の障害
目や耳の障害(内部および外部)も、サリドマイド胎児症の診断に用いられる特徴の1つである。目と耳は、胚の4/5週目から8/9週目頃までに発達するが、これは手足が急速に成長するのと同時期である。サリドマイドは、目が小さい(小眼球症)無眼球症(眼球がない)視力低下などの原因となる。また、眼の欠陥には、異常な流涙(涙の形成)や流涙がないこと、コロボマ、斜視などがある(Smithells, 1962; Cullen, 1964; James, 1965; Newman, 1977; Schmidt and Salzano, 1980; Kelsey, 1988; Miller and Stromland, 2011)。眼球障害は片側だけで発生することもあるが、障害のない方の眼の視力が低下することもある(Smithells, 1962)。眼球運動の異常も観察され、通常、耳の欠損や顔面筋の弱さと一緒に起こります(Smithells and Newman, 1992)。
サリドマイド生存者の耳の欠損は通常左右対称であり、外耳の欠如(無耳)から外耳の減少(小耳)まで様々である(Ruffing, 1977; Smithells and Newman, 1992)。サリドマイド生存者の中には、難聴または聴力低下、および耳の欠損に加えて脳神経麻痺も観察される(Smithells and Leck, 1963; Livingstone, 1965; Newman, 1977; Ruffing, 1977; Newman, 1985; Miller and Stromland, 1999)。
顔面損傷
サリドマイド胎児症のもう一つの重要な特徴は、出生時に肥大した母斑または血管腫(「ストークマーク」としても知られる、Lenz and Knapp, 1962; Lenz, 1988; Smithells and Newman, 1992; McCredie, 2009; Stephens, 2009)があることである。血管腫は通常、額の中央に観察され、鼻の上から上唇まで伸びることもある。これは毛細血管腫であり、一時的なもので、通常は生後2〜3年以内に消失する(Newman, 1985, 1986; Smithells and Newman, 1992)。顔面麻痺および顔面非対称もサリドマイド胎児症に関連しており、これは顔面筋の弱体化および顔面神経の損傷によるものと思われる(Newman, 1985, 1986; Smithells and Newman, 1992; Miller and Stromland, 1999)。サリドマイド被害に関連したその他の顔面疾患には、不規則な歯数・間隔、小さな顎、口蓋裂・口唇裂、小さな鼻などがある(Newman, 1985, 1986; Smithells and Newman, 1992)。
椎骨柱
サリドマイド生存者では、不規則な椎体間隔、特に下部脊柱における椎体の癒合、場合によっては進行性の後弯など、様々な脊椎の問題が報告されており、生涯を通じて外科的介入を必要とすることがよくある(Ruffing, 1977; Smithells and Newman, 1992)。サリドマイド生存者は平均より低身長になることがあるが、これは椎骨の欠損とは関係なく、脚の骨が短いことが原因である(Brook et al 1977年、Ruffing、1977年、Newman、1985年、Smithells and Newman、1992)。
内臓の損傷
子宮内でサリドマイドに暴露されると、すべての内臓が影響を受ける可能性がある。心臓、腎臓、生殖器、消化管などの奇形が見られる(Smithells and Newman, 1992; Ruffing, 1977; Lenz and Knapp, 1962)。しかし、このような奇形の正確な発生率は不明である。なぜなら、このような欠陥は常に外見的に見られるわけではなく、特に人生の後半になってから現れる場合もあるからである。
子宮内および出生後の死亡の多くは、心臓の欠陥が原因であると考えられる。尿路や腎臓にも、馬蹄形、低形成、回転、異所性の奇形など、生命を脅かすさまざまな状態が見られる(Nowack 1965; Newman, 1985, 1986; Smithells and Newman, 1992)。サリドマイド生存者では、内性および外性の生殖器異常が報告されている。男性では精巣の欠如、精巣の異常、精巣下垂症などがあり、女性では子宮の奇形や生殖管の欠損などがある(Cathbert and Speirs, 1963; Newman, 1985; Newman, 1986; Smithells and Newman, 1992)。サリドマイドへの曝露に関連するその他の一般的な問題としては、肛門狭窄症、腸閉鎖症、幽門狭窄症、鼠径ヘルニアなどがある(Lenz and Knapp, 1962; Somers, 1962; Cuthbert and Speirs, 1963; Nowack, 1965; Newman, 1985, 1986; Smithells and Newman, 1992)。
神経および中枢神経系の損傷
サリドマイドで障害を受けた子供の中には、顔面神経麻痺、脳神経伝導障害、自閉症やてんかんの発症率が高く、後年になってから診断されるという証拠がある(Soules、1966年、Smithells and Newman、1992年、Miller and Stromland、1999年、Miller er al 2005)。サリドマイドは、発達中の神経経路に影響を与える可能性があり(Miller and Stromland, 1999)おそらく脳内の血管新生を阻害することで(Hallene er al)。 動物モデルでは、このような障害が胎児の発育のかなり後期に発生することが示されている(Hallene er al)。)
サリドマイドが胎児にダメージを与えるのはいつですか?
サリドマイドは、”臨界期 “とも呼ばれる時間的に敏感な短い期間に形成中の胚にダメージを与える。敏感な時期は、受精後20日目から36日目(最終月経後34~50日目、図 図2;2; Lenz and Knapp, 1962; Nowack, 1965; Smithells and Newman, 1992; Miller and Stromland, 1999)。この時間的に敏感なウィンドウの前後に暴露しても、胚にダメージを与えないと考えられている(Newman, 1985, 1986; Lenz and Knapp, 1962; Smithells and Newman, 1992)。しかし、サリドマイドをヒトやラットが早期に暴露すると流産が誘発され、ラットが後期に胎児に暴露すると脳障害が誘発される(James, 1965; Kajii et al 1973)。このことから、安全な服用期間はないと考えられる。
図2 サリドマイド胎児症の時間的窓、または “臨界期”

サリドマイド暴露後、胚に外見上の大きな損傷が発生した時期を示すグラフ。
報告によると、サリドマイド50mgを1錠摂取するだけで、妊娠の最大50%に先天性障害が発生するとされている。さらに、サリドマイドを時間差で投与された胚が無傷だったとしたら驚くべきことだとする報告もある(Newman, 1985; Stromland and Miller, 1992; Smithells and Newman, 1992)。実際、1964年に英国で起きたサリドマイド災害に関する英国政府の詳細な報告書によると、妊娠中にこの薬剤にさらされたことが確認された母親から、無傷または外見上の損傷のない子供が数人生まれたことが示されている(UK Government Report, 1964)。これらの人々が、出生時には明らかでない他の問題を抱えていて、それが後になって明らかになったかどうかは不明である。
サリドマイドの催奇形性の時間的な窓は、サリドマイドに罹患した子供の両親とその医師とのインタビューを経て決定された(Lenz and Knapp, 1962; Nowack, 1965; Ruffing, 1977; Lenz, 1988; Miller and Stromland, 1999; McCredie, 2009)。これらのインタビューから、摂取と暴露の日付を確認し、乳児に見られる損傷と相関させて、損傷のタイミングを決定した。この時期は、主に外見上の損傷と重度の内臓損傷に相関している。明らかに人生の後半になるまで現れないような他の障害は記録できなかった。この時期にサリドマイドを投与すると、四肢、顔面、生殖器などの外見上の症状や、腎不全などの明らかな内臓障害により、より重篤な障害が発生します(図(2)2)。ウィンドウの終わりに向かって暴露されると、手足や目・耳の負傷につながる。
一刻を争うウィンドウは、急速な胚発生の時期(4週目以降)と重なっており、すべての器官や組織の発生を可能にするために、多くの細胞の動き、増殖、器官形成、血管形成が行われ、また多くの異なるシグナル伝達経路が活性化されている。胚形成は、胚が完全にパターン化されて形成される10~11週目頃まで続くる。妊娠中の残りの期間は、現在の呼び名である胎児が成長し、成熟するための期間である。サリドマイドはつわりの治療に使われてた。つわりは4週目から12週目まで続く人もいれば、妊娠中に起こる人もいるので、サリドマイド災害を支えた主要な発育イベントと重なる。
1960年代に行われたヒトを対象とした研究の大半は、重度の障害を受けた乳児の障害を評価したものであり、成人の障害や遅発性障害を評価した研究はほとんどないことを考えると、この薬は当初説明されていたよりもはるかに多くの障害を引き起こしていた可能性がある。
動物実験、特に人間以外の霊長類を対象とした研究では、サリドマイドに暴露された後、様々な障害が誘発され、その障害は子孫の間で異なる可能性があることが示されている(Merker et al 1988年、Ema et al 2010,Vargesson et al 2013)。例えば、あるリトメイトは4本の四肢すべてに、別のリトメイトは1本の四肢に、別のリトメイトは尻尾の異常だけに、さまざまな損傷を示す可能性がある(Merker er al)。1988; Ema er al 2010; Vargesson, 2013)。このような損傷のばらつきのメカニズムは不明であるが、ヒトにおけるサリドマイドの損傷はより広範囲に及ぶ可能性があることも示唆されている。
サリドマイドによるダメージは、他のヒトの症状を模倣することもある
サリドマイドが引き起こす被害は、個人によって大きく異なる可能性がある(Lenz and Knapp, 1962; UK Government Report, 1964; Ruffing, 1977; Schmidt and Salzano, 1983; Smithells and Newman, 1992)。サリドマイドがどのようにして、このような被害の幅やばらつきを引き起こしたのかはまだ不明であるが、おそらく、薬剤の代謝やクリアランスの個人差、遺伝的要因や環境的要因などが考えられる。
サリドマイドで誘発される障害の一部は、サリドマイド胎児症に特有のものではなく、顔面神経麻痺、デュアン症候群、自閉症などの他のヒトの症状や、橈骨形成不全などの四肢の減少に独立して見られるものである(Smithells and Newman, 1992; Miller and Stromland, 1999; Lenz and Knapp, 1962)。実際、この薬剤が引き起こす損傷の一部は、他のヒトの先天性奇形と混同されることがよくある。特に、母親が妊娠中にサリドマイドを使用したことを覚えていなかったり、認めなかったりする場合には、診断が困難になることがある。例えば、四肢の欠損を特徴とする沖広症候群や、心臓や四肢の欠損を典型的に示すホルト・オラム症候群は、重症度が異なるため、サリドマイド胎児症と混同されることがある(Kohlhase et al 2003,Kohlhase and Holmes 2004,Vargesson 2013)。また、ロバーツ症候群は、四肢の奇形、顔面の損傷、内臓の損傷が顕著であることから、偽サリドマイド症候群としても知られているが、これははるかに稀な疾患である。ロバーツ症候群は、染色体分離、細胞分裂、およびDNA修復に関与する遺伝子であるESCO2の突然変異によって引き起こされる(Bates, 2001; Schule er al)。) ロバーツ症候群のゼブラフィッシュモデルでは、ESCO2の欠損が細胞周期を乱すことで正常な発生を妨げることが示されている(Monnich et al 2011)。最後に、テトラメリアはサリドマイド生存者に発生するが、Wnt3遺伝子のホモ接合性変異を介してヒト集団でも発生する可能性がある(Niemann er al 2004)。Wnt3遺伝子の変異を持つ患者は、サリドマイド生存者の一部に見られるように、顔面や泌尿器にも障害がある。これらのヒトの遺伝子疾患に関連する遺伝子のいずれかが、サリドマイドの標的となってサリドマイド誘発性胚病を引き起こすかどうかはまだ不明である。サリドマイドによるエンブリオパシーが他のヒトの疾患と類似していることは、疾患の診断で直面する困難を浮き彫りにしている。遺伝子検査の出現により、多くの疾患を検査して除外することができるようになった。
サリドマイド胎児症を遺伝性疾患と見分けるもう一つの重要な点は、サリドマイドには変異原性がなく、欠陥は遺伝しない、つまり次の世代に受け継がれないということである(Ashby et al 1997; Ashby and Tinwell, 2002)。実際、スウェーデンで行われた最近の研究では、サリドマイド生存者の子孫を追跡調査したところ、子孫に傷や障害が見られなかったという結果が出ている(Stromland et al 2002)。
今日
最も重篤な影響を受けた子供たちは、四肢の奇形、顔面、生殖器、内臓の問題をすべて示した。最も重篤な影響を受けたサリドマイドベビー/チルドレン、通常は両側の四肢に損傷を受けた子供たちの研究(Lenz and Knapp, 1962; Smithells and Newman, 1992)は、今日のサリドマイド胎児症の診断に使用される診断基準の基礎となった。しかし、損傷の程度が低い患者や、例えば両手足の損傷を示さない患者は除外されていた。この薬が引き起こした障害の正確な範囲と重症度は、今後もわからないであろう。しかし、ブラジルではサリドマイドの悲劇が続いており、サリドマイドの生存者は多くが子どもや若年層であることから、引き起こされた損傷とその進行、さらには遅発性の問題を研究できる可能性がある。さらに 2014年初めには、世界保健機関がサリドマイドの専門家による会議を開催し、ブラジルの悲劇、さらには世界中でサリドマイドの使用が増加していることを考慮して、診断基準の両方を再検討し、より幅広い基準を作成し、薬剤の使用と禁忌に関するガイダンスを提供した。今回提案された新しい診断アルゴリズム(www.who-umc.org/graphics/28280.pdf )により、より多くのサリドマイド被害者が特定され、より良い治療・療法を受けられるようになることを期待している。
パート2:生化学と作用機序
サリドマイドは、非中毒性で非バルビツール酸系の鎮静剤として販売されていた。本剤は、脳の神経伝達や代謝などの重要な生理機能に関与する天然アミノ酸であるグルタミン酸の合成誘導体である。
サリドマイドは、グルタルイミド環とフタルイミド環の2つの環が結合した構造をしている(図(1A).1A)。サリドマイドは不斉炭素を有しており、不安定で2つのエナンチオマーが共存し、体液中や水中で2つの状態が急速に入れ替わる(Smith et al 1965; Franks et al 2004)。エナンチオマーの1つであるS-エナンチオマーには催奇形性がある。しかし、この薬剤はエナンチオマーの状態間で変換(ラセミ化)することができるため、催奇形性のない安定した形を作ることは非常に困難である。サリドマイドは両エナンチオマーのラセミ混合物として販売されていた(図(1A)1A)(Franks er al 2004)。
親分子の活性半減期は約8~12時間であると考えられている。本剤は体液中で加水分解されるほか、肝臓のシトクロムp450酵素で代謝される可能性がある(図1)。親分子が催奇形性の原因であると考えられているが、投与後すぐに多くの分解物が発見され(少なくとも18種類;Smith et al 1965;Franks et al 2004年)体外の胚培養で催奇形性が認められたものもあることから、親分子と分解物の組み合わせが催奇形性の原因であると考えられる。(Lee et al 2011)。
1961年2月にサリドマイドが禁止・撤回されて以来、この薬には血管新生、抗炎症、抗骨髄腫の役割があることが発見された。実際、サリドマイドは1965年という早い時期にハンセン病の治療に有用であることが判明し、現在では世界中でハンセン病の合併症の治療に使用されている(Sheskin, 1965)。1994年には、サリドマイドに抗血管新生作用があることが証明され、これがサリドマイド胎児症の原因である可能性が示唆された(D’Amato er al 1994)。現在、サリドマイドは一部のがんの治療に使用されている。サリドマイドは、TNF-αの産生を阻害することで、炎症反応を強力に抑制することも証明されている(Moreira et al 1993)。この作用により、サリドマイドはハンセン病や多発性骨髄腫、クローン病、ベーチェット病、HIV、全身性エリテマトーデス、ハンセン病などの治療に大きな効果を発揮している。
サリドマイド胎児症の作用機序
サリドマイドは、どのようにして胚に深刻かつ広範な障害を引き起こすのであろうか?一言で言えば、まだ完全には解明されていないということである。サリドマイド胚病については、過去50年間に30以上の別個のモデル/理論が提案されており、その詳細は別の場所でレビューされている。これらのモデル/理論には、DNA変異生成、軟骨形成への影響、神経/神経堤の毒性、細胞接着分子の阻害などが含まれる(Stephens、1988年、Stephens and Fillmore 2000,Stephens et al 2000,Vargesson 2009,2013)。研究の中には生体内試験のエビデンスを提示しているものもあれば、仮説のものもあり、有効な理論であれば、薬物作用の時間的な性質や、引き起こされるダメージの範囲や変動性に対応できる必要がある。
これらの理論は興味深く、メリットもあるが、現在広く支持されている理論は、サリドマイドの血管新生阻害作用-細胞死を誘発し、活性酸素種(ROS)を生成する薬剤の能力-、サリドマイドの結合標的であるユビキチンリガーゼのセレブロンが結合を阻害されると、サリドマイドによる胚の損傷が軽減されるというものである(Stephens 2009,Vargesson 2009,2013,Ito et al 2011)。
しかし、これらの説は必ずしも相互に矛盾するものではない。実際、提案されている理論のすべてが、サリドマイドが誘導する先天性障害の原因となる事象のカスケードの一部に関与している可能性が高い。さらに、最近では、他の分子標的もサリドマイドによる胎児障害に関連していると言われている。
サリドマイドの血管新生阻害作用
サリドマイドは、線維芽細胞増殖因子(GF)タンパク質によって誘導されたネズミの角膜の血管新生を阻害するというブレイクスルー研究で証明された(D’Amato er al)1994)。この発見により、サリドマイドは胎児の血管を標的として催奇形性障害を引き起こすのではないかと考えられるようになった。
胚発生に不可欠な血管新生
胚が正常に発生するためには、血管が必要不可欠である。血管は、成長する組織に酸素や栄養を供給し、不要な老廃物を排出する。胚発生の際、血管はまず血管形成により形成され、その後、血管新生により、胚や胎児の成長や成人してからも必要な複雑な血管樹に変化する(Vargesson, 2003)。血管新生とは、血管形成によって形成された原始的な血管が、低酸素や血管内皮成長因子などのシグナルに反応して、既存の血管内の内皮細胞が増殖し、無血管領域に移動することで精巧に作られることである。新しい血管チューブが作られると、血管チューブは血管平滑筋細胞をリクルートし、血管を安定させる。平滑筋のコーティングが失われると、内皮細胞が増殖し、信号を受けて新しい領域に移動するようになる(Vargesson, 2003)。血管は、胚の変化と成長に対応するために、胚形成と器官形成を通して急速に変化している。
血管は正常な胚の発生に不可欠であり、血管が失われたり破壊されたりすると、当然のことながら死や先天性欠損が生じる(Vargesson, 2003, 2009)。
サリドマイドが胚発生期および成人期に血管新生を標的とすること
サリドマイドは、成体では複数の作用を持ち、胚では様々な種類の障害を引き起こす。サリドマイドのどの作用がどのようにして実際に催奇形を引き起こすのかを明らかにするために、サリドマイドの安定した構造類似体をスクリーニングしてその機能を決定し、サリドマイドの作用のどの側面(血管新生阻害または抗炎症)が催奇形を引き起こすのかを確認し、結果として生じる損傷を研究して、この薬剤がどのようにして先天性障害を引き起こすのかについての洞察を得た(Ng et al 2003,Franks et al 2004,Therapontos et al 2009,Vargesson 2009,Mahony et al 2013)。
サリドマイドは、加水分解または肝代謝によって多くの副産物に分解される(Franks et al 2004)。サリドマイドの分解産物の1つであり、血管新生阻害作用があると考えられている5′-OH-サリドマイドを基にした4つのフッ素化アナログであるCPS49を含む、サリドマイドの様々な副産物が生成された(Price et al 2002,Ng et al 2003,Franks et al 2004,Vargesson 2013)。フッ素化は、化合物に安定性と生物活性の向上を与える(Ng et al 2003,Franks et al 2004)。
CPS49は、四肢が形成されたばかりのニワトリ胚の上半身に塗布した(E2.5,Therapontos er al 2009)。胚では曝露後1時間以内に血管が急速に破壊され、四肢のシグナル伝達遺伝子の発現や細胞死に変化が見られる数時間前に破壊された(Therapontos et al 2009,Vargesson 2009,2013)。肢の面積の減少は6時間後に見られた。24時間後には、四肢の切断または重度の短縮が観察され、さらに、細胞死の増加が見られ、FGF(先端隆起部と間充織の両方)とソニックヘッジホッグ(Shh)のシグナル伝達の消失が明らかになった(図(2).2)。FGFとShhは、発生中の四肢において重要なシグナル分子であり、パターニングと伸長を制御している(図(図33))。
図3 胚の四肢の発生。手足は胚の脇腹から芽が出て形成される
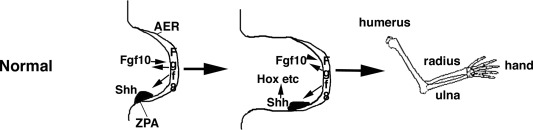
ヒトの場合、上肢は下肢(27日目)よりも約1日早く(26日目)形成される。肢芽は、2つの重要なシグナル伝達センターから構成されている。肢芽の遠位先端を覆う上皮が厚くなり、背側と腹側の表面を分けている「頂端外胚葉隆起」(AER)と、後遠位の中胚葉にある「分極活動領域」(ZPA)である。AERではFgf8が発現しており、これが間充織にシグナルを送ってFgf10を誘導し、ZPAではShhを誘導・維持し、ShhはFgf8を維持するようにフィードバックされる。このフィードバックループにより、細胞の増殖と四肢の伸長が維持され、他の遺伝子、例えばHox遺伝子が誘導され、四肢の要素である上腕骨、橈骨、尺骨、手甲、および軟部組織のパターンが確立されるのである。四肢は胚の脇腹の特定の領域から成長し、四肢が成長するにつれて近位から遠位へとパターン化されていく。つまり、上腕骨/胸骨が橈骨、尺骨/脛骨、そして手甲/足甲の前に敷かれるのである。
また、サリドマイドは、ニワトリやウサギの胚の四肢や、ゼブラフィッシュの胚で、FGFおよびShhシグナルの消失を引き起こすことが報告されている(Hansen et al 2002,Ito et al 2010,Knobloch et al 2011)。CPS49を処理したニワトリ胚では、たった1回の曝露で7日後にフォコメリアのような四肢が観察された(図 サリドマイドと同じように、CPS49は時間的に敏感に作用する。CPS49は、サリドマイドと同様に、時間的な制約を受けて作用し、早い時期に投与すると、手足がひどく切断され、アメリアのようになるのに対し、遅い時期に投与すると、指や指先を失うなど、それほど深刻なダメージを受けない。実際、ニワトリ胚におけるCPS49の損傷は、サリドマイドを用いた他の研究で見られた損傷と一致していた(Somers, 1962; Boylen et al 1963; Merker et al 1988; Tamilarasan et al 2006; Therapontos et al 2009; Vargesson, 2009, 2013; Ema er al)。)
図4 サリドマイドはどのようにしてフォコメリアを誘発するのか?
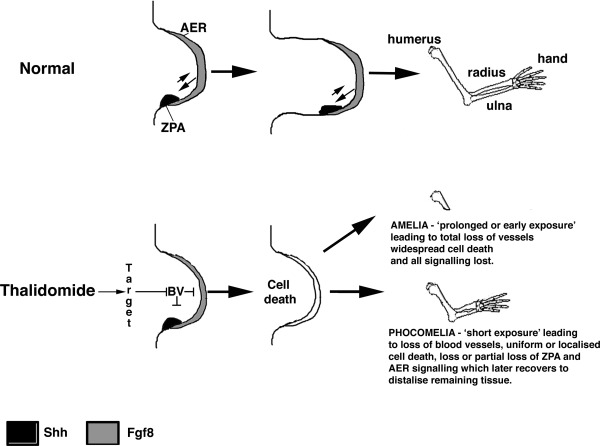
フォコメリアは、サリドマイド胎児症の顕著な特徴であり、この症状や災害に対する一般的なイメージとして残っている。フォコメリアは、手足の長骨が失われたり、著しく短くなったりするもので、他の疾患ではほとんど見られない。サリドマイドはどのようにしてフォコメリアを引き起こすのであろうか?サリドマイドおよびその類似物質の一部は、ウサギやニワトリの発達中の四肢におけるFGF(およびShh)の発現を低下または阻害することが示されている(Hansen et al 2002,Therapontos et al 2009,Knobloch et al 2011)。これらの遺伝子の発現は、数日後には元に戻る(Hansen et al 2002,Knobloch et al 2011)。さらに、発育中のマウスの四肢でFGFシグナルを減少させると、近位組織での細胞死の増加を引き起こすことで、フォコマリク様の四肢損傷を引き起こす(Mariani et al 2008)。サリドマイドの暴露は、ニワトリ胚の四肢の細胞死を誘発し(Knobloch et al 2007)、サリドマイドの血管新生阻害アナログであるCPS49も同様である(Therapontos et al 2009)。サリドマイドが血管を破壊し、その結果、細胞死が起こり、四肢のシグナル伝達経路が失われることが提唱されている(Therapontos et al 2009)。近位組織は永久的に失われ、置換することができない。これは、四肢が失われた膨大な数の細胞を置換することができないだけでなく、近位要素をパターン化した四肢の分子環境がもはや存在しないか、再現することができないという組み合わせによるものである(Mahony and Vargesson, 2013)。FGFシグナルの回復や再活性化によって四肢は回復するかもしれないが、組織が先端隆起部に非常に近く、遠位のシグナルにしか影響されないため、残った組織からは遠位の構造しか形成されないだろう。サリドマイド生存者の一部に見られる多指症も、これらのシグナルの誤制御によって説明できるのではないだろうか。サリドマイドへの曝露が長期に及んだり、手足が形成される直前に起こったりすると、血管が完全に失われ、細胞が広範囲に死滅し、FGF(およびShh)シグナルが完全に失われ、回復できずにアメリア(手足がない)になってしまう可能性がある。
同様に、ゼブラフィッシュの胚では、CPS49処理後、発生中の脊髄の血管が発育不良となり、急速に失われる。また、CPS49は、アクチンおよびチューブリンの細胞骨格の変化を防ぎ、糸状体先端細胞の形成および移動を阻害することで、培養中のヒト臍帯静脈内皮細胞(HUVEC)が増殖して新しい管を形成するのを防ぐことが示された(Therapontos er al)。)
サリドマイドの血管新生阻害アナログであるCPS49を用いた研究では、サリドマイドの血管新生阻害作用がその催奇形作用を時間差で引き起こすことが実証された(Therapontos et al 2009)。
なぜある血管は標的となり、他の血管は無傷なのか?
血管新生を行っている血管は、内皮細胞が増殖・移動して新たな管を形成するために、血管平滑筋の被膜を失っている(Vargesson, 2003, 2009, 2013)。平滑筋コートを持つ血管は静止しており、血管新生を行っていない。ラットおよびマウスの大動脈輪培養アッセイを用いたin-vitro試験で、CPS49は平滑筋を持たない血管を破壊するが、平滑筋コートを持つ血管は保護されることが実証された(Therapontos er al 2009)。このことは、平滑筋を持たない新生血管や形成中の血管がサリドマイドの影響を受けやすいことを示している。薬剤が胚に適用される時点でのニワトリ胚では、発達中の四肢の血管系は平滑筋を有していない(Vargesson and Laufer, 2001; Therapontos er al)。) 実際、発生中の四肢では、四肢の発生のかなり後期になるまで、血管に平滑筋の被覆が見られない(Vargesson and Laufer, 2001; Vargesson, 2009, 2013)。四肢とは対照的に、曝露時(E2.5)には、脳の微小血管、首や胴体の血管など、胚の大部分の血管が平滑筋の被膜を有しており、この時期にはこれらの血管は静止して保護されていることが示唆されている(Therapontos er al 2009; Vargesson, 2009)。この観察結果は、曝露のタイミングに応じて見られる四肢の欠損の範囲とよく相関している。曝露初期には重度の欠損が見られるが、四肢の血管系に平滑筋が出現する頃には欠損は指に限定される(Therapontos et al 2009)。さらに,ほとんどの組織が血管形成され,器官形成が行われている非常に若い胚(E1.5)にこの薬剤を適用すると,胚は死亡した(Therapontos er al 2009).
同じアッセイを用いて試験したサリドマイドの非血管新生類似体および加水分解物のいくつかは、ニワトリの胚に対して催奇形性がなく、明らかに有害ではないことがわかった(Therapontos er al)。) このことから、この薬剤の血管新生阻害作用は、時間依存的に様々な四肢の欠損を引き起こす可能性があることがわかる。
ニワトリ胚におけるCPS49は、四肢のシグナル伝達経路が変化する前に血管の消失を引き起こす。ゼブラフィッシュの胚では、CPS49は血管を急速に消失させるが、これはHUVECの研究から、アクチン細胞骨格の動態を阻害することによると考えられている(Therapontos er al)。) ゼブラフィッシュを使った他の研究では、サリドマイドが血管の発達における重要なシグナル分子である血管内皮成長因子VEGFなどを変化させることが示されている(Yabu er al)。) また、ゼブラフィッシュを用いた別の研究では、サリドマイドが、発達中のヒレに血管が形成される前に、ShhおよびFgf8の遺伝子発現パターンに影響を与える可能性が示されている(Ito er al)。) しかし、この研究では、VEGFを含む血管マーカーは調べられておらず、胚の他の領域の血管については詳しく調べられていない。ゼブラフィッシュのヒレとニワトリの手足では発生・形成の仕方が異なるため、種によって薬剤の作用が異なることが再確認されたのかもしれない。
他の研究でも、サリドマイドによって血管が標的となり破壊されることが実証されている(D’Amato et al 1994年、Hallene et al 2006,Tamilarasan et al 2006,Siamwala et al 2012,Vargesson et al 2013)。これらには、FGF を染み込ませたビーズに反応して誘導された血管がサリドマイド塗布後に破壊されるげっ歯類およびウサギの角膜アッセイが含まれる(D’Amato et al 1994; Kenyon et al 1997)。妊娠後期にサリドマイドを投与されたラットの胎児は、自閉症の原因とされる脳領域の一部に血管の破壊が見られる(Hallene er al)。) 内皮細胞の機能と血管の形成に必要な分子である一酸化窒素は、ニワトリ胚の血管を保護するようである。サリドマイドは一酸化窒素の発現を阻害し、その結果、血管が失われる。一酸化窒素を過剰に発現させると、サリドマイドで誘発された損傷を救済および/または防止することができます(Tamilarasan et al 2006,Majumder et al 2009,Siamwala et al 2012)。ゼブラフィッシュの胚では、サリドマイドはVEGF受容体の枯渇により血管障害を引き起こす(Yabu et al 2005)。また、サリドマイドは、ヒト成人患者の遺伝性出血性毛細血管拡張症(HHT)の治療に成功したことが示されている。この疾患で見られる「漏れ」のある血管は、平滑筋の動員と血管新生の抑制によって安定化します(Lebrin er al)。)
他の血管新生阻害剤は、例えばバルプロ酸ナトリウムのように催奇性がある(Whitsel er al 2002)。さらに、発生初期に血管が失われると、通常は致死的になるか、深刻な変形・損傷を引き起こす可能性がある(Vargesson and Laufer, 2001; Vargesson, 2003, 2009)。
最後に、胚の血管の発達とパターニングに関与する多くの重要な分子が、サリドマイド暴露後に変化した発現パターンを示すことが報告されている。例えば、アクチンとチューブリン、インテグリン、血管内皮成長因子、PDGFβ、一酸化窒素、セラミド、アンジオポエチン、ノッチ、HIF、Slit2/Roboシグナル、ROSなどである(Stephens et al 2000,Vargesson 2009,2013,Feng et al 2014,Li et al 2014年。)
これらを総合すると、血管新生阻害メカニズムは依然として魅力的であり、それを裏付ける証拠が数多く存在する。
細胞死・活性酸素誘導仮説
もう1つの魅力的な仮説は、サリドマイドが活性酸素の生成を誘導し、細胞に酸化ストレスを与え、それが四肢欠損の原因になると提唱されている(Parman et al 1999年、HansenとHarris 2004)。PBN(α-フェニル-N-tertbutylnitrone)という酸化ストレス中間体を捕捉・防止する薬剤をウサギに投与すると、サリドマイドによる胎児の四肢異常が防止され(Parman et al 1999年)ウサギ胚の培養で催奇形性を引き起こすサリドマイド加水分解物の生成が防止されることが実証された(Lee et al 2011)。さらに、Fgf8およびFgf10の発現は、サリドマイド処理されたウサギの胚では失われるが、この効果はPBNスピントラップ試薬を使用すると逆転する(Hansen et al 2002)。サリドマイドへの曝露は、四肢組織の細胞死を誘発することもあり(Hansen and Harris, 2004; Knobloch et al 2008, 2007; Parman et al 2009; Wells et al 2009)、四肢の骨格要素の消失や、体内の他の組織の損傷を説明することができる。サリドマイドは、四肢における骨形成タンパク質(Bmp)の発現とDickkopf-1(Dkk1)の発現をアップレギュレートする。これらのタンパク質は、細胞死を制御するなど、四肢の発達において重要な役割を果たす(Knobloch et al 2007)。PBNを使用すると、このサリドマイドによる発現上昇が抑制され、サリドマイドによる障害から胚が保護されるようである(Knobloch et al 2011, 2007)。Dkk1は、Bmpsの下流の標的であり、Wntのアンタゴニストでもあり、細胞の生存と増殖を制御している。そのため、胚組織に酸化ストレスを誘導すると、細胞死誘導によりサリドマイド胚病を引き起こす可能性がある(Parman et al 1999年、HansenとHarris 2004,Knobloch et al 2008,2007,HansenとHarris 2013)。また、活性酸素の誘導は、母親の糖尿病(Ornoy et al 2015)や、エタノールやフェニトインなどの薬物(Knobloch et al 2011,HansenとHarris 2013)など、他のプロセスによる催奇形性の原因にも関連している。さらに、活性酸素はXenopusの正常な胚発生に必要であり、Xenopusのオタマジャクシの尾の再生にも必要であることから、活性酸素が正常な発生と異常な発生の原因に重要な役割を果たしていることが明らかになっている(Love et al 2011;Love et al 2013)。しかし、これらの過程に活性酸素がどのように関与しているのかは不明である。さらに、サリドマイドがどのようにして特定の組織で細胞死と活性酸素を時間差で誘導し、このような障害を引き起こすのかも不明である。サリドマイドの血管新生阻害アナログであるCPS49を投与した後、形成された四肢でも細胞死の誘導が観察されており、おそらく血管の阻害が活性酸素と細胞死の誘導の引き金または関与している可能性がある(Therapontos et al 2009; Vargesson, 2009)。
血管が失われることで細胞にストレスがかかり、局所的に細胞死が起こる可能性があることや、生体内でサリドマイド誘発性の活性酸素を形成することで、サリドマイド誘発性の損傷を予防・軽減できるという証拠があることから(Parman et al 1999年、Hansen et al 2002,Hansen and Harris 2013,Knobloch et al 2007,Lee et al 2011年)この2つのメカニズムを合わせて考えると、サリドマイド胎児症で見られる損傷や損傷範囲の多くを説明できると考えられる。
サリドマイドによる催奇形性のメカニズムとしては、他にも、軟骨形成への影響(Stephens et al 2000年)神経毒性/神経堤消失(McCredie and McBride、1973年)DNAインターカレーション(Jonsson、1972年、Hague et al 2011)などが提案されている。これらの提案されたメカニズムはすべて何らかの関与があると思われるが、どのような順序で行われるのであろうか。サリドマイドを投与された動物では軟骨が失われ、神経が欠落したり変化したりすることがわかっているが、これらの組織はいずれも発生の比較的後期に形成されるため(四肢を含む主要組織が形成され、成長した後であることは間違いない;Vargesson, 2003, 2013)これらの影響は薬剤の主要な作用の下流にあると考えられる。組織や器官が損傷したり欠損したりすると、結果的に軟骨形成や神経支配が変化することが想定される。さらに、血管パターンの変化は、骨の成長とリモデリングを可能にするために特殊な血管系を必要とする軟骨形成に影響を与える可能性がある(Kusumbe et al 2014; Ramasamy et al 2014)。実際、ヒト胚の四肢では、受胎後45日目(最終月経周期から約59日後、Hootnick et al 1980年、Levinsohn et al 1991年、Packard et al 1991)頃に、胚的な状態から大人のような状態へと血管が移行するという証拠がある。さらに、血管パターンの正しい移行の失敗は、サリドマイド胎児症に関連する短大腿骨のような状態を含む、一連のヒト下肢の異常を説明するために提案されている(Hamanishi, 1980; Hootnick et al 1980; Levinsohn et al 1991; Packard et al 1991)。このように、形成中の四肢の血管に損傷があると、血管パターンの胚から成体への移行が妨げられたり、制限されたりして、骨の形成やパターンに影響を与える可能性がある。
もちろん、サリドマイドの分子標的は何なのか、サリドマイドはどのようにしてこのような広範囲にわたる胚の損傷を引き起こすのか、という大きな疑問がある。作用機序や標的は複数あるのであろうか?
サリドマイドの分子標的
サリドマイドの作用機序については、催奇形性よりも、ヒト成人における抗炎症作用および抗骨髄腫作用の基礎となるものが多く知られている。サリドマイドは、炎症反応に不可欠なTNF-αの発現を速やかに抑制する。しかし、サリドマイドの催奇形性に関連する新たな標的が同定されているが、これらの標的がどのようにして胚の損傷を引き起こすのかはまだ不明である。
セレブロン
セレブロンは、ヒトの精神遅滞に関連する候補遺伝子である(Higgins er al 2004; Ito er al 2011)。セレブロンはユビキチン化に関与しており、DDB1 (DNA Binding Protein 1) と共に Cullin4 (Cul4) を含む E3 ユビキチン化複合体の一部を形成し、破壊のために分子を選択します (Ito et al 2010; Ito et al 2011)。サリドマイドは、セレブロンと結合することで催奇形性を開始すると考えられており、セレブロンがE3ユビキチン化複合体を構築して破壊対象の分子を選択するのを妨げ、発生シグナル分子の誤制御を引き起こすと推定されている(伊藤 et al 2010,2011)。
成人におけるサリドマイドの抗炎症および抗骨髄腫反応におけるセレブロンの役割は、はるかによく理解されている。例えば、さまざまな症状の治療に用いられるサリドマイドの構造変異株であるレナリドミドとポマリドミドの両方もセレブロンと相互作用し、下流の標的であるイカロスとアイオロスを選択的に活性化して分解に勧誘し、多発性骨髄腫における作用の媒介に役立つことがわかっており、この薬剤の抗腫瘍作用と催奇形作用が解離できることをさらに示している(Kronke er al)。) エレガントな結晶結合構造アッセイにより、サリドマイドとセレブロンがどのように結合するか、サリドマイドのS-エナンチオマー(また、その関連アナログであるポマリドマイドとレナリドマイドの両方についても)がセレブロンと結合できることが示され、さらに、サリドマイドが骨髄腫細胞を標的とし、セレブロンとの結合を通じて標的とすることが示された(Chamberlain et al 2014;Fischer et al 2014)。実際、これらの研究はさらに、近位肢の発達に関与する遺伝子であるMeis2を含め、いくつかの標的がE3ユビキチン化複合体との結合を阻止され、その結果、分解されない可能性を示唆している(Fischer et al 2014)。また、Cereblonは、DNAの構造に不可欠な成分であるウリジンと結合できることが明らかになっており、ウリジンを過剰に曝露することで、ゼブラフィッシュの胚におけるサリドマイドのような損傷を軽減することができる(Hartmann et al 2014)。セレブロンが相互作用してE3ユビキチン化複合体を形成するCul4aに注目した研究では、ゼブラフィッシュにおいて、Cul4aが胸鰭(および前肢)と心臓の発生に関与する遺伝子であるTbx5aに結合できる可能性が示唆されている。この研究は、サリドマイド結合後のCereblonが組織特異的な標的に結合することで組織特異的な作用を持つ可能性を示唆する他の研究に加えている(Zhao er al)。) セレブロン複合体があるタンパク質の分解を誘導し、他のタンパク質の分解を阻止する能力は、サリドマイドの多様な作用を少なくとも部分的に説明するのに役立つ。
しかし、セレブロンが結合したサリドマイドが、実際にどのようにして催奇形性をもたらし、さまざまな胚の損傷を引き起こし、時間的に敏感な作用の窓に作用するのかは、まだ明らかになっていない。サリドマイドと結合できない変異型セレブロンタンパク質を胚に誤発現させたところ、サリドマイドによる障害が軽減され、Fgf8の発現が維持された(Ito er al)。) いくつかの研究では、サリドマイドに暴露された後、発生中のニワトリやウサギの手足、ゼブラフィッシュのヒレにおいて、Fgf8シグナルが減少または消失することが示されている(Hansen et al 2002,Ito et al 2010,Knobloch et al 2011)。しかし、Fgf8の制御がCereblonの発現に直接または間接的に依存しているかどうかは不明である。さらに、胚発生におけるCereblonの発現パターンも完全には解明されていない。しかし、セレブロンをノックアウトしたマウスは正常であり、完全に機能していると考えられる(Lee er al)。) これらの研究を総合すると、セレブロンは、代謝調節、脳の発達、知的能力、炎症反応、催奇形性などの重要な役割を担っていることがわかる。しかし、胚発生におけるセレブロンの正確な役割はまだ不明であり、セレブロンがサリドマイドと結合することでどのように催奇形性を引き起こすのかは、現在のところ不明である。さらに、サリドマイドがセレブロンに結合することが、セレブロンの既知の血管新生阻害作用や細胞死誘導作用とどのように結びつくのか(あるいは結びつかないのか)についても不明である。なお、Cereblonは、ゼブラフィッシュ胚の頭部の血管系で発現していることが報告されており、サリドマイドの血管新生阻害作用とCereblonとの関連が示唆されている(Ito er al)。)
チューブリン
サリドマイドの類似体である5HPP-33はチューブリンと結合することができ、これは結晶構造の結合アッセイによって実証されている(Rashid er al 2015)。チューブリンは、細胞骨格の一部であり、,細胞の増殖に必要であり、これは胚の血管新生と新しい血管の形成に不可欠である。本研究では、サリドマイド類似物質5HPP-33にチューブリンが結合し、細胞骨格のダイナミクスが変化して細胞分裂を妨げることを明らかにした。一刻を争う時期には、多くの臓器・組織が成長・成熟しており、このような影響を受ける可能性がある。この研究は、サリドマイド(Tamilarasan et al 2006)およびサリドマイドの血管新生阻害アナログであるCPS49(Therapontos et al 2009)をHUVEC細胞に投与すると、アクチン細胞骨格のダイナミクスが乱れ、その結果、血管新生が阻害されるという他の研究結果を裏付けるものである。サリドマイドがチューブリンに結合することで、細胞の増殖や移動が阻害され、組織の形態形成が不全になる可能性があり、その重症度は血管や組織の成熟度に応じて時間的に変化する可能性がある。
一酸化窒素と可溶性グアニルサイクラーゼ
一酸化窒素は、可溶性グアニルシクラーゼの活性化を介してcGMPの産生を刺激することにより、血管新生に関与する。サリドマイド投与後にcGMPレベルが低下し、HUVEC細胞培養において血管新生がうまくいかなくなる(Tamilarasan er al)。) cGMPレベルが上昇すると、サリドマイドによる血管新生阻害が抑制される。in silicoモデリングによると、サリドマイドは可溶性のグアニルシクラーゼと結合できることが分かっている(Majumder et al 2009)。このことは、サリドマイドが一酸化窒素のシグナル伝達経路を阻害することで、胚の血管新生に影響を与えることを示唆している。
さらに、サルの胎児、ヒトおよびマウスの胚性幹細胞におけるサリドマイド暴露後の分子変化を調査したいくつかの研究では 2000もの遺伝子発現プロファイルの変化が示唆されている(Ema et al 2010,Meganathan et al 2012,Gao et al 2014)。これらの遺伝子発現プロファイルの変化の多くは、血管関連遺伝子や細胞骨格関連遺伝子である。
まとめ
多くの遺伝子発現変化は、サリドマイド曝露の結果であり、血管および細胞骨格に関連していると思われる。サリドマイドの結合パートナーがいくつか同定されており、特にセレブロン、イカロス、アイオロスがサリドマイドの機能を媒介する上で重要な役割を果たしている。チューブリンは、サリドマイドの副産物と結合することが示されており、このことは、サリドマイドの抗血管新生作用、抗増殖作用、抗移住作用を説明することができる。さらに、PBN、一酸化窒素、プロスタグランジンHシンターゼ、アスピリンなど、いくつかの分子が胚のサリドマイド誘発性損傷から保護することがわかっている(Parman et al 1999年、Majumder et al 2009,Lee et al 2011,Arlen and Wells、1996年)。これらは、親分子および/または催奇形性のあるサリドマイドの副産物が生成されたり作用したりするのを防ぐことで作用する可能性がある。サリドマイドのこれらの分子標的や相互作用が、実際にどのようにしてサリドマイド胎児症に見られる様々な障害を引き起こし、その結果として生じるのかは、まだ議論の余地がある。また、サリドマイドの他の標的、おそらく組織特異的な標的でも、催奇形性を引き起こすものがあるかどうかは、まだ未解決の問題である。
結論と課題
サリドマイドは、今日でも世界を震撼させる惨事を引き起こし、悲しいことにブラジルでも再び起こっている。胎児の発育初期にサリドマイドにさらされた結果、以前にもそれ以降にも見たことのないような深刻で様々な障害が発生した。実際、この薬剤が引き起こした最も顕著な障害は、いまだに完全には解明されていないphocomeliaである(図4)。橈骨形成不全、内臓損傷、生殖器損傷など、他の症候群でも発生する可能性があるが、橈骨形成不全の場合は、サリドマイド胎児症ではともかく、一般的にはどのように発生するのかは不明である(図4).4)。サリドマイドは、その後、ハンセン病や多発性骨髄腫の治療など、多くの臨床用途が発見されたため、現在も使用されている。しかし、臨床効果はそのままに、副作用である先天性欠損症を起こさない薬を作ることはできないのであろうか。このような目的のために新薬を設計するには、サリドマイドがどのようにして短時間で障害を引き起こしたのかを理解することが不可欠である。サリドマイドの催奇形作用のメカニズムについては、いまだに議論の余地がある。サリドマイドは、血管新生などのグローバルなプロセスに影響を与えることで複数の組織を標的としていると考えられている。これにより、特定の組織において局所的な活性種の発生と細胞死を誘発し、組織障害を引き起こすと考えられる。内皮細胞における標的は何か?チューブリン?サリドマイドは特定のタイプの内皮細胞に結合できるのか?最近の研究では、骨を形成する際にのみ見られる新しいH内皮細胞のタイプが特定された(Kusumbe et al 2014,Ramasamy et al 2014)。サリドマイドは組織特異的な血管を標的にして、酸化ストレス誘発、細胞死、成長不全、シグナル伝達の喪失などを引き起こしているのではないか?あるいは、サリドマイドは、複数の組織において、異なる組織特異的なメカニズムで作用する可能性がある。そのメカニズムには、血管新生阻害、活性種の誘導、そしてもちろん、セレブロンやチューブリンなどの他の分子標的との結合が含まれる(図5参照)。最終的には、どちらの可能性も魅力的であり、どちらもサリドマイドが胚に与える深刻さや幅広い損傷を同じように説明できるだろう。
図5 サリドマイドによる胚へのダメージの枠組み
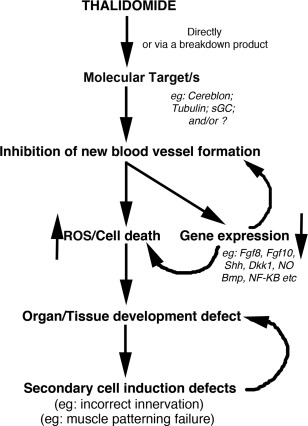
この枠組みは、サリドマイドによる胚障害の説明を試みるために、これまでに提案されたモデル・仮説の大部分を取り入れたものである。サリドマイドおよび/または分子標的に結合した後の分解産物は、血管の平滑筋に負の作用を及ぼし、おそらく内皮細胞のアクチン細胞骨格に影響を与え、その増殖や無血管領域への移動を妨げ、酸化ストレス、細胞死、遺伝子発現の低下を引き起こし、結果として組織障害を引き起こす。手足や内臓などの急速に発達する組織や器官では、これが壊滅的なダメージとなり、組織の欠損や組織の機能低下を引き起こし、成長を妨げる。また、損傷した組織や欠損した組織では、適切な軟骨形成、神経支配、筋肉のパターニングなどが適切に行われず、状態や損傷を悪化させてしまう。
臨床薬としてのサリドマイドへの関心が再燃しているにもかかわらず、催奇形性を引き起こすその作用機序は未だに謎に包まれている。しかし、現在、サリドマイドに大きな関心が寄せられていることを考えると、この薬剤が誘発する壊滅的なメカニズムの全容がついに解明されるのは時間の問題であると期待される。
謝辞
サリドマイドについて刺激的な議論をしてくれた、現在および過去の研究室メンバーであるChris Mahony、Shaunna Beedie、Lucas Fraga、Christina Therapontos、Alex Diamond、そしてNigel Brown、Suvro Chatterjee、Lynda Erskine、Douglas Figg、Hiroshi Handa、David Hootnick、Jurgen Knobloch、David Packard Jr、Robert L. Smith、Lavinia Schuler-Faccini、Cheryll Tickle、Lewis Wolpertなど多くの同僚に感謝する。
