Safety and efficacy of generic drugs with respect to brand formulation
www.ncbi.nlm.nih.gov/pmc/articles/PMC3853662/
2013年12月
Luca Gallelli,1 Caterina Palleria,1 Antonio De Vuono,2 Laura Mumoli,1 Piero Vasapollo,2 Brunella Piro,3 and Emilio Russo1
要旨
ジェネリック医薬品は、活性物質が同じ、剤形が同じ、適応症が同じであり、基準となる医薬品と生物学的同等性が同じであれば、先発医薬品と同等となる。薬価を下げるために、多くの国でジェネリック医薬品の使用が指示されている。しかし、先発品から後発品への切り替えの際には、生物学的同等性や賦形剤の役割など、臨床的な有効性や安全性について明らかにされるべき点もある。結論として、ジェネリック医薬品の使用は、罹患日数(再発までの期間)の増加や治療の失敗につながる可能性があり、一方で、高濃度の薬剤を使用することで、用量依存性の副作用のリスクが高まる可能性がある。
キーワード
抗生物質、生物学的同等性、ブランド、臨床効果、ジェネリック、安全性
はじめに
ここ数年、イタリアでは1996年の金融法(1995年12月29日付G.U.302号の549/1995年法)に基づき、薬価の引き下げと国民の医療制度への経済的負担の軽減を目的として、いくつかのジェネリック医薬品が導入されている。実際、後発医薬品の参入により、先発医薬品は3ヶ月後には約50%、1年後には約80%のシェアを失っていると言われている[1]。
イタリアで法的に定義されているように、ジェネリック医薬品は、活性物質が同じ(±5%の差がある)剤形が同じ、適応症が同じ、基準医薬品と比較して生物学的同等性(±20%)が同じであれば、先発医薬品と同等であるとされている(G.U. n. 208 of 05.09.1996のLaw n. 425/1996,Legislative Decree no. 219/06)[2]。
このコンテストでは、少なくとも生理学的なレベルでは、ジェネリック医薬品は先発医薬品と非常によく似た挙動をしており、理論的には同じような効果を示す可能性がある。実際、1996年から 2007年までにFDA(アメリカ食品医薬局)(米国食品医薬品局)によって承認された経口投与されたジェネリック医薬品の単回投与の臨床生物学的同等性試験2070件を比較した興味深い研究では、製品に有意な差はないことが示されている[3]。
これと一致して、他の著者は、ジェネリック医薬品による治療や先発品からジェネリック製剤への切り替えは、重大な臨床的失敗や副作用の発現とは関係がないことを文書化している[4,5,6]。
一方、ジェネリック医薬品は、イノベーター医薬品と比較して一定の範囲で生物学的同等性の試験が行われているが、安全性や有効性の試験は行われていないため、ジェネリック医薬品が必ずしも先発医薬品と治療的に同等であるとは限らない[7]。
特に、注射剤の存在下では、上記の報告されている法律と一致し、生物学的同等性試験は不要である。さらに、徐放性または治療指標の狭い薬剤の存在下では、12名の若い健康ボランティア(18歳から55歳まで)を対象とした臨床試験が必要である。しかし、これらの試験は、これらの製剤の生物学的同等性を評価するものであり、薬力学的な評価ではなく、薬物動態学的な評価を行っている。そのため、有効性や安全性に関するデータは記録されていない。実際、ブランド品からジェネリック医薬品への切り替え後に副作用が発現したり、臨床的に失敗したという報告もある[8,9,10,11,12,13,14]。
特に、ブランドジェネリックスイッチは、治療を受けた患者の30%で臨床的な改善と関連していると推定されているが、30%は改善を経験せず、10%は副作用を経験し、30%は臨床的に有効性がないか、副作用のために治療を中止したとされている[15]。
本症例検討では、フルオロキノロン系ジェネリック製剤による治療中の有効性の欠如を報告するとともに、この法的アプローチの限界も考慮しながら、相対的な理由を論じている。
症例報告
ケース1
再発性尿路感染症の既往歴を有する70歳の女性が 2012年7月10日に排尿時に疼痛を伴う灼熱感を訴えて開業医(GP)に入院した。病歴から、カルシウムブロッカー(アムロジピン、10mg/日)で治療された高血圧症の存在と、アモキシシリン治療後の皮膚反応の既往歴が明らかになった。臨床検査では下腹部の不快感と骨盤部の疼痛が認められた。尿検査所見では、白血球と血液の存在が確認され、pHは酸性であった[表1]。また、尿は強い臭気があり、濁っていた。
表1 症例1の尿検体の検査所見

2012年7月12日、急性膀胱炎と診断され、シプロフロキサシン(Ciproxin, Bayer® 750 mg 1日1回投与)を7日間投与された(7月13日、尿検体の微生物学的検査で大腸菌(2×105 colony forming units [CFU]/mL)が検出された)。 9 mcg/mL,範囲:0.06~8)およびアモキシシリンクラヴラン酸塩(3.96 mcg/mL,範囲:1~16)のいずれに対しても良好な感受性を示した。
7月20日に実施されたフォローアップでは,膀胱炎が持続していたため,3日後に新たに微生物学的評価を行ったところ,大腸菌(5×105 CFU/mL)からの持続感染が認められた(MIC:4.9 mcg/mL,範囲:0.06-8)。
薬理学的評価の結果、本剤の代わりに後発品のシプロフロキサシン(マイラン・ジェネリック® 750mg 1日1回)を服用していたことが判明したため、シプロフロキサシン(Ciproxin, Bayer®;750mg 1日1回)のブランド品を処方したところ、臨床症状や検査値の改善が認められ、副作用の発現は認められなかった[表1]。
症例2
72歳の女性が急性細菌性気管支炎の発症で開業医の診察を受けた。病歴からカルシウム拮抗薬(アムロジピン10mg/日)とβ遮断薬(アテノロール100mg/日)による治療中の高血圧症の存在が判明した。
診察では血圧120/85mmHg,体温38.6℃、リンパ節腫大・リンパ節腫大症は認められなかった。心血管系および腹部安静は正常であった。
臨床検査では,喘鳴,緑色の粘液を伴う咳嗽,息切れが認められた。そのため,パラセタモール(必要に応じて500mg)とレボフロキサシン(タバニック,サノフィ・アベンティス®錠500mgを1日1回10日間投与)が処方されたが,4日後に症状の持続を理由に開業医に再受診した。詳細な薬理学的評価を行った結果、イタリアの法律に基づき、薬剤師が生物学的に同等で安価な薬剤があるとのアドバイスを受けたため、患者はブランド品ではなくジェネリックのレボフロキサシン(ランバクシー® 500mg 1日1回)を服用していたことが判明した。
ジェネリックのレボフロキサシンをTavanic®に変更したところ、2日で症状が完全に改善し、副作用の発現もなかった。
症例3
他の全身疾患の既往歴のない49歳女性が,2日前に発熱(38℃)を呈し,粘液を伴う咳と息切れを伴っていたため開業医を受診した。急性気管支炎と診断され、パラセタモール(必要に応じて500mg)とレボフロキサシン(タバニック、サノフィ・アベンティス®錠500mgを1日1回10日間)が処方された。6日後、症状の悪化(39.5℃の発熱、緑色の粘液)を訴えて開業医を受診した。病歴からブランド品ではなくジェネリックのレボフロキサシン(ランバクシー® 500mg 1日1回)を使用していたことが判明したため、ジェネリックのレボフロキサシンをタバニック®に変更し、7日間で症状が完全に消失した。薬物治療中の副作用は認められなかった。
症例4
41歳の男性が4日間、目の周囲の痛み、圧痛、腫脹、圧迫感を訴え、臨床評価のためにかかりつけ医を受診した。診察の結果,発熱(37.9℃),嗅覚・味覚の低下,鼻からの黄色い分泌物を伴う鼻閉を訴えていた。
急性副鼻腔炎と診断され、ベタラクタム系薬剤に対するアレルギーのため、レボフロキサシン(タバニック、サノフィ・アベンティス®錠500mgを1日1回、14日間)とベクロメタゾン(ベンテラン、バイオフューチュラファーマS.p.A®錠1mgを8時間ごとに3日間)の併用療法を行い、3日後に再来院して臨床評価を行った。3日後の経過観察の結果、発熱(38.5℃)の悪化を伴う症状の持続が認められ、レボフロキサシンのジェネリック製剤(ランバクシー®、500mg 1日1回)を使用していることが紹介された。ジェネリック製剤からブランド製剤に変更したところ、約10日で症状は完全に消失した。
コメント
このような場合には、その点を強調しておきよう。
先発医薬品からジェネリック医薬品への切り替えは、薬剤師によって提案されたものである。薬剤師は、このケースのように、医師が処方箋上でジェネリック医薬品への切り替えを特に禁止していない場合、イタリアの法律(第149号2005年7月26日)に同意して、先発医薬品の代わりにジェネリック医薬品を推奨し、販売することができる。
有効性の欠如に関連するすべての要因、例えば調剤ミス、疾患、薬物相互作用、キノロン系薬剤に対する耐性など[16,17,18,19,20,21,22,23,24,25,26,27,28,29]は除外された。最初の症例では,微生物学的評価で抗生物質に対する感受性が高かったため,耐性化を除外した可能性があるが,すべての症例でブランド製剤の投与により臨床所見および検査所見の改善が認められ,副作用の発現は認められなかった。
また、最初の症例を除き、報告されている他の症例はすべて同一の薬剤を継続して使用していたため、効果がなかったことを完全に確認することはできず、後発品を継続して使用しても治療効果が認められた可能性があると考えられる。いずれにしても、治療中に早期効果が認められないことは議論の余地があり、さらなる検討が必要である。
したがって、このような場合には、後発品での治療中に効果が現れないという仮説が考えられる。
有効性の欠如と副作用の発現には、いくつかのメカニズムが関与している可能性がある。
ジェネリックと先発品の生物学的同等性の±20%の差
この違いは、薬剤の有効性に役割を果たす可能性があり、抗生物質での治療中に非常に関連している。特に、シプロフロキサシンは、約60%の肝代謝を受け、バイオアベイラビリティは50~65%で、半減期は3~5時間であることが示されている。レボフロキサシンは、バイオアベイラビリティが非常に高く(約100%)肝代謝があり、半減期は6~8時間である。細菌感染症におけるフルオロキノロン系薬剤の有効性は、薬物動態および薬力学的指標の適切な値が得られるかどうかで決まる。阻害時間曲線下面積=濃度下面積(AUC)(0-24)/MIC(24時間のAUC-時間曲線をMICで除したもの)及びCmax/MIC(ピークレベルをMICで除したもの)[30] したがって、後発品とブランド品の生物学的同等性が低下すると、特にチトクロームP450多型を有する患者では臨床効果が低下する可能性がある[31,32]。
また、現行法では先発医薬品と後発医薬品との間で20%の生物学的同等性の差があるが、後発医薬品の切り替え時には生物学的同等性を定義することはできないことを強調しておきたい。
賦形剤の違い
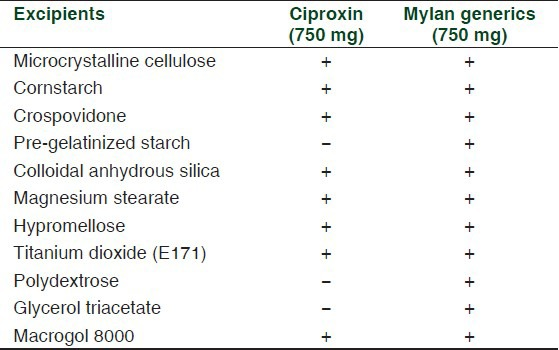
先行研究では、ブランド製剤とジェネリック製剤の臨床的な違いを説明するために、賦形剤の違いが考えられることが示唆されている[33]。
イタリアでは、実際の法律(Legislative Decree 219/2006 in G.U. n. 142 of 21.06.2006)では、賦形剤の違いを薬物反応に関連するとは考えていない。
実際、「消化管通過(ソルビトール、マンニトールなど)吸収(界面活性剤や輸送タンパク質に影響を与える賦形剤など)生体内溶解性(共溶媒など)活性物質の生体内安定性」に影響を与える可能性のある賦形剤の存在は、EMAの生物学的同等性に関するガイドラインにも記載されている[34]。
さらに、いくつかの研究では、賦形剤の違いがジェネリック製剤での治療中の反応の低下に関係していることが報告されている[9,35]。
他の研究では、以前にブランド品のフロセミドを服用していた患者において、ジェネリックフロセミド製剤の賦形剤として使用されているクロスカルメロースナトリウムに対するアレルギー反応の発現が報告されている[36]。 同様に、乳糖不耐症の不整脈患者が、ある抗不整脈薬(例えば、イソプチン120mg®またはライドモノルム300mg®など)の製剤から、乳糖ベースの賦形剤を含む別の製剤(例えば、ベラパミル(Verapamil eg,®)またはプロパノン(Propafen San)など)に切り替えた。このような患者は消化管障害を経験する可能性があり、その結果、腸管輸送時間と薬物の全体的な吸収に影響を与え、それによって薬物の全身レベルに影響を与える可能性がある。さらに、Reiffel[37]は、剤形変更後の心臓性不整脈患者において、不整脈の再発、催不整脈、死亡との関連性を報告している。
賦形剤の違いが、本剤の有効性の欠如に関与している可能性がある。
表2 レボフロキサシン500mgのブランド品(タバニック®)とジェネリック品(ランバクシー®)の賦形剤の違い
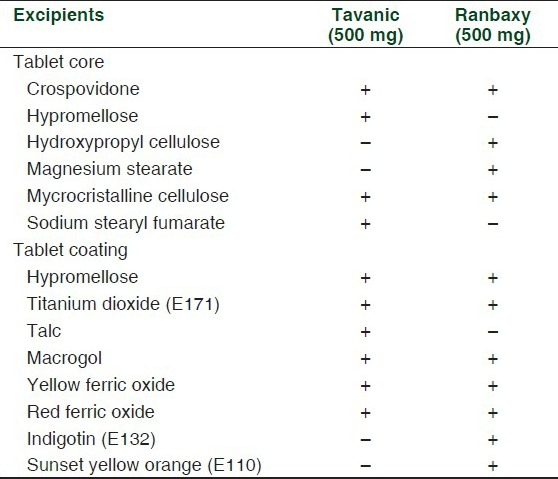
表3 シプロフロキサシン750mgのブランド品(シプロキシン®)とジェネリック品(マイラン®)の賦形剤の違い
医薬品の不純物
いくつかの研究では、ジェネリック医薬品はブランド医薬品と比較して総不純物率が3%を上回っていることが示されている。この因子は、薬剤のバイオアベイラビリティーに影響を与え、それゆえに治療効果に影響を与えることが以前に報告されている[38]。
このように考えると、ブランド品からジェネリック医薬品への切り替えは、費用対効果の観点から必ずしも好ましいものとは言えないかもしれない。
実際、一次医療におけるシプロフロキサシンの価格と消費に対するジェネリック医薬品の影響を評価したレトロスペクティブ研究では、経口シプロフロキサシンの総消費量の有意な増加と、尿分離株から得られた大腸菌の耐性の増加が実証されている[39]。
さらに 2012年10月、イタリア医薬品庁(Agenzia Italiana del Farmaco)は、抗てんかん薬(例:レベチラセタム、トピラマート)について、慢性的に治療を受けている患者には、メーカーから他のメーカーへの切り替えを避けて、同一の製剤を使用し続けることを提案した。言い換えれば、新たにてんかんと診断された患者が特定の製剤で抗けいれん治療を開始した場合には、同一の薬剤を使用し続けるべきである。
結論
結論として、ジェネリック医薬品の使用は、罹患日数(再発までの時間)の増加と関連したり、治療の失敗につながる可能性があり、一方で、薬剤の濃度が高いと用量依存性の副作用のリスクが高まる可能性がある。全体としては、治療中のジェネリック製剤の効果を十分に評価することが望ましいと考えられる。
Manning and Smith[41]と同様に、後発品の治療中の有効性の欠如を明らかにするためのファーマコビジランスや製造販売後のモニタリングシステムに対する臨床医の意識改革が重要であることを強調しておく必要がある。
利益相反
なし
