コンテンツ
www.ncbi.nlm.nih.gov/pmc/articles/PMC6039921/
2018年5月29日オンライン公開 doi: 10.12688/f1000research.13694.2
pmcid: pmc6039921
バージョンアップのお知らせ
改訂された バージョン1からの修正点
改訂された原稿での変更点
- 言葉の修正と読みやすさを追求した。
- 記事は2つのSection に分かれており、Section AはブライトンまでのAEFI評価について、Section Bはブライトン以降の改訂版AEFIカテゴリーについて扱っている。
- Bradford Hillの基準が紹介され、Bradford Hillの生物学的勾配が、複数の抗原を一度に使用することの害との関連で議論されている。また、現在の知識の限界(生物学的妥当性)が、高線量麻疹による女児の死亡の認知を遅らせていることも紹介されている。
- 五価ワクチン接種後の先天性心疾患児の死亡について、記事本文に紹介。
- Box 5ロタウイルスワクチンによっては、ロタウイルスによる下痢は減少するが、下痢全体の発生率(全原因下痢)には差がないことが明らかにされた。
- 科学的に妥当な説明がまだなされていない、高活性麻疹ワクチンによる男女の死亡率の違いについて追記した。
- 判決で示された複数ワクチン接種後のサイトカインストームによる死亡(および感受性児の死亡)のメカニズムに関するパラグラフを新たに追加した。
- イタリア軍兵士は同時に5つ以上の抗原を受け取ってはいけないという判決に関するパラグラフが導入された。
- 見出しの「Conclusion」を削除した。
- これからどうするのか」というパラグラフを新たに設けた。
- ここで指摘されたことに対して、WHOから回答を得るための努力については言及されている。
ピアレビューの概要
| 審査日 | レビュアーの名前(複数可) | バージョンアップのお知らせ | 審査状況 |
|---|---|---|---|
| 2018年7月5日 | ピーター・アーベイ | バージョン2 | 承認済み |
| 2018年6月4日 | トム・ジェファーソン | バージョン2 | 承認済み |
| 2018年4月3日 | ピーター・アーベイ | バージョン1 | 予約の上、承認された。 |
| 2018年3月14日 | トム・ジェファーソン | バージョン1 | 予約の上、承認された。 |
概要
世界保健機関(WHO)は最近、予防接種後の有害事象(AEFI)の分類方法を改訂した。疫学調査において、事前にワクチンによるものと認められた反応のみが、ワクチン製剤関連反応として分類される。市販後調査で観察された死亡例は、それに先立つ小規模な第3相試験で記録された死亡例に統計的に有意な増加がない場合、「ワクチンとの因果関係の一致」とはみなされない。もちろん、対照試験段階で死亡の有意な増加を引き起こしたと指摘されたワクチンは、おそらく認可されないだろう。認可後は、死亡やすべての新しい重篤な副作用は、「偶然の死亡・事象」または「分類不能」とされ、ワクチンとの関連は認められない。その結果、パラドックスが生じることは明らかである。
また、因果関係の定義も変更された。「プロセスに他の要因が介在しない」場合にのみ使用されるようになった。したがって、先天性心疾患の基礎疾患(他の要因)を持つ小児が、ワクチン接種後に発熱と心不全を発症しても、心不全はワクチンとの因果関係とはみなされないことになる。ワクチン安全性に関する世界諮問委員会は、心臓に持病のある小児が五価ワクチン接種後に死亡した事例を多数記録している。WHOは現在、そのような子どもたちにワクチンを接種する際の注意事項を勧告している。これによって、死亡のリスクは減少した。新しい因果関係の定義を用いると、この関係が認められず、命が危険にさらされることになる。以上のことから、AEFIマニュアルの再評価と改訂が早急に必要である。AEFI報告は、ワクチンの安全性のためと言われている。ワクチンセーフティ(ワクチンに対する安全性)ではなく、チャイルドセーフティ(子どもの安全性)を重視する必要がある。
キーワード 五価ワクチン、クインバクシム、ファーマコビジランス、ヒル基準、マクロファージ性筋膜炎、安全性定期報告、ブライトン分類、医薬品副作用、突然死、TOKEN試験
はじめに
五価ワクチン(ジフテリア、破傷風、百日咳、Hib、B型肝炎の混合ワクチン)をいち早く導入した国のひとつがスリランカである1。スリランカでは 2008年1月1日に5価ワクチンQuinvaxem(Crucell)が導入された。同年4月29日、5人の死者を出したことを受けて、政府はこのワクチンを撤回した。世界保健機関(WHO)の専門家チームは、予防接種後の有害事象(AEFI)を調査し、死亡がワクチン接種と関連しているとは「考えにくい」と報告した。この報告書の全文は、インド・デリーの高等法院に提出されるまで、広く公開されていなかった2。報告書全文から、3人の死亡について他の説明がつかないことが明らかになった。したがって、WHOのAEFI分類のためのブライトン基準(Box1参照)を用いて、それらは予防接種に関連する「可能性が高い/高い」に分類されるべきだった。専門家は、評価に使用したAEFI分類から「probable」と「possible」のカテゴリーを削除した上で、死亡はワクチン接種に関連する「可能性が低い」と報告した。スリランカでの死亡をこのように誤解させる分類を可能にするためにブライトン分類が変更されたことは、Indian Journal of Medical ResearchとBritish Medical Journalで報告された3,4.
2013年5月4日、ベトナム保健省は、クインバクセム(クルーセル)が12人の死者5を出したため、使用を中止した。WHOの専門家がベトナムの死亡事例を調査した。今回彼らは、『クインバクセムはWHOによって事前に認定されており…、このワクチンに関連した致命的な免疫後有害事象(AEFI)はこれまでない』と報告した5。このワクチンは、WHOの専門家が過去にAEFIによる死亡を記録したスリランカで使用された五価ワクチンと同じブランドである。スリランカの調査の後、ベトナムの調査の直前に、AEFI分類に使用される方法が改訂されたようである。改訂されたAEFI因果関係評価を用いると、スリランカから報告されたAEFIは「AEFIのケースではない」と分類される可能性がある。スリランカとベトナムの両国は、WHOの報告後、五価ワクチンの再導入を説得された。AEFIを「Not a case of[AEFI]」と分類する新しいメカニズムについて議論する。
Box1
WHO予防接種後の有害事象(AEFI):因果関係の評価ブライトン基準
| 因果関係用語 | 評価基準 |
| 非常に高い/確実 | ワクチン投与と時間的に妥当な関係のある臨床事象。
同時期に発生した疾患や他の薬物・化学物質では説明できない、ワクチン投与との時間的 または他の薬剤や化学物質によって説明できないもの |
| プロブレム | ワクチン投与と合理的な時間的関係を持つ臨床的事象であること。
ワクチン投与との間に合理的な時間的関係があり、同時期の疾患や他の薬物・化学物質に起因する可能性が低い臨床事象。 薬物や化学物質に起因するとは考えにくいもの。 |
| 可能 | ワクチン投与と合理的な時間的関係を有する臨床事象であるが、同時期に発生したワクチ
ワクチン投与との間に合理的な時間的関係があるが、同時に発生した疾患や他の薬剤・化学物質によっても説明可能な臨床事象。 を説明することができるもの。 |
| ありえない | ワクチン投与との時間的な関係から、因果関係はありえないが、もっともらしいと思われる臨床事象
因果関係は考えられないが、基礎疾患や他の薬物・化学物質によって 基礎疾患や他の薬物・化学物質で説明できるもの |
| 無関係 | 時間的な整合性がなく、基礎疾患や薬物・化学物質によって説明可能な臨床的事象。
基礎疾患や他の薬物・化学物質によって説明できるもの |
| 分類不能 | 情報が不十分な臨床事象
原因の評価と特定を可能にするための情報が不十分な場合 |
参考
www.rho.org/files/rb3/AEFI_Causality_Assessment_WHO_2005.pdf
Section A
因果関係の評価の歴史的背景:ヒュームからブライトンまで
因果関係評価の論理の進化は魅力的である。著名な哲学者、科学者、法曹界の著名人、統計学者がこの問題に取り組み、多くのことが書かれてきた。この記事では、単純化しすぎるというリスクを除けば、そのすべてを抽出することは不可能だろう。私たちは、薬物反応の因果関係を明らかにすることに主眼を置いているので、この議論には、この議論のいくつかの側面のみが重要である。
原因と結果(XはYの原因である)を定義することは、これまで容易でなかった。ヒューム6世によれば、因果関係の主要な特徴は、時間的先行性(XはYに先行しなければならない)、連続性、原因とその効果の関連性の規則性である。しかし、交絡は第三の要因によって可能である。
日焼けの発生率が急増するときには、アイスクリームの消費量が多くなることが知られている。アイスクリームを食べると日焼けをする、という間違った結論もあり得る。この場合の第三の要因は、暑い気象条件である。アイスクリームを食べることと日焼けをすることは、どちらも晴天の日と関連している。ヒュームは、XがYにとって十分である場合にのみ、XをYの原因とみなすことができると規定することによって、交絡の問題を回避した。しかし、これは誤りである。マッチを擦って火をつけるのは、酸素があるときだけである。マッチを打つこと自体では十分ではない。別の立場として、XがYにとって必要である場合にのみ、XはYの原因であるとすることもできる7.ジョン・マッキーは、自然界では同じ結果に対して複数の理由(原因)が存在し得ると示唆した8。ある建物が、電気配線の短絡による火花(X)で燃え上がるかもしれないし、放火の結果(Z)かもしれない。したがって、(X)も(Z)もYにとって必要ではないが、(X)と(Z)の両方はYにとって十分な原因である。そこで問題は、Xの要因がなければYが発生したかどうかである。法律学では、複数の原因が同時に作用している場合、「but for」テストは機能せず、因果関係の問題は、推定される原因が結果に実質的に寄与したかどうかであることが認められている9。これはGraham Dickie V. Flexcon Glenrothes Limited[2009]ScotSC 143(04 September 2009)のケースで主張されたものである。Peter M. WillcockとJames M. Leppは、「Causation in medical negligence cases」において、これらの問題について詳しく論じている。
生物学では、因果関係にはさらに確率的な要素がある。同じ身長の男性と同じ身長の女性が子供を産んだとしても、その子供がすべて同じ身長になるとは限らない。観察された因果関係が同じであれば、可能な身長の確率分布が存在する7。
Bradford Hill10は、因果関係を評価するために、因果関係を支持する9つの指針を述べている。1)強さ-効果の大きさ、2)一貫性-異なる場所、異なる人による同様の観察結果の再現性、3)特異性-代替説明がないこと、4)一時的-原因が常に効果をもたらすこと、5)生物学的勾配-用量反応勾配を示すこと、6)生物学的説得力-現在の知識では限界があるかもしれない、7)疫学と実験結果の一致、8)実験的証拠、9)類似の要素の効果に注目、である。これらの検討は、ワクチン反応の疑いにも適用される。
薬物有害反応
薬物有害反応(ADR)は、あらゆる薬物の使用後に起こる可能性がある。薬剤と因果関係のある事象と偶然の事象を区別するためには、慎重な評価が必要である。因果関係の評価は、事象が医原性のものであったり、回避可能なものであったりするため、非常に重要である。通常、市販されている薬剤に有害な反応を示すのはごく一部であり、他のものは無害である。このような時折起こる事象の因果関係の帰属は、特に複雑である。ADRの調査は、因果関係を確率の尺度で評価する。世界保健機関(WHO)の国際医薬品監視共同センターが開発した因果関係評価システムは、ウプサラWHOセンター(WHO-UMC)スケールと呼ばれている。これは、簡単な方法論であるため、広く用いられている(Box 2参照)。ヒュームの定説に基づき、まず時間的な先行性と連続性を確認する。有害事象は、疑われる薬剤が投与された後、合理的な時間枠の中で出現しなければならない。薬物摂取までの時間から関連性が考えにくい事象は、「関連性の低い」事象に分類される。合理的な時間内に発生した事象で、他に説明がつかないもの(病気や他の薬剤に起因しないもの)は、当該薬剤との関連が「probable/likely」に分類される。薬物反応は、合理的な時間的関係があるが、別の説明もある場合、「可能性」に分類される。John Mackieの格言では、薬物は効果にとって十分であるが必要ではないとされている。
Box2 WHO-UMCの因果関係カテゴリー
| 因果関係用語 | 評価基準 |
| 一定 | -薬物摂取と時間的な関係があると思われる事象または臨床検査値異常
-病気や他の薬物で説明できない -薬理学的、病理学的に妥当と思われる休薬反応 -薬理学的あるいは現象学的に確定的な事象(すなわち、客観的かつ特異的な医学的障害あるいは認識された薬理学的現象 薬理学的または現象学的に確定的な事象であること) -必要であれば、再チャレンジが可能であること |
| 可能性が高い | -薬物摂取と時間的に合理的な関係がある事象または臨床検査値異常で、薬物に起因する可能性が低いと考えられるもの
病気や他の薬物に起因するとは考えにくい -休薬に対する反応が臨床的に妥当であること -再チャレンジは必要ない |
| 可能 | -薬物摂取と合理的な時間的関係のある事象または臨床検査値異常
-病気や他の薬物で説明できる可能性もある -薬物離脱に関する情報が不足しているか、不明確である可能性がある |
| ありえない | -薬物摂取との関係がありえない(ありえないわけではない)時間帯での事象または臨床検査値の異常。
不可能ではない) -病気や他の薬物がもっともらしい説明をしている。 |
| 条件付き
未分類 |
-事象または臨床検査値異常
-適切な評価のためにさらなるデータが必要である、または -検査中の追加データ |
| Unassessable/
分類不能 |
-副作用を示唆する報告
-情報不足・矛盾のため判断不能 -データの補完や検証ができない |
参考文献Uppsala Monitoring Center.WHO-UMCシステムによる標準化された症例因果関係評価の使用。Uppsala monitoring centreの許可を得て複製。www.who-umc.org/media/2768/standardised-case-causality-assessment.pdfにて入手可能。
「可能性が高い/確実である」と判定されるには、その反応が客観的かつ特異的な医学的障害または認識された薬理学的現象であり、用量反応または再投与による症状の再発の証拠が必要である。万が一、ADRで死亡した場合、再チャレンジは不可能である。致死的なADRの因果関係を明らかにすることは通常困難であり、反応は「可能性が高い/低い」または「可能性がある」に分類されることが多い。
「確かなもの」と「ありそうなもの」の違いは、単に証明の許容水準にある。「確実」であれば、高水準の反論の余地のない証明(たった一つの不規則な結果による理論の反証)が求められる。自然発生的な再チャレンジが1件、きちんと記録されていれば、(たった1人の患者であっても)規則性の強い証拠となる。非常に可能性が高い」場合、合理的な疑いを超えた証明が必要である。
「Balance of Probability」は、「probable」と「possible」に分類するために必要な証明のレベルであり、これが医療とファーマコビジランスに関連する証明の基準である。このレベルの証明(一応の事実)があれば、「予防原則」が発動されなければならない。これについては後述する。
予防接種後の有害事象
ワクチンは、健康な人の集団全体に投与される予防措置として用いられる医薬品である。病気がない状態で投与されるため、副作用がほとんど出ないことが非常に期待される。しかし、重篤な有害事象や死亡事故に対する許容度は低い。予防接種後の有害事象(AEFI)は、他の薬剤よりも注意深くモニターされなければならない。信頼できる予防接種安全性評価・モニタリングシステムは、予防接種プログラムを成功させるために不可欠である。WHOは、「予防接種後有害事象(AEFI)」を開発した。ブライトン分類として知られる「予防接種後有害事象:因果関係評価」を開発した。これは、ADRのWHO-UMC因果関係分類に非常によく似ている。最近まで、この分類はWHOの専門家がAEFIが報告されたときに使用した試金石であった(Box 1参照)。
WHO-UMCの因果関係分類(Brighton分類の前身)の感度や対応力を示す一つの指標として、1999年にロタウイルスワクチンであるRotaShieldが12例のワクチン誘発性腸炎を報告された後、速やかに製造中止になったことがあげられる。生後2カ月未満の小児では、約2000人に1人が他の原因で腸重積症を発症している。この調査結果に基づき、米国疾病管理センター(CDC)は、RotaShieldワクチンを接種した乳児1万人あたり、さらに1〜2例の腸重積症が発生すると推定している。約10万人の乳児に接種した後、同ワクチンは撤回された11。2013年、ブライトン分類は放棄され、改訂版AEFI分類に変更された。ブライトン分類からの切り替えを促した理由は、改訂版AEFIマニュアルには明示されていない12。
Section B
ブライトン棄てられる因果関係評価の改訂
国際医科学会議(CIOMS)/WHO:ワクチンのファーマコビジランスに関する報告書。2010年10月、一連の会議の後、40人の専門家(うち19人は利益相反の可能性がある業界代表)がAEFIの分類基準の書き直しに協力した。ワクチンファーマコビジランスのための用語の定義と適用」と題されたこの文書は、「予防接種後の有害事象のシグナル検出と調査をより優れたものにするためのツールを提供する」と報告されている13。
この193ページの文書の170ページ、ガイドラインの注釈の見出しの下に、小さな文字で次のように書かれている:「ある事象が症例定義に合致しないという十分な証拠がある場合、そのような事象は拒否されるべきで、『[AEFI]の症例ではない』として報告されなければならない」このような証拠は、除外基準を満たすか、調査で診断に必要な基準(必要条件)が陰性であることが明らかになった場合に、十分であるとみなされる。このような事象は却下され、「[AEFI]の症例ではない」と分類されるべきである」13。
CIOMS/WHOの「優れたシグナル検出のためのツール」は、AEFIを「AEFIの症例ではない」と分類して目をつぶることによって機能している。AEFIと予防接種の因果関係が否定されるだけでなく、AEFIが発生しなかったかのように見せかけられる。AEFIは「AEFIの症例ではない」と指定された後、システムから削除されると、シグナル検出はもはや不可能である。2013年5月にWHOが五価ワクチン5には致命的なAEFIは発生していないと断言した上記「はじめに」の話は、スリランカのAEFI死亡例2がCIOMS/WHOのツールを使って「Not a case of[AEFI]」として再分類されたことを示唆している。
過去にワクチンに関連した反応の症例定義に合致する反応のみを考慮する。CIOMS/WHOの報告書(11ページ)によると、症例定義は標準文献から採用することも、査読者自身によるものも可能である。
症例定義は、これまでの疫学的研究を活用し、因果関係を確認するためのさらなる研究を促進するものである。しかし、個々の事象に関連する因果関係の排除は、その事象が既存の症例定義に適合しているかどうかに依存することはできない。拒否された」という言葉の蔑称的な使用(「そのような事象は拒否され、”AEFI ”の症例ではない」と分類されるべきである)は、防衛的な姿勢を示唆している。AEFIの報告は因果関係を評価され、分類されるべきで、「却下」されるべきでないことは以前にも指摘したとおりである14。
WHOのAEFIマニュアル改訂版
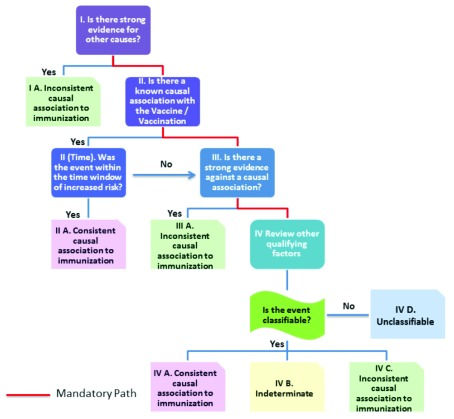
2013年3月、WHOの「AEFIに関するユーザーマニュアル」の改訂版が、新しいアルゴリズム12 とともに発表された。このマニュアルでは、CIOMS/WHOの報告書から定義や概念を取り入れたことを認めている。AEFIの新しいアルゴリズムは、図1 に再現されている。
図1 AEFI分類の新アルゴリズムの改訂を示すフローチャート
AEFI分類の改訂:因果関係の新しいカテゴリー
ワクチン投与後に発生した事象のみがAEFI因果関係評価の対象となる。この最初のStepは、優先順位と連続性についてのヒュームの口述を思い起こさせる。新しい方式では、因果関係は「予防接種との因果関係が一致」、「不確定」、「予防接種との因果関係が一致しない」、「分類不能」の4つのカテゴリーに分類される。
予防接種との一貫した因果関係
この新しい分類では、因果関係のレベルが最も高い。旧分類での「可能性が非常に高い/確実」よりも確定的なものではない。反論の余地のない証明、あるいは合理的疑いを超えた証明は要求されない。確率のバランスさえも評価されない。新制度では、有害事象は同時に「予防接種との因果関係が一致するもの」と「予防接種との因果関係が一致しないもの」に分類される。AEFI12の改訂版マニュアルの36ページには、経口ポリオワクチン接種後に急性弛緩性麻痺を発症した小児の例が示されている。この小児は麻痺発症の1カ月前に発熱があった。便培養からワクチン株ポリオウイルスが検出された。これは、ポリオワクチン接種後の既知の反応であり、麻痺はリスクが高まる時間帯に起こったため、「予防接種との因果関係がある」と分類された。また、麻痺の1カ月前の発熱が完全に調査されていないため、「予防接種との因果関係がない」と分類された。このように、正反対の結論を同時に認めてしまう曖昧さが、新しいスキームの特徴である。
AEFIマニュアル改訂版では、「特定の個人に与えられたワクチンが報告された特定の事象を引き起こしたか」という質問(Did it?)に答える前に、「与えられたワクチンは特定の有害事象を引き起こすことができるか」という質問(Can it?)に答えなければならないことが示唆されている。という質問に答える必要がある。推論すると、ワクチンが有害事象を引き起こすことができるという集団レベルでの証拠がある場合にのみ、その反応は『予防接種との因果関係の一致』と分類されることになる。
この推論には2つの点で欠陥がある。一方では、第4相試験で見られた新しい関連性をすべて否定している。一方、既知の有害事象であれば、偶然に起こったかもしれない事象であっても、因果関係が認められる。ロタウイルスワクチン接種後の有害事象として腸管喘息が認められているからといって、感受性が高まる重要な時期におけるすべての腸管喘息が、必ずしもロタウイルスワクチン接種によって引き起こされるとは限らない。この最高レベルの因果関係には不確実性が残っており、ワクチンによるAEFIの問題に対処するための価値を失っている。
予防接種との一貫性のない因果関係
新しい因果関係の分類の最下位は「予防接種との因果関係が不明確」である。このグループには、他の説明がつかない反応(従来は「可能性がある」に分類されていたもの)が含まれることがある。予防接種との因果関係が過去の疫学研究で証明されていないというだけで、「予防接種との因果関係が不明確」なグループに入ることになる。同じグループには、関連性が「なさそう」とされた反応や「関連なし」とされた反応も入る。このように多様な臨床状況に「予防接種との因果関係が認められない」という同じカテゴリーを使用することは、問題を難解にするだけである。改訂された制度では、この用語はAEFIと予防接種の間に関連性がないことを示唆するために使用されている。「因果関係なし」に分類される反応がいかに頻繁に発生しても、因果関係のある新たなシグナルとして調査されることはない。
不定期
「不確定」グループに分類されるのは、予防接種によって引き起こされた可能性があるが、過去に因果関係が証明されていない反応に限られる。不確定に分類されたAEFIに関する情報は、そのAEFIが未認識の事象の新しいシグナルであるかどうかを理解するためにプールされ分析されると予測される。しかし、この計画は、文字通りこのグループに分類されるAEFIがないように設定されている。この仕組みは後述する。
分類不能
原因の評価と特定を可能にする情報が不十分な臨床事象は、「分類不能」グループに分類される。
改訂版AEFI分類:新しいアルゴリズム
因果関係の最終的な分類が曖昧で重複し、明確に区別されていないのと同様に、因果関係12の判断に用いられるアルゴリズムも、論理的でよく考えられているとは思えない。
そのアルゴリズムを図1に示す。
因果関係評価アルゴリズム
4つの質問に順番に答えていく必要がある。
- 1.他の原因による強い証拠があるのであるか?
- 2.ワクチンやワクチン接種との因果関係が知られているか、もしそうなら、その事象がリスク増大の時間枠内にあったかどうか?
- 3.因果関係が知られていない場合、またはリスク増加の時間枠内でない場合。因果関係を否定する強い証拠があるか?
- 4.このように因果関係を否定する強い証拠がない場合、次に分類のための他の修飾因子を検討することになる。
- a.ワクチン接種とは無関係に起こりうるのか(バックグラウンド率)?
- b.その事象は他の健康状態の現れとなりうるか?
- c.以前に同様のワクチンを接種した後に、同等の事象が発生したか?
- d. 潜在的な危険因子や毒素にその事象の前にさらされたことがあるか?
- e.その事象の前に急性疾患があったか?
- f. その事象はワクチン接種とは無関係に過去に発生したか?
- g.ワクチン接種前に何らかの薬を服用していたか?
- h.生物学的な妥当性はあるか?
Step1
改訂されたアルゴリズムの最初のStepは、他の原因に対する強い証拠を探すことである。もし他の説明があれば、そのAEFIは「予防接種との因果関係が認められない」と分類される。ジョン・マッキーは、自然界では同じ結果に対して複数の理由(原因)が存在する可能性があり、2つの原因が同時に存在する場合は、どちらかが原因因子となる可能性があると述べている8。WHO-UMCのADR分類や旧WHO/BrightonのAEFI分類では、たとえ別の説明が可能であっても、薬剤やワクチンとの因果関係は「あり得る」とされていることに注意が必要である。さらに、2つの原因が相乗的に作用している可能性もある。この例として、遺伝やその他の個人の感受性因子がAEFIを発症しやすくしている場合がある15,16。新しいアルゴリズムでは、AEFIに別の説明があるか、別の因子が関与している場合、ワクチンとの因果関係は否定される12,14。
Step2
このレベルでは、ファーマコビジランスに関するCOIMS/WHOレポートが使用されている13。いくつかの反応に対するAEFI特有の症例定義が開発されている。特定のAEFIの症例定義と基準がない場合、「標準的な医学文献、国のガイドライン、または審査員がローカルに採用した症例定義」(11ページCIOMS/WHOレポート)を使って即興で行うことが許されている。症例定義に合致し、リスクが高まる時間帯に発生したAEFIは、「予防接種との一貫した因果関係」として分類される。
それぞれの有害事象の許容される時間枠は異なる。マクロファージ性筋膜炎の患者は、通常、びまん性関節痛、慢性疲労、著しい認知障害、疲労、またはうつ病を呈する中年成人であり、これは以前に免疫した部位のマクロファージ内に水酸化アルミニウムが長期間残留しているためである17。しかし、AEFIサーベイランスがこれほど長期に渡って行われることはほとんどない。
Step3
理論的には、因果関係が不明な反応や、リスクが高まる時間帯にない反応は、Step3に進むことができる。この段階では、因果関係を否定する強い証拠があるかどうかが問われる。すべての状況において、不規則な結果はあり得ないと断言することは不可能であるため、否定的な証明をすることは、非常に困難である。マニュアルに記載されている例は、MMRと自閉症に関するものである。
ワクチン安全性に関する世界諮問委員会(GACVS)と国際医学会評議会(IOM委員会)は、MMRワクチンと自閉症疾患との因果関係を示す証拠は存在しないと結論付けたと報告されている。このようなAEFIは、新しいアルゴリズムによれば、「予防接種との因果関係が認められない」と分類されなければならない。
このAEFIユーザーマニュアルの出版後、MMRと自閉症に関する結論が再び議論されるようになった(Box 3参照)。このような証拠の変化は、AEFIのアルゴリズムにこのStepを導入することの有用性に疑問を投げかけるものである。
Box3 アフリカ系アメリカ人の子供におけるMMRと自閉症リスク
2004年、CDCは、ワクチン接種を受けた子供がその後自閉症と診断されるリスクとMMRワクチン接種の年齢との間に関連はないことを証明する研究結果を発表した。このたび、著者の一人であるW・W・トンプソン博士の証言により、2歳以前にワクチンを受けたアフリカ系アメリカ人の子どもの自閉症のリスクは、2歳以降にワクチンを受けた子どもの340%であることが内部告発により明らかにされた。しかし、このデータはCDCが主張する結論に達するために、意図的に分析から外されたのである。CNNはCDCの内部告発の記事を掲載し、トムソンはオバマ政権から内部告発の免責を与えられたc。
参考文献
- a.DeStefano F,Bhasin TK,Thompson WW,Yeargin-Allsopp M,Boyle C. 自閉症児と学校適合対照者における麻疹・おたふくかぜ・風疹ワクチン接種開始年齢:大都市アトランタの人口ベース研究。小児科医。2004;113:259-66。
- b.Goldschmidt D. Journal questions validity of autism and vaccine study[Internet].CNN.com.2014 Aug 28[引用:2014 Sep 29].利用可能な場所:edition.cnn.com/2014/08/27/health/irpt-cdc-autism-vaccine-study
- c.h
Step4
このような「因果関係を否定する強い証拠」が存在しないと仮定すると、ワクチンとの因果関係が不明な反応はStep4へ進むことができる。ここで、反応が不確定と分類され、将来的に新しいシグナルとして評価される可能性がある。
この時点では、「分類可能」であるかどうか、つまりCIOMS/WHOの定義の下で分類するために必要なすべての検査が実施されているかどうかが問題となる。これは、AEFI評価中にこれらの定義が呼び出される2回目である。
もしいくつかの調査が行われなかったり、入手できなかったりした場合、AEFIは「分類不能」とされる(あるいは、OPV後の弛緩性麻痺が、麻痺の1カ月前の病気中の調査が入手できなかったため分類されたように「予防接種との因果関係が認められない」と分類される-この例はAEFIマニュアル12の付録3,36頁を参照されたい)。
もし、必要な調査をすべて行い、症例定義基準を満たしていれば、Step2で「予防接種との因果関係が一致」と分類され、Step4には来なかったはずだ。
第三の可能性は、すべての検査が行われたので分類可能だが、症例定義に当てはまらないというものである。この場合、CIOMS/WHOの原則が適用される。ある事象が症例定義に合致しないという十分な証拠がある場合、そのような事象は否定されるべきで、「AEFIの症例ではない」として報告されるべきである(CIOMS/WHO Definitions and Application of Terms for Vaccine Pharmacovigilance,page 17013 を参照のこと)。これにより、過去の疫学調査で予防接種との因果関係が認められなかったAEFIが「不確定」グループに含まれ、新たなシグナルとして評価される可能性を排除することができる。従って、Step4では、「分類不能」に分類されるか、「予防接種との因果関係が認められない」に分類されるかの2つの選択肢しかないように思われる。「不確定」または「免疫との一貫した因果関係」に分類されることは、上記のライダーを考慮すると論理的に不可能である。
この審査はこれで終わりではない。Step4では、他の適格な要因も調査される。バックグラウンド率、他の健康状態、潜在的な危険因子や毒素への曝露、急性疾患、他の投薬などの観点から、別の説明を再度検討することが推奨される。これらの「他の修飾因子」の多くは、他の原因の証拠を探す際に、おそらくStep1で除外されたはずだ。五価ワクチンが予期せぬ突然死を引き起こすという疫学的証拠(TOKEN Study)があるにもかかわらず、(冒頭で述べたように)多数の死亡例がワクチンによるものとは認められず、WHOの専門家報告書は死亡例がAEFIとして報告されたことを否定していることが、Box4から分かる。インドの保健家族福祉省のウェブサイトにアップロードされた132の深刻なAEFI事例の因果関係の評価は、この新しい分類を展開した結果を示している。このうち54人の乳児が死亡し、78人が生存している。因果関係の評価では、生存者の50%がワクチン接種による反応であったが、ワクチン関連と分類された死亡例は1つもなかった。ほぼすべての死亡例(96%)が、分類不能または偶然に分類された。これは、死亡がこのワクチンによる有害事象としてこれまで認められていなかったためと思われる18。ワクチン接種後に難治性けいれんで入院した小児は、ワクチン製剤に関連した反応と分類される可能性があるが、死亡した場合は「偶然死」と分類されることになる。
Box 4.五価ワクチン接種後の予期せぬ突然死(SUD)とTOKEN Study
AEFIに関しては、時間や場所、投与されたワクチンに関連した同じ有害事象の2つ以上の事例をクラスターと定義しているa。五価ワクチンはアジアで多数の死者を出しているが、まだ新しいシグナルとは言えないb-f.
AEFIアルゴリズムが改訂された後、死亡例は、ワクチンに関する疫学調査でAEFIとして報告されていないことを理由に、「[AEFI]の症例ではない」と分類されるようになった。しかし、TOKEN Studyはこの主張と矛盾しているg。
vonKriesは以前、認可されている2種類の6価ワクチンのうち1種類(Hexavac®)のワクチン接種後2日以内の標準化死亡率(SMR)が統計的に有意に増加することを見出し、TOKEN試験はその関連を確認または反証するために行われたものである。本研究は、Paul-Ehrlich-Institute(PEI)および連邦保健省(Bundesministeriumfür Gesundheit)の後援・協力を得て行われた。
ワクチン接種とSUDの時間的な関連を調べるために、自己管理ケースシリーズ(SCCS)を検討した。子供がSUDで死亡した場合、その保護者に研究への参加を呼びかけた。対象者の37.6%の親が参加した。研究者らは、子どもがワクチン接種後1週間以内に死亡した場合、保護者が参加する確率が2倍になることを見いだした。このバイアスを補正するために、逆確率加重解析が用いられた。著者らは、これは9カ月未満の乳児の選択バイアスを克服するのに役立ったが、それでもなお、この結果は年長児のSUDのリスクを過大評価する可能性があると指摘している。
5価ワクチン接種後(1年目,2年目)のSUDのリスク期間を接種後0~3日と対照期間4~28/183日で加重SCCS解析を行った結果,RRは8.11(p=0.006,95%CI=1.81~36.24;東研レポート表41)であった。SCCSによる重み付け解析では、6価または5価ワクチン接種後(生後1,2)のSUDの相対リスクは、リスク期間0-3日と対照期間4-28/183日で比較するとRR.2.19(p=0.031,95%CI=1.08-4.45;東研レポート表36)であった。
以上のことから、五価ワクチン使用後のAEFIとしてSUDSが起こりうるという疫学調査における合理的な証拠があり、このワクチン使用後の死亡を「AEFIのケースではない」と先験的に分類すべきではないことが明らかである。
参考文献
- a.h
- b.Lone Z,Puliyel J. インドのEPIに五価ワクチンを導入する。インドにおけるEPIへの五価ワクチン導入:注意喚起。インドJ Med Res 2010;132,: pp 1-3
- c.Puliyel J. AEFIと五価ワクチン:複合的な画像を探している。Indian J Med Ethics.2013;10:142-6.
- d.著者は記載されていない。ワクチン安全性に関するグローバル諮問委員会、2013年6月12-13日。Wkly Epidemiol Rec. 2013;88:301-12.www.who.int/vaccine_safety/committee/reports/Jun_2013/en/2015年1月11日にアクセス可能。
- e.Sreedhar S,Antony A,Poulose N. Study on the effectiveness and impact of pentavalent vaccination program in India and other south Asian countries.Hum Vaccin Immunother.インドと他の南アジア諸国における五価ワクチン接種プログラムの効果と影響に関する研究。2014;10:2062-5.
- f.Martin Schlaud M,Poethko-Müller C,Kuhnert R,Hecker H Robert Koch Institute.幼児の死亡に関する研究(生後2カ月から24カ月)(TOKEN Study)…www.rki.de/DE/Content/Gesundheitsmonitoring/Studien/Weitere_Studien/TOKEN_Studie/Studyreport.pdf?__b
- g.vonKries R,Toschke AM,Strassburger K,Kundi M,Kalies H,Nennstiel U,Jorch G,Rosenbauer J,Giani G.Sixavalent vaccines(diphtheria,tetanus,pertussis,poliomyelitis,hepatitis B,Haemophiliusinfluenzae type b)投与後の突然死と予期せぬ死亡:シグナルはあるのだろうか…。Eur J Pediatr 2005;164:61-9.
その他、用語の定義に関する微妙な変更
「因果関係」の再定義
因果関係という言葉は、現在では「原因になる因子と病気の間に、その過程に因子が介在していない因果関係があること」を意味する。これは、患者の安全にとって大きな後退である。旧制度では、例えば慢性心不全の高齢者がインフルエンザワクチン接種後に、ワクチンによる体温上昇や接種部位の局所反応によるストレスで心筋梗塞の症状を発症する可能性があると認識されていた。このような場合、ワクチンが心不全に寄与していると考えられる19。新制度では、この結果はワクチンとの因果関係とはみなされない。ワクチン接種がなければ、その時点で死亡していたかどうかが問われることはない。この認識がないと、多くの高齢者がこのワクチンを使用する際に、不必要にこの死のリスクにさらされる可能性がある。乳幼児へのワクチン接種後に突然死が発生したが、栄養失調など体調不良であった場合、因果関係の評価でワクチンと死亡との間に因果関係がないと結論づけられることはない。この定義には、相互因果関係を考慮する余地はない14,15。ワクチン安全性に関する世界諮問委員会は、心臓病の既往のある小児が五価ワクチン接種後に多数死亡したことを記録している。WHOは現在、そのような子どもたちにワクチンを接種する際の注意を呼びかけており、これによって死亡のリスクは減少している1。新しい因果関係の定義では、この関係は認められず、生命が危険にさらされることになる。
コレットらによると、一般の人と比べてワクチンに対する免疫原性反応が高い人がいる可能性があり、そのため遺伝的に決定されたAEFI発症の素因を理解することは重要である19。しかし、CIOMS/WHOの新しい因果関係評価スキームでは、このような考慮はされない。また、遺伝的要因で脳症を発症しやすい患者の脳症発症におけるワクチンの寄与も考慮されない15。Berkovicは遺伝子解析により、ワクチンによる脳症が疑われる患者のナトリウムチャネル遺伝子SCNIAのde novo変異を同定している16。不幸なことに、これらの症例では脳症の発症にワクチンが寄与していることが無視されている。
今更ながら、XがYに対してそれ自体で十分である場合にのみ因果関係を主張できるというヒュームの誤謬に陥り、予防接種が有害事象に「実質的に寄与」した可能性があるという事実が無視されているのは残念なことだ。
生物学的妥当性
生物学的妥当性は、ブラッドフォード・ヒルの「指導原則」の一つであり、因果関係を肯定するものである10。しかし、この原則は現在の知識によって制限されるものであり、それだけで因果関係を否定してはならない。例えば、現在では、高力価の麻疹ワクチンが女性の過剰死亡と関連していることが認められている20。この関連性の認識は、生物学的に妥当な説明がなかったため、遅れていた。WHOの専門家は、ワクチンには自然免疫系と適応免疫系の両方をアップレギュレートまたはダウンレギュレートする非特異的効果があり、これが子供の生存に影響を与える可能性があることを現在認めている21。
ロタウイルスワクチン接種と腸重積の関連も、生物学的に妥当な説明がつかない時期に認められた11(Box 5 参照)。したがって、ワクチンには非特異的な有益作用と予期せぬ有害作用の両方があり、それが最初に認識されたときに、その説明がつかないからといって無視してはならない。
Box5 インドのロタウイルスワクチン試験
安全性データのない「ロタバック」のプリクオリフィケーションについて
ロタシールドは、ワクチン接種を受けた子ども1万人あたり1人の腸重積症を過剰に発生させたため、回収された11。
しかし、新しいロタウイルスワクチンRotavac(Bharat Biotec)が、3つのセンターで合計4500人の小児に投与された試験(サンプル数が少なすぎて、1万人に1人という稀な事象を明らかにできない)a、bを経て、インドで認可されたのである。サンプル数が少ないにもかかわらず、このワクチンで腸仙症が非常に多かったようで、あるセンター(Vellore)では、対照群よりも有意に高かった。試験担当医師は再三の要求にもかかわらず、この分離されたデータの提供を拒否したd.政府は市販後調査で安全性を監視することを約束した。しかし、この試験の参加者は、(倫理的な臨床試験で義務づけられているように)RCTで見られたリスクについて説明されず、監視はワクチン接種後数週間という限られた期間であり、RCTで見られた有害事象はその期間外でのものであった。小児外科医や放射線科医がいないこの国の遠隔地では、腸重積による死亡が赤痢による死亡と誤って分類される可能性が高い。
この市販後調査のデータが出る前に、WHOは最近、このワクチンを国際的に使用することを認めたe。
ロタウイルス下痢症を減少させるが、下痢症全体の発生率を減少させない他のロタウイルスワクチンfや、下痢症全体の発生率を減少させるのではなく、増加させる他のワクチンの臨床試験が発表された。
参考文献
- a.Bhandari N,Rongsen-Chandola T,Bavdekar A,John J,Antony K,Taneja S,Goyal N,Kawade A,Kang G,Rathore SS,Juvekar S,Muliyil J,Arya A,Shaikh H,Abraham V,Vrati S,Proschan M,Kohberger R,Thiry G,Glass R,Greenberg HB,Curlin G,Mohan K,Harshavardhan GV,Prasad S,Rao TS,Boslego J,Bhan MK.の6名の研究者が参加した。 インドロタウイルスワクチングループ。生後2年目のインドの小児における一価ヒト-ウシ(116E)ロタウイルスワクチンの有効性。Vaccine.2014 Aug 11;32 Suppl 1:A110-6. doi: 10.1016/j.vaccine.2014.04.079. www.ncbi.nlm.nih.gov/pubmed/25091663
- b.John J,Kawade A,Rongsen-Chandola T,Bavdekar A,Bhandari N,Taneja S,et al. インドにおける経口一価ロタウイルスワクチンの第三相有効性試験における腸重積症のアクティブサーベイランス。Vaccine.2014;32(August(Suppl. 1)):A104-9/dx.doi.org/10.1016/j.vaccine.2014.03.036.
- c.Bajaj J,Puliyel JM.南インド、ベロールにおける116Eロタウイルスワクチンの腸重積リスクVaccine.2016 Jan 20;34(4):403. doi: 10.1016/j.vaccine.2015.03.007.Epub 2015 Mar 21. www.ncbi.nlm.nih.gov/pubmed/25800733
- d.Puliyel JM.116 E Rotavirus Vellore Study。ワクチン安全性データの要請。インドのロタウイルスワクチンに対する反応腸重積症の懸念は根拠がない、と研究者たち。www.bmj.com/content/350/bmj.h2867/rapid-responses
- e.h
- f.Kulkarni PS,Desai S,Tewari T,et al. インドの乳児におけるウシ・ヒト再活性化五価ロタウイルスワクチンの有効性を評価する無作為化第III相臨床試験。Vaccine.2017. www.ncbi.nlm.nih.gov/pubmed/28967523
- g.Kaur J,Puliyel J. Heat-stable oral rotavirus vaccine.N Engl J Med.2017;377:302www.ncbi.nlm.nih.gov/pubmed/28328346
生物学的妥当性の再定義
生物学的妥当性という用語の意味は、改訂版AEFIマニュアルで再定義されている。このマニュアルでは、生物学的妥当性は、検査所見や症状・徴候が感染症や抗原の自然史や病態生理と類似または一致する場合にのみ発動されることが明記されている。その他の生物学的に妥当な説明(原因から結果へ導くメカニズムや能力があることを示す)7は、適格ではない。Bradyの言う因果関係を確認する4つのアプローチとは、新ヒューム的規則性の検出、反事実の検討、実験操作、メカニズムと能力の検討である7。新AEFIは、実験的アプローチのみを認め、他の有効なアプローチを除外しているため、結果として、多くのケースで因果関係を検出できず、被害が発生する可能性がある。
慢性疲労症候群とHPVワクチン試験
上記の議論では、認可前のオリジナルの無作為化対照試験で報告された有害事象は、ワクチンに関連することが知られている有害事象として分類されることを前提としている。
スレートは、ヒトパピローマウイルス(HPV)ワクチンの無作為化試験を調査し、潜在的な副作用が1年間の研究の中でわずか2週間しか収集されていないことを明らかにした。2週間後、治験責任医師は個人的な判断で、医学的問題を有害事象として報告するかどうかを決めていた。多くの場合、彼らは新しい問題を「新しい病歴」として記載した。筋痛性脳脊髄炎は、慢性疲労症候群(CFS)として知られ、長期間の疲労によって通常の日常生活が制限される疾患である。HPV試験の参加者は、自分のこれらの衰弱した症状が有害事象として登録さえされていなかったとスレートに報告している。
CFSが有害事象として記録されていないことから、メーカーはCFSを「ワクチンの既知の有害事象」ではないと主張し、その後に報告されたすべての症例を割り引くことができたのである。
ロタウイルスワクチン試験
Box 5は、無作為化臨床試験(RCT)で記録され、ワクチンの承認と認可のために規制当局に送られる有害事象が、どのように公開されないかを説明したものである。これは、臨床試験報告書は一般に公開されるという欧州司法裁判所の判決に反している。
AEFIを記録・報告する際のその他の問題点
Box6は、Infanrix Hexaの安全性定期報告書(PSUR)15,16とその所見がイタリアの裁判所により公開された経緯、Box 7は、PSUR 19が情報公開規則に基づいて入手され、PSUR 16で報告された死亡が偶然に予想される死亡を上回ることが明らかになりPSUR 19から削除された経緯について述べている22。1986年、ロナルド・レーガン大統領は、ワクチン関連傷害を補償する無過失補償制度を創設する全米小児ワクチン傷害法(NCVIA)(42 U.S.C. §300aa-1 to 300aa-34)に署名した。これにより、ワクチン製造業者を訴えることが困難となった。また、VAERS(Vaccine Adverse Event Reporting System)が設置され、有害事象の報告が義務付けられた。Box 8は、患者がメーカーに製品による有害事象の責任を問うことを妨げる変さらについて述べている。Box 9は、AEFIデータが容易に入手できなくなったことについて示している。一方では、新しい分類がAEFIを「Not a case of[AEFI]」として割り引く一方で、安全性データは操作され、アクセス不能になっている。
Box6. 安全性に関する定期的な最新報告書:公衆の消費に適さない?
イタリアのニコラ・ディ・レオ判事は、Infanrix hexa(GlaxoSmithKline Biological社製)の第15回および第16回定期安全性アップデート報告書(PSUR)を「機密」として公開し、これがインターネット上で公開されているa。
246-9ページでは、ワクチン接種後の「突然死」の数が、自然界に存在する突然死の発生率から予想される死亡数を超えているかどうかを検証するための分析が行われている。バックグラウンドの発生率は、1年目は0.454/1000,2年目は0.062/1000と計算されている。悪名高いAEFI報告率については考慮されていない。1日目から20日目までの間に偶然に起こることが予想される突然死の数は、24ページの表36に表されている。ワクチン接種後の死亡を調べるために使用された分母は、ワクチン接種を受けた子どもの数ではなく、ワクチンの配布数である。この分母では、実際に接種された数よりも多くのワクチンが配布されるため、潜在的なシグナルが希薄になってしまうのである。
さらに、実際に投与された回数は、投与のたびに再発するような軽度の反応には適切かもしれないが、一度しか起こらないような死亡例には適切ではない。付録5Aでは、13例の死亡例が報告されている。1回目の投与後の死亡例は2回目、3回目の投与後よりも多く、2回目の投与後の死亡例は3回目の投与後よりも多かった。このパターンは、因果関係のあるAEFIでよく見られるものである。これらすべてのケースで適切な分母は、ワクチン接種を受けた赤ちゃんの数である。
ワクチン接種後3日間の死亡例は42例で、その後の3日間の死亡例は16例であった。ワクチン接種後すぐに死亡が集中したことは、死亡がワクチン接種のイベントに関連している可能性を示唆している。
患者の安全性データは、どう考えても企業秘密とみなされるべきではない。安全性報告書を秘密にするという慣行は、公的な監視の目から逃れ、規制当局との癒着の中で、このようなデータ操作を許している。このような慣行は改革されるべきである。
参考
a autismoevaccini.files.wordpress.com/2012/12/vaccin-dc3a9cc3a8s.pdfアクセス数:12/11/15
Box7
EMAと規制監視の失敗:PSURへの批判的評価の不在
グラクソ・スミスクライン(GSK)、Infanrix hexaに関する第19回定期安全性アップデート報告書a(PSUR 19(2014年10月22日までの死亡例)の機密事項が興味深く読める。Infanrix hexaは、全細胞百日咳を無細胞百日咳成分に置き換えた以外は五価ワクチンの成分をすべて持ち、さらに、注射用ポリオワクチンも入っている。第19報で報告されたワクチン接種後の累積死亡数は、第16報のPSURで報告された数より少ない。1歳以上の小児の死亡数は、第16回PSURから削除された死亡数を元に戻すと、偶然に予想される死亡数よりかなり多くなっていることがわかるb. 1歳以上の小児の死亡数は、第16回PSURから削除された死亡数を元に戻すと、偶然に予想される死亡数よりかなり多くなっている。
EMAは、メーカーが提出したPSURレポートを批判的に検討することなく受け入れているようだ。国際的な規制当局は、このような状況下でEMAによるデューデリジェンスに依存している。これは再評価される必要があるかもしれない。
参考
- a. ijme.in/wp-content/uploads/2017/09/infanrix-pusr.pdf
- b. ijme.in/articles/infanrix-hexa-and-sudden-death-a-review-of-the-periodic-safety-update-reports-submitted-to-the-european-medicines-agency/?galley=html
Box8 製造物責任:特許ではなく、患者を守る
Hexavac-六価ワクチン(DTaP-IPV-HepB/Hib)-は、ワクチン投与後48時間以内に5例のSIDSがジンカーの報告により、メーカーが理由を示さずに撤回したa.vonKriesは、生後2年目において、ワクチン接種後1日以内の原因不明の突然死(SUD)の標準化死亡率(SMR)は31.3(95%CI 3.8-113.1)、接種後2日以内は23.5(95%CI 4.8-68,6)であるとしたb.
同様にRotaShieldも12例の腸炎が報告された後、自主的に市場から撤去された。この年齢での腸瘻のバックグラウンド率は、ワクチンによる腸瘻のリスクの5倍であった。腸炎と予防接種を関連づける生物学的に妥当な説明はなかった。しかし、このワクチンは中止された。
メーカーはその理由を示すことなく、自主的にワクチンを中止した。製造物責任訴訟の可能性がメーカーの注意に影響したかどうかは不明である。
1980年以降、2つの大きな変化が起こった。これらの変化の結果として、ワクチン製造業者が欠陥製品の販売責任を問われる脅威は大きく減少した。
- 1.1980年代から1990年代にかけて、多くの国で無過失補償制度が導入された。これは、ワクチンで傷ついた子どもたちが補償を受けるには、その原因として過失を明確に証明する必要がないことを意味する。しかし、これは製造者が非を認める必要がないことも意味している。製造物責任のリスクは、政府によって無過失補償が提供されるようになったことで、大きく減少した。その結果、製造業者はワクチンの安全性に関してより無謀なことをするようになるかもしれない。
- 2. 2つ目の大きな変化は、2013年にAEFIの評価方法が全面的に見直されたことである。AEFIが繰り返し起こるという時間的な関連性を示すだけでは十分ではなくなった。下のフロー図は、AEFIが「予防接種との一貫した因果関係」と表示されるまでに満たす必要のあるすべての条件を示している。これもまた、製造業者が副反応に関してより無謀になることを助長しかねない。
参考文献
- a.Zinka B,Rauch E,Buettner A,Ruëff F,Penning R. 六価ワクチン接種後間もない乳児突然死の原因不明の症例。Vaccine.2006;24:5779-80.
- b.vonKries R,Toschke AM,Strassburger K,Kundi M,Kalies H,Nennstiel U,Jorch G,Rosenbauer J,Giani G. 六価ワクチン(ジフテリア、破傷風、百日咳、ポリオ、B型肝炎、ヘモフィルスインフルエンザb)投与後の突然死:シグナルはあるのかEur J Pediatr.2005;164:61-9.
- c.米国疾病管理予防センター。ロタウイルスワクチン(ロタシールド)と腸重積症www.cdc.gov/vaccines/vpd-vac/rotavirus/vac-rotashield-historical.htm.
- d.予防接種に起因する有害事象に伴う無過失補償:国際プログラムのレビュー。世界保健機関(WHO)紀要2011;89:371-378.www.who.int/bulletin/volumes/89/5/10-081901/en/2015年10月23日にアクセス可能。
Box9 AEFIデータへのアクセスの難しさ
- インドにおけるポリオと急性弛緩性麻痺について有害事象に対する一般の人々の意識が高まるにつれ、有害事象に関するデータを入手することが難しくなってきている。インドでは、全国ポリオサーベイランスにより、急性弛緩性麻痺の月次データが提供されている。このデータを分析したところ、2011年には、一般的に標準とされている非ポリオAFPの2/10万人よりも多い47,500人の子どもが新たに麻痺を発症したことが明らかになった。非ポリオAFP率は、過去3年間の累積投与回数と最も良い相関があったa。5歳以下の子どもへの投与回数が減った2年後に分析を繰り返したところ、AFP率が減少に転じたことがわかったb。ただし、ナショナル・ポリオ・サーベイランス・プロジェクト/WHOのウェブサイトでは、このデータは提供されなくなった。
- ワクチンに関するデータ解析プリント英国政府の医薬品・ヘルスケア製品規制庁(MHRA)は、有害事象の「イエローカード」通知から、簡単にアクセスできるDrug Analysis Printsとinteractive Drug Analysis Profiles(iDAPs)のcを提供している。しかし、これはワクチンには提供されていない。MHRAファーマコビジランスに依頼する必要がある。
参考文献
- Vashisht N,Puliyel J. Polio program: Let us declare victory and move on.インドJの医療倫理。2012年4月-6月;9(2):114から7まで。
- Vashisht N,Puliyel J,Sreenivas V.Trends in nonpolio acute flaccid paralysis incidence in India 2000 to 2013.Pediatrics.2015 Feb;135 Suppl 1:S16-7. doi: 10.1542/peds.2014-3330DD.PMID: 26005734
生物学的妥当性:多価ワクチンによる反応
ゴールドマンらは、予防接種後の死亡例のVAERSデータを見ると、5~8種類のワクチンを一緒に接種した赤ちゃんでは、接種回数が少ない赤ちゃんに比べて死亡率が高いことを明らかにした23。Boatman v. Secretary of Health and Human Services,13-611(Fed.)という事件では。CI 2017)では、生後4カ月の乳児が1日に7つのワクチン抗原を受けた場合、裁判所は専門家の意見を聞いた後、ワクチンで刺激された炎症性サイトカインは神経調節物質として作用し、乳児髄質のセロトニン作動性5-ヒドロキシトリプトファン(5-HT)系の抑制を起こし、過剰二酸化炭素に対する通常の化学感受性反応を鈍らせ、これにより脆弱な乳児を睡眠中に死亡させると判示した。複数のワクチンを接種すると、より大きなサイトカインの放出が誘発される。Hillの用量反応勾配(この場合抗原の数)の基準は、ここでも満たされるかもしれない10。
イタリア軍で5人に制限された複数ワクチン
イタリア議会委員会(Doc. XXII-bis N.23)は、海外に派遣されたイタリア軍人の死亡と重傷の事例について調査し、副反応を避けるために軍人に一価の単一投与ワクチンを同時に5つまでしか与えないよう勧告している。これらのことは、複数のワクチンを同時に使用することに注意が必要であることを示唆している。皮肉なことに、健康な成人軍人には禁止されているのに、イタリアではヘキサバック(6つの抗原を組み合わせたもの)は乳児への使用がまだ許可されている。
改訂版AEFI分類と予防原則
CIOMS/WHOが作成した改訂版AEFI評価スキームは、新たに観察された有害事象が予防接種と因果関係がある可能性を否定するように作られていることは、先の議論から明らかである。AEFIマニュアルには「ワクチンや予防接種が有害事象を引き起こすという疑惑には、迅速かつ効果的に対処しなければならない」と記されている。これを怠ると、ワクチンに対する信頼が損なわれ、最終的には予防接種の普及率に劇的な影響を与えることになる…」と述べている12。
図2は、ワクチンの副作用として知られているものを除くすべての症例AEFIを、因果関係がないものとして分類したものである。
図2
予防接種との一貫した因果関係」ステータス達成への道筋。
AEFI否定論は、「ある活動が環境や人間の健康に害を及ぼす恐れがある場合、たとえ因果関係が科学的に完全に確立されていなくても予防的措置をとるべきである」という「予防原則」(欧州連合法)に明確に違反するものである。社会と政府は、完全な科学的根拠が得られるまでは、リスクの証拠がある場合には予防措置を講じなければならない」と要請されている。ワクチン接種との新たな因果関係を全面的に否定できるこの新しいAEFI分類法は、欧州人権条約第2条(ECHR第2条)にも抵触する恐れがある。同条は、政府に対して、合理的に実行可能な最大限の範囲で、生命を保護する法律、予防措置、手段の枠組みを確立するよう命じている。
逆説的だが、AEFIアルゴリズムはワクチンの安全性のためと言われている。ワクチンの安全性よりも、公共の安全性のためのスキームが必要なのかもしれない。
五価ワクチンについては冒頭で紹介したが、その概要はBox 10にまとめられている。五価ワクチンは主に、AEFIサーベイランスが不十分で、マスコミが有害事象をあまり警戒せず、医薬品規制が厳しくない発展途上国で使用されるワクチンである。(欧米の豊かな国々では、全球百日咳ワクチンは使用されていないため、このワクチンはこれらの国では販売されていない)。原因不明の死亡例は、依然として報道されている。新しいAEFI分類では、ワクチンと死亡を結びつける「疫学的証拠」がないため、これらの死亡は「偶然の」SIDS死亡として見過ごされてきた。しかし、現在では、死亡とワクチンを結びつける疫学的証拠が得られている。
Box 10 AEFIの定義を変えたワクチン
五価ワクチンの話
1949年、ジフテリア、破傷風、百日咳を予防するDTPワクチンが導入された。最初の2つは頻繁に致命的な病気になる。しかし、DTPは神経系の副作用、発作、脳症、低血圧エピソード(HHE)bの原因となった。アセロラDTaPが開発され、欧米ではこれがDTPに取って代わった。
1981年にB型肝炎が導入された。B型肝炎に感染すると、特に出生時に獲得した場合、慢性肝疾患や肝細胞がん(HCC)を引き起こす可能性がある。発展途上国ではワクチンの普及が進んでいなかった。その理由の一つは、インドのような潜在的にワクチン普及率の高い国ではB型肝炎はよく見られるものの、HCCの発生率は非常に低かったからだc。現在では、インドの新生児は、母親から赤ちゃんへの受動免疫によって、幼少期(慢性キャリアになる可能性が最も高い時期)に保護されていると考えられている。しかし、ワクチンが普及すると、これが失われ、逆説的にHCCが増加する可能性がある。
1987年にタンパク質結合型Haemophilus influenza type bワクチンが導入された。アジアにおけるインフルエンザ菌b型の侵入性疾患の発生率は低く、これはおそらくHib莢膜多糖体fと交差反応性抗原を持つ他の細菌からの交差防御によるものであろう。アジアではHibワクチンの接種率が低い。
五価ワクチンは、HibやB型肝炎の接種率を向上させるために、使われていない新しいワクチンをDTPなどの先行するUIPワクチンと組み合わせることで、新しいワクチンがUIPgにおんぶにだっこの形で導入されたと言われている。五価ワクチンは、DTaPに切り替えていない発展途上国でのみ使用された。
五価ワクチンには死亡例がある。スリランカでの死亡例の調査では、ワクチンとの関連が「おそらくある」と報告するのではなく、WHOの専門家がブライトンの分類から「可能性がある」「可能性がある」というカテゴリーを削除してしまったのである。この場当たり的な即興は医学雑誌で報告された。その後、AEFI分類は正式に改訂され、第4相試験(市販後試験)で初めて注目された反応(この場合は死亡)はすべて「予防接種との因果関係の否定」として分類され、「偶然のSIDS死亡」として受け流されるようになったのである。
DTPワクチン接種を受けた4500万人の乳児と五価ワクチン接種を受けた2500万人の乳児を含む新しい研究は、五価ワクチン接種後の死亡の確率がDTPに比べて2倍(OR 1.98(95%CI 1.65 to 2.38))であるという疫学的証拠を今提供する。DPTから五価ワクチンへの切り替えにより、政府の監視システムに報告された72時間以内の死亡が122件(95%CI:101-145)追加された。これらの死亡の多くは、AEFIマニュアルが改訂されず、AEFIがより早く評価されていれば回避できたはずだ。実際、DTP-B型肝炎-Hibの混合ワクチンは、別々に接種した場合よりも局所的な反応を引き起こし、効果が低いことがよく知られている。これらの病気に対する予防は、ワクチンを別々に接種していれば、より効果的であったかもしれない。
参考文献
- a.h
- b.h
- c.…www.ncbi.nlm.nih.gov/pubmed/?term=Hepatitis+B+in+India%3A+Systematic+review+%26+report+of+the+_IMA+s
- d.h
- e.h
- f.…www.ncbi.nlm.nih.gov/pubmed/?term=Natural+免疫+to+Haemophilus+influenza+b+in+infancy+in+Indian+chi。
- g.h
- h.h
五価ワクチン接種後の死亡が単なる偶然のSIDS死亡であるかどうかを調べるために、DTPワクチン接種を受けた4500万人の乳児と五価ワクチン接種を受けた2500万人の乳児を対象にした研究が行われた。この研究では、DPTに関連した死亡(接種後72時間以内に政府の監視システムに自己申告)はすべて偶然のSIDS死亡である可能性があるが、5価ワクチン接種後の死亡率の上昇は5価ワクチンによるものと想定しなければならない。五価ワクチン接種後の死亡のオッズはDTPの2倍(OR 1.98(95%CI 1.65~2.38)であった。DTPの代わりに五価ワクチンを接種した場合、100万人あたり4.7人(95%CI:3.5~5.9)の追加死亡があった(p<0.0001)。このエビデンスがまとまるまでに、DPTから五価ワクチンへの切り替えによる122人の過剰死亡(95%CI: 101-145)が政府に報告された。この問題認識の遅れにおける新しいAEFI分類の貢献は、厳しいものである24。
ブライトン改訂の必要性
改訂された分類では、AEFIの分類から「おそらく」と「可能性」のカテゴリーが削除されている。これは、スリランカの死亡事故を調査した専門家と非常によく似ている。これは、ワクチン接種へのためらいとそれに伴うワクチンで予防可能な病気のリスクを減らしたいという賞賛に値する願望によって動機づけられているようである。スリランカの報告書では、「このレビューでは、有害事象や死亡の結果にワクチンが寄与したという証拠がないにもかかわらず、その事象や結果の別の原因(または原因)に関する決定的な証拠がない場合、症例は可能性が低いと分類された」と述べている。つまり、AEFIを「無関係」のカテゴリーに分類することは完全には正当化できない(他の原因に決定的に帰することができないため)と判断した。このような場合、ワクチンまたはワクチン接種が基礎疾患を明らかにした可能性を議論する場合でも、「可能性は低い」という結論は、ワクチンが死亡の主要原因ではないことを意味すると述べている。
スリランカの専門家は、死因を「可能性が低い」と分類することさえ、因果関係の可能性があると解釈されかねないとして、難色を示したようだ。報告書から引用すると、「可能性は低い」である。このカテゴリーを定義するにあたり、パネルは、WHOのカテゴリー「unlikely」が、有害事象と投与されたワクチンとの間に何らかの因果関係がある(逆に)可能性があると解釈されがちであることに留意した」
同じ理由と動機(AEFIとワクチン接種の因果関係に対する国民の不安を和らげるため)が、AEFI分類の改訂の原動力となったと推測される。
その余波
ワクチンは害よりも効き目があるということが、信仰の対象、教義、信条として受け止められている。もし、このAEFI否定論の目的がワクチンへの信頼を損なわないことであるなら、この計画は機能していないように思われる。実際、ワクチンは安全であると安心させるためのこうした努力によって、一般の人々の懐疑心は弱まるどころか、むしろ高まっているようである25,26。その結果、ワクチンで予防可能な疾病が大流行したのである27。
米国の一部の州では、公立学校への入学にワクチン接種を義務付けるという対応がとられている。カリフォルニア州では2016年7月1日から、ワクチン接種の個人的・宗教的信念による免除が認められなくなった。2016年の米国共和党大統領候補の討論会では、この施策への支持が広がっていないことが示唆されている。現在、保健福祉省公民権局は、良心や信教の自由が侵害された場合、個人が苦情を申し立てることができる良心・信教の自由課を設置している。これらの力がどのように作用するかは誰にもわからないが、現在のシナリオはワクチンと任意接種に対する国民の信頼にとって悪い予感がする。
これからどうするのか
AEFIマニュアルの再評価と改訂が早急に必要である。問題点を拾い上げると同時に、子どもの死亡率の大幅な減少につながったワクチンへの不信感を抱かせないような、よりよいシステムを構築する必要があるのである。
有害反応や死亡は、小規模な安全性試験では有意な増加として現れないかもしれない。しかし、予防接種後の死亡や重篤な有害事象の記録はすべて保存され、安全性のシグナルがないか定期的に見直す必要がある。これらの記録を「予防接種との因果関係が認められない」として廃棄する習慣は改める必要がある。DTPと五価ワクチンで行われたように、同じ年齢で接種したワクチンの有害事象を比較することで、どちらかのワクチンに関連した有害事象を特定することができるかもしれない。また、有害事象の性差別発生率も指標となるかもしれない。より良いシステムが開発されるまでは、WHO-UMCの死傷者分類とブライトン分類に戻り、子供の安全側に立つことが望ましいと思われる。
謝辞
Lucija Tomljenovicから原稿作成中に受けた情報提供や示唆に感謝する。
David Leggeは、BMJ13号に掲載された最初の批評の執筆に協力した。出版用に送る前に、彼は2016年3月に世界保健機関(WHO)の予防接種・ワクチン・生物学部門に手紙を書いた。しかし、この手紙に対してWHOからの回答はなかった。