コンテンツ
Repurposing of Chronically Used Drugs in Cancer Therapy: A Chance to Grasp
pubmed.ncbi.nlm.nih.gov/37370809
オンライン公開 2023 Jun 15.
PMCID: PMC10296024
PMID: 37370809
要旨
簡単な要約
癌による死亡者数は世界中で憂慮すべきペースで増加しており、この事実は癌治療に伴う副作用、選択性、耐性などの課題に関連している。予防薬や治療薬の継続的な開発が急務である。薬剤の再利用は、より早く、より安全で、より簡便で、より安価な再利用薬剤をもたらす創薬戦略として支持されている。本総説では、慢性的に使用されている抗糖尿病薬や降圧薬が、リパーポージング戦略によって、さまざまなヒトの悪性腫瘍の予防や治療に役立つことを示す。慢性的に使用されている薬剤の安全性、忍容性、低用量での有効性、長期使用への適性は、他の薬剤クラスと比較して格別の利点をもたらす。抗糖尿病薬や降圧薬には、様々なヒト悪性腫瘍の治療に有望な臨床エビデンスが存在する。この総説は、がん、糖尿病、高血圧を管理する臨床医に新たな知見を提供するものである。
要旨
癌治療のための創薬が進歩しているにもかかわらず、薬剤の再利用は依然として例外的な日和見的戦略である。このアプローチは、がん治療に伴う副作用、耐性、コストなどの課題を克服するために必要な多くの利点(より速く、より安全で、より安価な薬剤)を提供する。しかし、すべての薬剤が患者の状態や長期間の使用に適しているわけではない。そのため、慢性的に使用されている薬剤の再利用はより魅力的である。本総説は、ヒトの悪性腫瘍に対する世界的な闘いにおいて、抗糖尿病薬と抗高血圧薬を再利用することの重要性を強調している。複数のリソース(PubMed、Google Scholar、ClinicalTrials.gov、Drug Bankデータベース、ReDoデータベース、National Institutes of Health)から、抗糖尿病薬および抗高血圧薬の抗癌活性に関する利用可能なすべてのエビデンス(2023年3月30日まで)を広範に検索した。
興味深いことに、92以上の臨床試験が、14の糖尿病治療薬と降圧薬の15以上のがん種に対する抗がん作用を評価している。さらに、これらの薬剤のいくつかはフェーズIV評価に達しており、抗癌剤としての正式な発売が有望であることを示唆している。この包括的な総説は、抗がん作用を有するさまざまな糖尿病薬および降圧薬について、そのメカニズムや開発・評価段階に関する利用可能な証拠とともに最新の情報を提供するものである。従って、抗癌剤の発見や癌の管理に興味のある研究者や臨床医に役立つものである。
キーワード
リパーポージング、腫瘍学、オフターゲット、抗高血圧薬、抗糖尿病薬
1. はじめに
がんは、世界中の医療システムを圧迫する最も重大な健康問題であり[1]、2040年までに2,700万人以上のがん患者が新たに発生すると予測されている[2]。また、がんによる死亡者数も世界中で憂慮すべきペースで増加しており、国際がん研究機関(IARC)の推計によれば、2020年には約1,000万人の死亡が報告され、[3]、2040年には1,600万人以上に達するとされている。[2]。残念なことに、喫煙、不健康な食事、運動不足、その他の環境因子などの危険因子の蔓延が劇的に増加していることが、この増加をさらに激化させている。[4]。がん生物学が進歩し、様々な治療法が利用できるようになったにもかかわらず [5]、最も一般的な悪性腫瘍と死亡率は、特に低所得国や中所得国において増加している。[6]。現在のがん治療法は、選択性、特異性、複雑性、副作用、そして最も重要なこととして薬剤耐性に関連する複数の課題を抱えている。[7,8,9,10]。加えて、不均一性はすべての癌の特徴であり、ほぼすべての治療法とすべての癌種において、異なるメカニズムで薬物反応に影響を及ぼすが、薬剤耐性、ひいては治療失敗の主要な原因でもある。[11]。腫瘍の不均一性は多因子性であり、がん細胞の分化や発生状態、隣接する正常細胞の生物学的性質(内在性因子)、腫瘍微小環境や遺伝子変異(外在性因子)に起因するものであるため、これは当然のことである。[12]。その結果、腫瘍の代謝プロファイルは非常に不均一であり、特異的な治療戦略を開発・実施する上で深刻な課題となる。[13]。
さらに、化学療法剤、特にがん細胞の代謝経路やシグナル伝達に影響を及ぼす化学療法剤の長期使用は、腫瘍形成、転移、薬剤反応、再発、薬剤耐性、がん幹細胞にも影響を及ぼす。[14,15,16]。機能的精密医療または個別化医療は、腫瘍の脆弱性に関する情報を提供し、患者の転帰を改善するために、静的な特徴ではなく動的な特徴に従うもので、がん患者の治療におけるもう一つの戦略である。[17]。以上のことから、これらの現在および将来の課題を克服するために、治療戦略を再考し、より効果的な抗がん剤を開発するための継続的な努力が必要である。[18]。
薬剤の再利用は、創薬における例外的なオポチュニスティック戦略であり、[19]、臨床的に承認されている既存の非がん治療薬の新たな適応を探索するものである。[20]。新しい戦いのために古い武器を使うようなものである。薬剤の再利用(drug repurposing)」という概念には、他の病態を治療するために、承認された薬剤の「オフターゲット」効果や新たに認識されたオンターゲット効果を探索することが含まれる[19,21]。この戦略は、従来の医薬品開発法に比べ、より短期間で安価な医薬品開発プロセスを実現できるという点で有利である。[21,22]。薬剤再利用の長所と短所について論じることは、この総説の範囲を超えるので、興味のある読者は他の文献を参照されたい。[6,20,21,22,23,24,25]。
とはいえ、シルデナフィル、アスピリン、フマル酸ジメチルなどの古くからある薬剤を含め、再位置付けされた薬剤の例がいくつかあり、医学の歴史を彩ってきたことは注目に値する。[22]。腫瘍学では、リパーポーズ自体は新しい概念ではない。成功例は前世紀に遡り、当初は鎮静剤として使用されていたサリドマイド [27]が、多発性骨髄腫の治療薬として再位置付けされ、1998年にFDAに承認された。[28]。毒物である三酸化ヒ素やビタミンAの代謝産物であるオールトランス型レチノイン酸は 2000年に急性前骨髄球性白血病の治療薬としてFDAに承認された他の化学物質の例である。それ以来、リパーポージングは、効率と有効性に関する新たな洞察をがん研究にもたらした。その結果、今日の文献には、前臨床研究、観察研究、臨床研究、そしてFDAが承認したがん治療薬のリパーポーズが余すところなく掲載されている。例えば、PubMedで、”repurposed anti-cancer drugs “と検索すると、過去10年間(2014-2023)で580件以上の結果が得られ、強い増加傾向を示している。
薬剤の再利用の重要性にもかかわらず、薬剤の種類やクラスにかかわらず、免疫抑制剤[32]や抗炎症剤[33]のように、長期間使用できなかったり、患者の状態に適さなかったりする薬剤クラスもある。さらに、抗菌薬は微生物耐性や感染制御の喪失のリスクを高める可能性がある。さらに、いくつかのクラスの薬剤を再利用する場合、新しい適応症に基づく再製剤や再投与が必要となり、より複雑になる可能性がある。[21]。上記のような潜在的な制約があるため、慢性的に使用されている抗糖尿病薬や降圧薬の再利用は、より魅力的なものとなっている。
2. では、なぜ抗糖尿病薬や降圧薬の再利用は例外的なのか?
経口糖尿病治療薬や降圧剤は、長期間にわたって毎日服用する慢性薬である。それらは最小限の用量で有効であり、忍容性が高く、特許切れであり、安全性プロファイルもよく知られている。[35]。したがって、慢性的に使用されている薬剤の利点は、規制上の問題や特許政策など、他の薬物クラスの再利用の限界を上回ることができる。[36] [21]。さらに、以下に述べるように、がん、糖尿病、心血管系疾患との間に知られている関連は、がんに対する抗糖尿病薬や抗高血圧薬の再利用を支持するものである。
2.1. 糖尿病と癌の関係
糖尿病(特に2型糖尿病)と発癌の間には強い関連が存在する。[37]。がんと糖尿病はしばしば共存する疾患である。興味深いことに、多くのがん、特に膵臓がん、肝臓がん、乳がん、膀胱がん、子宮内膜がん、腎臓がんなどが糖尿病と顕著に関連している。[38]。したがって、興味深い。「逆因果」現象も存在する可能性がある。[39]。抗糖尿病薬と癌の発生率および死亡率との関係については、議論のあるデータが存在する。[40]。
それにもかかわらず、多くの研究が、がん治療における抗糖尿病薬の有益な効果を報告している。[38]。スルホニル尿素薬、ビグアナイド薬、チアゾリジン薬、ナトリウムグルコース共輸送体-2(SGLT2)阻害薬、ジペプチジルペプチダーゼIVなどの抗糖尿病薬は、多くのがんの治療において有益な効果を発揮することが報告されている。[41]。抗糖尿病薬のがんに対する活性は、がんと糖尿病との代謝的関連(すなわち、高血糖、高インスリン血症、炎症、酸化ストレス、肥満)に起因している。[39]。さらに興味深いことに、最近の報告では、抗糖尿病薬ががん細胞の代謝に影響を与えることによって直接的に、また腫瘍の危険因子に影響を与えることによって間接的に、がんの発生率を低下させることが示唆されている。[42]。最も有名な例は、2型糖尿病の第一選択薬であるメトホルミンである。症例対照研究、コホート研究、観察研究および臨床試験の複数のメタアナリシスにより、単剤または併用でのがん予防および治療に対するメトホルミンの有効性が報告されている。[43]。メトホルミンは、大腸がん、乳がん、膵がん、前立腺がん、肺がん。[42]、子宮頸がんのリスクを有意に低下させる。[44]。他の研究では、ビグアナイド薬の使用は、すべてのがん罹患率およびがん関連死亡率を20~30%減少させるという報告がある。[45]。さらに、あるコホート研究では、ピオグリタゾンは腎がんのリスク低下と関連していた。チアゾリジン系薬剤の投与を受けている糖尿病患者では、肺癌の発生率が低いことが報告されている。[47]。さらに、最近のエビデンスでは、新しいクラスの抗糖尿病薬であるSGLT2阻害薬が、2型糖尿病の既往のある肝細胞癌(HCC)患者の全生存率の改善と関連していることが明らかにされた。[48]。
最後に、抗糖尿病薬を再利用する根拠は、グルコース消費と癌との関連を考慮すれば驚くべきことではない。腫瘍細胞は好気的解糖を主に利用するため、代謝プロファイルを変化させ、グルコース取り込みの増加を示すことがよく知られている。[49]。興味深いことに、ほとんどの腫瘍でグルコース代謝が亢進しているため、18F-フルオロデオキシグルコースを利用して正常組織や病態の機能的または代謝的評価を行う非侵襲的イメージング技術であるポジトロン断層撮影法(PET)が、がんの診断や治療反応のモニタリング、さらなる治療の改善に利用可能であり、また利用されている。[50,51]。
2.2. 心血管疾患とがんの関係
心血管系疾患とがんは、類似した危険因子と共通の生物学的性質に関連した多くの類似点と相互作用を有しており、このことは、薬物療法が互いに良い影響を及ぼすことを示唆している。[52]。例えば、低酸素誘導因子-1(HIF-1)と核内因子κB(NF-κB)の活性化に関連する低酸素症は、高血圧、動脈硬化、大動脈瘤、肺動脈性肺高血圧症、心不全の発症に重要な役割を果たしている[53,54]。興味深いことに、HIFとNF-κBはまた、腫瘍代謝、血管新生、がん幹細胞の特定、細胞増殖、グルコースと脂質の代謝、転移など、発がん過程に関与するいくつかの遺伝子の発現を変化させる。[55,56]。そのため、いくつかのHIF阻害剤や活性化剤が、進行性/難治性がん患者の治療薬として臨床試験中である。[57,58]。
主にアンジオテンシン変換酵素阻害薬(ACE)、アンジオテンシンII受容体、直接的アルドステロン拮抗薬、β遮断薬、カルシウム拮抗薬などの薬理学的カテゴリーに属する降圧薬は、直接または間接的に、あるいはその両方において、悪性腫瘍の発生に影響を及ぼす可能性がある。[59]。しかしながら、いくつかの降圧薬クラスが腫瘍の発生を促進する役割に関するデータの包括的なレビューでは、このような状況において信頼できる証拠を導き出すことがかなり困難であることが強調されている。[60]。いくつかの研究では、いくつかの降圧薬が癌の発生に中立的または否定的な影響を及ぼすと報告しているが、[61,62]、他の研究では、癌リスクの軽減や、いくつかのヒトの悪性腫瘍に対する有望な治療薬として、単独または化学療法薬との併用で有益な効果を示している。[63,64,65]。例えば、利尿薬は肝臓がんやリンパ系/造血組織がんの発生率の上昇と相関し、前立腺がんや皮膚がんの発生率は低下する。[66]。
それにもかかわらず、血圧上昇、細胞増殖、血管新生、組織浸潤にレニン-アンジオテンシンおよびβ-アドレナリン作動性シグナルが関与していることから、これらの経路を阻害することが癌の予防や治療に重要である可能性が強調されている。[67]。さらに前臨床研究では、いくつかの降圧薬が化学療法抵抗性細胞株に対して共補助効果を示し、細胞増殖を阻害し、様々ながんにおいて化学療法感受性を高めることが示されている。[63]。例えば、プロプラノロールを1000日以上使用すると、頭頸部、食道、胃、結腸、前立腺など様々な癌の発症リスクが低下することがレトロスペクティブ研究で示されている。[68]。他の研究では、ACE阻害薬、アンジオテンシン受容体拮抗薬(ARB)、スタチンが乳がんの再発リスクを低下させることが示されている。[69]。さらに、ARBやACE阻害薬とスニチニブとの併用は、腎細胞がん患者の無増悪生存期間、奏効率、全生存期間を延長し、一次治療不応性を低下させる。[70]。
この総説は、リパーポージング戦略によるヒト悪性腫瘍との世界的な闘いにおいて、抗糖尿病薬と抗高血圧薬が極めて重要であることを強調している。この総説では、抗がん作用を有すると報告されているさまざまな抗糖尿病薬と降圧薬について、そのメカニズムや開発・評価段階に関する利用可能な証拠とともに包括的にレビューしている。本研究は、抗癌剤の探索に興味を持つ研究者に役立つであろう。また、糖尿病や高血圧、癌の管理に携わる臨床医や実務家にとっても、新たな知見が得られるであろう。
3. 降圧薬と糖尿病治療薬の再利用: 最新情報
降圧薬と糖尿病治療薬の癌に対する有望な効果は、豊富なデータによって確認されている。2023年3月までに、52の臨床試験と40の臨床試験が、それぞれ糖尿病治療薬と降圧薬の抗がん作用を評価している(図1)。興味深いことに、抗糖尿病薬と降圧薬のほとんどは第II相試験である。例えば、抗糖尿病薬の52の試験は、第I相(23%)、第II相(67%)、第III相(10%)であり、降圧薬の40の試験は、第I相(36%)、第II相(54%)、第III相(5%)、第IV相(5%)である(図1)。
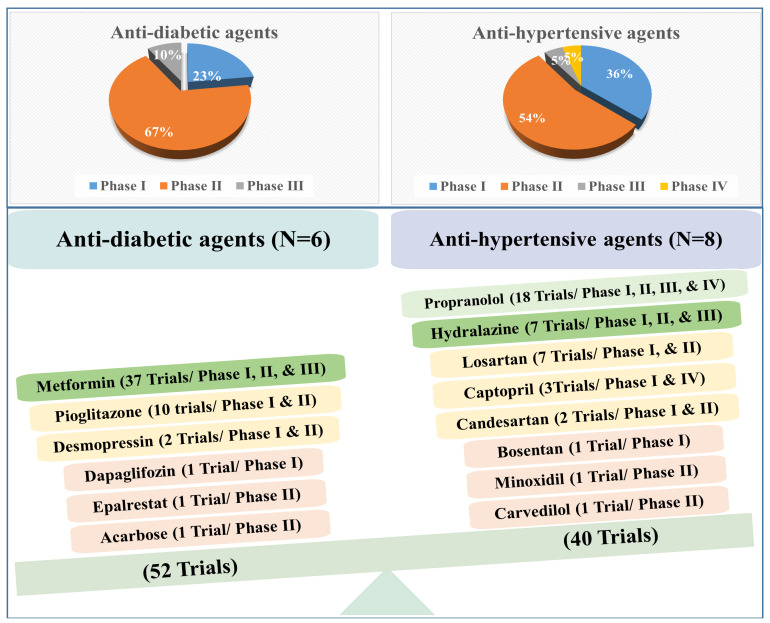
図1
異なる臨床試験における抗糖尿病薬と降圧薬の割合をまとめたものである。糖尿病治療薬は52の臨床試験に寄与しており、降圧剤は40の臨床試験に寄与している。
降圧剤の臨床試験は少ないが、3つの降圧剤(プロプラノロール、カプトプリル、アテノロール)がフェーズIVに達しており、それぞれ1つの良性腫瘍を対象としている。例えば、カプトプリルは乳児毛細血管腫に対して、プロプラノロールとアテノロールは成人の脊髄血管腫に対して評価されている(図2)。したがって、特定の腫瘍型に対する初めての降圧薬が正式に発売される日も近いかもしれない!さらに、他の降圧剤(ヒドララジンとプロプラノロール)は、他の薬剤との併用で、それぞれ乳癌と大腸癌を対象とした第III相評価に達している(図2)。
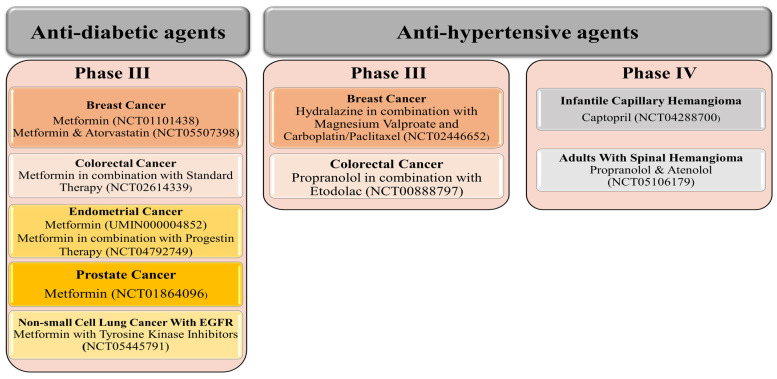
図2
現在、臨床第III相および第IV相試験で異なるがん種に対して評価されている抗糖尿病薬と降圧薬。メトホルミンは5つのがん種に対してフェーズIIIに達した唯一の糖尿病治療薬である。プロプラノロールとカプトプリルの2つの降圧剤は、それぞれ1つのがん種に対してフェーズIVに達している。
異なるがん種に対して第I相と第II相で使用された異なる降圧剤のリストをそれぞれ図3と図4に示す。
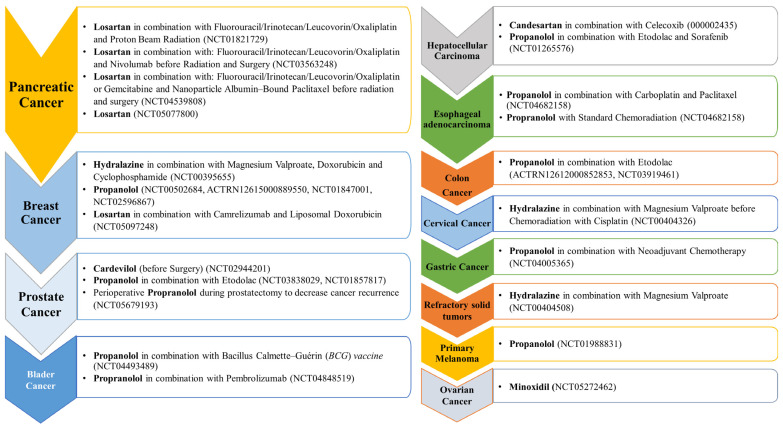
図3 降圧剤単独または併用による第II相臨床試験の数が多いがん種を示す。
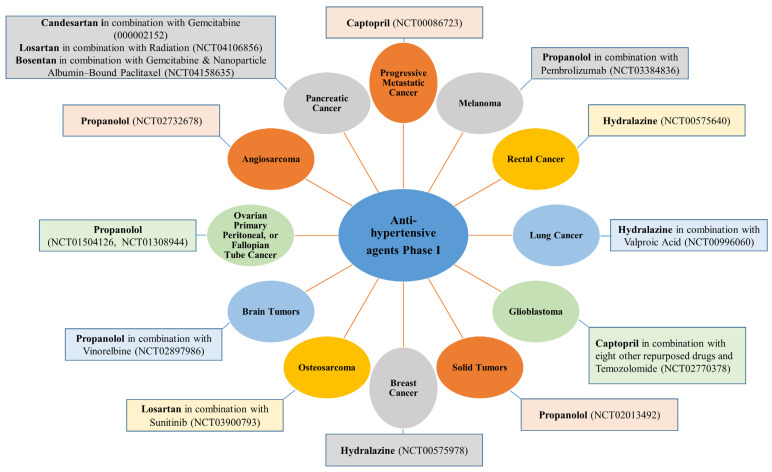
図4 現在、臨床第I相試験で異なるがん種に対して評価されている降圧剤
降圧剤とは対照的に、糖尿病治療薬はまだどれもフェーズIVに達していない。とはいえ、メトホルミンは最も人気のある評価中の薬剤であり、clinical trials.govでは、メトホルミンとがんで検索すると350以上の臨床試験が表示される。活動中および募集中の試験を絞り込んで検索すると、114試験に絞られた。これらの試験には、メトホルミンを単独(単剤療法)または他の薬剤と併用(併用療法)してがんを治療する試験が含まれている。メトホルミンは、5つの異なるがん種に対して、単独療法または他の治療薬との併用療法で第III相評価に達した唯一の抗糖尿病薬である(図2)。ピオグリタゾンやデスモプレシンのような他の抗糖尿病薬は、現在、がん細胞の耐性を低下させたり、有効性を改善するために、単独治療として、あるいは他の化学療法薬と組み合わせて、様々な種類のがんに対して高い有効性を示している(図5A,Bおよび図6)。
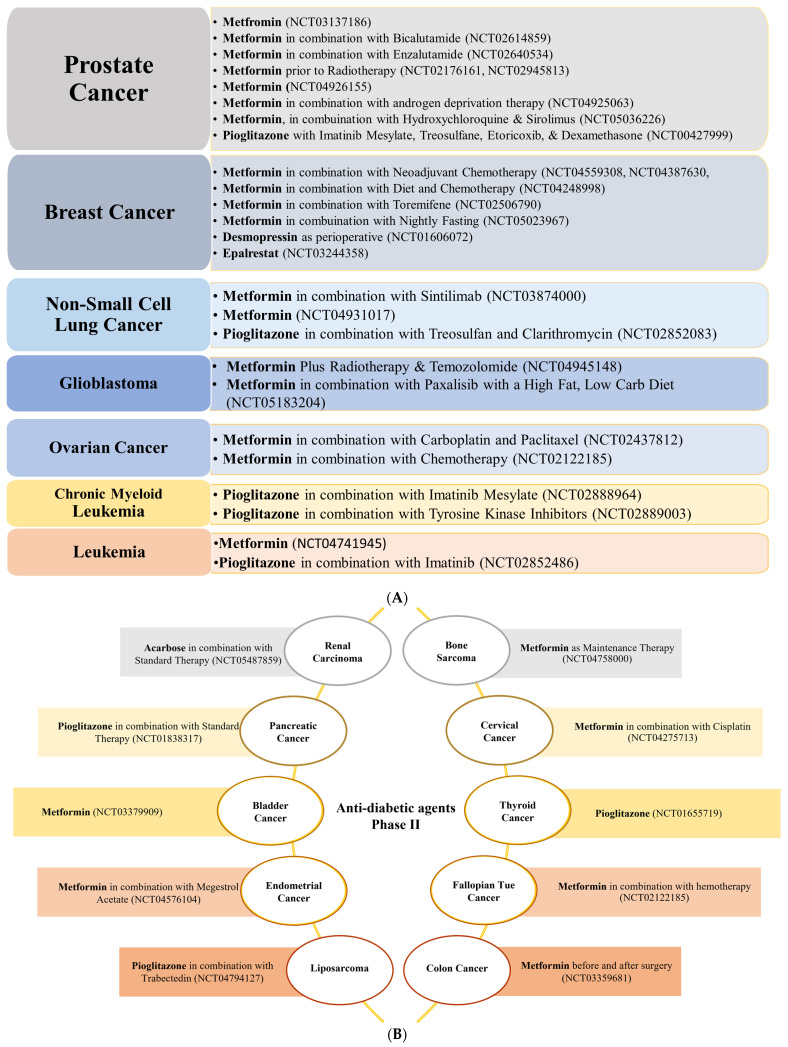
図5
(A)抗糖尿病薬を単独または併用した第II相臨床試験の数が最も多いがん種のリスト。(B)抗糖尿病薬単独または併用による第II相試験が現在1件しかないがん種。メトホルミンが6つのがん種に対して最も評価されており、ピオグリタゾン(3種類)、アカルボース(1種類)と続く。
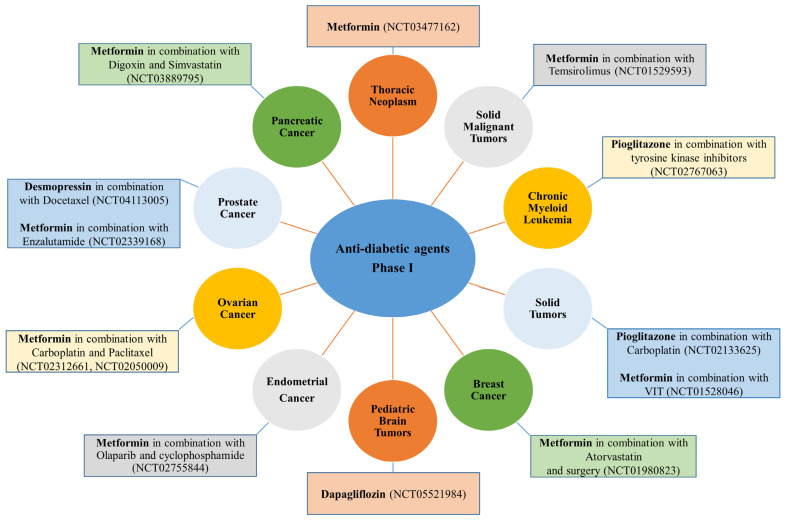
図6 現在、臨床第I相試験で異なるがん種に対して評価中の抗糖尿病薬
以下では、現在臨床試験中の異なるがん種に対する降圧剤と抗糖尿病剤の用法と、報告されている作用機序について、より詳細な概要を示す。
3.1. 大腸がん
3.1.1. 降圧剤
非選択的β遮断薬で最も強力な降圧剤であるプロプラノロール [71] は、単剤または他の治療薬との併用として18の臨床試験で評価されている(図1)。乳がん、肺がん、神経芽腫、血管肉腫、前立腺がん、膵がん、メラノーマ、白血病など幅広いがんに有効であるにもかかわらず[72,73,74]、プロプラノロールは、エトドラクとの併用で結腸・直腸がんに対する第II相試験(2試験)(図3)および第III相試験(1試験)の評価に至っている(図2)。メカニズム的には、プロプラノロールはp-ACT/p-ERK/p-MEKの発現をダウンレギュレートし、同時に生体内試験で自己CD8+T細胞を活性化することにより大腸がんを抑制する[75]。
カンデサルタンとイルベサルタン(ARB)は、結腸癌細胞株における腫瘍の脈管形成と血管新生を減少させる[76,77]。さらに、転移性結腸癌患者において、イルベサルタンはアクチベーター・プロテイン1(AP-1)のDNA結合とJUN遺伝子を阻害し、その結果、疾患の機能的放射線学的な完全な消失をもたらし、癌治療における大きな可能性を示した。[78]。エナラプリルやカプトプリルなど、アンジオテンシンIからアンジオテンシンIIへの変換を阻害するACE阻害薬 [79]も、試験管内試験と生体内試験の両方のモデルで結腸癌細胞に有効である。[80,81,82]。エナラプリルは、単独治療ではインスリン様成長因子1受容体(IGF-IR 1)の発現を低下させるが、[82]、5-フルオロウラシル(5-FU)と併用すると放射線感受性を高め [80]、NF-κB/STAT3経路を介して相乗活性を示す。[81]。エナラプリルの臨床試験はまだ行われていないが、現在収集されているデータは、がんに対する再利用薬としての可能性を示している。ニフェジピンは単独で、結腸癌細胞株におけるプログラム死リガンド1(PDL-1)の発現を抑制する。[83]。
3.1.2. 抗糖尿病薬
メトホルミンは、2型糖尿病に最もよく使われる薬物であり、肝糖新生を抑制し、インスリン感受性を改善し、末梢でのグルコースの取り込みと利用を促進する。[84]。図1に示すように、メトホルミンは37の臨床試験で単剤または標準療法との併用で評価されている。しかし、結腸癌に対するメトホルミンの活性は、標準治療との併用で第III相試験(図2)、手術前後の単独治療として第II相試験(図4)に達している。メカニズム的には、メトホルミンは様々な結腸細胞株で細胞周期停止を引き起こす。[85]。しかし、他の2つの抗糖尿病薬であるデスモプレシンとピオグリタゾンは、異なる作用機序で結腸癌細胞に対して有効性を示した。例えば、バソプレシン受容体2(AVPR2)に対する選択的アゴニストであるデスモプレシン [86] は、試験管内試験および生体内試験モデルを用いて結腸癌細胞の増殖を阻害することがわかった。[87]。対照的に、血糖コントロールとインスリン感受性を改善する合成ペルオキシソーム増殖因子活性化受容体(PPAR)リガンドであるピオグリタゾン [88] は、シクロオキシゲナーゼ(COX-2)とサイクリンD1の発現を減少させることにより、単独治療として異なる結腸癌細胞の転移を阻害する。[89]。
3.2. 乳がん
3.2.1. 降圧剤
ヒドララジンは血管拡張薬であり、よく理解されていない機序で動脈の平滑筋を弛緩させる。[90]が、乳癌に有効であり、バルプロ酸マグネシウムとカルボプラチン/パクリタキセルとの併用で第III相評価に達している(図2)。また、図3および図4に示すように、単剤または標準療法との併用で第I相および第II相の評価が行われている。ヒドララジンは乳癌患者において化学療法剤の効果を増大させ、あるいは耐性を低下させる。ヒドラジンは、生体内試験および試験管内試験の様々な乳がん細胞において、サイレンシングされたRARβ、p21、p16遺伝子を脱メチル化し、再発現させることができる。[91,92]。また、アドリアマイシンとの併用で、ヒドララジンは乳癌細胞の化学療法耐性を逆転させる。[91]。プロプラノロールは現在第II相段階にあり(図3)、様々な化学療法薬(すなわち、5-FUとパクリタキセル)の抗血管新生作用を増強する。[93]。ロサルタン(ARB)は、カムレリズマブおよびリポソーム型ドキソルビシン(図3)と併用することで、異なる乳癌細胞における化学療法剤の有効性を高め、耐性を低下させる(現在第II相試験中)[94]。さらに、生体内試験の様々な乳がんモデルにおいて、TNF-α、pSTAT3、IL-6の発現を低下させる。現在、他の降圧剤で乳癌に対する臨床試験が行われているものはないが、試験管内試験のデータでは、他の薬剤が乳癌に対して有効である可能性が示されている。例えば、ARB降圧薬であるカンデサルタンは、試験管内試験で乳癌細胞T-47DおよびMCF-7を阻害する[96]。さらに、カリウムチャネル開口薬であるジアゾキシド [97] は、乳がん細胞株における二重特異性チロシンリン酸化調節キナーゼ1A(DYRK1A)、インターロイキン-1受容体関連キナーゼ1(IRAK1)、スレオニン・チロシンキナーゼ(TTK)の発現を阻害する。[98]。
3.2.2. 抗糖尿病薬
メトホルミンは、乳がんに対する有効性で際立っている。メトホルミンは、乳癌治療に対して7つ以上の臨床試験で評価されている。メトホルミンは単剤またはアトルバスタチンとの併用でフェーズIIIに達している(図2)。メトホルミンは図5Aに示すように、化学療法剤、食事療法、絶食療法との併用でも第II相にある。メカニズム的には、メトホルミンは試験管内試験で広範な乳癌細胞に対して活性を示すことが研究で明らかにされている。[43,99,100,101]。例えば、メトホルミンは、miRNAの再発現とCSC特異的遺伝子のダウンレギュレーションを介して、試験管内試験で癌幹細胞(CSC)を阻害する[102]。また、メトホルミンはpSTAT3のリン酸化を低下させる。[103]。さらに、メトホルミンは乳がんにおいて、アデノシン一リン酸活性化プロテインキナーゼ(AMPK)を活性化し、哺乳類ラパマイシン標的キナーゼ(mTOR)とS6キナーゼの活性化を低下させ、mRNAの翻訳を減少させる。[104]。デスモプレシンはまた、乳がんの術前治療として第II相試験で評価されている(図5A)。様々な乳癌細胞株に対するデスモプレシンの有効性[105,106,107,108]は、アンジオスタチンの誘導[108]と転移の阻害[109]を介したものである。興味深いことに、デスモプレシンの新規アナログは、乳がん細胞MCF-7とMDA-MB-231に対して、より顕著な抗転移作用と転移抑制作用を示す[107,108]。アルド-ケト還元酵素ファミリー1メンバーB1(AKR1B1)阻害薬であるエパルレスタット [110] は、トリプルネガティブ乳癌(TNBC)に対して第II相試験中である(図5A)。本総説で取り上げた薬剤の中で唯一、がんに対する作用のオフサイトターゲットが発見されていない。その抗増殖作用、抗移行作用、抗浸潤作用は、AKR1B1の阻害に由来する。他の生体内試験および試験管内試験の研究でも、単剤またはクロリンe6や光線力学的療法との併用で、様々な乳がん細胞株に対するエパルレスタットの阻害効果が証明されている。[111,112]。ピオグリタゾンは、乳癌に対する臨床試験には使用されていないが、試験管内試験で、MCF7乳癌細胞においてMAPK依存的/一部PPAR非依存的にp21とp27を増加させることにより、G0/G1停止を誘導する。[113]。
3.3. 前立腺がん
3.3.1. 降圧剤
カルベジロール(α1-アドレナリン受容体拮抗作用を有する非選択的 β遮断薬)およびプロプラノロール(非選択的β遮断薬) [71,114] は、前立腺がんを対象とした第Ⅱ相試験で評価中の2つの降圧剤である(図3)。プロプラノロールはエトドラクとの併用または単独で周術期投与として評価され、カルベジロールは手術前の前立腺がん患者で評価されている。アテノロールを長期間使用すると前立腺がんの発生率が50%以上有意に低下することを示したレトロスペクティブ解析では、他の薬剤のプラスの影響が示されている。[115]。
一方、現在臨床試験中ではないが、カプトプリル(ACE-I)およびカンデサルタン(ARB)は、生体内試験 [116,117] および試験管内試験 [116] で前立腺がん細胞を阻害する。例えば、カプトプリルはp53の発現増加を介して前立腺がん細胞を自己破壊に向かわせる。[117]。さらに、前立腺癌細胞におけるカンデサルタンの腫瘍増殖抑制作用は、血管内皮増殖因子(VEGF)の発現低下および腫瘍血管新生抑制と関連していた。興味深いことに、カンデサルタンは前立腺細胞の生存率を損なわなかったが、腫瘍由来因子による内皮バリアの破壊を阻害した。[116]。さらに、ヒドララジンは前立腺がん細胞において、脱メチル化を介してサイレンシングされた遺伝子の再発現を引き起こす。[92,118]。
3.3.2. 抗糖尿病薬
4つの抗糖尿病薬が前立腺がんを対象とした11の臨床試験において、単独治療または他の化学療法薬との併用で評価されている。前立腺がんに対する最も有望な抗糖尿病薬はメトホルミンであり、8件の臨床試験が行われ、単剤治療(第III相、図2)および第II相(7件)において単剤治療または標準治療との併用が行われている(図5A)。メトホルミンの使用と前立腺がんの発生率または生存率との関連については議論のあるデータがあるにもかかわらず [115]、メトホルミンの直接的な抗がん機序またはメタボリックシンドロームの改善による二次的な作用により、前立腺がんのリスクが低下し、生存率が改善することが研究で示されている。[119,120] )。直接的な抗がん機序としては、肝キナーゼB1(LKB1)とAMPKの活性化、mTOR活性とタンパク質合成の阻害、p53とp21によるアポトーシスとオートファジーの誘導、血中インスリンの減少などが示唆されている。[120]。さらに、メトホルミンは、pRbリン酸化の低下、サイクリンD1およびE2F1タンパク質レベルの低下(AMPK非依存性)を介してG0/G1での細胞周期停止を誘導することにより、前立腺がん細胞株を阻害する。[85]。
ピオグリタゾンは、イマチニブメシル酸塩、トレオスルファン、エトリコキシブ、デキサメタゾンとの併用で前立腺がんに対して臨床第II相段階にある(図5A)。集団ベースのケースコントロール研究の結果、ピオグリタゾンの使用歴と前立腺がんとの間に逆相関があることが示された。[121]。メカニズム的には、ピオグリタゾンはTNF-α、TGF-β、およびケモカインの単球走化性タンパク質-1(MCP-1)のレベルを抑制する。[122]。
デスモプレシンは現在、ドセタキセルとの併用でフェーズI段階にある(図6)。メカニズム的には、デスモプレシンは試験管内試験および生体内試験の異なる前立腺細胞株において、ドセタキセルに対する放射線感受性を増加させた。[86,123,124,125]。興味深いことに、ウロキナーゼ型プラスミノーゲン活性化因子(uPA)およびマトリックスメタロプロテアーゼ(MMP-2およびMMP-9)のダウンレギュレーションを介して、デスモプレシン単独の抗腫瘍性および抗転移性が前立腺がんにおいても示されている。[125]。
3.4. 膵がん
3.4.1. 降圧剤
7種類以上の降圧剤が、膵がんに対して有望な抗がん作用を示している。ロサルタン(ARBsクラス)は膵癌に対して、単剤または5-FU、イリノテカン、ロイコボリン、オキサリプラチンなどの標準的な化学療法剤との併用、あるいは放射線療法や手術前の治療として、第II相試験(4試験)および第I相試験(1試験)が行われている(図3)。ロサルタンはまた、試験管内試験でさまざまな膵がん細胞に対して有効である。[94]。ロサルタンの機序としては、TGF-βとエンドセリン-1(ET-1)の発現の減少を介して間質コラーゲンとヒアルロン酸の産生を減少させることが示唆されている。[94]。カンデサルタンとボセンタン(本態性高血圧患者の血圧を有意に低下させるET受容体拮抗薬)は、ゲムシタビンや他の治療薬と併用した膵癌を対象とした第I相臨床試験中である(図4)。膵腫瘍において腫瘍の灌流を選択的に促進し、治療薬の送達を改善する戦略の可能性は、ET軸を標的とすることに依存していることが報告されている。[126]。ボセンタンは、試験管内試験において、膵星状細胞(PSC)およびDSL6A膵がん細胞の増殖とPSCにおけるコラーゲン合成を阻害することにより、抗線維化作用および抗がん作用を発揮する[127]。
さらに、最近の報告では、ボセンタンがET-1/ETAR軸シグナル伝達経路を遮断することにより、ゲムシタビンの膵がん細胞に対する増殖抑制作用とアポトーシス促進作用を増強することが明らかにされた[128]。エナラプリルは、膵がん細胞におけるVEGF発現を低下させ、膵トランスジェニックモデルにおいて化学予防効果を示す。[129]。さらに、ヒドララジンは、脱メチル化を介してサイレンシングされた遺伝子の再発現を誘導することにより、試験管内試験で膵がん細胞に対して有望な効果を示す。[92,118,130]。プロプラノロールは単独で、PC-2細胞に内在性経路を介してアポトーシスを誘導する。[116]。さらに最近の研究では、GemNab投与の1週間前にプロプラノロールとエトドラクを併用すると、膵癌患者の全生存期間と無増悪生存期間が有意に延長することが確認されている。[71,131,132,133]。さらに、他の降圧薬であるニフェジピンやフェンディリンは、試験管内試験で異なる膵がん細胞株に対して有望な活性を示す。[134,135]。
3.4.2. 抗糖尿病薬
膵癌に対する活性について臨床試験中の抗糖尿病薬は2種類のみである。標準治療と併用されるピオグリタゾンは第II相試験中であり(図5B)、ジゴキシンおよびシンバスタチンと併用されるメトホルミンは第I相試験中である(図6)。ピオグリタゾン単独は、生体内試験および試験管内試験において、様々な膵癌細胞でカルサイノエンブリオニック抗原(CEA)のmRNA発現を増加させる。[136]。同様に、メトホルミンの単独投与も、試験管内試験および生体内試験において、広範な膵がん細胞に対して有望な阻害効果を示す。[85,137,138]。
3.5. 肺がん
3.5.1. 降圧剤
ヒドラジンとバルプロ酸の併用は、肺癌を対象とした第I相試験中である(図4)。両薬剤はエピジェネティック薬として位置づけられ、試験管内試験および生体内試験で肺癌細胞に対して抗転移作用を示す。ヒドラジンとバルプロ酸の投与は、NIH 3T3-Ras細胞に対して増殖抑制効果を誘導し、MMP-2とMMP-9のゼラチナーゼ活性を増加させ、走化性と細胞運動を阻害する。[139]。新たなデータは、エピジェネティック療法が異常な腫瘍関連エピゲノムを再プログラムし、「抵抗性の獣を手なずける」ことで、非小細胞肺がん(NSCLC)の生存期間を延長できることを示唆している。[140]。
肺癌に対する臨床試験中ではないが、試験管内試験および/または生体内試験で異なる作用機序による有望な効果を示す他の降圧薬には、カンデサルタン、カプトプリル、カルベジロール、テルミサルタン、ニフェジピンがある。カンデサルタンは、ATP競合的に試験管内試験でのタンパク質のネディレーションを阻害し、その結果、cullin1-Nedd8およびUbc12-Nedd8の付加およびNAEを阻害する[96]。一方、ロサルタンはC-Cモチーフケモカインリガンド2(CCL2)を阻害し、転移における単球の動員を減少させる。[141]。テルミサルタンは細胞間接着分子I(CAM1)とMMP-9の発現を減少させ [142]、ニフェジピンはSPC-A肺がん細胞のET-1誘発性分裂促進作用を阻害する。[143]。さらに、カルベジロールは、試験管内試験および生体内試験の異なる肺がん細胞において、シトクロムP450 1B1(CYP1B1)を阻害する。[68,144]。さらに、カプトプリルは試験管内試験および生体内試験で肺がん細胞LNM35を阻害し、アポトーシスを誘導する。[145]。
3.5.2. 抗糖尿病薬
メトホルミンとピオグリタゾンは、肺癌に対して有望な結果をもたらす唯一の抗糖尿病薬である。メトホルミンはチロシンキナーゼ阻害剤と併用され、EGFRを有するNSCLCに対する第III相臨床試験(図2)、および単独治療またはシンチリマブとの併用(図5A)としての第II相臨床試験が評価されている。肺癌に対するメトホルミンの効果は、単剤または他の治療薬との併用で、肺癌の治療効果と予後を改善する様々なメカニズムが関与している。[146]。そのようなメカニズムには、LKB1依存性AMPKキナーゼ経路、AMPK依存性p53活性化、GRB/IRS-1/PI3K/AKT/mTOR経路のダウンレギュレーション、グルコースおよびアミノ酸濃度を調節するmTORC1の阻害などがある、 ミトコンドリア呼吸鎖複合体Iの阻害、肺miRNAの調節、腫瘍とその微小環境の調節(CD8+T細胞記憶の増強)、放射線治療薬の感作 [140,146,147,148,149]などがある。
同様に、ピオグリタゾンとトレオスルファンおよびクラリスロマイシンとの併用によるNSCLCに対する第II相臨床試験が存在する(図5A)。ピオグリタゾンは、肺癌に対する化学予防効果を有し、[150]、マウス発癌モデルにおけるベンゾ(a)ピレンB[a]Pの肺腺腫形成を減少させる。[150]。さらに、生体内試験誘発肺扁平上皮がんモデルマウスにおいて、ピオグリタゾンによる治療は有意な予防効果を示した。[151]。その機序としては、扁平上皮病変の減少、曝露マウスの気道における正常上皮細胞の増加、EMT遺伝子発現の変化による上皮性・間葉性の表現型の促進などが挙げられる。[152]。さらに、PTENの発現を増加させ、PI3K-Akt経路を阻害し、[153]、肺がん細胞株におけるゲフィチニブの効果を増強する。[153]。
3.6. 卵巣がん、子宮頸がん、子宮内膜がん
3.6.1. 降圧剤
直接血管拡張作用のある降圧剤であるミノキシジルは、卵巣がんの単剤治療として第II相試験が行われている(図3)。ミノドキシジルが効果を発揮するメカニズムには、ミトコンドリアの破壊と広範なDNA損傷を生じさせ、カスパーゼ-3に依存しない細胞死経路を活性化することによって、がん細胞の代謝および酸化状態を変化させることが含まれる。[154]。さらに、2つの第I相臨床試験が卵巣がんに対するプロプラノロールを評価している(図4)。In vitroのデータでは、プロプラノロールは活性酸素系(ROS)/JNKシグナル伝達経路を通じてアポトーシスと保護的オートファジーを誘導することにより、その効果を発揮することが示されている。[155]。
臨床試験中ではないが、カンデサルタンとテルミサルタンは、試験管内試験および生体内試験で卵巣がん細胞の血管新生を阻害し、VEGFの発現を低下させる。[76,156]。例えば、テルミサルタンは、サイレンシングされたAP遺伝子を脱メチル化して再発現させる能力に基づいて、HEY卵巣がん細胞においてPPARγの発現を増加させ、MMP-9の発現を減少させる。[157]。ヒドララジンは、シスプラチンによる化学放射線療法前のバルプロ酸マグネシウムとの併用で、子宮頸癌を対象とした第II相臨床試験で評価されている(図3)。ヒドラジンとバルプロ酸の併用は放射線感作を誘導し、子宮頸癌におけるシスプラチン化学放射線療法の有効性を増大させる。[158]。
興味深いことに、第III相臨床試験の予備的結果は、子宮頸癌においてヒドララジン・バルプロ酸(HV)療法がシスプラチン・トポテカン併用化学療法よりも無増悪生存期間において有意に有利であることを示している[159]。さらに、HVによるエピジェネティック療法は、子宮頸癌患者の原発巣における遺伝子の再活性化とタンパク質のアセチル化(p53のアセチル化)を引き起こす。さらに、ヒドララジンはG9Aヒストンメチルトランスフェラーゼを阻害することにより、子宮頸がん細胞株におけるゲムシタビン耐性を回復させる。[161]。In vitroでは、ヒドララジンは大腸腺腫症(APC)のメチル化を効果的に阻害し、APCの再発現を促進することで、ヒト子宮頸がん細胞株の細胞増殖を阻害する。[130]。
子宮内膜がんに関しては、ニフェジピンとテルミサルタンは有望な治療薬候補であり、異なる作用機序によって効果を発揮する。例えば、ニフェジピンが子宮内膜がん細胞株においてBeclin1とmTOR経路を介して後期アポトーシスとオートファジーを誘導するのに対して [162]、テルミサルタンはDNAの二本鎖切断とアポトーシスを誘導する。[163]。
3.6.2. 抗糖尿病薬
メトホルミンは、10件の臨床試験が行われ、卵巣癌、子宮頸癌、子宮内膜癌に対して試験された唯一の抗糖尿病薬である。興味深いことに、メトホルミンは子宮内膜癌に対して、単独または黄体ホルモンとの併用で第III相試験が行われている(図2)。さらに、卵巣癌(2試験、図5A)、子宮内膜癌、卵管癌、子宮頸癌(各1試験、図5B)に対して、メトホルミンと化学療法剤との併用に関する5つの第II相試験が存在する。さらに3つの第I相試験が卵巣癌と子宮内膜癌に対してメトホルミンを評価している(図6)。機序的には、メトホルミンはスフィンゴシンキナーゼ-1(SPHK)の発現を減少させ、血清スフィンゴシン-1リン酸(S1P)レベルを低下させることにより、患者由来の卵巣癌細胞の増殖、遊走、浸潤を減少させる。[164,165]。さらに、活性酸素が介在するアポトーシスシグナル制御キナーゼ1(ASK1)の活性化、JNKリン酸化、Noxa発現を介して、卵巣がんや胃がんにおいてアポトーシスを引き起こし、ミトコンドリア電位の喪失、ひいてはカスパーゼ-3の切断につながる。[165,166]。一方、ピオグリタゾン投与は、固形OVCAR-3腫瘍においてアポトーシスとネクローシスを増加させ、VEGF発現と微小血管密度(MVD)を減少させる。ピオグリタゾンとクロフィブリン酸を併用すると、AP-1の発現を低下させることにより、卵巣がんに対する強力な抗腫瘍効果が得られる。[167]。
3.7. 脳および脊髄のがん、神経芽腫、骨肉腫、頭頸部扁平上皮がん
3.7.1. 降圧剤
最も顕著で刺激的な効果は、カプトプリル、プロプラノロール、アテノロールに関するもので、これらは臨床第IV相評価に達しており、いつでもFDAの承認を得ることができる。例えば、カプトプリルは乳児毛細血管腫に対する最終段階(第IV相)にあり、プロプラノロールとアテノロールは成人の脊髄血管腫に対するものである(図2)。さらに、カプトプリルは他の8つの薬剤と併用され、膠芽腫に対するフェーズIにあり、プロプラノロールはビノレルビンと併用され、脳腫瘍に対するフェーズIにある(図4)。
Sulzbergerらによる研究では、カプトプリルによる乳児毛細血管腫の治療が、この疾患の生物学的性質にレニン・アンジオテンシン系が大きく寄与していることを確認した。カプトプリルは、ACEの平均値に影響を与えることなく、アンジオテンシンIIの平均値を低下させた。[168]。
さらに、MMP-2の発現抑制は、試験管内試験および生体内試験におけるカプトプリル単独およびテモゾロミドとの併用によるグリオサ肉腫に対する抗浸潤効果に重要な役割を果たしている。[169]。さらに、プロプラノロールは神経芽腫細胞においてp53経路を介してアポトーシスを誘導し、[170]、HNSCC [171] および神経芽腫 [172]における化学療法効果を相乗的に増強する。現在、ニフェジピンを用いた臨床試験は行われていないが、ニフェジピンは膠芽腫細胞におけるシスプラチンの効果を相乗する。[173]。カルベジロールやロサルタンなどの他の降圧剤も興味深い阻害作用を示す。例えば、カルベジロールは神経芽腫細胞およびTH-MYCNトランスジェニックマウスにおいてビンクリスチンの効果を増強し、[172]、ロサルタンはウィスターラットの神経膠腫細胞C6を阻害する。[174]。ロサルタンはまた、骨肉腫の治療薬として、スニチニブとの併用でフェーズI段階にある(図4)。
3.7.2. 抗糖尿病薬
SGLT2阻害薬であるダパグリフロジン[175]は、現在、小児脳腫瘍を対象とした第I相臨床試験中である(図6)。さらに、膠芽腫と骨肉腫に対する治療または維持療法としてのメトホルミンについては、3つの第II相試験が登録されている(図5A,B)。全生存期間と無増悪生存期間を改善する標準治療戦略を強力にサポートするメトホルミンの能力により、膠芽腫に対するメトホルミンの可能性が豊富な臨床研究および前臨床研究により支持されている。[176]。例えば、メトホルミンはAMPK経路を亢進させ、アポトーシス誘導、細胞増殖抑制、転移抑制、および多形性膠芽腫に対する化学放射線増感作用に関与している。[177]。しかしながら、膠芽腫におけるメトホルミンの抗血管新生作用については、より深い知見が必要である。
ピオグリタゾンの最も顕著な効果には、HNC細胞 [178]の強毒性細胞死の誘導と幹細胞の枯渇が含まれ、その結果、抗転移作用がもたらされる。[89,136]。スルファサラジンと併用すると、CDGSH鉄硫黄ドメイン2(CISD2)を阻害し、脂質活性酸素と第一鉄レベルを増加させる。さらにスルファサラジンは、生体内試験および試験管内試験で広範囲のHNC細胞に対して、スルファサラジン耐性細胞を強鉄細胞死に感作する。[178]。別の抗糖尿病薬であるデスモプレシンは、ヌードマウスの骨肉腫細胞MG-63と試験管内試験のU2-OS細胞を阻害する。[179]。
3.8. 肝臓がんおよび腎臓がん
3.8.1. 降圧剤
肝臓がんや腎臓がんに対する有効性を評価した臨床試験はないが、試験管内試験および生体内試験の研究から、4種類の降圧剤(カンデサルタン、イルベサルタン、テルミサルタン、カプトプリル)が有望な候補である。[96,180,181]。例えば、テルミサルタンとイルベサルタンは、pErbB3の発現を低下させ [181]、p38/MAPKのリン酸化を抑制してVCAM-1の発現を低下させることにより、肝がん細胞を阻害する。[180]。さらに、テルミサルタンは、カスパーゼ-3およびBax発現の増加、Bcl-2発現の減少(PI3/ACT経路)を介して、腎臓または腎臓がん細胞株においてアポトーシスを誘導する。[163,182,183]。カプトプリルは、生体内試験および試験管内試験で腎臓がん細胞SN12K-1を阻害する。[184]。
3.8.2. 抗糖尿病薬
複合オリゴ糖であるアカルボースは、膵α-アミラーゼおよび膜結合型腸α-グルコシドヒドロラーゼの競合的可逆的阻害剤として作用し、[185]、腎肉腫を治療するための標準的化学療法との併用で第II相臨床試験中である(図5B)。転移抑制のメカニズムは不明であるが、アカルボースは腎臓癌の成長を遅らせ、防御免疫反応を促進することが研究で明らかにされている。[186]。さらに、アカルボースを免疫療法または標的療法と併用すると、腎癌の治療成績が改善し、肺転移が減少した[186]。ここでもまた、ピオグリタゾンには肝細胞癌に対する化学的保護作用がある。[187]。この効果は、ピオグリタゾンがDENラットモデルにおいて、アディポネクチン産生の増加、MAPK活性化の減少、AMPK活性化の増加を通じて、肝細胞癌の進行に対する線維化を減少させることによる。さらに、ピオグリタゾンは、ヒトHCC組織において、RAGE、NF-κB、HMGB1、p38MAPK、Ki-67、MMP-2、サイクリンD1の発現を低下させることにより、アポトーシスとG0/G1での細胞周期停止を誘導する。[188]。さらに、メトホルミンは、腎細胞がん。[189]における低グルコース条件下での細胞増殖促進に影響を与え、幹細胞 [190] および腎臓がん。[191]におけるRag GTPaseおよびmTORC1シグナル伝達(AMPK非依存性)を阻害する。
さらに、エパルレスタットは肝臓がん細胞株 [192]や腎臓がん細胞株 [193]も阻害する。肝がんの実験モデルにおいて、エパルレスタットの抗がん活性が、単独治療として、あるいは化学療法や標的治療薬と併用されることで、様々なメカニズムが報告されている。[194]。これらには、AKR1B1の阻害を介したNF-κBシグナルの阻害 [111,195]、増殖・遊走・浸潤・転移の阻害 [111,112,196]、p27/p-Rb経路(p-Rb、サイクリンD1、Eの発現低下)を介したG0/G1細胞周期停止の誘導 [195]、mTOR阻害を介したアポトーシスおよびオートファジーの誘導 [195,198]などが含まれる。AKR1B1および/またはAKR1B10の阻害と上皮間葉転換の阻害に加えて、エパルレスタットはダウノルビシンとイダルビシンの効果を相乗的に増強し、[193]、生体内試験および試験管内試験でソラフェニブの阻害効果を増強する。[192,198]。
3.9. 胃がんおよび食道がん
3.9.1. 降圧薬
プロプラノロールは、胃がんに対するネオアジュバント化学療法と併用する第II相試験が行われている(図3)。プロプラノロールが胃癌細胞の腫瘍成長と増殖を阻害するメカニズムは、G1期の細胞周期停止とアポトーシスを誘導することである。[199]。また、リン酸化CREB-ATFおよびMEK-ERK経路の発現を低下させ、MMP-2、MMP-9およびVEGFの発現を抑制し、胃がん細胞の遊走を阻害する。[199,200]。さらに、プロプラノロールは、NF-κB、EGFR、COX、VEGFなどの発現を阻害することにより、胃癌に対するオキサリプラチンとチジオの放射線治療効果を改善する。[201]。
臨床試験にはまだ至っていないが、カンデサルタンやカプトプリルなどの他の降圧薬は、試験管内試験 [96] および生体内試験 [202] で異なる胃癌細胞株を阻害する。カプトプリルはまた、MMP-2とMMP-9の活性を低下させることにより、胃細胞の浸潤を阻害する。[202]。一方、テルミサルタンは、試験管内試験および生体内試験において、広範囲の食道がん。[203,204] および胆管がん細胞株に対して有効である。[205]。テルミサルタンの効果は、pErbB3およびトロンボスポンジン-1の発現を低下させ [204]、サイクリンA2、E、D1およびCDK2の発現を低下させることによりS期停止を誘導し、mTOR阻害をもたらす能力に起因する。[181,203,204,205,206]。
3.9.2. 抗糖尿病薬
胃がん、食道がんに対する抗糖尿病薬の臨床試験はない。しかしながら、近年いくつかの観察研究により、メトホルミンが胃癌のリスクを減少させることが示されている。[207,208]。さらに、メトホルミン単独では腫瘍体積を減少させるが、シスプラチン、ラパマイシン、またはその両方と併用すると、各薬剤単独での効果が増大し、胃癌の腹膜播種を抑制することが示唆された研究もある。[209]。また、メトホルミンはマウスの食道扁平上皮癌において、切断型GSDMD(miR-497/PELP1軸)を上昇させることにより、パイロトーシスを誘導するという報告もある[210]。さらに、メトホルミンはアポトーシスを誘導し、AMPK依存性経路のmTOR/ACT経路を抑制する。[165,166]。
3.10. 皮膚がん
3.10.1.
テルミサルタンは、メラノーマ細胞の代謝に影響を与え、グルコースの取り込みを増加させるが、解糖は増加させないため、皮膚がんにおいてミトコンドリアの分裂、活性酸素の発生、アポトーシス誘導を引き起こす。[211]。テルミサルタンはまた、皮膚がん細胞に対するベムラフェニブの効果を増強する。[211]。プロプラノロールは、単独治療として、または他の抗がん剤と併用することで、複数の機序を介して皮膚がん細胞に影響を与える。[212,213,214]。例えば、プロプラノロールはp53を増加させ、Akt3、PiK3R5、HIF1aの発現を減少させる。[215]。また、Bax/Bcl-2比の増加を介してアポトーシスを誘導する。[216]。さらに、カルベジロールはAP-1を阻害することにより、JB6 P+細胞のEGFを介した細胞形質転換を阻害する。[68]。
3.10.2. 抗糖尿病薬
in vitroおよび生体内試験の研究で、メトホルミンは様々な機序で皮膚がんに対して有効であることが確認されている。例えば、メトホルミンはメラノーマ細胞をG0/G1期に停止させ [217]、生体内試験ではTRB3(tribbles pseudokinase 3)の発現を阻害することにより、メラノーマの増殖と転移を抑制する。[218]。さらにメトホルミンは、AMPKの活性化を介して、黒色腫の細胞死と増殖、腫瘍微小環境にも影響を与える。さらに、メトホルミンは、広範なメラノーマ細胞株において、miR-192-5p/EFEMP1およびmiR-584 3p/SCAMP3軸の調節を介して、メラノーマの細胞増殖と浸潤も低下させる。[219]。
3.11. 血液がん
3.11.1. 降圧剤
ヒドララジンとバルプロ酸の併用は、骨髄異形成症候群(MDS)に対する無毒で効果的な治療法として有望であることが、第II相試験の予備的結果から示唆されている。[160]。さらに、エキサイティングな試験管内試験の知見から、ヒドララジンがT細胞白血病細胞Jurkatを阻害する能力があることが報告された。[220]。示唆されるメカニズムとしては、T細胞におけるDNAメチル化の阻害 [220]、Jurkat細胞におけるDNAメチル化酵素(DNMT)1および3AのmRNA発現 [118,220]、EGFR経路 [118,220]などが挙げられる。一方、テルミサルタンは、様々な成人T細胞白血病細胞において、オートファジーとカスパーゼ依存性および非依存性の細胞死を誘導する。[221]。エナラプリルは、STAT5の発現を低下させることにより、血液中の急性前骨髄球性白血病(APL)細胞に対しても活性を示す。[222]。他の知見では、カプトプリルは骨髄線維症に伴う病理学的変化の克服に大きな効果があることが示唆されている。[223]。示唆されるメカニズムは、骨髄細胞性の正常化、レチクリン繊維の減少、脾腫および巨核球症の減少、コラーゲン発現の抑制である。[223]。
3.11.2. 抗糖尿病薬
ピオグリタゾンとメトホルミンは、白血病に再利用されている。3つの第II相試験と1つの第I相試験が、白血病や慢性骨髄性白血病に対する他の薬剤(イマチニブやチロシンキナーゼ阻害薬(TKI)と併用した場合のピオグリタゾンの有効性を評価している(図5A)。ピオグリタゾンは、p27を増加させ、サイクリンD1の発現を減少させることにより、T細胞白血病細胞であるJurkat lをG2/M期に停止させるというメカニズムである。[224,225,226]。さらに、ピオグリタゾンは、慢性骨髄性白血病(CML)におけるSTAT5、HIF2α、カルボキシ末端ドメイン2(CITED2)の発現低下を介して幹細胞を枯渇させ[227]、イマチニブの効果を増強する[227]。ある第Ⅱ相試験では、白血病に対するメトホルミンの有効性も検討されている(図5A)。さらに、白血病、リンパ腫、多発性骨髄腫を含む血液悪性腫瘍に対するメトホルミンの有効性を支持するエビデンスが多数あり、複数の標的に対するメトホルミンの多面的作用によるものと予想される。[228]。報告されているデータによると、メトホルミンは骨髄腫細胞の壊死とアポトーシスを誘導する。さらに、メトホルミンは、細胞をG0/G1期またはG2/M期に停止させ、AMPKを活性化し、カスパーゼ依存性アポトーシスを誘導し、Mcl-1、IGF-1R、PI3K、pAKT、pmTORタンパク質の発現を阻害することにより、細胞増殖を阻害する。[228,229]。
4. 結論と今後の展望
従来の医薬品開発手順では、抗がん剤に高いコストがかかり、医療経済に対する世界的な負担を著しく増大させてきた。[5]。したがって、治療を受ける際の経済的負担に関連する金銭的・健康的影響を表す「経済的毒性」は、抗がん剤の評価において馴染みのある用語となり、成功するがん管理において考慮されるようになってきている。[230]。さらに、抗がん剤の価格の高騰は、患者の精神的健康(苦痛、ストレス、苦難、精神的負担を引き起こす)やその家族に害を及ぼす。[24]。さらに、がん患者のかなりの部分は、主にがん医療へのアクセスにおける格差と高額な経済的負担のために、適切な医療を受けられなかったり、受けられなかったりしている。[24]。これらの課題を総合すると、抗がん剤開発の成功率を向上させ、処理時間を短縮し、代替手段を用いてコストを削減する必要性が強調された。[25]。そのため、リパーポージングは、特にがん治療においてホットな話題となっている。多くの研究が、化学療法を含む治療応用のために、異なる薬物クラスのオフターゲット活性の可能性を評価し、報告している。しかし、薬物リパーポージングの重要性にもかかわらず、それは困難であり、臨床的利益を容易に達成することはできない。さらに、規制上の問題、特許政策、新たなビジネスモデル、組織や産業上の障害といった障壁が依然として存在している。[21]。
とはいえ、抗糖尿病薬や降圧薬を再利用して、ある種のがんの発生率を低下させ、ヒトの悪性腫瘍の予防や治療に役立てることは、先に述べたように、ユニークで例外的なことである。[39]。試験管内試験、生体内試験、臨床試験から得られたいくつかの証拠が、がんとの闘いにおける抗糖尿病薬や抗高血圧薬の重要性を裏付けている。このことは、糖尿病と高血圧(どちらも一般的な併存疾患である)が、同様の危険因子によって癌とも密接に関連していることを考えれば、驚くには当たらない。[231]。これらの疾患間の関連は、癌の治療に利用可能な異なる類似の標的を持つことによって、様々な機会を提供する。
それにもかかわらず、このレビューのエキサイティングな結論は、8種類の降圧剤(プロプラノロール、ヒドララジン、ロサルタン、カプトプリル、カンデサルタン、ボセンタン、ミノキシジル、カルベジロール)と6種類の糖尿病治療薬(メトホルミン、ピオグリタゾンピオグリタゾン、デスモプレシン、ダパグリフロジン、エパルレスタット、アカルボース)の6種類の抗糖尿病薬では、エパルレスタットだけが、糖尿病と癌の同じ標的であるAKR1B1/AKR1B10を阻害することにより、乳癌、子宮頸癌、口腔癌、肝臓癌、腎臓癌においてその効果を発揮する[111,195]。
もう1つの興味深い抗糖尿病薬はメトホルミンであり、同様のオンターゲット(糖尿病と癌)とオフターゲット(癌のみ)を調節することにより、異なる癌を阻害する。例えば、メトホルミンは細胞周期の停止を誘導し(結腸 [85]、皮膚 [217]、骨髄腫 [228,229])、アポトーシスを誘導する(前立腺 [120]、卵巣 [164,165]、膠芽腫 [177]、骨髄腫 [228,229])、 パイロトーシスを誘導し(食道扁平上皮がん。[210])、オートファジーを誘導し(前立腺 [120])、転移を減少させ(結腸 [102,164]、卵巣 [164,165]、膠芽腫 [177]、皮膚 [217])、CSCを阻害する(乳房 [102,137]、腎臓 [191])。さらに、メトホルミンによって繰り返し調節される経路は、STAT経路(乳房 [103,138])とmTOR経路(乳房 [104,166]、前立腺 [120]、腎臓 [191]、骨髄腫 [228,229])である。それにもかかわらず、メトホルミンの顕著な効果は、肺 [140,146,147,148,149]、膠芽腫 [177]、皮膚 [217]、骨髄腫 [229]において、糖尿病と同じオンターゲットであるAMPKの活性化(AMPK依存性)によってその効果を誘導している。したがって、メトホルミンがその多面的作用のために37もの臨床試験が行われているのも不思議ではない。
他の降圧剤や抗糖尿病剤も、がん種によって異なるオフターゲットを標的とすることで効果を発揮していることは、現在報告されているデータからも明らかである。例えば、ピオグリタゾンは臨床試験で2番目に多く評価されている抗糖尿病薬(10試験)であるが、癌においては異なるオフターゲットしか示していない。例えば、ピオグリタゾンは細胞周期の停止を誘導し(乳癌[113]、白血病[224,225,226]、肝臓[188])、アポトーシスを誘導し(肝臓[188]、卵巣[167])、壊死を誘導し(卵巣[167])、フェロトーシスを誘導し(頭頸部[178])、血管新生を阻害し(卵巣[167])、転移を阻害する(結腸[89]、頭頸部[178])。さらに、ピオグリタゾンは、COX、TNF、MCP-1を減少させることにより、結腸がん。[89]と前立腺がん。[122]において重要な抗炎症作用を示す。
同様の作用の多様性は降圧剤でも観察されるが、ヒドララジンは、乳がん。[91,92]、膵臓がん。[92,118]、子宮頸がん。[130]などの様々ながんにおいてエピジェネティック変化(DNA脱メチル化)を誘導することで効果を発揮する注目すべき降圧剤である(7つの臨床試験)。ヒドラジンの作用は、様々な標的のDNA脱メチル化からDNMTやG9Aヒストンメチルトランスフェラーゼの阻害まで多岐にわたる。逆に、ヒドラジンのDNAメチル化作用が自己免疫や全身性エリテマトーデス様疾患につながる可能性があることを考慮すると、ベネフィットとリスクの比率を明らかにするためには、さらなる研究が必要であることは言及に値する。[220,232]。
さらに、降圧薬や抗糖尿病薬に関連したがん発症のリスクに関するデータには議論の余地があり、さらなる解析が必要である。例えば、メトホルミンやチアゾリジン系薬剤は、その有益な効果にもかかわらず、膀胱癌のリスク上昇と関連する可能性がある。[42]。さらに、SGLT-2阻害薬に抗癌の可能性があるのか、あるいは有害な可能性があるのかについては、まだ答えが出ていない。[42]。ランダム化臨床試験は倫理的に実行不可能であるが、観察研究では通常、信頼性を制限するバイアスが存在する。このため、エビデンスに基づく推奨を行うためには、「ビッグデータ」をより詳細に収集する必要がある。[233]。結局のところ、一般的ながんリスクを回避するために有効な降圧療法を中断することを推奨することは、容易に正当化できないようである。[233]。
注目すべきは、この総説は臨床研究および前臨床研究に基づくデータを報告しており、以下に述べるようにいくつかの限界があることである。例えば、公表された前臨床データは、必ずしも医薬品の承認、ひいてはがんにおける治療薬の成功を保証するものではない。さらに、著者の臨床試験の目的と結論を報告するだけでは、必ずしも適切な臨床的結論を出すのに十分とは限らない。[235]。例えば、多くの系統的レビューで検討された複数の観察研究では、糖尿病患者において抗糖尿病治療ががんのリスクを低下させ、がん治療の有効性を改善する可能性が示されているが、[43,236,237,238,239]、非糖尿病がん患者において同様の予防効果を示そうとした臨床研究では、賛否両論の結果が示され、期待外れに終わっている。[240]。糖尿病患者と非糖尿病患者との間の臨床的有益性の差は、治療の至適投与量、スケジュール、期間、およびがん患者間の組織学的サブタイプや遺伝子型の不均一性によって説明される可能性がある。同様の結論は、がん患者における降圧薬についても報告されている。[67]。
したがって、各臨床試験の質、内的・外的妥当性、均質性、試験デザイン、結果の一貫性、解析、臨床的・統計的有意性、偏りや矛盾を批判的に評価し、十分な詳細を提供し、誤解を招きかねない重大なギャップを避けることが理想的であろう。[241,242]。さらに、抗糖尿病薬や降圧薬のがんに対する免疫調節効果を評価する臨床試験が必要である。さらに、承認された薬剤の長期使用後に得られたデータを評価することは、その成功を評価するために不可欠である。
とはいえ、上記の限界にもかかわらず、本総説で示されたデータは、複数のメカニズムを介して異なるがん種に有効な薬剤を再利用することがいかに価値あることかを示している。
最後に、この総説では、臨床試験やその他の利用可能な研究に関する現在の情報の要約も示し、議論している。さらに、慢性的に使用されている抗糖尿病薬や降圧剤を、オンサイトおよびオフサイトの標的を調節することによって、さまざまな癌の治療に利用することの利点が強調されている。残念なことに、薬剤再利用の重要性に関するデータが豊富にあるにもかかわらず、現在の治療法は高価な薬剤に依存している。したがって、がん患者は、安価で効果的、かつ毒性のない薬剤を迅速に入手する必要がある。願わくば、安全な降圧剤や抗糖尿病剤を用いた多くの有望な試験により、すべてのがん患者が格差なく治療され、経済的負担が大きな問題にならなくなることを期待したい。
資金提供
本研究は外部資金援助を受けていない。
利益相反
著者らは利益相反がないことを宣言する。
