Plasmalogens and Alzheimer’s disease: a review
www.ncbi.nlm.nih.gov/pmc/articles/PMC6466717/
オンラインで2019年4月16日公開
概要
リン脂質の一種であるエタノールアミンプラズマローゲン(PlsEtns)がアルツハイマー病(AD)と密接に関連していることが示唆されている。PlsEtnsの減少は、アルツハイマー病患者によく見られ、認知機能の低下や病状の重さと相関していた。限られた研究ではあるが、プラズマローゲンをアルツハイマー病患者やげっ歯類に投与することで、治療効果が得られることが示されている。
プラズマローゲンのADに対する有効性のメカニズムは、ADの特徴であるβアミロイド(Aβ)の合成を触媒する酵素であるγセクレターゼ活性の低下に関連している可能性がある。また、PlsEtnsは、オーファンGタンパク質共役型受容体(GPCR)タンパク質の活性化を介して、AKTおよびERKシグナルのリン酸化を促進することにより、神経細胞死を防ぐことが試験管内試験で明らかになった。さらに、PlsEtnsは、カスパーゼ-9およびカスパーゼ-3の切断を阻害することで、マウス海馬初代神経細胞の死を抑制することも判明している。
ADに関連するPlsEtnsの特徴的な分子種を明らかにし、バイオマーカーとしての役割を果たすためには、さらなる詳細な調査が必要であると考えられる。プラズマローゲンを用いた臨床的介入はまだ初期段階にあるが、ADの病態や神経機能を改善するための新たな治療法として検討される可能性を秘めている。
キーワード
プラズマローゲン、アルツハイマー病、バイオマーカー、治療効果、作用機序
はじめに
プラズマローゲンは、リン脂質の一種であり、主に細胞膜に存在する。エタノールアミン型のプラズマローゲン(PlsEtns)は,脳,腎臓,肺,骨格筋などに多く存在するリン脂質である[1]。PlsEtnsの特徴は,1位のグリセロール分子に脂肪アルデヒドを結合するビニルエーテル結合と,2位の脂肪アシル結合を持つことである。プラズマローゲンは、生体内での役割や様々な疾患との関連性が指摘されており、過去20年間で関心が高まっている。血漿中のPlsEtns濃度の低下が、アルツハイマー病(AD)心血管疾患、高血圧、癌、呼吸器疾患などと関連していることが報告されている[1-7]。PlsEtnsの作用に関連したいくつかのメカニズムが、主に試験管内試験の研究により、様々な著者によって示唆されている。例えば,膜の物理的二重層の特性を維持し,膜の融合やコレステロールの排出を含むシグナル伝達プロセスを促進すること [8, 9],酸化ストレスを防ぎ,炎症反応を抑制すること [7, 10-13]などが挙げられる。
本レビューでは、プラズマローゲンとアルツハイマー病との関連性に焦点を当てる。アルツハイマー病は,進行性の記憶喪失と認知機能障害を特徴とする複雑な神経変性疾患で,主に海馬で観察される進行性の神経細胞の減少を伴う[14, 15]。ADの発症原因やメカニズムは完全には解明されていないが、神経細胞の内外にβアミロイド線維(Aβプラーク)や異常な形態のタウ(タウタングル)が進行性に蓄積することが神経病理学的な特徴であると考えられている[14, 15]。現在のところ、ADのバイオマーカーは確立されておらず、ADのリスクを早期に発見し、病気の進行を防ぐための介入が可能となっている[16]。現在入手可能な抗認知症薬は、限られた期間でADに一定の効果を示しているが、強力な有効性と長期的な効果を持つ、より望ましい治療薬が必要である。
この総説の目的は、PlsEtnsの生物学に関する現在の知識を、ADとの関連に重点を置いて概観することである。PlsEtnsの化学的・生物学的特性を簡単に説明し、PlsEtnsとADとの関連、作用機序、診断・予後のバイオマーカーとしての可能性、ADの新たな治療標的に関する最新の文献的証拠を紹介する。
プラズマローゲンの性質
プラズマローゲンは、グリセロール骨格のsn-1位にビニルエーテル結合、sn-2位にエステル結合が存在することを特徴とするリン脂質のサブクラスである。sn-1位はC16:0(パルミチン酸)C18:0(ステアリン酸)またはC18:1(オレイン酸)の炭素鎖からなり、頭部基は通常、エタノールアミンまたはコリンのいずれかであり、エタノールアミン型プラズマローゲン(PlsEtns)とコリン型プラズマローゲン(PlsChos)の2つの主要なタイプがある。sn-2位は主に多価不飽和脂肪酸,具体的にはアラキドン酸(ARA)やドコサヘキサエン酸(DHA)で占められている[1-3, 17](図1)。プラズマローゲンは,ほぼすべての哺乳類組織に存在するが,最も高濃度に存在するのは脳,赤血球,骨格筋,精子であり,細胞膜の全リン脂質の18-20%を占めることもある[1, 15]。その分布と含有量は組織・細胞の種類によって大きく異なり、筋肉を除いてPlsEtnsはPlsChosの10倍以上である[18]。脳はPlsEtnsの含有量が最も多く、ヒト脳の全リン脂質の30mol%を占めているが、心筋はPlsChosの含有量が多い[3, 7, 17]。腎臓、骨格筋、脾臓、血液細胞には中程度の量のプラズマローゲンが存在するが、肝臓ではプラズマローゲンの含有量は少ない[2]。プラズマローゲン種の生体内でのユニークな機能は、sn-1ビニルエーテル結合の特性とsn-2位の多価不飽和脂肪酸の濃縮に直接関係している[1]。
図1 プラズマローゲンの化学構造
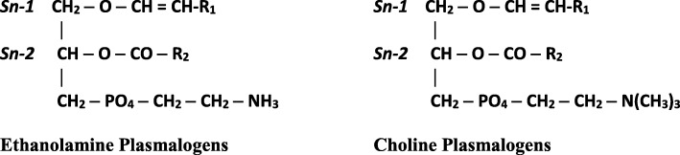
R1=パルミチン酸(16:0)またはステアリン酸(18:0)またはオレイン酸(18:1)。R2=アラキドン酸(20:4)またはドコサヘキサエン酸(22:6)またはオレイン酸(18:1)またはリノール酸(18:2)である。1位のアルキル鎖に二重結合がない場合、プラズマローゲンはアルキルプラズマローゲンと呼ばれ、ここで示すように二重結合がある場合はアルケニープラスマローゲンと呼ばれる。
リン脂質には、食事から直接摂取するものと、de novo合成によるものがある。食事性リン脂質は,通常,ほとんどすべての食品,特に卵,大豆,肉,魚,牛乳およびその他の乳製品の摂取を通じて,1日あたり約2〜5gという少量しか摂取されない[19, 20]。食事中のプラズマローゲンは腸で吸収され,組織に運ばれるが [21] ,食事中のプラズマローゲンの消化,吸収,その後の輸送の詳細については基本的に不明である.同様の状況は,食物ジアシルリン脂質の吸収とその後の輸送にも当てはまり,具体的な詳細はまだ明らかになっていない[22, 23]。循環しているプラズマローゲンは、食事由来のものと、主に肝臓や消化管上皮で合成されたものがあり[24, 25]、低密度リポタンパク質(LDL)を主要な輸送体とする輸送タンパク質を介して血液中に排出される[26]。そこからLDL受容体を介したトランスサイトーシス経路を経て脳に輸送される[27]。プラズマローゲンは,細胞膜の重要な構造リン脂質であるだけでなく,二次的なメッセージの貯蔵庫であり,膜ダイナミクスのメディエーターでもあり,膜融合,イオン輸送,コレステロール排出,膜結合酵素活性,シグナル伝達分子の拡散などに関与している。プラズマローゲンの生物学的機能については,文献でよく知られている[1, 2, 7-9, 28-30]。プラズマローゲンは抗酸化物質でもあり,特に脳や心臓の酸化ストレスに対して保護的な役割を果たしていることが示されている[12]。プラズマローゲンの生合成は,ペルオキシソームで開始され,小胞体で終了する(図2)[7, 31]。プラスマローゲンの合成過程で発生する欠陥は、生体内での生物学的機能に影響を及ぼす可能性がある。遺伝性(原発性)プラズマローゲン欠乏症は10万分の1と稀であり、プラズマローゲンの合成に必要なペルオキシソームタンパク質トランスポーターや酵素の合成に関わる遺伝子の変異・欠損によるペルオキシソーム障害との関連性が指摘されている[1]。遺伝性ヒトペルオキシソーム障害である穿孔性根瘤性軟骨異形成症(RCDP)に伴う一次性プラズマローゲン欠乏症では,組織内のプラズマローゲンが欠乏し,脳,骨,水晶体,腎臓,心臓などの多臓器に重篤な障害が生じる[17].また,心疾患,糖尿病,癌,呼吸器疾患,アルツハイマー病などの代謝性・炎症性疾患において,プラズマローゲンの合成低下や分解増加による二次的なプラズマローゲンの欠乏が報告されている[1-3, 7, 17]。コリンプラズマローゲンは、心臓組織では重要な役割を果たしているが、他のほとんどの臓器ではマイナーな種であるため、それらの臓器では重要でない役割を果たしている可能性が高い。
図2 プラズマローゲンの生合成経路
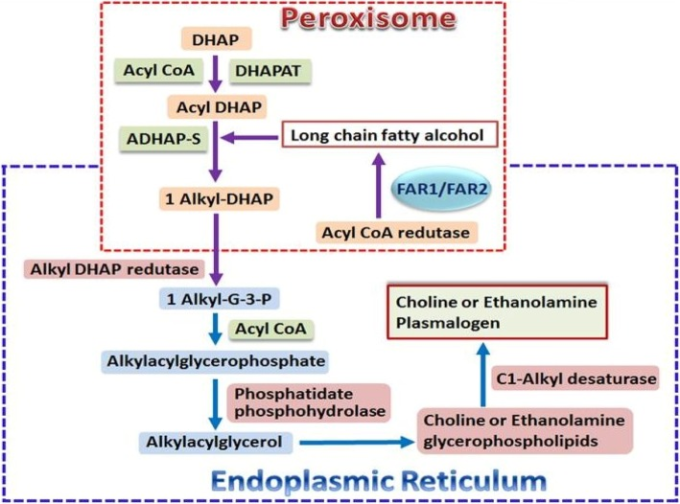
略語の説明 DHAP、ジヒドロキシアセトンリン酸;DHAPAT、ジヒドロキシアセトンリン酸アシルトランスフェラーゼ;DHAP、ジヒドロキシアセトンリン酸;ADHAP-S、アルキルジヒドロキシアセトンリン酸合成酵素;FAR1/2,アシル-CoAレダクターゼ1および2
アルツハイマー型認知症
アルツハイマー病は、進行性の記憶喪失と認知機能障害を特徴とする複雑な神経変性疾患である[14]。高齢者の認知症の原因としては最も一般的である。アルツハイマー病は、進行性の記憶喪失と認知機能障害を特徴とする複雑な神経変性疾患である[14]。ADの原因とメカニズムは完全には解明されていないが、神経細胞の内外にβアミロイド線維(Aβプラーク)と異常な形態のタウ(タウタングル)が進行性に蓄積することが神経病理学的な特徴であると考えられている[14, 15, 32-34]。また、神経細胞の収縮、低髄鞘化、神経炎症、ミトコンドリアの酸化ストレス、小胞体ストレス、コリン作動性機能障害など、ADの他の多くの神経病理が示唆されている[1, 3, 35-37]。様々な危険因子は、ADの臨床症状が現れるかなり前に病理学的変化を促進する。これには、年齢、心血管リスク、肥満、糖尿病、うつ病、喫煙、不十分な食事などのライフスタイル関連因子、家族歴およびおそらく遺伝的因子、環境因子(脳内のアルミニウムおよび亜鉛の蓄積)重篤な頭部外傷などが含まれる[1, 14]。ADの有病率は、2030年には全世界で7,400万人に達すると推定されており[38]、発症率を低下させるためには、早期診断と効果的な治療が重要となる。しかし、ADの病態は症状が現れるかなり前から始まっているため、脳内で進行する神経変性や神経細胞の減少は、認知能力の低下が顕著になるまで見過ごされがちである[14]。神経細胞の減少が認知能力の低下を伴う臨界点に達したときには、約50~80%の細胞がすでに死滅しており、病気の進行の経過を変えることが困難または不可能な状態になっている。現在、ADのバイオマーカーは確立されておらず、病気のリスクを早期に発見し、病気の進行を防ぐための潜在的な介入を可能にするものはない[16]。ADのバイオマーカーとして研究されているいくつかの要素の中には、PET(ポジトロン・エミッション・トモグラフィー)画像で示される脳内のアミロイドβや、脳脊髄液中の特定のタンパク質のレベル(例えば、成熟したニューロンの主要な微小管関連タンパク質であるAβとリン酸化タウのレベルや、血液中の特定のタンパク質群のレベル)がある[14]。しかし,それらの検査は侵襲的であったり,費用がかかったりする。また、それらの検査の感度は、臨床診断には不向きであることを反映している[39]。また、ADに対する有効な治療法はないが、コリンエステラーゼ阻害剤やメマンチン(ナメンダ)などの抗認知症薬は、限られた期間ではあるが、一部のアルツハイマー病患者の認知機能、全人的機能、および/または日常生活動作の改善を示している[40, 41]。
PlsEtnsのアルツハイマー病との関連性とバイオマーカーとしての可能性
過去20年の間に、プラズマローゲンの欠損とADの直接的な関連性を報告した研究が増えてきている。1995年にアルツハイマー病患者の死後脳サンプルにおいて、PEに比べてPlsEtnsが著しく欠乏していることを示した最初の研究が発表されて以来[42]、PlsEtnsとADとの関連に多くの注目が集まっている。最近の研究では、主にPlsEtnsの潜在的な治療的役割と、その有益な効果の分子メカニズムに焦点が当てられている。表1は、PlsEtnsとADの関係に焦点を当てた主な研究、特に過去5年間に発表された研究をまとめたものである。
表1 プラズマローゲン(Pls)の欠乏と、ADおよび関連疾患におけるその治療的使用、および神経細胞保護の役割に関する新たな分子的証拠
| 著者 | 設計 | 目的 | 結果 |
|---|---|---|---|
| 人間の研究 | |||
| 藤野ほか 2017年 | 軽度ADおよび軽度認知障害(MCI)の患者(60〜85歳)は、多施設二重盲検プラセボ対照試験にランダム化され、1 mg / dの精製プラズマローゲン(1 mg / dの精製プラズマローゲン)による24週間の治療を受けた。 Pls)ホタテ(n = 140)またはプラセボ(n = 136)から抽出 | 軽度のADおよびMCIの患者における認知機能および血中Pls変化に対するPlsの経口投与の有効性をテストすること。主な結果
ミニメンタルステート検査-日本語(MMSE-J); 副次的結果 ウェクスラー記憶検査-改訂版(WMS-R)老年期うつ病尺度-短期版-日本語(GDS-SJ)および循環中のPlsEtnsの濃度。 |
Plsの経口投与は、WMS-Rテストで示されているように、女性の軽度のアルツハイマー病患者と77歳未満の患者の記憶を有意に改善した。 軽度のアルツハイマー病患者は、治療群よりもプラセボ群で血漿PlsEtnsの有意に大きな減少を示した。 |
| ウッドら。2016年 | 臨床的に診断された遅発性AD(LOAD)患者(n = 90)軽度認知障害の患者(MCI、n = 77)および 76 = 78歳の対照(n = 51)の血清サンプルをリピドミクスによって分析した。 | 高分解能質量分析を利用してPlsEtnsとジアシルグリセロールのレベルを調査し、脂質レベルを疾患と相関させること。 | 各臨床診断内の3つの患者コホート(LOADおよびMCIが観察された:循環PlsEtnsが低い、循環ジアシルグリセロールが高い、およびこれら、2つの脂質変化のいずれもない。より多くの患者が疾患の進行段階で低レベルのPlsEtnsを示した。 |
| 山下ほか 2016年 | 28人のアルツハイマー病患者(年齢:72.5±1.4)と28人の正常な対照被験者(年齢:74.1±1.3)の血漿および赤血球サンプルを分析した。血漿Aβの評価は、アルツハイマー病患者の血液中のホスファチジルコリンヒドロペルオキシド(PCOOH)およびPlsEtnと相関していた。 | アルツハイマー病患者におけるAβ、ホスファチジルコリンの過酸化およびPlsEtnの相互作用を調査すること。 | アルツハイマー病患者の血漿は、PlsEtn種、特にDHA含有PlsEtnの濃度が低いことを示した。さらに、アルツハイマー病患者の赤血球(RBC)では、より低いPlsEtnおよびより高いPCOOHレベルが観察された。ADと対照の血液サンプルの両方で、RBCのPCOOHレベルはAβ40の血漿レベルと相関する傾向があった。 |
| ウッドら。2015年 | 死後の脳脊髄液(脳脊髄液)前頭皮質灰白質、および下にある白質の脂質動態分析 | 認知症が無傷の被験者を初期または確立された認知症の被験者から区別する潜在的なバイオマーカーを定義すること。老化と加齢に伴う認知障害の病態生理学における脳脂質の役割を理解している。 | モノアシルグリセロール(MAG)ジアシルグリセロール(DAG)および脂肪酸26:0は、軽度認知障害(MCI)および古い認知症(OD)コホートの灰白質で上昇した。PlsEtnsは、若年性認知症(YD)およびODコホートの灰白質で減少し、ホスファチジルエタノールアミンは、MCI、YD、およびODコホートで減少した。 |
| ウッドら。2010年 | AD評価スケール認知(ADAS-Cog)を使用して、40人のアルツハイマー病患者と67〜89歳の66人の対照の血清PlsEtnsを分析し、認知機能と相関させた。アルツハイマー病患者の血清PlsEtnsは1年後に再検査された。 | コントロールと比較してアルツハイマー病患者のADAS-Cogを使用して循環PlsEtnsのレベルと認知機能との関係を評価すること。 | 血清DHA-PlsEtnが正常レベルの75%以下の被験者のみが、12か月間で認知機能の低下を示した。ベースライン(> 75%)で血清PlsEtnレベルが正常な参加者間でADAS-Cogスコアに変化はなかった。 |
| Goodenowe etal。2007年 | 324人の認知症被験者(3つのグループ:低、中、重度の認知障害)の血清サンプルを分析し、50〜90歳の68人の認知正常被験者と比較して、認知症の重症度とPlsEtnsレベルの関係を調査した。 50〜95歳の209人の健康な被験者を3つの年齢グループ(50〜59,60〜69,および70〜95歳)に分け、それらの血清を分析して、PlsEtnsレベルに対する年齢の影響を決定した。 ADのある被験者(n = 20)とADの病状のない被験者(n = 19)の死後血清サンプルを分析して、血清PlsEtnsレベルを比較した。 死後検査でADであることが後で確認された50人の臨床的に診断されたAD被験者(3段階)からの血清を分析して、DHAPlsEtnsレベルを決定した。 日本に住む80人の日本人AD被験者と80人の認知症でない日本人被験者の血清サンプルを分析して、ADの血清DHAPlsEtnsレベルに対する民族的または環境的差異の影響を決定した。 |
ADの被験者の脳におけるPlsEtnsの枯渇を決定すること。また、ADにおけるPlsEtnsの脳内レベルの低下が、Aβの蓄積によって引き起こされる中枢性の影響であるのか、それともはるかに広範な変化が起こっているのか。 | PlsEtns種のレベルは、AD被験者の3つのグループすべてで有意に減少し、その減少はADの重症度と相関していた。ペルオキシソーム由来のPlsEtnsも、ADのすべての段階で有意に減少した。 60〜69年のコホートでPlsEtnsが非常に低い被験者%は、他の2つのグループの2倍以上であった。 ↑AD被験者と↓PlsEtnsのペルオキシソーム障害の両方における死亡率。 血清PlsEtnsレベルは、死後(55%)のAD被験者、および臨床的に診断されたAD被験者(47%)で有意に減少した。減少は病気の重症度に関連していた。 血清DHA-PlsEtnsレベルはAD被験者で有意に減少した。 |
| ハンら。2001年 | ADの2つの動物モデル、APPV717FおよびAPPswからの死後のヒト脳組織およびマウス脳組織を、エレクトロスプレーイオン化質量分析(ESI / MS)を使用して分析した。 | さまざまなAD臨床認知症評価を用いて、被験者のさまざまな領域からの灰色および白質の細胞膜におけるプラスミノーゲン含有量を体系的に調べること | ADの非常に早い段階で白質のPlsEtns含有量の劇的な減少(総PlsEtnsの最大40 mol%)。灰白質のPlsEtns含有量の不足(10 mol%-30 mol%の不足)とADの重症度(非常に軽度から重度)との相関。小脳白質のPlsEtns含有量の劇的な変化にもかかわらず、小脳灰白質のPlsEtns含有量と分子種の変化はない。10 mol%の欠損は、18か月齢のマウスの大脳皮質に見られたが、小脳には見られなかった。 |
| 動物実験 | |||
| 片渕ほか 2012年 | オスのC57 / 6 Jマウス(10ヶ月齢)をランダムに3つのグループに分けた:Pls(20 mg / kg)+リポ多糖(LPS)LPS、およびコントロール。鶏の胸の筋肉からplsを抽出した。すべての治療は7日間であった。 | 海馬における神経炎症およびβ-アミロイドタンパク質の蓄積に対するPlsの影響、および成体マウスにおけるLPSの末梢投与後の海馬Pls含有量の変化を解明すること。 | Pls投与は、LPSによって誘発されるグリア細胞(ミクログリア)の活性化を抑制し、海馬の神経炎症の減弱を示している。Pls治療はまた、海馬のβ-アミロイドタンパク質を廃止した。LPSによって誘発された海馬のPls含有量の減少を抑制した。 |
| マワタリ他 2012年 | 4週齢の20匹のオスのZucker糖尿病脂肪(ZDF)ラットをランダムに2つのグループ(グループあたり10匹)に分け,0.1%PlsEtnまたは対照食を4週間与えた。さらに、6週齢の18匹のオスのウィスターラットを2つのグループに均等に分け、PlsEtnまたは対照食を9週間与えた。 | 食事療法のPlsEtnの健康への影響を調べること。 | Zucker糖尿病脂肪ラットとWistarラットの両方に0.1%PlsEtnを補給すると、血漿コレステロールとリン脂質が減少した。それに対応して、赤血球のPlsEtnとホスファチジルエタノールアミンが増加した。 |
| 試験管内試験研究 | |||
| Hossain etal。2016年 | マウス神経芽細胞腫由来細胞(Neuro 2A、またはN2A)星状細胞株(A1)およびミクログリア細胞株(MG6)を、ニワトリの皮膚から抽出したPls(96.5%PlsEtns)で処理した。一次海馬ニューロンは、マウスのE-18胚から調製された。 | PlsEtnsがどのようにAKTおよびERKシグナル伝達を増強し、神経細胞を予防するかを調査すること。 | PlsEtnsはオーファンGPCR(Gタンパク質共役型受容体)タンパク質を活性化して、神経細胞でERKシグナル伝達を誘導した。GPCRの過剰発現は、細胞内のERKおよびAktのPlsEtnsを介したリン酸化を増強した。内因性PlsEtnsが減少すると、GPCRを介した細胞シグナル伝達が大幅に減少した。 |
| Hossain etal。2013年 | 神経芽細胞腫由来細胞Neuro-2Aおよび星状細胞由来細胞A1をPls(96.5%PlsEtns)で処理した。 | アポトーシス刺激に対するPlsEtnsのニューロン保護の背後にある分子メカニズムを調査すること。 | PlsEtnsは、神経細胞におけるAKTおよびERKシグナル伝達のリン酸化を促進することにより、神経細胞死を防ぐ。それらはまた、カスパーゼ-9およびカスパーゼ-3切断の阻害に関連する栄養素欠乏によって誘発される原発性マウス海馬神経細胞死を阻害した。 |
| 小野寺ほか 2014年 | γ-セクレターゼ活性は、酵母ミクロソームと再構成リポソームを使用したinvitroアッセイで測定された。 | invitroでのγ-セクレターゼ活性に対するPlsEtnsの効果を調査すること。 | PlsEtnsはγ-セクレターゼ活性を低下させた。細菌のPlsEtns調製物は、γ-セクレターゼ活性の用量依存的な阻害を示した。 |
| Rothhaar etal。2012年 | SH-SY5Y細胞、および61〜88歳の37人のアルツハイマー病患者と21人の対照からの58の死後脳サンプルをγ-セクレターゼ活性について分析した。核画分後のγ-セクレターゼ活性の エクスビボ分析のために、6つの追加のヒト死後脳およびC57BI6 / N野生型マウスの脳も分析された。 |
PlsEtnsがアミロイド前駆体タンパク質(APP)処理を調節できるかどうか、またはPlsEtnsレベルの低下がADの結果であるかどうかを判断すること。 | PlsEtnsレベルは死後のAD脳で減少した。 PlsEtnsは、SH-SY5Y細胞、死後のAD脳、およびマウス脳のγ-セクレターゼ活性を直接低下させた。 セクレターゼのタンパク質およびRNAレベルは影響を受けないであった。 |
PlsEtnsの減少は、死後の脳だけでなく、アルツハイマー病患者の脳脊髄液、血漿、血清、赤血球でも確認されている[30, 48-50]。アルツハイマー病患者の脳では、健常者の脳組織と比較して、PlsEtnsが70%も減少していることが観察されている[30, 32]。神経変性におけるPlsEtnsの欠損は、ADに特異的であり、ハンチントン病やパーキンソン病の神経変性の主要部位では観察されないことが判明した[3, 44]。また、海馬、側頭皮、前頭皮などの神経変性部位でPlsEtnsがより顕著に減少し、小脳では減少しないことが報告されている[15, 42, 44]。白質のPlsEtnsとは、sn-2位の脂肪酸組成が異なることがわかった。白質ではsn-2位がオレイン酸で占められているのに対し、灰白質ではドコサヘキサエン酸(DHA, 22:6)とアラキドン酸(20:4)が優勢である[3]。さらに、脳組織におけるPlsEtnsの減少は、ADの進行段階の違いと関連することが報告されている。白質のPlsEtnsの減少はADの初期段階と関連しており、死後のAD脳ではPlsEtns全体の40mol%までの劇的な減少が観察されている[44, 51]。このPlsEtnsの減少は、認知機能とは相関していなかった[3]。一方、灰白質のPlsEtnsの減少は、疾患の重症度と相関しており、死後のAD脳では、PlsEtns全体の減少のうち約10mol%~30mol%が、非常に軽度および重度の疾患状態に対応して記録された[3, 44]。同様に、アルツハイマー病患者の血清プラズマローゲンレベルが年齢をマッチさせた対照群と比較して75%以下に低下していることも、認知機能の低下との関連を示している[30]。DHAが脳の機能と密接に関係していることを示す報告は数多くある[52-56]。したがって、灰白質のPlsEtnsと白質のPlsEtnsがADの異なるステージと関連しているのは、少なくとも部分的には、sn-2位の脂肪酸組成の違いや、ミエリンと比較して神経細胞における主要な機能の違いに起因すると考えられる。これに対応して、アルツハイマー病患者の脳、肝臓、血漿、血清において、DHAおよびDHAを含むPlsEtnsのレベルが有意に低下し、その低下の程度はアルツハイマー病患者の認知機能低下と相関していることが観察されている[3, 24, 30, 49]。さらに、DHAとプラズマローゲンの循環レベルが高い場合、特にSn-2にDHAを含むPlsEtnsが多い場合、病気の重症度が改善された[30, 49]。
ADの脳でPlsEtnsが欠乏する原因は明らかになっていない。また、アルツハイマー病患者におけるPlsEtnsの減少が、病気の原因なのか結果なのかも不明である。両方の可能性があるが[15]、以前の提案では、ADのエートロジーの原因である可能性が指摘されていた[57]。ADにおけるPlsEtnsの減少に関しては、ペルオキシソームの機能不全、酸化ストレス、膜脂質ラフトの変化、炎症反応など、いくつかの可能なメカニズムが示唆されている[2, 3, 42, 58, 59]。プラズマローゲンの合成はペルオキシソームで開始されるため[31]、ペルオキシソームの変化・損傷はプラズマローゲン合成の変化をもたらす。アルツハイマー病患者の肝臓や脳ではペルオキシソームの欠損が報告されている[24, 58, 60]。また、ADの脳では、超長鎖脂肪酸(VLCFAs:ベヘン酸C22:0,リグノセリン酸C24:0,ヘキサコサン酸C26:0)の増加とプラズマローゲンの減少、神経細胞におけるペルオキシソーム体積密度の増加との間に相関関係が認められた[58]。これらのVLCFAはすべてペルオキシソームで代謝されるため、これらのデータはADにおけるペルオキシソームの機能障害を再び支持するものである[3]。さらに,VLCFAおよびPUFAを含むプラズマローゲンの変化は,機能的パフォーマンスにも影響を与える。大脳皮質におけるVLCFAの増加,脳,肝臓,血漿におけるDHAを含むプラズマローゲンの減少は,アルツハイマー病患者の認知機能障害と関連することが明らかになっている[24, 30, 44, 58]。
また、ADの脳におけるPlsEtnsの消失は、活性酸素種(ROS)によるプラズマローゲンの分解をもたらす酸化ストレスと関係している可能性がある[1]。ビニルエーテル結合があることで、プラズマローゲンは酸化ストレスを受けやすくなる[61]。このことは,プラズマローゲンがスカベンジャーとして,他の脂質やリポタンパク質を酸化的損傷から保護している可能性を示唆している[11, 62]。プラズマローゲンの抗酸化作用は,さまざまな活性酸素に対して報告されている[10, 59]。プラズマローゲンが減少すると、ADで進行中の酸化的損傷がさらに促進され、膜の特性が変化してさらなる損傷を引き起こす可能性がある[1]。細胞膜の脂質環境は、アミロイド前駆体タンパク質が膜内で切断されることから、プロセッシング酵素によるプロセッシングに影響を与える可能性がある。さらに,PlsEtnsの欠損に伴う膜遊離コレステロールの増加は,アミロイド前駆体タンパク質からのAβの産生を増加させた[63]。したがって、ADにおけるPlsEtnsの減少は、Aβの産生を促進する可能性がある。さらに、ある試験管内試験の研究では、Aβの凝集がプラズマローゲンによって調節されることが示されている[64]。一方、Aβや活性酸素の増加は、プラズマローゲンが生合成されるペルオキシソームの機能低下により、プラズマローゲンde novo合成の律速酵素であるアルキル-ジヒドロキシアセトンリン酸シンターゼの発現を低下させ、その結果、プラズマローゲンレベルが低下することも明らかになっている[60]。最後に、PlsEtnsは、神経伝達物質の放出に関連するシナプス小胞の膜融合を促進する主要な内因性脂質成分であることから、PlsEtnsの喪失は、シナプスの構造と機能に悪影響を及ぼし、ADで観察されるシナプス機能障害と神経伝達物質の枯渇に寄与する可能性があると予想される[1, 3, 59]。
プラズマローゲンのレベル低下は、神経炎症で観察されており、それは、酸化ストレスから細胞を保護するプラズマローゲンの抗酸化特性によるものと考えられる[59]。神経炎症,Aβの蓄積,活性酸素の生成,プラズマローゲンの欠乏の間には,関連性のあるループが存在することが示唆されている[59].さらに,プラズマローゲン選択的ホスホリパーゼA2(Pls-PLA2)という酵素によるPlsEtnsの分解は,DHAやアラキドン酸をグリセロール骨格のsn-2位から遊離させるが,このプロセスは,炎症状態で産生されるセラミドによって活性化される可能性があり,これが脳内のPlsEtnsの消失に寄与していると考えられる[65, 66]。アラキドン酸は、プロスタグランジン、トロンボキサン、ロイコトリエンの合成基質となる。DHAから得られる代謝物には、レゾルビン、マレシン、ドコサトリエン、ニューロプロテクチンなどがある[1, 67]。これらの分子はすべて炎症反応を制御しており、アラキドン酸とその誘導体は炎症促進プロセスに関与し、DHAとその誘導体は炎症抑制プロセスに関与している[13, 55, 68](図)(図33)。
図3 エタノールアミン・プラスマローゲン欠損症とアルツハイマー病の機構的関連性の提案
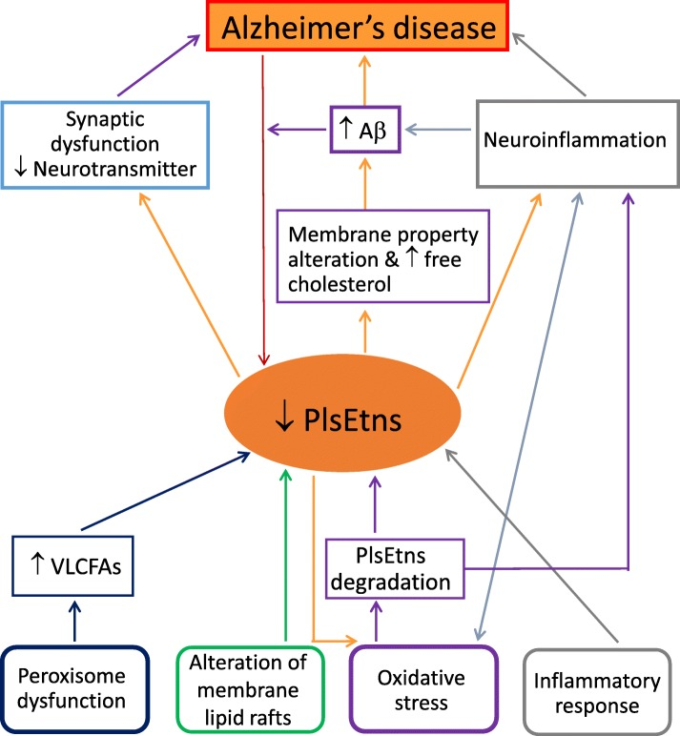
略語は以下の通り。Aβはβアミロイド、PlsEtnsはエタノールアミン・プラスマローゲン、VLCFAsは超長鎖脂肪酸を意味する。PlsEtnsは、アルツハイマー病(AD)と密接な関係がある。PlsEtnsの減少は、アルツハイマー病患者において一般的に見られ、認知機能の低下や病状の重さと相関しているが、PlsEtnsがアルツハイマー病の原因なのか、結果なのかはわかっていない。その両方である可能性も示唆されている。ADにおけるPlsEtnsの減少については、ペルオキシソームの機能障害、酸化ストレス、膜脂質ラフトの変化、炎症反応など、いくつかのメカニズムが考えられている。PlsEtnsの減少は、ADにおける酸化的損傷をさらに促進し、膜の特性を変化させる可能性がある。これに加えて、PlsEtnsの減少に伴う膜の遊離コレステロールの増加が、Aβの産生を増加させる可能性がある。Aβと活性酸素は、PlsEtnsのレベルをさらに低下させる可能性がある。PlsEtnsは、神経伝達物質の放出に関わるシナプス小胞の膜融合を促進する主要な脂質であり、PlsEtnsの欠損は、アルツハイマー病におけるシナプス機能不全や神経伝達物質の枯渇に寄与する可能性がある。PlsEtnsの減少と神経炎症との関連は、プラズマローゲンの抗酸化作用が細胞を酸化ストレスから守ることに関係していると考えられる。神経炎症はAβの蓄積と関連することが報告されている
PlsEtnsの欠損がADの病態と関連していることを示す研究が増えてきた。これらの知見から、研究者たちは、これらの分子がADのバイオマーカーとしての役割を担う可能性を提案している。しかし、循環プラズマローゲンレベルの低下は、虚血性脳血管障害、高血圧、尿毒症、高脂血症など、他の多くの臨床疾患でも見られることから、Wood氏が示唆しているように、PlsEtnsのADのバイオマーカーとしての有用性については、さらに研究を進める必要がある[3, 50]。今後の研究では、ADに関連するPlsEtnsの特徴的な分子種を特定することが重要である。これにより、PlsEtnsがADの信頼できるバイオマーカーとして有効であることを示す具体的な証拠が得られるかもしれない。
プラズマローゲンを用いたAD治療の可能性
いくつかの研究は、動物におけるプラズマローゲン置換療法に焦点を当てており、有望な結果が報告されている。片渕ら[59]は,精製したプラズマローゲンを7日間腹腔内投与したところ,リポポリサッカライドで誘発された成体オスのC57/6 Jマウスの海馬における神経炎症が軽減されたことを報告した。また、プラズマローゲン投与により、海馬におけるAβタンパク質の蓄積が消失し、これは海馬におけるプラズマローゲン含有量の減少が抑制されたことと相関していた[59]。リン脂質を10wt%含む試験食をラットに7日間与えると,血漿中のプラズマローゲン濃度が3倍,肝臓中のプラズマローゲン濃度が25%増加することがわかっている[21]。また,0.1%のPlsEtnをZucker diabetic fatty (ZDF)ラットに4週間,健康なWistarラットに9週間投与したところ,血漿中のコレステロールとリン脂質の濃度が低下し,それに伴い赤血球のPlsEtnとホスファチジルエタノールアミンの増加が認められた[17]。プラズマローゲンの前駆体であるPPI-1011(100mg/kg/day)をC57/6 Jマウスに2週間経口投与したところ,血漿および脳内のPlsEtnsの減少が回復し,このプラズマローゲンの回復は神経細胞の再髄鞘化の促進と関連していた[57]。
ヒトにおけるプラズマローゲンの治療効果に関する情報はほとんどなく,今後の研究の必要性が示唆されている.最近行われた無作為化二重盲検プラセボ対照臨床試験[15]では,77歳以下の軽度アルツハイマー病患者(女性)を対象に,ホタテ貝から抽出した精製プラズマローゲン1 mg/日を24週間経口投与したところ,記憶力(Wechsler Memory Scale-Revisedテストで示される)が有意に改善したことが報告された。本試験は、複数の施設で実施され、60~85歳の患者276名(治療群140名、プラセボ群136名)が参加した。これに対応して、軽度アルツハイマー病患者の血漿中PlsEtnは、治療群に比べてプラセボ群で有意に大きな減少を示した。
PlsEtnsのADに対する有益な効果の分子メカニズムは、主に試験管内試験の研究によって探求されてきた。プラズマローゲンは,Aβ合成の最終段階であるAβ40,Aβ42,Aβ43などの長さの異なる複数のAβペプチドの生成を触媒する膜結合型アスパラギン酸プロテアーゼであるγセクレターゼの活性を強く低下させることが明らかになった[32, 46]。Aβ42とAβ43の凝集が進むと,Aβの沈着が起こり,家族性ADの一般的な結果となる[69]。また,PlsEtnsは,神経細胞におけるプロテインキナーゼB(AKT)のリン酸化と細胞外シグナル調節キナーゼ(ERK)のシグナル伝達を促進することで,神経細胞死を予防することが研究で明らかになっている。これは,オーファンGPCR(Gタンパク質共役型受容体)タンパク質の活性化を介したものである。GPCRを過剰発現させると,神経細胞におけるプラズマローゲンを介したERKおよびAKTのリン酸化が促進されるが,内因性のPlsEtnsレベルが低下すると,GPCRを介した細胞内シグナル伝達が著しく低下することがわかった[70, 71]。さらに,マウス海馬初代神経細胞の死に対するPlsEtnsの抑制効果は,カスパーゼ-9およびカスパーゼ-3の切断の抑制と関連していることが判明し,PlsEtnsの脳内での抗アポトーシス作用が示された[71]。ADにおけるPlsEtnsの作用に関連する分子メカニズムをさらに深く探求し、これらの分子の理解を深め、ADの病理と機能を修正するための効果的な治療法としてのPlsEtnsの使用を評価するためには、より詳細な動物実験が必要である。
結論
多くの研究により、PlsEtnsの欠損とADとの間に関連性があることが示されているが、アルツハイマー病患者におけるPlsEtnsの減少が病気の原因なのか結果なのかは明らかではない。アルツハイマー病患者の血漿、血清、脳脊髄液、脳組織において、PlsEtnsレベルの低下が報告されている。このことから、PlsEtnsはADのバイオマーカーとして期待されている。しかし、PlsEtnsの循環レベルの低下は他の多くの臨床疾患でも見られることから、ADに関連するPlsEtnsの特徴的な分子種を決定するには、さらなる詳細な調査が必要である。プラズマローゲンのAD治療における臨床効果についてはほとんど知られておらず、動物実験で有望な結果が得られていることから、アルツハイマー病患者へのPlsEtns補充療法による介入研究が必要である。今後、PlsEtnsの作用に関連する分子メカニズムを生体内試験で研究することは、PlsEtnsをADの新たな治療薬として使用する可能性を決定するのにも役立つだろう。
