Contents
Neurocognitive Disorders and Dehydration in Older Patients: Clinical Experience Supports the Hydromolecular Hypothesis of Dementia
www.ncbi.nlm.nih.gov/pmc/articles/PMC5986442/
要旨
水分の恒常性の異常は、神経細胞機能障害、脳萎縮、慢性脳血管障害、神経変性疾患の早期発現である可能性がある。本研究の目的は,認知機能障害を有する被験者の血清浸透圧を解析することであった。
アルツハイマー病評価ユニットに通院している連続した1,091人の患者を対象に、Mini-Mental State Examination (MMSE)、21項目のHamilton Depression Rating Scale (HDRS-21)、Activities of Daily Living (日常生活動作)、Instrumental-日常生活動作 (手段的日常生活動作(I日常生活動作))、Mini Nutritional Assessment (MNA)、Exton-Smith Scale (ESS)、Culative Illness Rating Scale (CIRS)を用いて評価した。
各患者について、KhajuriaおよびKrahnによって開発された血清浸透圧の式を適用した。認知機能低下および/または抑うつ気分(CD-DM)を有する患者は571人、CD-DMを有さない患者は520人(対照群)であった。CD-DMを有する患者は、男性である可能性が低く(p<0.001高齢である可能性が高く(p<0.001有意な明確な認知機能障害を有する(MMSE:p<0. 001抑うつ気分の存在を示し(HDRS-21:p < 0.001対照群と比較して、日常生活動作(p < 0.001手段的日常生活動作(I日常生活動作)(p < 0.001MNA(p < 0.001ESS(p < 0.001)の主要な障害を持っている。
CD-DM患者は、対照群に比べて電解質濃度(Na+:p<0.001,K+:p<0.001,Cl-:p<0.001脱水症リスク(オスモラリティ:p<0.001腎障害(eGFR:p=0.021)が高かった。
アルツハイマー病患者では、現在の脱水のリスクが大きく(p≦0.001脱水はアルツハイマー病や血管性認知症(血管性認知症)のような認知症の種類を発症するリスクと関連していた(OR=2.016,p<0.001)。
多変量解析では、脱水状態の存在は日常生活動作(p<0.001)および手段的日常生活動作(I日常生活動作)(p<0.001)と関連していたが、年齢(r2=0.0046,p=0.77ESS(r2=0.0052,p=0.54MNA(r2=0.0004,p=0.48)と独立して関連していた。
さらに、若年の認知症患者は、認知症のない患者に比べて有意に脱水症状が多かった(65~75歳、p=0.001,76~85歳、p=0.001,≧86歳、p=0.293)。
水分子仮説は、微小循環の欠陥である間質液量の低下の存在下で、タンパク質のミスフォールディングと凝集の結果として、高齢者の脱水と認知機能障害の関係を説明しようとするものである。欠損したタンパク質は、脳の生体分子機構の情報量を損なうことが示され、その結果、神経細胞やシナプスの損傷を伴うことが示された。
キーワード
水分子仮説、脱水、高齢者、神経認知障害
1. はじめに
水バランスの調節は、中枢神経系と腎臓のさまざまな領域の機能と相互作用を含むフィードバック機構によって支配されている [1,2,3]。血漿浸透圧は体内の水分補給のレベルを示し、視床下部の浸透圧受容体はその変動を検出し、敏感に反応する [4]。生理的閾値(水1キログラムあたり290~295mOsm)を超えるレベルまで上昇した高血漿浸透圧は、神経下垂体の血管圧迫神経終末からのペプチドホルモンであるバソプレシンの分泌を導く。バソプレシンは腎臓の受容体と結合して水の排泄を減少させ、その後、ろ過された水のより多くの割合が血液中に戻される。この過程で血漿の浸透圧が低下し、バソプレシン分泌と口渇の刺激が減少し、フィードバックループが完成する[5]。入院患者によく見られるこのメカニズムの障害は、様々な水分バランス障害をもたらす。最近のエビデンスでは、加齢過程が水のホメオスタシスの複数の異常と一般的に関連していることが明らかになっており、罹患率、認知、骨粗鬆症、骨折、歩行不安定性、死亡率への影響が強調されている[4]。高齢の患者では、腎機能の変化、体組成、視床下部-下垂体の喉の渇きの調節、バソプレシン分泌の変化などの多因子メカニズムのために、水のホメオスタシスの調節が変化することがある [4]。これらの変化のいくつかの結果は、恒常性非弾性 [6]、すなわち、水分バランスを調整する能力が制限され、脱水および高オスモラリティにつながる [4,7,8] などのように現れる可能性がある。この欠陥は、刺激が知覚される高次皮質中枢に感覚入力を伝達し、そこから反応が発せられる正常な神経経路の喪失の結果である可能性がある[4,9]。水の恒常性の異常は、近年の水分子分子仮説[10]に従い、神経細胞の機能不全、脳の萎縮、慢性脳血管症、アルツハイマー病の初期症状であると考えている。このような仮定のもと、本研究では、認知機能障害、行動障害、血清計算オスモラリティの低下との関係を評価し、研究することを目的としている。
2. 材料と方法
本研究は、ヘルシンキ宣言、良好な臨床実践のためのガイドライン、および疫学における観察研究の報告を強化するためのガイドラインに従って実施され、人体実験に関する現地の倫理委員会(Prot.No. 3877/DS)によって承認された。本研究は観察研究であり、参加者への介入の割り当て、その効果評価、健康関連の生物医学的または行動学的アウトカムは考慮されていない。本研究では、健康な参加者を対照被験者として募集した。
2.1. 研究サンプル
2015年1月から 2017年3月にかけて、Istituto di Ricovero e Cura a Carattere Scientifico(IRCCS)「Casa Sollievo della Sofferenza」の老年科複合ユニットの認知機能障害評価ユニットに通院していた高齢者被験者を対象に、研究登録の可能性をスクリーニングした。入院後、これらの被験者は外来患者として受診した。対照群の患者は老年病棟で募集され、臨床的、認知的、情動的、機能的評価により認知障害がないと分類された。研究のための書面によるインフォームドコンセントを各患者、または親族もしくは法定後見人から得た。被験者はすべて白人で、ユダヤ系、東欧系、北アフリカ系の人はおらず、ほとんどの人が南イタリアの祖先を持ち、少なくとも3世代以上南イタリアに住んでいた。
除外基準は以下の通りである。(1)年齢65歳以上、(2)主観的認知機能低下イニシアチブ(SCD-I)ワーキンググループ[10]による主観的認知機能障害(SCI)の診断、(3)DSM5[11]基準による晩期うつ病(LLD)の診断。4)国立加齢医学研究所(NIAAA)基準による軽度認知障害(MCI)の診断[12];(5)NIAAA基準によるアルツハイマー病の診断[13]。(6) レビー小体型認知症(Dementia with Lewy bodies)DLB共同事業[14]の基準によるレビー小体型認知症(LBD)の診断、(7) 国立神経疾患・脳卒中研究所(National Institute of Neurological Disorders and Stroke-Association Internationale pour la Recherche et l’Enseignement en Neurosciences (NINDS-AIREN)[15]の作業部会の基準による血管性認知症(血管性認知症)の診断。(8) インフォームド・コンセントを提供できること、または重度の痴呆患者の場合は親族または法定後見人がいること。除外基準は以下の通りであった。(1)混合型認知症(MxD)の診断;(2)認知障害と因果関係のある重篤な併存疾患、腫瘍、その他の疾患または生理的状態(確認された血液感染症、ビタミンB12欠乏症、貧血、甲状腺、腎臓、または肝臓の障害)の存在;(3)アルコールまたは薬物乱用の既往歴、頭部外傷、および記憶障害を引き起こす可能性のあるその他の原因の存在。
対照群には、同じセンターで連続して評価された認知障害やうつ病症状のない高齢の患者を含めた。
2.2. 臨床的、認知的、感情的、機能的評価
患者の医学的状態は、構造化された面接、臨床評価、および患者の開業医からの記録のレビューによって収集された。
すべての患者の認知状態は、介護者との簡単な面接の後、Mini-Mental State Examination (MMSE) [16]とClinical Dementia Rating Scale (CDR) [17]によって定義された。認知症の診断は、常に神経画像診断(コンピュータ断層撮影や核磁気共鳴)によって裏付けられていた。不明瞭なアルツハイマー病/血管性認知症診断に対処するために、Hachinski Ischemic Score(HIS)に基づいたアルツハイマー病と血管性認知症の鑑別診断も実施された [18]。特に、4以下のスコアはアルツハイマー病の可能性が高いと考えられ、7以上のスコアは血管性認知症群に含まれていた。スコア5~6は混合型認知症(MxD)と診断され、本研究からは除外された。
情緒的状態は、Hamilton Depression Rating Scale (HDRS-21) [19]の21項目版を用いて評価した。LLDの診断はDSM 5基準に従って行った。
すべての患者において、日常生活活動(日常生活動作)[20]および日常生活機器活動(手段的日常生活動作(I日常生活動作))[21]スケールを用いて機能状態を評価し、Mini Nutritional Assessment(MNA)[22]を用いて栄養状態を調査し、Exton-Smith Scale(ESS)[23]を用いて圧痛発症のリスクを評価し、Cumulative Illness Rating Scale Comorbidity Index(CIRS-CI)[24]を用いて併存症を調査した。
2.3. 血清オスモラリティの値の定量化
血清浸透圧は、高齢者の水分補給状態の正確な指標である。血清浸透圧の間接的な推定値を算出するために、グルコース、尿素、電解質濃度[ナトリウム(Na+カリウム(K+塩化物(Cl-)]を用いている。血清オスモラリティの信頼性の高い指標を得るために、Khajuria and Krahn [25]が開発した血清オスモラリティ算出式[1.86 (Na+ + K+) + (1.15 ×グルコース) + 尿素 + 14]を用いた(全成分をmmol/Lで測定)。我々が採用した式は、糖尿病の有無にかかわらず、虚弱高齢者において精度が示されている[26]。参加者は、(1)正常に水分補給されている(計算された血清浸透圧275~295mmol/kg(2)脱水が差し迫っている(計算された血清浸透圧295~300mmol/kgまたは(3)現在の脱水がある(計算された血清浸透圧300mmol/kg)に分類された。腎機能は CKD-EPI の式で算出した:推定糸球体濾過率(eGFR)=141×min(Scr/κ,1)α×max(Scr/κ,1)-1.209×0.993Age×1. 018(女性の場合)×1.159(黒人の場合)[27]、ここでScrは血清クレアチニン(mg/dLκは女性0.7,男性0.9,αは女性-0.329,男性-0.411,minは女性-0.329,男性-0.9を示す。 411,minはScr/κまたは1の最小値、maxはScr/κまたは1の最大値を示す[28]。eGFRステージは、>90(健康な腎臓又は腎臓障害でeGFRが正常又は高い60~89(腎臓障害でeGFRが軽度に低下30~59(eGFRが中等度に低下15~29(eGFRが重度に低下<15mL/min/1.73m2(腎不全)と定義した[28]。
2.4. 統計解析
二項変数については、グループ間の差に関する仮説は、フィッシャーの厳密検定を用いて検定された。この分析は、2-Way 分割表分析を用いて行われた。連続変数については、Shapiro-Wilk 正規性検定および1標本Kolgomorov-Smirnov 検定によって正規分布が検証された。正規分布変数については、グループ間の差に関する仮説が、Welch 2標本のt検定または一般線形モデルを用いた分散分析(ANOVA)によって比較された。非正規分布変数については、群間の差に関する仮説が、連続性補正を用いたWilcoxon順位和検定またはKruskal-Wallis順位和検定によって比較された。リスク(年齢で調整した)は、オッズ比(OR)とその95%信頼区間(CI)として報告されている。すべての統計解析は、R Ver.2.8.1統計ソフトウェアパッケージ(The R Project for Statistical Computing; URL www.r-project.org/)を用いて行った。p値がタイプIの誤差率α=0.05よりも小さい検定を有意とした。
3.1.2統計ソフトウェアパッケージ(Rプロジェクト。
3. 結果
登録期間中に、1135人の高齢患者が研究に含めるためにスクリーニングされた。このうち、9人の患者は65歳未満のために除外され、12人の患者は検査が不完全であり、23人の患者はMxDを有していた。したがって、最終的な母集団は、男性542人(49.70%女性549人(50.3%)の1091人の患者で、平均年齢は78.80±6.72歳、年齢は65歳から97歳までであった。したがって、対照群には520名(男性326名、女性194名、平均年齢77.64±6.60歳、65~95歳の範囲)の患者が含まれ、対照群には571名(男性216名、女性355名、平均年齢79.94±6.67歳、65~97歳の範囲)の患者が認知機能の低下および/または抑うつ気分(CD-DM)を有していた。対照群とCD-DM患者の人口統計学的および臨床的特徴を表1にまとめた。CD-DM患者は対照群と比較して、男性である可能性が低く(37.80%対62.70%、p<0.001高齢である可能性が高く(79.94対77.64歳、p<0.001明らかに有意な認知機能障害を有し(MMSE:18.00対29.00,p<0.001抑うつ気分の存在(HDRS-21:10.96対2.48,p<0.001)を示していた。CD-DM患者は、対照群の個人と比較して、日常生活動作(4.14 vs. 6.00,p<0.001手段的日常生活動作(I日常生活動作)(3.31 vs. 8.00,p<0.001MNA(23.02 vs. 24.26,p<0.001ESS(17.32 vs. 19.32,p<0.001)に大きな障害を示した。両群では、CIRSスコア(p=0.241またはグルコース(p=0.903尿素(p=0.571およびScr(p=0.107)の値に差はなかった。CD-DM患者では、電解質濃度(Na+:141.00 vs. 140.28 mmol/L、p<0.001;K+:4.52 vs. 4.27 mmol/L、p<0.001;Cl-:105.04 vs. 103.73 mmol/L、p<0.001脱水症状のリスクが高かった。 001脱水のリスク(浸透圧:298.44 vs. 296.53 mmol/kg、p<0.001および腎臓障害のレベル(eGFR平均スコア:69.64 vs. 72.21 mL/min/1.73 m2,p=0.021)は対照群よりも高かった。
表1 対照群および認知機能低下および/または抑うつ気分(CD-DM)を有する患者の人口統計学的および臨床的特徴。
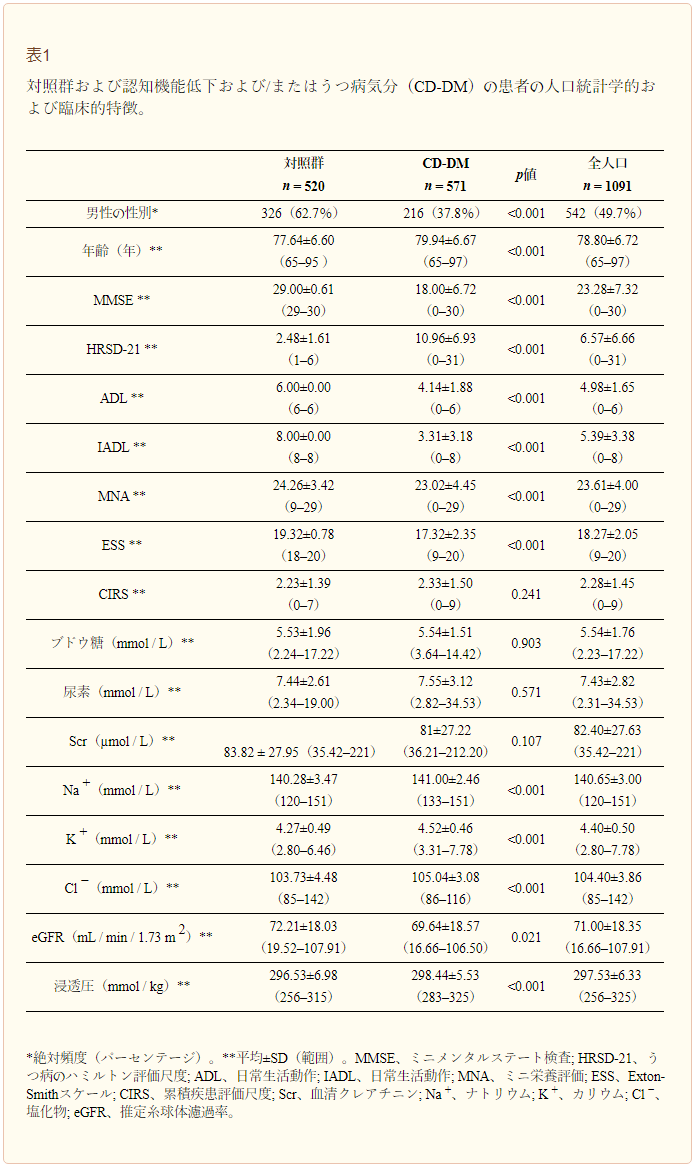
表2で説明したように、CD-DMに罹患した患者を6つのグループに分けた。(1)SCI 27名、(2)LLDと認知機能障害125名、(3)MCI 78名、(4)アルツハイマー病 122名、(5)血管性認知症 203名、(6)LBD 16名である。
表2 認知機能低下および/または抑うつ気分(CD-DM)を有する患者の臨床的特徴
MCI患者には、他の群に比べて男性(SCI:40.70% vs.認知障害を伴うLLD:20.00% vs.MCI:53.80% vs.アルツハイマー病:42.60% vs.血管性認知症:39.00% vs.LBD:43.80%)が多く含まれていた。アルツハイマー病、血管性認知症、LBDの患者には、高齢者が多く含まれていた(SCI:77.33 vs.認知機能障害のあるLLD。MMSE平均スコアに基づく認知機能障害が高く(SCI:27.64対認知機能障害を有するLLD:19.92対MCI:19.92MMSE平均スコアに基づく認知機能障害が高かった(SCI:27.64対認知機能障害を有するLLD:19.92対MCI:19.92)。19.92対MCI:25.14対アルツハイマー病:13.99対血管性認知症:15.24対LBD:17.72日常生活動作に基づく機能障害が高かった(SCI:6.00対認知障害のあるLLD。4.45 vs. MCI:6.00 vs. アルツハイマー病:3.57 vs. 血管性認知症:3.36 vs. LBD:3.56手段的日常生活動作(I日常生活動作)平均点(SCI:8.00 vs. LLD with cognitive impairment. 3.82 vs. MCI:8.00 vs. アルツハイマー病:1.60 vs. 血管性認知症:1.71 vs. LBD:2.06MNA平均スコアに基づく栄養失調のリスクが高かった(SCI:27.03 vs. LLD with cognitive impairment:23.26 vs. MCI:26.26)。 26 vs. MCI:26.00 vs. アルツハイマー病:21.96 vs. 血管性認知症:21.90 vs. LBD:22.63ESS平均スコアに基づく圧痛発症リスクがあった(SCI:19.00 vs. LLD with Cognitive Impairment. 17.66対MCI:18.88対アルツハイマー病:17.21対血管性認知症:16.32対LBD:17.63)が他の群に比べて多かった。
LLDと認知機能障害を有する患者は、HRSD-21評価の平均スコアが高かった(SCI:3.30 vs. LLDで認知機能障害を有する患者。14.66対MCI:4.91対アルツハイマー病:10.11対血管性認知症:13.09対LBD:12.23)が他の群に比べて高かった。
血管性認知症患者はCIRS平均スコアに基づく併存疾患が多かった(SCI:2.00 vs.認知障害を伴うLLD:2.42 vs.MCI:1.92 vs.アルツハイマー病:1.95 vs.血管性認知症:2.72 vs.LBD:2.13)。
アルツハイマー病と血管性認知症患者はグルコースの平均スコアが高かった(SCI:5.30 vs.認知障害を伴うLLD。5.30 vs. MCI:5.30 vs. アルツハイマー病:5.50 vs. 血管性認知症:5.80 vs. LBD:4.60Scr(SCI:73.50 vs. LLD with cognitive impairment. 75.60 vs. MCI:79.50 vs. アルツハイマー病:79.30 vs. 血管性認知症:87.90 vs. LBD:71.3)の内容である。アルツハイマー病またはLLDの認知障害患者では、Na+濃度が高かった(SCI:140.70 vs. LLDの認知障害。141.38対MCI:140.68対アルツハイマー病:141.80対血管性認知症:140.42対LBD:141.19)。)
LLDと認知障害のある患者と血管性認知症の患者では尿素の平均値が高かった(SCI:7.10 vs. LLDで認知障害のある患者。7.40 vs.MCI:7.00 vs.アルツハイマー病:6.80 vs.血管性認知症:8.20 vs.LBD:6.60K+(SCI:4.49 vs.認知障害のあるLLD。4.51 vs. MCI:4.44 vs. アルツハイマー病:4.45 vs. 血管性認知症:4.60 vs. LBD:4.24)のスコアが他の群に比べて高かった。
SCI患者はCl-平均スコアが高かった(SCI:105.30 vs.認知機能障害のあるLLD。104.66対MCI:105.00対アルツハイマー病:105.24対血管性認知症:105.02対LBD:105.06)が他の群に比べて高かった。
最後に、血管性認知症、アルツハイマー病、LLDの認知障害患者は、eGFRスコアに基づく腎障害のリスクが高かった(SCI:76.21 vs.認知障害のあるLLD。72.39対MCI:73.17対アルツハイマー病:71.82対血管性認知症:63.84対LBD:76.92)に加えて、他の群と比較して脱水症リスクが高かった(SCI:297.23対認知障害のあるLLD:298.77対MCI:297.00対アルツハイマー病:299.23対血管性認知症:298.63対LBD:296.36)。
図1に示すように、アルツハイマー病患者で算出された浸透圧の値は、対照群とMCI患者を比較して有意な差が認められ、アルツハイマー病患者では現在の脱水の大きなリスクが認められた(p≦0.001)。
図1 対照群、軽度認知障害(MCI)およびアルツハイマー病患者のオスモラリティ平均値の分布
表3に示すように、脱水はアルツハイマー病や血管性認知症のような認知症状態を発症するリスクと関連していた(OR=2.016,p<0.001)
表3 対照群とアルツハイマー病および血管性認知症(血管性認知症)患者における脱水リスクのロジスティック回帰分析

図2a,bに示すように、脱水症の存在は、図2cに示すように、日常生活動作(p≦0.001)および手段的日常生活動作(I日常生活動作)(p≦0.001)スコアと関連していたが、ESS(p=0.54)と独立して関連していた。さらに、脱水症リスクは、図2d,eに示すように、それぞれ年齢(r2 = 0.0046,p = 0.77MNA(r2 = 0.0004,p = 0.48)と独立して関連していた。
図2
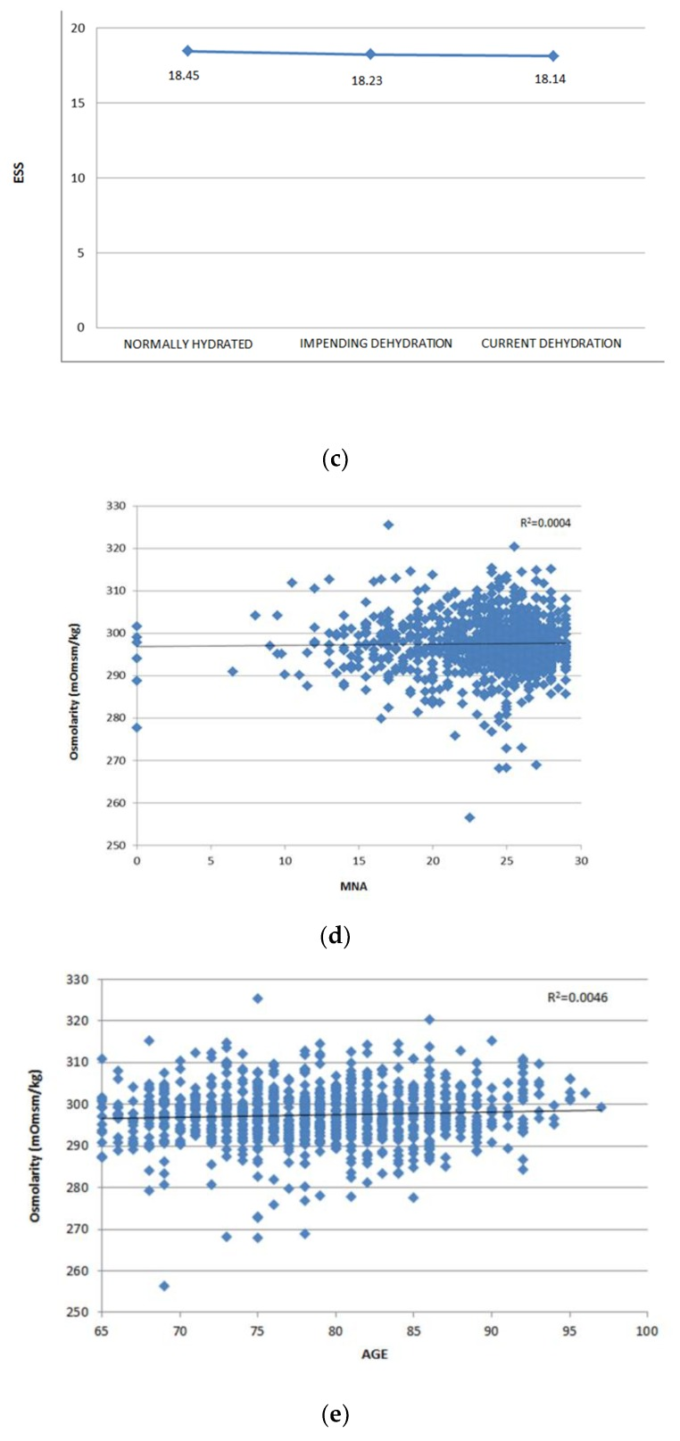
(a)日常生活活動(日常生活動作)スコアに従った脱水リスクの多変量解析;(b)器物的日常生活活動(手段的日常生活動作(I日常生活動作))スコアに従った脱水リスクの多変量解析。(c) Exton-Smith Scale(ESS)スコアに従った脱水リスクの多変量解析;(d) 患者の年齢に従った脱水リスクの線形回帰モデル;(e) Mini Nutritional Assessment(MNA)スコアに従った脱水リスクの線形回帰モデル。
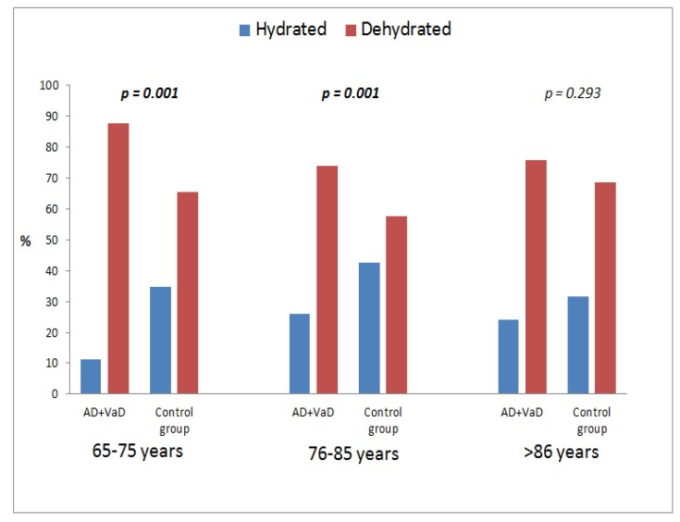
図3では、患者の年齢範囲を用いて、認知症(アルツハイマー病と血管性認知症)の若い患者(65~75歳と76~85歳)は、認知症のない患者(65~75歳、p=0.001,76~85歳、p=0.001,≧86歳、p=0.293)に比べて、有意に脱水症状が多いことが示された。
図3 認知症(アルツハイマー病・血管性認知症)患者と対照群の脱水リスクと年齢別の分布について
4. 議論の内容
脱水は、高齢者において最も一般的な体液および電解質の不均衡であることが報告されている[29,30,31]。最近の臨床研究では、水分補給状態が認知パフォーマンス、特に視覚的注意力と気分に影響を与えることが示されている[32]。細胞外浸透圧の変化は必然的に細胞内環境に影響を与え、不可逆的な形態学的・機能的損傷を引き起こす細胞機構の体積と機能に重要な変化をもたらする。このように、これらの変化は加齢に伴う神経血管障害の主な要因となりうるものであり、現在、潜在的な治療標的として研究が進められている。低水和による慢性的な循環血液量減少は、おそらく肥満、糖尿病、高血圧、さらにはアルツハイマー病の発症の背後にある主要なメカニズムの1つであるという仮説が立てられている[33,34,35,36]。脱水症に苦しむ入院中の高齢者は、死亡率が45~46%と高いことが報告されているが [31,37,38]、高齢患者における水分摂取および排泄に関する研究はわずかしか存在しない。障害、視覚障害、会話能力、失禁および摂取回数は、水分摂取量の減少の危険因子として考えられるが、このテーマで得られた結果は少なく、矛盾している [39,40,41,42,43]。心血管疾患の治療に使用される薬剤の大部分は、レニン-アンジオテンシン-アルドステロン系をブロックするが、この系は循環血液量減少によって生理的に活性化される[42]。最も重要なことに、脱水は入院している高齢者の死亡率の増加と関連している[2]。脱水のこの「仮説」は、総体水分が加齢とともに減少することを示す研究[44]および体格指数[37]の上昇とともに減少することを示す研究によってさらに支持されており、したがって、高齢および/または肥満および/または糖尿病患者は慢性的に脱水状態にある可能性があることを示唆している。また、全身の脱水に起因する循環血液量減少症は、細胞代謝に重要な悪影響を及ぼす[45,46]が、脳の容積を減少させ[47,48]、脳微小循環の障害を引き起こし、シナプスの形態を変化させ、シナプスとグリアの活性化の進行性の損失を引き起こす可能性がある。我々の研究では、MCI、血管性認知症、アルツハイマー病患者において、計算された血清浸透圧の障害を示している。結果から明らかなように、このデータは機能的・栄養状態の結果ではない。さらに、今回の研究では、認知症の若い患者(65~75歳と76~85歳)(アルツハイマー病と血管性認知症)は、認知症のない患者に比べて有意に脱水状態が高かった。
我々の転帰と一致して、CD-DMを有するすべての患者群は、年齢範囲で分析した場合でも、対照群と比較して脱水の有病率の増加を示した。特に、アルツハイマー病患者とMCI患者を比較した場合(これらの患者は将来アルツハイマー病を発症する可能性があることを考慮して大きな血清高オスモラリティリスクが観察された。さらに、アルツハイマー病患者と血管性認知症患者では、脱水に伴うより重度の認知障害が観察された。中枢神経系は、高度に親油性の器官であるにもかかわらず、80%の水分で構成されており、主にアストロサイトに貯蔵されているが、このアストロサイトは、おそらく水分を保持するために、そのエンドフィートプロセス上のAQP-4タンパク質のアップレギュレーションによって末梢性脱水に反応する[48]。水分子仮説は、微小循環の欠陥である低間質液量の存在下でのタンパク質のミスフォールディングと凝集に起因するものとして、高齢患者における脱水と認知機能障害の関係を説明しようとしている。欠損したタンパク質は、脳の生体分子メカニズムの情報量に障害を与え、結果として神経細胞やシナプスの損傷をもたらす。我々の結論は、議論されたトピックの生物学と生理学を深め、体液バランスの障害を評価し、治療することの重要性を検討することを示唆している。今回の結果を踏まえて、脱水が認知症の発症の原因であるかどうかを明確に定義するためには、さらなる研究が必要である。
