Contents
NAD+ Metabolism and Regulation: Lessons From Yeast
www.mdpi.com/2218-273X/10/2/330/htm
要旨
ニコチンアミド・アデニン・ジヌクレオチド(NAD+)は、様々な細胞内プロセスに関与する必須代謝物である。細胞内のNAD+プールは3つの生合成経路によって維持されており、細菌からヒトに至るまで大部分が保存されている。NAD+代謝は、糖尿病、癌、神経細胞変性症などの疾患の治療標的として注目されている。
NAD+代謝はダイナミックで複雑な性質を持っているため、NAD+の恒常性を制御する因子は、これまで不完全に理解されていた。近年、遺伝的に扱いやすい出芽酵母サッカロミセス・セレビシエを用いた研究により、新規なNAD+ホメオスタシス因子が同定された。これらの知見は、NAD+およびNAD+ホメオスタシス因子が細胞機能の維持・制御にどのように寄与しているかについての分子基盤を提供するものである。
ここでは、主要なNAD+生合成経路、NAD+ホメオスタシスと密接に関連し貢献している選択された細胞プロセス、栄養感知シグナル伝達経路によるNAD+代謝の制御についてまとめている。また、ヒト疾患におけるNAD+ホメオスタシス因子の意味合いも含めて議論を展開する。
NAD+前駆体と関連する細胞経路の相互調節と相互接続を理解することは、NAD+ホメオスタシスの複雑な調節のメカニズムを解明するのに役立つであろう。また、これらの研究は、さまざまなタイプのNAD+欠乏症に関連する疾患に特化した効果的なNAD+ベースの治療戦略の開発にも貢献する可能性がある。
1. 序論
NAD+、NADP+、および還元等価物であるNADHとNADPHは、多くの細胞内酵素反応に不可欠な酸化還元因子である。NADHはまた、サーチュイン(Sir2ファミリー蛋白質)を介した蛋白質の脱アセチル化やADPリボシル化などの蛋白質修飾において、共同基質としての役割も果たしている。これらの修飾されたタンパク質は、Ca2+シグナル伝達、クロマチン構造、DNA修復、概日リズム、代謝応答、寿命の調節に寄与している [1,2,3,4,5]。糖尿病、癌、神経細胞の変性など、いくつかのヒト疾患がNAD+代謝異常と関連している [2,3,5,6,7,8,9,10,11,12]。ニコチンアミド(NAM)、ニコチンアミドモノヌクレオチド(NMN)、ニコチン酸リボシド(NaR)、およびニコチンアミドリボシド(NR)などのNAD+前駆体の投与は、ヒト細胞を含む様々なモデル系において、NAD+レベルを上昇させ、関連する欠乏を改善することが示されている[3,5,6,7,8,9,10,11,13,14,15,16]。
ニコチン酸(NA)(ナイアシン、ビタミンB3)は、1900年代初頭にGoldbergerとElvehjemによって開拓された研究で「ペラグラ予防因子」として最初に同定された[17,18,19]。その後、NAはNAD+の生合成に関与していることが判明した[20,21]。HardenとYoungは、1906年に酵母ジュースの無細胞発酵におけるNAD+の存在を最初に記述した[22,23]。その後、von EulerとWarburgはNAD+とNADP+の純粋な画分を単離し、これらの分子の化学的性質を解明するために使用した[24,25,26]。
何十年にもわたって研究者たちは、NAD+とNAD+前駆体の恒常性の調節に寄与するシグナル伝達経路と細胞プロセスを解明してきたが、NAD+代謝の調節とNAD+前駆体治療の基礎となる分子機構はまだ完全には解明されていない。NAD+ホメオスタシスの研究は、細胞がNAD+を生成するために使用する前駆体の動的な柔軟性によってさらに複雑になっている。
例えば、NAMはNAD+前駆体であると同時に、サーチュインなどのNAD+依存性酵素の阻害剤でもある[27,28]。したがって、NAMは、適切なNAD+恒常性およびサーチュイン活性に依存する経路を介して細胞機能を調節することができる[29,30]。疾患におけるNAD+、サーチュイン、およびその下流の標的の正確な役割は不明のままである。出芽酵母サッカロミセス・セレビシエにおけるNAD+ホメオスタシスの調節に寄与する因子を研究することは、疾患におけるNAD+の役割についての解明に役立つかもしれない。
NAD+生合成は、酵母と脊椎動物の間で高度に保存されている。酵母細胞は常に小さなNAD+前駆体を放出したり回収したりするという性質を利用して [31,32,33]、NAD+の恒常性を調節する遺伝子を同定し、研究するための遺伝学的ツールが開発されてきた。酵母では、NAD+経路の構成要素の単一または複数の欠失を有する変異体や、特定の経路をピンポイントで特定する特別に定義された成長条件は、比較的容易に入手できる。
NAD+前駆体特異的遺伝子スクリーニングを用いた最近の研究では、いくつかのNAD+ホメオスタシス因子が明らかにされている[31,34,35,36]。NAD+生合成経路と細胞内プロセスが相互に関連していることを考えると、細胞内NAD+代謝の制御を解明するためには、さらなるNAD+ホメオスタシス因子の同定と研究が必要である。
2. NAD+生合成経路
酵母とヒトのNAD+生合成は、3つの経路によって維持されている:de novo合成、NAM/NAサルベージ、およびNRサルベージ(図1)。これらの経路によって維持されるNAD+レベルは、いくつかの異なるポイントで収束し、リボース、AMP、リン酸塩、ギ酸塩、アラニンおよびグルタミン酸の総プールに追加しながら、ATP、ホスホリボシルピロリン酸(PRPP)、およびグルタミンの細胞プールを消費する。これらの分子の中には、他の生合成経路に寄与したり、シグナル伝達機能を持つものもある。
したがって、細胞はこれらの代謝物とそのフラックスを制御された方法で維持しなければならない。我々は、細胞がこれらの代謝物を感知し、調整することができるすべてのメカニズムを完全に理解しているわけではないが、いくつかの既知のNAD+恒常性調節メカニズムには、転写制御、フィードバック阻害、栄養感知、および酵素または代謝物のコンパートメント化が含まれる[1,31,34,35,37,38,39,40,41,42]。
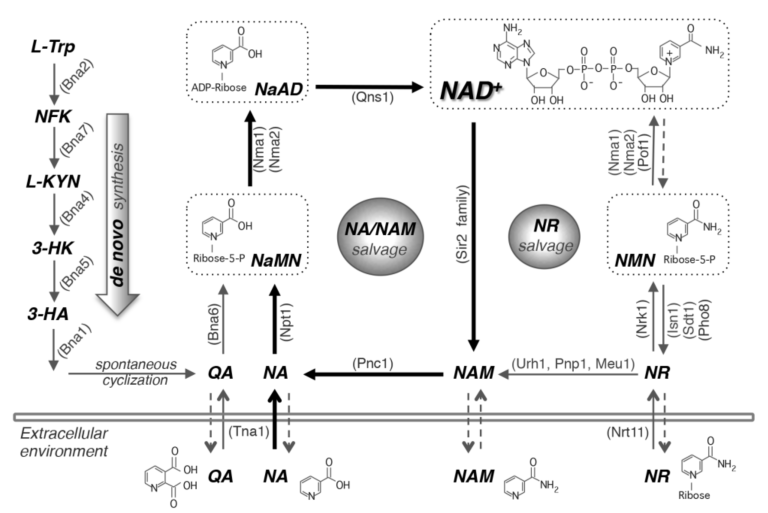
図1. NAD+生合成経路。酵母細胞では、NA、NAM、NRなどの前駆体をサルベージすることによって、またはトリプトファンからのデノボ合成によってNAD+を作ることができる。酵母細胞はまた、これらの前駆体を放出し、再取り込みする。de novo NAD+合成(左パネル)はBnaタンパク質(Bna2,7,4,5,1)によって媒介され、NaMNの産生をもたらする。この経路は、NAD+が豊富な場合には不活性である。
NA/NAMサルベージ経路(中央のパネル)もまた、NaMNを産生し、それはそれぞれNma1/2とQns1によってNaADとNAD+に変換される。NRサルベージ(右パネル)はUrh1、Pnp1、Meu1によってNA/NAMサルベージ経路に接続している。このモデルでは、酵母の生育培地には多くのNAが含まれているため、NA/NAMサルベージを中心としたモデルとなっている。細胞はまた、NaRをNAまたはNaMNに変換することにより、NaRをサルベージすることができる。
簡単にするために、この図ではNaRサルベージは示されていない。破線の矢印は、これらの経路のメカニズムが不明なままであることを示している。
NA、ニコチン酸。NAM、ニコチンアミド。NR、ニコチンアミドリボシド。NaR、ニコチン酸リボシド。QA、キノリン酸。L-TRP、L-トリプトファン。NFK、N-ホルミルキヌレニン。L-KYN、L-キヌレニン。3-HK、3-ヒドロキシキヌレニン。3-HA、3-ヒドロキシアントラニル酸。NaMN、ニコチン酸モノヌクレオチド。NaAD、デアミド-NAD+。NMN、ニコチンアミドモノヌクレオチド。タンパク質名の略称は( )内に示す。Bna2、トリプトファン2,3-ジオキシゲナーゼ。Bna7、キヌレニンフォルマミダーゼ。Bna4、キヌレニン3-モノオキシゲナーゼ。Bna5、キヌレニン分解酵素。Bna1、3-ヒドロキシアントラニル酸3,4-ジオキシゲナーゼ。Bna6、キノリン酸ホスホリボシルトランスフェラーゼ。Nma1/2、NaMN/MNアデニル転移酵素。Qns1、グルタミン依存性NAD+合成酵素。Npt1、ニコチン酸ホスホリボシルトランスフェラーゼ。Pnc1、ニコチンアミドデアミダーゼ。Sir2ファミリー、NAD+依存性タンパク質脱アセチル化酵素。Urh1, Pnp1, Meu1, ヌクレオシダーゼ。Nrk1、NRキナーゼ。Isn1、Sdt1、ヌクレオチダーゼ。Pho8、Pho5、ホスファターゼ。Pof1、NMNアデニルトランスフェラーゼ。Tna1, NA, QAトランスポーター。Nrt1、NRトランスポーター。
NAD+代謝へのトリプトファンの寄与を示す最も初期の徴候は、1945年にElvehjemが低NAのトウモロコシ飼料を与えたラットにトリプトファンを補給し、NAのレベルの増加を示したときであった[43]。デノボ経路(別名キヌレニン経路として知られている)は、トリプトファンからNAD+を合成し(図1)、最も細胞資源を費やし、おそらく最も好まれない経路である。
この経路は、Bnaタンパク質(Bna2、Bna7、Bna4、Bna5、Bna1)による5つの酵素反応と自発的な環化反応(図1)によってトリプトファンからキノリン酸(QA)が合成されることを特徴とする(44)[44]。Bna6はその後、PRPPのホスホリボース部位をQAに移し、これによりニコチン酸モノヌクレオチド(NaMN)が生成され、これもNA/NAMサルベージ経路で生成される。
二重特異性NaMN/NMNアデニルトランスフェラーゼ(Nmnats)、酵母におけるNma1およびNma2は、ATPのAMP部位の付加によるNaMNのニコチン酸アデニンジヌクレオチド(NaAD)への変換を担っている[45,46]。NaAD の NAD+ へのアミド化はその後、グルタミン依存性 NAD+ 合成酵素 Qns1 によって行われる [47]。
de novo経路のいくつかのステップは、基質として分子状酸素を必要とする(Bna2、Bna4、およびBna1)[44]。したがって、嫌気性条件下で増殖した細胞は、NAD+合成のためにサルベージ経路に依存する。NAD+が豊富な場合、de novo特異的経路の遺伝子(BNA遺伝子)は、サーチュインHst1によってサイレンシングされる[37]。Hst1の活性はNAD+に依存しているため、NAD+の枯渇はde novo経路の転写活性化につながる。最近の研究では、銅を感知する転写因子Mac1がHst1と協働してBNA遺伝子を抑制するように見えることが示された[34]。
1958年までにPreissとHandlerはNAから始まるNAD+合成ステップの経路を同定しており、この経路は主にPreiss-Handler経路と呼ばれている[48,49]。ヒトとは異なり、酵母ではこの経路には NAM のサルベージも含まれており、ここでは NA/NAM サルベージ経路と呼ぶことにする(図 1)。NA/NAMサルベージ経路は、酵母において前駆体NAとNAMからNAD+を生成する。
ほとんどの酵母増殖培地を記述するNA豊富な条件の下では、NA/NAMサルベージは好ましいNAD+生合成経路であり、細胞に十分なNAD+、高いHst1活性、およびBNA(de novo経路)遺伝子の抑制を提供する[34,37,50]。ヒトでは、NAMはNAMホスホリボシルトランスフェラーゼ(Nampt)によってNMNに変換され、その後、1956年にPreissとHandlerによって初めて同定されたNRサルベージ分岐によってNAD+に変換される[51]。
NAMは、サーチュイン媒介のタンパク質脱アセチル化を含む多くのNAD+消費反応から産生され、これらの反応の阻害剤でもある[28,52,53,54]。出芽酵母に見られるニコチンアミダーゼであるPnc1は、NAMのアミド基を加水分解してNAを産生する [55]。PNC1を欠失させると、NAMの濃度が上昇し、サーチュイン活性が阻害される[39,40]。de novo経路のBna6と同様に、Npt1はPRPPのホスホリボース部位をNAに移動させることでNaMNを産生する。NA/NAM サルベージ経路と de novo 経路からの NAD+ 生合成は NaMN の形成に収束する(図 1)。
Kornberg と Rowen は 1951 年に NAD+ 生合成の前駆体として NR を初めて同定した [56]。いくつかの研究 [57,58,59] を除いて、2004 年に Brenner のグループが酵母とヒトで NR キナーゼによる NMN への NR リン酸化を実証するまでは、NR 媒介の NAD+ 生合成はほとんど注目されていなかった [60]。前述したように、ヒトではNamptもまた、酵母にはない酵素であるNAMをNMNに変換している。
NRサルベージは、3つの経路の中で最も低コストであると考えられ、PRPPを必要としない(図1)。しかし、NRはNAMに変換することもできる。酵母では、これはヌクレオシダーゼUrh1およびPnp1によって達成され、NRをNA/NAMサルベージにリダイレクトする[16,61]。NRはNRキナーゼであるNrk1によってリン酸化され、NMNを産生する [60]。Nmnats(酵母ではNma1、Nma2およびPof1)は、ATPのAMP部位の付加によるNMNのNAD+への変換を担当している[36,45,46]。酵母では、NRサルベージ分岐は他の2つの経路にはない柔軟性を持っており、これはこの経路における酵素と前駆体のコンパートメント化によるものである。
例えば、液胞はNAD+中間体前駆体、特にNRとNMNの貯蔵に重要な役割を果たしている[35]。また、平衡化トランスポーターであるFun26は、液胞内と液胞外のNRの輸送を仲介している。Pho8は広い特異性を持つ液胞酸ホスファターゼであり、NMNからNRへの変換を仲介している。また、細胞質ヌクレオチダーゼSdt1とIsn1はNMNをNRに変換している[62]。さらに、酵母細胞は、NA、NAM、QAおよびNRのような小さなNAD+前駆体を放出し、再取り込みする(図1)[31,36,63]。
NAD+前駆体の取り込みには、特異的なトランスポーターTna1(NAとQAの場合)[33,63]とNrt1(NRの場合)[64]が関与しているが、前駆体放出のメカニズムは明らかになっていない。このように、NAD+生合成の3つの分岐は調整されており、細胞の要求や環境条件に合わせて調整されたNAD+を細胞に供給している。
3. 酸化還元反応におけるNAD+とその誘導体
NAD(P)+とNAD(P)Hは、酸化還元反応に普遍的に関与する補酵素として長い間認識されてきた [24,25,26]。NAD(P)+は基質からNAD(P)+をNAD(P)Hに還元する基質からNAM環の4位に水素化物イオンの形で2つの電子を受け取り、プロトンを放出する[65]。様々な分子の酸化をNAD(P)+の還元に結合させることで、細胞はNAD(P)HのNAM環に高エネルギー電子の形で一時的にエネルギーを蓄える。NAD(P)Hの電子配置は不利であり、NAD(P)HのNAD(P)+への酸化は容易に可逆的である。
NADP+はAMP部位の2位にリン酸基を追加しており[66]、これにより酵素はNADP+とNAD+を区別することができる。還元されたNAD(P)+と酸化されたNAD(P)+の化学量論的な濃度は、細胞が2つの異なる方向への電子の流れをサポートすることを可能にする。NAD+とNADHの酸化還元が支配的な役割を果たしている異化経路では、細胞は、より小さなビルディングブロックとエネルギーを生成するために、より大きな分子を分解する。
高エネルギー電子はNADHの形で一時的に貯蔵され、呼吸を介してATPを作るために電子輸送チェーンに寄付されることができる[67,68]。一方、NADP+は、細胞の形成を助ける分子の還元的生合成や活性酸素からの保護に重要である。コーンバーグは1950年にNAD+キナーゼによってNADP(H)からNADP(H)が生成されることを初めて示した[69]。
酵母には、NADP+を産生するNAD+基質を好む2つの細胞質NAD+キナーゼ[70]と、NADPHを産生するNADH基質を好むミトコンドリアNAD+キナーゼ[71]が存在する。NADPHは、トリアシルグリセロール、リン脂質、ステロイド、アミノ酸、ヌクレオチドの生成に必要である[72]。NADPHは抗酸化防御システムにも必要である。例えば、グルタチオンおよびチオレドキシン還元酵素による不活性なグルタチオンおよびチオレドキシンの活性型への直接還元に関与している[73,74,75]。
4. NAD+とNADHの酸化還元状態のバランスをとる
細胞の酸化還元状態と、この状態のバランスをとるために細胞が使用するシステムは、主に細胞の成長条件に依存する。たとえば、好気的に成長した細胞は、酸素へのアクセス権を持っており、電子輸送チェーンに電子を提供することにより、NADHのバランスをとることができる。嫌気的に成長した細胞は、唯一の基質レベルのリン酸化によってATPを生成し、NAD+/NADH比のバランスをとるために発酵のような他のシステムに依存している。
さらに、NAD+とNADHの異なるプール(細胞質とオルガネラ)が存在するため、酸化還元等価物は、シャトルシステムの使用によって細胞の様々なコンパートメントから行ったり来たりするために利用されている。
ここでは、このようなシャトルシステムの例として、ミトコンドリアとペルオキシソーム(図2)があり、これらもNAD+の恒常性維持に寄与している。酵母では、ミトコンドリアは自身のNAD+を合成せず、NAD+レベルを維持するためにNAD+トランスポーター(Ndt1とNdt2)に依存している[76]。
ミトコンドリアのNAD+キナーゼは、NAD+をNADP+に、またはNADHをNADPHに変換する[71]。酵母のミトコンドリアに属するNAD+の部分は不明であるが、他の生物の研究では、細胞内のNAD+の20-85%の範囲であることが示唆されている[77]。
NAD+および他の誘導体がどのように輸送されるか、またはペルオキシソームプールをサポートするために作られるかについては、あまり知られていない。
ミトコンドリアとペルオキシソームのいくつかのシャトルシステムが同定されており、その中には、マレ ート-アスパラギン酸 [78,79,80,81]、エタノール-アセトアルデヒド [82,83,84]、およびグリセロール-3-リン酸シャトル [85,86,87,88,89,90]が含まれている。これらのシャトル系は、NAD(H)の還元または酸化で基質を酸化または還元するためにデヒドロゲナーゼに依存している。
したがって、これらのプール間のNAD+またはNADHの交換はなく、むしろ、NAD(H)の隣接するプール内の電子を受け入れるか、または供与することができるデヒドロゲナーゼ生成物の交換がある。例えば、ミトコンドリアにおけるNAD+/NADH比の呼吸誘発増加は、リンゴ酸アスパラギン酸シャトルによってサイトゾルに伝達され得る(図2)。同様に、ペルオキシソームにおける脂肪酸β酸化によって誘導されるNAD+/NADH比の減少は、このようなシャトルシステムによって細胞質プールとバランスをとることができる。
ペルオキシソームの興味深い側面として、ペルオキシソームにはNADHをNMNHに加水分解するnudixヒドロラーゼNpy1が含まれていることが挙げられる[36,91]。NAD+ホメオスタシスへの寄与は不明であるが、酸化還元状態のバランスをとるか、ペルオキシソームからのNAD+代謝物の除去に重要な役割を果たしている可能性がある。酵母はまた、ミトコンドリアに酸化還元等価物を輸送せずに電子輸送鎖に電子を供与するNADH脱水素酵素、Nde1とNde2に直面しているサイトゾルを含んでいる[92,93]。

図2。NAD+ホメオスタシスと密接に関係している細胞プロセス。細胞内NAD+およびその誘導体のコンパートメント化とともに、様々な細胞プロセスがNAD+ホメオスタシスの調節に寄与している。例えば、NAD+と中間体は、小胞追跡を介して液胞に入り、その後、小さなNAD+前駆体に変換される。NRのような小型NAD+前駆体は、特定のヌクレオシド輸送体を介して液胞と細胞質の間を移動することができる。
小NAD+前駆体は、小胞輸送によって細胞外に出て、形質膜上の特定の輸送体を介して再び細胞内に入ることができる。核内ではサーチュインが媒介する遺伝子サイレンシングがNAD+を消費する。核と細胞質は同じNAD+プールを共有しているが、これはNAD+が単純な拡散によって核の孔を通過すると予想されるためである。
ミトコンドリアとペルオキシソームのNAD+(H)レドックスシャトルシステムは、NAD+代謝に直接影響を与えるものではなく、代わりに、オルガネラプールと細胞質プールの間の酸化還元等価物のバランスをとり、NAD+/NADH比を調節するように機能している。
5. NAD+を消費する細胞過程
上述のような酸化還元的な役割に加えて、NAD+は基質としても消費される。NAD+の消費は1941年にMannとQuastelによって早くから指摘されており、彼はNAMによって消費が抑制されることを発見した[94]。
1年後、HandlerとKleinはこの発見を確認し、NAMが反応によって解放されることを指摘した[95]。我々は現在、NAD+がタンパク質やRNAの修飾に重要な非レドックス的役割を持っていることを理解している。酵母では、これはタンパク質の脱アセチル化とRNAの5’キャッピングに限られている[96,97]。
しかし、哺乳類では、これはADP-リボシル化と呼ばれるプロセスでタンパク質にNAD+のADP-リボース部位のモノおよびポリ付加に拡張され、ポリADP-リボースポリメラーゼ(PARP)と呼ばれる酵素のクラスによって行われる。PARP活性は、細胞の生存およびゲノムの安定性にリンクしている[98]。
サーチュインは、酵母からヒトに至るまで高度に保存されている酵素の一群であり、タンパク質の脱アセチル化に関与している。サーチュインは、タンパク質のアセチル基をNAD+のADP-リボース部位に移動させ、脱アセチル化されたタンパク質であるo-アセチル-ADP-リボースとNAMを生成する。
出芽酵母には5つのサーチュイン(Sir2、Hst1-4)が存在するのに対し、ヒトには7つのサーチュイン(SIRT1-7)が存在する。NAD+依存性脱アセチラーゼ活性は、酵母のSir2で初めて同定されたもので、ヒストンの脱アセチル化による交尾型遺伝子座、リボソームDNA遺伝子、およびサブテロメア領域のサイレンシングに重要な役割を果たしている[99,100,101,102]。
サーチュインはまた、代謝酵素や転写因子を含むヒストン以外の標的も持っており[103,104]、転写調節、ゲノム安定性、細胞寿命を含む多くの細胞プロセスに影響を与える[103,104,105]。NAD+およびNAMは、サーチュイン活性および下流イベントの調節において重要な役割を果たしている。生合成酵素の欠失によるNAD+産生の欠乏は、サーチュインが媒介するサイレンシングを廃止する [106,107]。
NAMはNAD+プールを補充し、サーチュインなどのNAD+消費酵素の活性を阻害することができるため[28,52,53,54]、NAMの恒常性の維持は細胞機能にとって非常に重要である。NAD+合成経路への再侵入に加えて、NAMは、NAMメチルトランスフェラーゼによるメチル化によってクリアされ得る[108,109,110]。
いくつかの実施例では、RNAポリメラーゼは、開始ヌクレオチドとして(ATPの代わりに)NAD+を使用することにより、RNAの5’末端にNAD+を付加することが見出されている。このNAD+は、典型的なN7メチルグアニシンキャップの代わりに機能する。この修飾は、真核生物と原核生物の両方で行われる[96,111,112,113]。
これらのNAD+でキャップされたRNAは、N7メチルグアノシンでキャップされたRNAよりも非効率的に翻訳され、安定性が低い[113]。これは、これらの代謝物の濃度とエネルギー代謝がどのようにRNAや翻訳のような下流のプロセスに影響を与えるのかについて多くの興味深い疑問を提起していると考えられている。
さらに、いくつかの酵素は、タンパク質やRNAを修飾することなくNAD+を分解する。酵母では、これらにはNUDIXヒドロラーゼが含まれる[36,91]。例えば、ペルオキシソームのNUDIXヒドロラーゼNpy1は、NADHを切断してNMNHとAMPを産生する。ヒト細胞では、SARM1とCD38がNAD+を切断し、様々な代謝障害や疾患の一因になっていると考えられている[114,115,116]。
6. NAD+ホメオスタシスの制御
特定のNAD+前駆体の異常なレベルを持つ酵母変異体の研究は、新規なNAD+恒常性因子の同定につながっている[31,34,35,36]。これらの変異体は、酵母細胞が常に小さなNAD+前駆体を放出し、再取り込みするという観察に基づいて同定された[32,33]。例えば、NAMリリース特異的レポーターシステムを用いて、Nt-アセチルトランスフェラーゼNatB複合体のサブユニット、Nat3(触媒サブユニット)とMdm20(調節サブユニット)がNAD+生合成の潜在的な調節因子として同定された [31]。
NatBが介在するNt-アセチル化は、Nmnatタンパク質の適切なレベルを維持するために重要であると考えられている(図3)。酵母では、NmnatはNAD+生合成の速度制限因子である[31,42]。Nmnat は 3 つの NAD+ 生合成経路すべてに関与し、NaMN を NaAD に変換する(de novo および NA/NAM サルベージ)と NMN を NAD+ に変換する(NR サルベージ)のに関与している(図 1)。
Nt-アセチル化の欠乏は、Nmnatタンパク質およびNAD+レベルの約50%の減少をもたらした。Nt-アセチル化は主にタンパク質の共翻訳的な修飾であり、タンパク質のフォールディング、複合体形成、局在化、および分解を変化させる可能性がある[117]。Nmnatsタンパク質の恒常性とNAD+生合成におけるNt-アセチル化の正確な役割はまだ決定されていない。

図3. 酵母におけるNAD+代謝の制御。細胞内シグナル伝達経路による NAD+代謝の制御を示すモデル。NAD+とNAD+前駆体は斜体で、太字で示されている。タンパク質名の略語は楕円形で強調表示されている。破線は、メカニズムを明らかにするために追加のエビデンスが必要であることを示している。
NA/NAM放出スクリーンで高得点を獲得した多くの変異体は、ミトコンドリア機能に変化が見られ、ミトコンドリア機能とNA/NAMサルベージ経路の間の関連性を示唆している。NAMサルベージとNAD+ホメオスタシスにおけるミトコンドリアの正確な役割については、まだ研究されていない。
機能不全に陥ったミトコンドリアは細胞から除去される必要があり、バルクオートファジーまたは選択的マイトファジーによって分解の標的とされ、ミトコンドリアとその構成要素を破壊する。例えば、温度感受性ATP合成酵素変異体は、非許容温度でのマイトファジーによってミトコンドリアを選択的に分解する[118]。
この過程でNAD+の一部がサルベージされる可能性がある。NatB変異体におけるもう一つの興味深い知見は、NAMの増加が液胞NRに由来するように見えることであった。窒素飢餓によるオートファジーの誘導は、実際に NAM と NR のプールを増加させた [31] が、オートファジー特異的因子である ATG14 を欠失させることで減少した [119,120]。
窒素飢餓状態では、NatB変異体の細胞内のNAMとNRのプールの増加を密接に模倣しており、NAMの増加の少なくとも一部は、NAD+やNMNのような上流代謝物のオートファジー分解の増加に由来することを示唆している。
また、NAD+やNAD+中間体の分離されたプールを含むオルガネラを含むオルガネラも主な原因の一つであると考えられる。NAD+およびNAD+中間体のオートファジーによる標的化がNAD+の恒常性に与える影響を理解することは興味深いことであろう。
別の研究では、デノボブランチを標的としたQAリリーゼ特異的レポーターシステムを用いて、Mac1を新規NAD+ホメオスタシス因子として同定した[34]。Mac1は銅を感知する転写因子であり、銅欠乏に応答して銅輸送遺伝子の発現を活性化する [121,122,123]。MAC1を欠失した細胞はhst1∆変異体と同様のNAD+表現型を共有し、MAC1またはHST1のいずれかを欠失させることでBNA遺伝子の抑制を廃止するのに十分であった[34]。MAC1タンパク質は、Hst1を含むリプレッサー複合体(Hst1、Rfm1、およびSum1からなる)と協働して、BNA遺伝子発現を抑制している可能性が示唆されている(図3)。
Mac1がどのようにして転写活性化因子(銅輸送遺伝子)として機能するのか、また共抑圧因子(BNA遺伝子)として機能するのか、そのメカニズムはまだ解明されていない。栄養レベルで存在する場合、Mac1に銅が結合すると、分子内相互作用により、転写が不活性な状態になる。細胞が高銅ストレスにさらされている場合、Mac1は、過剰な銅の輸入を防ぐために迅速に分解される[124,125,126]。
銅が奪われると、Mac1タンパク質は安定化し、銅輸送遺伝子の発現を活性化することができる。したがって、通常の条件下では、転写的に不活性な(銅が結合した)Mac1の形態は、Hst1複合体と協働してBNA遺伝子を抑制することが示唆されている。これらの研究はまた、銅ストレスが高い場合も低い場合も、Mac1 を介した新しい NAD+ 生合成に影響を与える可能性があり、さらにストレスシグナル伝達機構もあることを示唆している。
銅のホメオスタシスとミトコンドリア呼吸の間には密接な関係があり、de novo NAD+ 生合成は O2 に依存していることを考えると、これらのプロセスが協調して制御されていれば、有益なことになるかもしれない。
いくつかの栄養感知およびストレスシグナル伝達経路もまた、NAD+代謝と関連している[34,127]。例えば、低リン酸(Pi)感知PHO経路の活性化は、NRサルベージ活性の増加と関連している(図3) [35]。興味深いことに、PHO活性化は低NAD+変異体でも観察され、低NAD+と低Piシグナル伝達の間のクロスレギュレーションを示唆している[35]。
さらに、NAD+誘導体のPi部位は、Pi制限中のPi消去のための潜在的な資源である。興味深いことに、PHOの活性化は、hst1∆変異体[34]とアミノ酸センシング活性が低下した細胞[128]でも観察された。そのメカニズムはまだ明らかになっていないが、これらの経路を結合させることは、特定の条件下では代謝的に有利であるかもしれない。
PKA (cyclic-AMP activated protein kinase A)、Sch9 (yeast Akt)、TOR (target of rapamycin)などの追加のシグナル伝達経路もまた、NAD+代謝において役割を果たしている可能性がある(図3) [129]。これらの経路は、ストレス応答転写因子であるMsn2およびMsn4を調節しているように見える[130,131,132]が、様々な軽度のストレスに応答してPnc1[38]の発現を増加させることが示されている(図3) [39]。
NAD+代謝物の放出と再取り込みもまた、NAD+恒常性に寄与している。酵母細胞は、特異的なトランスポーターNrt1(NR)とTna1(NAとQA)を介してNR、NA、QAを(低μM濃度で)取り込む [33,63,64]。これらのNAD+前駆体は、高濃度で存在する場合には、別のメカニズムで細胞内に入ることもある。
酵母では、高μMレベルのNAは、QAとNAが同じトランスポーターTna1を共有しているため、増殖培地から放出されたQAの再取り込みを阻害する可能性がある[34]。NAD+代謝物が酵母細胞からどのように放出されるかについては、あまり知られていない。小胞輸送と液胞貯蔵の両方が役割を果たしていることが示唆されている(図2)[1,31,133]。NAD+中間体の液胞分解はNAD+サルベージと一致しており、NAD+代謝物は小胞輸送とオートファジーを介して液胞に入る可能性がある。
NAD+代謝物は、その後、貯蔵または再利用のために、より小さな前駆体に分解される。平衡化ヌクレオシドトランスポーターFun26(ヒトhENTホモログ)は、液胞と細胞質の間のNRと他のヌクレオシドのバランスを制御している[35]。興味深いことに、NAMとNRの液胞貯蔵プールが観察されているが、過剰なQAのほとんどは細胞外に放出されている[33,34]。これらの研究は、NAD+代謝物のコンパートメント化もまた、NAD+ホメオスタシスの調節に重要な役割を果たしていることを示している。
7. NAD+と疾患
NAD+代謝の変化がいくつかの代謝障害や疾患と相関していることが明らかになっており、NAD+前駆体や化学的阻害剤を用いたNAD+生合成および消費経路の調節による治療的アプローチが積極的に検討されている[134,135,136,137]。NAD+代謝の変化は、酸化還元代謝またはNAD+消費酵素の活性を介して、多くの細胞プロセスに影響を与える。
NAD+代謝のどの側面が異なる疾患に重要であるかを分離することはしばしば困難であり、複数の因子の組み合わせである可能性がある。さらに、律速制限的なNAD+生合成因子は、異なる細胞タイプにおいて、または異なる環境条件において異なる場合がある。例えば、Namptは、哺乳類細胞におけるNAD+合成の速度制限因子である。Namptは、Nampt活性の減少および増加の両方が報告されているいくつかの疾患モデルに関与している[134,138]。
癌細胞はNAD+に対する需要が高いため、Namptの阻害は癌細胞の殺傷を促進することが示唆されている。さらに、PARPが媒介するDNA修復はNAD+を必要とするため、NAD+合成を制限することで癌細胞の死滅を促進する可能性が示唆されている[139]。これを裏付けるように、PARP阻害剤とNampt阻害剤の組み合わせは、乳がん細胞において合成致死性を誘導することが示されている[140]。
癌や糖尿病などの代謝性疾患におけるNamptとNAD+代謝の役割は、最近のいくつかのレビューで幅広く議論されている[5,6,134,138,141,142,143]。ここでは、神経系の選択された疾患におけるNAD+、NAD+生合成酵素NmnatsおよびNAD+依存性サーチュインの役割について議論する。
脱髄および変性を含む神経系の認知症および診断可能な病理学的変化は、ペラグラの後期に発生し、おそらく神経系におけるNAD+の重要性を示す最初の証拠である[144]。神経を切断または破砕すると軸索が劣化することを特徴とするワレリアン変性の研究から、NAD+が神経系の疾患に関与していることが明らかになった。遅いワレリアン変性変異マウス(Wlds)の発見は、すぐにNmnatsと神経系の疾患を結びつけた[145,146]。
Wlds変異体では、Nmnat1はそのN末端でユビキチン結合因子であるUBE4Bの最初の70アミノ酸と融合している[147]。この変化は、Nmnat1の過剰発現と軸索の細胞質コンパートメントへの再分配をもたらす。軸索内のNAD+生合成は通常、Nmnat2によって支えられているが、軸索への損傷はNmnat2の急速な分解を促進する[148]。
Wlds融合体は、Nmnat1の酵素活性を必要とすることが研究で示されているため、NAD+の合成を介してこれらの軸索を保護している可能性が高い[147]。さらに、NMNAT1とWldsの発現は他の神経変性モデルにおいても保護されているようである[149,150,151]。また、NMNAT1遺伝子の変異は、網膜変性の早期発症と急速な進行を特徴とするレーバー先天性甘露症と呼ばれる疾患において、子供の遺伝性失明の原因となっている[152,153,154,155]。
Nmnatsは様々な神経変性疾患に関与しているが、それらが果たす正確な役割は議論の余地があり、NAD+生合成およびタンパク質フォールディングシャペロン活性を含むようである[151,156,157]。
NAD+合成モデルの裏付けとして、ヒトのNAD+生合成の律速酵素であるNamptの過剰発現もまた、いくつかのモデルでは保護的である。最近では、トールインターロイキン受容体様タンパク質であるSARM1が、保存された軸索死の経路に重要であることが発見された[158,159]。
SARM1の二量化はNAD+の枯渇を引き起こし、結果として細胞死を引き起こした[160]が、最終的にSARM1はNAD+をADP-リボースとNAMに切断することが明らかになった[115]。しかし、NmnatsやNamptを過剰発現させたり、NRを補給したりすることで、NAD+の合成を介してSARM1が介在する軸索変性をブロックすることは可能である[160]。
しかし、他の経路では、NmnatsのNAD+生合成活性に依存しないものもある。例えば、Nmnat2活性は、タウの毒性を防止するためには無視できない。Nmnat2はHsp90と複合体を形成し、毒性のあるタウのリフォールディングを促進する可能性があることが示された[156]。
神経変性疾患の酵母モデルにおいても、酵母のNmnat Nma1およびNma2は、ミスフォールディングされたタンパク質からの保護を提供している[157]。全体として、これらの研究は、Nmnatsの発現を増加させ、Nmnatsの分解を遅らせるかまたは防止することが、様々な神経疾患を治療するための有用な戦略を提供する可能性があることを示唆している。
さらに、NAD+の枯渇は、ミトコンドリアの機能および酸化ストレスと闘う能力を含むいくつかのプロセスを調節するサーチュインなどのNAD+消費酵素に深刻な影響を及ぼす。実際、ミトコンドリア機能不全および活性酸素種の産生は、多くの神経変性疾患と密接に関連している[161,162,163,164,165,166,167,168]。
例えば、SIRT3はミトコンドリアに局在し、TCAサイクル、電子輸送鎖、およびケトジェネシスを含む様々な代謝経路の酵素を標的とする[169,170,171,172]。重要なことは、脱アセチル化と抗酸化酵素の活性化により活性酸素種の産生を制御することである[173,174]。
SIRT3ノックアウトマウスの皮質ニューロンは、興奮性、酸化性、代謝ストレスに敏感であり、SIRT3遺伝子導入により回復させることができる[175]。同じ研究では、ハンチントン病モデルを用いて、SIRT3ノックアウトマウスは機能的コピーを持つマウスと比較して、すぐに病状が悪化することがわかった。
アルツハイマー病では、SIRT3タンパク質レベルが著しく低下し、ミトコンドリアの機能不全を促進する[176]。筋萎縮性側索硬化症のいくつかの症例では、スーパーオキシドジスムターゼSOD1の変異は、ミトコンドリアの機能不全と断片化を促進し、最終的には運動ニューロンの死を促進する[177]。変異型SOD1G93Aを用いて、SIRT3の発現がミトコンドリアの断片化と細胞死を防ぐことが示されている[178]。
まとめると、神経系の様々な疾患は、NAD+レベルの低下、またはNAD+消費・生合成遺伝子の問題と相関しているようである。NAD+およびNAD+恒常性因子の低下は、代謝の調節を緩め、細胞を活性酸素に感作する。今後、NAD+合成を促進することで、これらの疾患を研究する試みが必要と考えられる。
酵母を用いた研究は、NAD+代謝とミトコンドリア機能の相互関係を解明するのに役立つかもしれない。例えば、高いNAMを放出する多くの酵母変異体もまた、ミトコンドリア機能の変化を示している[31]。これらの変異体を研究することで、より詳細なメカニズムの手がかりが得られるかもしれない。
8. 結論と展望
NAD+のバランスのとれたレベルは、適切な細胞機能を維持するために不可欠である。細胞は、遺伝子制御、フィードバック阻害、酵素や中間代謝物のコンパートメント化、栄養やエネルギーセンシングを介した生合成の調整など、NAD+の生合成を制御するための多くの方法を適応させていた。最近の研究では、NAD+のホメオスタシスを制御する新規な制御因子が同定されているが、多くの疑問が残されている。
例えば、酵母では、NAMはNA/NAMサルベージ経路に入るか、NAD+依存性サーチュインHst1の活性を阻害することでde novo経路(図1)を抑制することで、NAD+プールを補充することができる[34,37]。他の生物におけるde novo経路もNAD+によって抑制され、サーチュイン依存的な方法でNAMによって脱抑制されるかどうかは不明である。
NAD+によるde novo活性の抑制は細菌で観察されている[179,180]。しかし、NAMは大腸菌ではde novo NAD+合成活性を抑制しないようである[179]。サーチュインは種を超えて高度に保存されているため[181,182]、高次真核生物におけるde novo NAD+生合成の調節にサーチュインが関与しているかどうかを調べることは有益である。
NAD+中間体の複数の役割やNAD+ホメオスタシスを制御する新規な因子を理解するための今後の研究も大いに期待される。
NAD+代謝は、いくつかのヒト疾患の新たな治療標的となっている[5,7,11,14,183,184]。特定のNAD+前駆体の補給は、より効率的なNAD+合成経路への前駆体の流路を助けるために、遺伝子改変や特定のNAD+生合成ステップの阻害剤と組み合わされることが多い[10,184,185]。
したがって、複数のNAD+代謝経路の分子基盤および相互接続を理解することは、疾患特異的な治療戦略を開発するために重要である。特定のNAD+生合成経路/ステップに関連する欠陥が知られていれば、これらの治療戦略はより効果的であることが示されている[10,11]。
さらに、特定のNAD+代謝物およびNAD+生合成酵素もまた、付加的な機能を有することが報告されている[1,129]。例えば、de novo経路の代謝物は、いくつかの脳障害とリンクしている [12,186]。今後、NAD+中間体の多様な役割やNAD+恒常性を制御する新規因子の解明が期待されている。