Ivermectin Promotes Peripheral Nerve Regeneration during Wound Healing
オンラインで公開2018年10月1日
www.ncbi.nlm.nih.gov/pmc/articles/PMC6210064/
Dana M. Cairns,† Jodie E. Giordano,† Sylvia Conte,∥Michael Levin,‡§ and David L. Kaplancorresponding author* †§§.
要旨
末梢神経は、末梢神経系の神経保護グリアであるシュワン細胞の存在により再生能力を持っている。末梢神経が損傷を受けると、シュワン細胞は細胞毒性のあるグルタミン酸を取り込み、神経栄養シグナル分子を分泌することで、神経細胞の再生に適した微小環境を作り出す。末梢神経の修復障害は、損傷後のシュワン細胞の反応不良が原因であることが多く、特にヒトのような再生能力が制限された生物においては、神経の再生を促進するための新たな戦略を開発する必要性が非常に高い。
その一つのアプローチとして、神経の修復がはるかに効率的な下等生物のメカニズムを探求することが挙げられる。最近の研究では、抗寄生虫薬であるイベルメクチンがXenopus laevisのオタマジャクシの原始眼組織の過神経化を引き起こすことが明らかになった。本研究では、イベルメクチンが哺乳類の神経修復に果たす役割を調べることを目的とした。その結果、イベルメクチンで処理した神経幹細胞は、神経幹細胞の増殖と遊走を促進することがわかった。また、イベルメクチンのhDFsへの影響を調べたところ、イベルメクチンはhDFsが細胞外グルタミン酸を取り込み、グリア細胞由来の神経栄養因子を分泌し、細長い双極性形態を形成し、グリア線維性酸性タンパク質を発現することを明らかにした。
最後に、対応する生体内試験モデルでは、皮膚創傷部位にイベルメクチンを局所的に投与すると、治癒時にグリアとニューロンの両方のマーカーのアップレギュレーションが誘導されることを発見した。以上のことから、イベルメクチンが線維芽細胞にグリア様表現型を導入することで末梢神経の再生を促進することが明らかになった。
1. はじめに
中枢神経系とは異なり、末梢神経系(PNS)は損傷時の修復能力がかなり高い。末梢神経の修復は比較的効率的であるが、このプロセスが障害されているか、あるいは阻止されている場合もある。例えば、末梢神経の損傷や障害に伴って起こる神経障害は、痛みや感覚・運動の喪失を伴うことが多く、糖尿病、特定の自己免疫疾患、ヒト免疫不全ウイルス感染症、化学療法などが原因となることがある。さらに、外傷性外傷の3~10%は、外科的介入を必要とする急性末梢神経損傷を引き起こしている2。このような取り返しのつかない末梢神経損傷は、患者の生活の質に悪影響を及ぼし、重度の永久的な感覚・運動機能障害を引き起こし、完全な麻痺や慢性神経障害性疼痛を引き起こす可能性がある3。
生得的な末梢神経の修復能力は、少なくとも一部では末梢神経系の再生能力の高いグリア細胞であるシュワン細胞に起因していると考えられる。シュワン細胞は末梢神経を髄膜化し、軸索の誘導と再生に不可欠な役割を果 たしている。末梢神経を損傷すると、遠位軸索は退化するが、シュワン細胞は脱分化して増殖し、 その後の神経細胞の再生に適した微小環境を作り出すのに役立つ5 。7 GDNFは神経細胞の成長と生存を促進することが示されており、糖尿病性神経障害8 や坐骨神経切除などの実験的神経修復のための様々な治療戦略の開発に広く利用されている。分化されたシュワン細胞は通常、細長い双極性形態を示し、グリア線維性酸性タンパク質(GFAP)を含む特定の細胞骨格タンパク質のアップレギュレーションを開始する。興味深いことに、GFAPは特に末梢神経の再生に重要な役割を果たしており、GFAP非欠損マウスでは損傷後の神経細胞の再生が遅れていることが示されているが、これはシュワン細胞の調節障害によるものと考えられる11。
末梢神経損傷の治療法は開発されているが、いくつかの限界がある。11 末梢神経損傷の治療法は開発されているが、いくつかの限界がある。より大きな神経欠損や外傷の修復を必要とする患者の場合、主な治療法は自家神経移植であるが、犠牲となる神経組織の利用可能性が限られていること、ドナー部位の罹患率が高いこと、神経腫が形成される可能性があることなど、多くの欠点がある3。また、糖尿病性神経障害の転帰を改善しようとする実験モデルもいくつか存在する。例えば、最近の研究では、単純ヘルペスウイルスベクターを媒介とした血管内皮増殖因子の遺伝子導入を、糖尿病性神経障害のマウスモデルを用いて皮膚に皮下接種した12 。
現在の治療法には様々な欠点があるため、新しい標的を特定し、神経再生障害の問題に対処するための新たな戦略を開発することが非常に重要である。その一つのアプローチは、末梢神経の修復がはるかに強固で効率的な下等生物のメカニズムを調べることである。アキソロートルなどのサンショウウオの一部の種は、切断された四肢全体を再生することができ、その中には触覚や運動を伴う完全に機能的な 神経構成要素も含まれている13 。興味深いことに、切断時に軸索四肢の神経を切断すると四肢の再生が阻害されることから、神経機能の回復だけでなく四肢の組織全体の修復にも適切な 神経保護が重要であることが示唆されている14。
この生物は完全な再生能力を持っているが、類似種は再生能力は劣るが、哺乳類よりもはるかに高い修復能力を示している。例えば、南アフリカのツメガエルXenopus laevisは、尾、脊髄、四肢を部分的に再生することができるが、その再生能力は動物が成熟するにつれて着実に低下するため、サンショウウオのようには再生能力を高めることはできない15 。これらの動物が再生能力から非再生能力に移行する際に再生能力を高めるメカニズムを理解することは、哺乳類の修復能力を高めるための戦略を考案する際に役立ち、特にヒトでは加齢による再生能力の低下が確立されている16 。例えば、ゼノパスの宿主移植モデルを用いた最近の研究では、イベルメクチンが初期段階のオタマジャクシの側面に移植された原始眼組織の神経組織を強化できることが実証されている17 。イベルメクチンは、ヒトではオンコセルカ症の治療に使用されているが、ストロンギロイジダ症などの他のミミズ感染症や、疥癬などの寄生性皮膚疾患にも有効である18 。これらのイオンチャネルを神経損傷部位に局所的に刺激することで、神経の成長と修復を開始する可能性がある。我々は、この新たに発見された非再生段階のカエルの神経を増加させる方法が、ヒトのように再生能力が制限された生物の神経誘導にも有用である可能性があると仮説を立てた。
本研究の目的は、哺乳類の末梢神経修復に対するイベルメクチンの効果を評価することであった。21 ヒト皮膚線維芽細胞(hDFs)とhiNSCsを組み込んだ三次元(3D)二層コラーゲンゲル共培養システムを用いて、これら、2種類の異なる細胞間の複雑な相互作用を理解するための簡単な試験管内試験ツールとして使用したところ、hDFsをイベルメクチンで前処理すると、隣接するhiNSCsが有意に増殖を増加させることがわかった。同様に、前分化したhiNSCを用いた遊走アッセイでは、イベルメクチン処理したhDFが神経細胞の遊走を有意に増加させることがわかった。さらに、イベルメクチンがhDFsに及ぼす影響を試験管内試験で調べたところ、イベルメクチンはhDFsが細胞外グルタミン酸を取り込み、GDNFを分泌し、細長い双極性形態を形成し、GFAPを発現することを明らかにした。最後に、我々は試験管内試験で得られた知見を生体内試験モデルに翻訳し、皮膚創傷部位に局所的にイベルメクチンを投与すると、治癒時にグリアとニューロンの両方のマーカーのアップレギュレーションが誘導されることを発見した。以上の結果から、哺乳類の創傷治癒時における末梢神経の再生促進におけるイベルメクチンの新たな役割が明らかになった。
2. 結果
2.1. 皮膚線維芽細胞をイベルメクチンで処理すると共培養hiNSCの増殖が誘導される
我々は、DiD色素で蛍光標識されたヒト誘導神経幹細胞(hiNSCs)とヒト皮膚線維芽細胞からなる3D二層コラーゲンゲル共培養系を開発した(図11A)。これらのhiNSCは高度に増殖し、Sox1,Sox2,およびNestinを発現する(図S1)。別々のコラーゲンゲルに埋め込む前に、両方の細胞型は、ジメチルスルホキシド(DMSO)または1μMのイベルメクチンで一過性に処理し、その後、残留薬物を除去するために繰り返し洗浄した。hDFsは、下のゲルに播種し、ラベル付けされたhiNSCsは、上のゲルに播種し、二層構造体は、その後5日間培養した。
図1 真皮線維芽細胞をイベルメクチンで処理すると、3次元共培養で隣接する神経幹細胞の増殖が誘導される
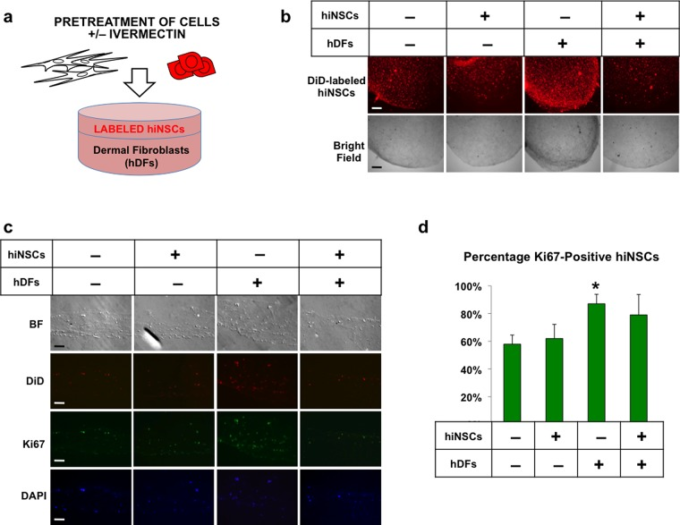
(a) 実験デザインの模式図。DiD色素で蛍光標識したヒト真皮線維芽細胞(hDF)とヒト誘導神経幹細胞(hiNSC)を、それぞれ1μMのイベルメクチンで処理した後、洗浄を繰り返して薬剤を除去し、3D二層コラーゲンゲル構築物に播種し、5日間培養した。b)3Dコラーゲンゲルコンストラクトの低倍率図、スケールバー。500μM。c)増殖マーカー、Ki67,スケールバーのために免疫染色されたコラーゲンゲルの凍結切除。100μM。d)Ki67陽性DiD標識神経幹細胞の定量化。*P ≤ 0.05, **P ≤ 0.01, ***P ≤ 0.001;ポストホックTukey検定を用いた一方向分散分析(ANOVA)によって決定。エラーバーは平均値±SDを示す。
神経成長に対する非細胞自律的な効果を示した以前のゼノパスの実験から得られた知見と同様に、17我々は、hDFがイベルメクチンで前処理されたこれらの構築物でのみ、神経成長の増加を観察した(図11B)。これらの二重層ゲルを凍結切除したところ、これらの構築物のhiNSCは増殖マーカーKi67を有意に高いレベルで発現していることがわかった(図11C,D)。
2.2. イベルメクチン処理線維芽細胞による分化神経細胞の移動誘導
イベルメクチンで処理したhDFが神経幹細胞の増殖を誘導することを確立したので、我々はまた、神経細胞の遊走にそれらの潜在的な効果を研究することを目的とした。これをテストするために、我々は、細胞培養プレートの底部のトランスウェルにhDFを播種し、DMSOまたは1μMのイベルメクチンで処理した後、その後、残留薬物を除去するために繰り返し洗浄した(図22A)。コーティングされた8μMの細孔膜上のトランスウェルの上部に、我々は、アッセイにおける増殖の影響を最小限に抑えるために、DiD標識ヒトニューロンを播種した。我々は、もはや増殖しておらず、パンニューロンマーカーβIIIチューブリン(Tuj1)(図S2A)の高レベルを発現していなかった1週間前から予備分化されていたhiNSCを利用した。これらのトランスウェルシステムを低血清培地中で一晩培養し(潜在的な細胞増殖をさらに最小化するために)トランスウェルの底部に移動する細胞の相対的な数を定量化した(図22B,C)。興味深いことに、イベルメクチン処理したhDFは、コントロール処理した細胞と比較して、神経細胞の遊走の有意な増加を示した。
図2皮膚線維芽細胞をイベルメクチンで処理すると、分化した神経細胞の遊走が誘導される
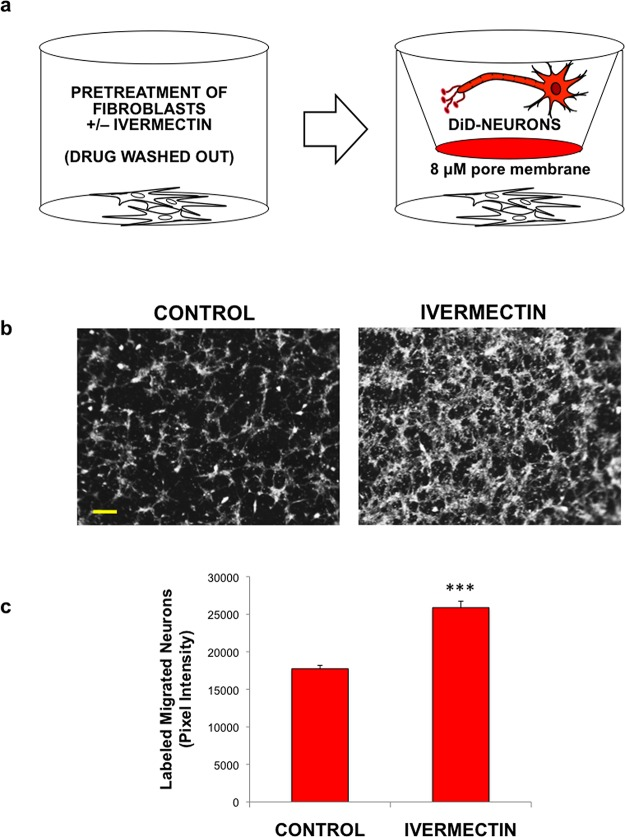
(a) 実験デザインの模式図。ヒト真皮線維芽細胞を細胞培養プレートの底部に播種し、イベルメクチンの有無にかかわらず処理した後、繰り返し洗浄して薬剤を除去した。分化されたDiD標識ニューロンを、線維芽細胞を含むウエルに配置されたコーティングされたトランスウエル(8μMの細孔サイズ)に播種した。細胞を低血清培地(潜在的な細胞増殖を最小限に抑えるため)で一晩培養し、トランスウェルの底部に移動する細胞の相対的な数を定量した。b)イベルメクチンの有無にかかわらず前処理した皮膚線維芽細胞との共培養時にトランスウェルの底部に移動した蛍光標識されたニューロンの画像、スケールバー:200μM。c)移行した細胞の定量化。*P ≤ 0.05, **P ≤ 0.01, ***P ≤ 0.001; 両側 t 検定により決定。エラーバーは平均値±SDを示す。
以上のことから、我々は、hiNSCではなく、間質性hDFsのイベルメクチン処理は、神経成長に深遠な効果を持っていたことを示している。重要なのは、両方の共培養モデルを確立する前に薬剤を広範囲に洗浄したので、これは、関連する効果は、別々の細胞タイプの最初の前処理の結果であり、全体の共培養コンストラクト上の薬剤自体の効果ではないことを示唆している。
2.3. イベルメクチンによる治療は皮膚線維芽細胞にグリア細胞の機能特性を採用させる
我々はまず、イベルメクチン処理した線維芽細胞が細胞外微小環境から潜在的に細胞毒性のあるグルタミン酸を除去しているという仮説を立てた。これをテストするために、我々はhDFを様々な濃度のイベルメクチンで一晩処理し、細胞外グルタミン酸濃度を測定するために細胞培養培地をアッセイした。それは以前に線維芽細胞培養培地は、多くの種類の培地製剤にl-グルタミン、グルタミン酸の前駆体、添加の結果として、大量のグルタミン酸が含まれていることが示されていた。興味深いことに、我々は、イベルメクチンでhDFsを処理すると、細胞外グルタミン酸濃度の用量依存性の有意な減少をもたらしたことを発見した(図33A)イベルメクチンで処理した線維芽細胞もまた、傷害時にニューロンが放出した細胞外グルタミン酸を取り込むことができるかもしれないことを示唆している。
図3 イベルメクチンによる処理は、皮膚線維芽細胞に細胞外グルタミン酸を取り込み、グリア細胞株由来の神経栄養成長因子(GDNF)を発現させる
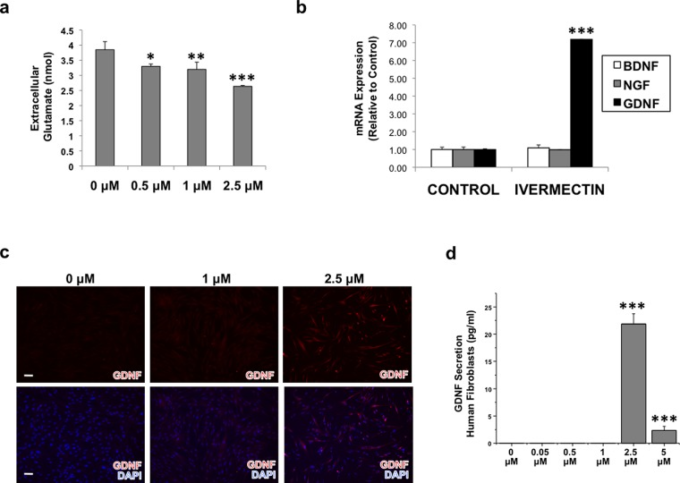
(a) 皮膚線維芽細胞を様々な濃度のイベルメクチンで一晩処理し、細胞培養液をアッセイして細胞外グルタミン酸濃度を測定した。(b) 皮膚線維芽細胞を1μMイベルメクチンの有無にかかわらず4日間処理し、その後、様々な神経栄養成長因子の定量的リアルタイムポリメラーゼ連鎖反応(qRT-PCR)分析に供した。c)イベルメクチンで処理した真皮線維芽細胞の免疫染色結果は、イベルメクチン濃度の増加に伴うGDNF発現の増加を示し、スケールバー。100μM。(d)イベルメクチン処理した真皮線維芽細胞から採取した細胞培養液の酵素結合免疫吸着アッセイ(ELISA)では、イベルメクチン処理した線維芽細胞からGDNFが分泌されていることが示された。*P ≤ 0.05, **P ≤ 0.01, ***P ≤ 0.001; post-hoc Tukey検定を用いた一方向ANOVAによって決定された。エラーバーは平均値±SDを示す。
我々は、hDFsのイベルメクチン処理は、隣接するhiNSCに何らかのパラクリン効果を誘発しているという仮説を立てた。そのため、我々はまた、イベルメクチンが線維芽細胞に神経栄養因子を発現させるかどうかを決定することも目的とした。我々は、hDFsをビヒクルまたは1μMのイベルメクチンで4日間処理した後、様々な成長因子の発現をアッセイするためにqRT-PCR分析に供した。その結果、イベルメクチンの脳由来神経栄養因子や神経成長因子に対する有意な影響は 4 日後には認められなかったが、イベルメクチン処理した hDF は、アストロサイト23 やシュワン細胞で高度に発現していることが示されているグリア細胞株由来神経栄養因子(GDNF)の発現を劇的に増加させた(FigureFigure33B)7。7 GDNF がタンパク質レベルでも上昇しているかどうかを確認するために、hDF をイベルメクチンで処理し、GDNF に対する免疫染色を行ったところ、1 μM 以上のイベルメクチンに曝露することで GDNF の発現が増加することがわかった(図 33C)。GDNF が mRNA とタンパク質の両方のレベルで上昇していることを確認した後、GDNF が分泌されているかどうかを理解することも目的とした。興味深いことに、イベルメクチン濃度≧2.5μMでは、hDFが培地中に有意なレベルのGDNFタンパク質を分泌することがわかった(図33D)。イベルメクチン濃度≧5μMでは、試験管内試験で細胞毒性を示すようであった(図S3)。
共培養hiNSC上のhDFsにおけるイベルメクチン誘発GDNF発現の役割をさらに解明するために、GDNFを機能的にブロックする抗体の存在下でニューロン遊走実験(Figure22と同様)を行い、この抗体がhiNSC遊走に対するイベルメクチン処理hDFsの効果を減少させることができることを発見した(FigureS4)。
2.4. イベルメクチン処理した線維芽細胞はグリア様の形態を示し、GFAP の発現を抑制した
イベルメクチンによって hDF がグルタミン酸の取り込みや GDNF の放出など、グリア細胞のある種の特徴を持つようになることが明らかになったので、イベルメクチンで処理した hDF がグリア細胞とより表現型的に類似したものになるかどうかを理解することも目的とした。以前の実験と同様に、hDFをイベルメクチンの濃度を上げて8日間処理した後、qRT-PCRおよび免疫染色を行った。また、GeneQuery Human Schwann Cell Biology qPCRアレイキットを用いてサンプルを処理したところ、イベルメクチン処理したhDFは、分化や維持を含むシュワン細胞生物学の様々な側面に関与する複数の遺伝子を高度に発現していることがわかった。末梢神経再生、細胞外マトリックス合成(SRY-box 10(Sox10)S100カルシウム結合タンパク質B(S100B)ミエリン塩基性タンパク質、成長関連タンパク質43(GAP43)神経細胞接着分子1(NCAM1)を含む(ただし、これらに限定されない)(図S5)。
さらに、qRT-PCR分析により、1μMイベルメクチンで処理したhDFFは、D4およびD8の両方において、有意に高いレベルのグリア線維性酸性タンパク質(GFAP)を発現したことが明らかになった(図44A)。同様に、我々は、イベルメクチンの濃度を増加させると、GFAPのより高いタンパク質の発現だけでなく、シュワン細胞のような表現型を連想させる形態学的変化をもたらしたことを実証した、コントロール線維芽細胞と比較して非常に細く、細長いものになる(図44B)。最後に、観察された効果が薬物の結果であり、薬物合成の非特異的なアーチファクトではないことを確認するために、イベルメクチンの異なる製剤を使用していくつかの実験を繰り返した。試験したすべてのイベルメクチン製剤について、GFAPがアップレギュレートされ、表現型の細長い形態も観察された(図S6)ことから、hDFsに対するイベルメクチンの効果に関する我々の知見は、薬物自体の主成分に起因する可能性が高く、製造プロセスの潜在的に汚染された副産物に起因するものではないことが示唆された。
図4 皮膚線維芽細胞をイベルメクチンの濃度を上げて処理すると、GFAP がアップレギュレーションされ、シュワン細胞を彷彿とさせる細長い形態が発現する
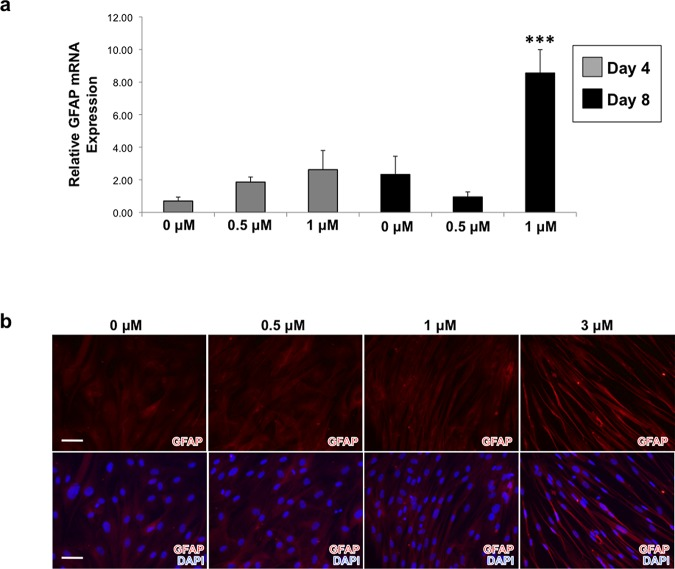
(a) 皮膚線維芽細胞を様々な濃度のイベルメクチンで4日間および8日間処理した後、GFAP発現のqRT-PCR解析を行った。(b) GFAP免疫染色は、比較的高い濃度のイベルメクチンで8日間処理した皮膚線維芽細胞がGFAP発現の増加だけでなく、シュワン細胞様の表現型に似た形態の変化をもたらしたことを示している、スケールバー。100μM。***P ≤ 0.001;ポストホックTukey検定を用いた一元配置分散分析によって決定されたように。エラーバーは平均±SDを示す。
2.5. 創傷治癒の生体内試験モデルにおけるイベルメクチンの効果
我々の 試験管内試験 での結果は、皮膚線維芽細胞をよりグリアールに近い表現型に変化させることで神経再生を促進するイ ベルメクチンの役割を明確に示していたが、これらの効果が 生体内試験 モデルでも見られるかどうかを理解することが重要であった。イベルメクチンで処理した真皮線維芽細胞が共培養神経細胞の成長を促進することを示唆する説得力のあるデータを得た後、我々は、生理学的に関連する細胞タイプ(真皮線維芽細胞と末梢神経)の両方を含み、イベルメクチンの局所的な薬物送達のためのシンプルなシステムを提供する生体内試験システムを選択した。この目的のために、我々は皮膚創傷治癒モデルを選択した。成人雄性BALB/cマウスの背側皮膚から直径8mmの全厚生検を2枚切除した。右側の創傷では、10μMのイベルメクチンまたはDMSO(コントロール)を含む30μLのコラーゲンゲルを創傷にピペッティングし、固化させることができた(図55A)。左側の創傷は未処理のままで、追加のコントロールとして機能した。両方の創部をTegadermで封鎖し、創部の進行を12日間にわたって追跡した。イベルメクチンが創傷の治癒を部分的に助けていることを、創傷の大きさを経時的に定量化することで確認した(図55B)。8-9日目および11-12日目には、イベルメクチン処理した創傷はDMSO処理したコントロールよりも有意に小さくなっていた。
図5 イベルメクチンは生体内での真皮生検の創傷治癒を促進する
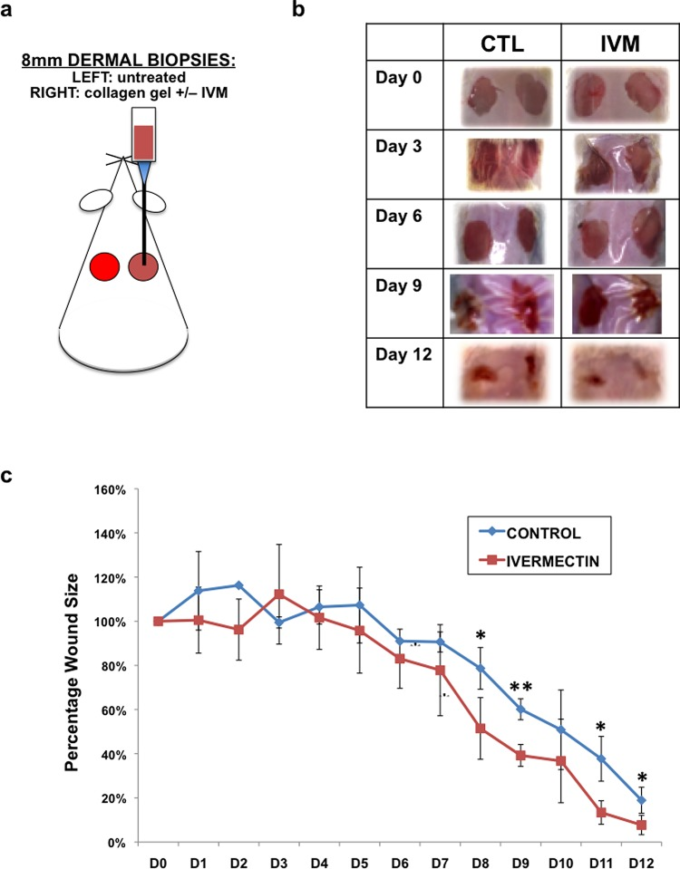
(a)実験デザインの模式図。各マウスの背側真皮層からバイオプシ(2×8mm2)を採取した。右側の創傷では、10μMイベルメクチンまたはDMSO(対照)を含む30μLコラーゲンゲルを創傷にピペッティングし、固化させた。左側の創傷は未処理のままで、追加のコントロールとして機能した。両方の創部をTegadermで封鎖し、創部の進行を12日間追跡した。(b) 時間経過に伴う創傷治癒の総形態の画像。(c)経時的な創傷の大きさの定量。*P ≤ 0.05, **P ≤ 0.01;両側 t 検定により決定。エラーバーは平均値±SDを示す。
2.6. イベルメクチン処理した治癒創傷では、神経細胞およびグリアマーカーの発現が増加した
次に、治癒した皮膚組織中の神経細胞とグリアの両方のマーカーの存在をアッセイした。創傷治癒が損なわれると瘢痕組織が形成され、神経が適切に再生できず、創傷部位の感覚が失われることが多いため、これは特に重要である。D12で犠牲にした後、創傷組織を切除して固定し、組織切片を免疫染色したところ、イベルメクチンを添加したコラーゲンゲルを投与したマウスでは、ビヒクルコントロールのコラーゲンゲルと比較して、分泌因子GDNF(図66A)グリアマーカーGFAP(図66B)末梢神経マーカー(PGP9.5)(図66C)の発現が有意に高いことがわかった。これらの知見は、創傷治癒の生体内試験モデルにおいて、イベルメクチンがグリア様細胞の生成を誘導することで神経の成長も促進することを示唆する我々の試験管内試験データと一致している。
図6
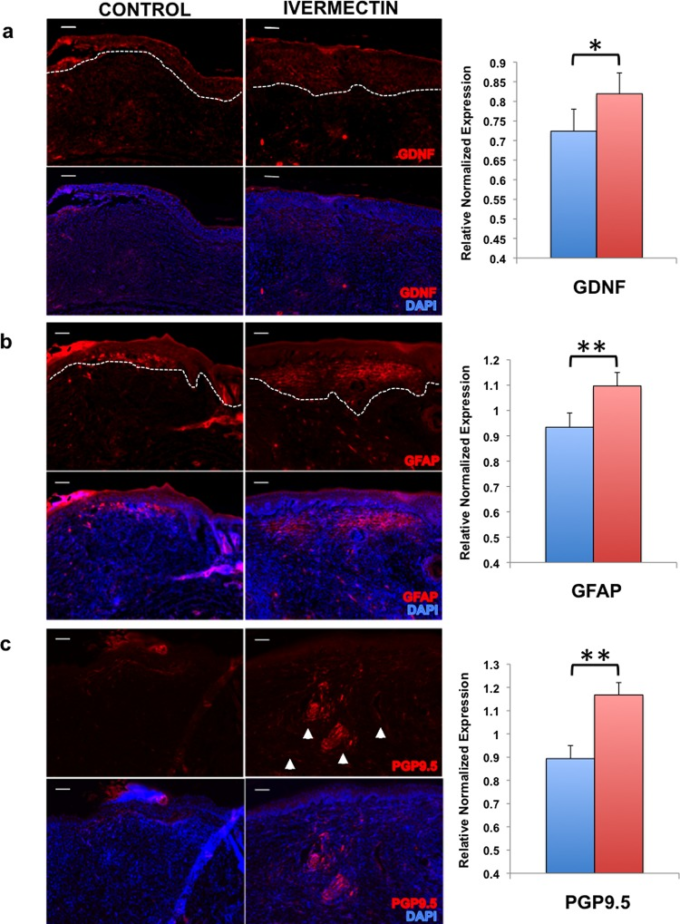
イベルメクチンは、神経成長を促進するグリア様細胞の分化を誘導することで創傷治癒を促進する。創傷部位の凍結切除を免疫染色し、(a)グリア由来成長因子(GDNF)(b)グリア線維性酸性タンパク質(GFAP)および(c)末梢神経マーカー(PGP9.100μM。*P≦0.05,**P≦0.01,**P≦0.001;両側 t 検定により決定。エラーバーは平均±SDを示す。
3. 議論
末梢神経系は生まれながらにして修復能力を持っているが、特にヒトのように再生能力が制限された生物では、このプロセスが損なわれるケースが様々に存在する。現在の治療法の限界を考えると、神経再生を促進するための新たな治療法の開発が急務となっている。その一つのアプローチとして、末梢神経の修復が非常に効率的である下等脊椎動物のメカニズムを調べることが挙げられる。駆虫剤イベルメクチンは最近、再生期のカエルの神経を強化することが示された。17 蛍光標識されたドナー眼のプリモルディアまたは標識されていない宿主オタマジャクシを、宿主動物の脇腹に異所性に移植する前に、イベルメクチンの有無にかかわらず、イベルメクチンで処理した。これらの実験から、非神経細胞間質組織のイベルメクチン処理は、隣接して移植された神経細胞組織からのニューロンの拡大を誘導するために利用できることが明らかになった。これらの結果は驚くべきものであったが、この現象がこの両生類モデルに特有のものなのか、それとも哺乳類系でも再現可能なのかを理解することが重要だ。
本研究では、哺乳類における末梢神経の成長促進におけるイベルメクチンの役割を明らかにした。その結果、イベルメクチン処理した線維芽細胞を用いて末梢神経幹細胞を共培養すると、末梢神経幹細胞の増殖と遊走が促進されることを発見した。さらに、イベルメクチンは線維芽細胞に細胞外グルタミン酸の取り込みを増加させ、神経栄養因子GDNFを発現させ、シュワン細胞の特徴である細長い形態やGFAPの発現を示すグリア様表現型を発現させることを発見した。このような形質転換されたグリア様細胞は、神経細胞の増殖を可能にし、神経再生をサポートする環境を提供している。さらに、マウスの創傷治癒モデルを用いて、神経再生促進におけるイベルメクチンの生体内試験での生理的役割を実証した。重要なことに、我々の結果は、哺乳類の組織再生における末梢グリアの重要な役割を示唆している現在の知見と一致している。最近、皮膚損傷が末梢グリアを活性化することが、生体内試験の全厚皮膚修復モデルで示された。24 同様に、シュワン細胞前駆体を移植したマウス切断モデルでは、指先の再生を促進するparacrine因子が局在的に分泌されていることが示された25。
現在、FDA(アメリカ食品医薬局)(アメリカ食品医薬局)承認のイベルメクチンは疥癬、シラミ、オンコセルカ症を含む様々な感染症の治療に使用されている26 が、その使用は末梢神経の修復の臨床応用にも応用できる可能性がある。イベルメクチンは、寄生する無脊椎動物の神経細胞や筋肉細胞にのみ存在するグルタミン酸チャネルと結合して活性化し、最終的には筋肉の麻痺や死に至ることが知られている26 。哺乳類では、これらのタイプのグルタミン酸チャネルは脳でしか発現していないと考えられており、血液脳関門によって保護されていることから、ヒトへの使用は安全であると考えられている。実際、臨床薬や動物用医薬品に使用されているものと同程度の低レベルでは、これらの哺乳類の脳特異的なグルタミン酸-ゲート塩化物チャネルには、本質的に識別可能な影響はない。しかし、イベルメクチンの高濃度(すなわち、マイクロモルの範囲)では、イベルメクチンがこれらのチャネルに作用することが示されている。ヒトのグリシン受容体19,ニワトリ27,げっ歯類28,ヒトのγ-アミノ酪酸A(GABAA)受容体29,ニワトリとヒトのα7ニコチン受容体30,ヒトのピューリン作動性受容体P2X420とP2X7を含む複数のチャネルのアロステリックモジュレーターとして作用することが示されている31。 31 これらの受容体の多くは、哺乳類、特にヒトでは複数の細胞型に存在しており、イベルメクチンの効果は当初考えられていたよりも広範囲に及んでいる可能性が示唆されている。
創傷治癒の微小環境の中には、治癒過程に関与する複数の細胞タイプが存在し、その多くは関連するイオンチャネルを多数発現していることが知られている。例えば、ヒト線維芽細胞は、グリシン、32 GABA、33 ピュリネリック、34 ニコチンなどの前述の受容体の多くを発現していることが示されている35 。このような内因性の発現と、様々な異なるイオンチャネルや受容体へのイベルメクチンの比較的非特異的な結合と機能の組み合わせにより、イベルメクチンが試験管内試験および生体内試験システムでどの特定の受容体または受容体に作用しているかを特定することはいささか困難である。イベルメクチンと複数のチャネルおよび受容体との相互作用の可能性がこのように複雑であるため、作用機序に関する洞察が制限されている。しかし、本研究で得られた知見は、イベルメクチンの下流での有効性と潜在的な臨床的有用性の両方において、イベルメクチンのより広範な影響を示す説得力のある証拠を提供するものである。
イベルメクチンの生体内での神経細胞およびグリアの増殖に対する効果は非常に顕著であったが、創傷閉鎖に対するイベルメクチンの効果はそれほど重大ではなかったことを認識しておくことが重要である。健康なマウスの創傷治癒を実験的に改善することは特に困難であることが認められている36 。特に、本研究で使用した BALB/c 野生型マウスは比較的早く治癒することが知られている37 。例えば、糖尿病、自己免疫疾患、化学療法などの他の合併症と関連していることが多い神経障害の様々な生体内試験モデルで同様の実験を繰り返すことができる38。さらに、イベルメクチンが線維芽細胞にGDNFを分泌させることを示していることから、この手法は、虚血組織の神経支配を促進するための潜在的な鎮痛剤39としてGDNFの内因性局所送達を誘導する方法としても応用できる40。
4. 材料と方法
4.1. hiNSCの生成
21 簡単に言えば、ヒト新生児包茎線維芽細胞(ジョナサンGarlick博士、タフツ大学からの贈り物)をポリシストロニックベクター(Addgene#24603,ホセCibelliからの贈り物)でリプログラミング因子OCT4,KLF4,SOX2,およびcMYCを発現するレンチウイルスに感染させた。濃縮したウイルスを、1-2のMOIで線維芽細胞培地中でポリブレン(Millipore)と組み合わせて使用した。培地を最終的にhiNSC培地に変更した:ノックアウト(KO)ダルベッコの改変イーグル培地(DMEM)は、20%KOキセノフリーSR、20 ng/mL組換えbFGF、1%グルタミン酸、1%抗生物質-抗真菌剤、および0.1 mM b-メルカプトエタノールを補充し、これはまた、1%KO成長因子カクテル(GFC)(Invitrogen社)を含んでいた。細胞をトリプシン化し、以前にマイトマイシンCによって不活性化されたマウス胚性線維芽細胞(MEF)フィーダー層上にプレートした。30日目以降では、コロニーは機械的にピックし、新鮮なmitotically不活性化MEFにpassagedした。コロニーは、酵素的にMEFフィーダー上のTrypLE(Invitrogen)を使用してパッセージすることによって拡大した。各摘出コロニーは、1つのhiNSCラインを表している。
4.2. イベルメクチンの調製
イベルメクチンの様々な製剤を、Sigma-Aldrich (Natick, MA)、Tocris (Minneapolis, MN)またはCayman Chemical (Ann Arbor, MI)を含む複数の供給源から購入した。本剤のすべての調製物について、その凍結乾燥形態からの再構成のためにDMSOを使用した。
4.3. 三次元コラーゲンゲルhiNSC共培養
ヒト真皮線維芽細胞(hDFs)とhiNSCsを1μMイベルメクチンまたは1μM DMSO(コントロール)で6時間処理した。コラーゲンゲルミックスは、68% 1.5×DMEM(Invitrogen)、30% Rat Tail Collagen I(Corning)、および2.5% 0.8 M NaHCO3を使用した。最下層のコラーゲンゲルを104 hDFs/ゲルを20μLのゲルに播種し、4ウェルプレート(Nunc)にピペッティングし、37℃で20分間部分的に固化させた。最上層は、30μLゲル中の104標識hiNSCs/ゲルで播種し、最下層の上にピペッティングし、37℃で完全にセットすることを許可した。完全に固化したら、hiNSC培地をウェルに添加し、FGFなしでhiNSC培地中で5日間3Dコンストラクトを培養した。
4.4. 神経細胞移行アッセイ
hDFsは、細胞培養プレートの底部に播種し、その後1μMのイベルメクチンまたは1μMのDMSO(コントロール)で6時間、および残留薬物を除去するために1×リン酸緩衝生理食塩水(PBS)で繰り返し洗浄した。親油性蛍光色素DiD(Invitrogen)で標識した分化ニューロンを、celllstartでコーティングした(Invitrogen)トランスウェル(8μMの細孔サイズ)上に播種し、これをhDFを含むウエルに入れた。細胞を、機能的ブロッキング抗体ヤギ抗GDNF(AF-212-NA、R&Dシステムズ、ミネアポリス、MN)の存在下または非存在下で、10μL/10mLの比較的低濃度または100μL/10mLの高濃度で、低血清培地(潜在的な細胞増殖を最小限に抑えるため)で一晩培養し、トランスウェルの底部に移動するDiD標識ニューロンの相対的な数を定量化した。
4.5. グルタミン酸取り込みアッセイ
hDFs を様々な濃度のイベルメクチンまたは DMSO で一晩処理し、細胞培地を採取してろ過した後、製造業者の指示に従ってグルタミン酸アッセイ(Sigma)を行った。
4.6.qRT-PCR
トータルRNAをRNeasy Miniキット(Qiagen)を用いて単離し、製造業者の指示に従ってMLV-reverse transcriptase(Invitrogen, CA)を用いてcDNAを生成した。定量的RT-PCRは、iQ5リアルタイムPCR検出システム(BioRad)を用いて行い、ハウスキーピング遺伝子GAPDHに基づいて正規化した。すべてのプライマー配列を表S1に記載した。また、GeneQuery Human Schwann Cell Biology qPCR Array Kit (ScienCell Research Laboratories, Carlsbad, CA)をメーカーの指示に従って行った。
4.7. GDNF ELISA法
GDNF ELISA(Promega)は、様々な濃度のイベルメクチンまたは DMSO で 4 日間処理した hDF から採取し、ろ過した細胞培地を用いて、製造者の指示に従って実施した。
4.8. 免疫染色
すべての試験管内試験培養物および生体内試験組織サンプルを4%パラホルムアルデヒドで固定し、1×リン酸緩衝生理食塩水(PBS)で洗浄した。三次元コラーゲンゲルと切除した組織は、免疫染色の前に凍結切除した。サンプルをブロッキングバッファーでインキュベートした。10%ヤギ血清と0.1%トリトンX-100を含む1×PBS。一次抗体をブロッキングバッファーに添加し、4℃で一晩サンプルとインキュベートした。翌日、サンプルを1×PBSで数回洗浄し、ブロッキングバッファー中の対応する蛍光標識二次抗体と室温(光を避けて)で1時間インキュベートした。核はDAPI(Invitrogen)でカウンター染色した。この研究で使用したすべての抗体は、表S2に記載されている。
4.9. 顕微鏡検査
明視野および蛍光画像は、Keyence BZ-X700顕微鏡と関連ソフトウェアを使用して得られた。全マウント3Dサンプルの画像は、オリンパスMVX10マクロスコープと関連ソフトウェアを使用して撮影された。
4.10. 生体内試験創傷アッセイ
動物実験は、タフツ大学で承認されたプロトコル#M2013-142の下で実施した。体重20〜25gの8週齢の雄性BALB/cマウス(チャールズリバーラボラトリーズ)を、最初に背中を剃り、ナイル(カーター・ウォレス社、ニューヨーク、ニューヨーク)で脱毛させた。マウスは、その後、イソフルランで麻酔し、8 mmの生検パンチは、2つのラウンド、フル厚さの切除創を作るために利用された。右側の創傷では、10μMのイベルメクチンまたはDMSO(コントロール)を含む30μLのコラーゲンゲルを創傷にピペッティングし、固化させることができた。左側の創傷は未処理のままで、追加のコントロールとして機能した。両方の創傷をTegadermを用いて封鎖し、創傷の進行を12日間にわたって追跡した。1つの実験につき3匹の動物を1つの処置につき使用した。各試験の終了時に、動物を安楽死させ、さらなる分析のために創傷部位の組織を切除した。
4.11. 統計学
すべてのデータは、実験ごとに分析した少なくとも3つの独立したサンプルを含む、平均±SDとして表される。統計学的に有意な差は、統計ソフトウェアSYSTAT12(Systat)を使用して、両側t検定またはポストホックTukey検定を用いた一因子ANOVAによって決定された。0.05未満のP値は有意であると考えられた。