コンテンツ
www.ncbi.nlm.nih.gov/pmc/articles/PMC8959108/
Front Nutr. 2022; 9: 827384.
オンライン公開 2022年3月8日
Jacqueline A. Barnett,1 Maya L. Bandy,1 and Deanna L. Gibsoncorresponding author1 ,2 ,*.
要旨
グリホサートおよびグリホサート系除草剤への環境暴露は、腸-脳-マイクロバイオーム軸を通じて間接的に世代を超えて神経発達および行動に悪影響を及ぼす可能性がある。
グリホサートがこのような影響を引き起こすメカニズムとして、宿主と腸内細菌叢の正常な共生関係を破壊することが考えられている。グリホサートは、ラクトバチルス属、ルミノコッカス属、ブチリコッカス属などのマイクロバイオームの常在菌を殺し、インドール、L-グルタミン酸、SCFAなどの腸-脳-マイクロバイオーム軸を介して作用する主要な微生物代謝産物の減少をもたらす。
腸内のグリホサート耐性微生物は、炎症性サイトカインや活性酸素の産生を増加させる可能性があり、その結果、HPAの活性化が進み、神経発達に影響を与えるグルココルチコイドの産生を増加させる可能性があるとされている。さらに、腸内細菌叢の母親の移転は、世代を超えて、免疫と神経発達に影響を与える可能性がある。
本論文では、グリホサートへの慢性的な曝露が腸内細菌叢に及ぼす影響と、神経精神疾患の発症率上昇と相関する腸脳軸への潜在的影響について考察している。
キーワード:不安、うつ、自閉症(ASD)、農作業、生態毒性学、グリホサート、世代間影響
亜毒性グリホサートへの曝露は、腸内細菌叢を破壊し、神経精神疾患に影響を与える可能性がある
英語には、”4文字言葉”という慣用句がある。この慣用句は、非常に不敬な言葉、スキャンダラスな言葉を指すことが多く、このベールに包まれた説明のもとでのみ定義されるべきものである。しかし、農業の現場で耳にする最も凶悪な言葉は、5文字の”weeds “(雑草)である。
雑草は栄養分や資源を奪い合い、農作物にとって大きな脅威となる。雑草の繁殖が制御できない場合、北米だけでも年間430億ドルの損失が生じると推定されている(1)。幸いなことに、現代の農業従事者は、雑草を管理・制御し、収穫量を最大化するために使用される除草剤の数々を利用することができる。ある除草剤は、商業農家に大きな影響を与えた。
*
グリホサートは、1974年にラウンドアップ®という商品名で初めて市場に投入された。グリホサートは、その幅広い作用機序と柔軟な使用形態により、革命的な存在となった。1990年代初頭にグリホサート耐性作物が誕生したことで、その使用量は大幅に増加した。
2007年までに、グリホサートは米国で最も広く使用されている除草剤となり、年間約1億8000万ポンドが商業用農業に、さらに800万ポンドが家庭菜園に使用されるようになった(2)。過去30年間、こうした散布量の増加により、多くの作物の残留基準値が上昇し、食品中のグリホサート残留量が増加した(3)。
消化器系と腸内細菌が全身の複数のシステムと双方向のコミュニケーションを行っていることを考えると、食事は腸の健康を左右する重要な要素であり、全身の健康やウェルビーイングに大きな影響を与える可能性がある(4)。最近、腸と脳と腸内細菌叢の間に関連性があることが発見された。
この腸-脳-マイクロバイオーム軸は、食事が精神的健康に影響を与えるメカニズムを提供する。消化管マイクロバイオームの変化は、不安、うつ病、アルツハイマー病、パーキンソン病など、複数の精神神経疾患や神経炎症性疾患と関連している(5, 6)。
*
グリホサートは、その幅広い除草作用で市場を席巻している。しかし、グリホサートの抗菌作用は1970年にまでさかのぼる。植物と同様、グリホサートの毒性は広域で、細菌、真菌(7)、原生生物(8)など多くの微生物を殺傷する。
当時は、これらの効果は取るに足らないもの、あるいは植物病原菌の防除に有益とさえ思われたことだろう。現在では、腸内マイクロバイオームとそれが人間の健康や病気に及ぼす影響について知られていることから、グリホサートが消化管マイクロバイオームなどの二次的手段を通じて人間の健康や行動に影響を及ぼすことが懸念される。
さらに、若者の間で不安やうつ病の割合が憂慮すべき速さで増加していることも、この懸念に拍車をかけている。北米では、18~25歳の人の不安の割合は、2008年から2018年の間にほぼ2倍になっている(9)。こうした増加は、昔に比べてメンタルヘルスがオープンに語られるようになったことが原因かもしれないが、この時期はグリホサート耐性のトウモロコシや大豆の作物が導入され、広く使用されるようになった時期とも重なる。
農業におけるグリホサート耐性作物の使用は、1997年から2009年にかけて3倍になった(10)。これに伴い、トウモロコシや大豆など、いわゆる「欧米型」の食事パターンのかなりの部分を占める作物の最大残留基準値が引き上げられた(図1)。グリホサートの一日摂取許容量(ADI)とは、人が直接毒性を受けることなく暴露できるグリホサートの量のことだ。
アメリカは世界で最も高いADIの一つであり、現在1.75 mgグリホサート/キログラム体重/日に設定されている(11)。しかし、グリホサートは、腸-脳-マイクロバイオーム軸などの二次的な手段で健康や精神神経疾患感受性に影響を与え、その影響は何世代にもわたって感じられる可能性がある。
ここでは、亜毒性グリホサート曝露が世代を超えて脳の発達や行動に影響を及ぼすメカニズムを提案し、今後の研究の方向性を提示する我々の見解を紹介する。しかし、グリホサート曝露とメンタルヘルスの関係の因果関係を真に理解するためには、より詳細でメカニズムに基づいた研究が必要である。
図1 過去30年の間に、米国内の青年および若年成人におけるうつ病の割合は驚くべき速さで増加している
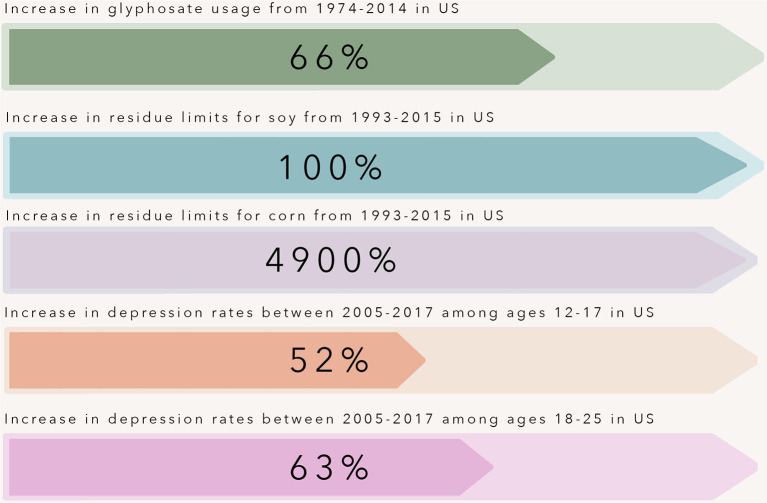
この時期は、グリホサート耐性のトウモロコシと大豆の作物が導入され、広く使用されるようになった時期と重なる。
農業におけるグリホサート耐性作物の使用は1997年から2009年にかけて3倍に増え、それに伴い、いわゆる「欧米型」食事パターンの大部分を占めるトウモロコシや大豆などの作物に対するグリホサートの最大残留基準値が引き上げられた
腸-脳-マイクロバイオーム軸
消化器系とそこに生息するマイクロバイオームは、中枢神経系と複雑なクロストークを形成している。トリプトファン、グルタミン酸、複合糖質などの食事成分は、多くの細菌の代謝産物の基質として機能する。トリプトファンやグルタミン酸などのアミノ酸は、キヌレニン、セロトニン(5-HT)、ドーパミン、γ-アミノ酪酸(GABA)、エピネフリンなどの多くの神経活性物質を合成する際の前駆体として機能する(12, 13)。
腸管上皮内の腸クロム親和性細胞は、腸管由来の5-HTの主要な生産者である。トリプトファン代謝物は、腸内でキヌレニンと5HTを合成するための重要な前駆体である。また、これらの代謝物は循環血液中に入り、血液脳関門を通過することで、脳内のセロトニン合成に影響を与えることができる(14)。
さらに、Clostridium sporogenesやLactobacillus spp.などの特定の常在細菌は、トリプトファンを3-インドールプロピオン酸(IPA)やインドール-3-アルデヒド(I3A)などの化合物に代謝することができる(15)。
IPAは、グリア細胞やアストロサイトの活性化を低下させ、DNA損傷を防ぎ、アルツハイマー病の病因の主要な要因であるβアミロイド線維の形成を阻害する、強力な神経保護作用のある抗酸化物質である(15)。I3Aは腸管免疫細胞内のアリール炭化水素受容体(AhR)に作用し、炎症と組織再生に顕著な役割を果たすことによって、粘膜の恒常性維持に重要なサイトカインであるIL-22の産生を増加させる(15)。したがって、腸は、脳に広範囲な影響を及ぼす分子メカニズムを起動させるゲートウェイとして機能している。
*
腸内細菌は通常、宿主と共生関係にあり、特に生後間もない時期に免疫系を形成する(16)。樹状細胞は、腸管上皮と相互作用する微生物を日常的に採取し、BおよびTリンパ球にシグナルを送り、適切な免疫応答を行わせている(16)。IL-6、TNF-α、IL-1βなど、腸管固有層で産生されるサイトカインは、全身循環に入り、広範囲に影響を及ぼす可能性がある。
これらのサイトカインは、強力な神経炎症特性を有することが示されている。IL-6とTNF-αは、アストロサイト、ミクログリア、ニューロンなど、脳内の多くの細胞で発現している(17, 18)。IL-6はオリゴデンドロサイトの分化や末梢神経の再生など神経組織内の恒常性維持に重要な役割を果たし(19)、TNF-αはグリア細胞の活性化や組織リモデリングなどの機能制御をもたらす(20)。
しかし、IL-6やTNF-αの高値は、多発性硬化症(19)、パーキンソン病(21)、アルツハイマー病(22)などの神経炎症性疾患の病態に重要な役割を果たすことが示されている。GABAは、中枢神経系(CNS)内の主要な抑制性神経伝達物質である。
バクテロイデス属(23)や一部のラクトバチルス属(24、25)など、常在細菌の一部は、アミノ酸であるグルタミンを前駆体として、腸内でGABAを合成することが分かっている。GABAがリラックス効果をもたらすことから、これらの菌の治療効果を利用して不安障害やうつ病を治療する方法が研究されている。
*
小腸で分解されなかった糖質は大腸に入り、そこで細菌によって短鎖脂肪酸(SCFA)に代謝される。SCFAは大腸細胞の主要なエネルギー源であり、バリア機能と恒常性の維持に重要な役割を担っている(26)。さらに、SCFAは、グルカゴン様ペプチド1(GLP-1)、ペプチドYY(PYY)(27)およびコレシストキニン(CCK)(28)などの腸管ホルモンを生産する腸内分泌細胞(L細胞)の刺激に役立っている。
GLP-1、PYYおよびCCKは全身循環に入り、そこで脳に作用して満腹感を促進する(29)。これらのホルモンはまた、門脈を通じて肝臓に移動し、血糖のホメオスタシスを調節し、タンパク質と脂肪の消化を助ける。CCKはCNS全体に存在し、CCKレベルが高いと、ヒト(30)およびげっ歯類(31-33)において不安およびパニック障害を促進することが示されている。
*
代謝物を介したコミュニケーションに加え、腸と脳は腸管神経系を介して直接コミュニケーションをとっている。腸管グリア細胞および腸管神経細胞は、腸管神経叢および粘膜下層に存在し、腸管神経系とCNSとの間の情報伝達を促進している。
迷走神経の求心性ニューロンは、腸管上皮を神経支配している(34)。これらのニューロンは、微生物の代謝物や微生物由来の神経伝達物質および神経ペプチドを認識する受容体を持ち、これらのシグナルをCNSに伝達して多くの生物学的プロセスを制御している(35-37)。
このコミュニケーションは双方向性であり、CNSは消化器系内の多くの変化を引き出すことができる。ストレスに応答して、CNSは視床下部-下垂体-副腎(HPA)軸を活性化させる。視床下部はコルチコトロピン放出因子の産生を開始し、下垂体から副腎皮質刺激ホルモンを放出させ、副腎からのコルチゾールの合成および放出を開始させる。
コルチゾールは、いくつかのシステムを調節することによって、ストレス要因に対処できるように体を準備する。コルチゾールは、グルコースの分解とグルカゴン抑制を誘発し、それによって血糖値を上昇させ、ストレス要因と戦う、あるいはストレス要因から逃れるための十分なエネルギーを身体に供給する。コルチゾールはまた、消化を阻害し、腸管バリアの完全性に影響を与える。消化管内の微生物の存在は、乳児のHPA軸の発達とストレス反応に寄与している。
特定の病原体を持たない(SPF)マウスからレシピエントである無菌マウスに糞便中の微生物叢を移植すると、無菌で生まれたマウスのHPA軸反応の変化がある程度回復したが、移植が生後早期に行われた場合に限られており、HPA軸の発達にコロニー化した微生物叢が関与していることが示唆された(38).
*
これらの知見は、食事と消化管マイクロバイオームと行動の間の微妙なバランスを浮き彫りにするものである。アミノ酸、食物繊維、脂肪などの食事成分は、消化管マイクロバイオームとその代謝産物の強力なメディエーターである。トリプトファン、SCFA、胆汁酸などの微生物代謝産物は、中枢神経系や代謝に影響を及ぼす可能性がある。
同時に、長時間のストレスとHPA軸の活性化は、腸の透過性に影響を与え、消化管マイクロバイオームの構成を変化させ、日和見病原体の増殖を促進し、有益と考えられる細菌属を減少させる可能性がある(図2)。腸と脳は相互に関連しており、両者が互いに影響を及ぼし合っていることは明らかである。
しかし、グリホサートなどの環境毒素が腸内細菌の種類にどのような影響を与え、その結果、腸脳軸にどのような変化をもたらすかは、依然として不明であり、懸念すべき点である。
図2 消化器系とその常在微生物群は、中枢神経系との複雑なクロストークに関与している
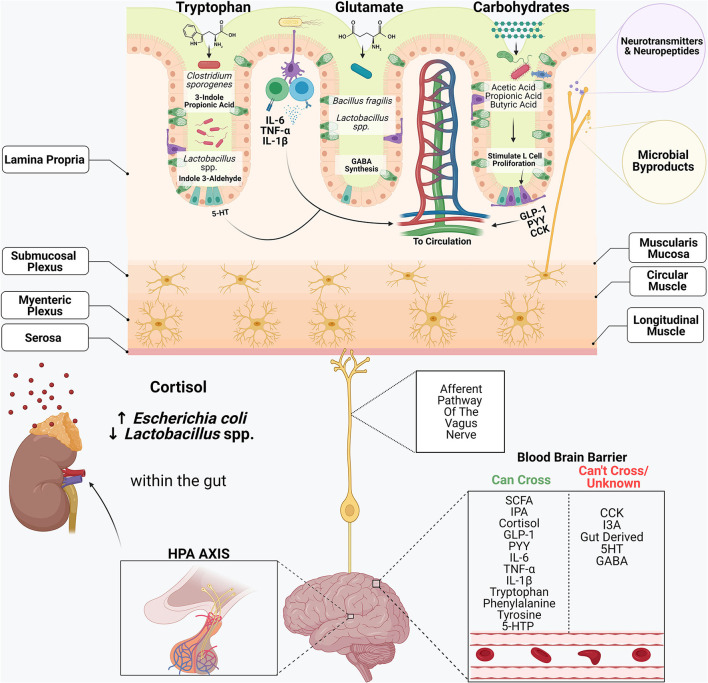
トリプトファン、グルタミン酸、複合糖質などの食事成分は、多くの細菌の代謝産物の基質となる。トリプトファンやグルタミン酸などのアミノ酸は、セロトニン(5-HT)、ドーパミン、γ-アミノ酪酸(GABA)、エピネフリンなど多くの神経活性物質を合成する際の前駆体として機能する。
腸管上皮に存在する腸クロム親和細胞は、腸管由来の5-HTの主要な生産者である。Clostridium sporogenesやLactobacillus spp.などの特定の常在細菌は、トリプトファンを3-インドールプロピオン酸(IPA)やインドール3-アルデヒド(I3A)といった化合物に代謝する。
Bacteroides属と一部のLactobacillus属は、アミノ酸のグルタミンを前駆体として腸内でGABAを合成する。短鎖脂肪酸は、グルカゴン様ペプチド1(GLP-1)、ペプチドYY(PYY)、コレシストキニン(CCK)などの腸管ホルモンを生産する腸内分泌細胞(L細胞)の刺激に重要な役割を果たす。
迷走神経の求心性ニューロンは、腸管上皮を支配し、微生物の代謝物、微生物由来の神経伝達物質や神経ペプチドを認識する受容体を持ち、これらの信号をCNSに伝達し、多くの生物学的プロセスを制御している。ストレスに応答して、CNSは視床下部-下垂体-副腎(HPA)軸を活性化させる。
コルチゾールはまた、消化を阻害し、腸管バリアの完全性に影響を与え、マイクロバイオームの組成を変化させる
グリホサートは腸内細菌を変化させ、精神神経症状を誘発・促進させる
グリホサートは、植物と微生物の両方で芳香族アミノ酸の合成に関与する代謝経路であるシキメート経路を阻害することによって作用する。動物モデルでは、グリホサートとグリホサート系除草剤の両方が腸内細菌叢の組成に変化を引き起こしている。
いくつかの分類群の変化は用量依存的あるいは製剤依存的であるように見えるが、特定の分類群はグリホサートの殺菌効果に対して特に感受性が高い(39)。このような分類群は、ヒトの消化管マイクロバイオームのマイナーな構成要素であり、腸-脳-マイクロバイオーム軸の中で重要な役割を果たすLactobacillus spp.である。
ラクトバチルス属は、腸内でトリプトファンを分解して、腸脳軸に不可欠なメディエーターであるインドールにすることができる(40)。上述のように、I3AはAhRを介して粘膜バリア機能の維持を助け、IL-22の産生をもたらす(41)。
AhRは、体内の多くの炎症促進および抗炎症経路を仲介し、環境、食事、微生物と宿主反応との関係におけるメディエーターであることが示唆されている(42)。細菌由来のインドールとAhRの相互作用は、健康寿命の延長(43)から、脳アミロイドーシスや高齢者の認知機能低下の病因に関与する炎症性サイトカインの減少(44)まで、幅広い健康利益を与えることが実証されている。
*
グリホサートとグリホサートベースの除草剤への暴露は、どちらもRuminococcaceaeのメンバーを減少させることが示されている(45)。腸内細菌叢におけるRuminococcaceaeの減少は、パーキンソン病(46)、統合失調症(47)、うつ病(48)などの複数の神経精神疾患状態に関与しており、ネズミの社会行動を調節する(49)。
Ruminococcaceaeのメンバーは、L-グルタミン酸を含む、気分や行動を変えることができる様々な代謝産物を生産している。アミノ酸であるL-グルタミン酸は、いくつかの方法で腸と脳の間のコミュニケーションを媒介する。まず、L-グルタミン酸は腸管の内腔側に存在する受容体と相互作用し、隣接する細胞や神経細胞へ情報を伝達する。
L-グルタミン酸の感知機構は、腹部迷走神経の求心性線維と遠心性線維の両方に存在する(50)。L-グルタミン酸はGABAを合成する前駆体でもあり、CNS内のGABAの減少は、うつ病(51)、不安症(52)、月経前不快気分障害(53)などの神経精神疾患状態と関連していることから、腸内細菌の代謝物が精神衛生に影響を与えるメカニズムとして期待されている。
糞便マイクロバイオーム内のGABA産生菌の減少は、うつ病に関連する脳のサインと負の相関がある(13)。GABAの合成に不可欠な役割を果たす消化管マイクロバイオームには、他にBacteroides属とLactobacillus属があり、どちらもグリホサートに対して高い感受性を示す(54)。
腸管由来のGABAが血液脳関門を通過して中枢神経系内のレベルに直接影響を与えるかどうかは不明であるが、GABA産生菌を投与すると、健常動物の中枢神経系内の神経伝達物質受容体の発現に影響を与えることが示されており、うつや不安を引き起こす重要な脳領域である前頭前野および扁桃体のGABA受容体の発現が減少することもわかっている(24)。
実際、L. rhamnosusを含むGABA産生菌で治療した動物は、不安やうつ様行動の減少、ストレス誘発性コルチコステロンレベルの減少を示した(24)。GABA作動性システム内の興奮と抑制のバランスを維持することは、適切な機能を発揮するために極めて重要であり、早期の生活の乱れは、自閉症(55)、統合失調症(56)、トゥレット症候群(57)などの生涯にわたる認知および感情障害の発症に関連している。
*
ストレスは、それが”flight-or-fight “反応であろうと炎症反応であろうと、CNS内で同じ結果をもたらす。トラブルの最初の兆候で、HPA軸が活性化され、グルココルチコイドが放出され、”flight-or-fight “反応に役立つ。
IL-1β、TNF-α、IL-6などの古典的な「炎症性」サイトカインは、HPA軸を活性化することがある。これらのサイトカインのそれぞれは、高用量のグリホサート投与に反応して増加する(58)。コルチゾールを含むこれらのグルココルチコイドは胎盤を通過し、胎児のHPA軸の発達と成熟に重要な役割を果たし、子孫のストレス反応を増加させる(59-61)。
Bifidobacterium infantisを含む特定の細菌種は、げっ歯類の忌まわしいストレス反応に有益な効果をもたらすことがある(38)。最近の研究では、グリホサート感受性酵素(EPSPSクラスI)およびグリホサート耐性酵素(EPSPSクラスII)の存在により、特定の微生物がグリホサートの有害な影響に抵抗する能力が検討されている(39)。ビフィドバクテリウム属のいくつかの亜種はグリホサート感受性クラスI EPSPS酵素を持っており、ビフィドバクテリウム属はグリホサートの影響に特に敏感である可能性が示唆されている(39)。
*
グリホサートへの暴露は、Ruminococcaceae、Butyricoccus spp.、Lactobacillus spp.、Clostridium spp.、Bacteroides spp.などのSCFA産生菌の量を減らす。
最近の研究では、SCFAは腸の恒常性とバリア機能の維持に加えて、腸-脳-マイクロバイオーム軸におけるコミュニケーションに基本的な役割を果たすことが強調されている。非コロニー化無菌マウスに暴露すると、ミクログリアの発達が変化するが、これは酢酸、プロピオン酸、酪酸の経口投与により改善される(62)。
ミクログリア細胞は、CNS内に見られる主要な免疫細胞の一つであり、神経炎症の促進および解決に重要な役割を果たす。アルツハイマー病やパーキンソン病などの神経炎症性疾患の病態におけるミクログリアの役割は、これまで広く研究されてきた。
しかしながら、新たな証拠により、免疫調節異常もまた、強迫性障害を含む精神および行動障害の病理に寄与していることが示唆されている(63)。SCFAは、セロトニン、ドーパミン、ノルアドレナリン、アドレナリンなど、CNS内の神経伝達物質の形成に関与する酵素の発現レベルを調節する上で重要な役割を担っている(62)。
SCFAの発現の変化は、自閉症スペクトラム障害、うつ病や不安神経症を含む気分障害、アルツハイマー病、パーキンソン病など、多くの疾患と関連している。さらに、Lactobacillus spp.を含むSCFA産生菌や他の酪酸産生菌の減少は、活性酸素種(ROS)の形成を介して酸化ストレスに寄与する。
CNSは、その高い酸素要求性により、活性酸素の影響に特に敏感である(64)。高用量(65)および低用量(66)のグリホサート暴露は、スーパーオキシドジスムターゼやグルタチオンレダクターゼなど、活性酸素の低減に必要な主要酵素を減少させる。すなわち、活性酸素を減少させる酵素の直接的な減少と、有害な酸化ストレスに直面して保護効果を発揮する常在微生物の減少である。
同様に、グリホサートは、炎症性サイトカインの過剰発現を通じてHPAを活性化すると同時に、ストレスを緩和するのに重要なマイクロバイオームメンバーを除去する可能性がある。
*
消化管マイクロバイオームのある種のメンバーは、腸内でグリホサートを変換する能力を持っている可能性がある。環境中では、土壌微生物がグリホサートの分解に大きな役割を果たしている。グリホサートの約70%は、グリホサートと同様の毒性を持つアミノメチルホスホン酸(AMPA)に分解される。
Pseudomonas spp.やAlcaligenes spp.など、土壌マイクロバイオームや消化管マイクロバイオーム内で見つかるいくつかの種は、グリホサートをサルコシンに代謝することができる(67)。サルコシンはグリシンの合成と分解の過程で自然に生じる副産物であり、多くの食品に含まれている。
最近の研究では、サルコシンには神経調節作用があることが示されている。具体的には、ある種の抗精神病薬による治療に加えてサルコシンを補給することで、統合失調症患者の症状が著しく低下することが報告されている(68)。この効果は、サルコシンがタイプ1グリシントランスポーター阻害剤及びグリシンアゴニストとして作用することにより、脳内のグリシン濃度を高め、N-methyl-D-aspartate(NMDA)受容体を活性化するためだと考えられている(68)。
また、サルコシンの投与により、統合失調症患者における大うつ病の症状が改善された(69)。しかし、健康な人でもストレスによってNMDA受容体が活性化されると、ミクログリアが活性化され、CNS内で炎症性反応が増加することが研究で示されている(70)。
全体として、腸内細菌群のある種のメンバーは、グリホサートをAMPAに加えてサルコシンにも変換する可能性がある。個人におけるNMDA活性化の増加は、統合失調症などの精神神経疾患を患っている人には有益かもしれないが、そうでない健常者には有害な結果をもたらすかもしれない。
*
全体として、これらの知見は、グリホサートへの曝露、腸内細菌叢の変化、GABA作動性システム、HPA軸、ミクログリア細胞の形成の忌まわしい発達との間に興味深い相関があることを示唆している。さらに、微生物によるグリホサートの代謝は、NMDA受容体の活性化を変化させ、健康でない人の神経炎症を促進する可能性がある。
グリホサートが誘発する消化管マイクロバイオームの異常は、精神的健康や幸福に必要な多くの神経伝達物質の合成に影響を与え、有害な活性酸素の形成を促し、ストレス時に有益と考えられている細菌を減少させる可能性がある。この相関関係についてはまだ解明されていないが、食品中にグリホサートが残留していることが知られていることから、この関係を証明または反証するためにさらなる研究が必要である。
禁止するかしないか?それが問題だ
グリホサートは、それ自体がスキャンダラスで冒涜的な「4文字言葉」になっている。政治や宗教のように、議論を引き起こすことを恐れて食卓で話題にすることのできない言葉である。グリホサートを悪者扱いすることは魅力的だが、グリホサートが貴重なツールであることに変わりはなく、気づかれないうちに社会に真の利益をもたらしていることもある。
グリホサートとグリホサート耐性作物の使用により、トラクター使用量の削減、散布回数の減少、耕起回数の減少による温室効果ガス排出量の削減、これらの実践による土壌中の炭素保持量の増加が実現されている。グリホサートを広く禁止すると、炭素排出量が増加し、自動車を1177万台走らせることに匹敵すると推定されている(71)。
しかし、グリホサートが人間の健康、発育、病気のかかりやすさに真のリスクを与える可能性があることも事実であり、グリホサートとグリホサートをベースとする除草剤が散布後数年から数十年にわたって環境内に残留することが最近の研究で示されていることから、こうした結果は何世代にもわたって感じられるかもしれない(72)。
*
グリホサートは小さく、不揮発性で、イオン化しやすい分子であるため、グリホサートの研究自体も多くのユニークな課題を抱えている。こうした課題が食品サンプルの分析を難しくし、不正確にしている。その結果、作物に対して任意の最大残留基準値が設定され、我々の食品供給におけるグリホサートレベルの日常的モニタリングが明らかに欠如している。
逆相クロマトグラフィーによる誘導体化や抽出の最適化など、回収率を上げるための追加ステップは時間とコストがかかり、日常的な大規模サーベイランスではほとんど行われない。このような透明性の欠如と、現在までに行われた研究の多くで用いられた生理学的に適切でない用量が相まって、一般市民の間に恐怖の連鎖を永続させている。
*
ここでは、グリホサートが腸-脳-マイクロバイオーム軸の変化を通じて精神衛生と行動に影響を与える可能性があることを強調する。しかし、これらの理論を裏付ける文献で用いられている量は、平均的な北米人が食事や環境からの暴露だけで受ける量よりはるかに多い。
結局のところ、人々が毎日浴びているグリホサートのレベルを決定するためには、より優れた検出方法と日常的なモニタリングが必要である。そして、グリホサートの使用量や残留基準値の指針を得るために、生理学的に適切な投与量と人間の健康への影響を利用した研究をさらに行う必要がある。
環境中に広く存在するグリホサート使用の長期的な影響をよりよく理解するためには、今後、数世代にわたって低用量のグリホサート曝露の影響を調べる長期的な多世代研究が必要である。グリホサートが次のDDTになる可能性は十分にあり、使用を中止した後も有害な影響を及ぼし続けるかもしれない。
さらに、ケトジェニックダイエット、ベジタリアン、グルテンフリーダイエットなどの食事パターンを調査する今後の研究は、これらの食事パターンや食事によるグリホサート暴露を減らす可能性について、一般に誤った情報が多く存在し、そうした主張を裏付ける科学的証拠がないことを考えると、非常に有益である(73, 74)。
さらに、グリホサートを主成分とする除草剤の組成について、これらのアジュバントへの慢性的な曝露が健康に及ぼす影響を判断するには、より透明性の高い情報が必要である。全体として、我々は、グリホサートおよびグリホサート系除草剤への環境暴露は、世代を超えて神経発達および行動に悪影響を及ぼす可能性があると仮定している。
資金提供
JBはNatural Sciences and Engineering Research Council (NSERC)のPGS-Dによる資金援助を受けている。MBはUBC Undergraduate Research Award (URA)による資金援助を受けている。ギブソン研究室で行われたグリホサート研究は、UBC crowd funding: crowdfundraising.ubc.ca/projects/what-in-the-wheat/によって資金提供されている。
利益相反
著者は、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
