Contents
Intranasal drug delivery: opportunities and toxicologic challenges during drug development
www.ncbi.nlm.nih.gov/pmc/articles/PMC7829061/
Lea-Adriana Keller,1,2 Olivia Merkel,対応する筆者2とAndreas Popp1
要旨
過去10年以上にわたり、医薬品研究開発における経鼻投与への関心が高まっている。このレビュー記事では、中枢神経系の適応症だけでなく、局所的および全身的な送達のための経鼻投与に関する情報をまとめている。
経鼻投与は、その非侵襲性の特徴、迅速な作用発現、多くの場合、より標的を絞った投与による副作用の軽減など、標準的な全身投与システムと比較して多くの利点を提供する。剤形の制限や、最適化されなければならない毒性学的な側面がまだある。医薬品開発の分野における経鼻的薬物送達は、神経疾患の治療のための興味深い送達ルートである。
全身的なアプローチでは、中枢神経系に効率的に薬物を供給することができないことが多い。本レビューでは、解剖学的、組織学的、生理学的根拠を説明し、現在承認されている経鼻送達による投与のための薬剤を要約している。さらに、経鼻投与された化合物の毒性学的考察に焦点を当て、医薬品開発のために考慮すべき製剤の側面についても論じている。
グラフィカルアブストラクト
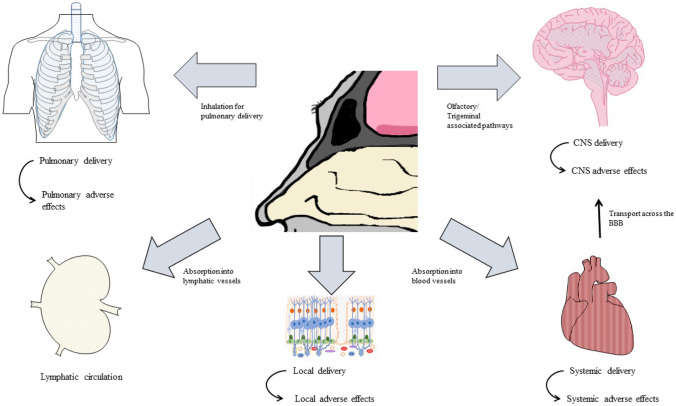
キーワード
経鼻薬物送達、嗅覚経路、鼻から脳への送達、鼻毒性
序論
経鼻投与は、何世紀にもわたって治療のために使用されていた。呼吸器管は、環境との主要な接触ゾーンであるため、細菌やウイルスなどの感染性粒子だけでなく、潜在的な治療のためのゲートウェイを意味する。前世紀において、経鼻的(IN)投与薬の使用は、主に、例えば、季節性鼻炎の局所症状または呼吸器の感染性疾患の治療に限定されていた。20世紀の終わりには、循環器系の適応症などの全身症状を治療するための代替ルートとして、経鼻投与ルートがより顕著になった。経鼻経路を介して中枢神経系(CNS)に薬物を送達する可能性は、1991年まで未踏のままであった。ウィリアム・フレイ2世は、脳の神経障害を治療するための鼻からの薬物送達方法の特許を提案した[1]。その後、鼻から脳への送達(nose-to-brain-delivery: ntb)の分野では特に、鼻から脳への送達への関心が高まってた。Ntbデリバリーは、全身デリバリーとは対照的に、血液脳関門(BBB)をバイパスしながら中枢神経系への治療薬のデリバリーを可能にする有望な代替手段である。従来の薬物送達アプローチと比較して、ntb送達は、嗅神経または三叉神経を介して直接中枢神経系にアクセスする非侵襲的な方法である。各製剤は、鼻腔から高次脳領域への細胞内および細胞外経路を含む異なる輸送メカニズムを好む。製剤開発の際には、血液循環、リンパ系、および脳脊髄液への吸収の影響を考慮しなければならない。いくつかの中枢神経系疾患については、特異的で効率的な治療用タンパク質が既に存在しており、他の疾患については、新しい生物製剤の開発が必要である。これらに共通しているのは、治療成績を改善し、現在承認されている全身薬と比較して、あるいは作用部位への送達が強化されれば、現在必要とされている全身投与量と比較して、副作用を減少させる可能性があるということである。局所および全身適応のために承認された製剤は数多く存在するが、中枢神経系送達のための経鼻製剤の開発は依然として課題である。このレビュー論文では、経鼻薬物送達(INDD)の可能性と利点を論じるだけでなく、現在の限界と毒性学的考慮事項についても強調している。鼻に関する解剖学的、組織学的、生理学的、病理学的な情報を、薬剤とその製剤に関するデータとともに収集し、INDDと薬剤開発への影響をさらに議論した。このレビュー論文では、局所、全身、中枢神経系の適応のための経鼻薬の確立のための将来の展望が強調されている。
鼻の解剖学
鼻は構造的にも機能的にも複雑な器官であり、五感の一つを宿している。ろ過、加湿、温度調節のほかに、嗅覚は、食物や捕食者、仲間を感知するための動物だけでなく、人間にとっても重要な機能である[2, 3]。鼻の主要構造は、実験動物として一般的に用いられるげっ歯類と人間とで一般的に比較することができる。鼻腔は、鼻孔から鼻咽頭に向かって伸びる2つの領域に分かれている。前庭領域、呼吸領域、嗅覚領域の3つの領域に分けることができる。ヒトの前庭領域は0.6cm2以上の広さがあり、鼻孔の開口部に位置している。この領域には鼻毛、扁平上皮細胞があり、繊毛細胞はほとんどない。呼吸器領域は、鼻の横の部分を150cm2でカバーし、最大の面積を占めている。ヒトでは呼吸器領域は鼻腔の80〜90%を占めているが、げっ歯類では鼻腔の50%しか占めていない(図1)。呼吸器領域は仮性柱状上皮であり、最も血管の多い領域である。主に粘液層のムチンを分泌するゴブレット細胞、繊毛細胞、無繊毛柱状細胞、基底細胞の4つの細胞から構成されている。第三の領域は嗅覚領域であり、ヒトでは鼻腔の10cm2程度を覆っている[3-6]。ヒトでは、鼻腔は副鼻腔とつながっている。副鼻腔は4つの対になった空間で、その中にある骨にちなんで名付けられている(前頭洞、蝶形骨洞、篩骨空気細胞、上顎洞)。副鼻腔の機能は明らかになっていないが、頭重の軽減、吸い込んだ空気の洗浄・加湿、音や発話の響きの改善などの機能をサポートしている[7,8]。前臨床動物モデルとヒトとの間での嗅覚上皮の表面積の違いに加えて、他のトランスレーショナルな限界もあり、それを考慮する必要がある。例えば、げっ歯類とヒトの嗅覚上皮へのアクセス性は、げっ歯類の鼻腔はヒトよりも狭く、そのためアクセスしにくいため、異なる[9, 10]。ヒトでは、嗅覚粘膜の採取は、耳、鼻、喉の外科医が局所麻酔薬を使用して行うことができるが、ラットでは、嗅覚上皮にアクセスするために鼻骨を除去する前に動物を安楽死させなければならない[10]。最近では、安楽死させずにラットの嗅覚上皮生検を行うための新しい手術方法が記載されている[9]。図1に示すように、鼻孔から鼻腔への曲がり具合、長さと体積、円錐体の構造、中隔窓の存在などの他の解剖学的要因は、種間での鼻の取り込みと吸収の違いを引き起こす可能性がある。鼻の生理学的条件、投与形態、投与方法、サンプリング技術、投与装置の選択は、ヒトの状況への翻訳を制限する可能性があるため、種の選択の際に考慮されるべきである[11-13]。
図1 ヒト(左)とげっ歯類(右)の鼻腔。鼻の穴の右側の扁平粘膜(SM)から始まる
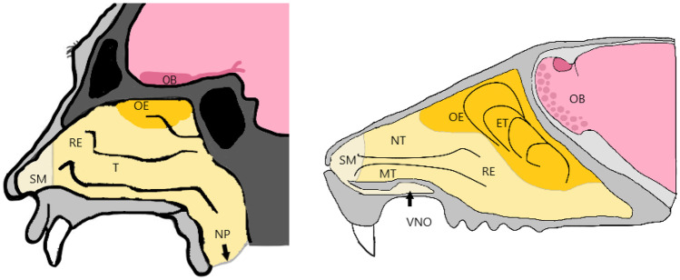
呼吸器上皮(RE)は、ヒトの鼻腔の主な部分を覆っている。ヒトには3つの鼻甲介(T)下鼻甲介、REの一部としての中鼻甲介、嗅上皮(OE)の中の上鼻甲介がある。げっ歯類では、REには上顎毛尖と鼻毛尖があり、OEにはエスモ毛尖がある。嗅球(OB)は篩板(しばん)に近接しており、脳に向かって突出する感覚ニューロンの軸索を介してOEに接続されている。げっ歯類の鼻腔はさらに、特定の化合物の嗅覚にも関与している優勢な嘔吐鼻器官(VNO)を持っている。
嗅覚領域
嗅覚上皮(OE)は、鼻腔の上部に位置し、嗅裂と呼ばれる鼻腔内の最初の環境情報の接触部である。ヒトではこの領域は面積の10%程度であるが、主にIN投与試験に使用されるげっ歯類では、嗅覚領域は総面積の50%を占めることがある[6, 14, 15]。嗅覚部には、上皮を覆う粘液層を分泌する管状のボウマン腺を含むいくつかの細胞タイプが含まれている。水平基底細胞(HBC)および球状基底細胞(GBC)は、前頭葉の近くに位置し、他の細胞タイプのための前駆細胞として作用する。さらに、嗅覚ニューロン(嗅覚受容体ニューロン(ORN)とも呼ばれる)は、嗅覚ニューロン(OSN)と呼ばれ、その周囲を支持細胞が取り囲んでいる(図2)。OSNは骨髄化されていない双極性の細胞で、粘膜表面に樹枝状に伸びており、繊毛が嗅覚受容体(OR)を運ぶ [16]。OSNの細胞体から、軸索は、鼻腔と脳を隔てるエスモイド骨の篩板(しばん)を通って嗅球(OB)に直接到達する。軸索は、さらに神経線維芽細胞(ONF)の層で覆われている相互に接続された嗅覚合奏細胞によって囲まれている。ONF層は、神経周囲鞘を形成している。OECとともに、ONFは嗅神経に沿ったOSN軸索を産巣に到達するまで網羅している [17]。
図2 嗅粘膜の構造と構成 鼻腔後部の嗅粘膜は、嗅上皮(OE)と前頭扁桃(LP)とともに、人体への環境手がかりの最初のコンタクトゾーンを表している
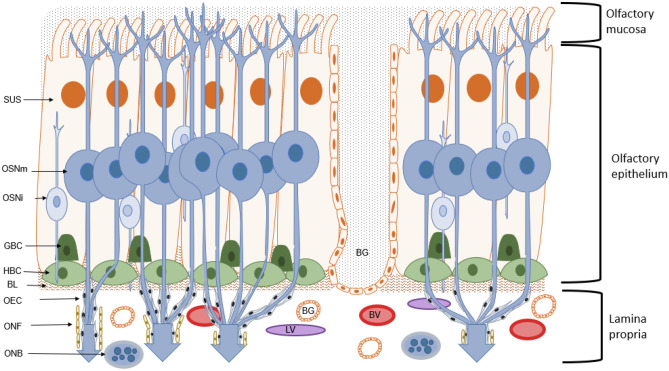
嗅上皮内では、成熟した嗅覚ニューロン(OSNm)が嗅球(OB)に向かって軸索を伸ばしており、そこでは僧帽細胞の樹状突起と糸球体を形成している。OSNmsの軸索は、嗅神経線維芽細胞(ONF)と嗅神経合流細胞(OEC)によって囲まれている。軸索は、OECとONFとともに、前頭葉の嗅神経束(ONB)を形成している。嗅覚神経叢はさらに、粘液を産生するボーマン腺(BG)と粘液腺(SUS)で構成されている。OEの中央部には、未熟なORN(ORNi)がある。OEは未熟な基底細胞、球状細胞(GBC)と水平基底細胞(HBC)の層に囲まれている。前頭葉扁桃(LP)は、基底葉扁桃(BL)によってOEから分離されている。さらに、前頭葉には血管(BV)とリンパ管(LV)がある。
専門化されたORは、嗅覚システムのシグナル伝達経路の最初の部分を表している。彼らは、人間が何千もの異なる匂いを区別することができるこのシステムの巨大な識別力を持っている。それらはGタンパク質共役受容体(GPCR)の大規模な遺伝子ファミリーに属するため、嗅覚受容体(OR)はGPCRの特徴的な7-膜貫通ドメイン(7TMD)構造を含んでいる[18]。分子に対するORの特異性は、リガンドが結合する膜貫通ドメイン内の広範な配列の多様性に基づいている。1つのOSNが1つのOR遺伝子を発現しているというのがコンセンサスな見解であるが、この規則は決定的ではないかもしれない[19, 20]。それにもかかわらず、観察は、機能的な受容体が発現している限り、細胞が1つの対立遺伝子を選択するが、低頻度で切り替えることができるという、受容体遺伝子選択のメカニズムを明らかにした[21, 22]。各OSNは、単一の樹状突起を上皮の表面に伸ばしている。そこから、ORを豊富に含む繊毛が空気中の臭気物質に接触するために伸びる。ORは、ヘテロ三量体Gタンパク質、Gタンパク質αサブユニット(Gαolf)およびGβγ複合体(Gβγ)の活性化をもたらすそのリガンドと相互作用する。活性化されたGαolfは、次にIII型アデニルシクラーゼを活性化し、ATPからのサイクリックAMP(cAMP)の産生を触媒する。cAMPレベルの増加は、ナトリウムイオンとカルシウムイオンの流入につながる環状ヌクレオチドゲート(CNG)チャネルを開き、それゆえにニューロンの脱分極につながる。最初の脱分極は、他のチャネルの開通と塩化物の流出によって増幅される [23]。ORはそのリガンドと相互作用し、信号は軸索に沿ってOBに向かって伝達される。同じORを発現するOSNは、すべて、その軸索を糸球体形成部の糸球体と呼ばれる別個の領域に送る [23]。このように、特定のORを発現するOSNの同一性が、産巣への軸索配線に役割を果たしていると考えられる。
嗅球への軸索配線
嗅覚情報を処理する最初の部位は、前脳の構造物であるOBであり、同じアイデンティティを持つ各嗅覚ニューロンの軸索が出会う場所である。1,000種類もの異なる種類の嗅覚受容体の軸索接続がどのようにしてこのように正確に組織化されているのかという疑問が、長い間、嗅覚研究の分野を忙しくしていた[24]。
哺乳類の嗅覚器官は、”糸球体 “と呼ばれる数千の信号処理モジュールを持つ単純な皮質構造を持っている。これらの糸球体は嗅覚収束センターを表し、同じタイプに属する臭気受容体のすべての入力が、その信号を僧帽筋細胞または房状細胞に伝達する。シナプス相互作用を媒介する局所神経回路によって処理される僧帽細胞への最初の軸索配線の後、情報は嗅覚皮質に送られる[25]。OBの糸球体は、OSNの軸索の地図を表し、したがって、そのORを表す。したがって、研究は、各臭気が糸球体の活動の特定の特徴的なパターンを持っていることを示している[25,26]。OBとOEにおける臭気受容体パターンのこの関係は、ゾーン間投影と呼ばれている。OBには、OEの背側部からベントラテラル部にかけて4つのゾーン(ゾーンI, II, III, IV)が並んでいる。印象的な発見の一つは、隣り合っている糸球体が類似した構造を持つ分子に反応することであった[24, 25]。現在では、ゾーンが重なり合っており、お互いに鋭い境界線を持っていないことが明らかになっている[27]。
もう一つの側面は、このマップがどのように維持されているか、また、OSN軸索がどのようにOBの適切な領域を標的にして収束するかである。合図の基礎となるヒエラルキーを調査するために多くの研究が行われてきたが、軸索配線は単純な単一の勾配では説明できない複雑なプロセスである。しかし、OBへの軸索ターゲティングにも役割を果たす可能性のある異なる因子やアプローチが議論されている。シグナル伝達カスケードにおけるこれらの因子の役割は、ノックアウト実験を用いて研究することができる。例えば、アデニルシクラーゼ3(AC3)のノックアウトは、軸索配線の障害をもたらした[28]。試験したOSNをAC3欠損バックグラウンドに置いた場合、異所性糸球体の形成が見られた。さらに、軸索が正しい位置に突出することが示されていても、糸球体の形成は損なわれていた [28]。他のアプローチでは、軸索配線に対するOR配列自体の影響を研究している[20]。軸索配線の他の重要な因子は、細胞接着と細胞表面分子である。背側-前側軸に沿って、受容体Robo2と軸索誘導キューSlit1を発現するニューロンによって分離が確立される。Slit1は腹側球根で高度に発現しているが、受容体Robo2は背側OSNで最も高い発現パターンを示している[29,30]。さらに、OSNの背側軸索末端から放出される化学吸着剤Semaphorin3Fとその受容体Neuropilin2は、OEの腹側OSNで高レベルで発現しており、Slit1とRobo2とともに背側-背側軸に沿ったOSN突起の位置決めに影響を与えている[23]。内側-側方軸については、画像は背側-背面軸のように明確ではない。インスリン様成長因子(IGF)は、産巣の側方領域または内側領域のいずれかの神経支配において重要な役割を果たしていることが示された。IGFは細胞培養においてOSN成長円錐のための直接的な化学吸引剤として作用することができるが、IGF1および2の存在だけでは、側方または内側のいずれかのOBへの軸索の配線を説明するのに十分ではない[31]。第3の軸である前後軸に沿って、ORはそれ自身に影響を与える。前後軸に沿って、特定の受容体を持つOSNが特定の糸球体に制限されることを説明する1つのもっともらしいモデルがある。この軸に沿った誘導には、OSNの内在的な活性が不可欠であると考えられる。重要な因子の一つは、軸索誘導の合図に対する成長円錐の応答を調節することができるcAMPである。興味深いことに、Neuropilin1のような特定の遺伝子の転写レベルは、cAMPを介したレベルと相関している。Neuropilin1受容体のレベルが高い場合は、後方OBへの軸索投影につながるが、レベルが低い場合は、より前方への投影につながる [32]。さらに、細胞接着分子Kirrel2と3,および反発性のあるEphrin A5とその受容体は、OSNにおいて相補的なパターンで作用している[22]。したがって、これらの遺伝子のそれぞれの発現パターンが異なることで、ORの同一性を決定する特定のパターンと、1つの糸球体への同じOR型の収束が得られることになる。このモデルは、合図に対するOSNの感受性が、OSN軸索を糸球体に位置づけることを示唆している。これら3つの軸索誘導のメカニズムは、嗅覚系の組織がいかに複雑であるかを示している。特に、同じタイプのORを発現するOSNがランダムに広がって同じ糸球体に到達する収束のメカニズムは、シグナルネットワークの詳細な知見を与えてくれる。
嗅球から中枢神経系の高次領域へ
OBは5つの層で構成されており、OSN軸索から糸球体層内の僧帽筋/房状細胞の一次樹状末端への最初の興奮性求心性投射の後、さらなる信号伝達に重要である[33, 34]。僧帽筋細胞と房状細胞の両方がOBの求心性ニューロンとして作用する。OSNと僧帽筋/房状細胞の間のこの求心性興奮性シナプスは、神経伝達物質であるグルタミン酸を介して、その信号を嗅覚野(OC)の異なる領域に向けて伝達する。嗅覚野のさまざまな領域に向けての情報伝達は、僧帽筋細胞(MC)と房状細胞(TC)が時間的に異なる情報を伝達している。嗅覚野の前方領域のみに集中的に投射するTCと、嗅覚野のすべての領域に分散的に投射するMCが報告されている[35-37]。僧帽筋/房状細胞の活性化は、介在ニューロンとして作用する糸球体周囲細胞とのデンドロデンドリン系(GABA作動性シグナル)の相互シナプスを介した側方抑制を含むフィードバック抑制をもたらす。これらのメカニズムは、入力信号の調整に重要であり、高活性と低活性の僧帽筋/房状細胞の間のシャープな特異性につながる[36, 38]。糸球体周囲細胞のほかに、糸球体層もまた、広範囲の神経伝達物質を用いて、遠心求心性線維を介して中枢神経系のより高い部分からの信号を受信する。外側の叢状層には、房状細胞のソーマータだけでなく、僧帽筋/房状細胞の一次および二次樹状突起、顆粒細胞の先端部も含まれている。僧帽細胞層は薄い層であり、主に僧帽細胞の体形と房状細胞および顆粒細胞の軸索からなる遠心線維とともに構成されている。顆粒細胞層は、主にインターニューロンの顆粒細胞からなり、僧帽細胞への抑制回路に重要な役割を果たしている。顆粒細胞層はまた、求心性遠心線維を介して、前嗅核、嗅皮質、対角線帯の細胞、小嚢座、ラッパ核からの入力を受ける[33, 39]。
興味深いことに、他の感覚系とは異なり、嗅覚経路は皮質領域に到達する前に視床を通過しない。嗅覚野からは、僧帽細胞と房状細胞の軸索が側方嗅道を形成し、嗅覚野に直接信号を伝達する。嗅覚野は、前脳の腹側表面にある構造的に異なる皮質領域であり、前部嗅核(AON)、嗅管、海賊状皮質(PC)、いくつかの扁桃体核(A)および内嗅野皮質(EC)から始まり、前方から神経支配を受け、いくつかの小領域で構成されている[30, 40]。嗅覚皮質は、大脳皮質領域と嗅覚野との間の相互接続の複雑なシステムを表しているだけでなく、視床、視床下部、大脳新皮質、海馬などの高次脳領域との皮質間接続も持っている。発達期の軸索配線は、高次脳皮質内の軸索配線や大脳皮質に向かう軸索配線よりもさらに複雑である。大脳皮質内の領域間の通信は、OB内の通信よりも複雑であるため、脳の領域への軸索配線の過程は、まだまだ研究の対象となっている。
嗅覚上皮の取り込み経路とメカニズム
鼻の中の異なる空間間の輸送機構と流れが存在することは19世紀から知られていた[41]。しかし、神経疾患の増加に伴い、鼻から脳への薬物送達(ntb)の分野が前進するまで、これらの輸送メカニズムは未解明のままであった。わずか数十年前の1991年、ウィリアム・フレイ2世は、脳内の神経疾患を治療するための鼻から脳への薬物送達方法の特許を提案した[1]。それ以来、アルツハイマー病などの脳疾患を治療するための鼻から脳への薬物送達法の大きな可能性を示す、多くのエキサイティングな基礎的前臨床研究および応用臨床研究が行われてきた[42-45]。しかしながら、分子が鼻粘膜から中枢神経系に輸送される正確なメカニズムはまだ明らかにされていないが、IN投与を用いた更なる薬物送達アプローチの恩恵を受けることができるだろう。
IN投与のアプローチは、主に嗅神経と三叉神経という2つの形態学的構造に焦点を当てている。IN投与された物質が使用する経路には、嗅神経と三叉神経に沿って中枢神経系へと輸送されるための細胞内、細胞外、細胞外のメカニズムがある(図3)。細胞内嗅神経経路では、ピノサイトーシスとエンドサイトーシスを利用して物質がOSNに取り込まれる[15]。その後、物質はOSN軸索に沿ってOBに運ばれる。分子が大脳とポンズの神経の起源に配信されると、彼らは脳全体に分散することができる。別の経路は、嗅上皮経路であり、物質は前頭葉に吸収され、さらに嗅神経路を取り囲む隙間を利用して中枢神経系に入る[46, 47]。前頭葉からは、物質は局所の血管やリンパ管によって吸収されるが、物質の大部分は、嗅神経線維芽細胞と嗅神経線維芽細胞の間にある神経周囲空間を通って、バルクフローによって移動する。この空間は脳のくも膜下腔に通じており、そこから物質がさらに分布することができる [15]。
図3 物質が嗅上皮(OE)を通過するには、3つの異なる経路がある
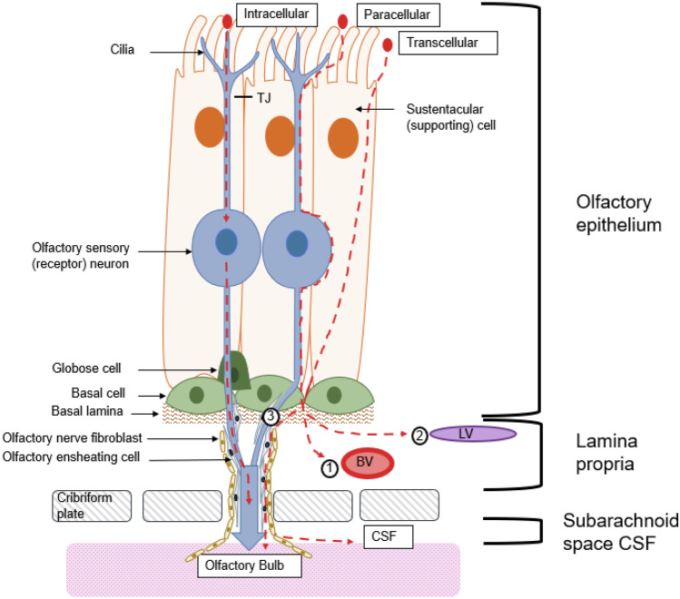
物質は受容体に結合し、受容体介在性エンドサイトーシスなどによって内部化される。その後、物質は嗅覚ニューロン(OSN)を通って嗅球(OB)に向かって移動する。もう一つの可能性としては、物質が嗅覚ニューロン(OE)内の漏れた通路を利用して、傍細胞を通って前頭葉扁桃に移動することが考えられる。第三に、物質はsustentacular細胞(SUS)を通って、細胞を越えてlamina propriaに運ばれる可能性もある。そこから、物質は、(1)循環に達する局所血管(BV)によって吸収されるか、または(2)リンパ管によって吸収され、首の深部頸部リンパ節に排出され得る。(3)物質は、嗅覚合奏細胞と嗅神経線維芽細胞との間の腓骨腔を利用して、嗅神経に関連してOBに移動することができる。cribriform の版を渡した後、物質はまた理論的に脳脊髄液に達し、異なった脳領域を通って配ることができる
細胞内経路
細胞内経路は、広範囲の異なる分子によって利用されている。広く検討されているペプチドインスリン(5.8 kDa)[48]以外にも、金粒子(50 nm)[49, 50]やアルミニウム塩[51]もエンドサイトースすることが知られている。嗅覚系の細胞内経路を研究するための古典的なモデル分子は、80 kDaのサイズを持つワサビペルオキシダーゼ(HRP)と共役した小麦胚芽アグルチニン(WGA)である。20世紀後半、いくつかの研究で、HRPがピノサイトーシスを利用してOSNに侵入することが示された[52-55]。その後、1995年には、HRP単独とは対照的に、WGA-HRPが受容体介在性エンドサイトーシスを介した取り込みの増加を示すことを示す実験が発表された[56]。ピノサイトーシスは受容体介在性エンドサイトーシスよりも可能性が高いように思われるが、WGA-HRP以外のさらなるアプローチでは、嗅粘膜や産婦人科領域での特異的な受容体発現が示唆されている。初期に発見された例としては、脳由来神経栄養因子(BDNF)の受容体介在性取り込みが挙げられる[57]。最近、多くの研究が、代謝受容体が嗅覚系に発現しており、インスリン、レプチン、オレキシンなどのホルモンが嗅粘膜上のこれらの受容体に結合できるという見解を強く支持している[58-62]。
しかし、ウイルスもまた、受容体介在性エンドサイトーシスを利用して嗅上皮に侵入することができる。多くのインフルエンザウイルスの亜型、ヘルペスウイルスおよびポリオウイルスは、繊毛表面の異なる受容体を使用して嗅覚ニューロンに侵入する。1912年までに、ポリオウイルスがORNに侵入して中枢神経系に感染する能力を研究が発見した [63]。1930年代には、この仮説は研究によって支持され、最終的には、ポリオウイルス炎のパンデミック中に病気を予防するために、カナダの学童に硫酸亜鉛を使用してOEを化学的に焼灼するという結果をもたらした[64-66]。ポリオウイルス受容体は1990年代に同定されたにもかかわらず、OE表面上の受容体の発現に焦点を当てた研究はまだ少ない[67-69]。しかしながら、インフルエンザのサブタイプは、細胞表面の構造物を利用して嗅上皮に侵入することも可能である。インフルエンザサブタイプは、ガラクトース(鼻上皮ではSAα2,6Ga)に結合した末端シアル酸を持つ糖鎖に結合してOSNに侵入する[70-72]。さらに、ヘルペスウイルスが細胞表面のヘパラン硫酸およびネクチン-1を用いて嗅神経上皮に侵入することができるという強い支持がある[73-75]。鼻を人体への侵入口として利用するウイルスの最新の例は、SARS-COV-2ウイルスである。最近の研究では、鼻および嗅覚上皮が義務的受容体であるアンジオテンシン変換酵素II(ACE2)およびプライミングプロテアーゼTMPRSS2を発現していることが示された。興味深いことに、嗅覚の喪失はSARS-COV-2感染の初期マーカーである。COVID-19患者の嗅覚障害は、ACE2を非神経細胞として発現するustentacular細胞の損傷が原因であることが提案されている [76-79]。
分子、薬物、ウイルス、その他の物質が内包された後、小胞を含む貨物(エンドソーム)はソーマを通過する。いくつかはゴルジ体を通過するが、他のものは軸索を通って産生部に向かって直接輸送される。細胞内の軸索輸送は、標識されたトレーサーを用いて可視化され、前向性と逆行性の輸送メカニズムが存在することを示している [55, 80]。小胞は、中枢神経系に到達するために、嗅神経内では約4mm、ラットの三叉神経内では約20mmの細胞内距離をカバーしなければならない[81]。神経細胞の輸送はかなり遅いプロセスであると議論されている。Croweらは、嗅神経の軸索輸送だけでは、経鼻的に投与された薬物が脳に到達するまでに45分しかかからないと述べている[15]が、エンドサイトーシスやエキソサイトーシスなどの他のプロセスはこれらの計算には含まれていないため、実際には時間が長くなる。これは、WGA-HRPと嗅覚C線維を用いたex vivo研究で測定された速度値に基づいている。1日あたり36mmの遅い速度と、1日あたり130mmの速い輸送機構の2つの値が推定された[80]。速い速度速度は、さらなる研究によって支持されている[53, 81]。前述のように、いくつかの分子およびウイルスは、その3つの主要な神経分節のうちの2つ(V1眼科神経;V2上顎神経)で鼻腔を支配している三叉神経に沿ってエンドサイト化され、トランスロケーションされる可能性がある[81,82]。WGA-HRPに加えて、IN投与の研究では、IGF-1および単純ヘルペスウイルスが三叉神経経路を利用して中枢神経系に到達できることも示されている[83-86]。
細胞外経路
細胞外経路は、支持細胞への細胞間取り込みか、鼻上皮の漏れた部分を介した細胞外拡散のいずれかから始まる。上皮細胞はタイトジャンクション(TJ)を介して接続されており、帯状オクルーデン(ZO)-1,2,3,オクルーディンやクラウディン-1,3,4,5,19などのタンパク質を発現しているにもかかわらず、細胞間の裂け目が存在することが知られている[87,88]。鼻の上皮は、アポトーシスによって採掘されるまでのOSNの平均寿命が30~60日で、一定のターンオーバーを経ている[89-91]。OSNが完全に置換されず、TJが機能していない限り、インスリン(5.8 kDa)IGF-1(7.5 kDa)アルブミン(65 kDa)さらには幹細胞などのタンパク質やペプチドが中枢神経系に到達できるチャネルが残っている[92-96]。鼻上皮における薬物の通過性を改善するために、TJ伝染性を高めるためのシグナル伝達機構や製剤化アプローチがある。プロテインキナーゼ、マイトジェン活性化プロテインキナーゼ、ミオシン軽鎖キナーゼなどの様々なシグナル伝達調節因子の他にも[97]、胆汁酸塩などの界面活性剤やキチン誘導体キトサンなどのカチオン性ポリマーもTJの伝染性を高め、薬剤の吸収を高めることが知られている[98]。
扁平上皮から、物質は、さらに分布するための異なる方法と並行して3つの経路を移動する。まず、局所の血管に吸収されて全身循環に入る。鼻の上皮、特に呼吸器部分は血管網が豊富であるが、INインスリンの研究は、IN投与後の局所血管での吸収と全身分布は鼻では重要な要因ではないという見解を支持している[44, 99]。さらに、物質や分子は粘膜下からリンパ系に吸収される。鼻のリンパ管は、首の深部頸部リンパ節に向かって排出される[100, 101]。経鼻的に投与された分子の主要な側面は、頭蓋コンパートメントとの接続を有する、神経周囲および血管周囲空間への細胞外拡散および対流であるように思われる。前述したように、細胞内軸索輸送は、嗅神経内の〜4mmの距離では0.74(高速)-2.7時間(低速)、三叉神経内の〜20mmでは3.7(高速)-13時間(低速)と計算された時間で、かなりゆっくりとした動きをしている。その代わり、嗅神経と三叉神経に沿った細胞外拡散は、神経周囲空間で行われるため、わずかに速くなる。LochheadとThroneは、Fickの第二法則の1次元(距離)のみの簡略化されたバージョンを使用して、嗅神経の時間を0.73-2.3時間と計算した[15, 81]。しかし、これらの速度は、より遅い輸送を予測しているため、実験データと一致しない。125I]標識IGF-1を用いたINの研究では、中枢神経系への急速な分布(〜30分)は拡散や細胞内輸送よりもむしろ細胞外の対流によるものであることが示唆されている[92]。急速な速度を説明できるメカニズムの1つは、鼻の血管周囲空間におけるバルクフローである。嗅神経に沿った多くの動脈が軸索に栄養分を供給している。収縮期の波は血管周囲空間内の高圧波をもたらす。いわゆる血管周囲ポンプが、脳に向かって流体と分子を迅速に分配する役割を果たしていると示唆されている[102-104]。200μm/minの速度で経鼻的に[125I]標識されたIGF-1を適用するのに必要な時間を計算すると、IGF-1が血管周囲バルクフローを介して脳幹に到達するまでの時間は0.33時間と予測された[81]。これらは予測値であり、生体内の状況を完全に表しているわけではないが、予測値は、細胞外輸送がより速く、おそらく薬物が中枢神経系に到達するための最も顕著な経路であるという仮説を支持している。
承認されている経鼻剤の現状
INデリバリールートは、様々な薬剤や治療法のデリバリーにおいて、より多くの関心を集めている。過去10年間で、全年齢層、全性、全臨床段階の患者を含む介入型IN試験の量は 2000年から 2010年までの期間と比較して約3倍に増加している(ClinicalTrial.gov)(図4)。この臨床試験数の増加は、他の投与経路と比較してもさらに高い。ClinicalTrial.govに掲載されている2000年から 2020年の間に完了した静脈内介入試験の数は、完了した経鼻内介入試験の約18倍であるが、同じフィルターを使用した静脈内介入試験の発表数は、過去10年間で2倍にしか増加していない。
図4 経鼻投与を用いたClinicalTrial.govに掲載された臨床試験論文数
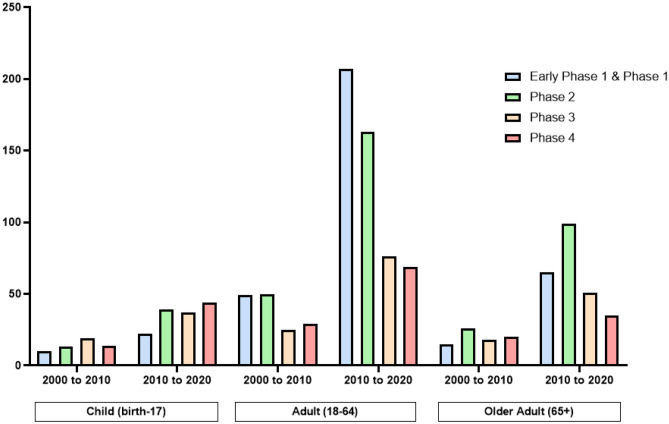
使用したフィルターには、募集状況(募集中、積極的(募集していない)完了)適格性基準(年齢群(小児、成人、高齢者)全性別)試験成績(全)試験相(第1相初期、第1相、第2相、第3相、第4相)が含まれてた。
INの送達は通常、局所的に作用する薬剤に関連しているが、中枢神経系疾患の全身的な効果および治療は、前臨床研究および製薬業界によってますます注目されている[14, 47, 105, 106]。経鼻投与は、非侵襲的であり、薬剤の投与が容易であるため、経口投与などの一般的な経路に比べて多くの利点がある。さらに、IN投与された全身作用性薬物は急速に吸収され、迅速な作用発現を示す。吸収が速いのは、先に述べた粘膜下の豊富な血管系によるものである。代謝性ファーストパス効果の回避は、より高いバイオアベイラビリティーにつながる可能性がある[14, 106, 107]。また、脳への到達を目的とした薬物については、鼻からの薬物送達は、より低い全身曝露とより効率的なターゲティングにつながるため、多くの場合、副作用が低減されることが知られている[108]。IN薬物送達への関心の高まりを支持する最も著名な議論の一つは、BBBをバイパスする可能性である。BBBは、神経学的中枢神経系障害を治療するための制限因子である[47, 109]。薬物やバイオ医薬品の経鼻投与には、さらに多くの制限や考慮しなければならない側面がある。投与量が少ない親油性の薬剤(MW < 1 kDa)はよく吸収されるが、鼻粘膜はペプチドやタンパク質のような大きな親水性の薬剤(MW > 1 kDa)に対しては伝染性が低いことを示している。さらに、粘膜クリアランス、酵素分解、低い薬物保持時間などのプロセスは、INデリバリーシステムを介した薬物送達の効率を制限している。これらの制限効果を減少させることを目的とした多くの技術やアプローチが研究されている[106, 107]。経鼻デバイス技術は、作用部位および治療効果の正確なターゲティングのために最適化が進められている。以下のセクションでは、局所送達、全身送達および中枢神経系送達という用語は、経鼻投与後の物質または薬物の流通経路に関する用語として使用されているが、適応症に関する用語としては使用されていない。
局所送達に用いられる経鼻投与
局所的に作用する薬剤の経鼻送達は、一般的に、液体製剤として、鼻スプレー/エアロゾルポンプを介して投与される[110]。この送達システムは、局所的および全身的な用途に必要とされるように、追加の加湿効果を有し、鼻腔内の広範囲の薬物分布に到達する可能性を提供するので便利である[111]。しかしながら、水性製剤および長期使用の主な制限は、微生物の安定性および防腐剤の存在であり、これは刺激性およびアレルギー効果につながる可能性がある[110,112]。アプローチは常に送達技術を開発しており、粘膜表面での滞留時間を長くし、患者の頭の位置など、患者の個々の投与手順内でのばらつきを減らしている。他にも、フィルター付きの経鼻加圧定量吸入器が、非繊毛部が主な沈着部位である鼻腔前部にブデソニドを塗布するために使用されている[112]。
鼻腔内投与のための一般的な薬剤は、抗ヒスタミン剤とコルチコステロイドであり、アレルギー反応や感染症に基づく季節性鼻炎や鼻づまりを治療するための第一選択薬である[14]。局所に作用する薬剤は、発症が早いため、これらの適応症では利点がある。さらに、抗ヒスタミン剤やコルチコステロイドは、外用薬として全身のバイオアベイラビリティが低いため、副作用が少なく、中枢神経系への影響がない。経口投与と比較して、これらの薬剤のIN投与は低用量を必要とする[113, 114]。アレルギー性鼻炎のメディエーターとしてのヒスタミンの役割は、20世紀初頭から知られている。レボカバスチンは、高い効力を有するH1受容体選択性薬物である。レボカバスチンは第二世代のヒスタミンH1受容体拮抗薬に属する。これらの第二世代の薬物は、経口投与ではなく局所投与した場合、中枢神経系の鎮静作用を伴わずに、改善された利益とリスクのプロファイルを示している[115, 116]。季節性鼻炎の治療のための局所投与薬の別のグループは、ステロイド性抗炎症薬、すなわちコルチコステロイドである。コルチコステロイドは、標的細胞に局在する単一のグルココルチコイド受容体に結合する。トランザクティベーションまたはトランスレプレッションにより、抗炎症作用が生じる。これらの効果には、サイトカインやメディエーターの放出に影響を与えることや、鼻内の炎症性細胞のリクルートを減少させることなどが含まれる [117]。ブデソニド、フルニソリド、フルチカゾン、モメタゾン、トリアムシノロンなど、多くの承認されたコルチコステロイドが市場に出回っている。コルチコステロイドは抗ヒスタミン薬よりも強力で効率的であると考えられているにもかかわらず、利益/リスクプロファイルに関して、これら、2つのグループに有意な差は見出されていない [113]。
全身送達に使用される経鼻適用
局所的な効果を得ることを目的とした局所送達のためのIN投与とは別に、幅広い治療効果を得るための全身曝露を目的としたIN送達システムがある。全身曝露を目的としたIN投与は、片頭痛、頭痛、感染症予防、疼痛管理、ホルモン補充療法、禁煙、てんかん発作のような緊急時の治療など、幅広い適応症で検討されている[9, 98]。これらのアプローチは、全身送達のためのINアプリケーションの利点によるものである。鼻粘膜は薬物吸収のための比較的大きな表面積を提供している;しかしながら、個々の吸収およびバイオアベイラビリティの値は、化合物、製剤、試験された種、および送達デバイス自体に本当に依存している。Costatinoらは、低分子量の薬物の場合、IN投与後のバイオアベイラビリティは比較的高く、変動性は低いが、高分子量の薬物の場合、バイオアベイラビリティは低く、変動性は高く、注射と比較して[114, 118]であることをまとめている。IN投与後の全身送達については、鼻腔内の血管性が高いことが特に有利である。さらなる利点は、薬物の迅速な導入、一次代謝がなく、患者の快適性とコンプライアンスを最大化するための非侵襲性である[107, 119]。歴史的に、局所送達の場合と全身送達の場合があるように、承認されているほとんどの経鼻投与用医薬品は、鼻腔内スプレー/エアロゾル装置を介して送達されている[14, 112, 120]。しかし、全身送達の適応症については、鼻腔デバイスの調査の一つの目的は、鼻粘膜上での薬物の滞留時間を延長することである。したがって、いくつかのアプローチを挙げると、経鼻ゲル、マイクロエマルジョン/懸濁液、およびマイクロスフィアが開発中です[112]。
プロプラノロール、ニフェジピン、ニトログリセリンのような一般的な例が臨床で示されているように、INアプリケーションを介した全身送達の可能性は、心血管系の適応症に使用される薬剤で実証されている[114]。プロプラノロールの経鼻投与は狭心症患者の運動耐性を改善することが示されている[121]。さらに、臨床研究が行われ、一般的な非経口投与製剤と比較して作用発現がより迅速であることから、心血管薬の静脈内投与および全身送達が適切な代替手段であることが示された[121,122]。
全身効果を達成することとは別に、鼻を介した送達は、全身曝露に到達した後に中枢神経系を標的とするためにも使用される。IN適用後の全身投与による中枢神経系標的化の例として、鎮痛薬の投与がある。
IN鎮痛剤は、頭痛や片頭痛の治療、がんの痛みなどに使用されている。IN鎮痛薬の主な利点は、代謝性のファーストパス効果を回避し、バイオアベイラビリティの向上と迅速な発症を可能にすることである。特に、慢性がん患者の画期的な疼痛に使用されるモルヒネは、経口投与された場合、広範なファーストパス効果を基盤としている;したがって、INの投与は迅速かつ効果的な緩和を提供する [123, 124]。モルヒネは極性、親水性、低分子量の薬物である。吸収促進剤を使用せずにモルヒネを経鼻投与した場合、バイオアベイラビリティは10%であるが、キトサンをベースとした製剤を使用したヒトにおけるモルヒネの場合、バイオアベイラビリティは80%まで上昇する可能性がある[123]。ブトルファノール、フェンタニル、スマトリプタン、ゾルミトリプタンなどの点鼻薬を用いた片頭痛や頭痛の治療にも同様のことが言える[105,114]。これらの低分子の承認された経鼻製剤は、薬物分子が高い伝染性と低分子量(1kDa未満)を特徴としており、全身循環で治療レベルに達することができるため、経鼻吸収促進剤を含まない。例えば、ブトルファノール酒石酸塩の市販されている製剤は、塩化ナトリウム、クエン酸および塩化ベンゼトニウム(pH5.0)を含む水溶液鼻腔スプレーとして送達される[105,125]。全身に作用する低分子のINアプリケーションの他の例としては、インドメタシンやケトロラックのような抗炎症作用を持つ鎮痛剤がある[14]。
鎮静剤やてんかん発作(ベンゾジアゼピン系)やオピオイド過量投与(ナロキソン)などの緊急時における全身分散型のINドラッグデリバリーの実現可能性は、現在調査中である。Nyxoid®は、例えば欧州で承認されているナロキソンの経鼻剤である。この製剤は、ナロキソン塩酸塩二水和物、クエン酸三ナトリウム二水和物、塩化ナトリウム、塩酸、水酸化ナトリウムおよび精製水を含んでいる[126]。ベンゾジアゼピンであるミダゾラムは、両適応で経鼻的に使用される。臨床試験では、その使用は鎮静剤としてだけでなく、抗てんかん薬の緊急病院前治療としても記載されている[114,127,128]。IN経路による適用では、どちらの適応症も経口経路と比較して発症が早く、バイオアベイラビリティーが改善され、取り扱いが容易であるという利点があり、特に前臨床の状況では介護者に関連している[129, 130]。
IN送達された薬剤によるホルモンの置換は、全身送達を伴うIN適用の重要な適応である。一例として、水性製剤の17-β-エストラジオール(Aerodiol®)があり、これは女性の更年期症状を軽減するためのエストロゲン療法として使用されている。経口投与と経皮投与を比較した研究では、INは24時間までの血漿中濃度時間曲線下面積(AUC)有効性、副作用の頻度が同等であることが示されている[131-134]。さらに、ホルモン補充療法には、ペプチドやタンパク質などの生体高分子が市販されている。例えば、サケカルシトニン(Miacalcin®、ノバルティス;Fortical®、ユニジーン)を含有する経鼻スプレーが、骨粗鬆症の治療のために市販されている。デスモプレッシン(Desmospray®, Ferring)は、糖尿病性股関節症、尿閉症、血友病A、フォン・ウィレンブランド病(I型)の治療のための抗利尿ホルモンとして使用されており、また、ゴナドトロピン放出ホルモンアナログとしてブスリリン(Suprecur®. サノフィ-アベンティス)およびナファレリン(シナレル®、ファルマシア)は、前立腺癌および子宮内膜症の患者の血中テストステロンおよびエストロゲンレベルを低下させるために使用されている[105, 135-140]。これらの製品はいずれも吸収促進剤を含んでいないが、IN適用後のペプチドおよびタンパク質の全身的なバイオアベイラビリティーは通常1%未満である。しかしながら、これらのペプチドベースの製品は、低い全身レベルでも強力で治療効果があるため、有効である[125]。
IN送達は、一般的に、全身的な適応症を治療する小型の生体高分子の送達ルートとして、ますます使用されるようになってきている。それにもかかわらず、非水性製剤のための迅速な粘膜クリアランスおよび鼻粘膜の低い吸収能力などの制限は、製剤内の賦形剤および吸収促進剤の組成を改善することによって解決されなければならない。
中枢神経系への送達に使用される経鼻適用
経口薬物送達は、ヒトに薬物を投与する最も一般的な方法である。しかし、神経疾患や疾患の治療のためには、経口送達方法では、中枢神経系(CNS)に効率的に薬物を送達できないことが多い。脳内には、病原体、神経毒性分子、およびその他の潜在的に有害な物質から中枢神経系を保護するための障壁、特にBBBが存在する。BBBは中枢神経系と末梢の間の重要なインターフェースであり、内皮細胞から構成されており、TJと接着接合体(AJ)によって互いに緊密に接続されている[119, 141-143]。全身ルートを介して中枢神経系に到達する物質の量を減少させるもう一つの要因は、多剤排出タンパク質トランスポーターの存在である。活性なP糖タンパク質排出ポンプは、BBBの内腔側に存在し、薬物を血流に戻すことにより、中枢神経系での薬物曝露量を減少させる[142, 144]。嗅覚系にもこのような排出トランスポーターが存在することが研究で明らかになった[145]。しかし、親油性の高い小さな薬物分子(<500 Da)だけが、高分子の1%未満、低分子の2%しか占めていないBBBを通過することができる[108, 141, 146]。アルツハイマー病などの神経障害の治療の文脈では、それはBBBと全身のファーストパス効果をバイパスし、したがって、効率的な薬物送達ルートとして有望なアプローチであるため、薬物のIN投与は、ますます関心を集めている[47, 119]。
前述したように、OEから中枢神経系への直接的な経路が存在する。この経路は、細胞内および細胞外の経路と関連しており、細胞間、細胞間、細胞外輸送機構が関与しており、嗅神経線維および三叉神経線維とともに鼻粘膜から中枢神経系に薬物を輸送することができる。研究では、低分子だけでなく、ペプチドやタンパク質もこれらの経路を利用して、前脳の構造物である産巣に直接到達することが示されている。OBから、それらはまた、細胞外に分散するか、またはさらに高次脳領域に向かって細胞内に輸送される[81, 146]。投与経路にかかわらず、脳実質内で一定の標的送達を達成することは依然として困難である。なぜなら、物質は標的に到達するために脳内を長距離(~mm)移動しなければならないからである[147, 148]。細胞外空間内の輸送は、脳体積の20%程度を占めるため、薬物の拡散に重要な役割を果たしている[148, 149]。薬物または物質が、経鼻送達後、BBBを越えて脳に到達するか、または脳への直接注入後に脳に到達するかにかかわらず、微小環境内での分布には細胞外拡散が関与している[148]。脳内分布は、ナノテクノロジーによって促進することができる[150]。研究は、ナノセラピューティクスおよびナノマテリアルが、対流強化送達[151]だけでなく、経鼻送達[152]を介しても、神経膠芽腫のより効率的な治療のために、脳内での薬物の生物分配を改善することを示している。
化学療法剤は、一般に、INDDシステムのために考慮される[152,153]。IN経路の主な利点は、他の臓器系での副作用が減少する可能性があることである[146, 154]。ペリリルアルコール、メトトレキサート、テロメラーゼ阻害剤などの脳腫瘍を治療するための化学療法剤は、鼻からの投与が可能であり、効果的な代替戦略であることが、さまざまなアプローチによって示されている[155-160]。
さらに、いくつかのペプチドおよびタンパク質がntb送達のために研究されている。代表的な例としては、社会的行動や自閉症に対するポジティブな効果で知られるオキシトシン[161-163]や、中枢神経系のヒポクレチンシグナルと嗅覚を改善し、ナルコレプシー[164-166]の治療法の可能性を提供するオレキシン-Aなどが挙げられる。経鼻薬物送達のためのもう一つの潜在的な薬剤は、肥満および睡眠障害を治療するためのレプチンである。レプチンの全身投与および末梢投与では肯定的な効果が得られなかったが、INレプチンの前臨床試験では食欲の低下およびその結果としての体重減少が示された[167-169]。
嗅覚関連経路を介して中枢神経系を標的とした薬剤のIN応用の実現可能性を示す例として、インスリンがある。インスリンは中枢神経系におけるエネルギー代謝の重要な調節因子である。インスリン感受性グル経過トランスポーターは、BBBを介してインスリンを輸送するが、インスリン受容体は脳の様々な領域で広く発現しており、その濃度は産巣、大脳皮質、視床下部、海馬、小脳で最も高い[170, 171]。中枢神経系におけるインスリンの機能の摂動と、脳内(または脳脊髄液)のインスリン濃度が低い方へと末梢へと移行することは、認知障害やアルツハイマー病の形成に寄与することが示されている。さらに、高血糖や糖尿病状態などの末梢の異常は、アルツハイマー病発症のリスクを改善している[42, 172-174]。このことは、糖尿病に罹患している患者がアルツハイマー病を発症しやすいことを示唆している。さらに、前臨床および臨床の多くの研究は、加齢に伴う認知障害における認知および記憶を改善するINインスリンの能力を示している[43, 175-178]。いまだに、INインスリンを投与するための承認された製剤は市販されていない。
RNA治療薬も言及されており、神経変性疾患を治療するためのIN投与が注目されている。このようなアプローチのためのsiRNAおよびアンチセンスオリゴヌクレオチドの可能性を調査した過去10年間の出版物が増加しており、例えば、siRNAは、IN送達後に嗅神経に沿って移動することが示されている[48,179-182]。
INの応用のためのもう一つのエキサイティングな新しいアプリケーションは、嗅神経管に沿って中枢神経系に向かって幹細胞を送達することである。2009,ある科学者グループは、蛍光標識されたラット間葉系幹細胞(MSC)とヒト神経膠腫細胞をナイーブマウスやラットに経鼻的に投与すると、嗅覚関連の神経経路を利用して中枢神経系の異なる領域に到達することを初めて示唆した[183]。その後、生理活性遺伝子を持つ神経幹細胞/前駆細胞を脳内グリオーマの標的とする可能性が明らかにされた [184]。現在、神経幹細胞、前駆細胞、間葉系幹細胞を用いて、脳腫瘍や神経変性疾患の治療の可能性を調べる前臨床研究が増加している。これらのアプローチは、外科的な注射や血管内投与に代わる安全で効率的な方法であると考えられている[185-188]。
嗅覚路関連経路を介した中枢神経系送達のための製剤の承認は、しかしながら、嗅覚上皮を介した薬物の分布および吸収を増加させている適切な経鼻デバイスに依存している。経鼻剤の分布パターンは、粒子径に強く依存し、これは、次に、投与装置および製剤の物理化学的特性によって影響を受ける。製剤の粘度は、鼻腔スプレーの飛沫サイズに影響を与え、その結果、沈着部位に影響を与える [189]。経鼻製剤の粘度が高いと、滞留時間が長くなるため、鼻粘膜を介した吸収が促進される。逆に、拡散が遅いため、全身への送達が減少する[190]。この文脈では、ナノテクノロジーをベースとしたアプローチや、鼻の後部への分配を容易にし、肺への沈着を最小限に抑える双方向性鼻腔気腹器などのデバイスなどの新しい送達戦略を開発するために大きな努力がなされている[112, 191]。Rabieeらによる最近発表されたレビュー[45]は、ntb送達のための天然および高分子ナノ粒子を使用した既存のアプローチを要約し、議論している。著者らは、高分子ナノ粒子は、アルツハイマー病に対する薬物のntb送達のための有望なキャリアであると結論づけている。しかし、この結論は、他の中枢神経系の適応症にも適用できる可能性がある。
経鼻適用の毒性学的課題
安全性は、効果的で安全な製剤を設計する際の重要な課題である。開発プロセスにおいては、薬剤そのものだけでなく、製剤中の有効成分や賦形剤についても安全性を考慮しなければならない。吸収促進剤は、ペプチドやタンパク質のような大きな分子に必要である。これらは、鼻粘膜の伝染性を改善することにより、IN投与後の薬剤のバイオアベイラビリティを高める。他の賦形剤は粘接着剤として作用し、鼻粘膜との接触時間を延長する。賦形剤は、それ自体の安全性プロファイルおよび薬剤の局所曝露時間の増加のために、最終的な製剤の安全性を著しく低下させる可能性がある[192-194]。また、製剤の局所的、全身的、中枢神経系、および肺への影響についても、毒性学的な考慮事項を議論しなければならない。
局所的な副作用
医薬品の局所的な忍容性は多くの異なる要因に依存し、個人差がある。温度や加湿などの環境的手掛かり、心理的要因だけでなく、感染症、持病、アレルギーなどの個人の生理的要因も、医薬品と鼻粘膜との局所的な相互作用に影響を与える。このレビューでは、内在的な生物学的要因のみを考慮している。これらの生物学的要因は鼻粘膜での薬物吸収に影響を与え、最終的な医薬品の毒性学的プロファイルに影響を与える。鼻血流は、吸入された空気の温度または加湿のような鼻の中の重要な条件を調節する。血流に影響を与えることが知られている薬剤には、血管運動剤などの様々なものがある。アレルギーや風邪の鎮痛剤として使用されるオキシメタゾリンは、血管収縮剤として鼻の中の血流を減少させることが示されている[195-197]。さらに、INコルチコステロイドもまた血管収縮薬であり、季節性鼻炎患者の緩和につながる。鼻出血や鼻中隔穿孔などのまれな副作用が観察された [113, 115, 198, 199]。対照的に、他の薬剤は鼻の血流を増加させ、例えばヒスタミン、アルブテロール、イソプロテレノール、フェノテロールなどである[113,118]。
毒性学的および安全性の問題に関して考慮すべきもう一つの生物学的要因は、鼻粘膜における酵素活性である。鼻粘膜は環境の鍵と直接接触する場所であるため、有害物質や外来物質に対するバリアにもなる。したがって、物質や薬剤を代謝する防御酵素も存在する。現在までに、鼻粘膜には、P450依存性代謝経路に属する酵素(例えば P450モノオキシゲナーゼ)第I相酵素(フラビンモノオキシゲナーゼ、アルデヒド脱水素酵素、エポキシドヒドロラーゼ、カルボキシルテラーゼなど)第II相酵素(グルクロン酸トランスフェラーゼ、硫酸トランスフェラーゼ、グルタチオントランスフェラーゼ)[118, 200, 201]から構成されている。これらの酵素は、オピオイド、ヒスタミン、コルチコステロイドなどの経鼻投与された低分子薬物の代謝も行っていると推測される[118,202]。
酵素は、潜在的に有害な物質や外来物質から鼻や上気道を保護するだけでなく、鼻粘膜システムは、鼻内の防御機構の主要な部分を占めている。粘液層は鼻の上皮を覆い、毛様体拍動を介して鼻咽頭に向かって粒子を輸送している。毛様体拍動頻度(脳血流)は、温度、細胞内Ca2+、cAMP、細胞外ATPレベルによって制御され、細胞制御下にある。鼻粘膜の他の生理機能には、その保水能力と気道内の効率的な熱伝達の責任が含まれる。さらに、それは表面電気活性を示す [193]。このように、これらのシステムの障害は、製剤の接触時間の延長、生理的障害、および粘膜および鼻上皮の損傷につながる可能性がある。
ヒトの鼻粘膜は、平均的な生理的pHが6.3であり、したがって、わずかに酸性である。粘液中のpHを維持することで、毛様体クリアランスの機能が確保される[203]。したがって、鼻腔内製剤のpHは、鼻刺激を避けるために4.5〜6.5のpH範囲内であるべきである[118]。pHだけでなく、浸透圧も毛様体拍動に影響を与え、それゆえに局所的な毒性学的考察に寄与することができる[118,190]。しかし、多くの物質は刺激または阻害のいずれかを介して粘膜クリアランス(MCC)に影響を与えている。刺激効果の代わりに、抑制効果は、鼻の乾燥、刺激性、くしゃみ、鼻のかゆみだけでなく、薬用鼻炎や鼻づまりなどの有害な副作用の主な原因となる。MCCや脳血流の効果は通常試験管内試験で評価されていることに言及する価値がある。これらの試験管内試験では、試験管内試験ではMCCおよび脳血流に対する効果が示されるのに対し、生体内試験では同じ化合物が検出可能な副作用をもたらさないことが多いため、生体内試験での最終的な効果を予測することはできない[204]。一般に、多くの化合物について、粘膜クリアランスおよび脳血流に対する阻害効果は用量および時間依存性であることが示された。例えば、α-アドレナリン受容体アゴニストであるオキシメタゾリンおよびキシロメタゾリンは、用量依存的にヒト鼻粘膜に対する阻害効果を試験管内試験で示した[205, 206]。多くのコルチコステロイドや抗ヒスタミン薬も試験管内試験でMCCや脳血流に影響を与えているが、同時に生体内試験では副作用を示していない[194, 207-209]。しかし、薬剤の粘膜効果は一面に過ぎない。賦形剤は、鼻粘膜および上皮を介した薬物の輸送およびバイオアベイラビリティーを改善するためだけでなく、微生物汚染および分解から製剤を保護するためにも使用される。それらのエンハンサーおよび防腐剤は、毒性学的検査において考慮され、評価されなければならない。防腐剤の毒性学的関連性の顕著な例として、化粧品やいくつかの鼻腔内製剤に使用されている塩化ベンザルコニウム(BKC)がある。BKCは、ニワトリ胚の気管、ラット、モルモットの気管組織など、さまざまな動物モデルで脳血流に対する抑制効果を示した。この効果は、最終的な応答として、繊毛性と繊毛毒性と用量と時間に依存している[210,211]。ラットの生体内試験組織学的検査では、BKCも鼻病変を誘発することが示された。ラットの鼻腔内に0.05および0.10 w/v %の濃度のBKCを投与すると、鼻粘膜前部の上皮剥離、変性、水腫、好中球浸潤などの病理組織学的所見が得られた[212]。さらに研究は、生体内の鼻粘膜に対するBKCの毒性効果をサポートしている[213]。例えば、ある研究では、10μlの鼻腔用ステロイド製剤を、BKCの有無にかかわらず(310または220μg/ml)ラットに1日2回、21日間投与した。BKCを含む製剤を投与されたラットの鼻腔では、上皮細胞の高さの減少、個々の上皮細胞の多形性、繊毛の数の減少、上皮細胞層を覆う粘液の損失に関連した杯細胞の減少など、様々な変化が観察された[214]。さらに、試験管内試験では、ヒト鼻粘膜に対する毒性や脳血流阻害作用も観察されている[207, 215]。それにもかかわらず、BKCの生体内試験での毒性効果を報告していない研究があるので、BKCに関する安全性の懸念は依然として論争の的となっている。しかし、生体内での水性製剤でのBKCの使用は安全であると考えられている[194, 213, 216]。欧州医薬品庁(EMA)は、医薬品製品中のBKCの平均的な経鼻使用量は0.02~0.33mg/mLであり、前臨床データでは、ラットの試験管内試験および生体内試験で繊毛に対する時間と濃度に依存した毒性効果が示されているとまとめている。さらに、彼らは、患者の一般的な集団に対して安全性の限界を推奨することはできないと述べている[217]。
防腐剤の他に、浸透促進剤も鼻腔内製剤に使用されている。これらは、鼻上皮および粘膜を横断する化合物のバイオアベイラビリティーおよび輸送を改善するものである。エンハンサーの望ましい効果としては、TJの開口、粘液層の変化、およびタンパク質分解酵素の阻害が挙げられる。逆に、それらの機能は、破壊的な性質を有し、したがって、付加的であり得る有害な副作用をもたらし得る[192,194,204,216]。多くの物質および化合物は、鼻粘膜に刺激物として作用するが、非損傷性であることを考慮することが不可欠である。製剤の局所効果は常に薬物と賦形剤の相互作用である。さらに、安全性の問題について結論を出す前に、用量、時間、試験管内試験システム、動物種などの試験方法を慎重に評価しなければならない。
全身性および中枢神経系の副作用
経口または静脈内適用のような他の投与経路と比較して、INDDを使用する主な利点の1つは、代謝性ファーストパス効果のバイパス、および全身性副作用のリスクの低減である。AERODIOLとして販売されている経鼻17 b-エストラジオールは、経口薬物送達よりもIN薬物送達の方が優れている可能性がある例である。いくつかの臨床研究では、AERODIOLは、経口または経皮送達と比較して、少なくとも同程度の効率性を示しながら、乳房痛や破過出血などの全身性の副作用が少ないことが示されている[132-134, 218]。ジアゼパムやミダゾラムなどのベンゾジアゼピン系薬剤の経鼻投与についても同様のことが観察されたが、これらは他の適応症のほかに、緊急時の発作やてんかんの治療にも使用されている。観察される主な全身性の副作用には、鎮静、眠気、眠気、健忘症だけでなく、呼吸抑制も潜在的な副作用である[219]。しかし、臨床および病院前の研究では、INベンゾジアゼピンは経口、直腸または静脈内投与と同等またはそれ以上に安全であるという見解が支持されている[220,221]。中枢神経系に対する多くの全身性の副作用および影響は、物質が血液循環に到達し、BBBを通過する能力に起因する。従来のてんかん治療では、不適切な投与および誤った薬剤選択の結果として、薬剤がBBBを十分に通過しない場合に、抗てんかん薬に対する薬剤抵抗性が起こりうる[222]。これらの合併症や薬物関連の毒性は、適切な薬物送達システムによって克服することができる。ナノテクノロジーをベースにしたシステムは、ntb送達を改善するための新技術である。これらのシステムは、より的を絞った効率的な脳への送達を容易にし、同時に副作用を軽減することができる[223]。ナノテクノロジーベースの薬物送達システムを使用することの利点は、てんかん、精神病関連障害、神経膠腫などの異なる中枢神経系の適応症に対して示されている[152, 223-227]。
経鼻投与される交感神経模倣薬オキシメタゾリンは、鼻炎の局所治療薬としてだけでなく、麻酔薬として、またエピスタキシスの治療にも使用されている。オキシメタゾリンは強力な末梢性αアドレナリン作動薬であるが、全身の血液循環に達すると、中枢性α2アドレナリン受容体を刺激することもある。したがって、全身への悪影響には、特に、血管収縮および交感神経系への影響(高速、不規則またはドキドキするような心拍、頭痛、めまい、眠気、高血圧、神経質および震えなど)が含まれる [197,228,229]。これらの作用は、高血圧、頻脈、末梢血管収縮を引き起こす可能性がある。しかし、経鼻オキシメタゾリンの副作用プロファイルは、投与経路を問わず、特異的なものではなく、一般的な交感神経刺激薬の副作用と一致している。さらに、それらの副作用は、小児医療および基礎疾患を有する患者に特に関連している[228-232]。
経鼻投与された薬剤および製剤は、静脈内または経口投与などの他の投与経路と比較して、全身的に優れた忍容性を示している。これは主に代謝性フィストパス効果の回避によるものである。さらに、抗てんかん薬に対する薬剤耐性のような臨床で観察される全身性の副作用は、薬剤自体の特性、誤った取り扱いまたは過量投与に依存するが、投与経路には依存しない[222]。
肺作用
薬物や物質に起因する呼吸器や肺の問題は、臨床観察や組織学的観察で集中的に記述されている。それらの影響は、睡眠中の咳や呼吸障害などの軽度のものから、肺毒性、感染症、肺炎、アシドーシスなどの重度のものまで多岐にわたる。呼吸器に影響を及ぼす物質や薬剤は1300種類以上がリストアップされている(www.pneumotox.com)。本レビュー記事では、IN投与後に呼吸器系に有害な影響を誘発する薬剤のみを取り上げる。上述したように、ベンゾジアゼピン系薬剤は、小児集団における緊急発作イベントの治療のために経鼻的に適用される。1つの既知の副作用は、治療誘発性呼吸抑制である。しかし、この副作用は投与経路とは無関係である。実際、収集されたデータによると、ミダゾラムやジアゼパムなどのベンゾジアゼピン系薬剤の静脈内投与は、経口または静脈内投与に比べて呼吸抑制に関して安全であることが示唆されている。直腸投与と同等の安全性があると判断されている[219, 233, 234]。もう一つの例は神経ホルモンであるオキシトシンであり、これは陣痛誘発、中絶、または産後出血のコントロールに静脈内投与で使用される。オキシトシンは比較的安全な薬物として記載されているにもかかわらず、肺高血圧および肺水腫などの治療誘発性の重篤な副作用および生命を脅かす副作用のまれな症例が報告されている[235-238]。精神疾患の治療として、経鼻的に送達されたオキシトシンが研究されている。ヒトを対象としたINオキシトシンの研究が多数ある;しかしながら、有害事象は標準化されたスキームに従って記載されておらず、したがって一貫性のない報告がなされている [161-163, 239, 240]。IN投与は一般的な投与経路ではないため、オキシトシンのIN投与と静脈内投与の安全性への影響を比較した研究はまれである。INオキシトシン投与の安全性データを報告している文献レビューでは、喘息発作などの軽度の呼吸器作用のみが言及されている[241, 242]。
肺作用は、製剤が市場承認を遅らせる、あるいは承認後に取り下げられる重要な理由となりうる。これは、肺薬物送達の分野にとって教訓となった。Exubera®は 2006年に米国市場に参入したPfizer Labs社(ニューヨーク州ニューヨーク市)の吸入型インスリンの最初の承認製剤であった。Exubera®は、肺疾患のない非喫煙者の1型および2型糖尿病の治療に使用された[243]。Exbuera®は、経済的な理由のほかに、肺毒性の問題があった[244]。また、臨床使用中に非進行性の乾性咳嗽等の症状が認められ、長期使用により肺機能パラメータが低下したため、肺機能検査が必要となった[243, 245]。また、過去にExbuera®を使用した喫煙者で肺がんを発症した例もあった。インスリンは成長因子であり、インスリンの吸入は、増殖性インスリン様成長因子(IGF-1)経路の二次的な活性化につながる可能性がある[246]。しかし、これらの肺がん症例が吸入インスリン製剤と関連しているかどうかを判断するには、症例数が少なすぎた[243]。2014年以降、マンカインド・コーポレーション社がPK/PD特性を改善した吸入インスリン製剤「アフレッツァ」の米国での承認を取得したが、結局、肺毒性の問題は否定できなかった[247]。
薬剤自体だけでなく、製剤の他の成分が肺や呼吸器への悪影響をもたらす可能性があることを考慮することが重要である。投与量および濃度依存的に、塩化ベンザルコニウムは、その標的臓器が肺であることを示した。それは、吸入後に肺の炎症、炎症および肺胞障害を誘発し、ラットにおける経口または静脈内投与後に肺水腫および肺炎を引き起こす可能性がある[248]。実際、鼻腔スプレーの防腐剤として0.007~0.01%の低濃度で使用される塩化ベンザルコニウムは、肺への影響に関しては安全であると考えられている[249]。
規制上の考慮事項
市販候補品の承認を得ることは、長い医薬品開発の手順の終わりであるが、規制面は最初から認識しておく必要がある。米国で任意の新薬の承認を得るためには、安全性、有効性、品質を考慮する必要がある。これらの情報は、新薬申請(NDA)としてFDAに提出することになる。しかし、現時点では、吸入インスリン(Exbuera®)のようないくつかの例について以前に説明したように、経口吸入および/または経鼻製剤(OINDP)は、すでに承認された製品の再利用のために最も頻繁に議論されている。したがって、このセクションでは、米国食品医薬品局(FDA)の要件に関する呼吸器デリバリーのための特別な安全性、有効性、品質の考慮事項に焦点を当てている。さらに、生物学的製剤については、生物学的製剤だけでなく低分子医薬品にも適用されるため、別途言及していない。
新薬がFDAに承認されるまでには、505(b)(1)、505(b)(2)のNDA、505(j)の略式NDAの3つの異なる規制パスがある。呼吸器送達のような新しい投与経路を使用した再利用医薬品は、規制手続き505(b)(2)の資格を得ることができる。これは、以前に承認された医薬品の安全性と有効性のデータを利用できるため、有益な場合がある[250-252]。前臨床試験や全身の安全性は、承認された薬剤の以前の試験のデータによって正当化される可能性があったとしても、新たな前臨床試験や臨床試験から必要とされる追加的な情報はまだ存在する[253]。
前臨床試験の考察
FDAは、再製剤化された医薬品と代替投与経路の場合に必要となる可能性のある前臨床試験をまとめたガイダンス文書を公表した。一般的に、すべての医薬品の再製剤及び新しい投与経路を有するすべての医薬品については、ICH M3(R2)及びICH S9に概説されている推奨事項に従わなければならない。IN送達のための前臨床試験の試験デザイン要件は、新製剤の吸入試験と同様でなければならない。これらの試験には、2種(少なくとも1種は非げっ歯類)を対象とした短期試験(2~4週間)と、その後、最も適切な種を対象とした最長6ヶ月間の慢性試験が含まれる。慢性吸入試験において、増殖性又は前駆細胞性の変化をもたらす毒性が観察されず、以前の発がん性試験で経口経路による十分な局所気道暴露が 達成された場合には、吸入経路での追加の発がん性試験は必要とされない。局所の安全性については、ガイダンス文書には、局所組織(肺、鼻粘膜、気管支)及び影響を受ける可能性のある脳領域の組織学的評価が含まれている [254]。
Salminen、Wiles、Stevensは505(b)(2)のNDAの非臨床要件をレビューでまとめているが、非臨床要件は医薬品に大きく依存していると結論付けている[255]。例えば、有効性評価のために追加試験が必要かどうかは、製品の用途に依存する。全身用の OINDP の場合は、生物学的同等性薬物動態試験や相対的なバイオアベイラビリティー試験により、呼吸経路での有効性を示すことが可能な場合がある。しかし、局所使用の場合は、目的の異なる先行研究から有効性を導き出すことはできない[253]。
臨床的考察と人的要因
臨床領域では、全身曝露による安全性情報は、既に承認されている医薬品有効成分(API)や賦形剤(不活性成分)には再利用できるが、局所曝露に使用することを意図している場合には再利用できない。その場合、新たな安全性情報を作成しなければならない;これは未承認の賦形剤を使用する製剤にも当てはまる [253]。通常、505(b)(2)の申請には、経鼻投与経路の有効性を実証するための第III相臨床試験が必要となる。経鼻薬物送達デバイスの最大のハードルの1つは、患者とデバイスとの相互作用インターフェースである。これは、性能および有効性に影響を与え、効果のない、または安全でない使用につながる可能性がある。そのため、FDAはヒューマンファクターエンジニアリング(HFE)およびユーザビリティエンジニアリング(UE)のガイドラインに取り組んでいる[256-258]。
CMCの考慮事項
化学・製造・制御(CMC)の分野では、品質管理(QC)プログラムと「製品特性評価」試験を含む実質的な情報が必要とされる。OINDP の QC プログラムには、例えば、経鼻スプレー、定量吸入器(MDI)ドライ パウダー吸入器(DPI)の送達された用量の均一性、空気力学的粒度分布、抽出物の試験に関する推奨事項が含まれている [259, 260]。勧告では、申請者はデバイス開発の初期段階で重要な品質属性のリストを作成すべきである。しかし、物理的、化学的、生物学的又は微生物学的な特性又は特性である クロロキンA は、ICHQ8(R2) [260]に概説されている所望の製品品質に沿ったものでなければならない。CMC 領域は OINDPs のための特別な課題であり、承認された経鼻送達デバイスの場合もデバイスの性能は固定されていない。性能は製剤と患者の相互作用に依存するため、批判的に評価しなければならない。
結論
現在までのところ、IN製剤は主に局所および全身適応で承認されており、季節性鼻炎や疼痛管理だけでなく、小児のてんかん発作などの緊急時にも使用されている。しかし、全身投与後の薬剤のバイオアベイラビリティーがBBBによって制限されていることから、神経変性疾患やその他の中枢神経系疾患のように、中枢神経系の適応症でのINDDへの関心が高まっている。さらに、現在のCOVID-19パンデミックで肺疾患が発生しているように、ワクチン開発には鼻からの投与も含まれるようになるであろう。非侵襲的な使用の利点と、全身的な副作用を軽減するためのより標的を絞った投与の可能性とは別に、製剤面での限界と毒性学的な考慮事項がまだ存在している。解剖学や生理学だけでなく、病理学的なメカニズムや互いの影響を理解するために、より多くの基礎研究が必要とされている。IN投与後に個々の化合物が取る経路や分布経路を解明することは、INアプローチに適した薬物送達システムを開発するために極めて重要である。生体内でのイメージング法(ライブおよびレトロスペクティブ)と、それぞれの組織または標的臓器における化合物レベルの定量分析を組み合わせた、より多くの実験的アプローチおよび研究が必要とされている。また、製剤組成が薬物の分布経路や経路に与える影響についても、さらに研究が必要である。剤形特性と経鼻デバイス技術は、例えば全身吸収よりもntb送達や肺送達を好む方法について、標的臓器への送達を最適化するための焦点となるであろう。公表されている研究に基づいて、脳内で治療レベルを達成するためには、それぞれの薬剤にどのような用量が必要なのかは不明である。そのため、効率的な送達のためには、異なる製剤アプローチを系統的に比較検討する必要がある。したがって、鼻から脳や体の他の部分への薬物やその製剤の輸送における嗅覚神経と三叉神経の役割を解明することは、治療アプローチの新たな可能性を開く重要な基礎研究課題である。遺伝子治療や細胞治療のアプローチを必要とする適応症だけでなく、季節的に出現するパンデミックや肺疾患も、将来的に最適化された堅牢なINDDシステムの恩恵を受けることになるであろう。臨床段階にある医薬品の数の増加や、新しい経鼻送達デバイスの開発は、市場承認に必要な規制上の考慮事項やガイドラインの開発を促進することにもなる。
