Contents
Impact of aerobic exercise and fatty acid supplementation on global and gene-specific DNA methylation
www.tandfonline.com/doi/full/10.1080/15592294.2019.1582276
概要
運動や栄養補助食品を含む生活習慣の介入は、DNAメチル化を修飾し、健康上の利点を発揮することができるが、その根底にあるメカニズムは十分に理解されていない。ここでは、急性有酸素運動とオメガ3系多価不飽和脂肪酸(n-3 PUFA)とエキストラバージンオリーブオイル(EVOO)の補給が、グローバルおよび遺伝子特異的(PPARGC1A、IL-6,TNF)DNAメチル化、および無病人の白血球におけるDNMT(DNAメチルトランスフェラーゼ) mRNA発現に与える影響を調査した。
訓練を受けた8人の男性サイクリストを対象に、二重盲検、無作為化、反復測定デザインで、n-3 PUFAとEVOOを4週間補充した前後の運動テストを実施した。運動は、グローバルなメチル化低下(事前 79.2%;事後 78.7%; p = 0.008)を誘発し、同時に、メチル化低下(事前 6.9%;事後 6.3%; p < 0.001)と PPARGC1A の mRNA 発現の増加(p < 0.001)をもたらした。
メチル化と運動パフォーマンスとの間の関連も検出された。サプリメントとトライアルの間の相互作用は、n-3 PUFAに続くDNAメチル化の増加とEVOOに続くメチル化の減少を示すIL-6の1つのCpGについて検出された(p = 0.038)。
炎症および酸化ストレスのマーカーと関連したグローバルおよび遺伝子特異的なDNAメチル化。EVOOの補充は、n-3 PUFAの補充と比較してDNMT1のmRNA発現を減少させた(p = 0.048)一方、DNMT3a(p = 0.018)とDNMT3bのmRNA発現を減少させた。今後の研究では、DNAメチル化に対する生活習慣の介入の影響をさらに解明する必要がある。
キーワード
PPARGC1A、IL-6,TNFa、DNMT、DNAメチル化、運動、炎症、n-3 PUFA
序論
運動や食事介入などの環境刺激は、グローバルレベルおよび遺伝子特異的レベルでDNAメチル化を修飾する可能性がある[1]。運動トレーニングの研究では、骨格筋 [2-4] と血液白血球 [5-7] の両方において、運動後のゲノムのメチル化低下が実証されている。骨格筋では、急性運動によりゲノムのメチル化が誘導されることが実証されている[4,8-10]が、急性運動後の白血球のDNAメチル化を調べた唯一の研究では、DNAメチル化の変化は検出されなかった[11]。急性運動が白血球のDNAメチル化に与える影響についての文献は少ないが、白血球のトランスクリプトームのリモデリングによってエピジェネティックな影響が示唆されている[12-14]。
急性運動は、免疫応答のミトコンドリア生合成、代謝、筋肉のリモデリングなど、様々な細胞プロセスに関与する遺伝子の発現調節と関連している[14-16]。ペルオキシソーム増殖因子活性化受容体γ・共活性化因子α(PGC1-a)をコードするPPARGC1A遺伝子は、ミトコンドリア生合成のマスターレギュレーターとして知られており、有酸素トレーニング適応において重要な役割を果たしている[17]。免疫細胞では、PPARGC1Aは抗炎症[18,19]および抗酸化防御[20]に関連しているが、運動誘発性の炎症および酸化ストレスがPPARGC1AのDNAメチル化に与える影響は不明である。エピジェネティック研究では、PPARCG1Aのプロモーターから260塩基のCpG部位がmRNA発現の調節と関連している。骨格筋では、運動は PPARGC1A -260 CpG サイトを脱メチル化し、PPARGC1A mRNA 発現を同時にアップレギュレートすることが示されている [8,10,21]。骨格筋ではよく特徴づけられているが、免疫細胞を含む他の細胞や組織でのPPARGC1A発現の調節については十分に理解されていない[22]。
十分な強度と持続時間の運動は、組織の損傷を引き起こし、全身性の炎症反応を引き起こす可能性がある [14,23]。炎症性サイトカインであるIL-6およびTNFaの循環レベルの上昇は、サルコペニアの進行および身体能力の測定値と強い相関がある[24,25]。急激な運動はまた、骨格筋と免疫細胞の両方で活性酸素種の産生を増加させ [26]、酸化ストレスの発生や脂質、タンパク質、DNAの損傷につながる可能性がある [27]。酸化ストレスのマーカーやIL-6やTNFaなどの炎症性サイトカインの循環レベルの上昇は、DNAメチル化酵素(DNMT)[28-32]の発現を変化させ、DNAメチル化パターンに影響を与えることが示されている[11,33]。炎症性サイトカインのDNAメチル化は、関節リウマチ[34]や肥満[35]に伴うIL-6を含む様々な炎症性疾患と関連している;2型糖尿病[36]やアルツハイマー病[37]に伴うTNFのDNAメチル化。運動後の炎症性サイトカインの循環レベルが上昇しているにもかかわらず[14,23]、IL-6やTNFなどの炎症性サイトカインをコードする遺伝子のDNAメチル化に及ぼす運動の影響は不明のままである。
脂肪酸(FA)の栄養補給は、DNAメチル化の調節を介して運動誘発性炎症を予防する可能性がある。オメガ3多価不飽和FA(n-3 PUFAs)とエキストラバージンオリーブオイル(EVOO)を含むFAのサプリメントは、炎症のレベルを低下させるために消費されている[38,39]しかし、運動誘発性炎症に対するこれらのサプリメントの影響は明らかではない。いくつかの研究では、FAサプリメントで運動後の炎症の減少が検出されている[40,41]一方で、他の研究では炎症に変化がないことが報告されている[42,43]。FA補給の抗炎症効果のための新たなメカニズムは、エピジェネティックな変更[44-47]を経由している。n-3 PUFAsの高いオキアミ油と食事のサプリメントは、PPARGC1A mRNA発現を減少させることが実証されており、mRNA発現の変化は、血漿中のn-3 PUFAsの変化に負の相関があった[48]。総n-3 PUFA含有量は、IL-6 DNAメチル化およびIL-6タンパク質濃度の両方に負の相関がある[47]。
EVOOは、n-3 PUFAの影響を評価するための運動研究で一般的に使用されるコントロールである;しかしながら、EVOOのサプリメントはまた、炎症に関連する遺伝子のDNAメチル化を変更することが報告されている[49]。FAの補給が運動誘発性炎症にエピジェネティックな影響を与えるかどうかは、同定されていないままである。
本研究では、有酸素運動が無病者の白血球におけるグローバルおよび遺伝子特異的(PPARGC1A、IL-6,TNF)DNAメチル化およびDNMT mRNA発現に与える影響を調査した。また、これらの関係がFAの補給によって修飾されるかどうかを調べた。また、運動パフォーマンスに関連する生理学的マーカー、運動後の炎症や酸化ストレスとDNAメチル化との関連についても検討した。
結果
グローバルシトシンメチル化とDNMT mRNA発現
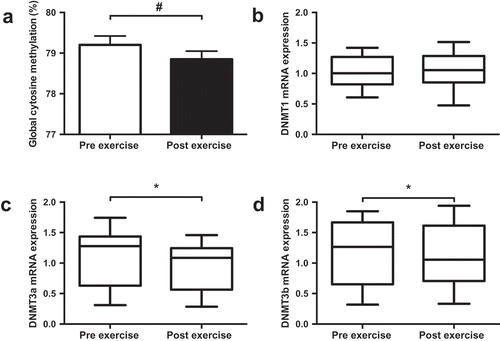
1時間のサイクリングは、Luminometric Methylation Assay(LUMA;図1(a);Pre 79.2%;Post 78.7%、p = 0.008)によって評価されたグローバルメチル化を減少させ、DNMT3a(図1(c);p = 0.018)およびDNMT3b(図1(d);p = 0.046)の両方のmRNA発現を減少させた。FAのサプリメントは、DNMT3aまたはDNMT3bのグローバルなメチル化またはmRNA発現を変化させなかった(図2; p > 0.05)。DNMT1のmRNA発現は運動によって影響を受けなかったが、サプリメントとトライアルの間に有意な相互作用が確認された(p = 0.048; 図2(b)2つのサプリメントによるmRNA発現への差動効果を示唆している。グローバルDNAメチル化値とDNMT mRNA発現との間には相関関係は検出されなかった。
図1. DNMT1(b)、DNMT3a(c)、DNMT3b(d)のグローバルDNAメチル化値(a)とmRNA発現に及ぼす運動の影響。データは各時点での全試行の平均値として示されている。* p < 0.05,# p < 0.01。
図2. グローバルDNAメチル化(a)およびDNMT1(bDNMT3a(c)およびDNMT3b(d)のmRNA発現に対するn-3 PUFAおよびEVOOのサプリメントの影響

データは、各サプリメントについて、サプリメント投与前と投与後の試験(サプリメント投与後-サプリメント投与前)の間の相対的な変化(Δ)として示されている。* p < 0.05.
遺伝子特異的DNAメチル化とmRNA発現
PPARGC1A
運動後にPPARGC1AのDNAメチル化の減少(Pre 6.9%;Post 6.3%、図3(a);p<0.001)とmRNA発現の増加(図3(b);p<0.001)が検出された。FAの補充は、PPARGC1AのDNAメチル化またはmRNA発現に影響を与えなかった(p>0.05)。PPARGC1A DNAメチル化とDNMT3aおよびDNMT3b mRNA発現との間に、中等度ではあるが有意ではない負の相関が検出された(図5)。
図3. CpG-260のDNAメチル化(a)およびPPARGC1AのmRNA発現(b)に対する運動の影響

データは、各時点での全試行の平均値として示されている。# p < 0.01.
IL-6
運動後のIL-6タンパク質濃度の上昇(Pre: 0.63 ± 0.24 pg/mL, Post: 3.78 ± 0.55 pg/mL; p < 0.001)にもかかわらず、運動後のIL-6 DNAメチル化(p > 0.05)またはmRNA発現(p > 0.05)に変化は見られなかった。CpG3(-1094)については、n-3 PUFAに続いてDNAメチル化が増加し、EVOOに続いてメチル化が減少したことを示す有意な相互作用がサプリメントとトライアルの間で検出された(図4(a); p = 0.038)。同様の、有意ではない(p = 0.080)傾向は、補充後のIL-6 mRNA発現のために検出された(図4(b))。すべてのCpG部位にわたる平均IL-6メチル化とDNMT3b mRNA発現との間に有意な相関が検出された(、p = 0.007)。
図4. IL-6 CpG3 DNAメチル化(a)およびIL-6 mRNA発現(b)に対するn-3 PUFAおよびEVOO補給の影響

データは、補充前と補充後の試験(補充後-補充前)の間の変化(Δ)として示されている。 n-3 PUFA、n-3多価不飽和脂肪酸、EVOO、エキストラバージンオリーブオイル。* p < 0.05.
図5. すべての条件(サプリメント、時間、トライアル)にわたるDNAメチル化平均値と遺伝子発現値との間のスピアマンのRho相関係数
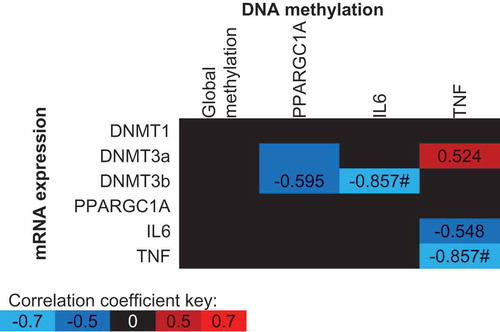
各遺伝子について評価されたすべてのCpG部位の平均値は、関心領域の全体像を提供するために使用されている。青は負の相関を示し、赤は正の相関を示し、黒は-0.5〜0.5の間の相関係数を示す。* p < 0.05,# p < 0.01。
TNF
運動またはFAsの補給はいずれもTNF DNAメチル化またはmRNA発現を変化させなかった。3つのTNF CpG部位と補充後の差動メチル化の間に傾向が確認された(CpG2 p = 0.069; CpG3 p = 0.098; CpG4 p = 0.067; CpGmean p = 0.077)。TNF DNAメチル化は、TNF mRNA発現と負の相関を示した(図5;p = 0.007)。しかし、IL-6およびDNMT3a mRNA発現とTNF DNAメチル化との間には、中程度の、しかしながら、有意ではない相関が検出された(図5)。
DNAメチル化と運動後の生理学的マーカーとの関連性
図6は、運動後のDNAメチル化と運動、酸化ストレス、炎症に関連する生理学的マーカーとの関連を示している。FAの補給に先立って、PPARGC1AとTNFの両方のメチル化ポスト運動は、タイムトライアル(TT)パフォーマンス(図6,p < 0.05)と有意に相関している。n-3 PUFAとEVOOの補充に続いて、TTパフォーマンスとPPARGC1AとTNF DNAメチル化の両方の間の相関は弱まり、もはや有意ではない(図6)。末梢血単核球(PBMC)プロテインカルボニル(PC)濃度、酸化ストレスの細胞内指標、グローバルおよびPPARGC1Aメチル化の両方の間に負の相関が検出されたが、n-3 PUFAの補充前には、関連性は検出されないでした(図6)。酸化ストレスの全身的な尺度である血清中のPCの濃度は、ベースラインではDNAメチル化とは無関係でしたが、EVOOの補充に続いて、有意な相関は血清PCとPPARGC1AとTNFの両方のDNAメチル化(図6)の間に存在していた。DNAメチル化と血清IL-6濃度の間の唯一の有意な相関は、n-3 PUFA補給後のグローバルDNAメチル化と負の相関であった(図6)。
図6。運動後のDNAメチル化と運動パフォーマンス、酸化ストレス、炎症に関連する生理学的マーカーとの間のスピアマンのRho
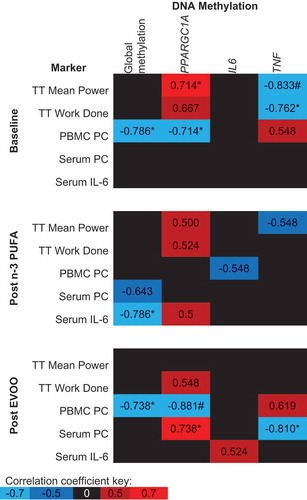
各遺伝子について評価したすべてのCpG部位の平均値は、関心のある領域の全体像を示すために使用されている。青は負の相関を、赤は正の相関を、黒は-0.5から0.5の間の相関係数を示す。 n-3 PUFA、オメガ3系多価不飽和脂肪酸;EVOO、エキストラバージンオリーブオイル;TT、タイムトライアル;PC、プロテインカルボニル。*p < 0.05,# p < 0.01。
議論
有酸素運動とFAの補給は、白血球のDNAメチル化とmRNAの発現パターンを調節することができる。1 時間のサイクリングバイトは、グローバルおよび PPARGC1A の DNA メチル化と DNMT3a、DNMT3b、PPARGC1A の mRNA 発現を減少させた。FAの補給は、IL-6のプロモーター領域のCpGサイトのDNAメチル化に異なる効果を誘導した; n-3 PUFAはメチル化を増加させ、一方、EVOOの補給はメチル化を減少させた。DNMT1のmRNA発現についても同様の結果が確認され、プロモーター領域TNFの3つのCpG部位についても傾向が存在した。グローバルDNAメチル化、PPARGC1A、IL-6,TNFの運動後のDNAメチル化、運動パフォーマンス、炎症、酸化ストレスに関連する生理学的マーカーとの間に有意な相関が確認され、エピジェネティックな修飾が機能的な効果を持つことが示唆された。
今回初めて、運動後の白血球におけるグローバルなメチル化亢進を報告した。急激な運動が血球に与える影響を調べた唯一の先行研究は、複数の検査を補正した後のDNAメチル化の変化を検出することができなかった[11]。本研究の結果は、慢性的な運動トレーニング[2-7]や急性の運動後に血漿[50]や骨格筋[4,8]で正味のメチル化量が減少したという以前の報告と一致している。他の研究では、グローバルなDNAメチル化の変化を検出することができなかった[51,52]が、これは、DNAメチル化の増加と減少のCpG部位の数が同じであることによって説明できる[51]。また、運動によって誘発されたメチル化低下は、デトレインの期間中に保持され、更なるトレーニング後に更にメチル化低下することが実証されている[4]。これらのデータは、急性および慢性の運動が、典型的には低メチル化をもたらすDNAメチル化パターンを変化させるのに十分であることを示唆している。
本研究では、FAの4週間のサプリメントは、グローバルなDNAメチル化に影響を与えなかった。対照的に、n-3 PUFAの6ヶ月間のサプリメントは、アルツハイマー病患者のグローバルDNAメチル化のためのサロゲート、LINE-1 DNAメチル化を減少させた[53]。しかし、LINE-1のメチル化は、健康なコントロール[54]と比較してアルツハイマー病患者で増加しているため、これらの個人におけるn-3 PUFAの補充は、健康な個人で検出された正常なレベルにグローバルなDNAメチル化を復元するために作用する可能性がある。グローバルメチル化(LUMA対LINE-1)の異なる代替手段の使用は、これらのアッセイが調査する異なる領域の研究間の直接比較を防ぐことができる。2つの別個の研究では、LINE-1とLUMAによって提供されるメチル化推定値はあまり相関がないことが示されている[55,56]。
初めて、有酸素運動後のメチル化の減少と同時に増加したPPARGC1AのmRNA発現が白血球で検出された。本研究の結果は、有酸素運動によって骨格筋のメチル化が低下したという過去の報告[2,8,10]と一致しており、運動が PPARGC1A の DNA メチル化に全身的な影響を与えている可能性を示唆している。骨格筋とPBMCsのmRNA発現プロファイルは、n-3 PUFAを8週間補充した後に高度に関連していることが示されている[57]。我々は、本研究ではPPARGC1Aのメチル化/mRNA発現とn-3 PUFAの補給との関連を見つけることはできないが、本研究で検出されたハイメチル化は、骨格筋のサロゲートとして使用される血液由来の発現プロファイルのさらなる証拠を提供し、骨格筋における運動の影響と一致している。
白血球からのPPARGC1Aのメチル化に関する唯一の以前の報告は、身体活動との関連を検出することができなかった[58]。以前の関連性の欠如は、PPARGC1Aのプロモーター領域における異なるCpG部位の調査の結果である可能性がある。あるいは、これらの結果の不一致は、免疫細胞のメチル化パターンの不均一性を反映している可能性もある[59]。運動は循環白血球の数を増加させるので、メチル化の変化はDNAメチル化パターンの変化というよりも、白血球の割合の違いによるものかもしれない[60]。本研究では、白血球(リンパ球、好中球、単球、好塩基球、好酸球)の数を考慮してDNAメチル化の値を調整している[59]が、これまでの報告ではこの重要な変数を考慮していなかった。
白血球PPARGC1Aメチル化と運動パフォーマンスの間に正の相関があることは、DNAメチル化の増加がパフォーマンスの優位性をもたらす可能性を示唆している。PPARGC1Aは、単球におけるミトコンドリアの生合成をアップレギュレートし、抗炎症表現型へのシフトを誘導すると考えられている[18,19]。IL-6 タンパク質濃度との関連は認められなかったが、PPARGC1A の DNA メチル化と PC 濃度との間には負の関連が検出され、PPARGC1A の抗酸化的役割のエピジェネティックな制御が示唆された。運動後の白血球と骨格筋のミトコンドリア機能を比較した文献は限られているが、骨格筋組織とPBMCsの両方における歩行速度とミトコンドリア機能の関連は、骨格筋のミトコンドリア機能と血液由来のミトコンドリアの間に保存されたメカニズムを提供している[61]。保存されたメカニズムのさらなる証拠は、ミトコンドリアの構造と機能に関連する遺伝子が、有酸素運動後の骨格筋と好中球で共発現していることから示唆されている[62]。本研究で白血球で検出されたのと同じ表現型の関連性が骨格筋でも存在するかどうかを調べるためには、今後の研究が必要である。
有酸素運動は、IL-6またはTNFのDNAメチル化またはmRNA発現を変化させなかった。運動が炎症性サイトカインに与えるエピジェネティックな影響は比較的知られていないが、いくつかの研究で炎症性疾患におけるサイトカインのDNAメチル化の役割が示唆されている[34-37]。本研究では、TNFのDNAメチル化とmRNA発現との関連は検出されなかったが、n-3 PUFAは、骨格筋細胞の炎症に伴って観察されるエピジェネティックな変化を逆転させることが以前に実証されている。TNFの投与はハイパーメチル化を誘導し、MyoDのmRNA発現を減少させた[63]が、EPAの補充は筋肉におけるTNFの影響を和らげ、MyoDのmRNA発現を回復させる[44]。本研究ではIL-6の循環タンパク質濃度が上昇したにもかかわらず、運動負荷はTNFaタンパク質濃度を上昇させず、炎症性サイトカインのDNAメチル化パターンを修飾するのに十分な炎症反応を誘発した可能性がある。TNFのハイパーメチル化は、同じ期間にエネルギー消費量を減少させた人と比較して、8年間で500kcal/wkのエネルギー消費量を維持または増加させた高齢者で報告されている[64]。本研究と同じTNF CpG部位は、以前にmRNA発現、血漿中濃度、および脂肪率の測定値と負の関連性を示すことが示されている[65,66]。本研究では、運動後のTNF DNAメチル化とBMI、運動パフォーマンスおよびTNF mRNA発現との間に有意な負の相関が検出された。これらのデータは、急性の激しい運動はTNF DNAメチル化を調節しない可能性があることを示唆しているが、定期的な運動の長期的な利点である脂肪率の低下は、その後TNF DNAメチル化レベルを上昇させ、その結果、TNF mRNA発現および脂肪率の上昇に関連する慢性的な低悪性度炎症レベルを低下させる可能性がある。
以前に、IL-6プロモーターの上流~600 bpの領域のメチル化の減少は、赤血球n-3 PUFA濃度およびmRNA発現の増加と関連していた[47]。本研究では、EVOOとn-3 PUFAの補充は、IL-6の1つのCpG(-1094)に対して対照的な効果を示した(n-3 PUFAに続くメチル化の増加とEVOOによるメチル化の減少)。DNAメチル化と炎症性疾患[34,35]およびmRNA発現の両方との間の以前の関連付けのために、上流から〜1,000 bpの領域を本研究で調査した。研究間の矛盾する結果は、プロモーターの異なる領域が異なるIL-6発現を調節していることを示している可能性がある。n-3 PUFAとOOのサプリメントは、FAの代謝を担当しているエロンガーゼとデサチュラーゼ酵素の差動メチル化を誘導することが示されている[67]。これらの酵素の差動DNAメチル化は、より少ない炎症性エイコサノイドの生産に向かって切り替えるためにn-3 PUFAsのための可能性を示している。デサチュラーゼとエロンガーゼ酵素のDNAメチル化は、本研究では測定されていないが、そのような2シリーズのプロスタグランジンではなく、3シリーズのようなn-3 PUFA由来のエイコサノイドの生産に向かってスイッチは、潜在的にn-3 PUFAが、EVOOではなく、サプリメントに続くIL-6の増加したDNAメチル化によって示されているサイトカイン発現[38]を減らすために示されている。
DNMT mRNA 発現に対する運動と FA 補給の影響を調査し、DNMT mRNA 発現の変化が修飾された DNA メチル化の根底にある潜在的なメカニズムであるかどうかを確認した。その結果、DNMT1 mRNAの発現はFA補給により調節され、運動によりDNMT3aとDNMT3bの発現が低下した。これは、DNMT3aの発現が急性運動後に低下したことを初めて示したものであり、DNMT3bの発現低下は以前にも報告されている[31,68]。本研究では DNA メチル化評価を行うことで、1 回の有酸素運動で DNMT の発現が低下し、それに伴ってグローバルおよび遺伝子特異的な DNA メチル化が低下することを確認することができた。運動誘発性DNMT発現とDNAメチル化を同時に評価した唯一の報告は、8週間のレジスタンストレーニングプログラムであった[6]。ゲノムワイドな方法では、グローバルなメチル化の正味の増加または減少は確認されていないため、DNMT3bの変調がメチル化の亢進を引き起こすのか、またはメチル化の亢進と亢進の両方に重要であるのかを特定するためには、さらなる研究が必要である。
本研究では、DNMT1 mRNA発現に対するn-3 PUFAとEVOOの補給の対照的な効果を検出した。ヒトのDNMT発現に対するFA補給の影響を取り巻く文献は乏しいが、動物モデルでは、n-3 PUFAであるα-リノレン酸の補給がDNMT mRNA発現の変化と関連している[69,70]。興味深いことに、本研究と同様に、グローバルなDNAメチル化の変化は、変調されたDNMT1発現[69]と一緒に検出されないでした。DNMT1はDNAメチル化を維持する機能を持っているため、DNMT1 mRNAの発現が増加してもグローバルなDNAメチル化の変化は期待できない可能性がある。EVOOがDNMT発現に与える影響は不明であるが、EVOOにはデカルボキシメチルオレウロペインアグリコン(DOA)[71]を含むフェノール化合物が含まれており、競合的な阻害を介してDNMT活性を低下させる[72]。DNMT活性の指標がないことが今回の研究の限界であるが、DNMT mRNAの発現と活性の平行した変化が以前に報告されている[73]。活性を測定することで、DNMT mRNA 発現の変化とサプリメント摂取後の DNA メチル化の変化との関連性の欠如を説明できる可能性がある。
運動とFA補給はDNMTの発現に直接影響を与える可能性があるが、これらの介入は中間的なメカニズムによってDNMTの発現を修飾する可能性がある。miRNA-29 -130および-148を含むいくつかのmiRNAの発現が関連している。DNMT発現[74-77]、運動[78]、FA補給[79-81]。IL-6タンパク質レベルは、miRNAの調節を介してDNMT mRNA発現[30-32]を調節することが報告されている[29]。今回の研究では、運動後の IL-6 タンパク質発現の増加が小さかったため、DNMT 発現を調節するには不十分である可能性があり、これまでの報告との一致が見られなかった。今後の研究では、偏心運動などの炎症反応の強い運動を行い、運動誘発性炎症が DNMT 発現に及ぼす影響を調べる必要がある。DNMTs の発現を制御する同じ miRNA の発現を変更する運動と n-3 PUFA の補充の能力は、miRNA の発現が DNA のメチル化を制御する基礎的なメカニズムの 1 つである可能性を示唆している。
本研究では、訓練を受けたサイクリストの均質な集団の使用は、潜在的に他の集団への結果の一般化可能性を制限する。本研究では、トレーニングを受けた男性サイクリストを集団として選択したが、彼らは運動刺激に最も慣れており、これが最小のエピジェネティック反応に反映されると期待される。以前、COPD患者の血漿中のグローバルDNAメチル化を減少させるには運動を1回行うだけで十分であったが、トレーニング介入後には運動を行ってもグローバルDNAメチル化を減少させるにはもはや十分ではなかった[50]。運動トレーニングは、糖尿病の家族歴によってDNAメチル化パターンを異なる形で変化させることが以前に実証されている[2]。今後の研究では、トレーニングを受けたアスリートと定住者、あるいは疾患コホートにおける運動の影響を比較し、運動によって誘発されるDNAメチル化パターンの変化が多様な集団における健康や疾患に寄与しているかどうかを明らかにすべきである。
結論として、本研究では、有酸素運動の急性発作と訓練を受けた男性サイクリストの白血球におけるDNAメチル化とmRNA発現にFAの補充の影響を強調している。これらの遺伝子のエピジェネティックな制御における変化は、運動パフォーマンスや炎症/酸化ストレスに関連する生理学的マーカーと関連しているが、これらの関連性を確認するためには、より広範な研究が必要とされている。本研究の観察的性質は、運動とFA補給に続くDNAメチル化の変化を制御する基礎的なメカニズムの同定を妨げ、したがって、将来のメカニズム研究は、そのようなメカニズムを特定するために必要とされる。ここでは、DNMT mRNA発現の変調が将来の研究のためのそのようなメカニズムの一つである可能性があることを示唆している。今後の研究では、FAの運動と補給がDNAメチル化に全身的な効果を持つかどうかを調べるために、複数の組織タイプを比較する必要がある。
研究方法
参加者
表1に記載されている特徴を持つ8人の参加者について、データの完全なセットが利用可能であった。参加に先立ち、各参加者からインフォームドコンセントが提供された。参加者は、代謝性疾患または心血管疾患の既往歴のない健康な非喫煙者であった。研究に先立つ6ヶ月間、参加者はn-3 PUFA、抗酸化剤または抗炎症サプリメントの既往歴がなかった。参加者は、彼らの身体活動を記録し、研究を通して習慣的な食事を維持した。実験プロトコルは、ラフバラ大学倫理人間参加者小委員会によって承認され、ヘルシンキ1975年の宣言に従って実行された。
表1。参加者の特徴。Wmax、最大有酸素作業率。
研究概要
本研究は、事前試験と4つの実験試験から構成されている。実験試験は、二重盲検、無作為化、反復測定デザインでn-3 PUFAとEVOOの4週間のサプリメントの前と後に完了した。各補給期間の間に4週間のウォッシュアウトを行った(図7)。
図7。試験の概要(a)と試験日(b)の模式図。 n-3 PUFA、オメガ3系多価不飽和脂肪酸、EVOO、エキストラバージンオリーブオイル、Wmax、最大有酸素運動量。
プレテスト
参加者は研究開始前に身長、体重、8人分の体格測定を受けた。最大有酸素運動量(Wmax)と最大酸素摂取量(V̇O2max)は、Lode Excalibur Sport ergometer(Lode B.V, オランダ)を使用した段階的な運動テストを用いて決定された。運動テストは100Wで5分間のサイクリングのウォームアップ期間から始まりました。その後、自発的疲労(20revs∙min-1の自分で選択したケイデンスの減少)が起こるまで3分ごとに50Wのワークロードを増加させた。一次基準と二次基準を使ってV̇O2maxを測定できるように、各ステージの最後の1分間に呼気を集めた[82]。Wmaxは次の式を使って計算された。
Wmax=Workload÷[(t/180)x50]
ここで、tは最終ステージで完了した時間(秒)である。インクリメンタルサイクリングテストの終了後、参加者は10分間の休息をとり、15分間のTT慣れを完了した。
実験トライアル
試験は、一晩10時間の断食を行った後、朝(7-9時)に実施された。参加者には、試験の24時間前から3日間の食事日記を記入し、激しい運動を控え、アルコールやカフェインの摂取を控えるよう求めた。パフォーマンステストは、70%Wmaxで45分間のサイクリングと15分間のTT [83]で構成されていた。
サプリメント
n-3 PUFA(Holland and Barrett, Warwickshire, UK)とEVOO(Puritan’s Pride, New York, USA)の両方のサプリメントがカプセル形式で提供された。参加者は、5.7gのn-3 PUFAと0.01gのα-トコフェロールを1日に提供する1日6カプセル、または6gのEVOOを1日に摂取するように指示された。n-3 PUFAの用量は、用量が4週間にわたってヒトの血液の脂質プロファイルの変化を誘導するのに十分であったことを示す以前の知見に基づいて選択された[84,85]。サプリメントのコンプライアンスは、カプセル数によってモニターされた。
分析手順
採血
静脈血は、非利き腕の前庭静脈に挿入された静脈カテーテルを介して採血され、運動前と運動直後に全血を採取した(図 7)。PBMC は、製造者の指示に従って Ficoll-Paque Premium (GE healthcare, USA) を使用した密度勾配遠心によって全血から分離した。得られたPBMC細胞ペレットを、タンパク質カルボニルの分析のために200μlのRIPA緩衝液に懸濁した。抗凝固剤を含まないバキュータイナー(Becton, Dickson & Company, UK)で採取した全血を室温で凝固させ、血清タンパク質カルボニルおよびIL-6の分析のために2800rpmで15分間遠心分離した。
核酸の単離
ゲノムDNA(gDNA)は、QIAamp DNA Blood Midi kit(Qiagen、ドイツ)を用いて、製造元の指示に従って全血2mLから単離した。製造者の指示に従い、Tempus Spin RNA Isolation Kit(Applied Biosystems、米国)を用いて、Tempus Blood RNAチューブに採取した全血からRNAを単離した。単離されたDNAおよびRNAの濃度(平均値±SD)および純度(吸光度比A260/A280±SD)は、Nanodrop2000(ThermoSciencentical,USA)を用いて決定した。単離されたgDNAの平均濃度は183.50±54.48 ng/μL、吸光度比A260/A280は1.90±0.02,RNAの平均濃度は120.32±41.02 ng/μL、吸光度比A260/A280は2.09±0.02であった。抽出後、DNAは-20℃、RNAは-80℃で保存した。
ルミノメチル化アッセイ
LUMAは、以前に記載された[86]と同様に、軽微な調整を加えて、グローバルなDNAメチル化のマーカーとして使用した。簡潔に言うと、200 ngの gDNA を含む 2 つの反応を、1 つはメチル化感受性酵素 FastDigest HpaII、もう 1 つは FastDigest MspI (Thermo Scientific, USA) を用いて、37 °C で 20 分間インキュベートした。インキュベーション後、各反応の13μLをアニーリングバッファーと混合し、Pyromark Q24プレートの別個のウェルに添加し、PyroMark Q24 MDxシステム(Qiagen、ドイツ)を用いて、以下の分注順序で分析した。ACTCGAとした。ピーク高さをエクスポートし、以下の式を用いてメチル化率を計算した。
メチル化=(1-(HpaIIIピーク2/HpaIIIピーク1)/(MspIピーク2/MspIピーク1))×100。
ビスルファイトパイロシーケンシング
gDNA サンプルは、製造元の指示に従って EpiTect Fast Bisulfite Conversion Kit (Qiagen, Germany) を用いて重亜硫酸化した。重亜硫酸塩変換した DNA サンプルの PCR は、PyroMark PCR Kit (Qiagen, Germany) を使用して、製造元の指示に従って実施した。すべてのアッセイについて、95℃で15分間の初期活性化期間に続いて、変性(95℃で30秒アニーリング(56℃で30秒)および伸長(72℃で30秒)の3段階のサイクルプロセスを45サイクル行った。PCRプロセスは、72℃で10分間の最終延長期間で終了した。Pyromarkカスタムアッセイ(Qiagen、ドイツ)のゲノム位置、プライマー配列および解析する配列を表2に示す。単一のPCR産物を確認するために、アンプリコンをゲル電気泳動で分析し、紫外線トランスイルミネーター(BioRad、米国)で可視化した。非重亜硫酸塩変換DNAのPCR増幅がないことは、重亜硫酸塩変換DNAに対する各アッセイの特異性を確認した。DNAメチル化は、PyroMark Q48 Advanced CpG Reagents(Qiagen、ドイツ)を用いたPyroMark Q48 Autoprepシステム(Qiagen、ドイツ)を用いて評価した。分析する配列をPyroMark Q48 Autoprepソフトウェアバージョン2.4.2(Qiagen、ドイツ)に入力して、ヌクレオチド分注順序を生成した。不完全な重亜硫酸変換を検出するために、非CpGシトシンをヌクレオチド分注オーダーに含めた。各CpG部位のメチル化は、CpGモードでセットされたPyroMark Q48 Autoprepソフトウェアを用いて決定した。標的領域内の全てのCpG部位の平均メチル化を、個々のCpG部位のメチル化を用いて決定した。既知のメチル化パーセンテージ(0%、12.5%、25%、50%、75%、87.5%、100%)の標準を、EpiTect PCRコントロールDNAセット(Qiagen、ドイツ)を使用して作成し、PCRバイアスのためのアッセイをチェックするために、期待されたメチル化パーセンテージと観察されたメチル化パーセンテージの間の標準曲線を生成するために、パイロシーケンス分析を受けた。各アッセイについて高い決定係数(R2 > 0.99)が決定され、PCRバイアスがないことを示している。
表2. DNAメチル化を決定するために使用したパイロシーケンシングアッセイの詳細
原文参照
ゲノム参照コンソーシアムヒトビルド38パッチリリース12を使用して同定されたゲノム位置。CpG部位は、解析する配列中にYで示されている。For、フォワードプライマー、Rev、リバースプライマー、Seq、シーケンスプライマー、TSS、転写開始部位、bp、塩基対。
mRNA発現
High-Capacity RNA-to-cDNA™ Kit (Applied Biosystems, USA)を用いて、製造者の指示に従って最低 1 µg の RNA を相補的 DNA (cDNA) に逆転写し、脱イオン水で 5 ng/µL の濃度に希釈した。相対的な mRNA 発現は、関心のある各遺伝子の定量的 PCR (qPCR) により行い、Viia7 リアルタイム PCR システム (Applied Biosystems, USA) を使用して GAPDH の発現に正規化した。各反応には、5μLのSybrGreen PrecisionPlus qPCRマスターミックス(PrimerDesign、英国),0.5μLのフォワードおよびリバースプライマー(表3および4μLの5 ng/μLのcDNAが含まれてた。すべてのサンプルを、95℃で2分間の初期変性、95℃で15秒間、60℃で60秒間の40回のサイクルを繰り返すというサイクル条件を用いて、二重に実行した。関心遺伝子の相対mRNA発現を、2-(ΔΔCt)式を用いて計算した;最初の試験からのプールされた群平均運動前Ctを対照として使用した。全参加者および実験条件におけるGAPDHの平均Ct値は17.13±0.41であり、ばらつきは2.40%と低かった。各mRNA発現アッセイの効率は、cDNAサンプルの連続希釈から生成された標準曲線を用いて決定した(表3)。効率は、式を用いて算出した。
表 3)を用いて算出した。mRNAの発現を決定するために使用したアッセイの詳細。For、フォワードプライマー、Rev、リバースプライマー、bp、塩基対。
E = ((10(-1/傾き))-1)x100,傾きは標準曲線にフィットする線形回帰の勾配である。各アッセイの効率は、R2 > 0.99で90〜105%であった。
インターロイキン-6 (IL-6)
運動前および運動直後の血清 IL-6 濃度は、高感度酵素イムノアッセイキット(R & D Systems、米国)を使用して測定した。ヘマトクリットおよびヘモグロビンは、血清IL-6値を調整するために使用される血漿量の変化を確認するために使用された [87]。
プロテインカルボニル(PC
PCは社内ELISA [88,89]により評価した。血清サンプル、PBMC ライセートおよび標準試料をコーティングバッファー(50mM 炭酸ナトリウム、pH = 9.2)で 0.05mg/mL の濃度に希釈し、ビシンコニンアッセイ法を用いた。タンパク質カルボニル基を、2,4-ジニトロフェニルヒドラジン(1mM、2M塩酸中)で誘導体化し、モノクローナルマウス抗-DNP抗体(Sigma Aldrich、英国)およびラット抗-マウスIgE、HRPにコンジュゲートしたもの(AbD Serotec、英国)でインキュベートした。ウェルの吸光度は490nmで測定し、PC濃度は当研究所で作製した公知のPC標準の吸光度値(1.28〜5.20nmol/mgタンパク質)を用いて決定した。PBMC中のPC濃度は、急性運動により誘発されるタンパク質濃度および細胞数の変化(Beckman Coulter, UK)を調整した。
統計解析
すべての統計分析は、IBM SPSS Statistics ソフトウェア(SPSS バージョン 23)を使用して実施した。データは、Shapiro-Wilkの検定により正規性を評価した。DNAメチル化研究において、DNAが抽出される白血球の組成は重要な考慮事項であるため、すべてのDNAメチル化解析は細胞不均一性調整値で実施した[59]。mRNA発現の解析は、対数倍変化データを用いて行った。DNAメチル化およびmRNA発現値は、2(サプリメント)×2(トライアル)×2(時間)反復測定ANOVAを用いて解析した。運動の影響は、絶対値(各時点の全試行の平均値)を用いて示され、一方、FAsの補給の影響は、補給前と補給後の試行(補給後-補給前)の間の相対変化(Δ)として示されている。値は平均±95%CIとして表される。
スピアマンのRho相関分析は、DNAメチル化値、mRNA発現値、および運動パフォーマンス、炎症および酸化ストレスに関連する生理学的マーカーとの関係を評価するために使用した。p値<0.05を統計的に有意とみなした。中程度(>0.5)の相関係数は関心があると考えられたが、大きな(>0.7)相関係数のみが統計的に有意であると考えられた。