Contents
Early approval of COVID-19 vaccines: Pros and cons
www.ncbi.nlm.nih.gov/pmc/articles/PMC8437465/
オンライン公開2021年7月20日。 doi: 10.1080/21645515.2021.1944742
Md Arifur Rahman a , b and Md Sayeedul Islam c
概要
安全で効果的なワクチンの開発は 2019年のコロナウイルス感染症(COVID-19)のパンデミックを抑制するための最優先課題となっている。COVID-19は発生当初から高い死亡率と経済的損失をもたらしたが、同時にDNAワクチンやmRNAワクチンなどの新しい治療法を開発する機会にもなっている。このようなワクチンが速やかに受け入れられれば、人命の損失を防ぎ、経済を活性化し、通常の生活を取り戻すことができると期待されているが、重大な落とし穴がある可能性もある。ここでは、有望なワクチンプラットフォームを広く治療に用いるための、今後の方向性と課題について概観する。
キーワード: ワクチン, SARS-CoV-2, COVID-19, mRNA, DNA
はじめに
2019年12月に重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)ウイルスが発生して以来、世界のほとんどの国に広がり、多くの命が奪われ、社会的・経済的構造に大打撃を与えている。その後、世界ではこの致命的な病原体に対するワクチンの開発プロジェクトが数多く行われている。プラスミドDNAワクチンやmRNAワクチンは、病原体を不活化または減衰させるのではなく、抗原をコードする遺伝子ビルドを開発する方がはるかにシンプルで迅速であり、生きた病原体を扱う危険性を回避できることから、標準的なワクチンの代替となる可能性があると言われている。しかし、COVID-19を除いて、商業的に認可された、あるいは第3相臨床試験を成功させたDNAワクチンはまだない3,4。さらに、プラスミドDNAは宿主のゲノムに組み込まれる可能性があり、多くの場合、DNAワクチン接種は有効性が低いだけでなく、自己免疫のリスクが妨げられている3,5。対照的に、mRNAは、非感染性、非統合性のプラットフォームであり、通常の細胞プロセスによって分解され、その生体内での半減期は様々な修飾や配布方法を用いて制御することができる6-8。しかし 2021年1月11日、COVID-19ワクチンの開発プロジェクトが開始されてからわずか1年で、SARS-CoV-2に対する初のmRNAワクチンが承認された。2021年5月25日現在、SARS-CoV-2に対する少なくとも14種類の核酸ベースのワクチン(3つのプラットフォーム)が米国食品医薬品局(FDA)と世界保健機関(WHO)から発行されている9。SARS-CoV-2に対する世界的な予防接種を確実にするために、COVID-19ワクチングローバルアクセス(COVAX)イニシアチブが形成されている10。COVAXの主な目標は 2021年末までに、COVID-19ワクチンを20億回分調達して公平に配布し、その中にはCOVID-19ワクチンの費用を十分に負担できない92の中低所得国も含まれており、高所得の自己資金国と同等のアクセスを得られるようにすることである11,12 本報告書では、SARS-CoV-2に対するmRNA/DNAワクチンの使用が早期に承認された場合に考えられる影響についてまとめている。
コロナワクチンの早期承認の意義
フェイスマスクの使用、物理的な分離や社会的距離の取り方、曝露者や症状のある人の検査、接触追跡、隔離などは、SARS-CoV-2の拡散を防ぐためには不成功であることが証明されている。そのため、新たに承認されたワクチンには危険が伴う可能性があるものの、COVID-19関連の罹患率や死亡率を最小限に抑えるために、いくつかのワクチンが認可されている。COVID-19ワクチンの早期承認は,COVID-19パンデミックの抑制に大きな役割を果たすかもしれない.
ワクチンは人命の損失を減らし、経済的損失の回復にもつながる
COVID-19が発生して以来、死亡率は約2.1%と推定されており 2021年5月25日までに約350万人が死亡している13。COVID-19の重症・死亡例は、免疫の過活性化と過剰なサイトカインの放出に関連しており、多臓器不全につながる14-16。感染症に対するワクチンは 2011年から 2020年までの10年間で、少なくとも2,300万人の命を救ったと推定されている17。しかし、考えられる安全上のリスクを特定、定量化し、考えられる利点とのバランスをとることは、あらゆるワクチンを承認する際の重要な検討事項である。これまでmRNA/DNAワクチンをヒトに使用した経験がないにもかかわらず、COVID-19の伝染性と死亡率の高さから、長期的な臨床追跡調査を行わずにワクチンが承認されている。DNAおよびmRNAワクチンの中和抗体産生の有効性はすでに実証されている4,18,19。さらに、いくつかのフェーズ1のmRNAおよびDNAワクチンの臨床試験では、感染性病原体から身を守るのに十分な中和価が得られ、安全性と有効性について満足のいく結果が得られている。例えば、ウエストナイルウイルスに対するDNAワクチンは、様々な年齢層で中和抗体を誘導することができ、エボラウイルス、マールブルグウイルス、ジカウイルス、HPV感染に対する安全性と免疫原性を備えている20-24。また、ジカウイルス、呼吸器合胞体ウイルス(RSV)インフルエンザウイルス、狂犬病ウイルス、エボラウイルス、H1N1インフルエンザなどに対するmRNAワクチンは、すでに動物で十分な結果が得られている。さらに、H10N8,H7N9インフルエンザウイルス、狂犬病ウイルス、HIV-1ウイルスに対するmRNAワクチンの前臨床および臨床プロファイルでは、許容できる忍容性をもって防御免疫原性を誘導することができる26,29。 -31 COVID-19ワクチンの場合、現在承認されているmRNAワクチンおよびウイルスベクターワクチンのワクチン効果は約70%から90%以上である32-37。SARS-CoV-2に対する承認済みのワクチンが、その臨床試験の結果から正当化されるように、COVID-19を制御することが期待されている32,34。さらに、ワクチン接種プログラムは、通常の人間の活動に戻るために必要な集団免疫を促進し、ひいては世界経済の回復を助けることになるはずである。
安価で、簡単で、再現性のある
パンデミックを抑制・回避するためには、感染症の予防・対策用のワクチンを作ることが最も重要だ。しかし、HIV-1,単純ヘルペス、RSVなどの複雑なウイルスに対しては、従来のワクチン接種方法では成功しないことが多くあった。さらに、商業的なワクチンの開発には何年もかかるのが普通である。mRNAワクチンとDNAワクチンは、細胞のプロセスに依存せずに設計・開発されるため、適応性が高く、比較的安価であり、製造プロセスの拡張性が高いため、短期間でほぼすべてのタンパク質を抗原としてコード化することができる。新しいmRNAベースの技術の最大の利点は、免疫逃避性の突然変異株に対抗するために、ヌクレオチド配列を調整して処方を変更することが容易であることである。最近では、SARS-CoV-2 RBDの完全な変異マップが作成され、この新技術を用いた抗体治療薬の合理的な設計が可能になるかもしれない38。さらに、これらのワクチンは、同じ製造工場で同じ製造プロセスを用いて製造することができる。このようなワクチンは、試験管内での化学反応と同様に、バッチ間で一貫性があり、再現性がある。このことは、COVID-19のような感染症のパンデミックシナリオや、患者固有のがん関連抗原や変異抗原に対するがんワクチンの開発に大きな価値をもたらす39,40。
感染症と非感染症の両方に適している
mRNA/DNAワクチンの最大の利点は、感染性の病原体を使用せずにタンパク質を工学的に設計してワクチンを製造するため、病原体の培養や精製の工程が必要ないことである。ヌクレオチド配列がわかれば、どんなに感染力が強くても、ワクチンを製造することができる。また、抗原の精製が困難ながんなどの非感染性疾患にも同様に対応できる。また、生物には複数の血清型・遺伝子型からなるものが多く、従来の方法では、複数のエピトープを用いたワクチンの製剤化は非常に困難であったが、核酸ベースのワクチン技術はこの問題を解決することができる。SARSやMERS、エボラ出血熱のように感染力の高い病原体を扱うには、バイオセーフティレベル4の安全キャビネットと高度な設備を備えた実験室が必要であるが、mRNA/DNAワクチンは比較的低リソースで製造できる可能性がある。さらに、世界中の複数の研究所を利用することで、専門家の研究所への依存度を下げ、生産能力を高め、輸送や生産にかかる時間やコストを削減し、最終的には一般市民への配布の遅れを短縮することができるはずである。
核酸系ワクチンの欠点
核酸ベースのワクチンが承認されれば、COVID-19を規制することで死亡率を下げ、患者を日常生活に復帰させることができるだけでなく、他の病気の研究を支援することにもなる。しかし、新規の核酸ワクチンに人々をさらすにあたっては、長期使用が可能な治療法とみなされるまでに、いくつかの深刻な問題が解決されなければならない。
長期的な安全性のデータがない初のmRNA ワクチン
ワクチン開発を成功させるには、通常数年という長い時間が必要である。最近までは、おたふくかぜワクチンが最も早いワクチンで、開始から約4年後の1960年に承認された。2020年12月11日、米国食品医薬品局は、Pfizer-BioNTech社のmRNAベースのCOVID-19ワクチン「BNT162b2ʹ」を米国内で流通させることを認める、COVID-19予防のための初の緊急使用認可(EUA)を発行した41。その1週間後には、「mRNA-1273ʹ」、別名「Moderna COVID-19 Vaccine」と呼ばれる別のmRNAワクチンのEUAがFDAから発行された34。 33 これら以外にも、DNAベクターを用いた初の「ChAdOx1 nCoV-19ワクチン」(アストラゼネカ/オックスフォードのCOVID-19ワクチン)が 2021年2月15日にWHOによって承認された42。その後、ヤンセン/ジョンソン・アンド・ジョンソンの別のベクターベースのワクチンが2021年3月12日に承認された。
9 これらのワクチン開発プロジェクトはすべて 2020年1月にSARS-CoV-2の遺伝子配列が決定された直後に開始されている43-46。「34 BNT162b2ʹ」では、試験参加者の半数が2回目のワクチン接種後、わずか2ヶ月間の追跡調査を行っただけで、さらに少数のサブセットでは最大14週間の追跡調査が行われた。一方、オックスフォード・アストラゼネカ社が製造したChAdOx1 nCoV-19ワクチンでは、安全性に関するフォローアップの平均は3~4カ月であった。いずれのケースでも、ワクチン接種群と非接種群に一過性の副反応が見られたが、ほとんどのケースで発症後2~3日以内に消失した。しかし、早期に承認されたため、ワクチンの効果と防御期間に関するより包括的な情報はまだ決定されていない34。
遅発性の副作用と予防期間は不明
ワクチンは、長い臨床試験や前臨床試験を経て承認されているため、一般的に安全である。予防措置がとられており、重篤な全身性有害事象の発生率は極めて低いにもかかわらず、単一または複数のワクチンを組み合わせて接種した場合に、神経系、関節系、自己免疫系に好ましくない影響が生じることが多数報告されている。例えば、経口ポリオワクチンでは、ワクチン関連の麻痺性小児麻痺が報告されている47。黄熱病(YF)ワクチン接種プログラムでは、ワクチン接種後脳炎、急性散在性脳脊髄炎、ギラン・バレー症候群(GBS)など、ワクチン関連の重篤な神経トロピン性疾患が報告されている48。副作用は単なる関連性であり、因果関係は確立されていないが、HBV、腸チフス/パラチフス、炭疽、破傷風、MMR、BCG、天然痘、DPT、インフルエンザ、百日咳、ポリオなどの他のワクチンでも、GBS、多発性硬化症、自閉症、関節炎、全身性エリテマトーデス、糖尿病などの影響が報告されている49。DNAワクチンには、ゲノム統合の重要なリスクがあると考えられている。繰り返しになるが、この確率は極めて低いと考えられており、DNAワクチンはまだヒトへの認可を受けていないため、統合に関する問題は現在のところ理論的なものである。しかし、何億もの有効量を健康な患者に投与するとなると、非常に稀な事象であっても、特に多くの国でのワクチン接種の疲労を考慮すると、深刻な安全性の問題となる可能性がある50。
mRNA ワクチンは、ゲノム統合のリスクがないが、いくつかの制限がある。50 。抗原の発現期間は、DNA ワクチンでも RNA ワクチンでも数ヶ月に及ぶことがある。しかし、現在のmRNAワクチンは、mRNAが翻訳された後に速やかに分解され、ワクチンによって誘導された中和抗体以外は何も残らないため、従来のワクチン技術よりも安全でクリーンなワクチンと言えるかもしれない。一方、次世代mRNAワクチンでは、自己複製するmRNAが抗原だけでなくウイルスの複製装置もコードしているため、抗原が高レベルで発現し、より長い刺激を与えることができ、保護期間が長くなると考えられる4,6。
54-56 エピトープの拡散やバイスタンダーの活性化、遺伝的に自己炎症を起こしやすい人の自己炎症の調節障害などは、COVID-19ワクチン接種の前後に急性および慢性の自己免疫を引き起こす可能性がある57,58。さらに、核酸ベースのワクチン接種では、細胞外のnaked RNAやDNAが関与し、密に詰まった内皮細胞の伝染性を高め、浮腫を引き起こす可能性があることが示されている59。生体内試験および試験管内試験の証拠により、血液凝固因子、特にXII因子とXI因子が細胞外のnaked RNAに強く結合し、血液凝固の接触プロセス経路に関与するプロテアーゼを活性化することが示されている59。59 アストラゼネカとJNJのワクチンの第3相試験では、ドイツ、オーストリア、アメリカ、インドなどで多発性硬化症や横隔膜炎などの重篤な有害事象が報告され、早期に警告が出された60。 -64 一般的な副作用は、めまい、頭痛、疼痛、筋痙攣、筋肉痛、知覚異常などで、まれに震え、複視、耳鳴り、発声障害、痙攣、帯状疱疹の再活性化などが検出されている。64 このエビデンスは受動的なモニタリングに基づいているため、報告のバイアスがかかり、誤りが含まれる可能性がある。さらに、多くの患者がワクチン接種を受けているため、神経疾患の発生率が高い人々の背景があるため、神経疾患の特定の症例が偶然だけで発生する可能性もある。
アストラゼネカのワクチンに関連した自己免疫性血栓症は、イギリス、EU、スカンジナビア諸国などの異なる地域で、ヘパリン誘発性血小板減少症をまねく。アストラゼネカ社の COVID-19 ワクチン(AZD1222)を接種した患者において、まれに脳洞静脈血栓症(CSVT)と血小板減少症が報告された60,65 。少なくとも 9 名の患者がワクチン接種後 4 日から 16 日の間に血栓症を呈した。そのうち7名は脳静脈血栓症(CVT)1名は肺塞栓症、1名はCVTと脾静脈血栓症の両方を発症し、そのうち4名が死亡した。60 ワクチンによる免疫性血栓性血小板減少症(VIITT)および失神などの不安関連有害事象が JNJ ベクターワクチンで報告されている。失神は10万回接種あたり8.2件検出されており 2019年7月~2020年6月の失神の報告率が10万回接種あたり0.05件であったインフルエンザワクチン接種の約164倍となっている61。一方、VIITTの発生率は、アストラゼネカ社製ワクチンでは50万回接種あたり約1件と予測されている65。60,65-68 安全性への懸念から、一部の国ではJNJワクチンとアストラゼネカワクチンの両方で、ワクチン試験が一時的に中断された。60,65-68 一般人口における脳静脈洞血栓症の発生率は年間10万人あたり0.22~1.57人と推定されており、最終的にはワクチンとは無関係であると判断された60 COVID-19ワクチンの利点はリスクを上回ると判断された69 したがって、複数のmRNA/DNAモダリティとデリバリーメカニズムが初めてヒトに使用され、より多くの患者集団で評価されるようになると、保護のためには継続的な評価が必要となる。
ヒトのコロナウイルスに対する認可されたワクチンはなく、一般的な風邪ウイルスに対するワクチンは短命で効果が低い
コロナウイルス科は、α、β、γ、δコロナウイルスの4属からなり、31kbという大きな一本鎖のポジティブセンスRNAのゲノムを持っている。病原性の高いSARS-CoV、SARS-CoV-2,MERS-CoVはすべてベータコロナウイルス属である。他の4つの主要なヒトコロナウイルス(HCoV)は、HCoV-229E、HCoV-OC43,HCoV-NL63,およびHCoV-HKU1であり、これらはヒトの一般的な風邪の約15%の原因となっている。72,73 HCoV-229EとHCOV-OC43の推定再感染率は、それぞれ30%と80%と推定されている74-76。
コロナウイルスと同様に、RSV、インフルエンザウイルス、ライノウイルスなどの他の呼吸器系ウイルスも、中和抗体の寿命が短いことや多数の血清型が存在することから、抗体を介した防御やB細胞の記憶障害を引き起こす77-80。82 カリフォルニア州で発見され、現在、米国および29カ国に広がっている新規SARS-CoV-2変異株CAL.20 C(B.1.427/B.1.429)は、モノクローナル抗体パネルから逃れたことが報告されている83。
COVID-19ワクチンのもう一つの重要な懸念点は、高齢者で十分な免疫反応が得られるかどうかである。高齢者は、高親和性抗体の産生に障害があり、体細胞超変異やアイソタイプスイッチングに障害があり、ナイーブT細胞が著しく減少し、TCRレパートリーが減少して反応性の低いCD8+ CD28-T細胞が存在することが研究で明らかになっている84。 -89 SARS-Cov-2の最も深刻なリスクグループは高齢者である。90-92 全体の症例死亡率(CFR)は約4%と推定されているが、60歳以上の年齢層で急速に増加しており、70-79歳と80歳以上の年齢層ではそれぞれ16.9%と24.4%に達している91,92。最近では、イギリスとアメリカにおいて、ファイザー社やオックスフォード・アストラゼネカ社のCOVID-19ワクチンの2回目の接種後に、高齢者でも若年層と同様の強い持続的な抗体反応が得られたことが報告されている94-96。
ヌクレオチドを介した異所性の免疫刺激
I型インターフェロンの産生は、あらゆるウイルスに対する最も重要な第一線の自然免疫防御の一つであり、適応免疫の開始にも不可欠である。DNAウイルスに対する自然免疫応答は、パターン認識受容体(PRR)によって開始されると考えられているが、その正確なメカニズムは不明である97。一方、RNAウイルスに対する免疫感知メカニズムは非常によく研究されている。98-100 RIG-Iは、様々なウイルスファミリーに由来するウイルスRNAを感知することが示されている98,101。さらに、食事からヌクレオチドを摂取することでも免疫反応を引き起こすことができる105。細胞外ヌクレオチドの中でもATPは最も豊富で、一般的に古典的な危険信号と考えられており、免疫反応のイニシエーターまたはターミネーターとして作用することができる。また、外因性のヌクレオチド/ヌクレオシドとその受容体が結びつくことで誘発されるシグナル伝達は、様々な遺伝子の発現を調節することができ、その中にはサイトカインのレベルに特異的に影響を与えるものもある106。先に述べたように、一部のプラットフォームでは、大量生産、自己発現、急速な分解などの高度な技術により、核酸ベースのワクチンに関連するリスクが排除されている。しかし、様々なプラットフォームで投与されたCOVID-19ワクチンは、長期に渡ってモニターする必要がある。
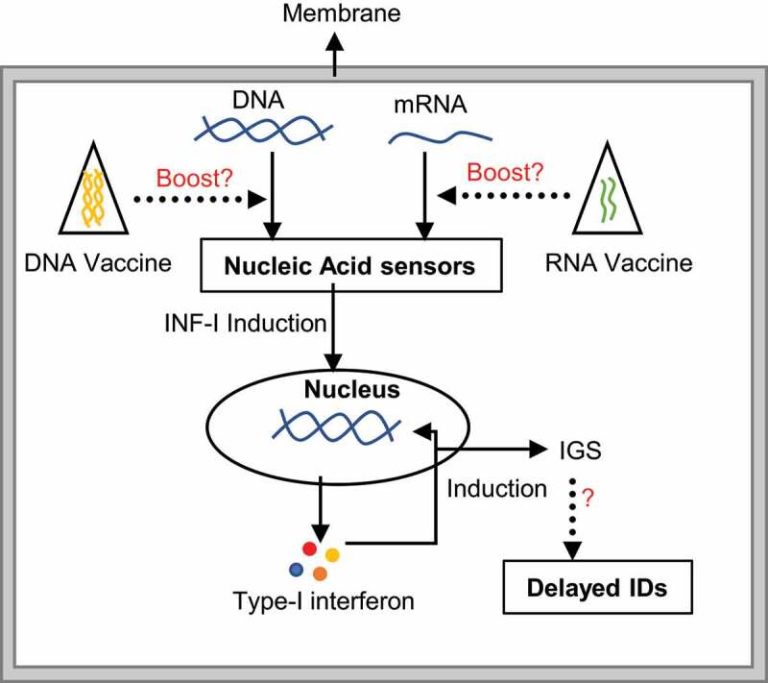
図1 核酸を介した免疫刺激のメカニズム
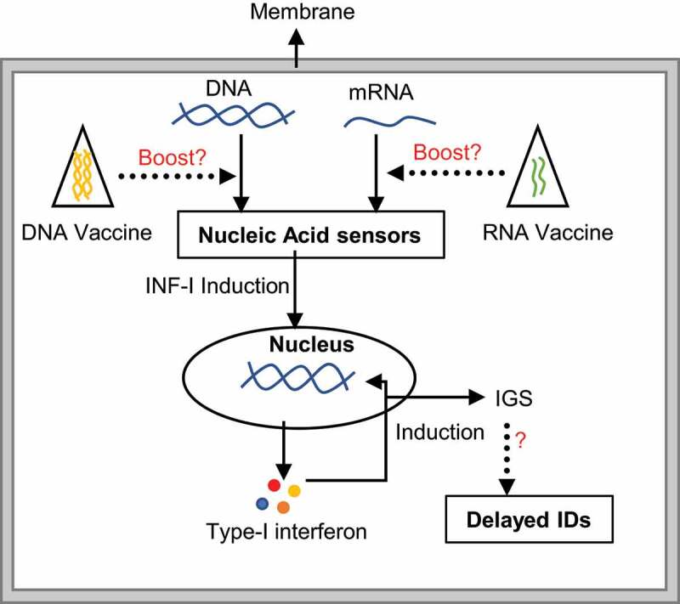
感染体、食事、細胞のDNA断片など、あらゆるソースからの裸のmRNA/DNAの存在は、タンパク質複合体によって感知される。その後、下流のシグナル伝達によりI型インターフェロンが誘導され、さらにインターフェロン刺激遺伝子(IGS)の産生が促進される。IGSの異常な発現は、さまざまな免疫疾患(ID)につながる可能性がある。第二世代のmRNAワクチンはより安全であり、このメカニズムとの関連性は低いかもしれないが、ワクチンの形で核酸に長期間さらされると、核酸を介した免疫感知経路が活性化され、免疫疾患のリスクが高まる可能性がある
ワクチン関連強化疾患のリスクについて
ワクチン関連疾患憎悪(VAED)は非常に稀であるが、ワクチン接種歴のない感染症と比較して、重篤な感染症の副反応を引き起こす傾向がある。VAEDは、抗体依存性増強(ADE)としても知られており、ワクチン接種や一次感染によって産生された病原体特異的な抗体によって、二次感染が直接促進される疾患である(図2)。COVID-19ワクチンの製造において考えられるリスクの一つは、ワクチンによって誘発される免疫反応がSARS-CoV-2の獲得を促進したり、再感染時やワクチン接種後の感染時に病気を悪化させたりするのではないかということである。この現象は、非ヒト霊長類を用いた動物実験を含め、承認されたワクチン試験ではまだ観察されていないが、免疫の原理や前臨床試験では、現時点でCOVID-19ワクチンの安全性を主張する正当な根拠が得られていないため、この問題を解決するのは時期尚早である。COVID-19による病気の重症化の可能性を含めた有害事象を検出するために、ライセンス供与後のモニタリングによって長期的なフォローアップを行う必要がある。
図2 抗体の作用とウイルス感染に対する抗体依存性増強(ADE)の模式図
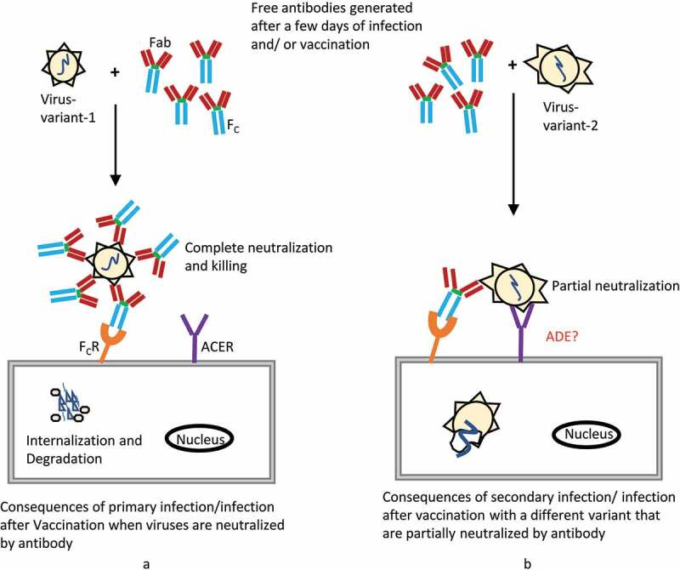
(a)ウイルス感染やワクチン接種後、数日後に生成された抗体がウイルスを中和することで、さらなる感染から身を守ることができる。(b)二次感染やワクチン接種後に別のウイルス株に感染すると、それまでの抗体では完全に中和されない。しかし、抗原が類似しているため、部分的に中和されることで、抗体が結合するFc受容体によるウイルスの内在化が促進される可能性がある。核酸ベースのCOVID-19ワクチンは正常に承認されており、非ヒト霊長類の動物実験を含む臨床試験では、ADEの合併症は認められていないが、ワクチンを接種した人は時間を追ってモニタリングする必要がある
将来の展望
1990年に、試験管内で転写されたmRNAを注射した動物からタンパク質を産生することに成功して以来、研究者たちはmRNAベースのワクチンの製造を試みてきた。現在までに、イヌのメラノーマがんワクチン、ウマのウエストナイルウイルスワクチン、魚の感染性造血壊死ウイルスワクチンなど、いくつかのプラスミドベースのワクチンがすでに動物用として承認されている。39,110,111 最近では、前臨床のワクチン開発プロジェクトが多数発表され、いくつかはヒトの臨床試験に入っている4。核酸ベースのワクチンは、ヒトの細胞性T細胞やB細胞に反応を起こさせるという重要な能力があることが、多くの臨床試験で証明されているが、ヒト用のDNAワクチンの製造は、これまでのところ同様に成功していない。その中には、HIVワクチン、ジカウイルス、インフルエンザウイルス、狂犬病ウイルス、各種がん(メラノーマ、乳がん、肺がん、前立腺がん、卵巣がん、多発性固形がんなど)に対するワクチンなどが含まれている4。しかし、COVID-19は考え方を変え、SARS-CoV-2ウイルスの出現から1年後には、少なくとも14種類の核酸ベースのワクチン(3つのプラットフォーム)が承認された9。いくつかのmRNAまたはベクターベースのCOVID-19ワクチンが承認されたことは、ワクチン学の新しい時代を切り開くものとして大きなインパクトがある。オックスフォード・アストラゼネカ社のワクチンは、EU、米国、中国、インド、日本、英国、ブラジル、インドネシア、バングラデシュ、オーストラリア、エジプト、アルゼンチン、カナダなど、世界中の多くの国で10億回分がすでに注文されている112。これらの先駆的なワクチンは、明らかに「核酸ベースの治療薬」全体の試験と考えることができる。このように、性別、民族、社会経済的地位に関係なく、核酸ベースのワクチンの大規模な試験結果がCOVID-19ワクチン接種プログラムによって世界中で生み出されることになる。他の疾患に対する核酸ベースのワクチンの承認は、ほとんどこのワクチンにかかっているので、医学界はこのワクチンの成功を待ち望んでいるに違いない。
おわりに
COVID-19ワクチンの開発は、一般市民、政府、科学者、規制当局、産業界など、社会の主要なセクターが共通の目的に向かって協力することで得られる可能性を示すものである。安全で信頼性が高く、安価で配備可能なCOVID-19ワクチンを製造することは、パンデミックを終息させ、通常の生活を取り戻すために不可欠である。しかし、これまでの風邪やインフルエンザウイルスに対するワクチンの有効性や免疫反応の持続性が低いことや、新しいワクチンに対する疑問点を考えると、COVID-19ワクチンの初期の有望な結果を祝うのは時期尚早である。自然感染やワクチン接種後の防御的な適応免疫反応の信頼性を評価するには、長期的な研究が必要である。