コンテンツ
Dietary Protein and Amino Acid Intake: Links to the Maintenance of Cognitive Health
www.ncbi.nlm.nih.gov/pmc/articles/PMC6627761/
要旨
高齢化社会の急速な進展に伴い、アルツハイマー病や関連する認知症(ADRD)の発症率が増加している。これらのADRDの増加に対抗するために、科学者や臨床医は、病気の発生率を改善するための予防法にますます重点を置き始めているが、その中でも特に食事の摂取に焦点を当てている。
タンパク質/アミノ酸の摂取量は、ADRDの予防に関連するように研究の急成長分野であり、消費は、低筋肉量、睡眠、ストレス、うつ病、不安などの疾患関連の危険因子の数に直接関連している。その結果、タンパク質/アミノ酸の摂取が認知機能低下の修正可能な危険因子に影響を与える役割は、科学的な探求のための強固な領域を提供してきたが、この研究はまだ推測であり、具体的なメカニズムを証明する必要がある。
本レビューの目的は、タンパク質とアミノ酸の現在の理解とADRDに関してそれらが果たす予防的な役割について説明することであり、同時に、この一連の研究に対する将来の推奨事項を提供することである。さらに、認知機能低下の長期的なリスクを適切に管理するために、現在推奨されているタンパク質摂取量と、高齢者がどの程度のタンパク質を摂取すべきかについても議論する。
キーワード
タンパク質、アミノ酸、アルツハイマー病、認知症、認知、認知機能低下、危険因子
1. はじめに
日常生活に支障をきたすほどの精神能力の低下を特徴とするアルツハイマー病および関連する認知症(ADRD)は、患者やその介護者、医療システムに関わる深刻な課題を世界的に抱えている。予測では、ADRDの世界的な有病率は2015年から 2050年の間に3倍の1億3,000万人を超えると推定されている[1]。ADRDは世界で最も高価な健康状態の一つと考えられており、診断された人の生涯のケア費用は321,000米ドル/人と推定されている[2]。米国だけでも、ADRDの費用は2018年の1860億ドルから 2050年には7500億ドル(400%増)に増加すると予測されており、一方で認知症の診断は同期間に550万人から1380万人へと~150%増加すると予測されている[2]。さらに、認知症と診断された人に介護者が提供したケア時間は184億時間(2,320億ドル以上)と推定されている[2]。
一度診断されるとこの疾患に関連した多額の費用がかかるが、ADRDは前臨床段階が長期化するため、長期間にわたって発見されない傾向がある[3,4]。この段階では、神経細胞や神経生物学的変化は、顕著な症状が現れるまでに何年も何十年もかかる可能性がある。臨床的に検出可能な認知機能の問題が発現する前に、人々は一般的に主観的認知機能低下(SCD)と呼ばれる現象を経験する [5]。SCDは、臨床的に測定可能な異常とは関連していないが、個人によって知覚される記憶と認知の主観的な変化として定義されている[3,6]。SCDを経験した人は、認知症、特にアルツハイマー病の発症リスクがあると考えられている。SCDを放置すると、正常な認知機能と診断可能な認知症の中間である軽度認知障害(MCI)に進展する可能性がある。前述のADRDに関連した費用負担や有効な薬剤の不足を考えると、病的な認知機能の低下を遅らせたり遅らせたりする非薬理学的介入を開発する必要がある。
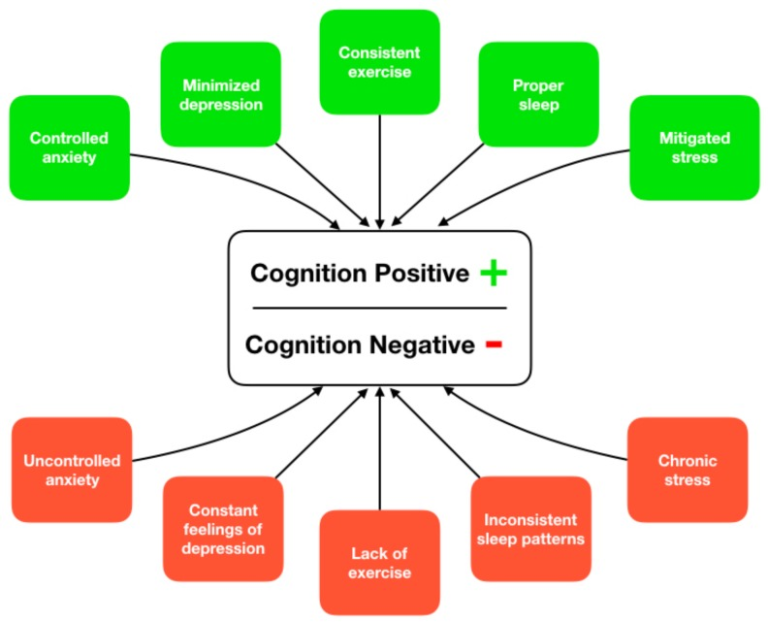
ADRDの原因は多因子性であり、リスク因子の組み合わせ(修正可能なものと修正不可能なもの)が疾患の発症と進行に関与していることがますます認められている[11]。その結果、ADRDの治療を単一因子の解決策として分類することは困難であり、代わりに研究者が疾患の発症と進行に関連する行動的危険因子に焦点を当てた多因子的アプローチをとることが推奨されている[12]。ADRDに関連する主な修正可能な危険因子のいくつかは、運動、睡眠、ストレス、抑うつ、不安であり、これらの因子のいずれかを改善することで、疾患進行の全体的なリスクを低下させる可能性がある(図1)。さらに、個人レベルでこれらの危険因子を改善する能力は、認知機能の低下の軌跡に全体的にプラスの効果をもたらす可能性がある。
図1 生活習慣に基づいた活動による認知機能低下の改善またはリスクを高めるための支援経路
認知機能低下を改善するために推奨される主要な予防策の1つは食事であり、複数の食事因子がすでに調査されている[13,14,15]。食事と認知機能低下についての詳細な説明は別の場所にあり[16]、本レビューの範囲を超えている。三大栄養素のうち、タンパク質とその構成アミノ酸は、細胞の機能と完全性(脳細胞を含む)を維持するために不可欠な食事パターンの構成要素である。実際、約1000人の被験者を対象とした大規模調査では、タンパク質の摂取量が多い食事はMCIまたはADRDの全体的なリスクの低下と関連していることが明らかになった[17]。研究者らは、これらの結果は、アミノ酸の摂取量が少ないと、神経伝達物質の合成に必要な必須タンパク質の摂取量が減少するという事実に起因する可能性があると示唆した(例えば、トリプトファンは血液脳関門を通過することができ、セロトニン前駆体である)。動物モデルを用いた研究では、血液脳関門を通過するトリプトファンの輸送が加齢とともに減少する可能性があることが示唆されており [18] 、これがヒトでも当てはまるとすれば、高齢者のタンパク質摂取量の減少は神経細胞の機能に悪影響を及ぼす可能性がある。
タンパク質の摂取不足は、運動 [19]、睡眠 [20]、ストレス、うつ病、不安 [21,22,23]などのADRDの修正可能な危険因子の減少と関連している。社会経済的地位(SES)もまた、SESが低いほどタンパク質摂取量に影響を与える傾向があり、消費率の低下につながる[24,25]。高齢者の約10~25%は推奨食事摂取量(RDA)よりもタンパク質の摂取量が少なく、高齢者の5~9%は推定平均必要量(EAR)の0.66g/kg/日よりも摂取量が少ない [26]。注意すべき点は、EARは健康な人口のニーズを満たす平均摂取量であり、この摂取量レベルは人口の約半数には不足しているということである[26]。その結果、タンパク質摂取不足のリスクにさらされている高齢者の割合は潜在的に大きくなり、慢性または急性疾患を持つ高齢者ではなおさらである。
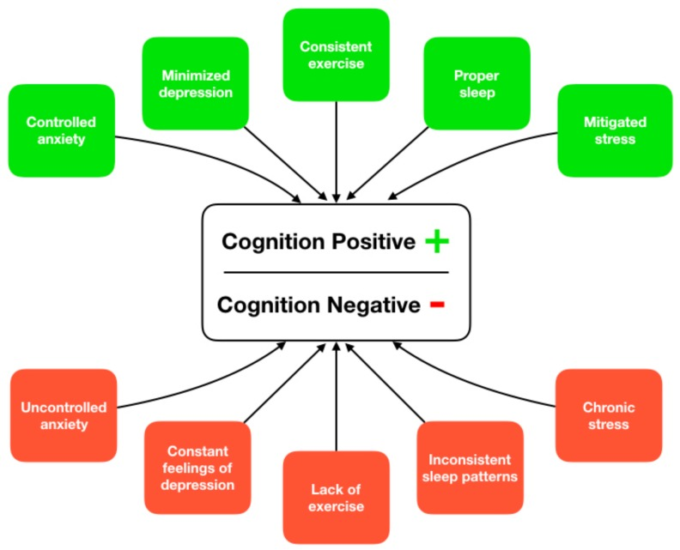
タンパク質とその構成アミノ酸が認知機能低下の修正可能な危険因子を改善する役割を果たしていることと、高齢者のかなりの割合が適切なレベルのタンパク質を摂取していないという事実が相まって、この分野は科学的な研究の興味深い分野となっている。しかし、アミノ酸と認知機能低下に関する厳密な研究が不足しているため、この関係の因果関係は十分に理解されておらず(図2)その結果、多くのメカニズムは推測の域を出ていない。それにもかかわらず、多くの研究でアミノ酸が認知機能の健康に果たす役割を示す相関関係が明らかにされている。既知のADRD危険因子に関してタンパク質とアミノ酸の現在の理解をまとめた後、このレビューでは、連想的な研究から、作用の根本的なメカニズムをさらに解明するより強固な科学的探求への移行をサポートするための努力として、この研究の体のための将来の推奨事項を提供する。
図2
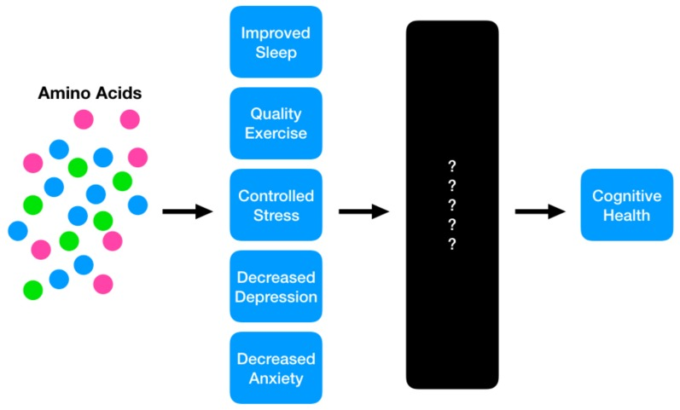
タンパク質とその構成アミノ酸が、将来の認知機能低下のリスクを軽減する役割を果たす可能性があるというモデルが提案されている。現在の科学の状態は、これらの栄養介入がプラスの効果をもたらす可能性が高いことを示唆しているが、因果関係のメカニズムはまだ「ブラックボックス」であり、今後の調査が必要とされている。
2. 方法
このレビューに含まれるすべての経験的論文は、査読付きジャーナルに掲載されたものである。年、言語、研究の設定、または論文が最初に発表された国については制限を設けなかった。研究が査読付きで、複数の被験者がいる場合はレビューに含まれた(症例報告は含まれていない)。最初のデータベース検索で見逃した可能性のある追加の論文を特定するために、GoogleとPubMedの検索を行った。ブール検索戦略は、以下のキーワードと論理で行われた:(「運動」OR「身体活動」OR「フィットネス」OR「健康」OR「睡眠」OR「ストレス」OR「不安」OR「うつ病」AND(「タンパク質」OR「アミノ酸」)AND(「アルツハイマー病」OR「認知症」OR「認知障害」OR「認知機能低下」)およびそれらの派生語、ならびに関連する論文の書誌情報をさらに調査した。文献のレビューは以下のセクションに分かれている。(a)運動、(b)睡眠、(c)メンタルヘルス(ストレス、抑うつ、不安)(d)高齢者のためのタンパク質の推奨/ガイドライン。
3. 運動について
運動と食事からのタンパク質/アミノ酸摂取量は古典的に関連しており、運動パフォーマンス [27]、虚弱性[28]、加齢に伴う慢性疾患(サルコペニアなど)[29]を含むがこれらに限定されないあらゆる分野にわたっ て、その証拠が示されている。さらに、運動自体が長期的な認知に直接影響を与えることを示唆する膨大な文献がある。しかし、これまでのところ、この2つの要素の間のギャップを埋める証拠はほとんどない。このセクションでは、アミノ酸の摂取量と認知機能の低下について、限られているとはいえ、現在入手可能な文献を説明しながら、この潜在的な関連性を説明する。
外因性タンパク質の摂取が認知に及ぼす影響を理解するためには、まず、筋肉量と認知機能の健康との間の独立した関係を明確にすることが重要である。この分野での重要な研究は、健常者と早期アルツハイマー病と診断された人を評価したBurnsら[30]によって行われた。すべての被験者は、二重エネルギーX線吸収法(DXA)脳磁気共鳴画像法(MRI)神経心理学的検査で評価された。健康な対照群と比較すると、早期ADRDと診断された人は、DXAで測定された筋肉量の減少を示した;これらの差は、性別をコントロールした後でも持続した。この研究ではまた、脳内白質体積の減少、全脳体積の減少、認知能力の低下がすべて除脂肪量の減少と有意に関連していることが明らかになった[30]。重要なことに、総体脂肪と体脂肪率は、認知症のある人とない人の間で有意な差はなく、認知能力や脳の容積とも関連していなかった。これらの結果は、より古典的な体組成測定(すなわち、体重指数/体脂肪)とは対照的に、除脂肪体重が認知症リスクとより敏感に関連している可能性を示唆している。除脂肪体重と認知機能の低下との因果関係は今回の調査からは直接推測できないが、身体活動はADRDや加齢に伴う脳や身体の構造的・機能的変化を減衰させる可能性があると提案されている[31]。したがって、筋肉量の減少につながるそのような活動の欠如は、認知機能の低下を加速させる結果となる可能性がある。
除脂肪筋量に加えて、筋力も認知機能の低下に関して考慮されるべきである。この概念は、ADRDのベースライン診断を受けていない900人以上の地域居住高齢者の9つの筋群から個別に筋力を測定した縦断的調査によって探求された [32]。筋群は個別に評価され、複合測定値にまとめられた。約4年後、結果は、ベースラインの筋力の各1ユニットの増加がADRDを開発するリスクの約43%の減少と関連していることを示した。この関連性は、肥満度指数、身体活動、肺機能、血管危険因子、血管疾患、アポリポ蛋白E4の状態などの因子をコントロールした後も維持された。さらに、筋力の増加は、グローバルな認知機能の低下の速度が遅く、MCIのリスクの減少と関連していた[32]。これまでの調査と組み合わせることで、運動が認知機能の健康を維持するための保護メカニズムである可能性があることを示すさらなる証拠となる。
筋量と筋力の低下が認知機能低下の重要な危険因子であることを考えると、加齢とともに両者の維持がますます重要になってくる。身体的観点からは、タンパク質の摂取は筋肉量の維持に役立つ [33,34]。しかし、空腹感の低下、口腔内の健康状態の低下、および/または味覚と嗅覚の低下など、多くの加齢に関連する因子がタンパク質消費量の減少に寄与している(表1)。
表1 高齢者のたんぱく質摂取量が減少する理由
- 口腔内の健康状態が低下して肉類系の食品が噛みにくくなる
- 空腹感を緩和し、全体的な摂取量を減少させる。
- 味覚の低下による糖分・加工食品の摂取量の増加
- 嗅覚が低下し、特定の食べ物を楽しむことができなくなる。
- 自立した買い物ができなくなり、特定の食品を手に入れることができなくなる。
- より多くの調理済み食品のオプションの消費につながる食品の準備を扱うための限られた快適さ
これらの要因が組み合わされると、タンパク質回転率が負の値になる傾向があり、最終的には骨格筋の異化または分解につながる [35]。骨格筋では、タンパク質回転率は、筋タンパク質合成とタンパク質分解の正味の結果である [36,37](タンパク質代謝と筋肉成長の間のメカニズムの詳細な説明については、TiptonとWolfe [38]を参照)。その結果、タンパク質の摂取量を増やすと、この方程式が正味の正の値に保たれ、最終的には筋肉量が維持されるか、または潜在的に増加する可能性がある。
逆に、タンパク質の適切な消費量が一貫して不足しているか、または関連する要因のために、タンパク質のターンオーバー率が継続的に純マイナスになると、筋肉の消耗、そして最終的にはサルコペニアのような病状につながる可能性がある。サルコペニアは、著しい筋萎縮、ダイナペニア、および身体機能の低下によって直接特徴づけられ、これらはすべて認知機能の低下と関連している[35,39,40]。これまでの文献では、MCI患者の12.5%、ADRD患者の23.3%がサルコペニアを併存していることが示されており[41]、サルコペニアのリスクを軽減することは、関連する認知障害のリスクを軽減するのにも役立つ可能性があることを示唆している。
適切なアミノ酸摂取量と運動を組み合わせることで、臨床的にサルコペニアと診断された人の除脂肪量を改善することが示されている [41]。この研究では、サルコペニアと診断された女性150名を対象に、30分の筋力強化運動と20分のバランス・歩行訓練を含む3ヶ月間の運動プロトコルを追跡調査した。介入終了後、運動とアミノ酸補給の組み合わせは、サルコペニア女性の筋力だけでなく、筋肉量と歩行速度の向上にも効果的であることが示された[42]。しかし、アミノ酸補給の筋量および筋力に対する効果は、サルコペニアと診断された人に限定されないことに注意することが重要である。
別の研究では、虚弱高齢者の男女を対象に、長時間の抵抗型運動トレーニング中の筋肉量、筋力、身体能力に対するタンパク質補給の影響を評価した[43]。抵抗運動プログラムには、24週間にわたって週2回のセッションが含まれていた;この間、被験者には1日2回、15gのタンパク質(合計30g/日)またはプラセボのいずれかが補給された。介入終了時の除脂肪体重は、プロテイン群では47.2kgから48.5kgに増加したが、プラセボ群では変化は見られなかった。グループ間の差は除脂肪体重に限定された;筋力と身体能力は、両方のグループで、食事によるタンパク質補給とは無関係に有意に改善した[43]。
これらの研究では、筋肉量と筋力を高めるために設計された適切な運動プログラムへの参加を通じて認知力を高めるために、食事性タンパク質/アミノ酸の使用のための強力な可能性を示唆している。しかしながら、アミノ酸の摂取と認知機能の低下との間のギャップを直接埋めている文献は少なく、この関係の背後にあるメカニズムを適切に理解するためにはさらなる研究が必要である。今後の研究では、ベースラインの健康な人々を対象に、適切に開発された運動プログラムと組み合わせた場合の適切なタンパク質/アミノ酸摂取量の縦断的効果を調査することが推奨される。このデザインにより、研究者はMCIまたはADRDの転換率に対するアドヒアランスを測定することで、この介入の有効性を決定することができるようになる。
4. 睡眠
睡眠は短期的な認知問題[44,45]だけでなく、ADRDの長期的な進行 [46,47,48,49]にも直接関連している。疫学的調査からのデータは、ADRD患者の45%までが睡眠障害を報告しており [50,51]、これらの障害は進行した認知機能低下と直接相関していることを示唆している [50,52]。これらの症状がADRDの発達の初期に現れることは明らかであり、最近の証拠は一晩の睡眠不足でさえ脳内のβ-アミロイド蓄積の増加とリンクしている[53]。睡眠とβ-アミロイドの発達との関係の機序論
的記述については、Juら [54]を参照されたい(ADRDに関連したβ-アミロイドの発達に関する一般的なレビューは Murphy and LeVine [55]で見つけることができる)。さらに、高齢者における睡眠特性と認知機能低下との間のリンクが示唆されており、睡眠と認知が密接に関連しているという事実を強調している[53,56,57,58]。具体的には、昼間の居眠り、夜間の睡眠時間、および過度の昼間の眠気が、高齢成人における将来の認知機能低下の臨床指標として文書化されている[58]。
一般的に、睡眠の質の低下を改善することに関しては、構造化された就寝時間のルーチン、日中のベッドでの時間の減少、日光への曝露の増加、夜間の騒音/光の減少、身体活動の増加、および栄養の改善など、多くの非薬理学的治療オプションが提案されている [20,50,59,60]。睡眠の質と栄養との関連性は、最初は大学生 [61,62] を対象に調査されたが、その後、アスリート [60]、小児 [63]、慢性疾患(肥満など)のリスクがある人 [64]、および高齢者 [65] にも拡大され、肯定的な結果が得られている。さらに、この栄養学的観点から、タンパク質および/またはアミノ酸の摂取が睡眠の質と持続時間にポジティブな影響を与えうることを示す証拠が増えている。
5-ヒドロキシトリプタミン(5-HT)γ-アミノ酪酸(GABA)オレキシン、メラニン濃縮ホルモン、アセチルコリン、ガラニン、ノルアドレナリン、ヒスタミンなどの神経伝達物質はすべて、睡眠覚醒サイクルと関連している。その結果、これらの神経伝達物質の放出および/または抑制を調節する栄養介入は、睡眠に下流の影響を及ぼす可能性がある。 l-トリプトファンは、5-HTとメラトニンの両方の上流の前駆体として作用するアミノ酸である [65,66,67,68]。メラトニンは、睡眠覚醒サイクルへの影響を介してヒトの睡眠を調節することが十分に証明されているホルモンである。そのため、l-トリプトファンの操作を通じてメラトニンを増加させることを目的とした栄養介入が顕著になってきている。l-トリプトファンは、血液脳関門を通過するために他の大型の中性アミノ酸と競合する。l-トリプトファンを多く含むアミノ酸サプリメントは、脳内へのl-トリプトファンの流れを増加させることができ、最終的には睡眠の質の促進に重要な役割を果たす可能性がある[60]。
l-トリプトファン以外にも、睡眠の質の向上に有益な役割を果たす可能性のある個々のアミノ酸がある。これらのアミノ酸の1つはグリシンであり、少量(3~5g)は一般的に食事から毎日摂取されているが、一般的にはヒトではde novo合成によって生成される非必須アミノ酸である[69]。グリシン補給の効果は、主観的な睡眠問題を経験している女性を含む二重盲検クロスオーバー調査で調査された[70]。被験者が5日間グリシンの3 g /日を消費したとき、彼らはセントメアリー病院睡眠質問票(前の24時間以上の睡眠を調べる)と宇宙航空疲労チェックリスト(覚醒時の感情を調べる)[70]の合計スコアで有意な改善を経験した。
同様の3gの用量を用いた別の研究では、寝る前のグリシン摂取により、主観的な睡眠の質と睡眠効果(睡眠時間/睡眠中の時間)が改善され、日中の眠気が軽減され、記憶認識能力さえも改善されたことが明らかになった[71]。さらに、睡眠導入(第2期睡眠の最初の出現までの潜時)と徐波睡眠(第3期睡眠の最初の出現までの潜時)に関するポリソムノグラフィーの潜時は、グリシン摂取により短縮された。グリシンを評価した以前の研究ではいずれも副作用を報告しておらず、これは以前の研究の3倍の9g/日の摂取で、自己報告された副作用はなく(軽度の消化器系の問題を除いて)日中の眠気の増加をもたらすキャリーオーバー効果もなかったことを報告した高用量研究でさらに確認されたことに留意すべきである[72]。
l-オルニチンもまた、睡眠改善に役割を果たす可能性のある非必須アミノ酸であるが、その有効性を研究した研究はこれまでに1件のみである。健康な日本人成人52人に1日400mgのl-オルニチンを補給したところ、プラセボを補給した対照群と比較して、自己申告による不眠症が改善された。介入群では、睡眠の開始と維持、および睡眠時間についても有意な改善が観察された [73]。これらの結果は肯定的であるが、これらの主張を立証するためにはさらなる研究が必要である。
タンパク質/アミノ酸が睡眠の増強に利用される可能性があるという仮説に基づいて、大規模な研究が実施され、多量栄養素の消費と自己申告による睡眠時間との関連性が調査されている。5000人以上の被験者を含むNHANESデータベースからの研究では、睡眠時間と身体的および精神的健康との関係が調査された [74]。研究者は、非常に短い睡眠時間(1晩5時間未満)に分類された人は、通常の睡眠時間(1晩7-8時間)に比べてタンパク質消費量が低いと報告していることを決定した [74]。これらの結果は、Kantら[75]およびHaghighatdoostら[76]によって報告された結果と類似しており、異常な睡眠サイクルを持つ人は、1晩6~8時間の正常な睡眠サイクルを維持している人と比較して、タンパク質消費量が有意に少ないことが示唆された。
これらの結果は普遍的に支持されているわけではないことに留意すべきである。60~80歳の男女を対象とした別の調査では、タンパク質消費量と睡眠時間の間に逆相関があり、タンパク質摂取量の減少は睡眠時間の増加と関連していることが明らかになった[65]。しかし、この調査の著者らは、被験者はカロリー摂取量が非常に低いと自己申告しており、全体的に食事摂取量が著しく過少に報告されていることを示唆していることを示している(自己申告型の食事デザインでは珍しくない)[77]。
これらの研究をまとめると、異常睡眠者はタンパク質濃度の低い食事を摂取する傾向があり、タンパク質/アミノ酸の摂取量が多いことと睡眠時間との間には正の関係があることが示されている。しかし、Santanaら[65]が報告したように、これらの結果は、議論の余地があるとはいえ、ユビキタスなものではなく、この関係をさらに解明するためには、将来のランダム化比較研究を実施しなければならない(研究デザインおよびデータ解析上の考慮事項のリストについては、Dashtiら[20]からの引用である表2を参照のこと)。
表2 睡眠時間と食事摂取量の関係:今後の調査に向けた研究デザインの推奨 *.
研究デザイン
- 睡眠の変数(持続時間を含む)を客観的に評価する
- 睡眠・食事データの同時収集を含む
- 昼間の睡眠だけでなく、夜間の睡眠も含めて
- 関連する遺伝的バリアントの説明
- 睡眠延長試験および介入試験の実施
- 食事摂取量に伴う睡眠時間の変化を評価する縦断的調査の実施
- 食事の摂取量を客観的に測定し、タイミング、消費頻度、間食などを考慮して測定する。
データ分析
- 確立されたカットオフ値を使用して、短い睡眠時間を定義する
- 睡眠と他の結果変数との間の非線形関連の検定
- アセスメントのタイミングやデータ収集の際に季節性を考慮する。
- 効果修飾語(すなわち、年齢、性別、BMI、人種/民族性、または抑制)の検定。
- 多変量解析を行う際には、交絡変数を考慮してほしい。
- 小規模調査から得られた知見を用いて、因果関係やメカニズムを検証するために、より大規模なコホート研究を展開する。
* 表はDashtiら[18]の原著から引用している。
前述のように、睡眠はADRDの重要な危険因子である。さらに、タンパク質とその構成アミノ酸の補給は、様々な集団において、睡眠の質と持続時間を改善する可能性があることが示されている。これは明らかにタンパク質/アミノ酸の摂取とADRDの進行を改善するための睡眠の改善の間の強力なリンクの可能性を示している。しかし、これらの関係の因果関係の仮説はまだ根拠がなく、この仮説を具体化するためには、より詳細な研究が必要である。
5. メンタルヘルス
世界保健機関(WHO)によると、メンタルヘルスとは「個人が自分の能力を実現し、人生の通常のストレスに対処し、生産的で実りある仕事ができ、自分のコミュニティに貢献することができる幸福な状態[68]」であるとされている。アルツハイマー病/認知症に関しては、ADRDのリスクと関連するメンタルヘルスの様々な要素がある。これら3つの構成要素のすべては、結果として、認知機能の低下を緩和する役割を果たすかもしれない特定のタンパク質/アミノ酸の介入によって積極的に影響を受けることが示唆されている。
一般的に、脳と身体がどのように要求に反応するかと定義されている[82]が、ストレスはその長さ(短期/長期)タイプ(ネガティブ/ポジティブ)または現実(現実/知覚)の変化によって引き起こされる。ストレスが長期に渡って長期化すると、それは慢性ストレスと呼ばれ、長期的な身体的・精神的健康に深刻で有害な影響を及ぼす可能性がある。時間の経過とともに、慢性ストレスは、うつ病[83]、不安[84](どちらもADRDの危険因子である)そして最終的には認知機能の低下[78]を含む、多数の健康関連の懸念につながる可能性がある。多くの研究は、ストレスと動物モデルでの認知機能低下の間の機序的関係を分析しており[78,85,86,87,88]、人生の早い時期の慢性的なストレス因子は、強化されたアルツハイマー病関連の病因への素因をもたらす傾向があることを実証している。これらの結果は、Rush Memory and Aging Projectによって示されたように、ヒトにも当てはまるようである。このプロジェクトでは、研究者は神経症の特徴について患者をテストし、「苦痛の傾向」のスコアが高かった患者は、次の3年間でADRDと診断される可能性が2.7倍高いことを発見した [89]。
この概念を評価したより堅実な調査の一つは、50年間で13,000人以上の被験者を追跡し、晩期の不安、うつ病、およびアルツハイマー病の発生との関係を調査したものである [90]。その結果、晩期のうつ病を経験した人は認知症になるリスクが2倍に上昇すると結論づけられ、以前の研究と同様であった [89,91,92]。しかし、この効果は晩期のうつ病だけに限定されたものであり、人生の早い時期にうつ病を経験しても将来のADRDの問題を予測することはできず、一方、中年期にうつ病を経験するとADRD診断のリスクが約20%上昇した。それにもかかわらず、血管性認知症に特化してみると、中年期と晩期にうつ病の症状を呈している人は、疾患リスクが3倍以上に増加していた [90]。アルツハイマー病の神経画像化イニシアチブは、研究者にとっても、精神的健康と認知機能の低下との関係を探る絶好の機会となっている[93]。Leeらによる初期の研究 [94] では、うつ病を患っている被験者は、うつ病症状のない人と比較して、前頭葉、頭頂葉、側頭葉の白質萎縮のレベルが高いことが明らかになった。
ストレス、うつ病、および不安が将来の認知機能低下のリスクに及ぼす影響を考えると、主にアミノ酸トリプトファンに焦点を当てた栄養介入を評価する研究がいくつか登場している。生体内では、トリプトファンは中枢神経系と消化管で合成されるセロトニン [95] の前駆体として作用するが、末梢で産生されるセロトニンは血液脳関門を通過できない [96]。さらに、トリプトファンは自発的に合成することができず、その結果、食事から適切なレベルのトリプトファンを得なければならない [97]。トリプトファンの摂取量が少ないと脳内セロトニンレベルが低下し、これはうつ病や不安症の発症に関与する重要な危険因子であると考えられている[21]。
NHANES 2001-2012年(n = 29,687)のデータを評価したところ、トリプトファン摂取量は自己申告したうつ病のレベルと逆に関連していることが判明した[22]。この関係は、約8000人の女性を対象とした調査でも見られ、うつ病の被験者は非うつ病の被験者に比べてトリプトファンの摂取量が有意に低かった[23]。さらに、ノースダコタ大学の研究では、情動障害(不安、抑うつ、気分)に対する食餌性トリプトファンの効果を評価した。高トリプトファン食と低トリプトファン食をそれぞれ4日間摂取した後(条件間で2週間のウォッシュアウトを含む)参加者の気分は有意に上昇し、同時に抑うつ症状と不安症状が減少した[21]。
うつ病、不安、ストレスの症状を調節する可能性のある別のアミノ酸はGABAである。GABAはタンパク質の構成要素として使用できないため、従来のアミノ酸とは考えられていないが、GABAは脳内の主要な抑制性神経伝達物質として作用し、レベルの低下は幅広い問題(例えば、うつ病や不安)に関与している[98,99]。この概念は、大うつ病を患っている人はGABAレベルが低い可能性が高いことを示唆する2010年の研究によってさらに強固なものとなり[100]、この概念をさらに支持している。GABAレベルと精神的健康症状との関連性にかかわらず、このような問題を緩和するための経口サプリメントの有効性については研究が不足している。今後の研究で外因性のサプリメント/摂取の有効性を判断できるまでは、うつ病および/または不安緩和の方法としてGABAの増加摂取を利用することは推奨されない。
6. タンパク質摂取、認知健康、マイクロバイオーム
最後のコメントは、ADRD に関連するように急成長しているマイクロバイオームの分野に対処すべきである。マイクロバイオームには、特定の量と比率に応じて有用であったり有害であったりする微生物(すなわち、細菌、真菌、ウイルスなど)が含まれている[101]。ヒトの体内にはヒト細胞の10倍以上の数の微生物細胞が含まれており、最近の研究では、腸内微生物叢が脳内の化学物質の産生に影響を与え、ADRDなどの神経学的な問題に寄与する可能性があることが示されている[102,103,104]。
ADRDに関しては、マイクロバイオームと脳の間には前後のコミュニケーションシステムがあるようであり、疾患条件下ではこのコミュニケーションが障害され、有害な病理学的促進経路を強化する[103]。脳内の異常な活動は腸の状態を変化させ、神経炎症とアミロイド沈着の増加につながる可能性がある[102];その後、マイクロバイオームのこの変化は、神経炎症、不安、およびうつ病を悪化させる脳内代謝物の生産を増加させる[102,104]。その結果、脳の健康が個人の全人的な健康状態と複雑に関連していることは驚くに値しない。
ADRDの開発に関連付けられている前述の危険因子と同様に、マイクロバイオームは、栄養と具体的にはタンパク質の消費によって密接に影響を受けている[105,106,107]。アミノ酸に関連して、食事摂取量の供給源、濃度、およびバランスは、マイクロバイオームの構成、構造、および機能に寄与する主要な要因である。タンパク質と炭水化物の間の適切な比率(または低タンパク質食)が、タンパク質の推奨/要件を超える食事と比較して推奨されることが示唆されている[101,107]。実際、食事性タンパク質摂取量の増加は、疾患のリスクの増加に関連する病原性微生物の増加につながる可能性がある[101]。しかし、このメカニズムは十分に理解されておらず、一部のタンパク質はマイクロバイオームの健康にプラスの影響を与える可能性があることに注意することが重要である[107]。例えば、インドール(トリプトファン由来の必須アミノ酸)の腸内細菌発酵は、神経発達を改善し、多発性硬化症などの状態から保護する可能性がある[101]。これらのデータの結果として、強力な結論を出す前に、タンパク質とマイクロバイオームとの間の機序的関係とADRDへの影響をさらに検討することが重要である。
7. 高齢者のタンパク質/アミノ酸摂取推奨量
筋肉の成長に関連するように、人体内でのタンパク質の消費についての継続的な議論がある。一方の議論は、指定された時間枠内で消費して利用できるタンパク質の上限があることを示唆しており[108]、もう一方の議論は、タンパク質の摂取はタンパク質合成に直線的に関連しており、それ以上の摂取が効果的でなくなる上限閾値は存在しないことを示唆している[109]。いずれにしても、より多くのタンパク質を摂取する高齢者は、筋肉量と筋力を維持する能力が高いという圧倒的な証拠がある[110,111,112,113]。欧州臨床栄養代謝学会(ESPEN)は、高齢の成人が少なくとも1.0~1.2gのタンパク質を含む食事を体重1kg/日に維持することを推奨している[19]。急性または慢性疾患を持つ可能性のある高齢者では、1.2~1.5gのタンパク質/kg体重/日が推奨されており、重度の病気や怪我をしている人ではさらに多くの摂取量が必要となる。しかし、現在のところ、認知機能に関連したタンパク質摂取に関する推奨事項はないことに注意が必要である。
タンパク質/アミノ酸の摂取と認知を直接結びつける証拠が乏しいため(現在の研究はすべて疾患に関連した危険因子に焦点を当てている)認知機能の健康について具体的な推奨を行うことはまだできない。将来のガイドラインのための適切な平行線は、術前の栄養不良を回避するために利用されている現在の推奨事項に見出すことができるかもしれない。グローバルなプロスペクティブ・コホート研究では、栄養不良の入院患者および手術患者は、合併症リスクの増加 [114,115,116,117]、再入院率の増加 [114,118,119,120]、入院期間の長期化 [114,115,118,119,121]、死亡リスクの増加 [114,119,122,123]、およびケアコストの増加 [114,124]などの臨床転帰が有意に悪いことが示唆されている。その結果、米国非経口経腸栄養学会[125]、周術期品質イニシアチブ[126]、および前述のESPEN[127]などの外科栄養ガイドラインはすべて、栄養状態のスクリーニングツールの選択、栄養不良を評価するツール、およびリスクのある患者に対する適切な介入についての詳細を提供してきた。これらのガイドラインでは、系統的で日常的な栄養スクリーニング、検証されたツールによるその後の栄養評価、または登録栄養士による包括的な栄養評価(スクリーニングでリスクが確認された場合)が提案されている。認知機能低下の分野に関連するものとして、このフレームワークは、ADRDのリスクがある人のための栄養学的ガイドラインや介入勧告の開発をリードする理想的な機会を提供している。
8. 結論
上述したように、大規模な研究基盤は、ADRDの原因が多因子性であり、リスク因子(修正可能なものと修正不可能なもの)の組み合わせが疾患の発症と進行を決定することを実証している[11]。食事性タンパク質とその構成アミノ酸は、認知機能の低下に関連する危険因子に及ぼす影響を通じて、長期的な認知において重要な役割を果たしている可能性がある。現在までのところ、タンパク質/アミノ酸の摂取と認知機能の低下を直接結びつける科学的データは限られている。その結果、現在得られている結論のほとんどは大雑把なものであり、さらなる調査が必要である。例えば、タンパク質が身体活動の結果を最大化し、身体活動が認知状態の維持に有益であることは知られているが、タンパク質と認知状態との間の直接的な作用機序は不明のままである。アミノ酸・タンパク質の摂取と認知機能の健康の背後にある真のメカニズムを解明するというこの概念は、睡眠、ストレス、メンタルヘルスなどの他の修正可能な危険因子についても同様である。タンパク質とその構成アミノ酸が縦断的な認知健康に及ぼす可能性のある下流の結果を直接調査するためには、さらなる研究が必要である。さらに、特に認知機能の健康に関連した最適なタンパク質摂取要件に関する情報は乏しい。その結果、最適な認知機能を維持するためのタンパク質の摂取または特定のアミノ酸の摂取に関する決定的な結論と具体的な推奨事項を開発するために、さらなる研究が必要とされている。