Contents
pubmed.ncbi.nlm.nih.gov/36231680
Curative Potential of Substances with Bioactive Properties to Alleviate Cd Toxicity: A Review
Int J Environ Res Public Health.2022 Oct; 19(19):12380.
オンライン公開 2022年9月28日
要旨
急速な都市化と工業化により、カドミウム(Cd)汚染は憂慮すべき事態となっている。カドミウムは有毒な重金属であり、生体内での生理機能は知られていないため、人々の健康に深刻な脅威を与えている。カドミウムは半減期が長く(10~30)、臓器や器官に蓄積され、不可逆的な損傷を与えることが多いため、深刻な問題となっている。
さらに、カドミウムの汚染は、特定の発がん性・非発がん性の健康リスクにつながる可能性がある。そのため、人々の健康への悪影響を最小限に抑えなければならない。カドミウムは空気、水、土壌、食物連鎖を通じて体内に入ることができるため、カドミウムの毒性を防御し、除去するための一つの方法として、生物に対するカドミウムの悪影響を除去することを目的とした栄養補助食品を使用することが考えられる。
食品または薬用植物に含まれる天然由来の生物活性化合物は、生体に有益な影響(主に抗酸化、抗炎症、抗老化、抗腫瘍形成)を与え、カドミウムを含む様々な汚染物質や汚染物質の悪影響を緩和することが報告されている。
本研究では、最近研究されたカドミウムの悪影響を緩和することができる生理活性物質やミネラル元素の様々なモデル系に対する治癒効果をまとめ、カドミウム由来の健康脅威を軽減するだけでなく、将来的にはカドミウム毒性の予防と制御、カドミウム汚染の除去が達成できることを想定している。
キーワード カドミウム、毒性、酸化ストレス、生理活性物質
1.はじめに
カドミウム(Cd)は、生体内で未知の生理機能を持つ非必須金属である。カドミウムは、生体の生理機能が不明な非必須金属であり、ヒトに様々な健康被害をもたらすことが明らかにされ、大きな問題となっている。カドミウムは、1960年代に日本の高濃度汚染地域で深刻化した有痛性骨疾患の原因であることが報告され、大きな注目を集めた。この地域では、30年以上にわたって汚染された食物や水を摂取した結果、体内にカドミウムが蓄積し、「痛い痛い病」と訳される骨粗鬆症様疾患「イタイイタイ病」が発症した[1,2]。カドミウムは天然に存在する重金属であるが、表層環境中のカドミウムの90%以上は人為的な活動に由来している。カドミウムによる環境汚染の主な原因は、化石燃料の燃焼、セメント製造、リン酸肥料製造、冶金作業、下水汚泥、廃棄物沈着などです[3]。カドミウムは分解性が遅いという特徴があるため、環境中に非常に長く存在し、植物や他の生物に吸収され、生体系に蓄積される可能性が高くなる。さらに、土壌から植物への移行が多いため、人間によるカドミウムの摂取はほとんど避けられない。食物連鎖は、タバコの煙や汚染された大気とともに、ヒトがカドミウムを摂取する主な原因であり、血液、尿、組織中のカドミウム濃度の上昇をもたらす。カドミウム由来の食品汚染は、地理的な地域性、土壌からのカドミウムのバイオアベイラビリティ、土壌組成、栽培作物の種類、植物の遺伝学、地域の農法、原材料のポストハーベスト操作、食品の調理に関連する複雑な問題である[4].
本研究の目的は、生物活性を有する食品由来化合物によるカドミウム毒性の緩和策について、詳細かつ広範な文献検索を行うことであった。カドミウムの毒性は、植物、微生物、動物に至るまで、さまざまなモデル系で説明されている。カドミウムの毒性を除去し、カドミウムが生体系に与える影響を理解することは、カドミウムの毒性から人々を守るための戦略開発に貢献する可能性がある。そのため、この研究では、ほとんどの種類の生物試料におけるカドミウムの影響とその軽減の可能性を考慮した、幅広い研究を行った。Medline/PubMed、Web of Science、Science Direct/Elsevier、Springerなどの国際的なデータベースで索引付けされた雑誌から広範な文献を検索した。さらに、Google booksとGoogle Scholarも考慮した。レビューで引用された適格な文献ソースは、英語のみで書かれた出版物で 2003年から2022年までの日付のものであるが、大半は過去5年以内のものである。文献検索には、以下の用語の組み合わせ(キーワード)を適用した:「カドミウム」「毒性」「イタイイタイ」「酸化ストレス」「フリーラジカル」「消化器」「腎毒性」「肝毒性」「細胞毒性」「環境汚染」「緩和」「ミネラル元素」「マクロ元素」「ミクロ元素」「ビタミン」「生理活性物質」「抗酸化」「植物」「動物」「微生物」未発表の著作物や個人的な通信、症例報告や手紙、全文が入手できない論文は除外された。合計で200の関連文献が収集され、レビューのために処理された。
2.カドミウムの毒性
カドミウムの健康への影響の深刻さは、ヒトでの半減期が約20~30年と非常に長いことと、組織や臓器からのカドミウムの排泄率が低いことが相まって、体内にカドミウムが蓄積し、長期間の曝露によって健康に様々な悪影響を及ぼすことと密接に関係している[5]。カドミウムの人体への悪影響を最小限に抑えるため、食品や環境中のカドミウムの許容量が設定されている[6,7]。暫定耐容月摂取量は、国連食糧農業機関/世界保健機関(FAO/WHO)の専門委員会が疫学調査に基づいて定めたもので、25μg/kg体重に設定されている。これは、1日の摂取量が0.83μg/kg体重/日、70kgの人で58μg/日であることを表している。尿中カドミウム閾値は5.24μg/gクレアチニンである。さらに、大気中のカドミウムの安全基準は5.0 ng/m3(年平均)、飲料水では3 μg/L、作物生産に積極的に利用されている土壌では3 mg/kgに設定されている[7,8]。
通常、体内でスルフヒドリル基と結合しているカドミウムの輸送は、肝臓(30%)や腎臓(30%)などの軟部組織に主に誘導され、残りのカドミウムは全身に分布する[9].カドミウムが攻撃する主要な臓器は腎臓であるが、カドミウムは肝臓、肺、膵臓、生殖器、胎盤、骨、造血系、神経系、循環器系の構造および機能を変化させることが示されている。さらに、カドミウムが介在する酸化ストレスは、卵子の成熟障害、生殖能力の低下または性機能障害を引き起こし、胚の発達を損ない、しばしば出生前の死亡につながる[10,11,12,13].カドミウムはまた、DNAの一本鎖切断の形成を促進するため、ラットのライディッヒ細胞に対して直接的な毒性を示し、その結果、正常な細胞の割合が減少し、テストステロンの分泌が減少する[14].さらに、非毒性量のカドミウムであっても、精巣の遺伝子発現パターンを変化させ、精巣自己免疫への傾向を強めることから、内分泌撹乱物質であることが示されている。さらに、カドミウムはエストロゲンおよびアンドロゲン受容体に直接結合し、エストロゲンおよびアンドロゲン様活性を増強する[15,16]。
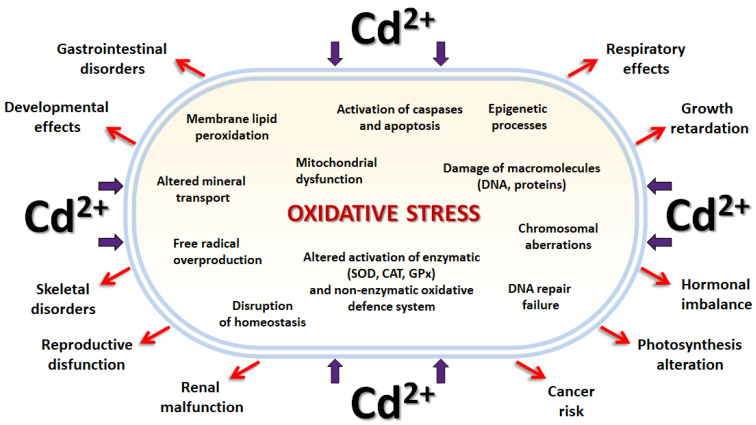
カドミウムは最も毒性の強い元素の一つであるため、数十年前からすでに科学的関心の中心となっている。最近では、カドミウムを介したDNAの変化が、カドミウムの顕著かつ懸念される影響と考えられている。カドミウムへの暴露は、発がん性、アポトーシス、壊死を引き起こす直接的な細胞毒性に関連している(図1)。カドミウムは、様々なモデル系において、様々なメカニズムでDNA損傷を誘発することが示されている。カドミウムに暴露されたシロイヌナズナの苗木では、ランダム増幅多型DNA(RAPD)テストを用いて、有意な遺伝子変化が検出された[17]。さらに、C57BL/6妊娠マウスのカドミウム処理は、胚細胞にDNA損傷を引き起こし、p53、p21、Baxの転写レベルのアップレギュレーションとBcl-2のダウンレギュレーションを通じてBcl-2/Bax均衡をシフトするため、アポトーシス経路の活性化の引き金になる[18]。また、カドミウムを介した酸化ストレスの誘導によるDNAの断片化は、貝類のMeretrix meretrixの肝膵臓[19]、カエルのRana limnocharisの精巣[20]、骨芽細胞株[21,22]、さらにヒト肝癌細胞[23] で報告されている。カドミウムを介した変異原性のメカニズムに関する現在の知見は、広範囲にレビューされている[24,25]。カドミウムの発がん性は、DNAの複製後のミスマッチ修復を阻害する能力[26,27]と、細胞周期の停止を阻止する能力[28,29]によって証明されており、これらは共に高レベルの遺伝子不安定性をもたらす。発表された科学論文の多くでは、カドミウムによるDNA損傷は、カドミウムを介した酸化ストレスと密接に関連している[30,31,32,33]。カドミウムは活性酸素種(ROS)の産生を直接促進するわけではないが、細胞の抗酸化システムを阻害するため、ヒドロキシルラジカル、スーパーオキシドアニオン、過酸化水素などのROSが蓄積し、結果として酸化的DNA損傷が引き起こされる。その他のカドミウム由来の細胞障害は、細胞のホメオスタシスに影響を与える細胞のイオノームバランスの不安定性に関連しており[34,35,36,37,38]、遺伝子の発現を変化させるカドミウム媒介エピジェネティック修飾に関連している[37,39,40,41,42].
図1 カドミウムの毒性。カドミウム毒性が生体に及ぼす危険な影響を模式的に示したもの。カドミウムが生体に過剰に暴露されると、フリーラジカルの産生増加と抗酸化防御システムの障害による酸化ストレスの結果、膜脂質の過酸化、高分子の損傷、染色体異常、DNA修復不全、細胞の恒常性を乱す代謝の悪化、カスパーゼの活性化、アポトーシスが起こり、主に細胞に重大な変化をもたらす。細胞機能の欠陥は、生体に傷害を与え、胃腸障害、発育障害、骨格の変化、生殖機能障害、腎機能障害、発がんリスク、呼吸器への影響、成長遅延、ホルモンバランスの乱れ、光合成の変化などをもたらす可能性がある。
3.食品添加物によるカドミウム毒性軽減効果
世界中の著者による研究によると、食品や水から摂取されるカドミウムの許容濃度限度をしばしば超えている[43,44,45]。さらに、カドミウムはいかなる生理的過程にも関与せず、生物に対する毒性のみが知られているため、集団の健康に対する悪影響は最小限に抑えなければならない。体内におけるカドミウムの隔離の動態と代謝において、メタロチオネイン(MT)は、カドミウムと結合してCdMTを形成し、それによってカドミウムの即時毒性効果を防止するという重要な役割を果たすと、[46]は概説している。しかし、カドミウムの濃度が高くなったり、長期間さらされたりすると、MTの能力を超えてしまうため、カドミウムが生体に与える影響を軽減するための戦略を適用する必要がある。最も有望な戦略のひとつは、食品供給システムである。トゥアラン蜂蜜[47]、果物[48]、オリーブオイルやコロシントオイル[49]などの様々な食品が、カドミウムを介した毒性に対して有益な機能を引き起こすことが示されてきた。しかし、食品そのものではなく、食品に含まれる生物学的活性物質、特に抗酸化栄養素がカドミウム毒性を除去する役割を担っている。
3.1.ビタミン類
3.1.1.ビタミンC(アスコルビン酸)
ビタミンC(L-アスコルビン酸、アスコルビン酸塩、AsA)は、生物学的ストレスにさらされた細胞において、過剰な活性酸素を隔離するために代替不可能な役割を果たす著名な抗酸化剤である。AsAの生合成、異化、リサイクルを担う遺伝子を遺伝子操作し、植物におけるAsA合成を改変する研究により、AsAがCdなどの金属によるストレスを含む様々なストレスに対抗・予防できることが明らかになった[50]。さらに、AsAを植物モデル系に外因的に適用することで、カドミウムの毒性から保護する能力があるかどうかを調べる必要があった。実際、AsA(0.1,0.3,0.5 mM)をトウモロコシ(Zea maysL.)に葉面散布すると、Cd(CdSO4 50 mg/kg土壌、4週間)に曝露したトウモロコシの成長、増殖、光合成能力、タンパク質濃度を回復させた。カドミウム曝露によるトウモロコシの酸化ストレスは、マロンジアルデヒド(MDA)含量の増加、H2O2蓄積、スーパーオキシドディスムターゼ(SOD)、ペルオキシダーゼ(POX)、カタラーゼ(CAT)、グルタチオン還元酵素(GR)の活性上昇によって検出されたが、これらはASAによって著しく改善されていた。さらに、トウモロコシの穀粒によるカドミウムの取り込みは、AsAを葉面散布することで減少した[51]。同様に、10μMのCdCl2(Brassica napusL. cv. Tammi)に曝露したカドミウムストレスのナタネ苗にAsA(それぞれ250 mg/kgまたは500 mg/kgを単葉投与、または苗を1 mM AsAでプレインキュベート)を適用したところ、AsA-SH-NADPHサイクル恒常性維持を介して活性酸素含量を減少させる保護効果も検出した[52]と100μMCdCl2曝露した小麦苗[53]。
カドミウムの毒性が生物全体のホメオスタシスに及ぼす影響を示すため、単細胞の非病原性酵母Schizosaccharomyces pombeで、その影響とAsA処理の効果が[54]によって調査された。植物モデル系で得られた知見と同様に、細胞はAsA処理(10 mM AsA前処理、30分)により有意に利益を得た。カドミウム(10,20,40,100,400μMCdCl2)に曝露した細胞は、イオノームバランスが損なわれ、酸化ストレスにより膜脂質が過酸化し、細胞の形状が変化して成長遅延を引き起こした。AsA前処理は、Cdの影響を受けた細胞の状態を顕著に改善した。
また、モデル動物を用いて、カドミウムはウサギに肝毒性および心毒性を引き起こすことが示されている。CdCl2を1.5 mg/kg体重(b.w.)の用量で28日間経口投与すると、肝臓および心臓にCdイオンが大幅に蓄積し、肝臓および血漿の正常な生化学パラメータが変化したが、これはAsA(150 mg/kgb.w.)の補充によってほぼ回復した[55,56]。マウスモデル系では、CdCl2曝露(100 mg/L飲料水、8週間)が、生体の抗酸化能の変化と密接に関連した血管機能障害を引き起こすことが示された。この研究では、マウスにおけるCd誘発高血圧および血管機能障害の酸化的損傷の緩和および血管機能の改善に対するAsA(50または100 mg/kg b.w.)の薬理効果を初めて実験的に証明した[57]。これらの研究によると、AsAの補給は、カドミウム誘発性障害に対する治療的および予防的アプローチとして提案することができる。
3.1.2.ビタミンE
ビタミンEとは、トコフェロールとトコトリエノールをまとめたもので、そのうちα-トコフェロールのみがヒトに必要なビタミンEを表している。すべての細胞に存在する脂溶性の抗酸化物質で、膜の過酸化脂質から細胞を守る第一の役割を担っている。活性酸素の生成を制御することによる強力な抗酸化機能に加えて、ビタミンEは免疫力を高める特性を持ち、シグナル伝達や遺伝子発現を調節して、がんや心血管疾患または神経変性疾患から生体を保護する[58,59,60]。ビタミンEの欠乏はまれだが、ビタミンEの補給は、生体の免疫機能を大幅に高めるだけでなく、生物学的ストレスにさらされた生体の状態を改善することが示されている。カドミウム誘発ストレスに対するビタミンE補給の効果は、水生および陸上のさまざまなモデルシステムによって証明されている。
水生動物は陸生動物に比べてカドミウムを蓄積しやすいため、養殖場における魚のカドミウム影響を適切な方法で除去することが必要である。カドミウムは、ナイルティラピア魚の体重増加やタンパク質濃度を低下させ、血清クレアチニン、AST(アスパラギン酸アミノトランスフェラーゼ)、ALT(血液アラニンアミノトランスフェラーゼ)値が上昇し、肝機能や腎機能に変化を与えることが示されている。本研究の著者らは、カドミウム(25または50 mg CdCl2/kg飼料)で汚染された飼料に、天然クレイ(飼料の3%)、ビタミンC(100 mg/kg飼料)、ビタミンE(50 mg/kg飼料)を添加した。いずれの添加物も成長率を高め、Cdの影響を受けた血清クレアチニン、ALT、AST値を改善し、魚体中の残留Cdを減少させた。したがって、ビタミンEだけでなく、ビタミンCや天然粘土も、カドミウム誘発ストレスにさらされた魚の腎臓と肝臓の機能を改善する能力がある[61]。同様に、グラスコイCtenopharyngodon idellusをCdに曝露(20 μM/kgCdCl2を腹腔内注射、注射後 4,8、12,16日目にサンプル採取)すると、肝臓、血液、腎臓に毒性が現れた。肝毒性は、肝細胞のCd含有量の増加、MDA濃度の上昇、肝細胞のアポトーシス率の増加、アポトーシス関連遺伝子のmRNA転写発現の亢進によって顕在化した。カドミウム添加は肝臓の機能と形態に影響を与え、CAT、SOD、GPx(グルタチオンペルオキシダーゼ)の活性が著しく低下し、抗酸化防御機構が変化した。また、草鯉のカドミウム曝露により、血中および体幹腎のカドミウム含有量が増加し、臓器障害や免疫毒性に関連することがわかった。ビタミンE(20 IU/kgをCdCl2注射後4日目に補充)のCd処理魚への補充は、血液および組織中のCd含有量の減少、損傷臓器の安定化、保護抗酸化システムの促進をもたらし、中毒魚の健康状態を著しく改善した[62,63]。
また、陸上動物モデル系においても、カドミウムを介したストレスによる組織毒性および損傷が検出された。カドミウム(CdCl2,5 mg/kg b.w.、28日間または30 ppm、7週間飲水)に曝露したラットおよびマウスの肝毒性は、肝臓重量の減少、肝臓組織変化、酸化ストレス、肝臓中のカドミウム含有量の増加、血清中のALTおよびAST濃度の上昇、重度の肝細胞壊死、肝細胞の破裂、肝索の乱れによって証明されている。ビタミンEの投与(それぞれ100 mg/kg b.w.または50 IU/kg)は、酸化物質に対する細胞応答を制御する著名な制御経路であるNrf2(核因子赤血球2関連因子2)経路のタンパク質をコードする遺伝子の発現を促進するので、酸化ストレスを抑制することにより、カドミウム由来の生化学的および病理学的変化を改善した[64,65]。
CdCl2に暴露されたラットの腎毒性は、複数の独立した科学研究所によって組織学的および生化学的分析によって証明された。実験動物へのCdCl2の投与は、毎日経口投与(それぞれ20 mg/kg b.w.を30日間、5 mg/kg b.w.を28日間)、腹腔内投与(1日2 mg/kg b.w.を8日間)、飲料水(蒸留水中50 ppm Cdを20週間)により行われた。腎臓組織および腎臓ミトコンドリア画分において、SOD、CAT、グルタチオン還元酵素(GR)、GPx、グルタチオン-S-トランスフェラーゼ(GST)、脂質過酸化酵素(LPx)などの酵素的防御系の活性の、Cd添加による変化を測定した。さらに、カドミウム処理により腎臓に蓄積され、体重および腎臓の減少、血清中のBUN(血中尿素窒素)およびSCr(血清クレアチニン)の上昇を引き起こし、腎臓の組織学的変化を引き起こした。カドミウム中毒では、糸球体濾過量(GFR)は低下したが、アンジオテンシン変換酵素(ACE)活性は亢進し、血圧と心拍数は上昇した。カドミウムに曝露したラットにビタミンEを投与(それぞれ20 mg/kg b.w., 100 mg/kg b.w., 250 mg/kg b.w., または40および400 mg/kg b.w. )すると、腎臓を機能障害から保護し腎機能障害を正常化し、腎細胞のアポトーシス抑制、抗酸化防御系の増強による酸化ストレスからの腎臓保護が認められた[66,67,68,69].
さらに、カドミウムに曝露したラットの精巣を分析したところ(2 mg/kg b.w. Cd(NO3)2を28日間毎日注射、または 2 mg/kg b.w.CdCl2を実験期間30日目に投与)、Bay/Bcl-2比の増加、プロトンポンプ(Na+/K+-ATPase、Ca2+-ATPase、Mg2+-ATPase)活性の低下による精子数、生存率、運動率の低下、ホルモンレベルの低下などミトコンドリア経路でのアポトーシス現象が見られた。ビタミンE投与(それぞれ100 UI/kg b.w. 28日間、または100 mg/kg b.w. 30日間)は、精巣のプロトンポンプ活性に対するカドミウムの毒性効果を改善し、カドミウム誘発のアポトーシスから精巣を保護し、精巣完全性、構造および機能を改善した[70, 71].
一般に、Cdの中毒は、生体の保護的な抗酸化システムに対する大きな挑戦となる。カドミウム(CdCl2 0.4 mg/kg/w.の単回腹腔内注射、または1 mg/kg/w.の1日1回皮下注射(s.c.)、30日間)を投与すると、活性酸素の産生が増加し、生体に酸化ストレスを与える。mg/kg/wのCdCl2を30日間皮下注射)、活性酸素の産生が増加し、細胞に酸化ストレスを与え、血液学的および生化学的パラメータを変化させ、血漿クレアチニン、MDA、ALT、AST、ALPおよびBUNレベルを増加させ、GPx、CAT、GP、GSTおよびSOD活性を減少させた。ビタミンE(20 UI/kg b.w.または60 mg/kg b.w.をそれぞれ30日間、s.c.注射で単回i.p.投与)治療は、血液学的値に対するCdの毒性効果、および抗酸化防御システムの構成要素に対して保護的な役割を示す[72,73,74]。
試験系に対するカドミウムの毒性作用とビタミン補給による軽減を表1にまとめた。
表1 ビタミンの効果
| 物質名 | モデル | 物質の投与量 | Cdの投与量 | Cd曝露による有害反応と物質による治療効果 | レフ。 |
|---|---|---|---|---|---|
| ビタミンC | ゼアメイズL. | 0.1-0.5 mM (4週間葉面散布) | 50 mgkg-1土壌 | 植物成長、光合成、タンパク質含量、MDA含量、H2O2蓄積、CAT、SOD、GR活性、穀物Cd吸収量 | Zhang et al., 2019年【51】。 |
| アブラナ科 | 250および500 mgkg-1(単回葉面散布) | 10 μM(等量) | アスコルビン酸-グルタチオンサイクル、活性酸素量 | ユング et al., 2020年【53】。 | |
| Triticum aestivumL. | 1mM(苗のプレインキュベーション) | 100 μM(等量) | AsA-GSH-NADPHサイクルホメオスタシス、活性酸素発生 | Wang et al., 2017年[52]。 | |
| Schizosaccharomyces pombeL. | 10 mM (細胞処理30分) | 10-400 μM(等量) | イオノームバランス、CAT・SOD活性、MDA含量、細胞モルフォロジー | ナブラチロワ et al., 2021年[54]。 | |
| ラビット | 150 mgkg-1b.w.(28日間経口投与)。 | 1.5 mgkg-1b.w.(28日間経口投与)。 | カドミウム蓄積量、血液生化学的パラメータ | ムムタズ et al., 2019年[55]、アリ et al., 2020年[56]。 | |
| マウス | 50および100 mgkg-1b.w.である。 | 100 mgL-1(飲料水中、8週間) | 血管機能障害、高血圧、酸化的障害 | ドンプンハ et al., 2011年[57]。 | |
| ビタミンE | ティラピア | 50mgkg-1食を12週間摂取 | 20および50 mgkg-1飼料 | 血清クレアチン、ALT、AST活性、残留カドミウム量 | アヤト et al., 2017年[61]。 |
| クテノファルンゴドンアイデルス | 20 IUkg-1(Cd注射後4日目に単回投与)。 | 20 μMkg-1単回 i.p.注射。 | 肝細胞効果、MDA含量、肝細胞アポトーシスおよびアポトーシス関連遺伝子、肝形態、SOD、CAT、GPx活性 | Duan et al., 2018年[62]、Huang et al., 2020年[63]。 | |
| マウス | 100 mgkg-1 または50IUkg-1 |
5 mgkg-1b.w.を28日間、または 30 ppmを7 週間、飲料水に添加する。 | 肝臓重量とCd含有量、ALTとAST含有量、肝細胞の壊死、肝細胞の破裂、酸化ストレス、抗酸化酵素、Nrf2遺伝子の発現抑制効果 | ファング et al., 2021年[64]; アルアッタール 2011年[65] |
|
| ラット | 20mgkg-1重量部、100mgkg-1重量部、250mgkg-1重量部、または40および400mgkg-1重量部、および100UIkg-1) | 20 mgkg-1b.w.を30日間、5 mgkg-1b.w.を28日間毎日経口投与する;または i.p. 2 mgkg-1b.w.を8 または 28日間、または飲料水中 50 ppmを20 週間投与する)。 | CAT、SOD、GR、GPxおよびGST、LPX、体重効果、血清尿素およびクレアチニン、腎組織変化、アンギオテンシン変換酵素、血圧、心拍数 | アディら2016年[66]、ファングら2021年[67]、カラブルット・ブランら2008年[68]、チェ&リエ2003年[69]。 |
3.2.鉱物の元素
3.2.1.セレン
必須微量元素であるセレンは、土壌、水、および一部の食品に自然に含まれている。代謝を正常に行うためには、毎日少量のSeを摂取することが必要である。欧州食品安全機関(EFSA)によると、適切なSeの摂取量は、成人1日あたり70μg Seに設定されている[75]。有機と無機の両方の起源を持つSeの吸収は、小腸で行われる。Seは、様々な組織に分布して重要な生物学的機能を発揮する調節タンパク質であるセレノプロテインの合成に必要である。グルタチオンペルオキシダーゼ(GPX)、チオレドキシンレダクターゼ(TrxR)、ヨードチロニンデオジナーゼ(IDD)などのセレノプロテインは、その幅広い抗酸化活性により、細胞の酸化傷害を防ぐことが大きな役割である。このように、抗酸化作用を持つSeは、人間にとって重要な微量元素に属し、健康増進のための栄養補助食品として提案されている[76]。カドミウムを含む重金属の解毒元素としてのSeの利用、およびカドミウム毒性に対する保護機構については、最近、[77,78]によって広範にレビューされている。両研究とも、Seはその形態にかかわらず、主に生体の抗酸化防御能力を高める能力により、カドミウム毒性に対して実質的にプラスの効果をもたらすと述べている。しかし、Seの過剰摂取(3.2~6.6mg/日)は、主に皮膚や神経症状を伴う毒性作用の可能性があることも示されている。したがって、Cd解毒療法にSeを安全に使用するには、まだ集中的な臨床試験を必要とする。
多くの科学研究機関が、様々なモデル系を用いて、カドミウム毒性に対するSeのポジティブな効果を確認している。鶏胸筋の微量元素とアミノ酸プロファイルに対するカドミウムの影響は、[79]によって分析されている。誘導結合プラズマ質量分析法(ICP-MS)により、CdCl2(150 mg/kg、90日間)暴露下では、鉛(Pb)、水銀(Hg)、アルミニウム(Al)、リチウム(Li)イオンが増加し、セレン酸ナトリウム(Na2SeO3)、鉄(Fe)、クロム(Cr)含有量が減少することがわかった。さらに、カドミウムによる必須アミノ酸の乱れとして、バリン(Val)、ロイシン(Leu)、アルギニン(Arg)、プロリン(Pro)の濃度が著しく低下した(L-8900自動アミノ酸分析装置による測定値)。これらのカドミウムによる悪影響は、Se(亜セレン酸ナトリウム0.2 mg/kg、飼料中のSeは2 mg/kg)の補給により著しく改善された。CdCl2(2.5μM、24時間)を投与した鳥類レグホン雄性肝腫(LMH)細胞は、Ca2+ホメオスタシスの著しい破壊、カドヘリン(CNX)/カレティキュリン(CRT)サイクルの変化、CdによるERストレスおよびオートファジーが細胞死を引き起こすことがわかった。Se(Na2SeO3の1.25または2.5μM)は、カルモジュリン(CaM)/カルモジュリンキナーゼIV(CaMK-IV)シグナル伝達経路の構成要素の発現を高め、結果としてカドミウムによる細胞内Ca2+不均衡を緩和することが明らかにされた。著者らは、Seを介したCa2+ホメオスタシスの調節は、Cdが誘発するオートファジーとERストレスのクロストークを減少させるため、LMH細胞をCdによる肝毒性から保護すると結論付けた[80]。2つの独立した研究において、鶏の肝臓を使用して、標準食品へのCd投与による毒性効果(それぞれ150 mg/kgのCdCl2を90日または120日)、および無機(亜セレン酸ナトリウム、Se、2 mg/kg)または有機(セレン酵母、Sey、0.5 mg/kg)のいずれかの形態のSeによる保護効果をそれぞれ調べた。Cong et al.(2019)[81]は、Cdを介したMDA、DPC(DNAおよびタンパク質架橋)、PCO(タンパク質カルボニル)含量の増加を検出したが、シトクロムCYP450、b5、グルタチオン(GSH)の含量およびアミノピリン-N-デメチラーゼ(AND)、エリスロマイシン-N-デメチラーゼ(ERND)、アニリン4水酸化酵素(AH)、NADPH-シトクロムC還元酵素(CR)の活性は、減少した。このデータは、Cdによる酸化ストレスの影響が、ニワトリのCYP450に関係していることを示している。しかし、Cdによる肝臓中毒は、亜セレン酸ナトリウム(Se)の補充によって大きく改善された。同様に、Wangら(2020)[82]の研究では、カドミウム添加により、SOD、GPx、CATの活性が低下し、MDAレベルが上昇し、肝臓壊死を引き起こし、MLKL、Rip1、RIP3、ERK、JNK、P38 mRNAの発現が増加し、caspase8発現が減少したが、SeYの補充により、カドによる変化が大幅に回復した。本研究によると、Cdは酸化ストレスの増強とMAPKシグナル伝達経路の活性化を通じて鶏肝臓のネクロプトーシスを仲介するが、SeYは酸化ストレスの低減とMAPK経路のダウンレギュレーションを通じてCdによるこの種の損傷を防止する。無機および有機形態のSe補給に関するわずかに異なる結果は、Lynchら(2017)[83]によって観察された。著者らの研究では、カドミウム中毒の48時間前にプレインキュベートした2つの有機形態のセレン、セレノメチオニン(Se-M)またはSe-酵母(SeY)、および2つの形態の無機セレン、亜セレン酸ナトリウム(Se-Ni)またはセレン酸ナトリウム(Se-Na)で細胞培養液に0.4 ppmのセルを使用。0.5,0.7,1ppmCdCl2の濃度で24時間カドミウムに曝露した後の細胞生存率とDNA損傷に対するこうした前処理の効果を、ブタの腸上皮を模倣するためにブタの血清を含む増殖培地で培養したブタの空腸上皮細胞(IPEC-J2)で評価した。EFSAガイドラインのレベルで使用した場合、両方の有機Se種は、カドミウム誘発のDNA損傷と細胞死からIPEC-J2モデル系を保護した。しかし、無機Se-NiとSe-Naは保護効果を示さず、さらに、Cdの悪影響を増強することさえあった。このことは、有機セレニウムの補給によってのみ、ブタの腸の完全性がカドミウム誘発のダメージから保護される可能性を示唆している。
Seは植物の生育にも有益であることが示されているため、トールフェスク苗を用い、Cd毒性に対するSeの影響を評価した。Cd(30mg/LのCdSO4,7日間)に曝露した植物は、葉の黄変、株高、根長の減少などの生理的な毒性症状を示した。また、MDA含量や電解質漏出(EL)が増加し、抗酸化酵素活性、光合成効率、クロロフィル、可溶性タンパク質含量は減少した。さらに、カドミウム曝露により、葉緑体Cu/Zn-SOD、細胞質Cu/Zn-SOD、GPx、アスコルビン酸過酸化酵素(APX)などの抗酸化系関連遺伝子の発現が抑制されたが、GR、光合成関連遺伝子(psbB、psbC)、ただしpsbAを含まない。Se(0.1mg/L、Na2SeO3水溶液)の投与により、クロロフィルおよび可溶性タンパク質含量、CATおよびSOD活性が増強された。また、Se添加によりELとMDA含量が減少し、psbA、psbB、psbC、Chl Cu/Zn-SOD、Cyt Cu/Zn-SOD、GPx、APXの発現量が増加した。このように、Seは抗酸化能と光合成活性の向上を通じて、トールフェスクのカドミウムによる障害を緩和した[84]。これと一致して、Auobi Amirabadら(2020)の研究[85]では、大根植物において、Se(2,4、または8 mg/LのNa2SeO3、Cd曝露6日後)がCd(5および10 mg/LのCdSO4,30日)アンタゴニストとして機能し、成長基板への適用がCd障害バイオマス獲得、強化クロロフィル生合成および必須微量栄養素の吸収を大幅に改善したことが確認された。Seはダイコン植物体内でのカドミウムの取り込みと輸送を減少させ、酵素的な抗酸化保護システムの活性化を促進した。驚くべきことに、カドミウム汚染土壌(CdCl2 0.3 mg/kg土壌、6カ月間)で栽培した小麦の葉にSe(Na2SeO4 10, 20, 40 mg/Lを耕起期、伸長期、頭頂期に3回)を葉面散布すると、光合成、組織バイオマス、抗酸化酵素活性が著しく向上し、Cd毒性を緩和するコスト効率の良い戦略として葉面散布が使えることが示された[86].
これらの研究により、カドミウムを介したストレスに対する生物の耐性を高めるために、主に有機形態のSeを補充することが強く示唆された。
3.2.2.亜鉛
亜鉛(Zn)は必須微量栄養素で、成人では約2~3gの量で体内に偏在している。Znは主に筋肉と骨(85%)、皮膚、肝臓(11%)に存在し、残りは体中の様々な組織に含まれている。生体内のZn含有量の約0.1%を毎日補充することは、細胞内Zn量の増加を司るZRT/IRT様タンパク質(ZIP)ファミリーの14メンバーと細胞内Znの減少を司る亜鉛トランスポーター(ZnT)ファミリーの10メンバーからなる30以上のZn輸送制御タンパク質によって制御されている[87]。亜鉛は、3000種類もの既知の亜鉛タンパク質が、自然免疫反応や適応免疫反応の制御、成長、組織維持、創傷治癒など、無数の生理的プロセスに関与していることから、必須元素である。Znは、転写因子NF-κB(Nuclear Factor Kappa B)を標的として生体の炎症反応を制御し、炎症性サイトカインを制御し、酸化ストレスを制御するため、生体の適切な免疫機能を維持するために不可欠である。Znの毒性はまれだが、推奨食事量(RDA)である1日15mgを大幅に超える摂取は、疲労、心窩部痛、または吐き気をもたらす貧血および好中球減少の症状を誘発することがある[88、89]。しかし、栄養失調は亜鉛の欠乏につながり、創傷治癒の障害、免疫反応の変化、皮膚の発疹など、さまざまな健康合併症を引き起こす。亜鉛の状態と健康状態の関連性は否定できない事実であるため、亜鉛の追加補給は、例えばカドミウムによる生物学的汚染のような特定の状態を防ぐのに有効だろうかもしれない[90]。多くの研究により、Znはカドミウムの毒性に対する保存元素であることが認識されている。ZnとCdは化学構造が似ているが、Znは過剰摂取しない限り、生物に有害な副作用を与えることは示されていない。しかし、Znはその構造と電荷が似ているため、Cdの細胞への取り込みを阻害する。一般に、Znによるカドミウム毒性予防のメカニズムは、2つの金属の直接競合、Zn由来のMT誘導、Znトリガーによる酸化還元ホメオスタシスという活動に要約されるかもしれない。カドミウム毒性軽減におけるZnの役割に関連する現在の知識は、最近、Yuら(2021)によってレビューされている[91]。
さまざまな細胞、動物、および植物モデル系が、Cdを介した障害に対するZn補給の効果を調べるために使用されている。SH-SY5Yカテコールアミン作動性神経芽腫細胞株で実施されたBrancaら(2018)[92]の実験は、細胞生存率の低下、酸化ストレス、および神経細胞の発芽を誘発する小胞体(ER)ストレスを引き起こすCd(10μMCdCl224時間)の有毒活性を示している。そこで、Zn(50μMZnCl2)とSe(100nM Na2SeO3)を添加したところ、Cdによる神経毒性を抑制することが確認された。別の細胞モデルでは、Madin-Darby bovine kidney (MDBK) 上皮細胞を用いて、Cd (10 または 50 μMCdCl2, 3, 6, 12, 24 h) 毒性を打ち消すZnの保護作用を実証した。Zn(10または50μMZnCl2)が、細胞によるCdの取り込み、Cdが介在するアポトーシス細胞死、ミトコンドリア損傷、および酸化ストレスを緩和する能力は、Zn補給がCdの過剰蓄積に対する家畜の保護要素であることを指定する[93]。Cd(40,80,160,320μMCdSO4,2時間)またはCd+Zn(40,80,160,320,640μMZnSO4)に曝露した酵母Saccharomyces cerevisiaeにおけるPanら(2017)[94]の遺伝子発現解析では、Cdは912遺伝子の発現変化を誘発し、Cd+Znは627遺伝子に発現変化を引き起こしたことが明らかになった。Cdストレス細胞へのZn処理により、Cdで差次的に発現する全遺伝子のうち、92.1%の遺伝子が効率よく逆転し、48.7%の遺伝子の発現が完全に逆転した。遺伝子発現の結果から、Zn処理による細胞防御の多方向メカニズムは、ZnをトリガーとしたCdによる酸化ストレスに関連する遺伝子の発現抑制、Znを介したイオン恒常性、ミトコンドリア膜電位(MMP)維持に関わる遺伝子の発現維持、Znを介したCdによる硫黄およびGSH代謝に関わる遺伝子の発現抑制にあることが判明した。さらに、ZnはCdの細胞内レベルを低下させ、Cdによるリボソームタンパク質、S含有アミノ酸、Sリッチタンパク質、抗酸化酵素の合成変化を抑制することがわかった。アミノ酸代謝、窒素代謝、酸化的リン酸化、ユビキチンを介したタンパク質分解に関わる遺伝子など、カドミウムによって変化したすべての遺伝子発現がZnの供給によって修正されたわけではないが、Znはカドミウム毒性から実質的に保護するものであることが示された。Ben Mimouna (2018)[95]による興味深い研究は、妊娠中および授乳中に飲料水にCd(50 mg/LCdCl2)、Zn(60 mg/LZnCl2)、またはZn+Cdを投与した母親からのラット子に対するCd誘導神経毒性とCd毒性に対するZnの影響について扱っている。海馬体積測定では、間接的なカドミウム曝露により、CA1、CA3錐体細胞層、歯状回の体積が有意に変化・減少することがわかった。また、スーパーオキシドディスムターゼ(SOD)活性とメタロチオネイン(MT)レベルがラット子宮で有意に上昇した。Znを併用することで、カドミウム曝露による変化がほぼ改善され、学習と記憶のプロセスに関与する重要な構造である海馬のカドミウム媒介障害に対する保護効果が強調された。
Cdは生殖毒性を有することが知られているため、淡水ガニSinopotamon henanenseおよびラット精巣の形態、生理、抗酸化パラメータに対するZnの影響およびその推定効果を解析した。カドミウム(0.05, 0.1, 0.5 mg/LCdCl2, 14日間、または1 mg/kg/dayCdCl2, 21日間 i.p. 注射)曝露により、精子数および運動率は減少し、組織学的損傷、形態学的病変、相対精巣重量(RTW)の減少、SOD、CAT、GPx活性およびMDAレベルは増加した。両実験動物モデルにおいて、Zn(それぞれ0.1および1 mg/LZnSO4または0.5および1.5 mg/kg/日ZnCl2)の投与は、主に抗酸化状態の改善によりCdによる精巣毒性を予防または逆転させた[96,97]。さらに、妊娠中、または妊娠と授乳期にCd(飲料水中50 mg/LCdCl2)、Zn(飲料水中60 mg/LZnCl2)、またはZn+Cdを投与した母親からの雄子において、Cdストレス下のラット精巣発達とZnの効果を検証した。Cdを介したZn代謝の阻害により、妊娠中の母体の低亜鉛血症は、胎児のZn欠乏を引き起こし、授乳期にはさらに顕著になった。Znの欠乏は、出生後12日目と21日目にCdの蓄積を引き起こし、その結果、異常な精細管が形成され、21日目と35日目に精巣重量と血漿中テストステロン濃度が減少する。興味深いことに、Zn処理はCd誘発精巣毒性から雄ラットをかなり保護した。これは、Cdの毒性作用が、妊娠中の母親で確立される出生前のZn代謝の破壊を介することを示唆している[98]。135世代にわたる長期的なCd曝露後に選抜されたCd(亜致死Cd濃度である44μg/gの食物)適応ビートアルミワームSpodoptera exiguaに対するZn(100,200,400μg/gの食物)の影響の解析に焦点を当てた興味深い研究がTarnawskaら(2019)によって行われた[99]。L4およびL5ステージの期間、細胞DNA損傷、生化学パラメータ(ADP/ATP比、ATPおよびHSP70濃度)で表される生活史形質が決定された。Znを添加した幼虫の分析結果は、Zn無処理の昆虫群と比較して、幼虫のステージが有意に延長され、細胞および生化学的指標が修正されたように見えた。本研究の著者らは、Znの供給がカドミウム中毒に対するSpodoptera exiguaの保護に寄与していると考えているが、しかし、成長速度は犠牲になっている。
Cdの毒性を軽減する目的で、Znを葉上または土壌に外因的に適用することも、Cdの植物への悪影響を軽減するために使用されてきた。Znは、主に抗酸化能の向上と、植物の成長、光合成の増加につながるCd輸送の制御によってCd毒性を緩和する(Rizwanら(2019)[100]によるレビュー)。カドミウムで自然汚染された炭鉱に近い場所の土壌2.5kgを入れたポットに植えた植物にZn処理(0.2%ZnSO4の葉面散布、または41.2mg/kgZnSO4を添加した土壌)を行うと、小麦の流入トランスポーター遺伝子TaNramp5を有意にダウンレギュレート、排出トランスポーターTaTM20とTaHMA3は上昇し、カドの蓄積が抑制されると報告されている。さらに、葉面散布により葉のTaHMA2の発現が低下し、根から芽へのカドミウムの移行が減少することがわかった。土壌へのZn施用は、根のTaLCT1遺伝子の発現を低下させ、根のカドミウム濃度を低下させる。さらに、このことは、穀物中のカドミウムを効率的に減少させることにつながり、食と収穫の安全性を同時に確保することになる[101]。
食品や医薬品にナノ粒子を広く使用することは現代の征服であるため、Sharifan et al.(2020)[102]は、葉緑種のホウレンソウ(Spinaciae oleracea)、パセリ(Petroselinum sativum)、コリアンダー(Coriandrum sativum)における重金属毒性(CdSO4 1 mg/LとPb(NO3)2100 mg/Lの組み合わせ、2 週間)に対するナノ酸化亜鉛(純水中 100 mg/L)の影響を調査しており、Hejazy et al.(2017)[103]は、ラットのCd誘発毒性(飲料水中のCdCl2 2.5-5 mg/kg b.w. 28日間)に対する金属Zn(飲料水中のZnCl2 10 mg/kg b.w. 28日間)、およびナノ亜鉛粒子(3,10,100 mg/kg b.w. 1日のガベージで)影響を解析した。ナノ酸化亜鉛粒子は、新芽の銅と鉄の含有量を増加させ、その結果、根によるカドミウムの吸収を制限し、分析した3種の葉菜類をカドミウム毒性から保護した。
驚くべきことに、ラットでは、金属Znがカドミウム毒性から保護するという明確な証拠があるにもかかわらず、ナノZn粒子(15,20,30 nm)はカドミウム中毒からの保護に適していない。ナノZn粒子を投与した動物の血液分析では、ヘマトクリット(HCT)が有意に増加し、血液凝固時間が有意に減少した。さらに、AST、ALT、トリグリセリド、総コレステロール、LDL、遊離脂肪酸は、ラットのコントロールグループと比較して、Cd-およびナノ亜鉛添加後に顕著に増加したが、金属ZnはCdによる生体毒性を緩和させる。このことは、ナノ亜鉛はカドミウム障害から植物を保護するために使用される可能性がある一方、金属亜鉛は動物やおそらく人間の保護にも適していることを示唆している。
3.2.3.カルシウム
成長および発達、細胞分裂、細胞質の流れ、および細胞内シグナル伝達を含む様々な生理学的プロセスに関与する必須多量栄養素としてのカルシウム(Ca)は、Cdとの化学的類似性により、Cdストレスから生物を保護するための外因性添加物として使用可能である。植物におけるカドミウムストレス除去のためのCa補給の使用は、Huangら(2017)[104]によって広範囲にレビューされており、Caレベルが上昇した植物がカドミウム由来の変化に対する改善された耐性を有するという証拠を提供している。カドミウムの毒性は、さまざまな植物種で広く研究されている。Farzadfar ら(2013)の研究では、0,120,180 μMCdCl2ストレス条件下で、2 週間水耕栽培したMatricaria chamomillaL.の苗を0,0.1,1、5 mMCaCl2で処理した[105]。Caの添加は、Cdによる植物のMDA含量の増加、抗酸化酵素活性の低下、活性酸素の蓄積を有意に改善した。さらに、Caはバイオマスの蓄積をもたらす成長パラメータの上昇を助け、Cdイオンの流入を減少させた。Liら(2016)の研究[106]では、Cd(50μMのCdCl2,5日間)に曝露したシロイヌナズナの苗は、H2O2含量の増加および脂質の過酸化によって決定される酸化ストレスの増加を示した。さらに、オーキシンの分布とレベルが変化し、主根(PR)の長さが減少し、側根(LR)数が増加した。Ca(3mMのCaCl2,5日間)の投与は、酸化ストレスを軽減するだけでなく、オーキシンの恒常性を回復させ、カドミウムによる根の成長阻害を緩和することがわかった。カドミウムによる土壌汚染は、植物生産だけでなく、人間の健康にも大きなリスクをもたらす。2つの独立した研究により、Ca(2.5および5 mg/kgのCaCl2土壌、または0.05,0. 5、ad 5 mM Ca(NO3)2、基底塩培地(BMS)バックグラウンド溶液のいずれかで、3日間、または耕種期または熟成期のいずれかにおいて、cd(50および100 mg/kg土壌のCdCl2、またはBMSのバックグラウンドで50μM Cd(NO3)2)に対して、それぞれ、 Cd(CdCl2、50μMCd(NO3)2、50および100mg/kg土壌、Cd汚染土壌の背景)、摂取および移動、Cd-Mediated Oxidative damage、Cd-cointerで栽培したイネの収量および関連成分の調節において。の影響を調べた[107,108].カドミウム汚染土壌に5 mMのCaを添加すると、OsNRAMP1およびOsNRAMP5トランスポーター遺伝子のダウンレギュレーションが起こり、根からのカドミウムの取り込みが著しく減少したが、OsHMA2トランスポーター遺伝子のアップレギュレーションおよび重金属ATPaseのOsHMA3ダウンレギュレーションは根から芽へのカドミウム転流を増加した。Caを介した地上部のカドミウム含有量の増加にもかかわらず、カドミウム代謝におけるCaのこの両刃の役割は、最終的にイネ粒子中のカドミウム含有量を減少させる結果となった[107]。さらに、Ca処理(2.5および5.0 mg/kg土壌)は、Cd由来の酸化ストレスを緩和し、酵素的抗酸化物質(SOD、POD、CAT)の活性を高め、カロテノイドおよび光合成色素の数を増やし、イネのプロリン、水溶性タンパク質、水溶性糖含量を改善し、全体として羽片数、羽片あたり穂片、種子着生率、1000粒重、穀物収穫量の増加からなる収量を増やすことになった。さらに、根、茎、葉、穀物におけるカドミウムの蓄積は、Ca添加により有意に減少した。このことは、Ca添加が低カドミウム米穀の生産とカドミウム汚染土壌で育った作物のカドミウムの毒性効果を改善する可能性を示唆している[108].
ひよこ豆(Cicer arietinumL.)の種子を200μMCdCl2に6日間曝露し、100mMCaCl2または100μM EGTA(ethylene glycol tetraacetic acid)のいずれかと同時に処理した魅力的な実験が行われた。この処理により、Cdで還元されたチオレドキシン(Trx)およびチオレドキシン還元酵素(NTR)活性が2.75倍および1.75倍に増加し、H2O2量が減少し、フェリドキシン(Fdx)活性がコントロールレベルまで変調した。さらに、Ca/EGTAの添加は、Cu/Zn-SODの遺伝子発現と活性に対するカドミウムの有害な影響を打ち消し、CATとAPXの活性を刺激して、カドミウム汚染から植物を保護した[109].また、地衣類のHypogymnia physodesでは、カドミウム毒性(10および100μMのCdCl2曝露)に対するCa(100および1000μMのCaCl2,24時間)の保護効果が検出され、Ca由来のカド蓄積抑制、ROS生成および脂質過酸化の減少、チオール、グルタチオンおよびアスコルビン酸レベルの正常化によって確認されている。この結果は、地衣類におけるカドミウム曝露下でのCaの改善反応は、植物におけるその効果に匹敵することを示している[110]。植物や地衣類以外にも、単細胞微生物である酵母Saccharomyces cerevisiae[111]や海洋細菌Bacillussp. 98[112]でCaによるカドミウム毒性防御が実験的に証明されていることは特筆すべきことである。カドミウム(50, 100, 200, 500 μMCd2+、最大60分、または2-3日、実験セットアップによる)にさらされたS. cerevisiae細胞は、Yvc1pチャネルを通して液胞から放出される細胞質Caが劇的に増加し、これが、Cch1p / Mid1pチャネルを介して細胞に到達した外部Ca(10 mMCa2+)とともにカドミウムストレスへの細胞適応を媒介して反応した[108].Ca(5,10,15,20,25,30mM Ca2+)を添加した細菌細胞は、NO合成酵素の発現低下とNOジオキシゲナーゼの発現促進により、Cd(0.2, 0.4, 0.6, 0.8, 1, 1.5, 4mMCd2+)誘発の細胞内NO過剰産出を抑制した。さらに、カドミウム汚染環境における細菌の自己防御機構として、余分なCaの存在により、鉄の取り込みに関連するタンパク質の発現が増加し、鉄の獲得が促進されることが知られている[112].
さらに、水系または食餌のCa(CaCl2 30および60 mg/g食、またはCaCO3 20および60 mg/kg食、または0.2 mM低Ca2+および0.8 mM高Ca2+淡水濃度)による保護作用が確認された。8mM高Ca2+淡水濃度、それぞれ)、Cd(急性水系曝露として50μg/LのCd(NO3)2を7日間、または3μg/L水系および500mg/kg食Cd(NO3)2を28日間、または環境Cd2+10μg/L人工淡水および食Cd2+10μg/魚/日2,4、14,35日)、水生モデル動物であるニジマス(Oncorhynchus mykiss)またはモザンビークティラピア(Oreochromis mossambicus)の幼魚で毒性が検出され、飼料Caの効果がより顕著に示された。Ca添加飼料は、水中でのCaおよびCdの摂取量を短期的に50%以上減少させ、その結果、対象組織でのCdの慢性蓄積を有意に減少させることから、CaおよびCd摂取の輸送メカニズムは、鰓および腸での共通の経路を使用していることが示唆された。さらに、Caの補給は、Cdによって引き起こされるStanniusのコーポラスの構造と形態および骨組織の損傷を保護した[113、114、115]。
カドミウムストレスに対するCaの効果については、哺乳類を対象とした研究でも確認されている。Cd(0.5mg/kg体重のCdCl2,10日間)を経口または非経口で曝露し、Ca添加乳(1%、3%、6%のCaHPO4)を与えたラットの子から得た肝臓、腎臓、脳、屠体(内臓と皮膚を含む体)組織について原子吸光分析による元素分析を行った。カルシウムの補給は、経口投与で上昇したカドミウム含有量を減少させることができたが、必須元素のレベルは影響を受けなかった。しかし、この分析で設計されたCaの供給は、非経口投与されたカドミウムの結果に影響を与えるには十分ではなかった。これは、哺乳期には、Ca過剰が組織中の微量元素含有量に影響を与えずに経口曝露したカドミウムの吸収と保持を減らすのに役立つかもしれないことを示唆している[116]。さらに、Cd(1,5、50 mg CdCl2/kg食、90日間)に曝露した若い雌ラットを用いて、Ca補充(0.4%Ca2+)によるCd媒介骨損傷の軽減能力を分析した。Cdが介在する骨形成および骨質障害は、Caの補給により有意に回復した。Caの供給により、骨のバイオメカニクス、血清中の骨形成マーカーレベル、骨形成遺伝子マーカーの発現が増加し、血清Klothoレベル、線維芽細胞増殖因子23/Klotho関連遺伝子発現、骨の微細構造損傷が減少した[117]。さらに、Ca(CaCO3 100 mg/kgを週5回経口投与)の単独またはビタミンD(600 UI/kgを週3回)との併用投与、およびカルシメティック化合物NPS R-467(10 μMを尾静脈注射)の使用は、それぞれラットのCd誘発肝毒性とマウスの腎毒性を緩和する。CdCl2(飲料水中44mg/L、4週間)に暴露された肝組織は、MDA、H2O2、タンパク質カルボニルなどのプロオキシダントが著しく上昇した。また、インターロイキン(IL)1β、IL-6、IL17A、腫瘍壊死因子-αなどの炎症性サイトカインが増加し、抗炎症性のIL-10、IL-22マーカーや抗酸化物質のGSH、GPx、CAT活性が減少した。さらに、カドミウム曝露は、ラット肝臓において、低ビタミンD、肝組織のCa濃度の低下、Ca結合タンパク質(CAM/CAMKIIA/S100A1/S100B)、貯蔵作動型(RyR1/ITPR1)チャネル、ビタミンD代謝酵素(Cyp2R1/CP27a1/CYP24a1)の発現変化を引き起こした[118].同様に、カドミウムに曝露したマウス(10,100,1000ppmのCdCl2を28日間食餌投与)では、糸球体の萎縮、腎近位尿細管障害、MDA値の上昇、尿蛋白量の増加、腎障害分子1(KIM-1)の発現上昇といった腎臓障害が認められた。さらに、カドミウムの長期暴露は、腎臓のアポトーシスと損傷を誘発するオートファジーのフラックスの阻害を引き起こした[119]。CaとビタミンDの併用は、血清や組織中のCd含有量を大きく減少させ、肝臓の炎症や酸化マーカーは、ビタミンDとCaの併用がCdによる肝障害から生物を実質的に保護することを示唆している。また、NPS R-467を用いたCaSRの活性化により、カドミウムで阻害されたオートファジーが活性化し、腎臓のアポトーシスとダメージが軽減されることが明らかになった。したがって、カルシメティック化合物NPS R-467とCa/ビタミンD治療は、カドミウムによる腎毒性および肝毒性を予防する適切な戦略であり、ひいてはカドミウムに由来する慢性腎臓病または肝臓病の治療に役立つかもしれない[118, 119].
3.2.4.ケイ素、マグネシウム、マンガン
また、カドミウム毒性に対するケイ素(Si)、マグネシウム(Mg)、マンガン(Mn)の影響も調査している。
水耕栽培されたラミーBoehmeria nivea(L.)Gaudにおいて,Si (1 mM/L ofNa2SiO3) および Se (1 μM/LNa2SeO3) 添加によるCdCl2 (5 mg/L, 7 days) 誘発毒性の軽減を検討した。その結果、SeだけでなくSiの添加により、植物中のCdの含有量および根から地上部への移動が減少した。さらに、SOD、グアイアコールペルオキシダーゼ(POD)、APXなどの抗酸化酵素活性を刺激し、ラミー葉の総ROS、MDA、H2O2含量を減少させた。さらに、SiとSeの単独または組み合わせは、グルタチオン、アスコルビン酸、ビタミンEなどの非酵素的抗酸化物質の含有量を増加させることにより、植物をカドミウムストレスから保護した[120]。著者ら[121] は、5,10,20 mg/Lの濃度のSi および Se ナノ粒子(NP)を単独または組み合わせて使用することで、イネ(Oryza sativaL. )のカドミウム毒性を緩和する可能性について調査した研究で同様の結論に達した。本研究の著者らは、リン酸肥料の過剰使用により重金属で汚染された土壌にイネを植え、土壌には0.84 mg/kgのCd2+イオンが含まれていた。彼らは、SiとSe-Npsの葉面散布は玄米中のCdとフィチン酸の含有量を減らし、米粒の栄養品質を向上させると結論付けた。興味深いことに、水耕栽培で培養したPhytolacca acinosaRoxbに対するCd毒性も、マンガン(0.5, 1, 1.5, 2, 2.5, 3, 5, 6, 10, 12 mMMn2+)処理によって著しく減少し、マンガンとカドミウムのモル比によって大きく制御されている。P. acinosaの苗におけるCd(50, 100, 200 μMのCd2+に17日間曝露)毒性に対する防御は、溶液Mn/Cdモル比(SMCR)が低レベル(例えば、0および10)の場合、新芽におけるMn分布上昇によって確保され、SMCRが高レベル(例えば、50および60)では、脂質過酸化および植物水分損失の著しい減少、植物におけるMnとCd間の対立から生じる光合成増加を通じて植物防御が行われる[122].さらに、Mnはその抗酸化作用により、マウス組織における急性カドミウム(7 mg/kg b.w.CdCl2のs.c.注射の単回投与)中毒を予防することが報告されている。マンガン(カドミウム曝露24時間前に20 mg/kg b.w.MgCl2を単回投与)投与は、カドミウムによるGSH-Px活性およびLP(脂質過酸化)、カドミウムによるGSH枯渇を防ぎ、CAT活性を著しく低下させた。さらに、Cd処理マウスにMnを補充すると、腎臓と精巣のCd含有量が著しく減少したが、肝臓のCd含有量は、個々の臓器で多様なメタロチオネインが誘導された結果、増加した。マンガンを介したカドミウム毒性に対する保護は、カドミウム由来のCaホメオスタシスの変化を制限する能力にも依存する[123]。さらに、Mn(2,4、8,16,32,64μMMnCl2)補給によるカドミウム摂取量の減少(0.5~2μMCdCl2への24時間の細胞暴露)と、カドミウムによって促進される持続的ERK活性の阻害が異なる細胞タイプでMartinら(2006)によって示されている[124]。報告された結果は、Mnがカドミウム毒性に対する効果的な競合物質として考慮される可能性を示している。
さらに、動物モデル系を用いた実験により、カドミウムストレスに対するマグネシウム(Mg)の保護作用が明らかになった。カドミウムに暴露されたラットの血漿を分析したところ、動物の酸化状態に劇的な変化が見られた。Cdの単回投与(それぞれ30 mg/kg/w.の胃管投与または1.5 mg/kg/w.のCdCl2注射)による経口または腹腔内の悪影響は、SOD活性の低下、スーパーオキシドアニオン量の増加、総酸化状態の影響、高度酸化タンパク質生成物の上昇、MDA含量の増加によって表わされた。ラットにMgを経口または腹腔内投与(CdCl2処理の1時間前または10分前にそれぞれ50 mg/kg b.w. または3 mg/kg b.w. of Mg(CH3COO)2)すると、Cdによる検査パラメータの変化を大幅に防止した[125].これと一致して、1 mg/kgCdCl2と0.5 または 1.5 mg/kgMgCl2をi.p. 注射で、21日間投与したラットは、Cdによる腎毒性から保護された。マグネシウム処理は、Cdが誘発する腎臓の損傷を逆転させ、Cdは腎臓のMDA量と血清のナトリウム、カリウム、尿素レベルを増強し、Cdはクレアチニン、およびタンパク質レベルを減少させた[126]。さらに、[127]は、単離灌流ラット肝臓(IPRL)モデルシステムを用いて、カドミウム誘発性肝毒性に対するMgのプラスの影響を確認した。Cd(15μMのCdCl2,30分、60分、90分)の肝臓曝露は、IPRLモデルのグルタチオンレベルを低下させ、MDA含量とアミノトランスフェラーゼ活性を増強したが、Mg(MgSO4 1.2 mM)の共処理はCdの毒性を低下させた。したがって、これらの結果は、Mgの補給がカドミウムの毒性に対して保護効果を持つ可能性があることを示す証拠となる。
試験系に対するカドミウムの毒性作用とミネラル元素の補給による軽減を表2にまとめた。
表2 ミネラル元素の効果
| 物質名 | モデル | 物質の投与量 | Cdの投与量 | Cd曝露による有害反応と物質による治療効果 | レフ。 |
|---|---|---|---|---|---|
| セレン | チキン | 飼料中のSeを2 mg kg-1または0.5 mg kg-1にする。 | 150mgkg-1を90日または 120日間投与 | イオノーム変化、アミノ酸含有プロファイル、MDA、DNA・タンパク質架橋、タンパク質カルボニル量、CYP450、b5、GSH、AND、ERND、AH、シトクロムC還元酵素、CAT、SOD、GPX、カスペース8、MAPKシグナル伝達経路 | Qu et al., 2020年[79]、Cong et al., 2019年[81]、Wang et al., 2020年[82]。 |
| 鳥類レグホン雄肝細胞 | 1.25 または 2.5 μM | 2.5 μM(等量)、24時間投与 | Ca2+ホメオスタシス、カルモジュリン、カドヘリン/カレティキュリンサイクルの変化、ERストレス、オートファジーによる細胞死への誘導 | Zhang et al., 2020年【80】。 | |
| 豚空腸上皮細胞 | 細胞培養液に0.4ppmを24時間浸透させる。 | 0.5-1 ppmを24時間、媒体中に存在させる。 | 細胞生存率、DNA損傷、細胞死 | リンチ et al., 2017年[83]。 | |
| きぬさや | 0.1 mgL-1水に溶かす | 30 mgL-1,7日間 | 草丈、根長、MDA含量、電解質漏出、抗酸化酵素活性、光合成効率、クロロフィル、水溶性タンパク質含量 | Li et al., 2020年【84】。 | |
| ラファヌスサティヴスL | 2-8 mgL-1,30日間 | 5-10 mgL-1,30日間 | カドミウム吸収量、クロロフィル生合成、微量栄養素含有量、酵素的抗酸化防御系 | アウオビ・アミラバード et al., 2020年【85】。 | |
| Triticum aestivumL. | 10-40 mgL-1(葉面散布、6カ月間)。 | 0.3 mgkg-1土 | 光合成、植物バイオマス生産、抗酸化酵素活性 | 呉 et al., 2020年【86】。 | |
| 亜鉛 | SH-SY5Yカテコールアミン作動性神経芽球腫細胞 | 50 μM(24時間均等投与) | 10 μM(24時間等量投与) | カドミウムによる神経毒性を抑制する。 | ブランカ他、2018年[92件]。 |
| MDBK上皮細胞 | 10および50μM(24時間等量投与) | 10および50μM(24時間等量投与) | カドミウムの取り込み、カドミウムを介したアポトーシス細胞死、ミトコンドリア損傷、酸化的ストレス | Zhang et al., 2014年[93]。 | |
| サッカロミセスセレビシエ | 40-640 μM (2時間等量) | 40-320 μM(2時間均等投与) | 遺伝子発現交代、イオノームの恒常性とミトコンドリア膜電位、硫黄とGSH代謝、リボソームタンパク質、S含有アミノ酸、Sリッチタンパク質と抗酸化酵素 | パン et al., 2017年【94】。 | |
| ラッツ | 妊娠中および授乳期の飲料水に60 mgL-1を含有する。 | 飲料水中50 mgL-1 | 海馬体積、CA1、CA3錐体細胞層および歯状回、SOD、メタロチオネイン量、出生前Zn代謝量 | ミモウナ et al., 2018年[95]、チェメック et al., 2016年[98]。 | |
| 胤舜 | 0.1-1 mgL-1,14日間 | 0.05-0.5 mgL-1,14日間 | 精子数および運動率、組織学的損傷、形態学的病変、相対精巣重量、SOD、CATおよびGPx活性、MDA | Liu et al., 2020年[96]、Babaknejad et al., 2018年[97]。 | |
| 翅斑病 | 100~400μgg・g-1の餌を135世代に渡って与える。 | 135世代に渡って44μg g-1の餌を与え続ける | DNA損傷、ADP/ATP比、ATPとHSP70の濃度、成長率 | タルナフスカ et al., 2019年【99】。 | |
| Triticum aestivumL. | 0.2% 葉面散布、または 41.2mgkg-1土壌 | 天然水 | 流入トランスポーター遺伝子TaNramp5、流出トランスポーターTaTM20およびTaHMA3、葉TaHMA2、根TaLCT1遺伝子 | Zhou et al., 2020年【101】。 | |
| ホウレンソウ | 100mgL-1水 2週間 | 1 mgL-1水 2週間 | CuおよびFeの含有量 | シャリファン et al., 2020年【102】。 | |
| 茴香(ういきょう | 100mgL-1水 2週間 | 1 mgL-1水 2週間 | CuおよびFeの含有量 | シャリファン et al., 2020年【102】。 | |
| セイヨウキズタ | 100mgL-1水 2週間 | 1 mgL-1水 2週間 | CuおよびFeの含有量 | シャリファン et al., 2020年【102】。 | |
| マトリカリア・カモミラL. | 水耕栽培の溶液に0.1-5mMを2週間放置 | 120および180μMを水耕栽培液で2週間培養 | 活性酸素蓄積量、MDA、抗酸化酵素、カドミウム流入量減少、バイオマス蓄積量 | ファルザドファル他、2013年【105】。 | |
| シロイヌナズナL. | 3 mM (5日間苗の暴露) | 50 μM (5日間苗晒し) | 酸化ストレス、細胞内H2O2量、脂質過酸化、オーキシン量と分布、根の長さ | Li et al., 2016年[106]。 | |
| オリザサティバL. | 2.5 および 5 mgkg-1土壌(3日間)、および BMS 溶液 0.05-5 mM(成熟期まで)。 | 50および100 mgkg-1土壌(3日間)、BMS溶液で50μM(熟成期まで)。 | カドミウム摂取量、酸化ストレス、SOD、CATおよびPOD活性、光合成、カロテノイド、プロリンおよびタンパク質含量、穀物収量および収量成分、OsNRAMP1およびOsNRAMP5、OsHMA2、OsHMA3トランスポーター遺伝子 | Zhang et al., 2020年[107]、Kanu et al., 2019年[108]。 | |
| カルシウム | Cicer arietinumL. | 100mM(種子暴露6日間) | 200 μM(種子暴露6日間) | 酸化ストレス、チオレドキシンおよびチオレドキシンレダクターゼ活性、SOD、CAT、APX | サコウヒ他、2021年[109]。 |
| ヒポギムニアフィソデス(L.)Nyl. | 100および1000μMを水に溶かして24時間放置 | 10および100μMを水に溶かして24時間放置 | 活性酸素とMDA、チオール、グルタチオン、アスコルビン酸のレベル | コヴァーチク et al., 2020年[110]。 | |
| Saccharomyces cerevisiaeL. | 10 mM(培養液中、60分または2~3日間) | 50-500 μM(培養液中、60分または2-3日間) | 液胞からのCa放出、Yvc1pトランスポーター、Cch1p/Mid1pチャネル | ルタ et al., 2014年[111]。 | |
| バチルス属 98 | 5~30mM(培養液中) | 0.2-4 mM (培養液中) | 細胞内NO産生、NO合成酵素、NOジオキシゲナーゼ、Fe取り込み | 呉 et al., 2021年【112】。 | |
| アイヌラックル | 30および60mg g-1食品、または20-60mgkg-1食事中 | 水中50μgL-1を7日間、または水中3μgL-1、または飼料500mgkg-1を28日間。 | カドミウム取り込み、カドミウム輸送、モルフォロジー | Baldisserotto et al., 2004年[113]、Franklin et al., 2005年[114]。 | |
| オレオクロミスモザンビカス | 0.2-0.8 mMの淡水濃度 | 10 μgL-1淡水、または1匹あたり10μgを35日間投与 | カドミウム輸送、鰓と腸でのカドミウム蓄積、形態 | プラタップ&ウェンデラー ボンガ 2007年[115件] | |
| ラット | 牛乳に1~6%配合 または0.4%溶液 または100mgkg-1を経口投与した。 |
0.5 mgkg-1b.w.を10日間投与する。 1~50mgkg-1食を90日間摂取。 または44 mgL-1を飲料水に4週間添加した。 |
カドミウム含有量、イオノーム、骨形成、骨形成遺伝子マーカー発現、線維芽細胞増殖因子23/Klotho関連遺伝子発現 カドミウムによる肝障害、MDA、H2O2、プロテインカルボニル、インターロイキン(IL)1β、IL-6、IL17A、腫瘍壊死因子-α、抗炎症IL-10、IL-22マーカー、GSH、GPx、CAT活性 |
Sarić et al., 2002年[116]、Huang et al., 2019年[117]、El-Boshy et al., 2020年[118]。 | |
| マウス | 100 mgkg-1食 | 10~1000ppmを28日間飼料に配合 | カドミウム誘発性腎毒性、糸球体萎縮、腎近位尿細管障害、MDA、尿蛋白、KIM-1、アポトーシ | グー et al., 2020年【119】。 | |
| ケイ素 | 縞瑪瑙 | ハイドロフォニック溶液で1mMを7日間放置 | 5 mgL-1を7日間ハイドロフォニック溶液に浸漬した。 | カドミウムトランスレーション、SOD、CAT、POD、APX、ROS、MDA、H2O2、グルタチオン、アスコルビン酸塩、ビタミンE | タン et al., 2015年[120]。 |
| オリザサティバL. | 5-20 mgL-1葉面散布 | 0.84 mgkg-1土 | Cd含有量、フィチン酸 | Hussain et al., 2020年【121】。 | |
| マンガン | ホトケノザ | 0.5~12mMをハイドロフォニック溶液で17日間放置 | ハイドロフォニック溶液で50~200μMを17日間投与 | Mn/Cd比、脂質過酸化と植物の水分損失、光合成の関係 | Liu et al., 2013年【122】。 |
| マウス | 20 mgkg-1b.w.単回 i.p.injection. | 7 mgkg-1b.w.単回s.c.注射。 | カドミウム含有量、GSH-Px活性、脂質過酸化、GSH、CAT | Eybl and Kotyzová 2010[123] (アイブルアンドコチゾヴァー 2010)。 | |
| マグネシウム | ラット血漿 | カドミウム曝露の10分前または1時間前に3および50 mgkg-1b.w. i.p.または経口曝露。 | 30 mgkg-1b.w.を胃管より単回投与する。 または1.5mgkg-1b.w.を単回i.p.注射する。 |
SOD活性、スーパーオキシドアニオン、総酸化状態、MDA、酸化タンパク質量 | ブハ et al., 2012年[125]。 |
| ラット | 0.5 または 1.5 mgkg-1b.w. i.p. 注射 21日間 | 1 mgkg-1b.w.のi.p. 注射を21日間行う。 | Cdによる腎毒性、MDA、血清ナトリウム、カリウム、尿素値、クレアチニン、蛋白質値 | ババクネジャド他、2016年【126件 | |
| 単離灌流ラット肝モデルシステム | 1.2 mM 90分 | 15 μM 90分 | グルタチオン量、MDA量の増加、アミノトランスフェラーゼ活性の向上 | Ghaffarian-Bahraman et al., 2014年[127]。 |
3.3.生理活性物質
3.3.1.ポリフェノール、フェノール類、フェノール酸類
フェノール化合物は、植物由来の二次代謝産物であり、その優れた抗酸化作用が知られている。フェノール化合物のヒト生体内での役割と代謝については、現在も熱心に研究されている。フェノール化合物は、非常に多様な化学構造を持ち、糖類や有機酸を含む化合物と遊離または結合した形で存在することが特徴である。一般に、フェノール化合物は、その構造に従って3つの主要なサブグループに分けることができる:(i)フェニルカルボン酸-安息香酸の誘導体、例えば、プロトカテク酸や没食子酸;(ii)フェニルプロペン酸-桂皮酸の誘導体、例えば、フェルラ酸、バニル酸やカフェ酸;(iii)最も知られていて豊富なフラボノイド群[128].
フラボノイド
フラボノイドは、植物由来の食品に多く含まれ、カドミウム由来のストレスに対する保護物質として提案されている。フラボノイドは、その化学構造により、フラバノン、フラボン、フラボノール、フラバン-3-オール、アントシアニン、イソフラボンのサブグループに分けられる。フラボノイドのカドミウム毒性軽減の主なメカニズムは、生体の抗酸化力の向上、イオノームバランスの維持につながるカドミウム隔離、カドミウムによる損傷からDNAを保護する能力によって示唆されている。さらに、フラボノイドは、炎症を抑制し、糖代謝を積極的に制御し、生殖ホルモンの分泌を促進することができる[129]。
ここでは、カドミウムによる障害を識別するために記述されたいくつかのフラボノイドを紹介する。
ルチン水和物
Obohら(2019)[130]とAbdel-Aleemら(2018)[131]は(2018)[131]は、フラボノール配糖体ルチン水和物(IUPAC名)の役割を調査した:2-(3,4-dihydroxyphenyl)-5,7-dihydroxy-3-[(2S,3R,4S,5S,6R)-3,4,5-trihydroxy-6-[[(2R,3R,4R,5R,6S)-3,4,5-trihydroxy-6-methyloxan-2-yl]oxymethyl]oxan-2-yl]oxychromen-4-one;の水和物)は、ラットのカドミウム誘発神経毒性および認知障害に対して、植物性食品に一般的に見られる。ラットの実験グループは、5mg/kgのCdCl2に加えて、25および50、または100mg/kgのルチンをそれぞれ14日間または30日間経口投与された。ルチンは、カドミウムストレスと残留カドミウムイオンの減少をもたらす強い抗酸化作用とは別に、ERK1/2とJNKアポトーシス経路の制限、およびラット脳におけるPTEN由来のmTOR生存経路活性化の抑制によってカドミウムによる認知機能障害を緩和した。さらに、ルチンの投与により、エクトヌクレオチダーゼ、アデノシンデアミナーゼ(ADA)、MAO活性が低下し、チオールレベルが上昇した。このように、ルチンは、カドミウムによって変化したプリン作動性およびモノアミン作動性調節酵素の活性を改善することにより、カドミウムによる脳損傷および記憶機能障害を回復させることができることがわかった。
クリシン
クリシン(IUPAC名:5,7-dihydroxy-2-phenylchromen-4-one)は、蜂産品に含まれるフラボノイドで、強い抗酸化作用、抗炎症作用、肝保護作用を持つことが示されており、その治療作用から食品として考慮することができる。Beyramiら(2020)[132]の研究では、著者らは2.5および5 mg/kg体重のナノリポソーム担持クリシン(NLC)を使用して、マウスにおけるカドミウム(連続30日間毎日飲料水に2 mg/kg b.w.Cd2+)毒性に対する保護作用の可能性について調べた。カドミウムによる肝ストレス、肝酵素の増強、空腸の形態変化、食物摂取量の変化は、NCLの補給によって回復した。したがって、NCLは、カドミウムが介在するマウスの変化を除去するための食品添加物として提案することができる。
ジオスミン
ジオスミン(IUPAC名:5-hydroxy-2-(3-hydroxy-4-methoxyphenyl)-7-[(2S,3R,4S,5S,6R)-3,4,5-trihydroxy-6-[[(2R,3R,4R,5R,6S)-3,4,5-trihydroxy-6-methyloxan-2-yl]oxymethyl]oxan-2-yl]oxychromen-4-one) 主にクエン類の果皮中に見いだすフラボノイドである、ジオスミンは、強力な抗酸化物質であり、抗腫瘍、抗炎症、抗高血糖、抗高脂血症、抗高血圧、抗変異原性などの特性を有している。クリシンと同様に、ジオスミン(100 mg/kg b.w. 経口投与)は、CdCl2を200 ppmの用量で30日間飲水曝露したラットにおいて、Cdによる肝障害に対して保護反応を示した。Cdによって変化した肝酵素レベルおよび活性、抗酸化パラメータ、組織学的パラメータ、体重は、ジオスミン(100 mg/kg/bw)の補給を受けた動物で顕著に回復した[133]。
ケルセチン
ケルセチン(IUPAC名:2-(3,4-dihydroxyphenyl) -3,5,7-trihydroxychromen-4-one) およびその誘導体は、ハーブ、野菜、果物などに広く含まれるフラボノイドである。ケルセチンは、抗酸化作用、抗炎症作用、免疫調節作用など、さまざまな生理活性を示すことが報告されている。フリーラジカルを消去する強力な抗酸化物質として、がん、糖尿病性腎症、腎線維症の予防に効果が期待されている。カドミウム毒性に対するケルセチンの保護作用が研究されている。カドミウム(0.4 mg/kg b.w.CdCl2)をマウスに3日間腹腔内注射すると、腎臓で特徴的なオートファゴソーム形成が起こり、LC3-II/β-アクチン比が上昇し、活性酸素レベル、MDA含量を劇的に増加させ、総抗酸化能は低下した。マウス腎臓におけるCd誘発酸化ストレスによるオートファジーは、5〜100 mg/kgb.w.の濃度のケルセチンによって著しく回復し、25 mg/kgb.w.のケルセチンで最も大きな効果があった[134]。同様に、カドミウム(2 mg/kg b.w.CdCl2,4週間)を腹腔内投与したラットでは、体重および精巣相対重量の減少、精巣の病理学的変化がみられた。カドミウムによる酸化ストレスに加え、カドミウム曝露により、オートファジーを示すP62とLC3-IIのタンパク質発現レベルが上昇した。逆に、ケルセチン(50 mg/kg b.w.)の経口投与は、酸化ストレスを軽減し、オートファジーを抑制することでカドミウム毒性を緩和した[135].驚くべきことに、2.5 μM Cd(CH3COO)2に12時間暴露したラット近位尿細管一次細胞は、オートファジーのフラックスが損なわれ、リソソーム分解能が低下していた。ケルセチン(1μg/mL)投与により、オートファジーのマーカータンパク質のレベルが低下し、TFEB依存的にリソソーム機能が回復した。これは、mTORC1阻害剤として知られるケルセチンが、TFEB活性を促進することでオートファジーを促進したためだ。さらに、v-ATPases阻害によるCd誘導リソソームアルカリ化は、ケルセチン処理により有意に回復した[136]。別の研究では、メタボロミクス手法を利用して、カドミウム(4.89 mg/kg b.w.CdCl2、飲料水、12週間)毒性に対するケルセチン(10および50 mg/kg b.w. 経口投与)のラット腎臓の保護作用を検討した。メタボロミクスと腎臓の病理組織検査により、11種類の分析代謝物においてカドミウム由来の有意な変化が見られ、ケルセチンの高用量投与により回復することが確認された。このことは、カドミウムをトリガーとする酸化ストレスが脂質、アミノ酸、プリン代謝を変化させ、腎毒性をもたらすことを示唆しており、ケルセチンによって減弱させることができる[137]。さらに、カドミウム(CdCl260μM、38.5℃、4,8、12時間暴露)誘発によるヤギ精子の保存中の酸化ストレスは、精子の運動性、生存率、膜の完全性、ミトコンドリア活性に障害を与え、胚の発達に変化をもたらすことがわかった。ケルセチン(10μM)で精子をプレインキュベーションすると、ヤギ精子だけでなく着床前胚もカドミウム由来の酸化ストレスから保護される[138].マウスのF1-F2世代の記憶障害とカドミウムの関連性に関する研究は、モリス水迷路とステップダウン潜伏試験を用いて決定された。妊娠期間中にCd(1.2 mg/kg/dayのCdCl2)を1週間腹腔内投与した場合の新生仔への影響について評価した。F1世代の脳組織では、GSTとCATの活性と発現が有意に亢進し、記憶障害を示した。ケルセチン(25,50,100 mg/kg b.w.)の併用により、この効果は逆転した。F2世代では、結果はばらつきがあった。本研究は、カドミウムが脳組織における抗酸化酵素活性と遺伝子発現の変化を通じて記憶障害を引き起こす可能性を示唆している。ケルセチン処理により、F1およびF2世代の脳組織における抗酸化能が改善され、カドミウム濃度が低下する[139]。以上のことから、ケルセチンは、カドミウムをトリガーとする酸化ストレスを緩和することによって、主にカドミウム毒性から細胞を保護することがわかった。
ヘスペレチン
ヘスペレチン(IUPAC名:(2S)-5,7-dihydroxy-2-(3-hydroxy-4-methoxyphenyl) -2,3-dihydrochromen-4-one )は、柑橘類に豊富に含まれるヘスペリジンから誘導されるフラバノン系のフラボノイドである。hesperetinの様々な生物学的活性が報告されている。ヘスペレチンの最も顕著な特徴は、抗酸化作用とフリーラジカルの除去、抗がんおよび遺伝毒性活性、心臓血管系の調節、神経系の保護、および抗菌および微生物活性に属する[140、141]。Shagirthaら(2017)[142]は、ラットのCd誘発神経毒性に対するヘスペレチンの保護効果を調査した。21日以内に毎日3 mg/kg b.w.のCdCl2を皮下注射したところ、脳内のアセチルコリンエステラーゼ活性の低下、活性酸素の増加およびカルボニル化タンパク質によって示される酸化ストレス、酵素的(SOD、CAT、DPx)および非酵素的抗酸化物質(GSH、総サルフィドリル基、ビタミンC)は減少した。さらに、Cd曝露ラットの脳では、典型的なアポトーシスマーカー(Bcl2 associated X protein(Bax)、シトクロムC、カスパーゼ3および9)が増加し、抗アポトーシスマーカー(Bell lymphoma 2(Bcl2)は減少した。また、ラット脳のミトコンドリア電子輸送連鎖複合体(I、II、III、IV)は、カドミウム曝露により減少した。重要なことは、ヘスペレチン投与(40 mg/kg b.w.、経口投与)により、Cd由来の酸化ストレスとミトコンドリア機能障害が緩和され、ラット脳におけるアポトーシスが減少したことである。
アントシアニン
アントシアニンは水溶性の有色色素で、植物に広く存在し、500種類を超える最も豊富なフラボノイドに属す。アントシアニンの生物学的活性は多岐にわたる。抗酸化作用、抗菌作用、抗炎症作用、抗変異原性、分化誘導、がん細胞増殖抑制、転移抑制、重金属封鎖など、健康への有益な作用が報告されている。アントシアニンは、マイトジェン活性化プロテインキナーゼ(MAPK)経路、フリーラジカル消去経路、シクロオキシゲナーゼ経路、炎症性サイトカインシグナル伝達経路など、環境の悪影響から生物を保護するためのさまざまな生物学的経路を利用する[143、144]。
ラットにCdCl2水溶液4μg/kg b.w.を胃管から30日間曝露したところ、肝臓および腎臓にCdが蓄積し、血清中のビリルビンおよび尿素濃度が上昇し、ALTおよびAST活性が増強された。アントシアニン(10 mg/kg b.w.)の共投与は、カドミウムによる障害からラットの肝臓と腎臓を保護した[145]。5mg/kg/日のCdCl2を10,20,30日間経口投与した雄マウスにおいて、アントシアニンシアニジン-3-O-グルコシド(C3G)(チョウで500mg/kg/日)のCdの内分泌撹乱作用に対する影響を検討した。その結果、C3G処理により、血清中のゴナドトロピン、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)のCdによる変化量が回復することが明らかになった。さらに、Cdで減少した性ホルモン受容体Gnrh1遺伝子の発現がC3Gによって回復したため、精巣のLHおよびFSH受容体の発現が改善し、テストステロンの合成に関連するシグナル伝達経路が活性化された。これは、カドミウム由来の男性生殖機能障害に対するアントシアニン摂取の保護効果を示唆するものである[146]。
ナリンギン
ナリンギン(IUPAC名:(2S)-7-[(2S,3R,4S,5S,6R)-4,5-dihydroxy-6-(hydroxymethyl)-3-[(2S,3R,4R,5R,6S)-3,4,5-trihydroxy-6-methyloxan-2-yl]oxyoxan-2-yl]oxy-5-hydroxy-2-(4-hydroxyphenyl)-2,3-ジヒドロクロメン-4-オン)は、柑橘類から得られるポリフェノール化合物で、抗酸化活性の引き金となる-OH基を有している。ペルオキシル、スーパーオキシド、ヒドロキシルラジカルを用量依存的に中和する能力がある。ナリンギン処理は、GSHとGPX、GR、SOD、CATの酵素活性の増強と関連している[147]。ヒト肝細胞癌(HepG2)細胞にCd(50μMCdCl2,24時間)を曝露すると、酸化ストレスが誘発され、抗酸化系が変化して細胞毒性が生じる。ナリンギン(5μM)を細胞に共存させると、酸化還元ホメオスタシス、ミトコンドリア膜電位が回復し、アポトーシスが抑制された。その抗酸化作用により、SOD、GST、CATの内因性活性が維持され、脂質過酸化、カスパーゼ3切断、シトクロムc放出が減少した。したがって、ナリンギンの保護メカニズムは、カドミウムを介した細胞毒性を防ぐその抗酸化能に起因している[148]。同様に、ヒトリンパ球において、ナリンギン(1および2μg/mL)は、フリーラジカルによる損傷から細胞環境を保護するため、その抗酸化性によってCd由来(20および40μMのCdCl2,24時間)の染色体異常から細胞を保護することができた[149]。
クルクミン
クルクミン(IUPAC名:(1E,6E)-1,7-ビス(4-ヒドロキシ-3-メトキシフェニル)ヘプタ-1,6-ジエン-3,5-ジオン)は、分子式C21H20O6、ジフェルロイルメタンとも呼ばれる黄色で疎水のポリフェノール化合物である。ウコン(Curcuma longa)に天然に存在し、強力な抗がん剤であると考えられている。クルクミンには強力なラジカル消去作用があり、酸化的損傷に対する保護作用を示すことが示された。さらに、クルクミンは、主にその抗酸化作用により、カドミウムによる臓器毒性に対する強力な保護および治療薬として報告されている[150]。クルクミンを最後に投与した1時間後または24時間後にCdCl2を単回皮下注射し、33μM/kgまたは5mg/kg b.w.のいずれかの用量でCdに曝露したマウスは、抗酸化酵素の活性、総グルタチオンおよびチオールの血清レベルが低下し、MDAおよび過酸化水素レベルが上昇することにより酸化ストレスを示した。また、カドミウム曝露により、精細管の直径が減少したが、精細管の内腔径は増加した。カドミウム投与に先立ち、クルクミンを0.14 mM/kg b.w.の用量で3日間胃内投与または100 mg/kg b.w.をi.p.注射により単回投与した。クルクミンを投与したマウスは、脂質およびタンパク質の過酸化という点でカドミウムの悪影響から大きく保護され、クルクミンによって抗酸化防御システムが増強され、カドミウム投与マウスの組織の形態学的パラメータが部分的に回復したことから、クルクミンがカドミウム毒性に対する治療成分としての可能性が示唆された[151,152].
カルバクロール
カルバクロール(IUPAC名:2-methyl-5-propan-2-ylphenol)は、タイムやオレガノなどの多くの芳香植物から生成されるモノテルペンフェノールで、安全な食品添加物として様々な治療への応用が考えられている[153]。Banikら[154]は、PC12細胞におけるCd誘発アポトーシスに対するカルバクロール(100μM)の役割を調査した。細胞をCd(10μMCdCl2,48時間)に曝露すると、成長遅延、グルタチオンレベルの低下、グルタチオンレダクターゼの発現が生じた。さらに、Cd添加により、カスパーゼ3の切断、シトクロムcとアポトーシス誘導因子(AIF)の増強、ストレス制御キナーゼmTOR(mammalian target of rapamycin)、Akt(protein kinase B)、NF-κB(nuclear factor kappa-light-chain-enhancer of activated B cell)、ERK-1(extracellular signal-regulated kinase-1) およびNrf2(futrical factor erythroid 2-related factor 2)発現量がダウンレートさせた。カルバクロールは、PC12細胞のカドミウムによる酸化ストレス、カスパーゼ依存性およびカスパーゼ非依存性のアポトーシスを強く抑制した。したがって、天然の抗酸化物質であるカルバクロールは、カドミウムによる毒性に対する安全な治療化合物としての可能性が示唆された。
フェノール酸類
フェノール酸の一部、例えばフェルラ酸やバニリン酸は、カドミウムの悪影響を緩和することが記載されている。
フェルラ酸
クルクミンの誘導体であるフェルラ酸(IUPAC名:(E)-3-(4-ヒドロキシ-3-メトキシフェニル)プロプ-2-エン酸)は、単子葉植物の細胞壁に存在するユビキタスフェノール化合物で、抗ラジカル活性を含む幅広い治療活性を有している。カドミウム(CdCl2 10 mg/kg/w)を皮下投与したラットを用いて、肝臓および腎臓におけるカドミウム誘発酸化ストレスに対するフェルラ酸(50 mg/kg/wを15日間および30日間経口投与)の役割を検討した。カドミウム曝露により、摂餌量と摂水量が減少し、体重と血清総タンパク質量(TPC)が減少し、肝臓と腎臓に病理組織学的障害が発生した。カドミウム由来の肝腎毒性は、AST、ALT、ALP、LDHなどのマーカー酵素のレベル、AST:ALT比、尿酸、尿素、尿素窒素、クレアチニン含量の増加で顕著に現れた。さらに、カドミウム投与により、肝臓および腎臓の組織において、脂質過酸化(MDA値)、脂質ヒドロペルオキシド(LOOH)、タンパク質カルボニル量(PCC)、総酸化状態(TOS)、酸化ストレス指数(OSI)の増加により示される肝および腎の酸化ストレスが生じた。肝臓と腎臓の抗酸化能は、カドミウム曝露により劇的に低下し、総チオール(TTH)、総抗酸化濃度(TAC)、酵素的抗酸化物質(SOD、CAT、GPx)、非酵素的抗酸化物質(還元グルタチオン(GSH)と総自由スルフヒドリル群(TSH)のレベルが著しく低下したことから証明されるようになった。フェルラ酸投与により、血清総タンパク質量と腎臓マーカー酵素は正常値に有意に回復し、酸化ストレスマーカーは減少し、肝臓と腎臓の抗酸化防御レベルは向上した。さらに、フェルラ酸は、肝臓と腎臓の組織の正常な組織構造を保護するため、カドミウムの毒性を緩和した。さらに、カドミウムが介在するTNF-α、COX-2、HSP70タンパク質のアップレギュレーションは、フェルラ酸処理によって回復した[155]。
バニリン酸
バニリン酸(IUPAC名:4-hydroxy-3-methoxybenzoic acid)は、フェルラ酸からバニリンを製造する際の中間体であり、バニリンの酸化体である。様々な食用植物や果実に含まれるフェノール誘導体である。その抗酸化作用、抗変異原性、抗菌作用、または抗炎症作用は、多くの研究によって確認されている[156,157,158]。カドミウム毒性によって特に障害される作物植物の1つはイネである。それゆえ、Bhuyanら(2020)[159]は、イネ(Oryza sativaL. cv. BRRI dhan54)におけるカドミウム由来のストレスに対するバニリン酸の効果を分析した。高濃度(2 mM)または中濃度(1 mM)のCdCl2で、72 時間処理したイネ苗は、光合成色素量、細胞内の浸透圧状態、バイオマス蓄積、生育が低下していた。カドミウム処理により、葉の相対的な張力、アスコルビン酸プールの大きさが変化し、活性酸素の発生が増加することで酸化ストレスの兆候が現れ、抗酸化系とグリオキサラーゼ系が変化した。バニリン酸(50μM)の併用は、イネ苗の栄養ホメオスタシスを促進することにより、抗酸化剤およびグリオキサラーゼ酵素活性を高め、活性酸素の生成を抑制し、浸透圧状態を改善し、フィトケラチン含量を高め、生物蓄積因子およびカドミウム転流因子を増加させた。このように、バニリン酸は、イネの初期苗の段階でカドミウム抵抗性を高めることができる植物保護化合物であることが示唆される。
3.3.2.ホルモン、植物ホルモン、代謝産物
サリチル酸
サリチル酸(IUPAC名:2-ヒドロキシ安息香酸)植物の成長と発達に重要な役割を果たす植物ホルモンは、様々な起源の病原体に対する植物の防御応答を制御する重要なシグナル分子である。サリチル酸による前処理は、Guo et al. (2019)[160]がレビューするように、Cdダメージに対する緩和効果を示した。サリチル酸シグナル伝達は、主に植物組織における活性酸素種(ROS)産生の調節と関連しており、細胞壁の再構築、Cdを含むイオンの取り込みのバランス、抗酸化防御システムの応援、光合成と老化の制御といった一連の適応的反応をもたらす。しかし、外因性SAの過剰投与はカドミウム毒性の増強につながる可能性があり、したがって適切な投与が不可欠である。Liら(2019)[161]の研究では、ジャガイモ(Solanum tuberosumL.)品種「Zaodabai」の茎の摘出物における200μMCdCl2共曝射によるCd由来の毒性に対するその効果を分析するために、600μMサリチル酸を10日間葉に散布して使用した。特に、サリチル酸の外用は、抗酸化酵素機構経路を刺激し、相対水分量(RWC)、クロロフィル、プロリン、サリチル酸の内因性含量を増加させ、カドミウム誘発毒性を緩和することが証明された。さらに、カドミウム処理したジャガイモ植物にサリチル酸を共存させると、MDA、過酸化水素(H2O2)、スーパーオキシドアニオンラジカル(O2-)の含有量が減少した。従って、サリチル酸は、植物がカドミウムの毒性を防御するのに役立つ有望な治療法である。
アブシジン酸
アブシジン酸(IUPAC名:(2Z,4E)-5-(1-hydroxy-2,6,6-trimethyl-4-oxocyclohex-2-en-1-yl )-3-methylpenta-2,4-dienoic acid)は作物にストレス耐性をもたらす重要な植物ホルモンの1つと考えられている。植物ホルモンは、ストレス条件下でその含有量が著しく増加し、ストレス耐性機能を媒介し、ストレス適応やストレス環境下での生存を助ける[162]。植物ホルモンは、植物の生物学的ストレスに対する耐性の向上に重要な役割を果たすことから、Dawudaら(2020)[163]は、カドミウム感受性レタス品種(Lactuca sativaL., cv. Lüsu)におけるカドミウム誘発毒性におけるアブシジン酸の役割について調べた。100μMのCdCl2(水耕栽培の養液を通して)を投与した植物では、H2O2およびMDAの含有量が増加し、酸化ストレスのマーカーを示した。さらに、Cd曝露により、光合成、植物バイオマス、葉の必須栄養素(Cuを除く)含有量が減少し、植物の葉と根のCd含有量は増加した。アブシジン酸(10μg/L)を葉に散布した植物処理は、カドミウムによるストレスを有意に緩和した。アブシジン酸の葉面散布により、葉と根のカドミウム含有量は減少したが、抗酸化酵素の活性、光合成、植物バイオマス、必須栄養元素の量は増加した。これらの結果は、アブシジン酸の葉面処理により、カドミウムに敏感なレタスのカドミウム耐性が向上し、カドミウム由来ストレス下での栄養品質と食の安全が促進されることを示唆している。
メラトニン
メラトニン(IUPAC名:N-[2-(5-メトキシ-1H-インドール-3-イル)エチル]アセトアミド)は、微生物、動物、植物などすべての生物に存在するホルモン物質で、1958年に「ウシ松果体」から発見された。メラトニンは松果体だけでなく、様々な組織や臓器で合成され、近年ではあらゆる細胞のミトコンドリアでも合成されることが明らかになった。メラトニンは、その優勢な概日リズム調節作用に加えて、非常に高い酸化ストレス条件下で生物を保護し、細胞保護、腫瘍予防、免疫調節をもたらす大きな可能性を持つ抗酸化剤であることが確認されている[164].また、メラトニン由来の生物ストレスに対する保護作用も報告されている。カドミウム(25 µMCdCl25日間、またはメラトニン処理2日後に50 µM Cd(NO3)28日間)は、菜種の苗とアオイ(Malva parviflora)植物に毒性をもたらし、高さやバイオマス、抗酸化酵素活性が低下したが、栄養液に15,50,100 µMのメラトニン添加で緩和された。メラトニンのカドミウムストレスに対する抗酸化作用は、SOD、CAT、ペルオキシダーゼ、アスコルビン酸ペルオキシダーゼ、プロリン、クロロフィル、アントシアニン含量、光合成速度の増加によってカバーされており、MDAとH2O2レベルは減少している。さらに、メラトニンはカドミウムのオルガネラ分画および液胞分画を減少させるため、カドミウムストレスに対する植物の耐性を増強した[165,166]。同様に、カドミウム(30 µMCdCl2、最長20日間)に曝露したマルス植物にメラトニン(100 µM)を処理すると、カドミウムの取り込みを制御するいくつかの遺伝子のmRNAレベルが変化し、カドミウムトランスレーションの減少、根のカドミウム取り込みと葉のカドミウム蓄積が減少し、根、茎、葉のメラトニン含有量は増加した。さらに、メラトニンの投与により抗酸化酵素の濃度と活性が上昇し、カドミウムによる酸化ストレスを緩和した[167]。これまでの知見と同様に、メラトニン(50および200μM)は、その強い抗酸化力により、カドミウム(50および100μMCdCl2)2日間塗布により過剰生成された内因性過酸化水素を分解する小麦苗根の能力を高め、過酸化水素の恒常性を維持し初穂成長を促進した[168].カドミウム(20 µMCdCl2、養液中、8日間)に曝露した白菜の苗を用いた実験では、カドミウムによって一酸化窒素(NO)が上昇し、トランスポーター遺伝子IRT1の発現が増加して、結果的にカドミウム吸収量が増加することがわかった。メラトニン(100 µM、1日1回葉面散布)を併用すると、カドミウムによるNOの蓄積とNO合成に関わる酵素の活性が低下し、IRT1遺伝子の発現も低下したため、カドミウム濃度は低下した。さらに、メラトニンは、カドミウムを介した光合成パラメータの低下と植物のバイオマスを有意に増加させた[169]。興味深いことに、Nabaei and Amooaghaie (2020)[170] は、Catharanthus roseus(L.) G. Don植物を50,100、および200 mg CdSO4/kg土壌に30日間曝露し、NOドナーであるニトロプルシドナトリウム(200 μM)単独またはメラトニン(100 μM)またはそれらの組み合わせによる葉面スプレーが曝露植物のCd耐性とフィトレメディア効率を高めることを示している。著者らは、メラトニンおよび/またはSNP処理により、シュートのバイオマスおよびクロロフィルaとクロロフィルbの含有量が増加し、POXおよびCAT活性が向上し、電解質漏出(EL)が減少し、根からシュートへのカドの取り込みおよびトランスロケーションが上昇することにより葉における必須カチオンのバランスを最適化したと結論付けた。カドミウム隔離に対するNOの効果の相違は、使用したカドミウム濃度や実験設定の違いに起因していると考えられる。メラトニンを介したカドミウム耐性において、硫黄(S)代謝が重要な役割を果たすことは注目に値する。カドミウム誘発ストレス下(メラトニン投与後24時間、100μMCd2+に15日間暴露した共処理植物)、カフェ酸Oメチル化酵素(COMT)遺伝子が沈黙しメラトニン欠乏となったトマト植物ではS蓄積量が減少しカド植物傷害が上昇する。外因性メラトニン(100 µM、15日間、5日おきに葉面散布)またはCOMTの過剰発現により、Sの取り込みと同化が促進され、植物の成長とカドミウム耐性が改善された[171].
メラトニンを介したカドミウム耐性の上昇をキノコで実験的に検討した。外因性メラトニン(50,100,200μM)は、カドミウム誘発酸化ストレス(2,5、8μMCdCl2を5日間添加)に対して抗酸化活性を促進する。カドミウム毒性を減少させるために指示されたメラトニンの防御活動には、アミノ酸およびグルタチオン代謝、酸化還元プロセス、金属、および活性酸素の解毒の強化が含まれる[172]。
メラトニンによるカドミウム毒性軽減の研究には、動物サンプルの分析が含まれる。Cd(5mg/kgのCdCl2を毎日i.p.注射)に14日間さらされたマウスは、排卵機能障害とERストレスの増加による卵巣障害を示した。メラトニン(25 mg/kg)の投与は、Cd誘発の病理組織学的損傷を部分的に逆転させ、排卵された卵子数を増加させたことから、マウス卵巣に保護効果がある[173].驚くべきことに、メラトニン(1μM)は、Cd(1-100nMのCdCl2,48時間)による卵巣がん細胞のエストラジオール(E2)由来の増殖を抑制することができ、Cd誘発卵巣がんに対する予防化合物としてメラトニンのポジティブな役割を示唆している[174]。
慢性低級カドミウム(飲料水中のCdCl250 mg/Lを1カ月間)に曝露したラット骨(大腿骨)および実験に応じて0.25~50 μmol/LCdCl2で4~72時間処理したヒト脂肪細胞(hMSC)において、骨組織に対するカド毒性を解析した。成体ラットのカドミウム曝露により、ミネラル成分および有機成分が減少し、大腿骨のCa2+レベルの低下により、骨損傷および組織学的変化が見られた。メラトニン(3 mg/L)投与により、大腿骨のミネラル化および組織構造が改善された。さらに、CdをhMSC細胞の増殖培地に添加すると、骨形成経路が損なわれ、脂肪形成分化が促進されるため、骨の老化が早まり、毒性を示すことが明らかになった。メラトニン(10 nmol/L〜50 μmol/L)は、これらの細胞の骨形成分化特性を著しく改善した[175]。
雄雌ラットにCd(CdCl2 1 mg/kg)を腹腔内注射で8週間慢性的に曝露すると、行動障害と関連する。Cd投与は、不安試験で不安神経症様作用、強制水泳試験(FST)で抑うつ様作用を示し、Y迷路試験やモリス水迷路(MWM)試験で記憶障害や学習障害をもたらす。Cdを投与すると、一酸化窒素(NO)濃度の上昇や脂質過酸化によって示される酸化ストレスが発生する。海馬の抗酸化酵素CATとSODの活性は有意に低下し、海馬の組織学的研究では、CA3小領域でカドミウムによる神経細胞減少が認められた。メラトニン投与(カドミウム投与30分前に4 mg/kg)は、海馬における抗酸化作用により、神経行動障害を相殺し、カドミウムによる神経細胞喪失を顕著に減少させた。興味深いことに、カドミウムとメラトニンの効果は性差があり、カドミウムは男性でより有害であり、メラトニンは女性でより保護的である[176]。
哺乳類におけるカドミウム曝露の重要な影響として、急性および慢性の肝障害と肝細胞死が挙げられる。カドミウム(CdCl2 2.0 mg/kgをi.p.注射し、注射後6,12,24時間後にサンプルを採取)に曝露した雄マウスは、肝細胞障害、血清ALT/AST酵素の増加、NLRP3(NOD様受容体ピリンドメイン含有3)インフラマソームを介した炎症細胞死が見られた。メラトニン(10 mg/kg、カドミウム投与3日前にi.p.注射)投与は、抗酸化作用により血清ALT/AST値を低下させ、カドミウム誘発肝障害の軽減につながり、炎症性サイトカイン産生の抑制、NLRP3インフラムソーム活性化の抑制、肝細胞死の抑制をもたらした。メラトニンは、急性肝不全の発症に重要な役割を果たす、細胞の酸化還元バランスを制御する内因性のチオレドキシン相互作用タンパク質(TXNIP)のCdによる過剰発現を抑制することに大きな関心を寄せている。さらに、メラトニンはTXNIPとNLRP3との相互作用を低下させた。したがって、カドミウムをトリガーとする肝臓の炎症と肝細胞死に対するメラトニンの保護は、TXNIP-NLRP3インフラマソーム経路の阻害を介して行われると結論づけることができる[177]。
フルボ酸(Fulvic Acid)
フルボ酸(IUPAC名:3,7,8-trihydroxy-3-methyl-10-oxo-1,4-dihydropyrano [4,3-b]chromene-9-carboxylic acid)は、腐植物質と呼ばれる多様な化合物のサブクラスで、コンポストの中の生物廃棄物が分解するなどの地化学および生物反応によって生成され堆積する。フルボ酸は、免疫系の調節、酸化状態の維持、および胃腸機能の改善において重要な役割を果たすことが示され、さらに、フルボ酸は重金属との強い錯形成能力を有する[178,179,180]。したがって、Wangら(2019)[181]は、レタス苗のCd毒性に対するフルボ酸の潜在的な保護効果を分析した。3葉期の苗を水耕栽培で20μMCdCl2で2週間処理したところ、栄養元素の不均衡による成長阻害、光合成装置の乱れによる光合成色素の減少、ROSの蓄積による酸化ストレスが生じた。カドミウム曝露植物に0.5 g/Lのフルボ酸を投与すると、抗酸化能が刺激され、活性酸素の蓄積を抑制することが確認された。さらに、フルボ酸処理により、カドミウム毒性からPSIIを保護し、クロロフィルの生合成を促進し、光合成に関与するFe、Zn、Mnなどの元素栄養素の根から芽への移動を促進し、光合成活動を促進した。したがって、著者らは、フルボ酸がレタスのカドミウム誘発毒性を緩和する能力は、活性酸素の過剰生産の排除とカドミウムの取り込みの抑制によるものと推測している。
試験系に対するカドミウムの毒性作用と生理活性物質の補充による緩和を表3にまとめた。
表3 生理活性物質の効果
| 物質名 | モデル | 物質の投与量 | Cdの投与量 | Cd曝露による有害反応と物質による治療効果 | レフ。 |
|---|---|---|---|---|---|
| ルチン | ラット | 25-100mgkg-1b.w.(14日間または30日間経口投与する) | 5 mgkg-1b.w.(14日間または30日間経口投与)。 | 神経毒性および認知障害、ERK1/2およびJNKアポトーシス経路、PTEN由来のmTOR生存経路の制御、エクトヌクレオチダーゼ、アデノシンデアミナーゼおよびMAO活性 | Oboh et al., 2019年[130]、Abdel-Aleem and Khaleel 2018年[131]。 |
| クリシン | マウス | 2.5および5 mgkg-1b.w.を30日間飲料水に添加した。 | 2 mgkg-1b.w.を30日間飲料水に添加した。 | 肝ストレス、肝酵素増強、形態的変化 | Beyrami et al., 2020年【132】。 |
| ジオスミン | ラット | 100mgkg-1b.w.を30日間飲料水に添加した。 | 飲料水に200ppm、30日間 | 肝障害、肝酵素、抗酸化パラメータ、病理組織学的パラメータ | アウル&エラスラン2019年版【133件 |
| ケルセチン | マウス | 5-100 mgkg-1b.w.をi.p. 注射で、3日間投与する。 | 0.4 mgkg-1b.w.をi.p. 注射で、3日間投与する。 | オートファゴソーム形成、LC3-II/β-アクチン比、活性酸素、MDA量、抗酸化力 | Yuan et al., 2016年[134]。 |
| ラット近位尿細管初代細胞 | 1 μgmL-1で12時間 | 2.5 μM、12時間 | オートファジーマーカー蛋白、TFEBによるリソソーム機能回復、v-ATPase | Zhao et al., 2021年【136】。 | |
| ラット | 10 および 50 mgkg-1b.w.を12 週間経口投与した。 50mgkg-1b.w. i.p.注射を4週間継続する。 |
4.89 mgkg-1b.w.を飲料水として12週間摂取させた。 2 mgkg-1b.w.のi.p. 注射を4 週間投与する。 |
腎毒性、代謝の変化、脂質、アミノ酸、プリン体代謝 身体および精巣の重量減少、精巣の病理学的変化、酸化ストレス、オートファジー |
Wang et al., 2020年【135】。 グァン et al., 2021年【137】。 |
|
| ヤギの精子 | 10 μM、38.5 ℃で12時間まで使用可能。 | 60 μM、38.5 ℃で12時間まで使用可能 | 酸化ストレス、精子の運動率、生存率、膜の完全性、ミトコンドリア活性、胚の発生変化 | マオ et al., 2018年[138]。 | |
| マウス | 20-100 mgkg-1b.w.day-1を1 週間投与する。 | 1.2 mgkg-1b.w.day-1を1 週間投与する。 | F1-F2世代の記憶障害、脳活動、GSTとCATの発現、カドミウム取り込み量 | ハルダー et al., 2019年[139]。 | |
| ヘスペレチン | ラット | 40mgkg-1b.w.を経口投与する。 | 3 mgkg-1をs.c. 注射で、21日間投与する。 | アセチルコリンエステラーゼ、活性酸素、タンパク質カルボニル化、SOD、CAT、DPx、GSH、ビタミンC、総スルフヒドリル基、アポトーシスマーカー、ミトコンドリア機能障害 | シャギルタ他、2016年【142件 |
| アントシアニン | ラット | 10 mgkg-1b.w.を胃管で30日間投与する。 | 4 μgkg-1b.w.を胃管で30日間投与する。 | 肝臓と腎臓のカドミウム蓄積 | Kowalczyk et al., 2003年[145]。 |
| マウス | 500 mgkg-1day-1を最大 30日間投与する。 | 5 mgkg-1day-1を最大 30日間投与する。 | ゴナドトロピン、黄体形成ホルモン、卵胞刺激ホルモンのレベル、Gnrh1遺伝子の発現量 | 李 et al., 2019年【146】。 | |
| ナリンギン | HepG2細胞 | 5 μM、24時間 | 50 μM, 24 h | 抗酸化システムの変化、細胞毒性、酸化還元ホメオスタシス、ミトコンドリア膜電位、アポトーシス、SOD、GST、CAT活性、脂質過酸化作用 | ラティ et al., 2017年[148]。 |
| ヒトリンパ球 | 1-2 mgmL-1,24時間 | 20および40μMで24時間 | 染色体異常、活性酸素、抗酸化代謝 | Yılmaz et al, 2012[149] (ユルマズ et al., 2012)。 | |
| クルクミン | マウス | 0.14 mMkg-1b.w.を3日間経口投与、または 100 mgkg-1b.w.を単回 i.p. 投与。 | クルクミン投与1時間後または24時間後に33μMkg-1または5mgkg-1b.w.をs.c.注射で投与 | 抗酸化酵素活性、総グルタチオンとチオールのレベル、MDA、H2O2、 | Eybl et al., 2006年[151]、Momeni et al., 2020年[152]。 |
| カルバクロール | PC12細胞 | 100 μM, 48 h | 10 μM, 48 h | 成長遅延、グルタチオンおよびグルタチオン還元酵素、カスパーゼ3、シトクロムc、アポトーシス誘導因子、mTOR、プロテインキナーゼB、核因子κ-光鎖-活性B細胞エンハンサー、細胞外シグナル制御キナーゼ1、核因子エリスロイド2関連因子2 | バニック et al., 2019年【154】。 |
| フェルラ酸 | ラット | 50mgkg-1b.w.を15日間または30日間経口投与する。 | 10mg/kg-1b.w.を15日および30日間、s.c.注射で投与する。 | 体重および血清総タンパク質量、病理組織学的損傷、AST、ALT、ALPおよびLDH、尿酸、尿素窒素およびクレアチニン含有量)、脂質ヒドロペルオキシド、MDA、タンパク質カルボニル量、総酸化状態および酸化ストレス指数、総チオール、総抗酸化濃度、SOD、CATおよびGPx、GSHおよび総フリーサルファヒドリルグループ、TNF-α、COX-2およびHSP70タンパク質 | サンジーヴ et al., 2019年[155]。 |
| バニリン酸 | オリザサティバL. | 50 μMの苗を72時間曝露した。 | 1および2mMの苗を72時間曝露した。 | 光合成色素、浸透圧状態、バイオマス蓄積、成長、活性酸素、アスコルビン酸プールサイズ、抗酸化・グリオキサラーゼ系、フィトケラチン含有量 | Bhuyan et al., 2020年【159】。 |
| サリチル酸 | ソラマメ | 600 μMの葉面散布曝露を10日間行う。 | 200 μMの葉面散布曝露を10日間行う。 | RWC、抗酸化酵素機構経路、クロロフィル、プロリン含量、MDA、H2O2、スーパーオキサイドアニオンラジカル | 李 et al., 2019年【161】。 |
| アブシジン酸 | リュウキュウアサガオ | 10 μgL-1を葉に散布 | 水耕栽培用養液で100μM | 酸化ストレス、H2O2、MDA、光合成、ミネラル栄養分、植物バイオマス | Dawuda et al., 2020年【163】。 |
| メラトニン | アブラナ科植物(Brassica napusL. マルバ・パルビフロラ(Malva parvifloraL. |
栄養剤に15,50または100μMを添加 | 25 µMで5日間、50 µMで8日間。 | 光合成、SOD、CAT、ペルオキシダーゼ、アスコルビン酸ペルオキシダーゼ、プロリン、クロロフィルおよびアントシアニン含量、MDA、H2O2 | サミ et al., 2020年[165]、トゥシ et al., 2020年[166]。 |
| セイヨウミドリイシ | 100 µM、最長20日間 | 30 µM、20日間まで | カドミウムトランスロケーション、抗酸化酵素活性、根のカドミウム取り込み、葉のカドミウム蓄積量 | He et al., 2020年【167】。 | |
| なのはな | 100μMを1日1回葉に散布 | 20 µMを栄養液に8日間浸す | 一酸化窒素、トランスポーター遺伝子IRT1の発現、カドミウム吸収量 | Ni et al., 2018年【168】。 | |
| G.ドン | 100 μMの葉面散布 | 50, 100, 200 mgkg-1土壌 30日間 | ファイトレメディエーション効率、シュートバイオマスおよびクロロフィル含量、PODおよびCAT活性、電解質漏出量 | ナバーイとアムアグハイ2020年版【170点 | |
| ソラマメ(Solanum lycopersicumL. | 100 μMの葉面散布を15日間、5日おきに行う。 | 100 μM、15日間 | 硫黄代謝、カフェー酸O-メチルトランスフェラーゼ(COMT)遺伝子 | ハサン et al., 2019年【171】。 | |
| きのこ類 | 50, 100, または 200 μMを成長培地に5日間投入 | 2,5、8μMを成長培地で5日間培養したもの | アミノ酸・グルタチオン代謝、酸化還元過程、金属、活性酸素について | 高 et al., 2020年【172】。 | |
| マウス | 25mgkg-1を14日間 i.p. 注射で投与する。 | 5 mgkg-1を14日間 i.p. 注射で投与する。 | 排卵機能障害と卵巣の損傷、病理組織学的損傷 | ヤン et al., 2019年[173]。 | |
| マウス | Cd投与前に3日間、i.p.注射で10mgkg-1を投与した。 | 2 mgkg-1をi.p. で単回注射した。 | 肝細胞障害、ALT/AST酵素、抗酸化活性、チオレドキシンインターアクティングプロテイン、TXNIP-NLRP3インフラマソームパスウェイ | Cao et al., 2017年[177]。 | |
| 卵巣がん細胞 | 1 μM、成長培地で48時間 | 1-100 nM、成長培地で48時間投与 | エストラジオール(E2)由来の増殖性 | あたい et al., 2018年【174件 | |
| ラット | 3 mgL-1を飲料水に1カ月間添加した。 | 飲料水に50 mgL-1を1カ月間添加する。 | ミネラルおよび有機成分、Ca2+レベル、骨損傷および組織学的変化 | クナニ et al., 2019年【175】。 | |
| ラット | 4 mgkg-1Cd投与30分前 | 1 mgkg-1をi.p. 注射で、8 週間投与する。 | 記憶・学習障害、NOと脂質過酸化、CATとSOD、カドミウムによる神経細胞消失 | ラムタイ et al., 2021年[176]。 | |
| ヒト脂肪細胞 | 10 nmolL-1-50μmol L-1を成長培地で4~72時間培養する。 | 0.25~10 μmolL-1を成長培地で4~72時間培養する。 | 骨形成分化特性、脂肪形成分化特性 | クナニ et al., 2019年【175】。 | |
| フルボ酸 | リュウキュウアサガオ | 0.5 gL-1を水耕栽培で2週間。 | 水耕栽培で20μMを2週間使用 | 栄養元素のアンバランス、色素量、光合成、光化学系PSII、ROS、抗酸化力 | ワン et al., 2019年[181]。 |
3.4.全植物抽出物
多くの植物が強い抗酸化作用を持つことから(図2)、カドミウム毒性除去に対する様々な植物全抽出物の可能性が検討された。
図2 生理活性物質。全植物抽出物中に最も多く含まれる生理活性物質の模式図
3.4.1.センナ・アレキサンドリナエキス
Senna alexandrinaはCaesalpiniaceaeに属し、北アフリカに生育する小型の多年生植物である。Sennaalexandrinaの葉の分析から、apigenin-6,8-di-C-glycoside、tinnevellin glycoside、emodin-8-O-β-D-glucopyranoside、Aloe emodin、ISORHAMNETIN-3-O-β-gentiobioside、KaempferolおよびD-3-O-methylinositolなどの薬理活性分子の存在が確認できたため、主に抗菌、抗ウイルスおよび下剤物質として使用されている。Wangら(2020)[182]の研究では、著者らは、ラットのカドミウム誘発肝毒性に対するSAEの効果を調べるために、微粉末の植物を70%メタノールに浸し、その後濃縮して凍結乾燥させたS. alexandrinaエキス(SAE)を使用した。Cdに曝露したラット(0.6mg/kg/日のCdCl2を28日間腹腔内注射)したラットは、血清中のAST、ALT、TB値が有意に上昇し、酸化マーカー(LPO、MDA、NO)、炎症性サイトカイン(IL-1β、TNF-α)、プロアポトーシス分子(BAX、カスペース3)値も上昇し、抗酸化分子(GSH、GPx、GR、SOD、CAT)、抗アポトーシスタンパクBcl-2の活性値は低下した。SAE(100mg/kg、28日間経口投与)の補充は、最も顕著な細胞内抗酸化制御分子Nrf2の発現を上昇させ、肝臓へのCd沈着を抑制し、Cdが介在する生体の酸化、炎症、アポトーシス応答を回復させた。さらに、SAE投与により、カドミウムによる肝組織の病理組織学的変化が抑制された。本研究の結果は、SAEがNrf2の発現を促進することにより、抗炎症および抗アポトーシスカスケードの開始を誘発し、カドミウム毒性から肝臓組織を保護することを示している。
3.4.2.ポーチュラカ・オレラセア(パースレーン)抽出物
ポーチュラカ・オレラセアは薬用植物で、α-リノレン酸やエイコサペンタエン酸などのオメガ3脂肪酸や、抗酸化作用や抗変異原性を示すアルカロイド色素のベタレインが豊富であることが知られている。さらに、カロテノイド、ビタミンA、C、B、Mg、Ca、K、Feなどのミネラル成分も含まれている。50%エタノールに浸したパースレーンの乾燥した粉末の葉から調製したエタノール抽出物は、Seifら(2019)[183]によって、ラットのCd誘発肝腎毒性に対する効果を調べるために用いられた。他と同様に、Cd(3.5mg/kg/dayのCdCl2を30日間腹腔内注射)に曝露したラットは、Cdが抗酸化酵素(SOD、CAT、GPX)活性の低下を誘発する一方で、血清中のMDA含有量の増加によって示されるように脂質過酸化が増加し、酸化ストレスに罹った。肝臓と腎臓の組織学的分析から、カドミウムによる出血と鬱血は、深刻な肝臓と腎臓の組織の壊死と変性につながったことがわかった。さらに、明らかな肝細胞の損傷は、血清AST、ALT、ALP、TGi活性およびTPレベルの著しい増強によって示された。カドミウム曝露による腎臓機能の変化は、血清尿素とクレアチニンの上昇をもたらした。プルスレンエキス(PEE)の摂取により、カドミウムによって変化したすべてのパラメータと組織について、完全な回復または大幅な改善がみられた。したがって、PEEは、動物モデルシステムにおいて、カドミウムを介した肝腎毒性に対して実質的な保護を提供すると結論づけることができる。
3.4.3.Aronia melanocarpaL. 抽出物
バラ科の多年生低木であるAronia melanocarpaL.(チョークベリー)の果実は、強力な天然抗酸化物質であるポリフェノールを豊富に含んでいる。ポリフェノールは、水酸基の数が多いことから、カドミウムなどの金属イオンをキレートする性質がある。ポリフェノールに加え、チョークベリーには、ビタミン、トリテルペン、カロテノイド、植物ステロールなど、フリーラジカルや活性酸素を無害化する機能を持つ生物要素が豊富に含まれている。ラットのカドミウム誘発毒性(1または5mg/kg b.w.のCdCl2を3,10,17、および24カ月間食事で摂取)に対するA. melanocarpaエキス(AE)(飲料水中の0.1%水溶液として)の有益な影響は、肝臓においてMężyńska et al.(2019)[184]が肝臓の抗酸化能に、Kozłowska ら (2020)[185]が肝臓のI 型とIII 型のコラーゲン量に、Dąbrowski ら (2020)[186]が顎下腺,Borowska ら (2017)[187]によるミネラル元素代謝に主眼をおいている。AEは、酵素的および非酵素的な抗酸化装置の改善,総抗酸化状態の増加,肝臓組織および顎下腺における脂質過酸化およびCd蓄積の減少として、Cd由来の酸化的ストレスからモデル動物を有意に保護した。また、カドミウム曝露によるコラーゲン代謝は、AE 補給によって著しく改善され、コラーゲン I 型とIII 型の発現量とその相互比(コラーゲン III/コラーゲン I)が補正され、さらにAE 処理によって肝臓のMMP(マトリックスメタロプロテイナーゼ)とそのTIMP(組織阻害剤)濃度が上昇した。また、カドミウムによって障害された。ZnやCuなどの生物学的に重要な元素の代謝は、AEの補給によって有意に(完全にまたは部分的に)改善された。これらの研究結果は、アロニア製品の摂取が、カドミウム曝露によって引き起こされる複数の傷害に対してかなりの保護を提供する可能性を示唆している。

3.4.4.Physalis peruvianaL. 抽出物
ゴールデンベリーとして知られるPhysalis peruvianaの果実は、ポリフェノール、ビタミンC、E、A、D、ビタミンB群の一部、ウィダノライド、カロテノイドを豊富に含むため、顕著な抗酸化作用があることが知られている。
ラットのCdによる腎毒性および肝毒性に対するPhysalis peruvianaメタノール抽出物(メタノールは減圧下で除去)の効果がDkhilら(2014)により検討された[188]。
6.5mg/kg/日のCdCl2腹腔内注射を5日間行ったラット群に、メタノールエキス(MEPh)を200mg/kg b.w.の用量で前投与した。Cdを介した腎臓の重量および指数の有意な減少、肝酵素の増加、ビリルビン、尿酸、尿素およびクレアチニンのレベルは、MEPhの補充によって改善された。したがって、MEPHをトリガーとする抗酸化作用と抗アポトーシス作用は、Cd処理ラットの肝腎毒性を緩和した。このことから、Physalis peruvianaの果実は、カドミウム毒性に対して適切な保護を提供する可能性があることが示された。
3.4.5.ミモザ・カエサルピニフォリアエキス
Mimosa caesalpiniifolia(ミモザ)は、ブラジル北東部原産の多年生早生植物で、再生能力が高く乾燥に強いことが特徴である。ミモザは、500種以上からなるマメ科の植物に属す。興味深いことに、伝統医学に用いられるほか、主に乾季に家畜の栄養源となったり、丈夫で耐性のある木造建築の材料として利用されている。Silvaら(2014)[189]は、ラットのカドミウム媒介ストレスに対するミモザ抽出物と酢酸エチル画分の予測されるポジティブな役割を調査した。Cd(1.2mg/kgb.w.のCdCl2を15日間)に曝露したラットは、酸化ストレスの上昇により、末梢血細胞および肝細胞のDNA損傷を受けた。ミモザのアルコール抽出物は、酢酸エチル抽出物(62.5 mg/kg/day)と同様に、62.5および125 mg/kg/dayでカドミウムによる遺伝毒性を著しく減少させ、カドミウム汚染下のDNA完全性維持に対する保護効果を示唆した。
3.4.6.スピルリナプラテンシスエキス
強い抗酸化作用と抗炎症作用を特徴とする単細胞藻類Spirulina platensisは、淡水域で生育し、食料源として利用されている。S. platensisは、肝保護作用、抗変異原性を持ち、鉄分やビタミンが豊富で貧血を抑えるなど、治療効果が高いことが分かっている。さらに、重金属毒性を軽減し、体内の腎毒性化合物を無毒化する能力もある。Alyら(2018)[190]は、S. platensis抽出物を用いて、ラットのCd誘発染色体異常およびDNA損傷に対する効果を調査した。Cd(3.5mg/kgb.w.のCdCl2を2mLの蒸留水に溶かし、60日間)の毒性効果は、ISSR-PCR分析により、いくつかのDNA塩基対の著しいDNA断片化、削除、消失、出現などの様々な遺伝子障害を明らかにした。さらに、カドミウム添加により、染色体数の減少、染色体の断片化、リング形成、染色体の欠失、二動原体染色体の発生が誘発された。さらに、S. platensis抽出物(1 g/kgを5 mLの蒸留水に溶解)を投与したラットの骨髄およびISSR-PCR分析では、染色体異常の数の減少およびDNA全体の安定化により、カドミウムによる遺伝子欠陥が著しく減少することが明らかになった。本研究の結果は、S. platensisエキスがCd由来の遺伝毒性からラットを保護することを示すものである。
3.4.7.紫ニンジン抽出物
ニンジン(Daucus carotaL.)の品種は、人間だけでなく動物の栄養学的にも最も経済的に重要な作物の1つに世界的に属している。ニンジンの根の色には、いくつかの種類がある。タップルートの色の違いは、一般的に作物の組成の違いと関連している。赤ニンジンはリコピンを含み、黄ニンジンはルテインを多く含み、オレンジニンジンはαおよびβ-カロテンを豊富に含み、一方ポリフェノール、主にアントシアニンはニンジンの紫色に典型的である。Claudioら(2016)[191]は、1.2 mg/kg b.w.CdCl2の単回腹腔内注射によってラットをCdに曝露し、同時に注入した400および800 mg/L濃度の紫ニンジンの抽出物が曝露動物の多臓器におけるCd媒介性変化を低減するかどうかを15日後に分析した。病理組織学的切片では、カドミウム添加による肝臓組織の変性が確認され、紫ニンジン抽出物処理により有意に改善された。同様に、コメットおよび小核アッセイにより、血液および肝細胞におけるカドミウム誘発の遺伝的変化の除去を示し、エキスのポジティブな効果が観察された。さらに、カドミウムによる肝細胞のCuZn-SODおよびシトクロムC遺伝子発現の低下と8OHdGレベルの上昇は、紫ニンジンエキス処理により改善された。このことから、紫ニンジンのエキスは、カドミウムによって引き起こされる遺伝毒性、酸化ストレス、組織変性からラットの複数の臓器を保護する能力があることが示唆された。
3.4.8.ブドウ種子エキスとブドウ種子プロアントシアニジン
ブドウ(Vitis viniferaL.)は、人間が果実として食べたり、ワインとして加工したりするブドウ科の植物である。ブドウ種子エキス(GSE)の原料となるブドウの種子には、カテキンやエピカテキン、ガロカテキン、エピガロカテキンの2量体、3量体などのオリゴマーを含む天然ポリフェノール化合物が豊富に含まれている。これらの物質は、フラバノールやフラバン-3-オールに属するプロアントシアニジンや縮合型タンニンの一種である。プロアントシアニジンは、抗酸化作用、抗菌作用、抗ウイルス作用、抗腫瘍作用、抗血栓作用、抗炎症作用、抗毒性作用などを有することから、薬理学的に重要な物質とされている。さらに、動脈硬化、大腸がん、胃潰瘍、白内障、糖尿病、前立腺の酸化ストレスの緩和などの効果が報告されている。ブドウ種子プロアントシアニジン(GSP)は、最も効率的な抗酸化物質の一つであり、抗酸化状態の維持と炎症性メディエーターの移動を排除することによって、細胞を酸化的損傷から守る。GSPは、ビタミンC、ビタミンE、β-カロテンと比較して、より強力な抗酸化作用を有していることが知られている。カドミウム毒性に対するGSEとGSPの効果を分析するために、いくつかの研究が行われている。192,193,194,195]により、カドミウムによるラット精巣への毒性およびGSEまたはGSP処理の影響に関するさまざまな側面が研究されている。カドミウム(CdCl2 2.5 または 5 mg/kg b.w.、4 週間または 3 ヶ月)に曝露されたラットは、PI3K/Akt 依存経路を通じて細胞保護分子 Nrf2/HO-1の発現低下により酸化ストレスマーカーを示し、精巣機能不全に至った。これは、シトクロムP450コレステロール側鎖切断酵素、シトクロムP450 17A1,3β-ヒドロキシステロイドデヒドロゲナーゼ(3β-HSD)、17β-HSD、アンドロゲン受容体、ステロイド生成急性調節タンパク質、卵胞刺激ホルモン受容体などのステロイド生成関連遺伝子のmRNA発現レベルの著しい低下によって明らかになった[190、192]。さらに、CdCl2(2.5または5 mg/kg b.w.、それぞれ48時間または30日間)をラットに曝露すると、アポトーシス細胞数の増加、平均精細管径の減少や上皮内層の不整配列、精巣混雑、浮腫、精原細胞の変性による精子形成障害といった精巣組織構造の変化が見られた[192, 194]。重要なことは、GSEとGSP(100-400 mg/kg b.w.)を投与すると、カドミウムによるラット精巣の障害が正常化し、カドミウムによる精巣毒性に対する保護機能があることが示唆された。
カドミウムのラットへの影響を調べた他の研究では、脳、膵臓、前立腺に悪影響があることが示された。飲料水中のCdCl215 mg/kg b.w.を3カ月間投与した場合の大脳の変性は、病理組織学的に脳血管の線維化および空胞化を示すことで実証された。さらに、莢膜細胞は衛星化し、脳細胞のMDAレベルは増加し、MAO-A、アセチルコリンエステラーゼ、GRは減少し、アポトーシス指標であるbcl-associated X(Bax)タンパク質の発現は劇的に増加した[196]。Bashirら(2016)[197]は、膵臓に対する酸化ストレスの上昇を通じたCd誘発(5 mg/kg/日b.w.、4週間)毒性に言及した。Cd中毒ラットの膵臓は、アポトーシスマーカー(cleaved Caspase-12/9/8/3)のレベルが上昇し、細胞保護分子Nrf-2とHO-1のレベルの低下によって示される酸化ストレスに苦しみ、TNF-α、IL1β、IFN-γなどの炎症性サイトカインのレベルが上昇したことからアポトーシスの兆候を見せた。病理組織学的顕微鏡写真では、外分泌腺に侵入した不規則な形の膵島が見られ、特に膵島の中心部では、ほとんどの膵島細胞が細胞質変化を示していた。同様に、カドミウムに暴露されたラットの前立腺は、著しい機能および構造の障害を示した。Leiら(2017)[198]が示すように、CdCl2(飲料水中60 mg/L、20週間)を投与した動物の前立腺におけるMDA、NO、還元/酸化グルタチオン、および酵素的抗酸化能のレベルの変化は、その酸化ストレスの増強を表示した。さらに、Cd添加により、前立腺のトランスフォーミング成長因子β1(TGF-β1)レベルの上昇、Smad3のリン酸化(p-Smad3)、Smad7、Nrf-2、HO-1、γ-GCLC、miR-133a/bレベルの低下、前立腺線維化の引き起こされた。GSEまたはGSP(100-400 mg/kg b.w.)をすべての実験条件でラットに投与すると、生体の抗酸化能が向上し、分析組織の組織学的外形が正常化したため、カドミウムによる変化が抑制された。さらに、マウスを用いた実験では、5 mg/kg b.w.CdCl2を30日間曝露すると、SOD および GSH-Px 活性が阻害され、腎臓のMDA 量が増加し、腎機能障害が生じ、Bax および Bcl-2の発現レベルが上昇して腎細胞のアポトーシスが示唆された[199].興味深いことに、カドミウムを介した酸化ストレスは、ハイイロニワトリの受精卵のE6.5で3μgのCdCl2を注入すると、胚日E17.5でStra8、Spo11、Scp3、Dmc1などの減数分裂特異的マーカーの発現障害によって示されるように、鶏の卵形成中の減数分裂進行を変更した[200]。重要なことは、GSP(それぞれ50 mg/kgまたは150 μg)を投与すると、カドミウムが引き金となった腎臓の酸化的損傷と生殖障害が軽減されたことである。これらの結果は、GSEとGSPがカドミウムを介した毒性に対して優れた保護効果を発揮することを示している。
4.結論
カドミウムの生物への曝露は、曝露量、曝露時間、モデル系によって様々な有害作用がある。カドミウムの影響を受けた植物は、成長遅延、光合成能力の変化、活性酸素の発生亢進による酸化ストレス、酵素的および非酵素的抗酸化システムの機能変化などを示す。さらに、単細胞の微生物や細胞株においても、カドミウムに由来する恒常性維持機能の破壊が顕著に見られた。カドミウムに暴露された細胞は、イオノームバランスが崩れ、酸化ストレスにより膜脂質が過酸化され、細胞形状の変化を引き起こし、成長障害につながった。水生動物および陸生動物は、主に汚染された環境からカドミウムの負の影響を受けている。水生動物では、汚染された水によるカドミウムの蓄積がより顕著に危険であり、カドミウムを介した酸化ストレスが臓器障害や免疫毒性につながり、血液、腎臓、肝臓の毒性を引き起こす。陸上動物モデル系では、カドミウムを介したストレスによる組織毒性や障害が主で、肝毒性、神経毒性、生殖系、腎臓、骨、心毒性などが見られる。
カドミウムに由来する変化の大部分は、抗酸化防御システムの破壊と関連しており、ひいては酸化ストレスにつながる。そのため、カドミウムが生体に与える影響を軽減するための戦略を適用する必要がある。健康増進に役立つ食品に豊富に含まれる生物学的活性物質、特に抗酸化栄養素がカドミウムの毒性を除去する役割を果たすため、最も有望な戦略の1つは食品供給システムを表している。
上記の知見は、カドミウム曝露によって変化した生体、特定のオルガネラ、または細胞機能を、主に抗酸化作用や金属キレート能を有する生理活性物質を用いて維持することを説明した研究のごく一部である。抗酸化作用を有するビタミン類(C、Eなど)、微量元素(Zn、Mg、Se、Mn、Caなど)、天然由来の化合物、フィトケミカルは、生理活性物質の許容量によって軽減効果が制限される可能性はあるものの、カドの細胞毒性作用を効率よく防止または軽減する。したがって、単一の分子ではカドミウム毒性を完全に抑制することはできないため、複数の生理活性物質を含む混合物を投与することが、カドミウム毒性に対するより効果的な戦略として機能することが想定される。