Contents
スピロノラクトン
スピロノラクトンによるミネラルコルチコイド受容体のブロックは、重症COVID-19病における幅広い治療作用を有する可能性がある
ccforum.biomedcentral.com/articles/10.1186/s13054-020-03055-6
肺レニンアンジオテンシン(Ang)系(RAS)は、そのバランスが肺の恒常性維持に重要な2つの経路から構成されている。内皮ACEは血管収縮と抗炎症作用を促進するためにAT1受容体に作用してAng IIを生成し、一方、上皮ACE2は血管拡張作用と抗炎症作用を発揮するためにMas受容体に作用してAng IIを切断してAng1-7に変換する。ACE依存性の優位なAng II形成へのシフトは、様々な形態のARDSにおける重要な病態生理学的機序であると推測されている[1]。
SARS-CoV-2は、肺のACE2をその細胞受容体として使用し、ACE2の分解とACE/ACE2の不均衡をもたらし、重度のCOVID-19病では、Ang IIが媒介する血管炎症と肺損傷を引き起こす可能性がある[1]。さらに、Ang IIはアルドステロンの放出を誘導し、これはミネラルコルチコイド受容体活性化を介して血管障害をさらに促進する可能性がある[2]。
アルドステロンはまた、ミネラルコルチコイド受容体を発現する免疫細胞にも複数の作用を及ぼす [3]。ミネラルコルチコイド受容体活性化は、マクロファージをM1プロ炎症性表現型へと分極化させる。
リンパ球では、ミネラルコルチコイド受容体の活性化は、炎症を起こすプロ炎症性のTh17 CD4+細胞と細胞傷害性のIFNγ+-CD8+ T細胞の分化を促進する(図1)ことから、免疫細胞におけるミネラルコルチコイド受容体の活性化が高炎症性プロファイルを促進することが示されている[3]。特に注目すべきは、Th17 T細胞の増加と高いCD8+細胞毒性がCOVID-19 ARDSを特徴づける高炎症状態に関与していることが提案されていることである[4]。
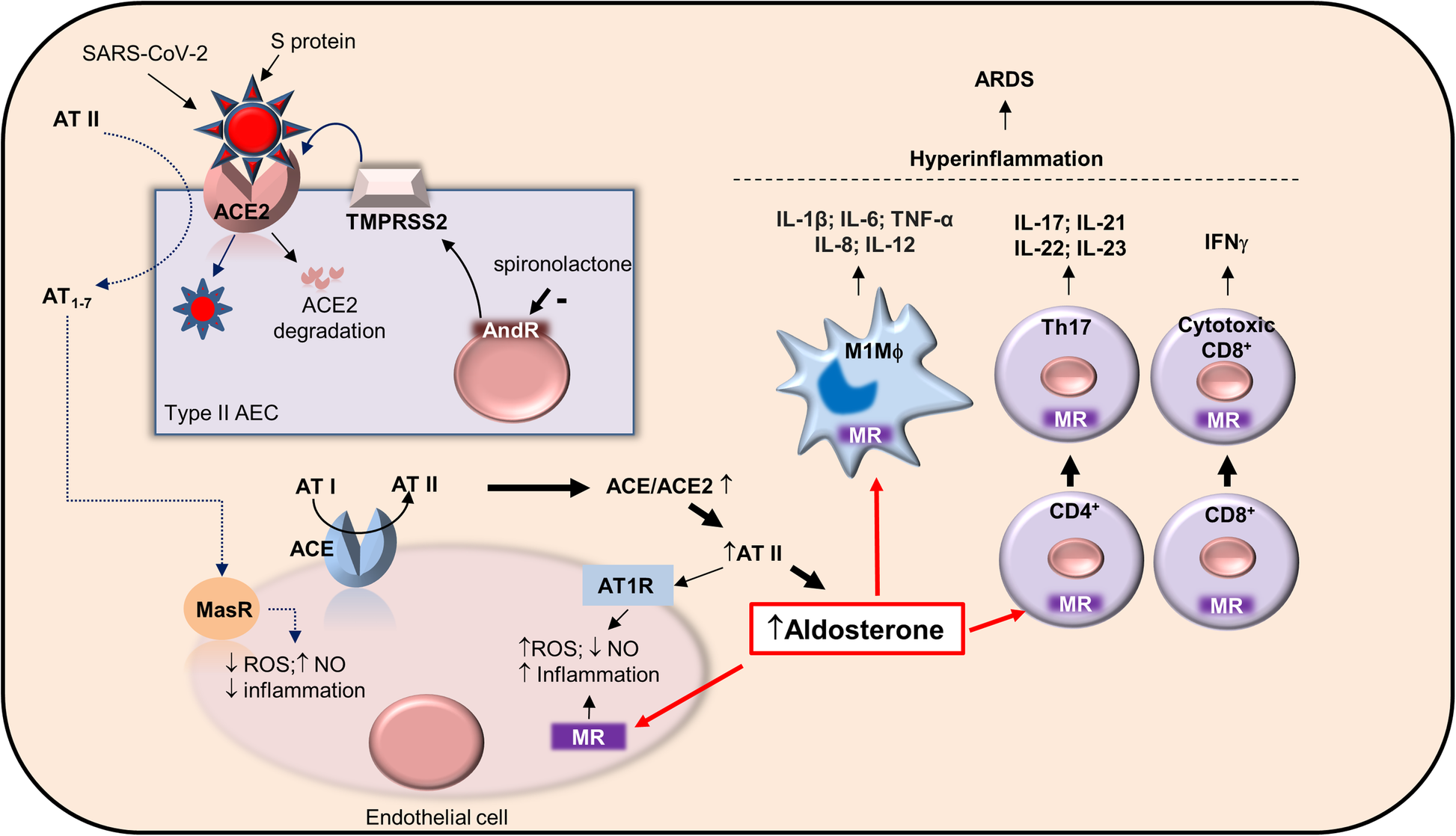
図1に示すように、COVID-19 ARDSは、Th17 T細胞の増加とCD8+細胞の細胞傷害性の亢進を特徴としている。COVID-19 ARDSにおけるスピロノラクトンの潜在的な薬理作用の部位。SARS-CoV-2は、そのスパイクSタンパク質とACE2受容体との相互作用を介してII型肺胞上皮細胞(II型AEC)に感染し、ACE2の内部化と分解、および肺ACE/ACE2アンバランスを促進する。
これにより、アンジオテンシンII(AT II)のアンジオテンシン1-7(AT1-7)への分解が阻止され(点線)、Mas受容体(MasR)を介した抗炎症性シグナル伝達が減少し、血管内皮細胞におけるアンジオテンシン受容体I型(AT1R)を介したプロ炎症性AT IIシグナル伝達が促進される。AT IIの増加はアルドステロンの形成をもたらし、これはミネラルコルチコイド受容体を介してシグナルを発し、血管炎症と免疫細胞の活性化をもたらする。
ミネラルコルチコイド受容体の活性化は、マクロファージをM1プロ炎症性表現型(M1Mϕ)へと分極させ、CD4+リンパ球をプロ炎症性Th17細胞へと分化させ、細胞傷害性IFNγ+CD8+リンパ球を誘導する。
炎症亢進状態の発現はARDSの引き金となる可能性がある。スピロノラクトンによるミネラルコルチコイド受容体阻害は、アルドステロンの劇症的な作用を中断させる可能性がある。さらに、スピロノラクトンは抗アンドロゲン作用を介して、ACE2との相互作用のためにSタンパク質のプライミングを行うセリンプロテアーゼであるTMPRSS2の発現を減少させる可能性がある。
アルドステロンを介した ミネラルコルチコイド受容体 活性化を伴う RAS シグナルの調節障害は、SARS-CoV-2/ACE2 相互作用と炎症性肺障害との重要な関連性を示しており、RAS 阻害薬、特に ミネラルコルチコイド受容体 アンタゴニストの興味深い治療法の可能性を示唆している[1]。
しかし、RAS阻害剤はACE2発現を増強する可能性があり、これはSARS-CoV-2の感染性に影響を与える可能性があるため、この治療戦略の欠点となる可能性があると主張されている[1]。
抗アンドロゲン作用
重要なことは、他のRAS阻害薬とは対照的に、ミネラルコルチコイド受容体アンタゴニストであるスピロノラクトンもまた、有意な抗アンドロゲン作用を有していることである[5]。
このような作用は、SARS-CoV-2感染において、ウイルスSタンパク質に対するプライミング効果を介してウイルスの侵入に重要な膜貫通型プロテアーゼであるTMPRSS2のアンドロゲン依存性の発現を阻害することにより、特に有用であると考えられる[5]。
したがって、ミネラルコルチコイド受容体アンタゴニストおよびアンドロゲン阻害剤としての二重の作用により、スピロノラクトンはCOVID-19 ARDSに大きな利益をもたらす可能性がある。当然ながら、スピロノラクトンの主要な作用(肺水腫の減少)もCOVID-19 ARDSにおいて有益であろう。
したがって、スピロノラクトンの薬理学的作用を組み合わせることで、COVID-19 ARDSの後期に適用した場合、スピロノラクトンが治療上の有益性をもたらすのではないかという仮説を立てた。治療の可能性を評価するために臨床試験が必要となるかもしれない。
SARS-CoV-2 ARDS患者におけるスピロノラクトンの使用
アンジオテンシンII(AT-II)は、局所的にも全身的にも無数の効果を持っている。肺胞AT-IIレベルの相対的な増加は、肺血管収縮、毛細血管透過性の増加、強化された線維化、最終的にはサイトカインストームをもたらす。また、ロバストな全身性血管収縮因子であり、アルドステロン産生の主要な誘導因子でもある(2)。
SARS-CoV-2 ARDSでは、低酸素血症に加えて、高ナトリウム血症や低カリウム血症もよくみられる(3、4)。ウイルスの病原性と、AT-IIレベルの上昇による二次的な高アルドステロン血症が転帰の原因となっている可能性がある(5, 6)。
スピロノラクトンはアルドステロン拮抗薬であり、抗炎症作用もあり、心疾患に広く用いられている(7, 8)。SARS-CoV-2患者では、電解質のアンバランスが深いため、フロセミドのような利尿薬はほとんど価値がないかもしれない。一方、スピロノラクトンはこのアンバランスを逆転させる(9)。
プローニング、神経筋ブロック剤の使用、水分制限に加えて、スピロノラクトンの投与を選択し、酸素化の点での改善が観察された。無作為化比較試験(NCT04345887)が進行中であり、この問題に対する答えが近いうちに得られるかもしれないと考えている。
スピロノラクトンはSARS-CoV-2からの保護を提供する可能性がある
アンドロゲン、アンジオテンシン変換酵素2(ACE2)、およびレニン-アンジオテンシン-アルドステロン系(RAAS)を標的とした場合
Spironolactone may provide protection from SARS-CoV-2: Targeting androgens, angiotensin converting enzyme 2 (ACE2), and renin-angiotensin-aldosterone system (RAAS)
要旨
コロナウイルス病19(COVID-19)では、4つの主要な因子が予後の悪化と相関している:加齢、高血圧、肥満、アンドロゲンホルモンへの曝露。アンジオテンシン変換酵素2(ACE2)受容体、レニン-アンジオテンシン-アルドステロン系(RAAS)の調節、および膜貫通型セリンプロテアーゼ2(TMPRSS2)の作用は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)細胞の侵入および感染に重要である。ACE2発現およびRAASは高血圧および肥満において異常であり、一方、TMPRSS2はアンドロゲンに曝露された場合に過剰発現しており、これらの因子がCOVID-19において過剰発現している理由を正当化する可能性がある。
SARS-CoV-2の治療標的の中で、私たちは、古くから使用されている安全なミネラルコルチコイドアンドロゲン受容体拮抗薬であるスピロノラクトンが、降圧作用、心保護作用、腎保護作用、抗アンドロゲン作用を有し、COVID-19からの保護を目的とした様々な部位で多元的な作用を発揮するのではないかと考えた。
現在のデータは、スピロノラクトンが同時に異常な ACE2 発現を緩和し、膜に付着した ACE2 と遊離循環 ACE2、およびアンジオテンシン II とアンジオテンシン-(1-7)(Ang-(1-7))の間のバランスを修正し、アンドロゲン媒介 TMPRSS2 活性を抑制し、肥満に関連した RAAS 機能障害を抑制し、その結果、ウイルスのプライミングを減少させることを示している。したがって、スピロノラクトンは、SARS-CoV-2からの保護を提供する可能性があり、特にCOVID-19の初期段階で臨床試験を行うのに十分な信憑性を有している。
序論
SARS-CoV-2 の特定の特徴は、長いウイルス脱落(平均 20 日間)[1] と潜伏期間(最大 11 日間)[2]、複数の無症候性感染の存在[1]、[2]、[3]、および表面やエアロゾル中での長期生存を含む、ウイルス競合政策の相対的な不成功を説明する可能性がある。
予備的なデータではあるが、SARS-CoV-2の予後不良と非定型的に相関する3つの主要因子、すなわち高血圧、肥満、アンドロゲンホルモンがあるという事実は、一貫したデータからは明らかにされていない。
実際、2型糖尿病(2型糖尿病M)(16.2%)や既往の冠動脈性心疾患(5.8%)と比較すると、年齢1年あたり約10%のリスク上昇に加えて、COVID-19による急性呼吸窮迫症候群(ARDS)患者では、高血圧だけが過剰に存在するようである[4], [5]。肥満や2型糖尿病Mを含むメタボリックシンドロームの有病率が欧米に比べて低い中国では、高血圧がSARS-CoV-2の最強のリスク予測因子として浮上した[6]。
肥満はさらにSARS-CoV-2の重要な危険因子として同定されており、パンデミックが拡大した後、肥満の有病率が高い国で顕著になっている。しかし、高血圧はCOVID-19の肥満患者における呼吸器重篤症状の独立した危険因子として残っており、肥満が高い地域のCOVID-19集中治療室(ICU)では依然として優勢であった。
強力な疫学的データはまた、アンドロゲンが SARS-CoV-2 感染性および病原性に直接関連しているという仮説を支持している。女性に比べて男性における重度の COVID-19 の発生率が大きいことは、代謝性疾患(肥満、2型糖尿病M、高血圧)の有病率の違いによって完全に正当化されているわけではない。したがって、思春期前の子供は、この集団がアンドロゲンにさらされていなければ、SARS-CoV-2感染からの必須の保護を示している。さらに、ジヒドロテストステロン(DHT)活性およびアンドロゲン受容体(AR)調節および感受性の間接的なマーカーであるハゲは、COVID-19でARDSを発症する男性において特に存在することが臨床的に観察されている。
アンジオテンシン変換酵素2(ACE2)受容体および膜貫通型セリンプロテアーゼ2(TMPRSS2)の存在は、SARS-CoV-2細胞の侵入に必須であり、ACE2およびTMPRSS2の発現は、その感染性を調節する可能性がある。ACE2およびTMPRSS2の発現異常は、高血圧および肥満、およびアンドロゲンへの曝露におけるそれぞれの発現異常が、最近の理論[7]、[8]、[9]、[10]によって提案されているように、これらがCOVID-19の危険因子である理由を正当化するのに役立つかもしれない。ACE2およびTMPRSS2の発現変化は、レニン-アンジオテンシン-アルドステロン系(RAAS)およびアンドロゲンアンタゴニストとしての作用により、スピロノラクトンおよび他のミネラルコルチコイドアンタゴニストによって同時に対処することができ、SARS-CoV-2に対する保護の可能性を提供する。感染時期に応じたCOVID-19の主な特徴を図1に示する。
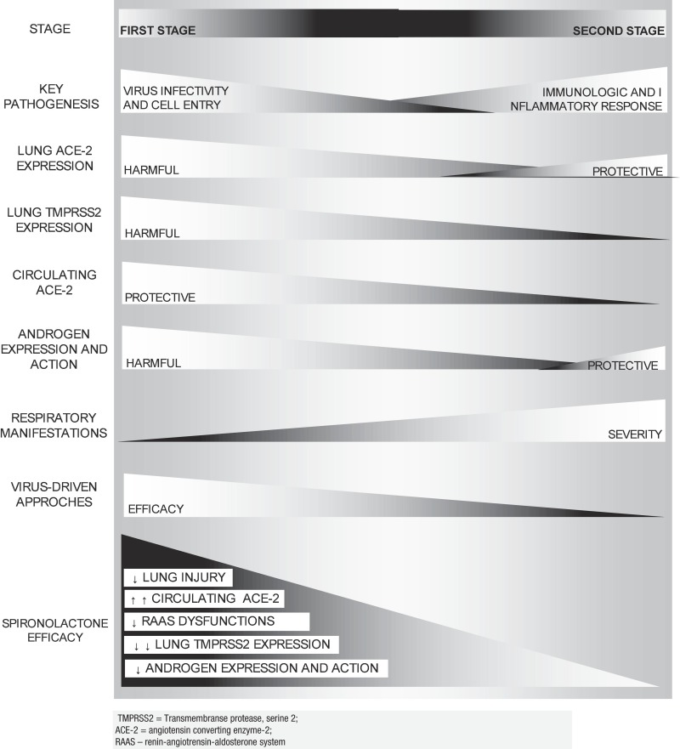
図1. COVID-19 ステージ、主要な特徴、ACE2発現、アプローチ。
仮説
スピロノラクトン。多目的薬でSARS-CoV-2からの防御が可能か?
1959年から使用されている安全な降圧・抗アンドロゲン薬であるスピロノラクトンは、ミネラルコルチコイド受容体(MR)に拮抗することにより、カリウムを節約する利尿薬として作用し、RAASやACE2の発現パターンを良好に示す傾向があり、抗アンドロゲン作用によりTMPRSS2の活性を低下させ、多動性作用により急性肺障害を予防する可能性があると考えられる。我々は、肥満、ハゲ男性(TMPRSS2発現が亢進している)、高血圧症など、重度のCOVID-19のリスクが最も高い集団のいくつかに対して、スピロノラクトンが保護を提供するという仮説を立てている。
仮説の評価
COVID-19におけるACE2発現:なぜ高血圧と肥満が危険因子なのか?
COVID-19における高血圧に関連した非定型的なリスクの増加が、それ自体が高血圧に由来するのか、血圧上昇の組織への影響に起因する二次的な肺の変化に起因するのか、あるいは高血圧に関連した予期せぬリスクが、実際に抗高血圧薬の特異的なクラスへの慢性曝露の影響に二次的に起因するのかどうかは、不明である。
アンジオテンシン変換酵素阻害薬(ACEi)またはアンジオテンシン受容体拮抗薬(ARB)[11]、[12]、[13]を服用している高血圧患者の割合が多いことが、高血圧におけるCOVID-19の特異的な重症度を正当化する主な基礎的メカニズムであると仮定されている。これはRAASに内在する作用により、肺内皮における表面接着型ACE-2の利用可能性を間接的に増加させ、COVID-19の初期段階ではSARS-CoV2とACE-2の結合が強化され、その結果、COVID-19の細胞侵入が促進される可能性がある。しかしながら、ACEiおよびARBとCOVID-19の重篤な症状のリスクの増加との間に相関関係があるという最初の報告にもかかわらず、システマティックレビューおよびメタアナリシスを含む更なる知見は、これらの相関関係を実証することができなかった [14], [15], [16]。
ARBとACEiはCOVID-19に関連する転帰について一貫性のない知見を開示しているが、高血圧がそのコントロールにかかわらず、COVID-19重症化の重要かつ独立した危険因子であることが示されているという事実は、まだ説明されていない。HbA1cに基づくコントロールの程度がCOVID-19転帰を予測する糖尿病とは異なり、高血圧は同様の相関を示さず、これはさらなる解析のために考慮されるべきである[5]。
肥満に関連したCOVID-19の重症度を正当化するために提案されている複数のメカニズムのうち、RAASシステム、ACE2の発現および活性の破壊、高血圧性および親炎症性アンジオテンシンIIおよびアンジオテンシン受容体-1(AT1)軸と、抗炎症性アンジオテンシン-[1-7]およびそのG共役型受容体であるMas受容体との間のバランスが、この集団におけるSARS-CoV-2感染性の特異的増加を説明している可能性がある。
高血圧と肥満は、SARS-CoV-2感染症の発症には、機能障害に関連したRAAS異常が重要であることを示す2つの主要な代表的なものである。
ACE2の発現に関しては、膜接着型ACE2は、RAASおよびCOVID-19におけるそれらの役割が異なる可能性が高いため、自由に循環するACE2と区別されるべきである。膜型ACE2は、特に肺、腎臓、心臓、精巣、腸などで広く発現しているが [17], [18], [19], [20] 、循環型ACE2のレベルは低く、肺での機能的役割は生理的条件下では臨床的にはあまり関係がないようである [21]。生理的条件下での臨床的関連性についての議論にもかかわらず、肺の上皮II型細胞が体内のACE2発現の最大80%を占めるという事実は、ACE2の参加を必要とする病態において臨床的に重要である[22]。実際、ACE2発現の欠如は、SARS-CoV感染に対する完全な抵抗性をもたらした[23]、[24]。特に、SARS-CoV2の受容体結合ドメイン(RBD)は、同じファミリーからの他のウイルス感染と比較して、アンジオテンシン変換酵素2(ACE2)とのより強い相互作用を有しており[25]、[26]、[27]、[28]、[29]、そしてACE2の発現の増加は、細胞に侵入するウイルスの能力を潜在的に増幅させる可能性がある。
付着したACE2の発現および利用可能性は、ウイルス複製の第一段階においてCOVID-19の重症度と直接相関しているが、ACE2の遊離循環形態は、SARS-CoV2と結合し、肺内皮におけるウイルスの侵入を妨げる可能性がある。組換えヒト可溶性ACE2がCOVID-19の重篤な症状、ARDS、および死亡の発生に対する保護的役割を果たす可能性があるという仮説が立てられてきたが、これはコロナウイルス誘発性肺損傷の予防における組換えACE2の有益な効果によって臨床的に実証されている[30]、[31]、[32]、[33]、[34]。生理的条件下では、循環血漿中のACE2は、膜に付着したACE2をSARS-COV2との結合から保護するのに十分なレベルでは存在しないかもしれない[30]。しかし、可溶性ACE2や血漿中のACE2濃度を上昇させる薬剤などの特定の条件下では、ACE2の保護作用が重要になる可能性がある。したがって、付着した ACE2 の利用可能性および発現と、自由に循環している ACE2 との間の推測的な比率は、COVID-19 の肺病原性を予測することができるが、この比率を評価する方法は現在までに開発されておらず、妥当性が確認されていない。したがって、前述したように、血漿中と膜中の ACE2 の違いを無視してはならない。
ACE2発現の異常とともに、別の仮説として、アンジオテンシンIIとアンジオテンシン1-7のレベルと効果の間のアンバランスが、臨床症状の重症化にも関与していると仮定している[35], [36], [37]。
COVID-19期間中の様々な臓器におけるACE2の発現および活性に関する高いレベルの不確実性のため、ACE2とCOVID-19重症度との間の相関に関する仮説は、肥満および高血圧の過剰発現と一致する疫学的データから作成されるべきである。図2は、生理的、未治療の高血圧、異なる薬物クラスの使用、および高アンドロゲン血症の異なるシナリオの下での(SARS-CoV-2の感染と複製)第1段階の仮説モデルを描いている。

図2. COVID-19の第1期、SARS-CoV-2細胞感染・複製期における提案シナリオの簡略化された仮説モデル。
重症COVID-19における男性の過剰発現を説明するアンドロゲン駆動説
SARS-CoV-2に対するアンドロゲンの影響に関する臨床データがないにもかかわらず、その強力な機序論的妥当性とそれに対応する疫学的データは、アンドロゲンを媒介とするSARS-CoV-2感染の理論的根拠を提供している[8]。
アンドロゲン調節型膜貫通プロテアーゼセリン2(TMPRSS2)は、ウイルスのスパイクタンパク質とウイルス細胞の侵入のためのACE2受容体を切断する重要な酵素である[8]。雄マウスはSARS-CoV感染に対して極めて脆弱であることが知られている[38]。
最近のアメリカのデータでは、非常に生産性の高い年齢層(40~49歳)では6倍以上の男性死亡者数、30~49歳では約2倍以上の男性入院者数という劇的な差が示されている[39]。
肺のII型肺炎球へのSARS-CoV-2の侵入は、アンドロゲンによって駆動される [8], [9], [10]。この理論は、女性および思春期前の被験者がCOVID-19 ARDSから比較的保護されているという知見を説明している。興味深いことに、1歳未満の乳児はCOVID-19の合併症のリスクが増加している可能性があり、これはミニ思春期の発生、すなわちこの年齢でのアンドロゲンの一過性の発現と一致している。著者らの報告では、アンドロゲンを媒介としたCOVID-19病の分子機構について詳細な仮説を提示している。その中で、ステロイド性アンドロゲン受容体競合阻害薬であるスピロノラクトンは、安全で効果的な代替薬として挙げられている。図2は、高アンドロゲン状態におけるCOVID-19の第一段階の仮想シナリオを示している。
アンドロゲン遮断薬がどのように生存に影響を与えるかについての前臨床データに大きな関心があるが、非ステロイド性アンドロゲン受容体遮断薬のフルタミドは、実験モデルの男性マウスでSARS-CoVの致死量からの生存を示した唯一の薬剤であった[40]。レムデシビルのような他の薬剤は雄性マウスの生存率を示すことができず、雌性マウスの解析に基づいて結論を出している[41]。
仮説の結果と考察
スピロノラクトン:SARS-CoV-2からの保護を提供する可能性のある多目的薬
スピロノラクトンは、現在、カリウムを節約する利尿薬クラスの主要な代表であり、正常な血圧を維持するためにACEiおよびARBと同様に効果的であり得る[42]、[43]、心機能に対処し、心臓および腎臓の保護を提供する[44]、[45]、[46]、[47]、[48]、[49]。肺膜付着型ACE2発現を特異的に増加させるACEiおよびARBとは異なり、スピロノラクトンは、膜付着型ACE2と比較して循環型ACE2のより広範な増加を含むACE2発現の好ましいパターンを示す傾向があり、SARS-CoV-2におけるその潜在的な保護的役割を強化している。一旦血漿ACE2がSARS-CoV-2に結合して細胞内への侵入を回避する可能性があり[50]、[51]、[52]、[53]、[54]、[55]、そして男性の性的去勢の有害事象を伴わずに、抗アンドロゲン活性によりアンドロゲン媒介のTMPRSS2をダウンレギュレートする可能性がある[56]、[57]、[58]。さらに、スピロノラクトンは、脂肪組織によるアンジオテンシノーゲン産生の増加およびアンジオテンシン-2-AT-1軸へのアンバランスによるRAASの過剰活性化を含む、RAASに対する肥満の有害な影響を緩和することが実証されている[58], [59], [60], [61], [62], [63], [64], [65]。肥満に関連したCOVID-19の合併症を減少させる可能性があり、肺において直接的な特異的抗炎症効果を有し、急性肺損傷を減少させる可能性がある[66], [67], [68], [69], [70], [71], [72], [73]。
注目すべきことに、スピロノラクトンは主にCOVID-19の第一段階の特徴である細胞内へのウイルスの侵入を標的とするので、スピロノラクトンは、SARS-CoV-2活性が二次的になり、悪化した炎症反応がCOVID-19によって誘発されたARDSの原因であるときに、呼吸器症状の合併症の前に、感染の初期段階で投与されるべきである。
議論
現在のCOVID-19パンデミックは、その経過と死亡率を変えるための迅速な対応が求められている。対応する疫学データおよび危険因子の同定に合致するSARS-CoV-2細胞の侵入および感染のメカニズムの学習は、COVID-19から保護するために提案された薬剤の有効性に関するより正確な予測を可能にした。
現在の選択肢の中で、研究者は、好ましくは、これらの分子に内在する5つの主要な理由のために、長く使用されている既存の薬剤、すなわち、COVID-19のための古い薬剤を再利用することに焦点を当てるべきである。1. 1.これらの薬剤の短期および長期の安全性プロファイルが知られているのに対し、新しい分子とのより長い研究の後にのみ得ることができる; 2.リスクが知られている、これは、直接モニタリングを可能にし、可能にする、新たにリリースされた薬とは対照的に、特に非常に少数の大規模な集団でテストされているため、ほとんど知られている効果のために、多臓器、多リスクのモニタリングが推奨される; 3.禁忌が知られている、いくつかの禁忌が大規模な研究でのみ検出することができる中で、新薬の禁忌の意識の欠如とは対照的に、害を提示する可能性があるものへの使用を避ける; 4.臨床医は、臨床試験に精通している。4. 臨床医が旧薬の臨床管理(ポソロジー、リスク、禁忌、合併症のモニタリングなど)に精通していることは、感染者数の多さからCOVID-19を専門センター内で管理できないために望ましい。5. 特許を取得した新薬のコストは、公衆衛生システムでは手が届かず、費用対効果が高いとは考えられない。
COVID-19に対するこれらの薬剤の大量臨床使用には、上述した旧薬の利点が不可欠である。この点で、それらの使用に疑問を抱かせるような望ましくない害を引き起こす可能性のある他の代替品とは対照的に、スピロノラクトンは、確かな安全性、広範な有効性を提供し、そして、スピロノラクトンがCOVID-19で中枢的に影響を受けるそれらの器官、すなわち肺、心臓、および腎臓に対して積極的な保護を提供するという試験管内試験(in vitro)、生体内試験(in vivo)、および臨床的証拠を満たす強力な妥当性を有している。
さらに、本論文で実証されたように、現在提案されている薬剤の大部分は、COVID-19の第一段階であるSARS-CoV-2ウイルスの複製および拡散の間にのみ潜在的な保護を提供するのとは異なり、スピロノラクトンはCOVID-19の3つの段階すべてで保護を提供する可能性がある作用を実証している。それは、SARS-CoV-2の感染性を低下させ、ウイルスへの過剰反応としてのサイトカインおよび炎症性ストームを抑制し、COVID-19の第1期、第2期および第3期については、それぞれ肺、心臓および腎臓の傷害を緩和する可能性があるからである。
私たちには、大規模研究でのスピロノラクトンの採用を支持するのに十分なデータがあり、関連するリスクがないため、温情的使用のための経験的な代替品である[74], [75]。
視点と結論
ACE2 の異常発現、アンジオテンシン II およびアンジオテンシン 1-7 のアンバランス、アンドロゲン活性は、疫学的観察によれば、SARS-CoV-2 感染性の重要な調節因子であると考えられる。スピロノラクトンは,ACE2発現を調節してSARS-CoV-2細胞の侵入を直接的,間接的に回避し,アンジオテンシンII-AT-1軸の過剰発現による害を減衰させるアンジオテンシン1-7レベルの上昇を示し,また,抗アンドロゲン剤としてTMPRSS2活性を介してウイルスのプライミングを低下させる作用を有することから,スピロノラクトンはSARS-CoV-2の予防および早期治療薬として理想的な候補薬であると考えられた。

