コロナウイルス サイトカインストーム放出症候群
サイトカインストームの証拠はまだない
遺伝情報に基づいて、研究者は、SARS-CoV-2受容体結合ドメイン(RBD)の生化学的および構造的特性が、SARS-CoVと比較してさらに高いhACE2結合親和性を示すことを確認している。
予備的なデータによると、抗体反応は疾患プロセスの初期に始まり、症状の開始後5日以内にIgAとIgMが検出される。より深刻なケースでは、リンパ球減少症は深刻であり、重症度と死亡率に関連している。これは、アポトーシスの活性化の結果である可能性がある。
初期のトランスクリプトーム分析の1つは、p53シグナル伝達経路の活性化を示唆しているが、他の経路も関与している可能性がある。
呼吸不全または急性呼吸窮迫症候群を伴う重症患者のサブセットでは、少数の死後研究でも、グランザイムとパーフォリンの発現を伴うTh17細胞と活性化CD8 + T細胞の数の増加が示されている。
高レベルのフェリチンおよびIL-6を伴う、患者のサブセットにおける顕著なマクロファージ活性化の証拠もある
一部では、これは極端なケースがあり、ウイルスの引き金が頻繁にあるマクロファージ活性化症候群に似ているが、今回のウイルスは全身性の免疫活性化ではなく単に粘膜と関連している。
サイトカインストームの素因
pubmed.ncbi.nlm.nih.gov/32474885/
COVID-19感染時のMASとサイトカインストームの背景
武漢で最初に報告された患者では、MAS、サイトカインストーム、ARDSの発生は、非常に高いレベルの血清プロ炎症性サイトカインとフェリチンによって予告されていた。過去には、IL-6、IFN-α、CCL5、CXCL8、およびCXCL-10の有意に高い血清レベルも、重症のSARS-CoVまたはMERS-CoV感染症患者では、軽症の感染症患者と比較して検出された[24]。
MASの臨床的および検査室的特徴は、持続的な発熱、血清フェリチン、トリグリセリド値の上昇、汎血球減少症、線溶性消耗性凝固症、肝機能障害、脾臓腫などである。加えて、NK細胞活性の低または不在、sCD25とsCD163の血清レベルの上昇、および貪食細胞による赤血球、白血球、または血小板を含む血球の巻き込みとして定義されている血球貪食症の存在は、MASの診断をサポートしている[3]。
MASとCOVID-19感染に伴うサイトカインストームの二次的な素因となる因子を以下に述べる。
1. ウイルスクリアランスの障害
COVID-19感染における主な問題は、SARS-CoVおよびMERS-CoV感染のようなウイルスクリアランスの障害である。これらのウイルスは、宿主防御機構に対抗するためのいくつかの戦略を有している。
SARS-CoVやMERS-CoVは、PRRを持たない二重膜を持つ小胞を産生し、この小胞内で複製することが可能である[25]。これらの戦略は、抗ウイルス免疫応答およびウイルスクリアランスの障害につながる。PCR検査は陰性であるが、少なくとも2週間は肺胞細胞およびマクロファージ中にウイルス包接体が存在することは、ウイルスクリアランスの失敗の可能性を依然として支持する[14]。
2. I型インターフェロンの低レベル
もう一つの要因は、抗ウイルス応答およびウイルスクリアランスにおいて非常に重要なI型インターフェロンの低レベルである[21]。ウイルス核酸を認識する細胞タンパク質は、ウイルス感染時にインターフェロンを刺激することによって媒介される。
MDA5によるウイルスRNAの認識は抗ウイルス免疫に不可欠であり、MDA5の欠乏はヒトにおけるウイルス感染症の傾向を引き起こす[26]。MERS-CoVの付属タンパク質である4aは二本鎖RNAに結合し、MDA5の活性化とIFN誘導を阻害する[27]。1997年のH5N1インフルエンザ発生時に死亡した人々は、IL-6を含む高力価の循環性サイトカインに関連したリンパ組織の萎縮を示したことに注目すべきである[28]。
MERS-CoV感染では、同様の炎症性サイトカインの上昇と抗ウイルス性サイトカインの低下が観察された[29]。
3. 好中球細胞外トラップ(NET)の増加
好中球は、微生物の巻き込み、活性酸素種の形成、脱顆粒、抗菌薬の分泌だけでなく、NETsの形成を介してだけでなく、ウイルスを含む侵入病原体を殺すことができる。NETsは、主に宿主細胞へのダメージを最小限に抑えながら、細胞外病原体を結合し、殺す好中球からのDNAで構成される細胞外繊維のネットワークである[30]。
Barnesらは、剖検所見に基づいて、好中球がNETを利用したCOVID-19病因に寄与している可能性を示唆した。彼らはまた、ドルナーゼα治療がこの感染症の管理に有益である可能性を示唆している[31]。DNA断片の細胞外への移動は、ミトコンドリアDNAの放出と形質膜の破壊によるものと、NETosisとして知られるプロセスによって引き起こされるものがある。
NETosisは、アポトーシスや壊死とは異なるプログラムされた細胞死の一種だ。ウイルスRNAとproinflammatoryサイトカインは、NETsとNETosisの両方の形成を刺激する可能性がある。抗ウイルス免疫におけるNETsの正確な役割はまだ解明されていないが、それらはCOVID-19病因に寄与するかもしれない[30,31,32]。
4. その他のメカニズム。
ピロプトーシス
ピロプトーシスは、細胞内病原体への感染時に最も頻繁に発生し、抗菌応答の一部であるプログラム細胞死の高度な炎症性およびカスパーゼ-1依存性の形態である。急速な漿膜破裂と炎症性の細胞内内容物の放出を伴うピロプトーシスもCOVID-19の発症に関与している可能性があると考えられている。急速なウイルス複製による膿栓症の増加は、炎症性メディエーターの大量放出につながる可能性がある[33, 34]。
Liuらは、肺における炎症性単球/マクロファージ蓄積のプロモーターとしてのスパイク糖タンパク質に対する抗体(抗S-IgG)の重要性を強調した。彼らは、ウイルス特異的な抗体応答が病理学的変化を引き起こす可能性があり、それがウイルスが媒介する肺損傷の原因となる可能性があることを示唆した[35]。Golonkaらは、コロナウイルスの糖タンパク質Sタンパク質が構造変化を起こし、IgGのFc領域を介して宿主細胞に侵入するのではないかと推測している。言い換えれば、抗体に依存してウイルスの宿主細胞への侵入が促進されるメカニズムを提案している[32]。
フェロプトーシス
上述したように、血清遊離鉄濃度が高くなる原因の一つとして、血液代謝の破綻が考えられ、炎症の一因となっている可能性がある[8]。最近では、フェロプトーシスとして知られる鉄媒介細胞死が、病因雑多な疾患の一翼を担っていることが報告されている[35、36]。COVID-19の発病におけるフェロプトーシスの役割と治療標的としての位置づけを検討する必要がある。
一緒に考えれば、抗ウイルス免疫を回避するためのウイルス脱出機構は、宿主防御の遺伝的または後天的欠陥とともに、ウイルスクリアランスを損なう可能性があり、その結果、MASおよび不適切な免疫活性化が生じ、ARDSおよび多臓器不全を引き起こす可能性がある。疾患経過が無症状から致死的なものまで様々である理由は、遺伝的要因と宿主の要因によって説明できるかもしれない[37]。
このことは、一部の家族で死亡者数が多い理由も説明できるかもしれない。遺伝的要因も初発HLH/MAS症例では役割を果たしていることから、HLH/MAS症例が頻繁に報告されている国と、重症で致死的なCOVID-19感染の頻度が高い国の両方を分析するためにメタ解析が行われた[38]。
興味深いことに、地理的分布は類似していることがわかった。原発性HLHの傾向を引き起こす遺伝子変異は、COVID-19の重症化の危険因子を構成している可能性がある。その反対に、家族性地中海熱(FMF)に関連した遺伝子変異は、そのような変異がいくつかのウイルスや細菌の病原体に対する抵抗性をもたらすと主張する歴史的仮説に基づいて、より軽い病気の経過をもたらすと推測されている。
実際、トルコとイスラエルから報告されたCOVID-19感染症における死亡率の低下は、この推測を支持する可能性がある(25.04.2020のhttps://covid19.who.int/accessedに基づく)。
興味深いことに、MASの発生は、自己炎症性疾患であるにもかかわらず、FMFでは頻繁ではない[39]。
COVID-19肺炎の初期段階におけるサイトカインストーム介入
www.sciencedirect.com/science/article/pii/S1359610120300484
SARSとMERSとは対照的に、武漢中央南病院の医師は、軽度の患者と比較して、IL-2、IL-7、IL-10、GSCF、IP10、MCP1、MIP1a、およびTNF-αのレベルが重症患者の血中で著しく上昇していることを発見した。
重度のグループの血中のIL-6のレベルは、軽度のグループのそれ(30%)よりも76%高かった。さらに、重度のSARS-CoV-2感染で死亡した患者から得られた組織学的検査および生検サンプルは、炎症性の高いCCR4 + CCR6 + Th17 + CD4 T細胞の濃度の増加を示し、T細胞の活性化が重度の免疫損傷に一部寄与したことを示唆する。
COVID-19のサイトカインストーム:予防と保護にスポットを当てる
www.tandfonline.com/doi/full/10.1080/14728222.2020.1783243
序論
COVID-19のサイトカイン放出症候群(CRS)は、多臓器支持を必要とする重篤な疾患の発症と関連している。炎症亢進による多臓器障害の進行を食い止めるためには、さらなる研究が必要である。
対象領域
PubMed/MEDLINETMデータベースに2020年5月9日~6月9日にアクセスし、CRSの治療と病態に関する最新の視点を検討した。
専門家の意見
化学走性の過剰活性化は、プロ炎症性サイトカインの放出をもたらすマクロファージ活性化症候群(MAS)を誘発する。IL-6およびTNF-αは、過剰炎症の最前線にある。炎症性カスケードは、内皮の活性化および毛細血管の漏出を誘導し、循環不全およびショックにつながる。内皮機能障害が持続すると、凝固カスケードの活性化と微小血管閉塞が起こる。内皮の活性化が続くと、肺組織の損傷に関係なく多臓器不全に陥る。
我々は、内皮を標的とすることで、このサイクルを中断させることができると提案している。免疫調節療法が提案されているが、適応免疫を阻害しないことを確認するためには、さらなるデータが必要である。
IL-6およびヤヌスキナーゼ、シグナル伝達物質および転写タンパク質経路の活性化物質(JAK/STAT)の阻害は、好ましい標的である。遠隔虚血性条件付け(RIC)は動物モデルで敗血症の炎症を減少させ,心血管保護と組み合わせた低リスクの介入として検討すべきである。
1. 序論
2019年12月、中国の湖北省は、急性重症呼吸器疾患(ARDS)と急速な多臓器不全を引き起こす新規RNAコロナウイルスの出現を宣言した[1]。ゲノム配列決定の結果、2003年に呼吸器疾患の大パンデミックを引き起こしたSARSコロナウイルスとの顕著な類似性(89%のヌクレオチド同一性)が確認された[2]。
その結果、COVID-19は、200カ国以上のインフラを無力化し、何百万人もの人々に感染するという、世界的なパンデミックへと発展した。ウイルスの高い病原性因子と既存の免疫がないため、治療上の課題が急速に高まっている。英国では、重症治療室に入院した患者の現在の予後は、約50%の死亡率が報告されており[3]、依然として慎重な状況が続いている。
COVID-19の感染は、無症状からARDSを伴う重症化まで、様々な臨床像を引き起こし、集中治療室(ICU)での多臓器サポートを必要とする。重症化の予測因子は明らかにされていないが、感染後7~10日目に悪化する傾向があることがよく報告されている[1, 4, 5]。
1918年のインフルエンザの大パンデミックに見られるように、サイトカインによる高炎症ストームがこの有害な疾患経過の原因であることが示唆されており、合併症の有無にかかわらず、老若男女を問わず、終末期に至ることが示唆されている [1, 4]。
したがって、COVID-19に誘導されるサイトカインストームを標的とした治療法の開発または再利用が急務となっている。これはCOVID-19に限ったことではないので、重度の炎症の治療ですでに確立されている既知の免疫調節介入から多くを学ぶことができる。
季節性インフルエンザ(ARDSを引き起こす可能性がある)に加えて、研究は、他の新しいコロナウイルス疾患、細菌性敗血症および出血熱の高炎症状態を促進するメカニズムも考慮すべきである。凝固障害と播種性血管内凝固(DIC)が進行した疾患の特徴であることを考慮すると [4]、後者の状態も関連性が高まる可能性がある。
ウイルス誘発性サイトカインストームは、50%の患者で持続性発熱、血液学的障害、ARDSを引き起こす二次性血球貪食細胞性リンパ組織球症(sHLH)と関連している[5]。これらの臨床的特徴は、血液学的悪性腫瘍のB細胞を標的とした自己免疫調節療法であるキメラ抗原療法(CAR-T)の後にも観察される。
CAR-T療法は患者の最大70%にサイトカイン放出症候群(CRS)を引き起こし [6] 、臨床スコアリングシステムは炎症亢進を起こしやすい患者を事前に評価するために使用されている。
同様に、COVID-19の臨床経過(1~7日目)の早い段階でCRSを抑制するための治療法を特定することが最も重要である。速やかな認識と介入は、宿主の炎症と細胞傷害の程度がすでに、不可逆的である可能性が高いときに、重症/重篤な疾患への進行を止めることができるかもしれない。
この観点からの意見記事の目的のために、PubMed/MEDLINETMデータベースに pubmed.ncbi.nlm.nih.gov/between 2020年5月9日~6月9日にアクセスし、COVID-19関連CRSの最新の関連免疫学と将来の治療目標を決定した。
1. 炎症性経路の定義
SARS-2-CoVは一本鎖RNAウイルスであり、肺上皮のACE-2受容体に結合し、エンドサイトーシスを介して細胞内に入る[4]。ウイルスの複製および製造の一部として、損傷関連分子パターン(DAMP)がサイトゾルに放出され、パターン認識受容体(PRR)およびRIG-I様受容体(RLR)を介して循環マクロファージによって感知される [7]。
マクロファージによるウイルス侵入の認識は、急性期応答サイトカインIL-6、TNF-α、IL-1βおよび1型インターフェロン(自然免疫系)の分泌を介して、化学走性および他の免疫細胞のリクルートのプロセスを開始する[8]。
異物遺伝物質の検出に関与する他のマクロファージ結合性受容体には、トール様受容体(TLR)、NOD様受容体(NLR)、およびインターフェロン関連のSTING/cGAS経路が含まれる[8, 9]。後者は、細胞間のクロストークおよび隣接細胞における抗ウイルスタンパク質の転写に関与している。
また、NLRは病原体のオートファジーを誘導するように作用し、インフラマソーム形成に関与している(NLR)。これらの分子は酵素カスパーゼ-1を活性化し、その前駆体からのIL-1βの産生を導く[10]。これらの分子はまた、腫瘍壊死因子受容体関連因子(TRAF)のアップレギュレーションを促進する [8]。
ヤヌスキナーゼ/シグナル伝達物質および転写活性化因子(JAK/STAT経路)は、自然免疫シグナル伝達の不可欠な部分を形成し、リンパ球前駆体からのナチュラルキラー(NK)細胞の分化に寄与している。NK細胞はIL-12によって活性化され、主要組織適合性複合体(MHC)情報が変化した、または欠落した宿主細胞を破壊しようとする [8]。
適応免疫応答は、樹状細胞がナイーブなCD4 T細胞に抗原断片を提示することで開始される。インターロイキン2,4,5,10はすべて、ナイーブT細胞のTヘルパー細胞への分化に役割を持っており、IFN-γに加えて、B細胞(血漿細胞)からのIgM抗体分泌を刺激する [11]。
記憶B細胞は、抗原性物質の「細胞記憶」を開発する役割を担っており、ウイルスの侵入が再発した場合に中和抗体を迅速に製造することができるようにする。Tレギュレーター細胞(Treg)と呼ばれるT細胞のサブグループは、体液性免疫応答の振幅を制御する上で重要な役割を持っていると考えられており、Treg細胞数の減少は自己免疫疾患への感受性の増加と関連していることが文書化されている[12]。
Treg細胞の枯渇はIL-6、17およびIFN-γのレベルの上昇をもたらし、IL-8の分泌を介して好中球のクリアランスを減少させる [13]。この一連の事象は、肺障害およびARDSの発症に寄与する[12]。
2. サイトカイン放出症候群の病態
サイトカイン放出症候群(CRS)は、病原性物質に反応して免疫系から放出される複数のケモカインの複雑なカスケードである(図1)。過剰炎症に重要なサイトカインには、IL-6、IL-8、TNF-α、IL1-β、MCP-1、GCS-F、IP-10、CCL1-3、IL-17およびIFNγが含まれる[4、5、14、8、11、15、16]。
1型インターフェロン(IFN-α/β)の分泌遅延もまた、CRSの発症を加速させると考えられている[8, 16, 17]。個人の免疫応答は、異なる病原体や疾患経過のステージによって異なる可能性がある[11]。その結果、研究者は、ウイルスクリアランスと抗体産生のメカニズムを維持しながら、免疫系の過剰な活動を鎮めるというジレンマに直面している。
このデリケートなバランスを崩すことなく、COVID-19で最も有害なサイトカインを特定することは困難である。サイトカインの阻害により、有益な適応免疫応答が損なわれるリスクが最近定義された [11]。
図1. サイトカイン放出症候群(CRS)および微小血管障害の発症における主要な経路。
図1 SARS-CoV-2ウイルスは肺系内のII型肺細胞に感染する。局所マクロファージは異物遺伝子に反応する。急性期反応サイトカイン(TNF-α、IL1-β、IL-6)は最初のサイトカインの波を引き起こし、一方、I型IFNはナチュラルキラー細胞(NK)の分化と適応免疫応答を開始する。
サイトカインIL-6は内皮の活性化と炎症性細胞の遊走を誘導する。Tissue Factorの分泌が増加し、免疫介在性血栓症につながる凝固カスケードのアップレギュレーションが起こる。内皮活性化は炎症性クロストークを刺激し、第二のサイトカイン波に寄与する。
図は[8,11,17]からの引用。略語。IFN – インターフェロン、NK – ナチュラルキラー細胞、VWF – フォンウィルブランド因子、G-脳脊髄液 – 顆粒球コロニー刺激因子、MCP-1 – 単球化学吸引性タンパク質1、CCL – ケモカインリガンド
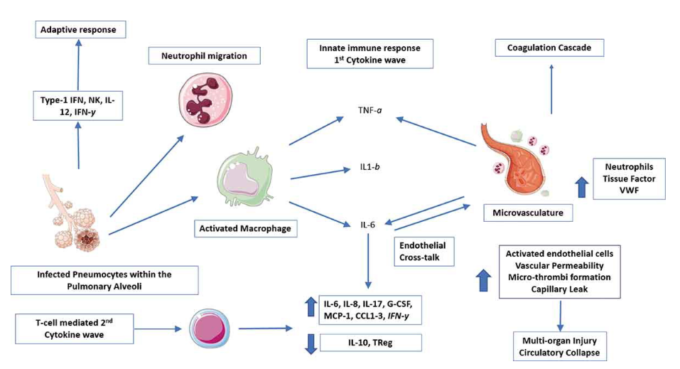
急性期反応サイトカインであるIL-6およびTNF-αは、多くの人がCOVID-19高炎症の病因における主要な「犯人」であると考えている[4, 8, 15]。IL-6はマクロファージ活性化症候群(MAS)[17]を促進し、プロ炎症性サイトカインの大量産生を誘発し、好中球および線維芽細胞の肺上皮への移動を誘導することが示唆されている。
この結果、コラーゲンおよびフィブリンの沈着が増加し、肺の下地組織の損傷につながる[8, 15, 17, 18]。重度のCOVID-19、SARSおよびエボラ出血熱(EHF)を有するヒトでは、IL-6レベルの上昇、疾患の重症度および死亡率との間に正の相関がある[4、19、20、21]。
CAR-T療法を受けている患者を対象とした研究では、IL-6の上昇はグレード4のCRSと関連しており、治療後2日目から5日目の間にピークを迎えた[6]。IL-6はさらに有害な内皮活性化を引き起こし、亜酸化窒素(NO)に依存した血管透過性の増加を引き起こすが、これについては後述する。
IL-6は、プロテアーゼTACE(TNF-α変換酵素)によって媒介されるように、親炎症性または抗炎症性のいずれかの形態に「クラス・スイッチ」する能力があることから、「味方であり敵でもある」と考えることができる。
IL-6がその可溶性受容体(sIL-6 R)に結合すると、高炎症のカスケードが誘導され、一方、IL-6膜に結合したIL-6複合体は、この反応をダウンレギュレートする [20]。IL-6の細胞内シグナル伝達は複雑であり、gp130受容体、JAK/STAT、RAS/RAF、およびAKT/P13 K経路が関与している[19]。
IL-6の「古典的」経路は、gp130に直接結合するIL-6受容体(IL-6 R)を関与させる。トランス」シグナル伝達経路は、可溶性のsIL-6受容体を使用して、膜結合型IL-6 Rを発現しない細胞におけるgp130結合およびシグナル伝達を補助する[19]。
インフルエンザの動物モデルでは、IL-6ノックアウトマウスは、死亡率の増加、貪食機能の低下、および線維芽細胞増殖の増加を示すことが判明した[22]。したがって、IL-6の化学走性および免疫系の分極を開始する能力により、IL-6の阻害は疾患の初期段階では好ましくないと考えられる。
TNF-αは、急性期応答サイトカインとしてのIL-6と同様の役割を持ち、COVID-19における炎症促進作用を有する。TNF-αの血清レベルの上昇は、CRS重症度の上昇と関連している[6、16、17]。さらに、TNF-αは、核カッパ因子B(NF-κB)シグナル伝達経路を活性化して循環前駆細胞をリクルートすることにより、組織再生に役割を果たしている[16]。
SARSウイルスのマウスモデル(組換えS「スパイク」タンパク質を使用)では、NF-κB経路を介してTNF-αおよびIL-6がウイルスによって直接刺激される可能性があることが実証されている[23]。これは、コロナウイルスの感染に反応して観察される急性期反応サイトカインの超正常レベルを説明するものであろう。
炎症性サイトカインの産生を刺激することに加えて、COVID-19はTNF-αを介したリンパ球のアポトーシスを誘導する可能性がある[16]。TNF-αは、関節リウマチなどの他の疾患状態において、ミトコンドリアのチトクロムcのサイトゾルへの放出を誘発することにより、カスパーゼを介在させた細胞死を誘導する[11]。通常の状況下では、これは慎重に制御された恒常性メカニズムであり、TNF-α/NF-κB活性化はまた、細胞保護タンパク質を誘導することができる[10]。
細胞死は、CD4/8数の減少(リンパ球減少症)をもたらす;重症COVID-19の臨床所見としてよく報告されているものである[4、8、15]。さらに、Tリンパ球の減少はあまりにも大きく、リンパ組織におけるリンパ球の隔離によって説明することはできないようである。IL-6およびTNF-αの保護作用および有害作用の両方が、COVID-19においてそれらの阻害を慎重に考慮しなければならないことを意味する[24, 25, 26]。
IL-6は、IL-23と組み合わせて、JAK/STAT経路を活性化し、Th17細胞の分化を導く;Tヘルパー細胞のサブタイプである。TH17はIL-17を分泌し、これは重症インフルエンザにおけるARDSの発症と関連している[13]。IL-17はCOVID-19 CRSの重要な推進因子である可能性があり、その阻害は、これが他のサイトカイン抑制剤と併用されていない場合には安全であると考えられている[11]。
CRSのもう一つの重要な寄与者は、免疫応答の初期にある1型インターフェロンの分泌の遅延または不十分である[15]。正確なメカニズムは不明のままであるが、1型インターフェロンの低レベルは、MASの増加およびサイトカインストームの悪化と関連している[8]。
さらに、SARS感染動物にI型インターフェロンを導入した場合、プロ炎症性サイトカインの低レベルが報告されている[17]。EHFのようないくつかのウイルスは、RIG経路の破壊を介してtype-1インターフェロン応答を積極的にダウンレギュレートすることができる[21]。COVID-19もまた、タイプ1IFN防御機構を混乱させることができる可能性がある。
重度のCOVID-19で増加したレベルで循環する他の分子には、単球化学吸引剤[8,11,15,26]プロテイン-1(MCP-1)、および小型の誘導性ケモカインCCL 1,2および3が含まれる。MCP-1はマクロファージの勧誘と遊走を助ける重要な分子であり、制御不能なマクロファージ活性化症候群(MAS)に寄与している可能性がある。
MCP-1のレベルの上昇は、CAR-Tがん治療に関連するCRSにも関与していることが示唆されている[6]。血液疾患に限定されるものではないが、CAR-Tは、リンパ除去化学療法後のB細胞悪性腫瘍の治療に頻繁に使用されている。
CAR-T療法のCRSは、循環器虚脱および凝固障害も特徴としているため、COVID-19との関連性が高いと考えられる。CAR-Tを受けた133人の血液内科患者を対象とした研究では、IL-6とMCP-1の両方のレベルが2~5日の間にピークを迎えた[6]。これは、重要なサイトカインが上昇し始める前に予防的治療を行うのに要する時間が短いことを示している。
密接に結びついたCCLケモカインは、アレルギー性喘息やインスリン抵抗性症候群などの多くの炎症性疾患プロセスに関与しており、また、プロトロンボティックである組織因子(TF)を誘導することができる[27]。組織因子は、内皮の活性化中にマクロファージ上で発現し、凝固カスケードを誘発して血栓症を開始させる。
これは局所的な出血がある場合には恒常性であるが、敗血症時に全身性である場合には有害である可能性がある[8]。肺ARDSは予後不良と関連しているが、COVID-19は多臓器傷害と循環虚脱が進行すると臨界期に入る。ウイルス血症および高サイトカイン血症は、プロ炎症性サイトカインの産生を駆動し続ける広範囲の血管障害をもたらす可能性がある[8]。
3. 内皮活性化-サイトカインストームの目?
COVID-19で観察された多臓器損傷は、サイトカイン誘発性内皮機能障害(内皮炎)の結果であるという証拠が出てきている[28]。
IL-6は内皮の活性化および好中球の浸潤を引き起こし、その結果、NO(一酸化窒素)が媒介する血管透過性の変化および血管緊張の低下をもたらす[8]。これは臨床的に好中球とT細胞リンパ球の比率の増加、および敗血症性ショックの発症に反映される[4]。
内皮の活性化は、病原性物質がより大きな血管に移動するのを防ぐために、最初に微小循環内で起こる。残念なことに、この活性化は微小血栓や毛細血管出血などの微小血管合併症を増加させる。COVID-19の予後不良の予測因子であるd-ダイマー[4]のような臨床マーカーは、フィブリン分解の産物であり、内皮が介在する凝固カスケードの活性化を反映している[8]。
COVID-19では、大規模な心外冠動脈閉塞を伴わないST上昇型心筋梗塞(STEMI)の症例が複数報告されている[30, 31]。イタリアのロンバルディア州の28人の患者のコホートでは、典型的なSTEMIを呈したCOVID-19患者の40%にフロー制限病変を認めなかった[31]。さらに、COVID-19で冠動脈が閉塞していないSTEMI患者の生検では、心筋炎は認められなかった[28]。
COVID-19の心筋梗塞(MI)は、サイトカイン誘発性の微小血管機能障害によって引き起こされる可能性がある[28]。トロポニンは、梗塞のコンテキストでは依然としてゴールドスタンダードなバイオマーカーであるが、微小血管閉塞(MVO)でも有意に上昇する可能性がある。顕著な上昇は敗血症性ショックでも認められ、予後を左右する[31]。2型心筋梗塞が優勢なCOVID-19 STEMIでは、血栓溶解療法は適切な治療法とはみなされない[30、31]。
COVID-19におけるACE阻害薬の役割については議論の余地があるが、一部では有害ではなく、有益であるとする意見もある [32, 33]。ACE阻害薬は心保護作用があることが証明されており、高血圧を抑制し、LVのリモデリングを促進することで、長期的な内皮活性化を減少させるのに役立つ[32]。
アンジオテンシンIIが血管のNO経路と関連していることを考えると、このコホートの患者はCRS誘発性炎症に耐えられるようになっている可能性がある[8]。動物モデルでは、治療用ヘパリンはLPSでのチャレンジ後の生存率を改善した[34]。しかし、ヘパリンは炎症性サイトカインレベルを低下させず、その後の凝固障害の発生により、活性化部分トロンボプラスチン時間(APTT)の解釈が困難になった。
微小血管イベントに加えて、COVID-19は動脈血栓症の増加と関連している。50歳未満のCOVID-19陽性患者5人の最近の症例研究では、本疾患の脳血管症状として虚血性脳卒中が報告されている[35]。
すべての症例で閉塞性血栓が確認され、治療は血栓回収を伴う抗凝固療法であった。動脈硬化のような非COVID疾患における内皮の活性化は、心血管系や神経血管系にも同様に影響を与えることを考えると、これらの現象は驚くべきことではないかもしれない[36]。
さらに、炎症性分子および白血球は血液脳関門を通過して中枢神経系(中枢神経系)の炎症を引き起こすことが知られている。中枢神経系は1型アストロサイトやミクログリアを介して自身のサイトカインを合成することができ、その結果、脳炎などのコロナウイルスの他の神経学的症状を引き起こする[38, 39]。
COVID-19は肺塞栓などの静脈血栓塞栓性イベント(VTE)の発生率を増加させることがよくわかってきた。107人の重症患者を対象としたフランスの研究では、COVID-19コホートでは重症インフルエンザの対照群と比較してVTEの割合が有意に高いことが明らかになった[42]。
全身性炎症と凝固カスケード活性化の関係は多くの疾患でよく認識されており、敗血症性ショックでは、TNFやIL-1などの炎症性サイトカインがプロ凝固組織因子(TF)を誘導し、重要な「免疫血栓性」経路を誘発すると考えられている[43]。
免疫介在性血栓症における新しいメカニズムが提案されており、血栓の消費による抗凝固プロテインS(PROS1)の枯渇がCOVID-19プロ血栓状態の発現に重要であることが明らかにされている[44]。
臨床医は現在、川崎病のような大・中血管血管炎に類似した新しい小児疾患を発見した初期段階にある [45, 46]。これは小児におけるCOVID-19感染の後遺症と考えられており、おそらく免疫媒介性血管障害を引き起こす小児用サイトカインストームの結果であろう。
さらなる研究は、多臓器損傷、心臓/脳血管合併症、および多系統血管炎/内皮炎を予防するための内皮保護に焦点を当てなければならない。これは、2型糖尿病のような慢性的で持続的なレベルの内皮機能障害を有し、COVID-19で予後不良であるような状態を有する個人において特に重要であると考えられる[4]。
臓器としての内皮系は、COVID-19により誘発される高炎症および血栓症の枢要なメディエーターとして考慮されなければならない。
4. サイトカイン抑制の新展開
COVID-19に関連するCRSの有害な効果が認識されているため、慢性炎症性疾患の治療に使用される既存の免疫調節療法の試験が急がれている。レムデシビル、ヒドロキシクロロキン/クロロキンおよびアルビドールのような宿主細胞を主に標的とする抗ウイルス剤(エンドサイトーシス、ウイルス複製および製造を調節する)は広く研究されており[45, 47]、多くの臨床研究の対象となっている[46, 48]。これらの薬剤は初期の有望性を示しているが、COVID-19のCRSの直接的なメディエーターとしての関連性は低いと考えられる。
IL-6受容体遮断薬であるTocilizumab(TCZ)は、この分野で大きな関心を集めている[5, 8, 11, 19]。IL-6 Rに直接作用するTCZは、古典的なシグナル伝達経路とトランスシグナル伝達経路の両方を阻害することができ、CAR-T療法に伴うCRSの治療薬として認可されている[19]。
伝統的に、TCZは関節リウマチ(RA)およびStill’s Disease(若年性発症関節炎)によるsHLHの治療に使用されている[5, 11, 15, 25]。慢性炎症性疾患を有する患者では一般的に忍容性が高いが、RAを対象とした第III相RCTのレビューでは、TCZは約7%の患者で上気道感染症を、6%の患者で高血圧症を引き起こしていることが明らかになっている[49]。
中国の武漢で行われたレトロスペクティブ研究では、COVID-19に対してTCZを投与された15人の重症患者の転帰を分析した。TCZはIL-6反応の緩和と関連していたが、この研究には対照群がなく、レトロスペクティブであり、患者は複数の免疫調節療法を受けていた[50]。無作為化対照試験(RCT)の結果は現在待たれている。
IL-6とアンドロゲンの調節の間に重要な関係が出現しているかもしれない[51]。男性におけるアンドロゲンのアップレギュレーションは、IL-6シグナル伝達を介して細胞膜貫通型セリンプロテアーゼ2受容体(TMPRSS2)の発現増加をもたらすことが提案されている[51]。
動物モデルは、TMPRSS2がACE-2受容体と並んで、COVID-19の宿主細胞への侵入を支配することを実証している。さらに、TMPRSS2の阻害は、SARS-CoV-2ウイルスを死滅させることがわかっている[52]。炎症性サイトカインの調節因子として、スピロノラクトンやビカルタミドなどの確立された抗アンドロゲン療法が注目されている [53]。
同様に、IL-1β(AnakinraTM)およびTNF-α(EtanerceptTM)の阻害剤は、すでに確立されている重症CRSにおける抗炎症剤として提案されている[8]。これらの薬剤は、LPS誘発感染症の動物モデルで有望性を示しているが [24]、ヒトでのデータは限られている。
JAK/STAT経路は、サイトカイン抑制の魅力的なターゲットと考えられている[5, 8, 11, 16, 17]。特筆すべきは、この経路を阻害することで、複数のサイトカインのシグナル伝達を阻害し、抗炎症効果を最大化することである。(JAK 1&3)を介してウイルスクリアランスに関連するサイトカインを阻害することには理論的に危険性があるため、注意が必要である[11]。
免疫抑制剤は、NK細胞と適応免疫応答をアップレギュレートするI型IFNシグナル伝達の干渉を介してウイルスクリアランスを阻害する可能性がある。さらに、JAK阻害剤は、COVID-19の重要な病態である静脈血栓症のリスクを増加させうる[16]。チロシンキナーゼ阻害剤であるポナチニブは、重症インフルエンザの動物モデルにおいて、複数のサイトカインの放出を阻害することが明らかになっている[54]。生体内試験(in vivo)では、ポナチニブは3つの重要なサイトカイン(IP-10、IL-8、MCP-1)を有意に抑制し、全死亡率を低下させた。
インフルエンザに関連したサイトカインストームで提案されている他の薬理学的薬剤には、ペルオキシソーム増殖因子活性化受容体アゴニスト(PPAR)、スフィンゴシン-1-リン酸受容体モジュレーターアゴニスト(S1P1)、COX阻害剤などがある[13]。コルチコステロイドは、以前に重症インフルエンザおよびARDSを患う重症患者の死亡率を増加させたことがあり、論争の的となっている] [55]。
IVIGおよび生存者の回復期血漿の投与は初期に有望であることが示されているが、これらの治療法は重症患者および確立されたグレード4のCRSの治療に適した治療法である[56]。最近、ラパマイシン(mTOR)経路の新しい標的が提案された [57]。これは、CRSにおける組織損傷が抗体依存性増強(ADE)に関連しているという原理に基づいており、このクラスの薬剤は以前に移植やH1N1におけるCRSの予防に利用されている[58]。
重症患者の治療に使用される体外膜酸素化(ECMO)などの循環支援法は、サイトカイン除去の効果的な手段であり、したがって多臓器への関与を減らすことができる[59]。薬物療法の選択肢を検討する際には、患者の血行動態の状態やショックの生理的影響も考慮することが臨床的に重要である。
重症治療チームは、重症のCOVID-19患者に最適な体液バランスを確保し、ARDS、体液過多、および腎低灌流を伴ううっ血性腎障害の発症を避けることが重要であることを観察してきた[60]。同様に、COVID-19に関連する心腎症候群は、血管透過性の変化に誘導されるIL-6によって引き起こされる過剰な体積膨張および第3空間体液蓄積のこのメカニズムによって起こり得る。
敗血症の動物モデルにおいて、遠隔虚血性コンディショニング(RIC)は、死亡率を減少させる上で有意な約束事を示している[61]。RICは広く報告されている心臓保護現象であり、標的臓器から離れた場所で連続的に虚血と再灌流を行うことで、心筋細胞を再灌流傷害(RPI)から保護することが明らかになっている[61, 62]。RICはヒトでは上肢に装着した血圧カフを徐々に膨らませたり縮めたりすることで行われる[63]。
LPSを投与したマウスでは、RICはプロ炎症性サイトカイン(IFN-γ、IL-1β、TNF-α)の血清中濃度を有意に低下させ、生存率を改善した。この作用機序については不明であるが、RICはアデノシン受容体を調節し、サイトカイン放出のNF-kB経路をダウンレギュレートする可能性があると考えられる[62]。ヒトでは、RICは迷走神経を介して再灌流障害による炎症を抑制しており、敗血症や急性心筋梗塞の両方で起こりうる。したがって、RICは、COVID-19の炎症性ストームを抑制する役割を有している可能性があり、アクセス可能であり、かつ単純な介入である。
5. 結論
COVID-19のサイトカインストームは、重篤な疾患や多臓器損傷の重要な誘因となる。我々は、COVID-19パンデミックにおいて現在検討されている免疫調節療法について説明し、有害なサイトカイン放出を媒介する遠隔虚血性条件付け(RIC)の利点について考察する。
臓器としての内皮系はサイトカインストームの重要な媒介者であり、その持続的な活性化は「敗血症の渦」を引き起こす。この意見は、敗血症時の全身虚血における心血管保護の重要性を考察し、さらなる研究への示唆を提供するものである。新規免疫調節薬と心血管保護の融合が重症COVID-19の悲惨な転帰に影響を与えることができるかどうかは、時間の問題である。
6. 専門家の意見:CRSにおけるRISKと多臓器保護を考慮すべし
COVID-19はもはや肺上皮に限った感染症ではなく、末期臓器不全を引き起こす多系統の炎症性疾患である[28]。レムデシビルのような抗ウイルス剤は症例研究[47]で疾患の重症度を低下させているが、COVID-19の決定的な治療法はまだ存在しない。したがって、私たちは、薬理学的な選択肢を完成させながら、末梢臓器の破壊を予防する他の方法に目を向けなければならない。
重症患者の報告から明らかなように、COVID-19における多臓器虚血は、心腎症候群、サイトカインの放出、血管の完全性の喪失による全身的な低灌流の結果として起こる[60]。細胞傷害およびアポトーシスを制限するために、他の虚血状態で利用されている臓器保護の原則を適用することが可能であるかもしれない。前述の動物モデルにおいてRICがサイトカインの放出に影響を与えることが観察されたことは、COVID-19のさらなる研究のための優れた基盤を提供するものである。
心筋保護は、心筋梗塞および再灌流傷害(RPI)後の心筋細胞への損傷を最小限に抑えるために開発された確立された概念である[65, 66, 67]。心臓は循環機能および多臓器灌流の中心であるため、心臓の保護はCOVID-19において多系統の利益をもたらす可能性がある。ST上昇型心筋梗塞(STEMI)の後には、全身の炎症を引き起こす重要な免疫応答がある[68]。
同様に、プラーク破裂後には、プロ炎症性サイトカイン、インフラマソーム、免疫介在性血栓症のアップレギュレーションがある[68]。Reperfusion Injury Salvage Kinase(RISK)経路の発見は、心保護研究における大きなブレークスルーであった[69]。RISKは、虚血の初期に活性化された場合、ミトコンドリア遷移孔開口(MTP)を減少させることで細胞死を最小限に抑えるように作用する生存促進タンパク質キナーゼのグループを記述している[65]。
組織の低酸素からの臓器保護は、「マルチヒット」アプローチが採用されている場合に最も最適である[70]。著者らは、実績のある心保護薬とRICのような再灌流傷害とサイトカイン放出を最小化する生理学的介入を融合させることによって、これが最もよく達成されると考えている[62]。
さらに、心保護薬理学の中には、細胞死と炎症を減少させる複数の経路(相加的効果)を標的とする機会がある[70]。そのような生存促進経路は、RISK、生存者活性化因子エンハンスメント(SAFE)、および亜酸化窒素/タンパク質キナーゼ(NO/PKG)で構成されている[65]。
これは、炎症亢進がNF-kBおよびTNF-αを介してアポトーシスを誘発し得ることを考慮すると、関連している[16]。RICは、動物モデルで実証された明確な利点にもかかわらず、ヒトへの翻訳はより困難である[61, 63, 67]。重要なことは、COVID-19は、サイトカインストームが発生する前の軽症の発症時にこの介入を適用する最適な機会を提供することである。
重度の敗血症およびCRSの間に心機能を維持することは、収縮性を改善し、酸素利用率を高め、灌流圧を維持することで世界的な利益をもたらす [71]。したがって、心機能の改善は腎機能および神経学的状態を保護する可能性がある。心臓は、心筋抑制因子(MDF)として知られる循環活性物質によって感染時に特に損傷を受けやすい。
これらの物質には、サイトカインであるIL-1β、IL-6、TNF-α、補体、および高レベルのNOが含まれる。MDFは、TLR-4などのトール様受容体に結合すると、炎症のNF-kB経路を介して作用する可能性がある [72]。
動物の敗血症性心臓で研究されてきた治療法には、カスパーゼ阻害剤、水素ガス(H2)、メラトニン、および独立成長因子I(GFI-I)が含まれる[73, 74]。この文脈ではサイトカインの抑制が試みられている;しかしながら、これらの治療法はこれまでのところ有意な有益性を示すことができなかった [73]。
他の心保護の開発では、ナトリウム-グルコースコトランスポーター2(SGLT2)阻害薬が糖尿病性心臓に有益である正確なメカニズムを特定するための研究が進行中である[73]。虚血によって誘発される微小血管機能障害を標的とした治療は、COVID-19にも同様に関心があるかもしれない。
P2Y12阻害剤およびスタチンに加えて、Rhoキナーゼ阻害剤(ROCKi)は、血管緊張、血管新生およびアポトーシスの調節を含む、心血管保護における多くの新規な作用を実証している[70, 75, 76]。ROCK阻害はさらに、内皮バリア機能を媒介し、白血球の遊走を減少させることができる[77、78]。
これらの保護効果は、心血管系に加えて中枢神経系でも認められており [77]、このクラスの薬剤は、さらなる研究のための汎用性の高いエキサイティングな見通しとなっている。
記事のハイライト
- IL-6とTNF-αはCOVID-19のサイトカイン放出症候群の鍵となるメディエーターである。
- マクロファージ活性化症候群と内皮活性化は持続性炎症の要
- 内皮病変は微小血管血栓と親血性血栓状態と関連している
- サイトカイン抑制療法を開発する際には、適応免疫応答に対するリスクを考慮する必要がある
- COVID-19 CRSの予防と保護には遠隔虚血性コンディショニングと心血管保護を考慮する必要がある

