コンテンツ
The Unique Characteristics of COVID-19 Coagulopathy
pubmed.ncbi.nlm.nih.gov/32552865/
要旨
COVID-19では血栓性合併症や凝固障害が頻発する。しかしながら、COVID-19関連凝固障害(COVID-19関連凝固障害)の特徴は、細菌性敗血症誘発性凝固障害および播種性血管内凝固障害とは異なっており、COVID-19関連凝固障害は通常、Dダイマーおよびフィブリノーゲンレベルの上昇を示すが、プロトロンビン時間および血小板数の初期異常は最小限である。
静脈血栓塞栓症と動脈血栓症は細菌性敗血症誘発性凝固障害/播種性血管内凝固障害と比較してCOVID-19関連凝固障害では頻度が高い。COVID-19関連凝固障害の臨床的・検査的特徴は,血球貪食症候群,抗リン脂質症候群,血栓性微小血管症とやや重複する。
本研究では,代表的な凝固症の特徴をまとめ,その類似点と相違点を考察し,COVID-19関連凝固障害の特徴を明らかにすることを目的とする。
背景
COVID-19における死亡率の高さと血栓塞栓性疾患との関連性にますます注目が集まっている[1, 2]。Dダイマーは疾患の重症度に関連する有用なバイオマーカーであることが繰り返し報告されており[3]、有害転帰の予測因子である[4]。
静脈血栓塞栓症の発生率が高く、抗凝固薬による血栓予防の重要性は、ガイダンス文書に記載されている[5]が、COVID-19患者12人中7人(58%)に深部静脈血栓症が頻発し、4人(33%)に肺塞栓症を合併しているという連続した剖検所見によって裏付けられている[6]。脳卒中や急性冠症候群などの動脈血栓症の発生率の増加もCOVID-19例で報告されている[7]。
この文脈での予防的・治療的抗凝固薬使用の有効性については議論の余地がある。最初の武漢の記述では、D-ダイマー値が3.0μg/mL以上のヘパリン投与患者の死亡率が低いことが報告されている(32.8% vs 52.4% 未治療、P = 0.017)、または敗血症誘発性凝固障害(細菌性敗血症誘発性凝固障害)(40.0% vs 64.2% 未治療、P = 0.029)[8]。
別の研究では、Paranjpeら[9]はCOVID-19患者2773人を分析したが、そのうち抗凝固療法を受けたのは28%のみであった;機械換気を必要とする患者(n = 395)では、全身性抗凝固療法を受けた患者の院内死亡率は29.1%で、生存期間中央値は21日であったのに対し、抗凝固療法を受けなかった患者では死亡率62.7%、生存期間中央値は9日であった。
レトロスペクティブなデータにもかかわらず、報告ではCOVID-19における高凝固性の役割と抗凝固療法の役割が強調されている。しかし、COVID-19関連凝固障害(COVID-19関連凝固障害)の病態生理は複雑であり、重症患者で報告されている標準的な血栓症のメカニズムとは重要な点で異なる可能性が高い。
このレビューでは、COVID-19関連凝固障害とよく特徴づけられた様々なタイプの凝固障害を比較対照する(表1)。
表1 COVID-19と鑑別疾患との間の血栓症および検査データの類似点と相違点
原文参照
敗血症誘発性凝固症および播種性血管内凝固症について
細菌性細菌性敗血症誘発性凝固障害や播種性血管内凝固(播種性血管内凝固障害)の病態生理は広く研究されてきた。細菌性敗血症誘発性凝固障害/播種性血管内凝固障害やCOVID-19関連凝固障害では「炎症」と「凝固」が共通のキーワードとなっているため、細菌性敗血症誘発性凝固障害/播種性血管内凝固障害に関する先行研究を検討することは有益である。
細菌性敗血症における凝固反応のメカニズムは複雑であり、病原体関連分子パターン(PAMP)や宿主由来のダメージ関連分子パターン(DAMP)など様々な因子が炎症反応の引き金となり、全身の凝固を活性化することが知られている(図1)。炎症と凝固はともに必須の宿主防御機構であるため、この反応は疾患の重症度に比例して増加し、潜在的に宿主を傷つける可能性がある [10]。
宿主防御機構には、インターロイキン(IL)-1β、IL-6、腫瘍壊死因子α(TNF-α)、補体系タンパク質などの炎症性サイトカインが含まれており、これらはすべて凝固障害を誘発する可能性がある[11]。
さらに、単球/マクロファージにおける組織因子の発現、好中球の活性化、好中球細胞外トラップ(NET)は血栓症の活性化をもたらす[12、13]。この血栓炎症反応は、細胞外小胞とともに、トロンビン生成をさらに増加させる内皮損傷を引き起こす[14、15]。
細菌性敗血症誘発性凝固障害/播種性血管内凝固障害では、しばしばプラスミノーゲンアクチベーターインヒビター-1(PAI-1)の過剰産生のために線溶が抑制され、組織微小循環内での進行性のフィブリン塊形成が臓器機能障害につながる[16]。このタイプの凝固障害を検出するには、血小板数の減少とプロトロンビン時間(PT)の増加(細菌性敗血症誘発性凝固障害スコアで使用される2つの検査パラメータ)が最も有用な指標である [17]。
線維溶解の抑制(線溶性シャットダウンとも呼ばれる)により、細菌性敗血症誘発性凝固障害/播種性血管内凝固障害重症度の上昇に伴ってDダイマーレベルの上昇がみられないことがある[18]。COVID-19では、D-ダイマー値は一般的に高く、通常は正常範囲の上限の5倍以上である。
また、細菌性敗血症誘発性凝固障害/播種性血管内凝固障害では、血管透過性の亢進などにより、アンチトロンビンなどの抗凝固タンパク質が有意に減少する[16]。
図1に示すように、細菌性敗血症誘発性凝固障害/播種性血管内凝固障害では血管透過性が低下していることがわかる。
図1
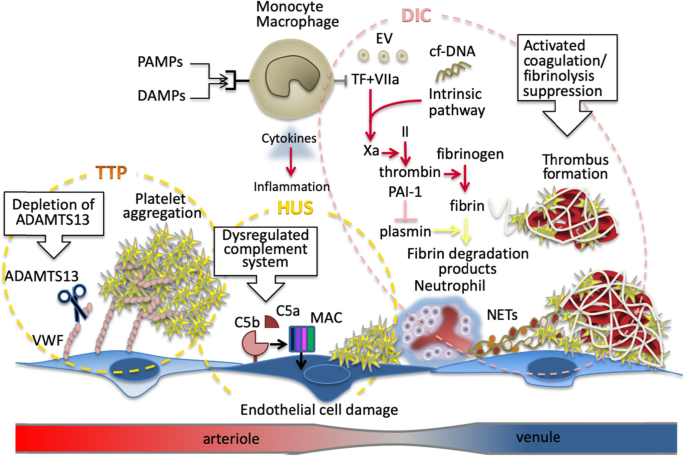
播種性血管内凝固、血栓性血小板減少性紫斑病、溶血性尿毒症症候群における血栓形成。
細菌性敗血症では、病原体関連分子パターン(PAMP)や宿主由来のダメージ関連分子パターン(DAMP)により、単球やマクロファージなどの免疫細胞が活性化される。免疫細胞は、組織因子(TF)を発現し、細胞外小胞(EV)を放出することにより、凝固カスケードを開始する。活性化された好中球および好中球細胞外トラップ(NET)も凝固に関与している。
凝固活性化の最終産物であるフィブリンの分解は、プラスミノーゲンアクチベーターインヒビター-1(PAI-1)のレベルの増加によって抑制される。血栓性血小板減少性紫斑病(TTP)では、抗ADAMTS13抗体によるvon Willebrand factor(VWF)の高マルチマーの増加が血小板凝集を刺激する。
溶血性尿毒症症候群(HUS)では、補体系とその末端産物である膜攻撃タンパク質(MAC)が血管内皮細胞を損傷し、血栓形成を開始する。
COVID-19関連凝固障害の場合、他の凝固バイオマーカーの変化は比較的軽微であり、異常はあまり見られない[2]。
Guanら[3]は1000人以上の患者を対象に報告しており、血小板数の中央値は全患者で168×109/Lであったが、重症呼吸器疾患患者のサブグループでは137.5×109/L(中央値)にとどまっていた(データはすべて入院時の値)。また、入院時にDダイマー値の異常が認められた患者は半数弱であったと報告している。中国からの別の報告では、入院時の血小板数が非生存者と生存者では低かった(中央値はそれぞれ122対178×109/L)ことも指摘されている。
Dダイマーの中央値は全例で2.03μg/mLであったが、非生存者では4.39μg/mLであったにもかかわらず、非生存者でもPTは比較的正常(12.6秒)であった[19]。その結果、COVID-19では播種性血管内凝固障害の発症率は低く、重症例でも1%未満であった[3, 20]。
別の研究では、Tangら[4]は、183例中16例(8.7%)が国際血栓止血学会(ISTH)の播種性血管内凝固障害基準を満たしており、播種性血管内凝固障害が約30%の症例で発生する敗血症よりも発生率が低いと報告している[4];さらに、CIVID-19自体の進行性ではなく、細菌性敗血症が重畳して播種性血管内凝固障害に進行する可能性も排除できない。
消耗性凝固障害は細菌性敗血症誘発性凝固障害/播種性血管内凝固障害の典型的な特徴であるが、そのタイプの凝固障害は、初期段階のCOVID-19では通常見られない。IL-1βおよびIL-6は血小板症および高フィブリノゲン血症を誘導することが知られており、持続的な炎症はこれらの因子の産生を刺激する可能性がある[21]。
また、初期では炎症や凝固は肺内に局在しているが、疾患の進行に伴って全身性の高凝固性となり、細菌性敗血症誘発性凝固障害/播種性血管内凝固障害に向かって進行する。
Dダイマーのミスマッチ上昇は、肺胞マクロファージから放出されるウロキナーゼ型プラスミノーゲンアクチベーター(u-PA)による肺胞内の局所的な線溶のアップレギュレーションによって説明される[22]。
さらに、ウイルスによる内皮細胞の直接感染(内皮に豊富に発現するACE2(アンジオテンシン変換酵素2、SARS-CoV-2の受容体)を介した細胞侵入を介したコロナウイルスにはむしろ特異的なメカニズム)は、プラスミノーゲンアクチベーターの大量放出をもたらす[23]。
疾患の重症度の上昇に伴い、フィブリノゲンレベルの上昇と活性化血小板によって生じるフィブリン形成の加速を伴うプロコアグラントシフトが生じる。PAI-1放出による線溶の抑制は、肺の毛細血管における血栓形成を加速させる。
ACE2は健康な状態では血管内皮の抗凝固特性を媒介するのに役立つが、SARS-CoV-2とACE2との結合は細胞障害を悪化させ、組織因子発現をアップレギュレートし、プロテインC系をダウンレギュレートする[24](図2)。
この状態では、組織の低酸素化や感染症の併発などの二次的な合併症の有無にかかわらず、凝固障害や血栓症などのイベントが起こりやすい。
図2
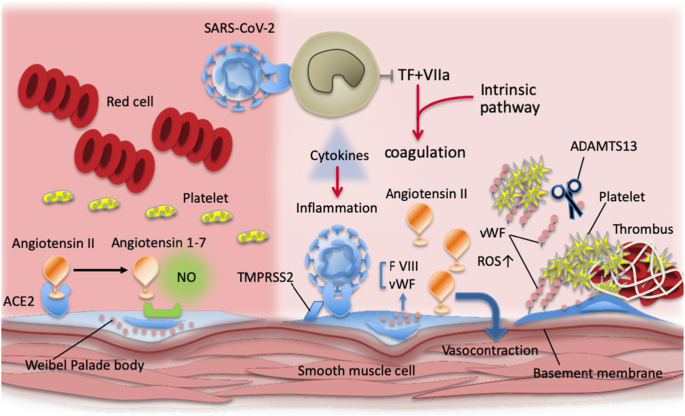
図2
COVID-19における血栓形成
健康な状態では、アンジオテンシン変換酵素2(ACE2)がアンジオテンシンIIをアンジオテンシン1-7に変換し、内皮細胞を刺激して一酸化窒素(NO)を産生する。NOは血管の血管拡張を助け、血小板の凝集を抑制する。
COVID-19では、SARS-CoV-2がACE2を占有し、アンジオテンシンIIレベルが上昇して血管収縮を起こし、血流が低下する。ワイベルパレイド体内に蓄積されたVon Willebrand factor(VWF)が循環に放出され、血栓形成が促進される。
ADAMTS13レベルの低下(COVID-19では報告されていない)は、血管内での血栓形成に寄与する可能性がある。
血球貪食症候群(HPS)/血球性リンパ組織球症(HLH)
血球貪食症候群(HPS)または血球貪食性リンパ組織球症(HLH)は、マクロファージ、ナチュラルキラー細胞、および細胞傷害性T細胞などの免疫細胞の過剰な活性化によって特徴づけられる高炎症性症候群である。
後天性HPS/HLHは、ウイルス感染を含む様々な誘因により二次的に活性化したマクロファージおよびリンパ球から放出される大量のプロ炎症性サイトカイン(TNF-α、インターフェロン-γ、IL-1、IL-2、およびIL-6)によるものである[25]。診断は5つの基準(発熱、脾腫、2つの細胞株のカウント低下、高トリグリセリド血症および/または低フィブリノゲン血症、血球貪食)に基づいて行われる[26]。
最近では、ナチュラルキラー細胞活性の低/不在、高フェリチン血症、および高可溶性インターロイキン-2受容体レベルを含む3つの追加基準が導入された。
HPS/HLHとCOVID-19関連凝固障害の間には、COVID-19における「サイトカインストーム」の発現などの類似点があるが、典型的なHPS/HLHの臨床所見および検査所見は、発熱および高フェリチン血症を除き、COVID-19では一般的ではなく、COVID-19のフェリチン値は通常、HPS/HLHでしばしば見られる極端な高値には達していない[27, 28]。
COVID-19患者を対象とした最近のレトロスペクティブ多施設研究では、非生存者と生存者のフェリチン値の上昇(1297.6 ng/mL vs 614.0 ng/mL、P < 0.01)およびIL-6の上昇(11.4 ng/mL vs 6.8 ng/mL、P < 0.0001)が報告されている[29]。
HPS/HLHの治療には、原因となる感染症への対処に加え、難治性疾患に対するコルチコステロイドおよび/または抗がん化学療法による免疫抑制療法が必要である[30]。
COVID-19では、骨髄生検での血球貪食は報告されていない[31];化学療法の使用は推奨されない。
HPS/HLHとは対照的に、COVID-19では重度の肺障害と凝固障害が優勢な特徴である。
肺上皮細胞におけるSARS-CoV-2の直接感染と肺毛細血管内皮細胞の損傷、およびそれに続く肺胞におけるu-PAによる線維素溶解の亢進を伴うフィブリン沈着が、COVID-19とHPS/HLHの違いに寄与している可能性がある[32]。
高サイトカイン血症説に基づき、抗サイトカイン療法がCOVID-19に重要な役割を果たしている可能性がある[33]。
しかし,HPS/HLHに用いられているコルチコステロイドは,重症急性呼吸器症候群(SARS)や中東呼吸器症候群(MERS)患者の転帰を改善せず,ウイルスクリアランスの遅延をもたらした[34].研究は進行中であるが、COVID-19の治療にコルチコステロイドを使用することを支持する強い証拠は現時点ではない。
抗リン脂質症候群(APS)
若い患者でも報告されている血栓性脳卒中は、COVID-19の重篤な合併症であり、抗リン脂質抗体の存在の臨床的意義は不明である[35、36]。二次性抗リン脂質症候群(APS)は、抗リン脂質抗体の存在下での動脈血栓症および静脈血栓症の発症によって定義される後天的自己免疫性血栓症である[37]。
抗リン脂質抗体、すなわち、ループス抗凝固抗体、抗カルジオリピン抗体、抗β2糖タンパク質(GP)I抗体は、血小板減少と活性化部分トロンボプラスチン時間(aPTT)の延長を誘導し、これらの所見はしばしばAPSの手がかりとなる。
肺障害はAPSでは一般的ではないが、稀ではあるが致死的な変異型である破局性抗リン脂質症候群(CAPS)は、急性肺障害を含む多臓器機能障害を引き起こす可能性があり[38]、過剰に活性化された補体系の関与が疑われている[39]。
APSにおける血栓症予防のための治療戦略は、抗血小板療法と抗凝固療法の併用を含むことができるが [40]、COVID-19患者において、未分割ヘパリンまたは低分子量ヘパリン(LMWH)の治療用量に抗血小板を追加するという同様のアプローチの有用性は不明であり、出血のリスクを増加させる可能性がある;COVID-19ではこの問題にランダム化比較試験が行われている [41]。
CAPSの治療には、抗凝固療法に加えて、グルココルチコイド、血漿交換および/または免疫グロブリンの静脈内投与が用いられる。COVID-19 [42]に対しては、convalescent plasma therapyが開発されているが、静脈内免疫グロブリンの使用は研究されていない。
Escherら[43]は、精神状態が変化し、呼吸不全と腎不全が続いたCOVID-19の興味深い症例を報告した。この患者は、抗カルジオリピン抗体および抗β2-GP I IgM抗体の上昇を示し、同時にフォン・ウィレブランド因子(VWF)および第VIII因子のレベルが著しく上昇していた。
この患者には当初、予防的にLMWHが投与されたが、凝固マーカーの異常が進行したため、抗凝固療法を治療用量の非分画ヘパリンに切り替え、臨床的には改善した。
APS抗体とCOVID-19におけるVWFの大幅な上昇が予後や治療に与える影響は不明のままであり、IgM抗体は通常APSでは病原性を示さないが、著者らは、このような異常な検査プロファイルは治療用量抗凝固療法の役割を示唆していると主張した。
血栓性微小血管症(TMA)
血栓性微小血管症(TMA)は、血栓性血小板減少性紫斑病(TTP)、溶血性尿毒症症候群(HUS)、および二次性TMAを含む臨床疾患である。
TMAは、微小血管症性溶血性貧血(微小血管症性溶血性貧血)および血小板減少症の臨床所見を伴う微小血管系(主に動脈)での血栓形成を特徴とする[44]。
COVID-19の剖検例における多臓器におけるびまん性微小血管血栓はTMAのそれと類似しており、血液学的マーカーの変化は、ヘモグロビンの減少、乳酸脱水素酵素(LDH)の増加、ビリルビンの増加、ハプトグロビンの減少、および分裂球症の出現に代表される軽度の微小血管症性溶血性貧血のそれと類似している[45]。
血栓性血小板減少性紫斑病(TTP)
TTPは、トロンボスポンジン1型をモチーフにしたジスインテグリンおよびメタロプロテアーゼのメンバー13(ADAMTS13)の自己抗体による枯渇または阻害によって引き起こされ、VWFの大型マルチマーを切断するメタロプロテアーゼ酵素である。
TTPでは、重度の血小板減少症や微小血管症性溶血性貧血とともに血小板/VWF微小血栓が認められる。後天性TTPは感染によって誘発される可能性があるが、これまでCOVID-19におけるADAMTS13の枯渇は報告されていない。むしろ、COVID-19におけるVWFレベルの上昇が報告されている。
Helmsら[20]は、COVID-19においてVWF活性、VWF抗原、および第VIII因子レベルが著しく上昇していることを発見した。さらに、調査した患者の90%近くがループス抗凝固薬陽性であり、COVID-19はTTPやAPSに類似した特徴を示していることを示唆している。
また,VWFと第VIII因子は内皮細胞内のWeibel-Palade体に蓄積されていることから,VWFの増加は血管障害の結果であると考えられた.内皮細胞のSARS-CoV-2感染はこれらの成分の放出を刺激し、ADAMTS13レベルとは独立してレベルが上昇する可能性がある。
コロナウイルスに類似したRNAウイルスであるデングウイルスは、内皮細胞を刺激してVWFを放出することが知られており[46]、VWFの循環レベルの上昇と脳卒中との関連がデングで報告されている[47]。
血小板減少、発熱、意識低下、および腎障害というTTPの特徴はすべてCOVID-19 [48]でも認められ、重複する病態生理が存在する可能性があることを示唆している。
しかしながら、TTPでは脳卒中や急性冠症候群などの動脈血栓塞栓症や微小血管(動脈)血栓症が優勢であるのに対し、静脈血栓塞栓症が優勢であり、COVID-19では微小血管症性溶血性貧血はあまり見られない。
溶血性尿毒症症候群(HUS)
HUSは感染症に続発して誘発されることもあり、補体経路の調節障害に起因する。HUSの典型的な症状は、微小血管症性溶血性貧血、急性腎障害、および他の臓器機能障害である[49]。Gavriilakiら[50]は、COVID-19は細菌性敗血症誘発性凝固障害/播種性血管内凝固障害よりもむしろHUSの病態生理および表現型に似ていると主張している。
活性化された補体は血小板を活性化し、溶血を誘導し、最終的に細胞膜を損傷する膜攻撃複合体(MAC [C5b-9])を形成する。COVID-19における補体系の研究はまばらであるが、MERS-CoVは、マウスモデルの血液および肺組織におけるC5aおよびC5b-9のレベルを増加させることが知られている[51]。
さらに、Margoら[52]は、COVID-19患者の肺微小血管系におけるMAC、C4d、およびマンノース結合レクチン関連セリンプロテアーゼ(MASP)2の沈着を描出した。
また、これらの所見は、オルタナティブおよびレクチンベースの補体経路の持続的な全身的活性化と一致していることも報告した。補体系の活性化はCOVID-19患者の内皮障害に関与している可能性があり、現在、抗補体療法の効果が研究されている[45]。
ヘパリン誘発性血小板減少症(HIT)
ヘパリン誘発性血小板減少症(HIT)は、ヘパリン治療後に起こりうる血栓性合併症である。COVID-19ではヘパリン(未分割またはLMWH)を用いた静脈血栓塞栓症予防が標準治療として浮上しているため、患者はHITを発症するリスクが高まる可能性がある。
この有害薬物反応は、血小板因子4(PF4)とヘパリンの多分子複合体を認識する血小板活性化抗体によって引き起こされる。患者はしばしば中等度から重度の血小板減少症を経験し、静脈血栓または動脈血栓(時には両方が同時に発生することもある)として顕在化する。
まれに、臨床的にも検査的にもHITに類似した症候群である「自発的HIT症候群」が、ヘパリン治療が行われていない場合に感染後に発生することがあるが [53] 、COVID-19では報告されていない。
HITのリスクは未分割ヘパリンと比較してLMWHの方が10倍低いため、COVID-19では血栓予防にLMWHが好まれる [5, 54]。血小板減少症、発症時期、血栓症、および血小板減少症の他の原因からなる4Tsスコアリングシステムは臨床診断に有用であるが [55] 、COVID-19患者での適用は困難であろう。
COVID-19患者ではベースラインの血小板数が高いと、HITに関連した血小板数の低下が臨床的に評価されない可能性があるため、HIT抗体の適切な検査評価を含めた臨床的な警戒が必要である。
HITが強く疑われる場合には、抗凝固療法を変更すべきであり、その際には、フォンダパリンまたは直接トロンビン阻害薬(例:アルガトロバン、ビバリルジン)[56]を含む選択肢が必要である。
結論
COVID-19のアウトブレイク以降、院外突然死エピソードの数が増加している。その理由の一つとして、COVID-19患者における大血栓性イベントの発生率の高さが考えられるが、これらの生命を脅かすイベントの発症機序は多因子性であり、現在も解明されていない。
COVID-19関連凝固障害は、細菌性敗血症誘発性凝固障害/播種性血管内凝固障害、HPS/HLH、APS、TTP/HUSに似ている点もあるが、凝固障害の新たなカテゴリーとして定義される可能性のあるユニークな特徴を持っている(図3)。
COVID-19関連凝固障害の発症には複数の因子が関与していることから、適切な管理を行うためには、その病態生理の理解を深めることが必要である。
図3

COVID-19関連凝固症の特徴的特徴
COVID-19関連凝固症(CAC)の臨床的・検査的特徴は、敗血症誘発性凝固症(SIC)/脱血性血管内凝固症(DIC)、血球貪食症候群(HPS)/血球貪食性リンパ組織球症(HLH)、抗リン脂質症候群(APS)、血栓性微小血管症(TMA)と部分的に重複している。しかし、これらの他の凝固病と完全に一致するものではない。

