コンテンツ
概要
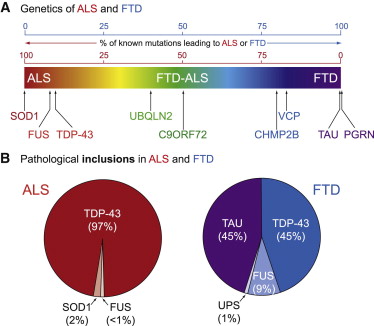
TDP-43は前頭側頭葉型認知症(FTLD)、家族性筋萎縮性側索硬化症(ALS)の発症原因タンパク質と考えられている。
ALSでは、TDP-43が90%以上関連する。
FTDではタウとTDP-43が約半々存在する。
https://sites.tufts.edu/als/the-answer/tdp-43-fus-tls-complex/
アルツハイマー病患者の20~50%にTDP-43
TDP-43の役割
TDP-43はRNAスプライシング、mRNAの代謝回転、RNA輸送、マイクロRNAの生合成、DNA結合を行うタンパク質と推定されている。
TDP-43はRNA中間体の切断調節をおこなっている。
![]()
https://www.jst.go.jp/pr/announce/20170809/index.html
TDP-43変異
TDP-43 変異の種類が多い 30種類以上
TDP-43はN末端とC末端に別れ、変異はC末領域に集中している。
dTDPは運動神経に重要な役割をもっている。
TDP-1は加齢の促進に関わる可能性
TDP-43変異体の増加
プロテアソーム活性の低下とmRNAの負の制御能の消失により、TDP-43の発現量が慢性的に増加
http://mlib.kitasato-u.ac.jp/homepage/ktms/kaishi/pdf/KI45-2/KI45-2p079-085.pdf
TDP-43は高度に制御されており、ストレスによるに局在化およびストレス顆粒内(SGs)内での蓄積の結果、制御を失う可能性が示唆されている。
https://www.ncbi.nlm.nih.gov/pubmed/23164372/
https://www.ncbi.nlm.nih.gov/pubmed/20948999/
TDP-43がストレス顆粒へ隔離されると、その結果核内で枯渇したTDP-43が急激に増加する可能性がある。このフィードバック応答がストレス顆粒のTDP-43の蓄積をさらに加速し、TDP-43が正常に機能しなくなる。
ストレス顆粒SGに局在するTDP-43は、安定したタンパク質凝集体を形成する可能性。
https://www.ncbi.nlm.nih.gov/pubmed/22306778
TDP-43凝集をペプチドで減少させても細胞死は防げない。
TDP-43はALS、FTLDの直接的な原因ではないかもしれない。
https://www.ncbi.nlm.nih.gov/pubmed/24252504
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3893365/
TDP-43と他の異常タンパク質の相互作用
前頭側頭葉型認知症患者のTDP-43とタウは、おそらくお互いに因果関係がない。
https://www.ncbi.nlm.nih.gov/pubmed/24861427
TDP-43の異常な蓄積が、タウの発現を誘導する可能性がある。
https://www.ncbi.nlm.nih.gov/pubmed/28960544
TDP-43と変異体αシヌクレインは、インビボでドーパミン作動性ニューロンと同時に過剰発現させると相乗的に神経毒性を誘導する。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3053535/
TDP-43 治療標的候補
ユビキチンプロテアソーム系とオートファジーの異なる役割
可溶性TDP-43は主にUPSによって分解されるが、凝集TDP-43のクリアランスはオートファジーを必要とする。
UPSおよびオートファジーの両方が機能的である場合にのみ、病理学的なTDP-43凝集体が可逆的な経路をたどり除去することができる。
それらのクリアランスは、オリゴマーTDP-43の自食作用による除去も含む。
過剰なTDP-43を除去するための治療は、異なる経路の組み合わせを標的とすべきである。
https://www.ncbi.nlm.nih.gov/pubmed/24424030
オートファジー
スペルミジン、タモキシフェン、カルバマゼピン
オートファジー活性化はFTLD-Uマウスのニューロンの病因を改善する。
https://www.ncbi.nlm.nih.gov/pubmed/23108236/
n-ブチリデンフタリド(漢方薬 当帰(トウキ))
n-BP投与はオートファゴソーム数を減少させるだけでなく、ミトコンドリアの形態学的機能低下を減少させることを明らかにした。
運動ニューロンのオートファジーダウンレギュレーションは、ALSマウスの生存を著しく延長する。
n-BPは小胞体ストレスを調節することによりオートファジーを調整している可能性がある。
エダラボン/Radiciva
エダラボンは安全であり、ALS患者の酸化的ストレスを軽減することによって運動機能障害の進行を遅延させる可能性がある.
https://www.ncbi.nlm.nih.gov/pubmed/17127563/
フルフェナジン・メトトレメプラジン
https://www.ncbi.nlm.nih.gov/pubmed/24974230/
ベルベリン
ベルベリンはmTORの阻害およびオートファジー分解経路の活性化を介してTDP-43タンパク質の蓄積を減少させる。
https://www.ncbi.nlm.nih.gov/pubmed/27769241/
エンド-リソソーム内経路
https://www.ncbi.nlm.nih.gov/pubmed/29611555
ヒートショックプロテイン
ヒートショックプロテインはTDP-43フィラメント凝集を阻害する。
https://www.ncbi.nlm.nih.gov/pubmed/24595055
オートファジーの小分子アクチベータ、ユビキチン – プロテアソーム系、DP-43タンパク質の活性化、シャペロンネットワークによるTDP-43のミスフォールディングの防止とクリアランスの向上がALSおよび前頭側頭型認知症を効果的に治療するための最も重要な標的
https://www.ncbi.nlm.nih.gov/pubmed/25652699
Hsp104シャペロン増強
TDP-43のみならずFUSに対しても、適切なタンパク質局在を回復させ、凝集物の溶解を増強することが観察されている。
https://www.ncbi.nlm.nih.gov/pubmed/24439375
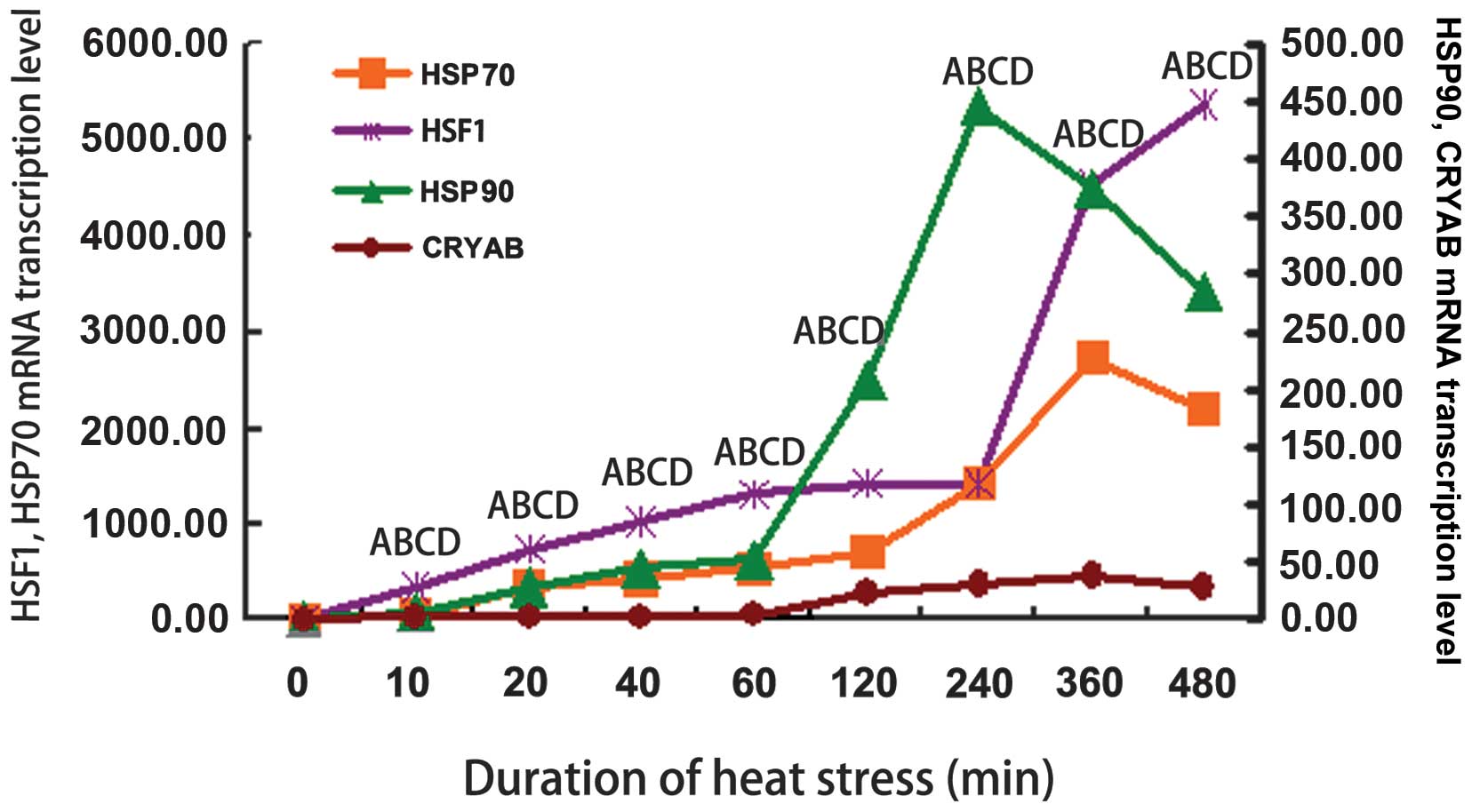
HSF1,HSP70
https://www.ncbi.nlm.nih.gov/pubmed/26936937
USP14
https://www.ncbi.nlm.nih.gov/pubmed/26998235.2
スモールヒートショックプロテインB8(HspB8)
https://www.ncbi.nlm.nih.gov/pubmed/20570967
HSP90阻害剤
シャペロン依存性神経変性疾患へのHsp90阻害剤による治療の展望
Hsp90を阻害し、Hsp70活性を増加させる治療戦略
https://www.ncbi.nlm.nih.gov/pubmed/25258700
HSP90阻害剤 ゲルダナマイシン
TDP-43はHsp90シャペロンネットワークによって制御されていると考えられている。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4172285/
ショウジョウバエの突然変異体TDP-43の神経毒性は、Hsp70を過剰発現させることで緩和された。
https://www.ncbi.nlm.nih.gov/pubmed/21441568/
https://www.spandidos-publications.com/ijmm/37/1/56
プログラニュリン/Progranulin(PGRN)
グラニュリン(GRN)の前駆体
PGRNの正確な役割は分かっていないが、神経栄養機能、炎症の調節を行い、細胞周期、運動性の制御に関与するキナーゼ依存性シグナル伝達カスケードを活性化する抗炎症分子であり、脳の保護効果有する新規標的因子として期待されている。
オートファジーにはプログラニュリンが必要であり、プログラニュリンの欠乏はオートファジーおよびTDP-43蓄積の障害(前頭側頭型認知症)を引き起こす。
プログラニュリンはオートファジーの重要な調節因子であるAMPKおよび、またはTBK1の上流に位置することが示唆されている。
老化など長期間によるオートファジーの慢性的な欠乏は、神経変性疾患のリスク増加につながる。
https://www.ncbi.nlm.nih.gov/pubmed/28778989
トレハロース
トレハロースはプログラニュリン発現を増強させ、神経変性疾患を治療するための有望な治療薬。
https://www.ncbi.nlm.nih.gov/pubmed/27341800
https://molecularneurodegeneration.biomedcentral.com/articles/10.1186/s13024-016-0114-3
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4919863/
低酸素
https://www.ncbi.nlm.nih.gov/pubmed/20933034
ダイニン/dynein の阻害
ダイニンの薬理学的な阻害は細胞内のプロテアソームによる分解が優先され、凝集ミスフォールドタンパク質を減少させた。ダイニン変異それ自体は運動ニューロンに有害。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5584856/
その他
酸化ストレス
エキソソーム分泌
https://www.ncbi.nlm.nih.gov/pubmed/27679482
C9orf72遺伝子
将来的に有望な治療標的のひとつ
C9orf72突然変異は、すべてのFTD症例の7〜11%に該当
http://www.als.gr.jp/staff/document/kiso/kiso_39.html
SOD1遺伝子
TDP-43阻害化合物
ベルベリン
オートファジー活性
https://www.ncbi.nlm.nih.gov/pubmed/27769241
トレハロース
トレハロースによるオートファジー制御のによるTDP-43蓄積の減少 in vitro
https://www.ncbi.nlm.nih.gov/pubmed/29383655
メチレンブルー、ディメボン
メチレンブルーおよびディメボンは、TDP-43の凝集を阻害する。
https://www.ncbi.nlm.nih.gov/pubmed/19560462
オメガ3多価不飽和脂肪酸
ω-3 PUFAが多い食品の消費は、ALSの発症を予防または遅延させるのに役立つ可能性がある。
https://www.ncbi.nlm.nih.gov/pubmed/25023276/
ラパマイシン、スペルマジン、カルバマゼピン、タモキシフェン
オートファジーを活性化するラパマイシン、スペルマジン、カルバマゼピンおよびタモキシフェンの4つの異なる化合物はすべて、TDP-43トランスジェニックマウスにおいて神経保護を示した。
ラパマイシンはTDP-43凝集の阻害を誘発
https://www.ncbi.nlm.nih.gov/pubmed/22473010/
グルタチオンモノエチルエステル
TDP-43病理を伴う運動ニューロンNSC-34細胞におけるグルタチオンの枯渇は、細胞質ゾル凝集の発生、TDP-43リン酸化、突然変異体TDP-43と同様の病理を生じる。
酸化ストレスとグルタチオン合成機能の喪失がTDP-43の過剰発現と密接に関連することを強く示唆している。
https://www.ncbi.nlm.nih.gov/pubmed/28818672
https://www.ncbi.nlm.nih.gov/pubmed/22198567
ラパマイシン
オートファジー活性によるTARDBP /TDP43クリアランス
https://www.ncbi.nlm.nih.gov/pubmed/23108236
リルメニジン/Rilmenidine
中枢性降圧剤として欧米で認可されているリルメニジンによる細胞の処理は、筋萎縮性側索硬化症(ALS)に関連するSOD1またはTARDBP / TDP-43変異体を発現する運動ニューロン細胞における強力なオートファジー誘導を示す。
https://www.ncbi.nlm.nih.gov/pubmed/28980850
シャペロンHSPB8発現促進剤(コルヒチン、ドキソルビシン)
https://www.ncbi.nlm.nih.gov/pubmed/26961006
https://www.ncbi.nlm.nih.gov/pubmed/27466192
ニモジピン
アリモクロモル/Arimoclomol
ヒートショックプロテイン発現の誘導補助剤
https://www.ncbi.nlm.nih.gov/pubmed/23978556
促進要因
過剰セレンに注意?
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3979119/
過剰レプチンに注意?
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4140473/
ミネラル欠乏に注意
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5786541/
パーソナライズド メディシン
https://www.ncbi.nlm.nih.gov/pubmed/27400686