Contents
Sirtuins in Alzheimer’s Disease: SIRT2-Related GenoPhenotypes and Implications for PharmacoEpiGenetics
www.ncbi.nlm.nih.gov/pmc/articles/PMC6429449/
要旨
サーチュイン(SIRT1-7)は、クロマチンサイレンシング、細胞周期制御、細胞分化、細胞ストレス応答、代謝、老化に重要な役割を持つNAD+依存性タンパク質脱アセチル化酵素/ADPリボシルトランスフェラーゼである。
サーチュインは、アルツハイマー病で障害されるエピジェネティック・マシーンの構成要素であり、アルツハイマー病の発症に寄与している。APOEε4陰性集団におけるSIRT2-C/T遺伝子型(rs10410544)(50.92%)とアルツハイマー病感受性との間には関連がある(SIRT2-C/C、34.72%、SIRT2-T/T 14.36%)。SIRT2とAPOEの変異体をビジェニック・クラスターに統合すると、18個のハプロタイプが得られる。
アルツハイマー病における5つの最も頻度の高いビジェニック遺伝子型は、33CT(27.81%)33CC(21.36%)34CT(15.29%)34CC(9.76%)および33TT(7.18%)である。SIRT2-T/T>SIRT2-C/T>SIRT2-C/Cキャリア、およびAPOE-4/4遺伝子型を保有する患者におけるSIRT2-T/TおよびSIRT2-C/TキャリアのAPOE-3/4およびAPOE-4/4キャリアの蓄積がある。
SIRT2バリアントは生化学的、血液学的、代謝学的、心血管表現型に影響を与え、アルツハイマー病における薬理上のエピジェネティックな転帰に適度に影響を与える。SIRT2-C/Tキャリアは最高の反応性を示し、SIRT2-T/Tキャリアは中間パターンを示し、SIRT2-C/Cキャリアは多因子治療に対する最悪の反応性を示す。
APOE-SIRT2ビジェニッククラスターでは、33CCキャリアは33TTおよび34CTキャリアよりも良好な反応を示し、24CCおよび44CCキャリアは最悪の反応者として振る舞う。CYP2D6の広範な代謝物(EM)は最良の反応者であり、貧弱な代謝物(PM)は最悪の反応者であり、超高速代謝物(UM)は中間代謝物(IM)よりも優れた反応者である傾向がある。CYP2D6遺伝子型との関連では、SIRT2-C/T-EMが最も優れた反応性を示する。いくつかのSirtuinモジュレーターがアルツハイマー病治療の候補となる可能性がある。
キーワード
アルツハイマー病、APOE、CYP2D6,エピジェネティクス、遺伝子型、多因子治療、ファーマコエピジェネティクス、薬理遺伝学、サーチュイン1-7,SIRT2
1. はじめに
アルツハイマー病の患者数は約4,500万~5,000万人(2030年には7,500万人、2050年には1億4,500万人、新規患者数は770万人/)。認知症の世界的な経済的コストは6040億ドル以上で、世界の国内総生産の1%に相当する。費用面では、米国では2260億ドル/年、欧州では1600億ユーロ/年をアルツハイマー病が占めている(50%以上がインフォーマルケアの費用、10~20%が薬理学的治療の費用)。米国だけでも、65歳以上の人のアルツハイマー病の直接費用は、2050年には1.1兆ドル以上になる可能性があると推定されている(2015年から 2050年までの医療費は約20.8兆ドルと推定されている)[1]。その関連性にもかかわらず、逆説的なことに、過去15年間にアルツハイマー病に対する新薬は開発されていない[1]。抗アルツハイマー病薬は費用対効果が低く、従来の薬で軽度の効果を得ることができる患者は20%未満である[1,2]。アルツハイマー病のファーマコゲノミクスは、治療成績の予測や反応者 vs. 非反応者の識別に有用であることが証明されている[2,3,4,5,6]。
神経変性疾患には、以下の理由から根治的な治療法がない[7]。
- (i)エピジェネティックな変化、脳血管の変化、環境的危険因子を伴う多遺伝子/複合体異常
- (ii)加齢に伴う発症と病勢進行(加齢に伴う有病率の増加)
- (iii)早期に発症し、数十年後に臨床症状が出現する進行性の神経細胞変性
- (iv) 異常なタンパク質の蓄積および病原性タンパク質の構造変化(神経毒性副産物の異常沈着)
- (v) 予知診断のための特異的なバイオマーカーがなく、早期発見のための特異的でない臨床表現型
- (vi) 治療的介入の選択肢が限られている。
エピジェネティクスは、DNA配列に構造的な変化を伴わない遺伝子発現の可逆的な変化を研究する学問である。エピジェネティック・マシナリーは、転写および転写後のレベルで遺伝子発現を調節することに寄与する相互に連結された要素のクラスターによって統合されている。エピジェネティックな変化は、薬理学的および/または栄養学的介入によって可逆的に変化する可能性がある。
古典的なエピジェネティックなメカニズムには、DNAメチル化、クロマチンリモデリング/ヒストン修飾、およびマイクロRNA(miRNA)調節が含まれる。正準DNAメチルトランスフェラーゼ(DNMT)(DNMT1,DNMT3A、DNMT3B)は、DNAメチル化パターンを維持する役割を担っている。DNAの脱メチル化は、少なくとも3つの酵素ファミリーによって制御されている。
- (i) 10-eleven translocation (TET) ファミリー; TET は 5mC の 5hmC への変換を仲介する
- (ii) AID/APOBEC ファミリー; これらの酵素は 5mC または 5hmC の脱メチル化の仲介役として作用する
- (iii) BER (base excision repair) グリコシラーゼファミリー; BER は DNA 修復に関与している。
クロマチンリモデリングとヒストンの翻訳後修飾は、様々なエフェクターの制御下にある。翻訳後修飾には、メチル化、アセチル化、ユビキチン化、スモイル化、リン酸化、アシル化(プロピオン化、ブチリル化、2-ヒドロキシイソブチリル化、サクシニル化、マロニル化、グルタリル化、クロトニル化、β-ヒドロキシブチリル化)N-グリコシル化、O-GlcNAシル化、シャペロン化、グルタチオニル化、ポリADPリボシル化、過酸化などがある。
ヒストンメチル化はヒストンリジンメチルトランスフェラーゼ(HKMT)によって触媒され、ヒストンデメチル化はヒストンリジンデメチラーゼによって触媒される。ヒストンのアセチル化は、ヒストンリジンアセチルトランスフェラーゼ(KAT)の5つのファミリー(KAT2A/GCN5,KAT2B/PCAF、KAT6-8,CREBBP/CBP、EP300)によって触媒される。
ヒストン脱アセチル化は、転写抑制やクロマチン構造の閉鎖に関与している。哺乳類には18のHDACが存在する。哺乳類のHDACは、酵母との相同性により4つのクラスに分類される(クラスI、II、III、IV)。クラスIのHDACは、核タンパク質であるHDAC1,2,3,および8によって代表され、HDAC1およびHDAC2は、転写コアプレッサー複合体(SIN3A、NuRD、CoREST)に存在し、HDAC3は、他の複合体(SMRT/N-CoR)の生物学的活性に参加している。
クラスIIのHDACは、クラスIIa(HDAC4,5,7,および9)およびIIb(HDAC6および10)に細分化される。クラスIIa酵素は核-細胞質界面に位置し、クラスIIbグループのメンバーは細胞質酵素である。
クラスIII HDCAはサーチュインファミリーのメンバーである(表1)。SIRT1,2,6,および7は核内酵素であり、SIRT3,4,および5はミトコンドリア酵素であり、SIRT1および2は細胞質に優先的に位置している。HDAC11は、クラスIVのHDACファミリーに属する核内タンパク質である[8,9,10,11,12,13,14,15]。
表1 サーチュイン
| 遺伝子 | 名前 | 軌跡 | 他の名前 | MIM番号 | 表現型 |
|---|---|---|---|---|---|
| SIRT1 | サーチュイン、S。cerevisiae、ホモログ1 | 10q21.3 | SIR2L1 | 604479 | アルツハイマー病; 胃がん; 肝細胞癌; 肥満; パーキンソン病; 前立腺がん; 2型糖尿病 |
| SIRT2 | サーチュイン、S。cerevisiae、ホモログ2 | 19q13.2 | SIR2L、SIR2L2 | 604480 | 脳腫瘍; 神経膠腫; 子癇前症と胎児発育遅延 |
| SIRT3 | サーチュイン、S。cerevisiae、ホモログ3 | 11p15.5 | SIR2L3 | 604481 | 乳癌; メタボリックシンドローム2型糖尿病 |
| SIRT4 | サーチュイン、S。cerevisiae、ホモログ4 | 12q24.23-q24.31 | SIR2L4 | 604482 | インスリノーマ; 2型糖尿病 |
| SIRT5 | サーチュイン、S。cerevisiae、ホモログ5 | 6p23 | SIR2 | 604483 | 乳癌; 結腸直腸癌; 肝臓がん; 肺癌 |
| SIRT6 | サーチュイン6(Sir2、S。cerevisiae、ホモログ、6) | 19p13.3 | SIR2L6 | 606211 | 脂肪肝疾患; リンパ球減少症; ロードキフォシス; メタボリック・シンドローム; 2型糖尿病 |
| SIRT7 | サーチュイン7(Sir2、S。cerevisiae、ホモログ、7) | 17q25.3 | SIR2L7 | 606212 | 乳癌; 白血病; リンパ腫; 甲状腺癌 |
エピジェネティック・マシーンの変化はアルツハイマー病の病因であり[9,10,11,12,13,16,17]、ファーマコエピジェネティック装置を調節することにより薬理遺伝学的結果に影響を与える[14,18]。サーチュインとApoEはアルツハイマー病発症におけるパラダイム的な役割を果たしているが、発症や治療におけるサーチュインとAPOEの間の潜在的な相互作用に関するデータは得られていない。
本論文では,サーチュイン2バリアント(rs10410544)を有する患者のジェノフェノタイプと,認知症の最も関連性の高い危険因子であるアポリポ蛋白質E(APOE)遺伝子,およびアルツハイマー病薬理遺伝学において最も影響力のある代謝遺伝子であるCYP2D6遺伝子との相互作用について初めて報告する[2,3,4,6,19]。
2. サーチュイン
サーチュイン(表1)は、ゲノムの安定性維持に特別な役割を持つ酵母遺伝子消音修飾因子(Silent Information Modifier 2, SIR2)の特徴付けに続いて、酵母で発見された。SIR2ホモログは、異なる種で同定されている。このカテゴリーのタンパク質脱アセチル化酵素は、細胞周期の進行、ゲノムの安定性の維持、および長寿の制御において重要である。酵母では、SIR2は複製と遺伝子サイレンシングの両方に影響を与えるタンパク質複合体と相互作用している。メタゾ類では、最大のSIR2ホモログであるSIRT1は、エピジェネティックな改変、サーカディアンシグナル、DNA組換え、DNA修復に関与している。哺乳類のSIRT1はDNA複製の調節に参加している[20]。サーチュイン(Sirt1-Sirt7)はNAD+依存性タンパク質脱アセチル化酵素/ADPリボシルトランスフェラーゼであり、クロマチンサイレンシング、細胞周期制御、細胞分化、細胞ストレス応答、代謝、老化において決定的な役割を果たしている[21]。異なるサーチュインは同様の細胞プロセスを制御しており、協調した作用モードを示唆している[22]。
2.1. SIRT1
SIRT1 (10q21.3)は、転写、DNA複製、DNA修復に関与するNAD+依存性ヒストン脱アセチル化酵素であり、ストレス応答およびクロマチンサイレンシング因子として作用する [23]。SIRT1は、エネルギー依存性核細胞サイレンシング複合体(ENOSC)のSUV39H1およびNMLと相互作用し、栄養不足時にリボソームRNA(rRNA)の転写をダウンレギュレーションし、エネルギー支出を減らし、細胞の生存率を向上させる[24]。ミトコンドリア機能の強化と抗酸化保護に関連するヒストンやタンパク質は、現在SIRT1の基質となっている。Sir2タンパク質(酵母およびマウス)は、NAD+依存性ヒストン脱アセチル化酵素であり、ヒストンH3のリジン9および14,ヒストンH4のリジン16に脱アセチル化活性を有する[25]。SIRT1関連遺伝子のサイレンシングは、ヒストンテールの脱アセチル化、ヒストンH1のリクルートと脱アセチル化、およびSIRT1が介在するヘテロクロマチン形成によって活性化された低メチル化H3-K79の拡散から生じる[26]。
細胞内の NAD+ レベルの変動が SIRT1 活性を調節している。SIRT1 は、タンパク質に結合した NADH の核内組織に影響を与える。遊離NADHと結合NADHは核内でコンパートメント化され、その核内分布はSIRT1に依存している[27]。肝臓では、SIRT1は、代謝経路に関与する酵素をコードする遺伝子を含む時計制御遺伝子の概日振動を調整する。G1/Sの進行は、サーカディアン遺伝子の発現と同様にSIRT1の不在によって影響を受け、欠陥脂肪酸β酸化による脂質蓄積を伴う[28]。Sir2ファミリーのいくつかのメンバーは、食事に応答して寿命を調節することができる[29]。Hst2はSir2ホモログであり、反復リボソームDNAの安定性を促進することがSir2に依存しない寿命延長に関与している。DNAの安定性は、カロリー制限による酵母の寿命延長に重要である。また、サーチュインは、テロメアクロマチンを無傷で維持することにより、複製老化の制御にも影響を与える。Sir2タンパク質の加齢に関連した減少は、酵母細胞におけるヒストンH4リジン-16アセチル化の増加とテロメア領域でのヒストンの喪失を伴い、このエピジェネティックな変化は、特定の遺伝子座の転写サイレンシングを阻害する結果となる[30]。SIRT1は、転写コアクチベーターPGC1Aを介して、空腹時のシグナルに応答して、肝内の糖新生/解糖経路を制御している[31]。SIRT1は、がん、血管新生、動脈硬化、Notchシグナルの調節、糖尿病、記憶と学習、不安、アルツハイマー病やハンチントン病などの神経変性疾患にも関与している[10,11,12,13,32]。
2.2. SIRT2
SIRT2(19q13.2)は、α-チューブリンを脱アセチル化するNAD+依存性脱アセチル化酵素であり、セントロソーム、分裂紡錘体、中間体を含む細胞周期中の分裂構造を制御し、セントロソーム増幅と繊毛形成を制御している[33]。
2.3. SIRT3
SIRT3(11p15.5)は、NAD+依存性脱アセチラーゼおよびモノ-ADP-リボシルトランスフェラーゼのサーチュインファミリーのミトコンドリア脱アセチラーゼであり、老化、代謝、および遺伝子サイレンシングなどの様々な細胞プロセスを制御する[34]。SIRT3遺伝子は、11p15.5上の大きなインプリントされた遺伝子ドメインに位置し、ユニークなN末端ペプチド配列内にミトコンドリアターゲティングシグナルを持つ[35]。SIRT3は強いNAD+依存性のヒストン脱アセチル化活性を示し、H4のLys16と、それ以下の範囲ではH3のLys9に特異性を持つ。SIRT3は、そのプロモーターにリクルートされると標的遺伝子の転写を抑制し、細胞ストレス(すなわち、DNA損傷、紫外線照射)および/またはSIRT3の過剰発現に続く核からミトコンドリアへと輸送される[36]。ミトコンドリアSIRT3の特定のSNPは、ヒトの寿命の増加と関連している。SIRT3関連のミトコンドリア酵素脱アセチル化は、電子輸送、抗酸化活性、脂肪酸β酸化、アミノ酸代謝に関与している。SIRT3は活性酸素を低下させ、ミトコンドリア透過性遷移孔の成分を阻害することでアポトーシスを予防する[37]。Sirt3は空腹時のミトコンドリア中間体代謝と脂肪酸の利用を調節し、長寿に寄与する[38]。
低酸素状態での2-ヒドロキシグルタル酸(2-HG)レベルの増加は、リジン脱アセチル化酵素の活性化と関連している。2-HGはエピジェネティックな機能を持つ低酸素代謝物である。乳酸脱水素酵素、イソクエン酸脱水素酵素、リンゴ酸脱水素酵素などの2-HG生成酵素のアセチル化は、2-HG生成活性を調節する可能性がある。低酸素状態での2-HGの上昇は、リジン脱アセチラーゼの活性化と関連している[39]。
2.4. SIRT4
SIRT4 (12q24.23-q24.31)は細胞代謝の重要な調節因子であり、脱アセチラーゼ活性は悪く、ADP-リボシルトランスフェラーゼ活性は強い。SIRT4は、ミトコンドリア酵素グルタミン酸脱水素酵素(GDH、GLUD1)と相互作用し、GDHを阻害する[40]。SIRT4は、ピルビン酸脱水素酵素(PDH)複合体のDLAT E2コンポーネントからのリポアミド補体を加水分解し、PDH活性を阻害する[41]。
2.5. SIRT5
SIRT5 (6p23)は、効率的なタンパク質リジンデスキニラーゼおよびデマロニーラーゼである。カルバモイルリン酸合成酵素-1 (CPS1) は SIRT5 の標的である。タンパク質のリジン脱アセチル化は、Sirt5によって反転させることができる翻訳後修飾を表している[42]。SIRT5 は弱い脱アセチラーゼ活性を持ち、強いデスキニラーゼ、デマロニラーゼ、デグルタリラーゼ活性を持つ[43]。
2.6. SIRT6
SIRT6 (19p13.3)は、NAD+依存性ヒストンH3リジン-9 (H3K9)脱アセチル化酵素であり、テロメアクロマチンを調節し、DNA損傷への耐性を促進し、ゲノムの不安定性を抑制し、塩基除去修復の役割と関連している[44,45]。Sirt6を過剰発現させたトランスジェニックマウスは、野生型マウスよりも有意に寿命が長い[46]。SIRT6は、遺伝子のサイレンシングを介して代謝恒常性を調節するゲノム安定性の保護因子である。NF-κB 経路の過剰活性化を介した Sirt6 欠損後に老化が加速する可能性がある。SIRT6 は H3K9me3 特異的ヒストンメチルトランスフェラーゼ Suv39h1 に結合してその単量化を誘導し、SIRT6 はシステインの単量化と Suv39h1 のクロマチン除去を介した IκBαのアップレギュレーションを介して NF-κB 経路を減衰させる [47]。
初期胚発生の間、ヒストンおよび DNA の修飾は、多能性と分化の間の平衡を維持するために重要である。SIRT6遺伝子の不活性化変異は、先天性異常と周産期死亡率をもたらす。Asp63(Hisへ)での変化は、H3K9脱アセチラーゼとデミリストリアーゼの機能を完全に喪失させる。マウスのSIRT6 D63H胚性幹細胞(mESCs)は、多能性遺伝子の発現を抑制せず、胚体に分化した際に重篤な表現型を示す。D63H変異体mESCは機能的な心筋細胞病巣の形成に失敗する[48]。Sirt6はグリアの分化に影響を与えずに海馬の神経新生を増加させる[49]。
2.7. SIRT7
SIRT7遺伝子(17q25.3)は、10個のエクソンを含み、6.2kbに及び、AML1(RUNX1)GATA、CEBPA、SP1の結合部位、およびいくつかのAluリピート(主にイントロン3内)を有する[50]。SIRT7は、原核生物には存在しないサーチュインクラスIVに属するタンパク質をコードしている。内在性のヒトSIRT7は、RNAポリメラーゼI(pol I)およびUBF(上流結合因子;上流結合転写因子UBTF)とコロケーションする。SIRT7 の過剰発現は Pol I を介する転写を増加させるが、SIRT7 のノックダウンまたはその触媒活性の阻害は、Pol I と rDNA との結合を減少させ、pol I の転写を減少させる [51]。SIRT7はNAD+依存性のH3K18Ac脱アセチラーゼであり、癌細胞の形質転換状態を安定化させる。SIRT7は遺伝子標的のプロモーターに結合し、そこでH3K18Acを脱アセチル化して転写抑制を促進する[52]。Sirt7 -/-マウスは、骨格および心血管機能を損なう全身的な加齢に関連した欠陥のために早死にする[53]。
3. アルツハイマー病におけるサーチュイン
3.1. SIRT1
前駆体mRNAスプライシングの制御低下は神経変性と関連している。イントロン除去を行い、スプライスサイトの選択を制御する機械の欠陥は、細胞の老化や生物の老化に寄与している。p53,IGF-1,SIRT1,ING-1のスプライスバリアントと老化との間には、機能的な関連性がある。スプライシング因子の活性の変化および主要なスプライスバリアントの産生の変化は、細胞の老化および老化表現型に影響を与える可能性がある [54]。SIRT1は、異常APP処理、神経炎症、神経変性、ミトコンドリア機能不全などのアルツハイマー病関連の発症機序に関与している[55,56]。突然変異や構造変化による APP の異常処理に起因する アミロイドβペプチドは、神経細胞に神経毒性を示す。NF-κB シグナルは アミロイドβ毒性において重要であり、NF-κB の調節サブユニットである RelA は アミロイドβ刺激を受けたミクログリアでアセチル化されている。Sirt1の過剰発現とSirt1の活性化はNF-κBシグナル伝達を減少させることで神経保護に寄与する[57]。カロリー制限はアルツハイマー病型アミロイド神経病理を予防し、トランスジェニック(Tg2576)マウスの脳内でSirt1発現とNAD+レベルを増加させる。Sirt1はRock1発現を阻害することにより、APPの非アミロイド性処理を促進する[58]。ADAM10は、アミロイド原性のアミロイドβペプチドではなく、可溶性のAPP-αを放出するためにAPPを切断するスクレプターゼとして作用することができる。Sirt1は、レチノイン酸受容体β(RARB)の活性化を介してADAM10発現と可溶性APP-αペプチドを増加させる[59]。
異常発現したmiR-200a-3pはアルツハイマー病脳に存在する。miR-200a-3pの抑制は、SIRT1を標的としたPC12細胞のアミロイドβ25-35誘導アポトーシスを減衰させる[60]。アミロイドβ25-35ペプチドは、完全長アミロイドβ1-42の毒性フラグメントである。アミロイドβ25-35に曝露された細胞では、SIRT1の発現と同様にPin1遺伝子およびタンパク質の発現が低下する。BDNF mRNAおよびタンパク質レベルはアミロイドβ25-35により増加し、神経毒性のある障害に対する代償応答を反映している。Pin1およびSirtuin 1は神経保護作用を有し、非アミロイド原性経路を介したアミロイド前駆体タンパク質処理を促進することによりアミロイド沈着を減少させる[61]。
哺乳類のラパマイシン標的(mTOR)は、代謝、細胞増殖、およびタンパク質合成の調節因子である。mTOR活性の低下は老化を遅らせる。神経細胞におけるアミロイドβ25-35処理は、細胞質から核へのmTORの転座を刺激し、その結果、mTORおよびp-mTOR(Ser2448)の発現が上昇し、PGC-1βの発現が低下する。さらに、PGC-1βの過剰発現はmTORの発現を低下させることがわかった。アミロイドβはSer2448の部位でmTORとp-mTORの発現を増加させ、アミロイドβの刺激はmTOR発現の調節においてサーチュイン1,PPARγ、PGC-1β経路に依存していると考えられる[62]。
ポリ(ADP-リボース)ポリメラーゼ(PARP)およびサーチュインは、細胞代謝、転写、およびDNA修復の調節に関与している。これらの酵素の欠損はアルツハイマー病において重要な役割を果たす可能性がある。アミロイドβペプチドおよび炎症は、PARP1の活性化および細胞死につながる可能性がある。アミロイドβ42オリゴマー(アミロイドβO)は、γセクレターゼの重要な構成要素であるプレセニリン(PSEN1およびPSEN2)の転写を増強する。アミロイドβペプチドは、β-セクレターゼ(BACE1)PSEN1,PSEN2,およびPARP1の発現を活性化する。PARP1 阻害剤である PJ-34 は、アミロイドβO の存在下で、α-セクレターゼ(ADAM10)PSEN1,PSEN2 の転写を上昇させた。また、PJ-34 は、核内 SIRT1,SIRT6,ミトコンドリア SIRT4,PARP3 の mRNA レベルを上昇させる [63]。
アルツハイマー病 では、SORL1(ソルチリン関連受容体)や SIRT1 遺伝子の発現が欠損している。SORL1プロモーターのDNAメチル化は、健康な高齢者とアルツハイマー病患者の両方の血液と脳の間で観察される発現の違いの原因となるメカニズムの一つとして作用する可能性がある[64]。
SIRT1はまた、APOEと関連した病原性メカニズムにも関与している。APOE-4の発現はSIRT1の著しい減少を引き起こす [65]。APOE4は、アルツハイマー病、血管性認知症、動脈硬化、心血管疾患、および他の形態の認知症(すなわち、血管性認知症、レビー小体型認知症)における最も重要な遺伝的危険因子の1つである。ApoE4は、二本鎖DNAを高親和性で結合し、核内転座を受ける転写因子として作用する。ApoE4のDNA結合部位は、栄養サポート、プログラムされた細胞死、微小管の分解、シナプス機能、サーチュイン、老化、およびインスリン抵抗性に関連する遺伝子の~61,700の遺伝子プロモーター領域を含む[66]。Pin1 mRNAはアポE4マウスの海馬ではアポE3マウスよりも高いが、内耳皮質と頭頂皮質では低い発現が検出された。Pin1レベルの低下は神経原線維変性とアミロイド生成過程を増加させる可能性がある。ApoE4マウスの前頭皮質ではSirt1レベルが低下し、前頭皮質ではPSEN1 mRNAレベルが低下している[67]。ApoE3とApoE4はAPPとナノモルの親和性を示すが、ApoE4のみがSirt1と可溶性アミロイド前駆体タンパク質α(sAPPα)のアミロイドβに対する比率を低下させ、神経保護性Sirt1と神経毒性Sirt2の比率が著しく異なる結果となった。ApoE4はまた、タウリン酸化およびAPPリン酸化を誘発し、プログラムされた細胞死を誘導する[65]。睡眠障害と概日リズム障害はアルツハイマー病では頻繁に起こる。ApoE-/-マウスの視交叉上核(SCN)の研究では、アミロイドーシスとタウの沈着とともに、網膜メラノプシンの発現が減少し、SIRT1を介したエネルギー代謝と時計遺伝子の発現が変化したことが明らかになった[68]。
グリセルアルデヒド由来の高度糖化最終生成物(AGEs)は、アルツハイマー病における神経毒性の源である。AGEsは活性酸素を介してAPPとアミロイドβを増加させ、AGEsとアミロイドβの組み合わせは神経毒性を増強する。AGEsは活性酸素を介してAPP処理タンパク質とSirt1の発現をアップレギュレートするが、下流の抗酸化遺伝子HO-1とNQO-1には影響を与えない。AGEsはSirt1の神経保護効果を損ない、ERストレスを介した神経細胞死を引き起こす[69]。酸化性グリコトキシン(AGEs)は食品中に存在する。現代の食生活の変化には、神経毒性のあるメチルグリオキサール誘導体(MG)などの過剰な栄養結合型AGEsが含まれている。食餌性AGEsは、抑制されたSIRT1および他の宿主防御を介してアルツハイマー病を促進すると推測されている[70]。
神経原線維変性のBraakおよびBraak段階に応じてグループ化されたアルツハイマー病症例の内耳皮質および海馬小領域および白質におけるSIRT1,3,および5の比較免疫ブロッティングおよび免疫組織化学的研究により、SIRT1の神経細胞小細胞再分布は、その発現の減少と平行していることが明らかになった。神経細胞集団に依存した段階的な神経保護の喪失を示唆し、SIRT1 と 3 は アルツハイマー病 の進行と並行して減少し、一方で SIRT5 の発現は アルツハイマー病 の進行中に増加することを示唆している [71]。前頭皮質ヒストン脱アセチル化酵素(HDAC)とSIRTのレベルは、アルツハイマー病の臨床経過中に変化する。HDAC1,HDAC3,HDAC6はアルツハイマー病で増加する傾向があるが、SIRT1は減少する。HDAC1 レベルは知覚速度と負の相関があるが、SIRT1 レベルは知覚速度、エピソード記憶、グローバル認知スコア、ミニ精神状態検査(MMSE)と正の相関がある。さらに、HDAC1は正の相関を示し、SIRT1は皮質神経原線維のもつれ形成と負の相関を示す [72]。
集団におけるSIRT1の血清レベルには年齢に関連した低下があり、血清SIRT1レベルはアルツハイマー病の初期バイオマーカーとして提案されている[73]。SIRT1レベルの明らかな低下は、健常者と比較して、アルツハイマー病および軽度認知障害(MCI)患者で観察される[73,74]。
SIRT1はアルツハイマー病において神経保護的である。SIRT1のノックダウンは、細胞の生存、増殖、機能性を阻害する。これらの効果は、抑制されたAKT活性、CREB活性化、およびp53発現の増加と関連している[75]。SIRT1の過剰発現は、10ヶ月齢の3×Tg-ADマウスにおいて学習および記憶を維持し、健康な非トランスジェニックマウスにおいて認知能力を向上させる。SIRT1の神経保護の新規経路としては、細胞のプロテオスタティック機構の強化と神経栄養因子の活性化が関与している可能性がある[76]。
SIRT1は神経変性疾患ではダウンレギュレーションされており、パーキンソン病ではα-シヌクレイン凝集体の形成を減少させることで保護的な役割を示している[77]。
細胞外α-シヌクレイン(eASN)はフリーラジカル形成を促進し、ミトコンドリア膜電位と細胞生存率を低下させ、アポトーシスを活性化する。eASNはAPP、αセクレターゼ(Adam10)メタロプロテアーゼMmp2とMmp10の遺伝子発現をダウンレギュレートし、Mmp11をアップレギュレートする。
Sirt1の活性化はオートファジーを誘導し、ミトコンドリアの恒常性を調節することで神経変性疾患からニューロンを保護する。アデノウイルス媒介による Sirt1 の過剰発現は、オートファジー処理を介してプリオンタンパク質(PrP106-126)による神経毒性を抑制し、PrP(106-126)によるミトコンドリアへの Bax 転移とサイトゾルへのチトクローム c の放出を減少させることが示された。Sirt1誘導オートファジーはPrP(106-126)誘発のミトコンドリア膜電位の低下から保護する。Sirt1 のノックダウンは PrP(106-126)誘発の細胞死とミトコンドリア機能不全にニューロンを感作する [79]。
他にも多くの因子が脳の恒常性の調節においてSirt1と協力している。その一例がFoxOsである。哺乳類のOクラスのフォークヘッド転写因子(FoxOs)は、認知に関連する脳中枢(すなわち、海馬、扁桃体、後頭核)に存在している。FoxOは記憶の形成と統合に必要とされるかもしれない。FoxOは、中枢神経系細胞の生存、アポトーシスとオートファジーの経路、幹細胞の増殖と分化に影響を与える。FoxOsはまた、複数の細胞経路(すなわち、成長因子、Wntシグナル、Wnt1誘導性シグナル伝達経路タンパク質1(WISP1)サイレント交尾型情報調節2ホモログ1(Saccharomyces cerevisiae)SIRT1)と相互作用し、FoxOsを逆制御し、認知および記憶プロセスに関与する細胞の運命を決定する[80]。
腐植酸(HA)は、血管疾患およびアルツハイマー病における潜在的な病原性因子である。HA は、Sirt1/PGC1α経路のダウンレギュレーションによって引き起こされるミトコンドリア機能不全とともに、PERK と eIF2αのリン酸化を刺激することで小胞体ストレスを活性化することで、アミロイドβ誘導細胞毒性に寄与している。Sirt1の過剰発現はHAおよびアミロイドβによる細胞生存能力の損失を減少させる[81]。
アスパラチルプロテアーゼβサイトアミロイドβPP-leaving enzyme 1(BACE1)は、アルツハイマー病におけるアミロイドβ産生の律速段階を触媒し、アディポサイトカインであるレプチンは、アミロイドβ産生を減少させ、BACE1活性を低下させる。転写因子核内因子κB(NF-κB)は BACE1 の転写を制御し、NF-κB 活性は SIRT1 によって制御されている。レプチンはSIRT1を活性化する。レプチンは、SIRT1 依存的な方法で p65 サブユニットのアセチル化を減少させることにより、NF-κB の活性化と転写活性を減衰させる [82]。
アルツハイマー病 における SIRT1 活性は、脳内の高リン酸化タウの蓄積と並行して低下する。レスベラトロールによるSIRT1の活性化は、ICV-STZによって誘発されたSIRT1活性の低下、およびERK1/2とタウのリン酸化の増加、ならびに実験動物における認知障害を逆転させ、SIRT1はタウの高リン酸化から海馬ニューロンを保護する[83]。
BACE1プロモーターには複数のPPAR-RXR部位が存在し、これらの部位におけるSIRT1-PPARγ-PGC-1間の直接的な相互作用は空腹時に増強される。eNOS欠損マウス脳では、アミロイドβ生成の律速酵素であるβ-secretase/BACE1の転写が、高コレステロール食を摂取した後に増加している。適度な空腹時には脳内のBACE1転写が減少し、同時にPGC-1の発現も上昇した。PGC-1の抑制効果は、リガンドに依存しない方法でSIRT1が介在する脱アセチル化を介して、活性化されたPPARγに依存している[84]。
ミクログリアは、アルツハイマー病におけるアミロイドプラークを分解することでアミロイドβクリアランスに参加している。転写因子EB(TFEB)によるリソソソーム機能の亢進は、ミクログリアにおけるアミロイドβクリアランスを促進する可能性がある。TFEBはフィブリルアミロイドβ(fアミロイドβ)の分解を促進し、沈着したアミロイドプラークを減少させる。SIRT1はリジン116(K116R)でTFEBを脱アセチル化し、リソソソーム機能とfアミロイドβ分解を促進する[85]。
ニューロンとアストロサイトを共培養した場合、ニューロンに対するアミロイドβ1-42誘発性の劇症効果はない。アストロサイトでは、アミロイドβ1-42はSIRT1の発現とペルオキシソーム増殖因子活性化受容体γ(PPAR-γ)を減少させ、ペルオキシソーム増殖因子活性化受容体γ共活性化因子1(PGC-1)とミトコンドリア転写因子A(TFAM)を過剰に発現させる[86]。SIRT1の活性化またはSIRT2の阻害は、アルツハイマー病の典型的な特徴である反応性神経膠原病を予防する可能性がある。アミロイドβ1-42で活性化されたアストロサイトをレスベラトロール(RSV)またはSIRT1活性化因子とSIRT2選択的阻害因子であるAGK-2で処理したアストロサイトは、RSVとAGK-2の両方がアストロサイトの活性化を減少させることを示している[87]。SIRT1はアルツハイマー病の治療標的として提案されている[88]。
3.2. SIRT2
SIRT2 は高度に保存されたリジン脱アセチル化酵素であり、老化、エネルギー産生、寿命延長に関与している。アルツハイマー病、パーキンソン病、その他の神経変性疾患では高レベルの SIRT2 が存在することから、SIRT2 は神経変性を促進するのではないかと解釈されていたが、SH-SY5Y 細胞では、SIRT2 の上昇はロテノンやジクワットによる細胞死から細胞を保護し、SIRT2 を酵素的に阻害することで細胞死を促進する。SIRT2 保護は、一部では SOD2 発現の上昇を介して媒介されている。SIRT2はパーキンソン病におけるα-シヌクレイン凝集体の形成を減少させる。いくつかの研究では、SIRT2は酸化ストレスに対する保護に必要であり、神経変性におけるSIRT2活性の上昇は、神経細胞のストレスに対抗するための代償メカニズムである可能性があることを示唆している[89]。
ヒトSIRT2 SNP rs10410544 C/TとAPOEε4陰性集団におけるアルツハイマー病感受性との間には関連がある[90,91]。C対立遺伝子と比較すると、rs10410544のT対立遺伝子は、遅発性アルツハイマー病発症のリスクが1.709倍であることを示している[90]。SIRT2 SNPは比較モデルにおいてヒトのアルツハイマー病リスクと関連している。ヨーロッパの集団では、APOE ε4陰性集団におけるアルツハイマー病のリスクと関連性の増加が示されている[91,92]。SIRT2 rs10410544 SNPはまた、ヨーロッパ人(ギリシャ人およびイタリア人)のアルツハイマー病症例ではアルツハイマー病との関連は認められなかったが、うつ病との関連も認められている[93]。本研究では、SIRT2-T/T遺伝子型はうつ病に対する保護と関連していた。
α-シヌクレインはリジン6と10でアセチル化され、これらの残基はサーチュイン2によって脱アセチル化される。 アセチル化をブロックする変異体は黒質におけるα-シヌクレインの毒性を悪化させる。このことは、サーチュイン2がいくつかのシヌクレイン異常症の治療法の選択肢となる可能性を示唆している[94]。
ミトコンドリア機能不全はアルツハイマー病の発症に関与している可能性が高い。ミトコンドリアは、微小管ネットワークのアセチル化を調節するSIRT2の過剰活性化によるオートファジー/ミトファジーの機能不全につながる可能性がある。SIRT2レベルの増加とチューブリンのLys40のアセチル化の減少は、アルツハイマー病細胞に存在する。AK1(特異的SIRT2阻害剤)またはSIRT2ノックアウトによって達成されたSIRT2機能の損失は、微小管の安定化を回復し、オートファジーを改善し、有毒なアミロイドβオリゴマーの除去を通じて細胞の生存を促進する[95]。アルツハイマー病における小分子(AGK-2,AK-7)によるSIRT2阻害は、可溶性α-アミロイドβPPタンパク質の増加に伴い、アミロイドβ産生と可溶性β-アミロイドβPPを減少させ、認知機能を改善する[96]。
全脳放射線治療(WBRT)は、未知のメカニズムを介してではあるが、望ましくない後遺症を生じる。これらのケースでは、SIRT2が神経変性と関連しているように思われる。ハンチントン病、パーキンソン病、およびアルツハイマー病のカノニカル経路は、治療後72時間以内に脳放射線によって急性に影響を受ける。Sirt2の欠損はハンチントン病とパーキンソン病の両方の経路に優先的に影響を与える。長期的な放射線の影響は、神経変性に関連するタンパク質のレベルの変化と関連していることがわかっており、Mapt、Mog、Snap25,Dnm1が同定されている[97]。サーチュイン阻害薬は、パーキンソン病[98,99]およびハンチントン病[100]の実験モデルにおいて神経保護効果を発揮する。
3.3. SIRT3
哺乳類のSIRT3-5は、SIRT3のタンパク質基質のいくつかのクラスターが同定されているミトコンドリアで活性化されている。SIRT3 は、ストレスによるミトコンドリアの完全性とエネルギー代謝の保護に関与するミトコンドリアの主要なサーチュインである。SIRT3は、アルツハイマー病、筋萎縮性側索硬化症、パーキンソン病、ハンチントン病などのいくつかの神経変性疾患の発症に関与している[101]。ミトコンドリア機能不全は、アルツハイマー病の発症に密接に関連している[102]。SIRT3の喪失は、興奮毒性を負荷した脳で神経変性を加速させる[103]。ミトコンドリアの活性酸素の増加は、初代海馬の培養においてSIRT3の発現を増加させ、SIRT3の過剰発現は神経保護効果を発揮する[102]。SIRT3のmRNAとタンパク質のレベルは、アルツハイマー病の大脳皮質とAPP/PS1ダブルトランスジェニックマウスの皮質で減少し[104]、Ac-p53 K320はアルツハイマー病のミトコンドリアで増加している。SIRT3は、脱アセチラーゼ活性依存的な方法でp53誘発ミトコンドリア機能障害および神経細胞障害を予防する。ミトープ53は、ミトコンドリアのDNAがコードするND2とND4遺伝子の発現を減少させ、その結果、活性酸素種(ROS)の増加とミトコンドリアの酸素消費量を減少させる。ND2とND4の発現はアルツハイマー病で減少する。SIRT3はND2とND4の発現を回復させ、ミトコンドリアの酸素消費を改善する。SIRT3の機能不全は、アルツハイマー病におけるp53を介した神経細胞およびミトコンドリアの損傷につながる可能性がある[105]。
SIRT3は、活性酸素の産生と解毒に関与するタンパク質基質(SOD2,カタラーゼ)および脂質β酸化経路の酵素を活性化する。ミクログリアは、中枢神経系における活性酸素の主要な細胞源である。サーチュイン3は細胞性活性酸素レベルの調節に関与している。Sirt3は、抗酸化遺伝子であるカタラーゼ(CAT)とマンガンスーパーオキシドジスムターゼ(MnSOD)を活性化する転写因子であるフォークヘッドボックスO 3a(Foxo3a)を脱アセチル化することで細胞性活性酸素を減少させる。SIRT3は、生後早期のラット脳の冠状体(CC)のアメボイド微小グリア細胞に局在し、成体ラット脳のCCのramified微小グリア細胞で減少している。ミクログリアにおけるSIRT3のノックダウンは、細胞内およびミトコンドリアの活性酸素の増加と抗酸化物質MnSODの発現の減少をもたらし、ミクログリアにおける活性酸素の制御におけるSirt3の役割を反映している。逆に、Sirt3の過剰発現はCATとMnSODの発現を増加させ、この効果はFoxo3aの発現と核内転座の増加を伴い、Sirt3がFoxo3aの活性化を介して抗酸化物質の発現を誘導することでROSを制御していることを示唆している[106]。
アミロイドβ1-42とSKI IIはフリーラジカル形成を誘導し、プロと抗アポトーシスタンパク質のバランスを乱し、細胞死を誘発する。アミロイドβ1-42はミトコンドリアタンパク質(アポトーシス誘導因子AIF、Sirt3,Sirt4,Sirt5)のレベルを上昇させる。アミロイドβ1-42への長期暴露後、カスパーゼ、MEK/ERKの活性化、およびミトコンドリア透過性遷移孔の変化は、細胞死に寄与する追加的な要因である。スフィンゴシン-1-リン酸(S1P)Sirt活性化剤、抗酸化剤(レスベラトロール、ケルセチン)は、アミロイドβ1-42の毒性作用下で細胞の生存能力を高める[107]。
下垂体アデニル酸シクラーゼ活性化ポリペプチド(PACAP)は、アルツハイマー病における神経保護効果を有する神経トロフィンである。PACAPとSIRT3の発現は、アルツハイマー病と3×TGマウスの脳では減少し、アミロイドβとタウタンパク質レベルとは逆相関している。PACAPによる治療はアミロイドβの毒性からニューロンを保護する。PACAPはミトコンドリアのSirt3産生を刺激する。Sirt3をノックダウンするとPACAPの神経保護効果は無効になり、この効果はSirt3を過剰に発現させることで逆転することができる[108]。
3.4. SIRT6
SIRT6はテロメアの維持、DNA修復、ゲノムの完全性、エネルギー代謝、炎症に関与しており、寿命の調節に貢献している。SIRT6はアルツハイマー病患者では欠損している [109]。SIRT6はDNA修復を促進するが、この活性は加齢とともに低下し、結果としてDNA損傷が蓄積される。SIRT6は、キナーゼGSK3α/βの活性化の増加を通じて、タウタンパク質の安定性とリン酸化を制御している[110]。SIRT6タンパク質の発現レベルは、アルツハイマー病脳では低下する。アミロイドβ42はSIRT6の発現を減少させ、海馬ニューロンでのSIRT6の過剰発現によってアミロイドβ42誘発のDNA損傷が防止される。現在、アミロイドβ42誘発DNA損傷とp53レベルとの間には負の相関が見られており、Nutlin-3によるp53のアップレギュレーションはSIRT6の減少とアミロイドβ42誘発DNA損傷を防止し、p53依存性のSIRT6発現はアミロイドβ42誘発DNA損傷から細胞を保護するとされている[111]。
4. APOE関連表現型
複数の研究により、APOE遺伝子型がアルツハイマー病表現型に及ぼす強力な影響が示されている。これらの研究から、いくつかの結論を導き出すことができる。(i)発症年齢は80%のAPOE-4/4キャリアで5-10歳早い;(ii)血清ApoEレベルはAPOE-4/4キャリアで最も低く、APOE-3/3とAPOE-3/4で中間、APOE-2/3とAPOE-2/4で最も高い;(iii)コレステロールレベルはAPOE-4/4遺伝子型を持つ患者では他の遺伝子型を持つキャリアよりも高い;(iv)HDL-コレステロールレベルはAPOE-3ホモ接合体の患者では低い傾向がある。(iv) HDL-コレステロール値はAPOE-3ホモ接合体ではAPOE-4対立遺伝子のキャリアよりも低い傾向がある;(v) LDL-コレステロール値はAPOE-4/4キャリアでは総コレステロールに類似したAPOE遺伝子型に関連したパターンで高い。(vi) 血清トリグリセリドはAPOE-4/4キャリアにおいて最も低い値を示す傾向があり、(vii) 一酸化窒素レベルはAPOE-4/4キャリアにおいて低下した値を示す傾向があり、(viii) 血清及び脳脊髄液 アミロイドβレベルはAPOE-4/4キャリアにおいて他の遺伝子型(APOE-3/3,APOE-3/4)キャリアと比較して異なるパターンを示す。(ix)血中ヒスタミン濃度はAPOE-4/4キャリアでは劇的に低下し、(x)脳萎縮とアルツハイマー病神経病理はAPOE-4/4>APOE-3/4>APOE-3/3で顕著に増加し、(xi)脳内マッピング活動はAPOE-4/4では疾患初期から遅波活動の増加を示している。(xii)脳血流動態(脳血流速度の低下、脈動性および抵抗指数の増加)はAPOE-3キャリアよりもAPOE-4キャリアの方が有意に悪く、光トポグラフィマッピングで評価される脳血流低下および新皮質酸素化もAPOE-4キャリアの方がより不足していることを示している。(xiii) APOE-4キャリアではリンパ球のアポトーシスが亢進している;(xiv) APOE-4/4患者では他のAPOE遺伝子型のキャリアよりも認知機能の低下が早い;(xv) APOE-3キャリアよりもAPOE-4キャリアの方が代謝・血液学的欠損(鉄、フェリチン、葉酸、ビタミンB12)が蓄積している;(xvi) APOE-3キャリアよりもAPOE-4キャリアの方が行動障害が多い。(xvi) いくつかの行動障害、概日リズムパターンの変化、気分障害はAPOE-4キャリアでわずかに多く、(xvii) 大動脈及び全身性アテローム性動脈硬化症もAPOE-4キャリアで多く、大動脈壁のアテロームプラークの大きさはAPOE-4/4キャリアでほぼ2倍になる傾向がある。(xviii)肝代謝およびトランスアミナーゼ活性も他の遺伝子型と比較してAPOE-4/4では異なる;(xix)高血圧およびその他の心血管系危険因子もAPOE-4対立遺伝子の保因者では蓄積する傾向がある;(xx)APOE-4/4保因者は従来の薬剤に対する反応性が最も悪い。これらの表現型の特徴はすべて、APOE-4ホモ接合体の生物学的欠点、およびこれらの患者がアルツハイマー病および/または付随する病理学的治療を受ける際に経験する可能性のある結果を明確に示している [2,3,4,6,112,113,114,115,116,117,118,119,120,121,122,123,124]。
5. SIRT2-APOE相互作用
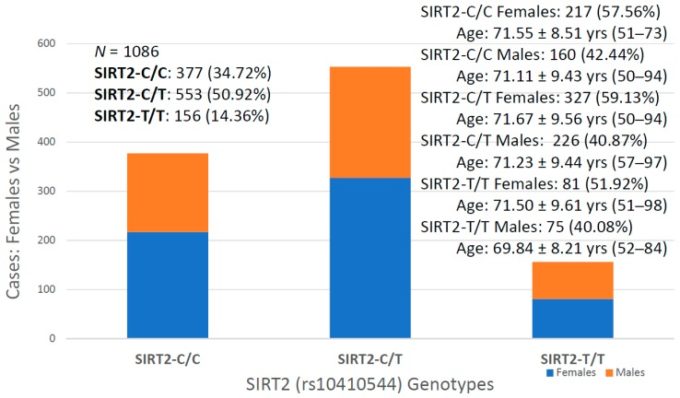
今回初めて、アルツハイマー病患者におけるSIRT2(rs10410544)バリアントとAPOE遺伝子型との間の潜在的な相互作用を検討した(N=1086;女性625名(57.55%)年齢:71.26±9.47歳、範囲:50~98歳、男性461名(42.45%)年齢:70.79±9.81歳、範囲:50~98歳、範囲:50~98歳)。50~98歳、および男性461名(42.45%)年齢:70.79±9.81歳、範囲:50~97歳)。50~97歳)であった。) SIRT2バリアントの分布と頻度(図1)は以下の通りであった。SIRT2-C/C 34.72%、SIRT2-C/T 50.92%、SIRT2-T/T 14.36%であった。APOE遺伝子型(図2)は以下のように分布していた。APOE-2/2 0.18%、APOE-2/3 7.64%、APOE-2/4 1.84%、APOE-3/3 56.35%、APOE-3/4 29.38%、APOE-4/4 4.61%であった(図2)。SIRT2とAPOEの変異体をビギニークラスターに統合すると、18個のハプロタイプが得られた(図3)。アルツハイマー病における5つの最も頻度の高いビジェニック遺伝子型は、33CT(27.81%)33CC(21.36%)34CT(15.29%)34CC(9.76%)および33TT(7.18%)である(図3)。SIRT2-T/T>SIRT2-C/T>SIRT2-C/Cにおいて、APOE-3/4およびAPOE-4/4キャリアの有意でない蓄積があり(図4)APOE-4/4遺伝子型を保有する患者において、SIRT2-T/TおよびSIRT2-C/Tキャリアの蓄積がある(図5)。両方の状況は、病原性効果および/または治療に対する治療反応の観点から関連している可能性がある。
図1 アルツハイマー病におけるSIRT2(rs10410544)バリアントの分布と頻度の性差

図2 アルツハイマー病におけるAPOE遺伝子型の分布と頻度の性差

図3 アルツハイマー病におけるAPOE-SIRT2ビジェニック遺伝子型の頻度

図4 主要なSIRT2(rs10410544)バリアントのキャリアにおけるAPOE遺伝子型の分布と頻度

図5 主要なAPOE遺伝子型のキャリアにおけるSIRT2(rs10410544)バリアントの分布と頻度

6. SIRT2関連遺伝子型
6.1. 年齢と性別
我々のサンプルでは、女性が57.55%、男性が42.45%を占めている。この女性:男性の比率は、すべてのSIRT2遺伝子型とAPOE遺伝子型で類似しているが、発症年齢には興味深い違いがあり、特にAPOE遺伝子型に関連していることがわかった。SIRT2遺伝子型は、他のSIRT2遺伝子型のキャリアよりも早い年齢で疾患を発症する傾向を示すSIRT2-T/T男性の場合を除いて、アルツハイマー病の発症年齢に影響を与えない(図6)。SIRT2-C/Cのキャリアのうち、女性は57.56%(年齢:71.55±8.51歳、範囲:51~73歳)男性は42.44%(年齢:71.11±9.43歳、範囲:50~94歳)となっている。SIRT2-C/Tの女性(59.13%;年齢:71.63±9.56年、範囲:50~94歳)と男性(40.87%;年齢:71.23±9.44年、範囲:51~97歳)は同様の発症年齢を示し、SIR2-T/Tの男性(40. 08%;年齢:69.84±8.21歳、範囲:52~84歳)は、女性(51.92%;年齢:71.50±9.61歳、範囲:51~98歳)よりも発症年齢が早い傾向にある(図6)。
図6 アルツハイマー病におけるSIRT2関連の発症年齢の違い

APOEでは、APOE-4対立遺伝子が発症年齢に明らかな影響を与えており、APOE-4キャリア(特にAPOE-2/4およびAPOE-4/4遺伝子型を保有する患者)は、APOE-4キャリアの患者よりも発症年齢が早いことが明らかになっている(図7)。
図7 アルツハイマー病におけるAPOE関連の発症年齢の違い

APOE-SIRT2ビジェニックハプロタイプは、23CC vs. 44CT (p = 0.05)、33CC vs. 34CT (p = 0.2)、33CC vs. 44CT (p = 0.009)、33CT vs. 34CT (p = 0.05)、33CT vs. 44CT (p = 0.004)、33TT vs. 34CT (p = 0.004)において発症年齢に有意な差を示した。34CT(p=0.05)、33CT vs. 44CT(p=0.004)、33TT vs. 34CT(p=0.04)、33TT vs. 44CT(p=0.01)、34CC vs. 44CT(p=0.001)、34TT vs. 44CT(p=0.01)、44CC vs. 44CT(p=0.01)である(図8)。
図8 アルツハイマー病における発症年齢のAPOE-SIRT2ビジェニック遺伝子型関連の違い

6.2. 脂質代謝とBMI
総コレステロール値は、SIRT2-C/Tキャリアで有意に高い(p = 0.05 vs. SIRT2-C/C)。脂質代謝に関連するその他のパラメータは、SIRT2バリアントのキャリア間で類似している(表2)。体格指数(BMI)は、SIRT2-C/C(28.06 ± 4.31 kg/m2)では、SIRT2-C/T(27.93 ± 4.55 kg/m2)およびSIRT2-T/T(27.99 ± 4.21 kg/m2)よりも高い傾向にあり、女性でも高い傾向にある(SIRT2-C/C:28.06 ± 4.31 kg/m2)。 17 ± 4.88 kg/m2,SIRT2-C/T:28.16 ± 5.03 kg/m2,SIRT2-T/T:28.18 ± 4.32 kg/m2)は、男性(SIRT2-C/C:27.88 ± 3.29 kg/m2,SIRT2-C/T:27.61 ± 3.76 kg/m2,SIRT2-T/T:27.76 ± 4.10 kg/m2)よりも高くなっている(表2)。
表2 アルツハイマー病患者におけるSIRT2関連の表現型
| パラメータ(正常範囲) | SIRT2-C / C | SIRT2-C / T | SIRT2-T / T |
|---|---|---|---|
| N = 1086 | 377(34.72%) | 553(50.92%) | 157(14.36%) |
| 年齢(年) | 71.15±9.62(50–94) | 71.49±9.51(50–97) | 70.70±8.97(51–98) |
| 女性(N = 625) | N = 217(57.56%) | N = 327(59.13%) | N = 81(51.92%) |
| 女性の年齢(年) | 71.55±8.51(51–73) | 71.67±9.56(50–94) | 71.50±9.61(51–98) |
| 男性(N = 461) | N = 160(42.44%) | N = 226(40.87%) | N = 75(40.08%) |
| 男性の年齢(年) | 71.11±9.43(50–94) | 71.23±9.44(51–97) | 69.84±8.21(52–84) |
| 収縮期血圧(SBP)(mm Hg)(120–160) | 140.96±20.72 | 140.89±20.76 | 139.69±19.62 |
| 拡張期血圧(DBP)(mm Hg)(70–85) | 79.49±11.89 | 79.52±11.70 | 79.64±11.62 |
| 脈拍(bpm)(60–100) | 67.89±11.89 | 68.34±12.80 | 67.71±11.82 |
| 重量(kg) | 70.41±12.69 | 70.47±13.28 | 70.57±13.71 |
| 高さ(m) | 1.58±0.09 | 1.58±0.09 | 1.59±0.09 |
| ボディマス指数(BMI)(kg / m 2) | 28.06±4.31 | 27.93±4.55 | 27.99±4.21 |
| グルコース(Glc)(mg / dL)(70–105) | 99.88±22.38 | 104.11±32.99 | 100.64±25.77 |
| コレステロール(Cho)(mg / dL)(140–220) | 218.68±47.48 | 223.65±48.26 (1) | 217.22±43.34 |
| HDL-コレステロール(mg / dL)(35–75) | 52.70±13.99 | 53.44±14.31 | 53.45±13.96 |
| LDL-コレステロール(mg / dL)(80–160) | 143.48±40.02 | 147.04±42.57 | 140.93±41.00 |
| トリグリセリド(TG)(mg / dL)(50–150) | 114.08±64.70 | 113.44±60.07 | 114.32±60.01 |
| 尿素(BUN)(mg / dL)(15–30) | 45.28±16.61 | 43.59±12.48 | 45.08±13.79 |
| クレアチニン(Cr)(mg / dL)(0.70–1.40) | 0.97±0.79 | 0.91±0.25 | 0.90±0.24 |
| 尿酸(UA)(mg / dL)(3.4–7.0) | 4.39±1.55 | 4.37±1.39 | 4.34±1.54 |
| 総タンパク質(T-Pro)(g / dL)(6.5–8.0) | 6.88±0.40 | 6.90±0.46 | 6.88±0.40 |
| アルブミン(Alb)(g / dL)(3.5–5.0) | 4.27±0.28 | 4.28±0.30 | 4.25±0.33 |
| カルシウム(Ca)(mg / dL)(8.1–10.4) | 9.16±0.42 | 9.22±0.46 (2) | 9.14±0.53 |
| リン(P)(mg / dL)(2.5–5.0) | 3.38±0.62 | 3.38±0.51 | 3.34±0.54 |
| アスパラギン酸アミノトランスフェラーゼ(GOT / ASAT)(IU / L)(10–40) | 21.87±10.32 | 22.72±24.04 | 23.63±14.78 (3) |
| アラニンアミノトランスフェラーゼ(GPT / ALAT)(IU / L)(9–43) | 22.66±15.09 | 23.30±22.75 | 26.21±25.93 (4,5) |
| ガンマグルタミルトランスペプチダーゼ(GGT)(IU / L)(11–50) | 30.32±46.81 | 31.01±38.39 | 33.71±45.68 |
| アルカリホスファターゼ(ALP)(IU / L)(37–111) | 78.20±28.36 | 78.90±35.80 | 80.41±38.38 |
| ビリルビン(BIL)(mg / dL)(0.20–1.00) | 0.76±0.39 | 0.74±0.37 | 0.68±0.30 (6) |
| クレアチンホスホキナーゼ(CPK)(IU / L)(38–174) | 88.51±68.03 | 89.96±78.18 | 83.98±49.18 |
| 乳酸デヒドロゲナーゼ(LDH)(IU / L)(200–480) | 305.44±70.66 | 303.53±72.46 | 310.31±78.81 |
| Na +(mEq / L)(135–148) | 142.32±2.50 | 142.34±2.62 | 141.98±2.42 (7,8) |
| K +(mEq / L)(3.5–5.3) | 4.35±0.38 | 4.34±0.36 | 4.31±0.38 |
| Cl −(mEq / L)(98–107) | 104.67±9.25 | 104.28±2.70 | 103.72±2.46 (9,10) |
| Fe 2+(µg / dL)(35–160) | 84.94±36.30 | 82.12±32.20 | 82.38±32.96 |
| フェリチン(ng / mL)(11–336) | 135.43±164.44 | 119.88±128.51 (11) | 106.79±111.09 |
| 葉酸(ng / mL)(> 3.00) | 7.19±3.94 | 6.78±3.69 (12) | 7.32±4.23 |
| ビタミンB 12(pg / mlで)(170から1000) | 504.37±315.05 | 501.73±302.43 | 498.07±296.97 |
| 甲状腺刺激ホルモン(TSH)(µIU / mL)(0.20–4.50) | 1.48±1.36 | 1.53±3.59 | 1.41±1.01 |
| チロキシン(T4)(ng / mL)(0.54–1.40) | 0.94±0.23 | 0.97±0.55 | 0.92±0.21 |
| 赤血球数(RBC)(×10 6 / µL)(3.80–5.50) | 4.60±0.47 | 4.59±0.45 | 4.53±0.53 |
| ヘマトクリット(HCT)(%)(40.0–50.0) | 42.08±6.01 | 41.71±4.12 | 41.35±4.63 |
| ヘモグロビン(Hb)(g / dL)(13.5–17.0) | 14.00±1.37 | 13.95±1.39 | 13.82±1.56 |
| 平均赤血球容積(MCV)(fL)(80–100) | 90.99±4.66 | 90.83±5.14 | 91.35±5.77 |
| 平均赤血球ヘモグロビン(MCH)(pg)(27.0–33.0) | 30.48±1.83 | 30.41±1.99 | 30.56±2.13 |
| 平均赤血球ヘモグロビン濃度(MCHC)(g / dL)(31.0–35.0) | 33.48±0.80 | 33.40±1.49 | 33.43±0.70 |
| 赤血球分布幅(RDW)(%)(11.0–15.0) | 13.22±1.30 | 13.18±1.63 | 13.38±1.80 |
| 白血球数(WBC)(×10 3 / µL)(4.0–11.0) | 6.41±1.80 | 6.42±1.75 | 6.18±2.24 (13,14) |
| %好中球(45.0–70.0) | 61.85±9.60 | 62.00±9.19 | 59.95±9.59 (15,16) |
| %リンパ球(20.0–40.0) | 28.61±8.38 | 28.38±8.19 | 29.87±8.87 (17) |
| %単球(3.0–10.0) | 7.10±1.99 | 7.28±2.20 | 7.53±2.45 (18) |
| %好酸球(1.0–5.0) | 2.65±1.91 | 2.72±1.85 | 3.08±4.80 |
| %好塩基球(0.0–1.0) | 0.53±0.24 | 0.52±0.22 | 0.78±3.05 |
| 血小板数(PTL)(×10 3 / µL)(150–450) | 224.15±68.65 | 227.62±65.50 | 224.96±72.74 |
| 平均血小板量(MPV)(fL)(6.0–10.0) | 8.38±0.96 | 8.29±0.98 | 8.35±1.17 |
(1) p < 0.05 C/C vs. C/T; (2) p = 0.03 C/C vs. C/T; (3) p < 0.05 C/T vs. T/T; (4) p < 0.05 C/C vs. T/T; (5) p = 0. 02 C/T対T/T; (6) p = 0.03 C/C対T/T; (7) p < 0.05 C/C対T/T; (8) p < 0.05 C/T対T/T; (9) p = 0.01 C/C対T/T. T/T; (10) p = 0.01 C/T vs. T/T; (11) p < 0.05 C/C vs. C/T; (12) p < 0.05 C/C vs. C/T; (13) p = 0.02 C/C vs. T/T; (14) p = 0.01 C/C vs. T/T;。 001 C/T対T/T; (15) p = 0.03 C/C対T/T; (16) p = 0.01 C/T対T/T; (17) p < 0.05 C/T対T/T; (18) p < 0.05 C/C対T/T。統計分析(対のt検定、分散分析、χ2およびフィッシャー厳密検定、マン・ワトニー順位和検定、線形および非線形回帰分析、ダービン-ワトソン統計量、ピアソン相関、スピアマン順位)は、IBM SPSS StatisticおよびSigma Stat 3.5プログラムを適宜使用して行った。結果は、本文中では平均値±SDとして、また、平均値±SDとして表される。2-tailed p < 0.05(またはp値(χ2) ≤ 0.05)は、統計的に有意であると考えた。
6.3. 血圧と心血管機能(心電図)
収縮期血圧と拡張期血圧の値は3群で同じであるが、男性、特にSIRT2-C/CとSIRT2-T/Tのキャリアで値が高くなる傾向がある(図9)。SIRT2-C/Cの47.21%、SIRT2-C/Tの48.27%、SIRT2-T/Tの52.06%で心電図が異常である(図10)。収縮期血圧(141.48±21.08mmHg)拡張期血圧(79.25±11.95mmHg)が高く、心拍数(69.79±13.13bpm)が高く、BMI(28.11±4.57kg/m2)が高い症例が心電図異常の患者に集積する傾向がある。正常心電図は、異常心電図(73.71±7.99歳)や境界心電図(72.24±8.24歳)に比べて、若年者(年齢:68.73±9.06歳)に多くみられた。APOE変異体の心電図への潜在的な影響については、APOE-2およびAPOE-4キャリアは、特にAPOE-2/4(60%の心電図異常)APOE-2/3(58%の心電図異常)およびAPOE-3/4(48%の心電図異常)で、より悪い心血管パフォーマンスを示すようである(図11)。SIRT2-T/TキャリアにおけるAPOE-2/3とAPOE-2/4の蓄積は、SIRT2-T/Tキャリアにおける異常心電図の発生率の高さに寄与している可能性がある。
図9 アルツハイマー病におけるSIRT2関連の血圧値

図10 アルツハイマー病におけるSIRT2(rs10410544)関連心電図(心電図)パターン

図11 アルツハイマー病におけるAPOE関連心電図(心電図)パターン

6.4. 生化学的および代謝パラメータ
ほとんどの生化学的パラメータは、コレステロール(p<0.05 C/C vs. C/T)カルシウム(p=0.03 C/C vs. C/T)GOT(p<0.05 C/T vs. T/T)GPT(p<0.05 C/C vs. T/T; p=0.02 C/T vs. T/T)ビリルビン(p=0.05 C/C vs. T/T。 02 C/T vs. TT)ビリルビン(p = 0.03 C/C vs. T/T)ナトリウム(p < 0.05 C/C vs. T/T; p < 0.05 C/T vs. T/T)塩化物(p = 0.01 C/C vs. T/T; p < 0.05 C/C vs. T/T)。 01 C/C vs. T/T; p = 0.01 C/T vs. T/T)フェリチン(p < 0.05 C/C vs. C/T)葉酸(p < 0.05 C/C vs. C/T)(表2)。
6.5. 血液学的パラメータ
血液学的パラメータのうち、白血球(p = 0.02 C/C vs. T/T; p = 0.01 C/T vs. T/T)好中球(p = 0.03 C/C vs. T/T; p = 0.01 C/T vs. T/T)リンパ球(p < 0.05 C/T vs. T/T)単球(p < 0.05 C/C vs. T/T)に有意差が見られた(表2)。
6.6. 認知
診断時のMini-Mental State Examination(MMSE)スコア評価では、SIRT2バリアントに関連した有意差は認められなかった(SIRT2-C/C:20.25±7.54,SIRT2-C/T:19.57±7.63,SIRT2-T/T:19.85±7.36)。しかし、診断時のAPOE関連認知パフォーマンスは、APOE遺伝子型によって有意な差が認められた。APOE-2/3キャリアのベースラインMMSE(MMSE 21.20±7.08)は、APOE-2/4(p = 0.02)APOE-3/3(p = 0.004)APOE-4/4のMMSE(p = 0.04)と有意に異なっていた。また、APOE-2/4はAPOE-3/3(p = 0.01)、APOE-3/3はAPOE-3/4(p < 0.001)、APOE-4/4(p = 0.02)との差を示した(図12)。これらの違いはすべて、薬物に対する治療反応や薬理遺伝学的研究に明確な影響を与える。
図12 アルツハイマー病における診断時のAPOE関連精神パフォーマンス(MMSEスコア)について

7. 薬理遺伝学とファーマコエピジェネティクス
薬物に対する薬理応答に関わる遺伝子は、大きく5つのカテゴリーに分類される。(i) 病気の発症に関わる遺伝子;(ii) 薬物の作用機序に関わる遺伝子(酵素、受容体、伝達物質、メッセンジャー、エピジェネティック・マシーンの構成要素);(iii) 薬物代謝に関わる遺伝子(第I-II相反応酵素);(iv) 薬物輸送体に関わる遺伝子;(v) 多面的なカスケードや代謝ネットワークに関わる多能性遺伝子 [2,19,125,126,127]である。これらの遺伝子はすべて、生理学的および病理学的条件での発現を特異的に制御するためのエピジェネティックな機械にさらされている[128,129,130]。エピジェネティックな制御は、薬理遺伝学的プロセスに関与する遺伝子の組織特異的な発現に関与している;その結果、エピジェネティクスは、薬剤の有効性と安全性、および薬剤耐性の開発において重要な役割を果たしている。エピジェネティックな変化は、チトクロームP450酵素の発現、主要なトランスポーターの機能、および核内受容体の相互作用に影響を与える [129,130,131,132]。
メカニズム遺伝子は、特定の薬物の作用機序に関与する受容体とそのサブユニット、酵素およびメッセンジャーをコードしている。エピジェネティック医薬品の場合、機械論的遺伝子は、エピジェネティック機械の構成要素をコードするものである。(i) DNA メチルトランスフェラーゼ阻害活性を有するヌクレオシドアナログ、低分子、天然物の標的である DNA メチルトランスフェラーゼ(DNMTs)(DNMT1,DNMT3A、DNMT3B)(ii) DNA デメチラーゼ(10-eleven トランスロケーション(TET)ファミリー、AID/APOBEC ファミリー、BER(base excision repair)グリコシラーゼファミリー)(iii) ヒストン脱アセチル化酵素(ヒストン脱アセチル化酵素)(ヒストン脱アセチル化酵素)(ヒストン脱アセチル化酵素)(ヒストン脱アセチル化酵素)(ヒストン脱アセチル化酵素)(ヒストン脱アセチル化酵素)。iii)ヒストン脱アセチラーゼ、HDAC阻害剤(短鎖脂肪酸、ヒドロキサム酸、環状ペプチド、ベンザミド、ケトン、サーチュイン調節剤)の標的である、(iii)ヒストンアセチルトランスフェラーゼ、(v)ヒストンメチルトランスフェラーゼ(リジンおよびアルギニンメチルトランスフェラーゼ)(iii)ヒストン脱メチラーゼ、(iii)クロマチン関連タンパク質(ATP依存性クロマチンリモデリング複合体)。SWI/SNF(スイッチング不全/スクロース非発酵)ファミリー、ISWI(模倣SWI)ファミリー、CHD(クロモドメイン、ヘリカーゼ、DNA結合)ファミリー、イノ(イノシトール必要量80)ファミリー)および関連タンパク質(DOT1L、EZH2,G9A、PRMTs)(vii)ブロモドメイン、(viii)クロモドメイン、および(ix)エピジェネティック・マシーンの他の構成要素[18]。
アルツハイマー病の場合、ほとんどの研究では、APOEとCYP2D6遺伝子が薬理遺伝学的結果に最も影響力のある遺伝子であり、従来の治療に対する治療反応に関連する病原性(APOE)と代謝性(CYPD2)遺伝子を代表するという点で一致している[2,3,4,6,7,19,125,127,133]。
7.1. 多因子治療に対するAPOEおよびTOMM40関連の治療反応
様々な研究により、APOE遺伝子型がアルツハイマー病治療薬に与える影響が報告されている[2,3,4,5,7,19,121,122,124,125,126,127,133]。我々は、APOE-4キャリアが従来の治療に対して最悪の反応を示すことが明確に示されたプロスペクティブ研究およびレトロスペクティブ研究を行ってきた[2,3,6,118,120,127,134]。TOMM40遺伝子座は、19q13.2のAPOE遺伝子座の近くに位置しており、APOE遺伝子座との連結不平衡状態にある。TOMM40遺伝子は、アミロイドβや他のタンパク質のミトコンドリアへの輸送に関与するミトコンドリア外膜トランスロッカーゼをコードしており、TOMM40遺伝子のイントロニック多型(rs10524523)(イントロン6)のポリTリピートがアルツハイマー病に関与していることが示唆されている[135,136,137,138,139,140]。APOE-TOMM40領域における異なるバリアントは、疾患リスク、アルツハイマー病発症時の年齢[135,136,137,138,139,140,141]、認知老化[142]および病理学的認知機能低下[143]に影響を及ぼす。イントロニックポリT(rs10524523)は、遅発性アルツハイマー病(高齢発症型アルツハイマー病)患者の脳におけるAPOEおよびTOMM40遺伝子の発現に影響を与える[144]。両遺伝子の発現は疾患に伴って増加する。523遺伝子座は、TOMM40および/またはAPOE転写の発現を調節することにより、高齢発症型アルツハイマー病感受性に寄与している可能性がある[144]。TOMM40遺伝子rs10524523(”523″)の可変長ポリTリピート多型は、脳白質の変化[145,146]や異なるバイオマーカー[147,148,149]など、APOEに関して報告されているものと同様のアルツハイマー病表現型とある程度関連している。
アルツハイマー病におけるAPOEおよびTOMM40関連の薬理遺伝学に関する最初の研究[3]から、我々は以下の結論を出すことができた。(i) 多因子治療は約50%の認知症患者に有用であり、一過性の期間(<12ヶ月)の認知機能の低下を安定化または改善する。(ii) APOE-4キャリアは最も反応が悪く、APOE-3キャリアは従来の治療で最も反応が良い。(iii) TOMM40ポリT-S/Sキャリアは最良の応答者であり、VL/VLおよびS/VLキャリアは中間応答者であり、L/Lキャリアは治療に対して最悪の応答者である。iv)APOE-4に関連するハプロタイプのTOMM40遺伝子のイントロン6にポリTリピートの数が多い(L)を有する患者(L/L又はS/L遺伝子型)は、治療に対する最悪の反応者である。v)APOE-3に関連するハプロタイプにおける短い(S)TOMM40ポリT変異体(S/S遺伝子型)を有する患者は、治療に対する最良の応答者である。(vi) 100%の症例では、L/L遺伝子型はAPOE-4/4遺伝子型と排他的に関連しており、このハプロタイプ(4/4-L/L)は、おそらく疾患の早期発症、より速い認知機能低下、および異なる治療に対する反応性の悪さの原因である[3]。
7.2. APOEおよびSIRT2関連の治療効果
同様のプロトコルを用いて、APOE、SIRT2およびCYP2D6バリアントがアルツハイマー病患者の多因子治療に対する治療効果に及ぼす影響を検討した。CDP-コリン(500 mg/日、p.o.)(コリン供与体、DNA合成・修復の中間代謝物)ピラセタム(1600 mg/日、p.o.)(向精神薬)サルディリピン(E-SAR-94010)(250 mg、t.i.d.)(脂質低下作用と抗動脈硬化作用を有する栄養補助食品、特許ID.P9602566)とアニソンの併用療法を1年間実施した。P9602566)アニモンコンプレックス®(1日2カプセル)(1カプセルあたりキヌアの精製エキス(250mg)硫酸第一鉄(鉄14mg相当量38.1mg)葉酸(200μg)ビタミンB12(1μg)を配合した栄養補助食品(RGS:26.06671/C))などがある。鉄(<35μg/mL)(4.45%)葉酸(<3 ng/mL)(5.43%)ビタミンB12(<170 pg/mL)(4. 13%)は、これらの代謝因子の認知への悪影響を避けるために、血清鉄(50~150μg/mL)葉酸(5~20ng/mL)およびビタミンB12レベル(500~1000pg/mL)を安定したレベルに維持するために、それぞれ鉄(80mg/日)葉酸(5mg/日)およびビタミンB複合体(B1,15mg/日;B2,15mg/日;B6,10mg/日;B12,10μg/日;ニコチンアミド、50mg/日)の追加補給を受けた。高血圧症(>150/85mmHg)の患者(28.04%)にはエナラプリル(5~20mg/日、p.o.)を投与し、高コレステロール血症(>220mg/dL)の患者(43. 48%)はアトルバスタチン(10-20mg/日)を投与された;糖尿病(グルコース>105mg/dL)の患者(24.24%)はメトホルミン(850-1700mg/日、p.o.)を投与された;および他の疾患(例:甲状腺機能低下症、高尿酸血症)を有する患者(3%未満)。甲状腺機能低下症、高尿酸血症等)では、病状に応じて適切な治療を行った。向精神薬(抗うつ薬、神経弛緩薬、催眠薬、鎮静薬)は避け、ベンゾジアゼピン系薬剤による一過性の短期間の治療を必要とした患者は5%未満であった。サイコメトリー評価(Mini-Mental State Examination、MMSE)血液パラメータ(表2)を治療前(ベースライン)と治療1,3,6,9,12ヶ月後に評価した[3]。
この治療法では、アルツハイマー病患者は最初の9ヶ月間に有意な認知機能の改善で反応し(図13)その後は他の多くの従来の治療法と同様に進行性の低下が観察される。このことは、現在の治療法は一過性の効果しかもたらさないが、発症の数十年前に神経変性プロセスが活性化してしまうと、進行性の神経細胞死からは保護されないことを示している。この反応は、診断時および治療開始時のベースラインMMSEスコア、さらには患者の遺伝的背景に大きく影響され、APOE-3/3キャリアは最も反応が良く、APOE-4キャリアは最も反応が悪いとされている(図14)。
図13 アルツハイマー病における多因子治療への認知的反応

図14 アルツハイマー病における多因子治療に対するAPOE関連の治療反応

異なるSIRT2遺伝子型を持つ患者は、治療の最初の3ヶ月間は同様の反応を示し、有意な改善を示し、SIRT2-C/Tキャリアのみが1年間、ベースラインレベル以上の認知改善を維持する。世界的に見ると、SIRT2-C/T キャリアが最も優れた反応を示し、SIRT2-T/T キャリアは中間的なパターンを示し、SIRT2-C/C キャリアは最も悪い反応を示している(図 15)。
図15 アルツハイマー病における多因子治療に対するSIRT2関連の治療反応。

7.3. APOE-SIRT2ビジェニック遺伝子型関連治療に対する認知応答
APOE-SIRT2ビジェニッククラスターの研究により、多因子治療に対する治療反応に影響を及ぼす診断時の認知パフォーマンスの重要な違いが明らかになった。ベースラインレベルでの認知能力の有意差は、23CC vs. 44CC(p = 0.01)23CT vs. 24CT(p < 0.05)23CT vs. 34CT(p < 0.05)23CT vs. 34TT(p < 0. 05)23CT vs. 44CC(p = 0.02)23TT vs. 24CC(p = 0.02)23TT vs. 24CT(p = 0.01)23TT vs. 34CC(p < 0.05)23TT vs. 34TT(p = 0.03)23TT vs. 44CC(p = 0.006)24CC vs. 33CC(p = 0.04)24CC vs. 33CC(p = 0.04)24CC vs. 33CC(p = 0.05)24CC vs. 33CT (p < 0.05)、24CT vs. 33CC (p = 0.01)、24CT vs. 33CT (p = 0.03)、24CT vs. 33TT (p < 0.05)、24CT vs. 44CT (p < 0.05)、33CC vs. 34CC (p = 0.006)、33CC vs. 34CT (p < 0.001)、33CC vs. 34TT (p = 0.004)、33CC vs. 34TT (p = 0.004)、33CC vs. 34CC (p = 0.05) 004)33CC vs. 44CC(p = 0.004)33CT vs. 34CT(p < 0.05)33CT vs. 34TT(p = 0.02)33CT vs. 44CC(p = 0.01)33TT vs. 44CC(p = 0.03)34CC vs. 44CC(p < 0.05)および44CC vs. 44CT(p = 0.03)であった(図16)。ベースラインレベルでのこの不均一性は、各患者のゲノム背景とともに、薬理遺伝学的転帰の決定要因となる。24CTキャリアは最初の1ヶ月間のみ改善を示し(p < 0.05)33CCキャリアは6~9ヶ月間(p < 0.05)33TTおよび34CTは3ヶ月間(p < 0.05)であった。これらのビギニークラスターによると、33CCキャリアは33TTおよび34CTキャリアよりも優れた応答者であり、24CCおよび44CCは最悪の応答者である(図16)。
図16 アルツハイマー病の多因子治療に対するAPOE-SIRT2ビジェニック遺伝子型関連の治療反応

7.4. 多因子治療に対するCYP2D6関連治療応答
CYP2D6遺伝子型は、アルツハイマー病におけるコリンエステラーゼ阻害剤や他の薬剤への反応に大きく影響する [2,7,19,118,127,133,150]。我々のサンプルでは、CYP2D6ジェノフェノタイプの分布と頻度は以下の通りであった。広範囲代謝者(EM)59.46%、中間代謝者(IM)20.06%、代謝不良者(PM)5.36%、超高速代謝者(UM)6.12%であった(図17)。診断時の認知パフォーマンスには、EM と PM の間(p = 0.01)IM と PM の間(p = 0.02)PM と UM の間(p = 0.004)で有意差が認められた。最も低いMMSEスコアはPMで検出された(図17)。PMではAPOE-3/4およびAPOE-4/4キャリアの蓄積があり、UMではAPOE-4/4キャリアが過剰に発現している(図18)。APOE-CYP2D6 bigenic genophenotypeでは、APOE-4/4キャリアのうち50%以上がIM、PM、UMであり、APOE-2/4の100%がEMである(図19)。APOE-4/4キャリアにIM、PM、UMが集中していることは、従来の治療に対するAPOE-4/4キャリアの認知能力の低さの一因となっている可能性がある。患者の代謝状態によると、EMは最も反応が良く、PMは最も反応が悪く、UMはIMよりも反応が良い傾向にある(図20)。
図17 アルツハイマー病における診断時のCYP2D6 GenoPhenotype関連精神パフォーマンス(MMSEスコア)

図18 CYP2D6 extensive(EM)intermediate(IM)poor(PM)Ultra-rapid metabolizer(UM)の表現型状態に関連するAPOE遺伝子型の分布と頻度

図19 APOE遺伝子型に関連するCYP2D6の広範(EM)中間(IM)貧弱(PM)超高速代謝者(UM)の分布と頻度

図20 アルツハイマー病における多因子治療に対するCYP2D6関連の治療反応

7.5. 治療薬におけるCYP2D6-SIRT2相互作用
SIRT2バリアントのキャリアにおけるCYP2D6表現型を統合すると、12のジェノフェノタイプが得られる。CCEM(21.42%)制御皮質衝撃M(8.73%)CCPM(1.79%)CCUM(1.98%)CTEM(28.77%)CTIM(16.07%)CTPM(2.78%)CTUM(2.98%)TTEM(9.13%)TTIM(4.37%)TTPM(0.76%)およびTTUM(1.19%)である。
これら12のSIRT2-CYP2D6ビジェノタイプは、診断時の認知パフォーマンスに差があることを示している。最悪のMMSEスコアはTTPMとCTPNに見られ、CCEM対CTPM(p=0.02)CCEM対TTPM(p=0.05)制御皮質衝撃M対CTPM(p=0.007)CCUM対CTPM(p=0.01)CCUM対CTPM(p=0.01)CCUM対TTPM(p=0.01)CCUM対TTPM(p=0.01)で有意差が確認されている。 01)CCUM vs. TTPM(p = 0.01)CTEM vs. CTPM(p = 0.04)CTEM vs. TTPM(p = 0.05)CTPM vs. CTUM(p = 0.02)CTPM vs. TTEM(p = 0.03)CTUM vs. TTPM(p = 0.006)およびTTEM vs. TTPM(p = 0.05)である(図21)。治療に対する反応性が最も良いのはCTEMであり、反応性が最も悪いのは制御皮質衝撃M、CCPM、CCPM、CTPM、TTPMである(図22)。
図21 アルツハイマー病における診断時のSIRT2-CYP2D6 GenoPhenotype関連精神パフォーマンス(MMSEスコア)。

図22 SIRT2-CYP2D6 GenoPhenotypeに関連したアルツハイマー病の多因子治療に対する治療効果について

8. サーチュインモジュレーターとエピジェネティック薬の薬理エピジェネティクス
8.1. エピジェネティックドラッグ
エピジェネティック薬は、エピジェネティック・マシーンの制御コンポーネントを標的とする化学物質または生物製剤である[18]。エピジェネティック医薬品は、遺伝子発現におけるエピジェネティックな変化を逆転させ、健康上の主要な問題の治療に将来の道を開く可能性がある[11,19,138,]。このように成長を続ける薬剤のカテゴリーの中で、ヒストン脱アセチル化およびDNAメチル化の阻害剤がいくつか米国FDAによって血液悪性腫瘍の治療薬として承認されており、いくつかのエピジェネティック薬剤がいくつかの疾患の治療薬として臨床試験で評価されている[18]。
エピジェネティック医薬品は、それぞれの標的に応じて以下のように分類される。(i) DNA メチルトランスフェラーゼ阻害剤。DNA メチルトランスフェラーゼ阻害剤:DNA メチルトランスフェラーゼ(DNMT1-3)と一部のDNMT複合体(DNMT3L/DNMT3A複合体、DNMT1/PCNA/UHRF1複合体)を標的とするもので、ヌクレオシドアナログ、低分子、天然物、二重阻害剤などに化学的に区別される;(ii) DNA デメチラーゼ調節剤;(iii) ヒストン脱アセチル化酵素(HDAC)阻害剤。これらの薬剤は、HDAC1-18,具体的にはクラスIのHDAC(HDAC1,2,3,および8)HDAC1/HDAC2転写コアプレッサー複合体(SIN3A、NuRD、CoREST)HDAC3-(SMRT/N-CoR)複合体、クラスIIのHDACs-IIa(HDAC4,5,7,および9)を標的とする。クラスIIb(HDAC6および10)クラスIII HDCAs(Sirtuins)(表3)クラスIV HDAC(HDAC11)およびヒストン脱アセチル化酵素RPD3。HDAC阻害剤は、短鎖脂肪酸、ヒドロキサム酸、環状ペプチド、ベンズアミド、ケトン、低分子、キノリン-3-カルボキサミド、カルバメート、およびハイブリッド化合物に分類される;(iv)ヒストンアセチルトランスフェラーゼ(HAT)阻害剤。これらの薬剤は、ヒストンリジンアセチルトランスフェラーゼに関連する多くの異なるタンパク質を標的とすることができる;(v)ヒストンメチルトランスフェラーゼ(HMT)阻害剤。HMT阻害剤:これらの薬剤は、ヒストンメチルトランスフェラーゼに関連するいくつかの成分を標的とする;(vi)ヒストンデメチラーゼ阻害剤。HDM阻害剤:ヒストン脱メチル化機械の構成成分(ヒストンリジン脱メチル化酵素、リジン特異的脱メチル化酵素1(LSD1)(KDM1A)KDM1-8,十文字Cドメイン含有ヒストンリジン脱メチル化酵素(JMJC)及びプロリルヒドロキシラーゼ)を標的とする。viii)ATP依存性クロマチンリモデリング複合体(SWI/SNF(スイッチング欠損/スクロース非発酵)ファミリー、ISWI(模倣SWI)ファミリー、CHD(クロモドメイン、ヘリカーゼ、DNA結合)ファミリー、INO(イノシトール必要量80)ファミリー)を標的とするであろう。viii)ポリコム抑制複合体1(PRC1)阻害剤(BMI-1阻害剤);(ix)ブロモドメイン阻害剤;および(x)クロモドメイン阻害剤[18]。
表3 ヒストン脱アセチル化酵素阻害剤とその関連化合物の分類
| カテゴリ | 薬物 |
|---|---|
| ヒストンデアセチラーゼ(HDAC)阻害剤 | |
| 短鎖脂肪酸 | 酪酸ナトリウム; |
| ヒドロキサム酸 | スベロヒドロキサム酸; スベロイルアニリドヒドロキサム酸(SAHA、ボリノスタット); オキサムフラチン; ピロキサミド; トリコスタチンA(TSA); m-カルボキシ桂皮酸ビス-ヒドロキサム酸(CBHA); 海綿動物Psammaplysillapurpureaの誘導体: NVP-LAQ824、NVP-LBH589; LBH-589(パノビノスタット); M344; ITF2357(Givinostat); PXD101(ベリノスタット); JHJ-26481585; CHR-3996; CHR-2845; GC-1521; OSU-HDAC-42; PCI-24781; テフィノスタット; アベキシノスタット; ツバスタチンA; レスミノスタット; ダシノスタット; Quisinostat; リコリノスタット; ロクリノスタット; プラシノスタット; イミダゾ-ケトピペラジン化合物 |
| 環状ペプチド | ロミデプシン(デプシペプチド、FR901228); アピシジン; 環状ヒドロキサム酸含有ペプチド(CHAPS); トラポキシンA; トラポキシンB; クラミドシン; HC毒素; バクテリアFK228; プリチデプシン(アプリジン) |
| ベンズアミド | MS-275(エンチノスタット); CI-994; RGFP136; RGFP966; MGCD0103(モセチノスタット); 化合物60; タセジナリン; チダミド |
| ケトン | トリフルオロメチルケトン |
| 小分子 | ドロキシノスタット; PTACH |
| キノリン-3-カルボキサミド | タスキニモド |
| カーバメート | ブフェキサマク(HDAC6i) |
| ハイブリッド化合物 | |
| パゾパニブハイブリッド; デュアルインドールアミン2,3-ジオキシゲナーゼ1(IDO1)およびヒストンデアセチラーゼ(HDAC)阻害剤; デュアルニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)およびヒストンデアセチラーゼ(HDAC)阻害剤; HDACi MS-275 + NOドナー; ポリアミンベースのHDAC-LSD1二重結合阻害剤; デュアルG9aおよびHDAC阻害剤; 三重阻害剤 |
オルトアミノアニリド6dおよびヒドロキサム酸13f; 化合物10; チアゾロカルボキサミド(化合物7f); 化合物35; ジニトロオキシ化合物31; フロキサン誘導体16; ボリノスタット-トラニルシプロミン誘導体; 化合物14; 化合物47 |
| サーチュインモジュレーター/阻害剤 | ニコチンアミド/ナイアシンアミド; スラミン; セリシスタット; イナウジン; AGK-2; AK-7; シルチノール; Salermide; MS3; スプリトマイシン; カンビノール; SEN-196; ジヒドロクマリン; テノビン-6; UVI5008; HR-73; SirReal2; 5-メチルメレイン; メレイン; Eurochevalierine; 8-ブロモ-1,2-ジヒドロ-3H-ナフト[1,2-e] [1,3]オキサジン-3-チオン-N-アルキル化誘導体; 2-((4,6-ジメチルピリミジン-2-イル)チオ)-N-フェニルアセトアミド誘導体 |
| サーチュインモジュレーター/アクチベーター | レスベラトロール; SRT-501; SRT-1460; SRT-1720; SRT-2104; SRT-2183; GSK-184072; ケルセチン; フィセチン; ブテイン; イソリキリチゲニン; ピセアタンノール; フルタミド; 硫化水素 |
| その他の化合物 | 3-デアザネプラノシンA(DZNep); ツバシン; EVP-0334; MOCPAC; BATCP; 6-([ 18 F]フルオロアセトアミド)-1-ヘキサンイカニリド; キナゾリン-4-オン誘導体: (E)-3-(2-エチル-7-フルオロ-4-オキソ-3-フェネチル-3,4-ジヒドロキナゾリン-6-イル)-N-ヒドロキシアクリルアミド; N-ヒドロキシ-3-(2-メチル-4-オキソ-3-フェネチル-3,4-ジヒドロ-キナゾリン-7-イル)-アクリルアミド; キノリン誘導体: SGI-1027(N-(4-(2-アミノ-6-メチルピリミジン-4-イルアミノ)フェニル)-4-(キノリン-4-イルアミノ)ベンズアミド); カルバマゼピン; APHA; (S)-4-2-(5-(ジメチルアミノ)ナフタレン-1-スルホンアミド)-2-フェニルアセトアミド)-N-ヒドロキシベンズアミド(D17); HDAC3阻害剤RGPF966; 3 ‘、4′-ジヒドロ-2’H-スピロ[イミダゾリジン-4,1’-ナフタレン] -2,5-ジオン 1-(3-メトキシフェニル)-5-(3,4,5-トリメトキシフェニル)-1H -1,2,4-トリアゾール-3-カルボキサミド; α、β-不飽和カルボン酸および尿素ベースの誘導体; マンソン住血吸虫ヒストンデアセチラーゼ8(HDAC8)阻害剤:N-(2,5-ジオキソピロリジン-3-イル)-N-アルキルヒドロキサメート誘導体; 非ヒドロキサム酸ベンゾチアジアジン二酸化物誘導体; 二次および三次-N-置換7-アミノヘプタノヒドロキサム酸誘導体; ポリオキソメタレート(PC-320); 大環状非リボソームペプチドHDAC阻害剤; Cd [L-プロリン] 2; テトラヒドロイソキノリンベースのHDAC阻害剤; ジチエニルエテン; フルギミド; イサチン/ o-フェニレンジアミンベースのHDAC阻害剤; JSL-1; ベンゾジアゼピン(BZD)誘導体; 7-ウレイド-N-ヒドロキシヘプタンアミド誘導体(CKD5) |
これまでにいくつかのエピジェネティックな薬剤がADモデルで試験されているが、前臨床試験や早期臨床試験に合格したものはなかった[10,11]。SIRT1遺伝子のハイパーメチル化とβアミロイド前駆体タンパク質(APP)遺伝子の脱メチル化は、アルツハイマー病では一般的な所見である。しかし、アルツハイマー病ではSIRT1の発現は低下し、APPの発現は増加している。ヒト神経芽腫SK-N-SH細胞をアミロイドβ25-35の存在下でエピジェネティックな薬剤であるDNAメチル化阻害剤5-アザ-2′-デオキシシチジン(DAC)とヒストン脱アセチラーゼ阻害剤トリコスタチンA(TSA)で処理したところ、アミロイド毒性下ではDACとTSAはAPPの発現に異なる効果を示すことが示された。MAPT(微小管関連タンパク質τ)PSEN1(プレセニリン1)PSEN2(プレセニリン2)およびAPOE遺伝子は、アミロイドβ25-35によってアップレギュレートされるが、DACおよび/またはTSAには反応しない[156]。
8.2. サーチュインモジュレーター
哺乳類のサーチュイン(SIRT1-7)は、細胞生存、炎症、エネルギー代謝、癌、老化、心血管疾患、神経変性に中心的な効果を持つNAD+依存性リジン脱アセチル化酵素である。したがって、この酵素ファミリーのメンバーは、加齢に関連した神経変性疾患や癌の治療のための有望な医薬品ターゲットとなっている。一連のサーチュインモジュレーターは、過去数十年の間に発見され、特徴づけられてきた [18,157表3および表4] が、動物モデルで健康上の利点を提供している。天然物と比較して、合成サーチュイン調節薬は、より高い効力、溶解性、および標的選択性を示し、さらに高い毒性も示している[18,157]。アルツハイマー病の潜在的な治療標的としてサーチュインが有望視されているにもかかわらず[158,159]、ブレークスルーは報告されておらず、アルツハイマー病や他の神経変性疾患を対象としたエピジェネティック薬はほとんど臨床試験中ではない[10,11,18]。以下の段落では、サーチュインモジュレーター(活性化剤および阻害剤)のいくつかの例を示す(表3および表4)。
表4 潜在的なサーチュイン(SIRT)モジュレーター。
| 治療薬 | |
|---|---|
 |
名前:ニコチンアミド、ナイアシンアミド、ビタミンPP、アミニコチン、ニコチン酸アミド、アミキシコチン、3-ピリジンカルボキサミド、パプレックス、ニコチルアミド 分子式: C 6 H 6 N 2 O 分子量: 122.12 g / mol IUPAC名:ピリジン-3-カルボキサミド カテゴリー:ビタミン メカニズム: SIRT阻害剤 ターゲット: SIRT1-7 |
 |
名前:Splitomicin ; 1,2-ジヒドロ-3H-ナフト[2,1-b]ピラン-3-オン; 5690-03-9; 1,2-ジヒドロ-3h-ベンゾ[f]クロメン-3-オン; CHEMBL86537 分子式: C 13 H 10 O 2 分子量: 198.22 g / mol IUPAC名: 1,2-ジヒドロベンゾ[f]クロメン-3-オン カテゴリー:抗生物質 メカニズム: SIRT阻害剤 ターゲット: SIRT1; SIRT2 |
 |
名前:HR-73 ; 959571-93-8; SCHEMBL18134584; SCHEMBL18134584; AC1OCFZN; HR73; CHEMBL271761; 8-ブロモ-2-フェニル-1,2-ジヒドロベンゾ[f]クロメン-3-オン 分子式: C 19 H 13 BrO 2 分子量: 353.22 g / mol IUPAC名: 8-ブロモ-2-フェニル-1 2-ジヒドロベンゾ[f]クロメン-3-オン カテゴリー:抗生物質 メカニズム: SIRT阻害剤 標的: SIRT1; SIRT2 |
 |
名前:シルチノール; サー2阻害剤ナフトール; 2-[(2-ヒドロキシナフタレン-1-イルメチレン)アミノ] -N-(1-フェネチル)ベンズアミド; 2-{[(2-ヒドロキシ-1-ナフチル)メチレン]アミノ} -N-(1-フェニルエチル)ベンズアミド 分子式: C 26 H 22 N 2 O 2 分子量: 394.47 g / mol IUPAC名: 2- [ [(Z)-(2-オキソナフタレン-1-イリデン)メチル]アミノ] -N-(1-フェニルエチル)ベンズアミド カテゴリー:複素環式化合物 メカニズム: SIRT阻害剤 ターゲット: SIRT1; SIRT2 |
 |
名前:スラミン、ナフリド、ゲルマニン、ナガノール、ベルガニル、フルノー、ファーマ、アントリポール、スラミン、ナガニン 分子式: C 51 H 40 N 6 O 23 S 6 分子量: 1297.26 g / mol IUPAC名: 8-[[4-メチル-3-[[3-[[3-[[2-メチル-5-[(4,6,8-トリスルホナフタレン-1-イル)カルバモイル]フェニル]カルバモイル]フェニル]カルバモイルアミノ]ベンゾイル]アミノ]ベンゾイル]アミノ]ナフタレン-1,3,5-トリスルホン酸 カテゴリー:ポリアニオン化合物 メカニズム: SIRT阻害剤 ターゲット: SIRT1; SIRT2 |
 |
名前:テノビン-6 ; 011557-82-6; CHEMBL595354; CHEBI:77729; 4-tert-ブチル-N -[[4- [5-(ジメチルアミノ)ペンタノイルアミノ]フェニル]カルバモチオイル]ベンズアミド 分子式: C 25 H 34 N 4 O 2 S 分子量: 454.63 g / mol IUPAC名: 4-tert -ブチル-N -[[4- [5-(ジメチルアミノ)ペンタノイルアミノ]フェニル]カルバモチオイル]ベンズアミド カテゴリー:小分子 メカニズム: SIRT阻害剤 ターゲット: SIRT1; SIRT2; SIRT3 |
 |
名前:Salermid ; (E)-N-(3-((2-ヒドロキシナフタレン-1-イル)メチレンアミノ)フェニル)-2-フェニルプロパンアミド; SCHEMBL8103931; HMS3648G04; 1105698-15-4 分子式: C 26 H 22 N 2 O 2 分子量: 394.47 g / mol IUPAC名: N- [3-[[(Z)-(2-オキソナフタレン-1-イリデン)メチル]アミノ]フェニル] -2-フェニルプロパンアミド カテゴリー:小分子 メカニズム: SIRT阻害剤 標的: SIRT1; SIRT2 |
 |
名前:カンビノール; NSC112546; NSC-112546; SIRT1 / 2阻害剤IV、カンビノール; NSC-1125476; 5-[(2-ヒドロキシ-1-ナフチル)メチル] -2-メルカプト-6-フェニル-4(3H)-ピリミジノン 分子式: C 21 H 16 N 2 O 2 S 分子量: 360.43 g / molIUPAC 名: 5-[(2-ヒドロキシナフタレン-1-イル)メチル] -6-フェニル-2-スルファニリデン-1H-ピリミジン-4-オン カテゴリー:小分子 メカニズム: SIRT阻害剤 標的: SIRT1; SIRT2 |
 |
名前:Selisistat ; EX527; 49843-98-3; 6-クロロ-2,3,4,9-テトラヒドロ-1H-カルバゾール-1-カルボキサミド; SIRT1阻害剤III; EX 527; SEN0014196 分子式: C 13 H 13 ClN 2 O 分子量: 248.71 g / mol IUPAC名: 6-クロロ-2,3,4,9-テトラヒドロ-1H-カルバゾール-1-カルボキサミド カテゴリー:小分子 メカニズム: SIRT阻害剤 ターゲット: SIRT1 |
 |
名前:Inauhzin ; 309271-94-1; AK175751 ; C25H19N5OS2; 1-フェノチアジン-10-イル-2-(5H- [1,2,4]トリアジノ[5,6-b]インドール-3-イルスルファニル)ブタン-1-オン; AC1NUV9U 分子式: C 25 H 19 N 5 OS 2 分子量: 459.58 g / mol IUPAC名: 1-フェノチアジン-10-イル-2-(5H- [1,2,4]トリアジノ[5,6-b]インドール-3-イルスルファニル)ブタン-1-オン カテゴリー:小分子 メカニズム: SIRT阻害剤 標的: SIRT1 |
 |
名前:ジヒドロクマリン; 3,4-ジヒドロクマリン; ハイドロクマリン; クロマン-2-オン; ベンゾジヒドロピロン; メリロチン; メリロトール; 1,2-ベンゾジヒドロピロン; 2-クロマノン 分子式: C 9 H 8 O 2 分子量: 148.16 g / mol IUPAC名: 3,4-ジヒドロクロメン-2-オン カテゴリー:小分子 メカニズム: SIRT阻害剤 ターゲット: SIRT1 |
 |
名前:AGK-2 ; UNII-DDF0L8606A; サーチュイン2阻害剤; 304896-28-4; 2-シアノ-3-(5-(2,5-ジクロロフェニル)フラン-2-イル)-N-(キノリン-5-イル)アクリルアミド; CHEMBL224864 分子式: C 23 H 13 Cl 2 N 3 O 2 分子量: 434.28 g / mol IUPAC名:(E)-2-シアノ-3- [5-(2,5-ジクロロフェニル)フラン-2-イル] – N -キノリン-5- ylprop -2-エナミド カテゴリー:小分子 メカニズム: SIRT阻害剤の 標的: SIRT2 |
 |
名前:AK-7 ; 420831-40-9; UNII-308B6B695N; CHEMBL3222141; 3-(アゼパン-1-イルスルホニル)-N-(3-ブロモフェニル)ベンズアミド; ZINC01159030 分子式: C 19 H 21 BrN 2 O 3 S 分子量: 437.35 g / mol IUPAC名: 3-(アゼパン-1-イルスルホニル)-N-(3-ブロモフェニル)ベンズアミド カテゴリー:小分子 メカニズム: SIRT阻害剤 ターゲット: SIRT2 |
 |
名前:SirReal2 ; 2-(4,6-ジメチル-ピリミジン-2-イルスルファニル)-N-(5-ナフタレン-1-イルメチル-チアゾール-2-イル)-アセトアミド 分子式: C 22 H 20 N 4 OS 2 分子量: 420.55 g / mol IUPAC名: 2-(4,6-ジメチルピリミジン-2-イル)スルファニル-N- [5-(ナフタレン-1-イルメチル)-1,3-チアゾール-2-イル]アセトアミド カテゴリー:小分子 メカニズム: SIRT阻害剤 ターゲット: SIRT2 |
 |
名前:レスベラトロール、トランスレスベラトロール、501-36-0、3,4 ‘、5-トリヒドロキシスチルベン、3,4’、5-スチルベントリオール、3,5,4’-トリヒドロキシスチルベン、レスビダ、(E)-レスベラトロール 分子式: C 14 H 12 O 3 分子量: 228.24 g / mol IUPAC名: 5-[(E)-2-(4-ヒドロキシフェニル)エテニル]ベンゼン-1,3-ジオール カテゴリー:天然ポリフェノール メカニズム: SIRT活性剤 ターゲット: SIRT1 |
 |
名前:ピセアタンノール; 10083-24-6; 3-ヒドロキシレスベラトール; アストリンギニン; ピセアタンノール; (E)-4-(3,5-ジヒドロキシスチリル)ベンゼン-1,2-ジオール; 3,5,3 ‘、4’-テトラヒドロキシスチルベン; NSC-365798 分子式: C 14 H 12 O 4 分子量: 244.25 g / mol IUPAC名: 4-[(E)-2-(3,5-ジヒドロキシフェニル)エテニル]ベンゼン-1,2-ジオール カテゴリー:天然ポリフェノール メカニズム: SIRTアクチベーター ターゲット: SIRT1 |
 |
名前:ケルセチン; ソフォレチン; ケルセチン; Meletin; Xanthaurine; ケルセチン; 3,3 ‘、4’、5,7-ペンタヒドロキシフラボン 分子式: C 15 H 10 O 7 分子量: 302.24 g / mol IUPAC名: 2-(3,4-ジヒドロキシフェニル)-3,5,7-トリヒドロキシクロメン- 4-one カテゴリー:天然ポリフェノール メカニズム: SIRTアクチベーター ターゲット: SIRT1 |
 |
名前:フィセチン; 528-48-3; 2-(3,4-ジヒドロキシフェニル)-3,7-ジヒドロキシ-4H-クロメン-4-オン; 5-デソキシケルセチン; 3,3 ‘、4’、7-テトラヒドロキシフラボン; Superfustel; コチニン; フィエティン; フステル; Fustet 分子式: C 15 H 10 O 6 分子量: 286.24 g / mol IUPAC名: 2-(3,4-ジヒドロキシフェニル)-3,7-ジヒドロキシクロメン-4-オン カテゴリー:天然ポリフェノール メカニズム: SIRT活性剤 標的: SIRT1 |
 |
名前:ブテイン; 487-52-5; 2 ‘、3,4,4’-テトラヒドロキシカルコン; 2 ‘、4’、3,4-テトラヒドロキシカルコン; 3,4,2 ‘、4’-テトラヒドロキシカルコン; EINECS 207-659-5 分子式: C 15 H 12 O 5 分子量: 272.26 g / mol IUPAC名:(E)-1-(2,4-ジヒドロキシフェニル)-3-(3,4-ジヒドロキシフェニル)prop- 2-en-1-one カテゴリー:天然ポリフェノール メカニズム: SIRTアクチベーター ターゲット: SIRT1 |
 |
名前:イソリキリチゲニン; 961-29-5; 2 ‘、4,4’-トリヒドロキシカルコン; 4,2 ‘、4’-トリヒドロキシカルコン; イソリキルチゲニン; (E)-1-(2,4-ジヒドロキシフェニル)-3-(4-ヒドロキシフェニル)プロプ-2-エン-1-オン 分子式: C 15 H 12 O 4 分子量: 256.26グラム/モル IUPAC名:( E)-1-(2,4-ジヒドロキシフェニル)-3-(4-ヒドロキシフェニル)プロプ-2-エン-1-オン カテゴリー:天然ポリフェノール メカニズム: SIRT活性化因子 標的: SIRT1 |
 |
名前:フルタミド; 162666-34-4; AC1O5YLM; DCL000372; DNC000657; GSK184072; (5Z)-1-ヒドロキシ-3-イソブチル-5-(2-メチルプロピリデン)ピラジン-2,6-ジオン 分子式: C 12 H 18 N 2 O 3 分子式: 238.29 g / mol IUPAC名:(5Z) -1-ヒドロキシ-3-(2-メチルプロピル)-5-(2-メチルプロピリデン)ピラジン-2,6-ジオン カテゴリー:複素環式化合物 メカニズム: SIRT活性剤 ターゲット: SIRT1 |
 |
名前:SRT-1460 ; 3,4,5-トリメトキシ-N-(2-(3-(ピペラジン-1-イルメチル)イミダゾール[2,1-b]チアゾール-6-イル)フェニル)ベンズアミド; 925432-73-1; CHEMBL254156; AK-57112 分子式: C 26 H 29 N 5 O 4 S 分子量: 507.61 g / mol IUPAC名: 3,4,5-トリメトキシ-N- [2- [3-(ピペラジン-1-イルメチル)イミダゾ[ 2,1-b] [1,3]チアゾール-6-イル]フェニル]ベンズアミド カテゴリー:小分子 メカニズム: SIRT活性化因子 標的: SIRT1 |
 |
名前:SRT-1720 ; 925434-55-5; N-(2-(3-(ピペラジン-1-イルメチル)イミダゾール[2,1-b]チアゾール-6-イル)フェニル)キノキサリン-2-カルボキサミド; CHEMBL257991 分子式: C 25 H 23 N 7 OS 分子量: 469.57 g / mol IUPAC名: N- [2- [3-(ピペラジン-1-イルメチル)イミダゾ[2,1-b] [1,3]チアゾール-6-イル]フェニル]キノキサリン-2-カルボキサミド カテゴリー:小分子 メカニズム: SIRT活性化因子 標的: SIRT1 |
 |
名前:SRT-2183 ; (R)-N-(2-(3-((3-ヒドロキシピロリジン-1-イル)メチル)イミダゾール[2,1-b]チアゾール-6-イル)フェニル)-2-ナフタミド; CHEMBL403308; BDBM50376978; ZINC29043608 分子式: C 27 H 24 N 4 O 2 S 分子量: 468.56 g / mol IUPAC名: N- [2- [3-[[(3R)-3-ヒドロキシピロリジン-1-イル]メチル]イミダゾ[2 、1-b] [1,3]チアゾール-6-イル]フェニル]ナフタレン-2-カルボキサミド カテゴリー:小分子 メカニズム: SIRT活性化因子 標的: SIRT1 |
 |
名前:SRT-2104 ; 093403-33-8; サーチュインモジュレーター; SRT 2104; UNII-4521NR0J09; SRT2104(GSK2245840); SCHEMBL964014; ZINC43202455; DTXSID00648729 分子式: C 26 H 24 N 6 O 2 S 2 分子量: 516.64 g / mol IUPAC名: 4-メチル-N- [2- [3-(モルホリン-4-イルメチル)イミダゾ[2,1-b ] [1,3]チアゾール-6-イル]フェニル] -2-ピリジン-3-イル-1,3-チアゾール-5-カルボキサミド カテゴリー:小分子 メカニズム: SIRT活性化因子 標的: SIRT1 |
8.2.1. 葉酸
アルツハイマー病患者の約6~10%は葉酸が欠乏しており、40%以上が心血管障害や血管の危険因子を表す疾患に罹患している。葉酸は、トランスジェニックマウスを用いた早期アルツハイマー病において、心血管障害や神経保護作用を示する。葉酸治療は、3×Tgマウスでは抑制されているSIRT1発現を、AMPK発現の増強を介して回復させる[160]。
8.2.2. レスベラトロール
レスベラトロール(3,4′,5-トリヒドロキシスチルベン)は、赤ワイン、ブドウ、ベリー類、チョコレート、ピーナッツに含まれるファイトケミカルである。レスベラトロールは、抗酸化作用、抗炎症作用、抗ウイルス作用、抗がん作用を示する。レスベラトロールは、ADモデルにおいて神経保護効果を示する。レスベラトロールは、アミロイド前駆体タンパク質(APP)の非アミロイド性分解を促進し、神経毒性のあるアミロイドβペプチドの除去を促進し、NAD+依存性ヒストン脱アセチル化酵素[161]の活性化を介して神経細胞へのダメージを低減する。
食品由来のポリフェノールは、動脈硬化、心血管疾患、癌、関節炎、白内障、骨粗鬆症、糖尿病、高血圧、アルツハイマー病などの加齢に関連した疾患から保護する。レスベラトロールとプテロスチルベンは、酸化損傷、炎症、テロメアの萎縮、細胞の老化に対してアンチエイジング効果を持つポリフェノールである[162]。
レスベラトロールはSIRT1の強力な活性化因子であり、カロリー制限を模倣して老化に関連した障害を予防する。軽度から中等度のアルツハイマー病症例におけるレスベラトロールの無作為化、二重盲検、プラセボ対照、第II相試験では、レスベラトロールが血液脳関門を通過し、中枢神経系の免疫応答を調節することが明らかになった[163]。
アミロイドβはコレステロールレベルとその中間体であるゲラニルピロリン酸とファルネシルピロリン酸に影響を与える。レスベラトロールはコレステロールの恒常性を維持し、SIRT1発現を増強する能力を介してアミロイド原性の負担を軽減する[164]。レスベラトロールは、アミロイドβ(抗神経細胞アポトーシス作用、抗酸化ストレス作用、抗神経炎症作用)を調節することで、神経保護作用を持つバイオファクターである。SIRT1は、ラット海馬におけるSIRT1発現およびCREBリン酸化を調節するcAMP応答結合タンパク質(CREB)の発現を調節することで、学習および記憶機能を調節する[165]。レスベラトロールは、アミロイドβ25-35による細胞生存率の低下を抑制し、軽鎖3-IIの発現、シークエストソーム1の分解、オートファゴソームの形成をアップレギュレートする。3-メチルアデニンによるオートファジーの抑制は、アミロイドβ25-35誘発神経毒性に対するレスベラトロールの効果を廃止する。レスベラトロールは、ポリ(ADP-リボース)ポリメラーゼ1(PARP1)のオートポリADPリボシル化であるSIRT1の発現を促進する。レスベラトロールが介在するオートファジーは、SIRT1(EX527)ニコチンアミドホスホリボシルトランスフェラーゼ(STF-118804)PARP1(AG-14361)の阻害剤、およびSIRT1とTyrRS小型干渉RNAトランスフェクションを用いると廃止することができ、オートファジー誘導に対するレスベラトロールの効果がTyrRS、PARP1およびSIRT1に依存していることが示されている[166]。
レスベラトロールは細胞のアポトーシスを減少させ、細胞間Ca2+ホメオスタシスを安定化させ、アミロイドβ25-35の神経毒性を減衰させる。アミロイドβ(5-35)抑制されたSIRT1活性はレスベラトロールによって反転し、その結果、Rho-associated kinase 1 (ROCK1)のダウンレギュレーションが起こる [167]。
レスベラトロールは軸索変性を遅らせる。レスベラトロールのワレリア変性に対する効果は、SIRT1を阻害すると失われる。内因性SIRT1阻害剤である乳癌-1(DBC1)をノックアウトすると、レスベラトロールの神経保護効果が回復する。レスベラトロールは、培養神経節におけるSIRT1とDBC1の解離を促進することにより、ワレリア変性から保護するようである[168]。
8.2.3. プテロスチルベン
レスベラトロール誘導体であるプテロスチルベンは、加齢に伴う障害やADモデルにおいて神経保護効果を示する。プテロスチルベンの食事は細胞ストレス、炎症、および アルツハイマー病 病理のマーカーに影響を与え、ペルオキシソーム増殖因子活性化受容体(PPAR)α発現のアップレギュレーションと SIRT1 レベルへの影響はない[169]。
8.2.4. クルクミン
ウコン(Curcuma longa)の黄色色素から抽出されたクルクミンは、抗酸化作用、抗アポトーシス作用、神経保護作用を示す。クルクミンは、培養大脳皮質ニューロンにおけるアミロイドβ25-35誘導細胞毒性を防ぎ、ミトコンドリア膜電位(ΔΨm)を改善し、活性酸素の発生を減少させ、アポトーシス細胞死を抑制する。クルクミンはまた、アミロイドβ25-35の存在下でBaxの発現のその後の減少を伴うSIRT1の発現を活性化する。クルクミンの保護効果は、SIRT1 siRNAによってブロックすることができる[170]。
クルクミンはアクロレインによって誘導される毒性に対して神経保護効果を発揮する。クルクミンはγ-グルタミルシステイン合成酵素、活性酸素種、活性窒素種の発現を回復させるが、グルタチオン(GSH)やタンパク質カルボニルには影響を与えない。アクロレインはNrf2,NF-κBおよびSirt1を活性化し、これらの試験管内試験効果はクルクミンによって調節される。また、アクロレインはpAktの低下を誘導するが、これはクルクミンによって相殺される[171]。
8.2.5. ニコチンアミドリボシド
欠損した細胞の生体エネルギーとDNA修復がアルツハイマー病の病因に寄与している。神経炎症、pTau、DNA損傷、シナプス機能障害、神経細胞の変性の上流にある細胞のNAD+枯渇がアルツハイマー病の病因となる可能性がある。ニコチンアミドリボシド(NR)による治療は、トランスジェニックモデルのpTau病理を減少させるが、アミロイドβ蓄積には影響を与えない。NRで処理した3×TgAD/Polβ+/-マウスは、海馬ニューロンのDNA損傷、神経炎症、およびアポトーシスの減少を示し、脳SIRT3の活性の増加を示した[172]。
8.2.6. オレオロイロペインアグリコン
オレオロイロペイン・アグリコン(OLE)は、エキストラバージンオリーブオイルに含まれるポリフェノールである。OLEは、凝集したタンパク質や損傷した小器官がリソソーム消化によって排除されるプロセスであるオートファジーを誘導することができる。オートファジーはアルツハイマー病では欠損しており、OLEは、AMPK/mTOR軸やサーチュインやヒストンアセチル化またはEB転写因子によって媒介されるオートファジー遺伝子発現の活性化を含むいくつかの経路を調節することにより、凝集したタンパク質を減少させ、認知力を向上させることができる[173]。
ポリ(ADP-リボース)ポリメラーゼ-1(PARP1)活性化は、アルツハイマー病におけるアミロイドβ誘導神経毒性イベントに寄与する。TgCRND8マウスのOLE処理は、PARP1の活性化とその産物であるPARのレベルをコントロール値に回復させる。N-メチル-N′-ニトロ-N-ニトロソグアニジン(MNNG)に曝露したときのPARP1活性化とPARP形成は、OLEまたはPARP阻害剤で前処理を行うことで廃止される。OLE による PARP1 活性化の低下は、SIRT1 の過剰発現と NF-κB およびプロアポトーシスマーカー p53 の減少によって平行している。
8.2.7. ホノキオール
ホノキオール(マグノリア・グランディフローラ由来のポリフェノールリグナン)は、抗酸化活性を持つSIRT3活性化剤である。ホノキオールはSIRT3の発現を増強し、活性酸素の発生や脂質過酸化を抑制し、抗酸化活性とミトコンドリア機能を増強し、トランスジェニックモデルのアミロイドβおよびsAPPβレベルを低下させる。ホノキオールはAMPK、CREB、PGC-1αの発現を増加させ、β-セクレターゼ活性を阻害し、結果としてアミロイドβレベルの低下につながる[175]。
8.2.8. フラボノイド
フラボノイドは、アルツハイマー病、老化および加齢に関連した炎症性疾患において潜在的に有益な効果を有する栄養補助食品である。フラボノイドは、アミロイド前駆体タンパク質(APP)処理、アミロイドβ蓄積およびタウ病理を媒介することにより、細胞外アミロイド沈着物および神経原線維のもつれを減少させることができる。フラボノイドの抗酸化作用および抗炎症作用、ならびにサーチュインおよびテロメアに対する調節作用もまた、神経変性の改善に寄与している。フラボノイドの中には、ポリ(ADP-リボース)ポリメラーゼ(PARP)および環状ADP-リボース(cADP)合成酵素(CD38およびCD157)を阻害し、細胞内ニコチンアミド・アデニン・ジヌクレオチド(NAD+)レベルを上昇させ、NAD+依存性サーチュイン介在性シグナル伝達経路を活性化するものがある[176]。
8.2.9. リバミピド
レバミピド(REB)は、経口投与後に血液脳関門を通過する消化管保護薬である。REBは、細胞内アミロイドβオリゴマー(100~150kDa)及び内因性アミロイドβ42分泌量を減少させ、腫瘍壊死因子-α変換酵素、崩壊酵素及びメタロプロテアーゼ-17,ネプリリシン、マトリックスメタロプロテアーゼ-14(MMP-14)/膜型-1 MMP、シクロオキシゲナーゼ-2及びサーチュイン1の発現を増強する[177]。
8.2.10. トリペプチド
SIRT1 は アルツハイマー病 病理における APP のアミロイド原性処理を減衰させる。CWR トリペプチドは、SIRT1 活性を増強する能力を持つ潜在的な SIRT1 活性化剤として特徴づけられている。このトリペプチドは、IMR32神経芽腫細胞におけるp53のアセチル化を減少させ、アミロイドβ毒性から細胞を保護する[178]。
8.2.11. アンペロプシン(ジヒドロミリセチン)
アンペロプシンは、中国のハーブであるアンペロプシス・グロスデンタタ(Ampelopsis grossedentata)に由来する天然のフラボノイドで、抗炎症、抗酸化、抗がん作用などの多元的な作用を持つ。d-galによる脳の老化モデルラットを用いた研究により、アンペロプシンによりmiR-34aの発現が抑制されることが明らかになった。miR-34aのアップレギュレーションは老化関連疾患と関連している。アンペロプシンはmiR-34aのダウンレギュレーションに関連して、SIRT1のアップレギュレーションとmTORシグナル伝達経路のダウンレギュレーションを介してオートファジーを活性化する[179]。
8.2.12. シスタチン C
シスタチンC(CysC)は、ヒト脳微小血管内皮細胞におけるアミロイドβ40分泌を減少させる天然のシステインプロテアーゼ阻害剤である。CysCによるアミロイドβ40の減少は、ユビキチン/プロテアソーム経路を介したβ分泌酵素BACE1の分解によって引き起こされる。CysCに応答して転写的にアップレギュレーションされるα-セクレターゼADAM10は、CysC誘導性sAPPα分泌に必要である。SIRT1のノックダウンは、CysCをトリガーとしたADAM10のアップレギュレーションとsAPPα産生を廃止する。CysC は、BACE1 のプロテアソーム分解と SIRT1 媒介の ADAM10 アップレギュレーションによって媒介されるアミロイド原性 APP 処理を非アミロイド原性経路に誘導することができる[180]。
8.2.13. シロスタゾール
アルツハイマー病におけるオートファジーはアミロイドβの分解を媒介しており、シロスタゾールはbeclin1,Atg5,LC3-IIの発現を増加させることでオートファジーを調節し、細胞内のアミロイドβ蓄積を減少させる。シロスタゾールは、レスベラトロール(SIRT1活性化薬)またはAICAR(AMPK活性化薬)として、P-AMPKα(Thr 172)およびP-ACC(アセチル-CoAカルボキシラーゼ)(Ser 79)の発現を増加させる。これらの作用は、KT5720,化合物C(AMPK阻害剤)またはシルチノールにより阻害される。シロスタゾールは、リン酸化されたmTOR(Ser 2448)およびリン酸化されたP70S6K(Thr 389)の発現を抑制し、P62/Sqstm1の減少と関連してLC3-IIレベルを増加させる。シロスタゾールはまた、カテプシンB活性を増加させ、p62/Sqstm1を減少させ、その結果、N2aSwe細胞におけるアミロイドβ1-42の減少を伴う。これらの効果はまた、シルチノール、化合物CおよびバフィロマイシンA1(オートファゴソームブロッカー)によっても阻害され、シロスタゾールによって誘導されるオートファゴソーム形成の亢進を示唆している。SIRT1遺伝子をサイレンシングしたN2a細胞において、シロスタゾールは、P-LKB1(Ser428)およびP-AMPKαの発現を変化させない。pcDNA SIRT1をトランスフェクトしたN2a細胞は、P-AMPKαの発現の増加を示し、これはN2a細胞におけるシロスタゾールの効果を模倣したものであった。Parkら[181]によって報告されたこれらの結果と一致し、シロスタゾールによって刺激されたP-LKB1およびP-AMPKαの発現はSIRT1依存性であるように思われる。シロスタゾールは、SIRT1 を介した P-LKB1/P-AMPKα を活性化し、mTOR の活性化を阻害することでオートファジーをアップレギュレートし、それによって アミロイドβ の蓄積を減少させる [61,181]。
8.2.14. オスモチン(じゃがい、トマトなど)
オスモチンは、哺乳類のアディポネクチンの植物タンパク質ホモログである。オスモチン治療はアディポネクチン受容体1(AdipoR1)を調節し、AMP活性化プロテインキナーゼ(AMPK)/サーチュイン1(SIRT1)活性化を誘導し、ADモデルにおけるSREBP2(ステロール調節エレメント結合タンパク質2)発現を減少させる。AdipoR1/AMPK/SIRT1/SREBP2シグナル伝達経路を介して、オスモチンは、シナプス前後の機能障害、認知障害、記憶障害、長期増強の改善を伴って、アミロイド原性アミロイドβの産生と凝集を減少させる。AdipoR1,AMPK、SIRT1サイレンシングは、オスモチンの効果を廃止し、アルツハイマー病の病理を増強する。オスモチンはまた、AMPK/SIRT1依存的な方法でα-セクレターゼ遺伝子ADAM10を活性化することにより、非アミロイド原性経路を増強する[182]。
8.2.15. フジサン(高麗人参・スカルキャップの根)
Fuzhisan(FZS)は、高麗人参の根(Panax ginseng C. A. Mey)バイカルスカルキャップの根(Scutellaria baicalensis Georgi)Acorus calamus L.(Acorus talarinowi Schotti)の根茎、およびradix Glycyrrhizae(Glycyrrhiza uralensis fisch)を含む漢方化合物である。FZSは、用量依存的にアミロイドβ25-35の神経毒性からPC12細胞を保護する。アミロイドβ40,アミロイドβ42およびsAPPβレベルはダウンレギュレートされ、sAPPα、ADAM10,SIRT1およびFoxO発現レベルはアップレギュレートされた。FZS の神経保護メカニズムは、ADAM10 および SIRT1-FoxO 経路の誘導によって媒介される [183]。
8.2.16. サリドロサイド(ロディオラ・ロゼア)
サリドロシド(Rhodioloside)は、植物性のRhodiola roseaに含まれるチロソールのグルコシドである。サリドロシドはロザビンとともに、この植物の抗うつ作用や抗不安作用に関与していると考えられている。d-ガラクトース(d-gal)誘発亜急性老化モデルにおける記憶力と神経炎症は、活性化核因子κB(NF-κB)p65/RelAと海馬におけるSIRT1発現のダウンレギュレーションに関連した悪化を示している。サリドロシドによる治療は、d-gal 誘発性記憶障害と TNF-αおよび IL-1βを含む炎症性メディエーターを改善する。サリドロサイドはまた、SIRT1 のアップレギュレーションを介して NF-κB シグナル経路を阻害する[184]。
8.2.17. CDP-コリン
CDP-コリン(シチコリン)は、コリン供与体であり、DNA代謝の中間体である。1970年代に開発されたこの古い化合物は、いくつかのヨーロッパ諸国と日本では数十年前から神経保護剤として使用されている。いくつかの研究は、多因子介入[2,3,120,127,134,150]に組み込まれたアルツハイマー病におけるその有用性を実証した。シチコリンは、神経可塑性を増強し、リン脂質合成の天然前駆体である。従来の特性に加えて、シチコリンはSIRT1発現を増加させる[185]。
8.2.18. 水素を多く含む水
アミロイドβによって誘発された活性酸素の蓄積はミトコンドリア機能障害を増加させ、アポトーシス細胞死を誘発する。水素を多く含む水(HRW)は、そのROS消去能力により、酸化ストレスによる障害の治療に効果的である。HRWは過剰なROSを中和することで酸化的ダメージを打ち消し、アミロイドβによる細胞死を緩和する。HRWは、Sirt1依存性の経路でAMP活性化プロテインキナーゼ(AMPK)を刺激し、フォークヘッドボックスプロテインO3a(FoxO3a)をアップレギュレーションする。HEWはアミロイドβ誘導性ミトコンドリア電位損失と酸化ストレスを減少させる[186]。
8.2.19. リナグリプチン(DPP-4阻害剤)
脳内インスリンシグナル伝達の障害がアルツハイマー病神経病理に影響を及ぼす可能性がある。リナグリプチンは、ジペプチジルペプチダーゼ-4(DPP-4)の阻害剤であり、インスリン分泌およびインスリン下流のシグナル伝達に影響を及ぼす。リナグリプチンは、アミロイドβ誘導細胞毒性から保護し、インスリン下流シグナル伝達を回復させることで、グリコーゲン合成酵素キナーゼ3β(GSK3β)の活性化やタウの高リン酸化を抑制する。リナグリプチンはまた、5′AMP活性化プロテインキナーゼ(AMPK)-Sirt1シグナル伝達を誘導することにより、アミロイドβ誘発ミトコンドリア機能不全及び細胞内活性酸素の発生を緩和する[187]。
8.2.20. メラトニン
メラトニンは、抗酸化作用、神経保護作用、抗興奮作用、免疫調節作用を持つ多元性内因性物質である。メラトニンとそのキヌラミン代謝物は、炎症反応の抑制と神経炎症の進行に重要である。サーチュインはメラトニンの制御下にある概日振動子に影響を与える[188]。
8.2.21. s-リノレノイルグルタチオン(GSH、リノレン酸、ビタミンE)
グルタチオン(GSH)は、哺乳類細胞の中で最も豊富な内因性フリーラジカル消去剤である。一連の新規なs-アシル-GSH誘導体は、ADモデルにおけるアミロイド酸化ストレスとコリン作動性機能障害を防止することができる。線虫野生型N2 Caenorhabditis elegans株の寿命は、GSH、リノレン酸、またはビタミンEのエチルエステルに関して、リノレノイル-SG(lin-SG)チオエステルを食事で補給することによって増強される。Sir-2.1 の Lin-SG 介在性過剰発現は Daf-16 (FoxO) 経路に関連しているようである[189]。
8.2.22. タウリン
タウリンは、神経保護効果を持つ脳内の天然のβ-アミノ酸である。タウリンは、アミロイドβ1-42誘導性の神経細胞死や細胞内Ca2+、ROSの発生を抑制する。SIRT1 の発現は アミロイドβ1-42 処理した SK-N-SH 細胞のタウリンによって回復し、タウリンは SIRT1 の活性化によって アミロイドβ1-42 誘導ミトコンドリア機能障害を防ぐことを示唆している[190]。
8.2.23. ラインリシネート
ラインリシネート(RHL)は、脳組織におけるアミロイドβ1-40およびアミロイドβ1-42,TNF-αおよびIL-6レベルを減少させることにより、老化促進マウスプローン8(SAMP8)マウスにおいて神経保護作用を示す。SIRT1,SOD及びグルタチオンペルオキシダーゼレベルはRHL処理により増加する[191]。
8.2.24. スルホ安息香酸誘導体 AK1
サーチュイン2阻害は、いくつかの神経変性疾患における神経保護戦略である可能性がある。SIRT2阻害剤AK1は、rTg4510マウス(タウ含有神経原線維凝集体の形成と神経細胞の損失によって特徴づけられるタウ病性前頭側頭型認知症のモデル)の海馬において、ある程度の神経保護を提供している[192]。
8.2.25. フィチン酸
フィチン酸(イノシトールヘキサキスリン酸)は、食物穀物に含まれるフィトケミカルであり、哺乳類細胞における重要なシグナル伝達分子である。フィチン酸は、増加した細胞内カルシウム、過酸化水素、スーパーオキシド、およびアミロイドβオリゴマーのレベルを減衰させることにより、アミロイド前駆体タンパク質-C末端断片誘発性細胞毒性に対する保護を提供し、適度にオートファジータンパク質の発現をアップレギュレートする。フィチン酸はチトクロム酸化酵素の脳内レベルを上昇させ、脂質過酸化を減少させる。Tg2576マウスでは、フィチン酸は、アミロイドβPPトラフィッキング関連タンパク質AP180,オートファジー関連タンパク質(beclin-1,LC3B)サーチュイン1,リン酸化AMP活性化プロテインキナーゼ(PAMPK)とAMPKの比率、可溶性アミロイドβ1-40,および不溶性アミロイドβ1-42の発現に中等度の効果を発揮する[193]。
8.2.26. ガンマ・セクレターゼ阻害剤
ガンマ-セクレターゼは、APPの異常なタンパク質分解開裂とアルツハイマー病の病因に関与する神経毒性のアミロイドβペプチドの生産のために責任がある膜内切断プロテアーゼである[2]。ほとんどのガンマセクレターゼ阻害剤は、毒性および/または有効性がないため、アルツハイマー病では失敗している。2-ヒドロキシナフチル誘導体は、ガンマセクレターゼ阻害活性を有するサーチュイン2のNAD+アナログ阻害剤のサブクラスである。2-ヒドロキシ-1-ナフタルアルデヒドは、ガンマセクレターゼ阻害のための最小のファーマコフォアである。ガンマ分泌酵素サブユニットプレセニリン-1 C 末端フラグメント(PS1-CTF)SIRT2,およびヤヌスキナーゼ3(JAK3)が共有するGXGシグネチャーヌクレオチド結合部位(NBS)は、阻害の標的タンパク質決定因子である[194]。
8.2.27. ドネペジル
ドネペジルは、アルツハイマー病治療のために世界的に最も多く処方されている薬剤である[195]。抗コリンエステラーゼ活性に加えて、ドネペジルはSIRT1活性を増加させ、活性酸素の発生を抑制する[196]。
8.2.28. サーチュイン阻害剤
ユーロシェバリエリン(Neosartorya pseudofischeri)。Neosartorya pseudofischeri 真菌由来の真菌代謝物ユーロチェバリエリンは、サーチュイン3の活性に影響を与えることなく、サーチュイン1および2の活性を阻害する。このセスキテルペンアルカロイドは、様々な癌細胞モデルにおいてヒストンH4およびα-チューブリンアセチル化を誘導し、強力なサイトスタティック効果を示している[197]。
12-[18F]フルオロドデカンアミノヘキサノアニリド(12-[18F]DDAHA)。Bonomiら[198]は、SIRT2によって媒介されるエピジェネティック制御プロセスの非侵襲的PETイメージングのために、SIRT2特異的な基質型放射性物質を開発した。12-[18F]フルオロドデカンアミノヘキサノアニリド(12-[18F]DDAHA)のラジオ合成は、12-ヨードデカン-AHA前駆体の求核的ラジオフッ素化によって達成された。
8-ブロモ-1,2-ジヒドロ-3H-ナフト[1,2-e][1,3]オキサジン-3-チオンのN-アルキル化誘導体。非選択的サーチュイン阻害剤スプリトミシンは、生物学的流体への溶解性が悪い複素環芳香族スクリーニングヒットの非極性誘導体である。改善された水への溶解性を有する新規なSIRT2阻害剤が発見された。8-ブロモ-1,2-ジヒドロ-3H-ナフト[1,2-e][1,3]オキサジン-3-チオンN-アルキル化された8-ブロモ-1,2-ジヒドロ-3H-ナフト[1,2-e][1,3]オキサジン-3-チオンの誘導体は、酵素のアセチル-リジンポケットに結合するためにチオカルバミン酸基に親水性モルホリノ-アルキル鎖を有するため、SIRT2阻害剤として有望な候補となる可能性がある[199]。
2-((4,6-ジメチルピリミジン-2-イル)チオ)-N-フェニルアセトアミド誘導体。2-((4,6-ジメチルピリミジン-2-イル)チオ)-N-フェニルアセトアミド誘導体は、新規なSIRT2阻害剤である。これらの化合物は、乳がん細胞の強力な阻害剤であり、用量依存的にα-チューブリンのアセチル化を増加させる[200]。
5-メチルメレイン。サーチュインは、真菌の増殖および二次代謝物の産生に関与している。Shigemotoら[201]は、真菌Aspergillus nidulansが産生するサーチュインA(SirA)のヒストン脱アセチル化酵素活性を阻害する真菌培養エキス579種をスクリーニングした。アスコミコ属3種、担子菌2種、重複菌3種を含む8つの真菌株がSirA阻害剤を産生することができる。JCM 8837は、SirA阻害活性を有するDidymobotryum rigidum由来のポリケチド5-メチルメレインであり、構造的にはムラリンに関連している。5-メチルメレインは真菌の二次代謝を調節し、真菌由来の新規化合物をスクリーニングするための可能性を秘めている。
9. 結論
サーチュイン(SIRT1-7)は、クロマチンサイレンシング、細胞周期制御、細胞分化、細胞ストレス応答、代謝、老化に影響を及ぼすNAD+依存性タンパク質脱アセチル化酵素/ADPリボシルトランスフェラーゼである。サーチュインは、クロマチン修飾因子およびヒストン脱アセチル化酵素として作用するエピジェネティック・マシーンの関連コンポーネントである[15]。SIRTをコードする遺伝子の変異は、エピジェネティックなメンデル病につながる可能性があり、特定のサーチュインのSNPは、いくつかの病状と関連している。いくつかのサーチュイン、特にSIRT 1,2,3および6は、アルツハイマー病の発症に関与する可能性がある。APOEε4陰性集団におけるSIRT2-C/T遺伝子型(rs10410544)(50.92%)とアルツハイマー病感受性との間に関連がある。アルツハイマー病におけるSIRT2遺伝子型の頻度は以下の通りである。SIRT2-C/C、34.72%、SIRT2-C/T、50.92%、SIRT2-T/T 14.36%である(図1)。SIRT2とAPOEの間には相互作用があり、この相互作用は病原性と治療的な結果をもたらす可能性がある。SIRT2とAPOEの変異体をビギニークラスターに統合すると、18個のハプロタイプが得られた。アルツハイマー病における5つの最も頻度の高いビジェニック遺伝子型は、33CT(27.81%)33CC(21.36%)34CT(15.29%)34CC(9.76%)および33TT(7.18%)である(図3)。SIRT2-T/T>SIRT2-C/T>SIRT2-C/Cキャリアにおいて、APOE-3/4およびAPOE-4/4キャリアの蓄積があり;そしてSIRT2-T/TおよびSIRT2-C/T遺伝子型は、APOE-4/4キャリアに蓄積する傾向がある(図4および図5)。SIRT2バリアントはまた、生化学的、血液学的、代謝学的、および心血管表現型に影響を与え、アルツハイマー病におけるファーマコエピジェネティックな転帰に適度に影響を与える(表2)。アルツハイマー病における多因子治療による治療的介入は、各患者の薬理遺伝学的プロフィールに応じて、治療の最初の3〜9ヶ月間は認知機能の改善という点である程度の利益を示する(図13,図14,図15および図16)。SIRT2-C/Tキャリアは最高の反応を示し、SIRT2-T/Tキャリアは中間の反応を示し、SIRT2-C/Cキャリアは治療に対して最悪の反応を示する(図15)。APOE-SIRT2ビジェニッククラスターでは、33CCキャリアは33TTおよび34CTキャリアよりも優れた応答を示し、24CCおよび44CCキャリアは応答不良である(図16)。SIRT2はまた、CYP2D6と相互作用し、この相互作用は、従来の治療に対する薬理遺伝学的応答の調節に寄与する。アルツハイマー病におけるCYP2D6ジェノフェノタイプの頻度は以下の通りである。広範囲代謝型(EM)59.46%、中間代謝型(IM)20.06%、代謝不良型(PM)5.36%、超高速代謝型(UM)6.12%となっている(図17)。CYP2D6-EMは最も反応が良く、PMは最も反応が悪く、UMはIMよりも反応が良い傾向にある(図20)。CYP2D6-PMとUMではAPOE-3/4とAPOE-4/4の遺伝子型の蓄積がある(図18)。CYP2D6遺伝子型との関連では、SIRT2-C/T-EMsが最も優れた応答者である(図22)。
本研究で得られた結果から得られた主な結論は、アルツハイマー病発症およびアルツハイマー病関連遺伝子型におけるSIRT2の影響は非常に軽度であるということであるが、SIRT2バリアントと他の遺伝子(すなわち、APOE、CYP2D6)との相互作用は、発症年齢、臨床経過、認知機能低下率、および薬理学的エピジェネティックな転帰に影響を与え、関連している可能性があるということである。この文脈では、アルツハイマー病発症におけるサーチュインの直接的または間接的な役割が確認され、その神経保護効果が明確に示されれば、将来的にはサーチュインモジュレーターがアルツハイマー病治療の候補になる可能性があると考えられる。