Repeated cold exposures protect a mouse model of Alzheimer’s disease against cold-induced tau phosphorylation
Published online 2019 Jan 26
Marine Tournissac,1,2 Philippe Bourassa,1,2 Ruben D. Martinez-Cano,2 Tra-My Vu,2 Sébastien S. Hébert,2,3 Emmanuel Planel,2,3 and Frédéric Calon1,2,∗.
要旨
目的
老年期はアルツハイマー病の発症率の上昇と関連しているが、体温調節障害にも関連している。この2つの関連性を示唆するように、低体温はタウの高リン酸化を誘導する。3xTg-ADマウスモデルでは、脳内のタウおよびアミロイドの病理学的障害だけでなく、代謝および体温調節障害も発症する。褐色脂肪組織(褐色脂肪組織)は哺乳類の主要な発熱因子であり、その刺激はげっ歯類やヒトの代謝障害を打ち消す。そこで我々は、褐色脂肪組織刺激がアルツハイマー病の神経病理を阻害するかどうかを検討した。
方法
15ヶ月齢の3xTg-ADマウスに、4℃の低温曝露(4時間)を1週間に5回、4週間にわたり反復短期低温曝露(RSCE)を行ったところ、住宅温度で飼育されていた動物と比較して、1週間に5回の低温曝露(4℃)が行われた。
結果
まず、3xTg-アルツハイマー病のRSCE訓練マウスが褐色脂肪組織熱発育を示し、耐糖能が改善されることを確認した。また、RSCE訓練マウスは、24時間の低温負荷によって海馬に誘導されるタウの過リン酸化に対して完全に抵抗性を示した。最後に、RSCEはバトカインである線維芽細胞増殖因子21(FGF21)の血漿中濃度を上昇させ、海馬のタウリン酸化とは逆の相関を示した。
結論
全体的に、RSCEを介した褐色脂肪組織刺激は、アルツハイマー病神経病理の3xTg-ADマウスモデルにおいて、代謝障害を改善し、寒冷化誘導タウの高リン酸化を完全にブロックした。これらの結果は、熱発育の改善がアルツハイマー病の治療効果を発揮する可能性を示唆している。
キーワード アルツハイマー病、褐色脂肪組織、タウリン酸化、体温調節、3xTg-ADマウス
1. はじめに
アルツハイマー病は、認知機能の障害によって特徴づけられる神経変性疾患であり、タウを含む神経原線維のもつれやアミロイドβ負荷プラークの存在によって神経病理学的に診断される [1], [2]。アルツハイマー病発症の主な危険因子は紛れもなく高齢である[3]。したがって、加齢によって引き起こされる病理学的変化をよりよく理解することは、アルツハイマー病発症の新たな手がかりを明らかにする可能性がある。加齢に伴う変化の中でも、体温調節障害は頻繁に報告されている。実際、高齢者は若年者よりも効率的に体温を調節することができず [4]、多くの人が日中の体温が正常値以下であり [5], [6]、基礎代謝の低下とともに [7] 、体温調節機能が低下している。興味深いことに、最適な体温を維持する上での欠陥の出現は、この集団におけるアルツハイマー病の発生率の上昇とほぼ一致している。
動物研究は、体温調節障害がアルツハイマー病の発症に寄与することを示唆する新しい証拠のラインを提供している。それは、体温の低下が病気の主要な神経病理学的マーカーの一つであるタウの高リン酸化を誘導することがげっ歯類の脳で繰り返し示されている[8], [9], [10], [11], [12] [1], [2]。動物モデルにおける我々の研究では、加齢と アルツハイマー病 病理の両方が、寒さ(4 ℃、24 時間)への急性曝露後のタウリン酸化の上昇を促進することを示している [11], [12]。例えば、非トランスジェニックマウスと比較して、アルツハイマー病の3xTg-ADマウスモデルは、加齢と神経病理の進行に伴って悪化する基礎体温が低い。興味深いことに、寒冷曝露はアルツハイマー病神経病理学を悪化させることが示された一方で、体温調節障害(28℃)はアルツハイマー病関連の神経病理学と認知機能障害の両方を改善した [11], [12]。
熱調節障害はまた、アルツハイマー病で起こると考えられている一般的な代謝不全の一部として解釈することができる。2型糖尿病は現在、アルツハイマー病を発症する危険因子と考えられているので、アルツハイマー病と糖尿病の間の強力な病原性のリンクは、近年、多くの報告で明らかにされている[13], [14]。逆に、アルツハイマー病患者は脳内グル経過代謝が低下し、インスリンシグナル伝達が障害されていることが示されている[15], [16]。さらに、末梢代謝障害は、アルツハイマー病神経病理学を発現する動物モデルで観察されている[17], [18]。興味深いことに、糖尿病や肥満のマウスモデルはまた、さらに2型糖尿病とアルツハイマー病 [19]、[20]の間の密接な関係を支持し、より高いタウリン酸化に関連付けられている体温調節障害を表示する。驚くことではないが、インスリン、チアゾリジン系薬剤、メトホルミン、GLP-1アナログ[21], [22]を含む多数の抗糖尿病薬が前臨床試験および臨床試験でアルツハイマー病に対する試験が行われている。
熱調節障害と代謝障害を同時に改善するための有望な戦略の1つは、褐色脂肪組織(褐色脂肪組織)の熱発育の刺激を介したものである。褐色脂肪組織は哺乳類の主要な発熱組織である。褐色脂肪組織は脂肪とグル経過を燃焼して熱を発生させ、血流を介して全身に放散する [23]。そのため、褐色脂肪組織の活性化は2型糖尿病や肥満の治療薬ターゲットとして長い間考えられてきたが[24]、(i)褐色脂肪組織は成人でも機能的であること[25]、(ii)褐色脂肪組織活性は寒冷曝露や薬剤によって調節できること[26]が示されたことから、新たな関心が高まっている。さらに、活性化された褐色脂肪組織は耐糖能とインスリン感受性を改善する顕著な能力を持っている[27], [28]。高齢者は褐色脂肪組織活性の低下を経験するため[29]、褐色脂肪組織刺激の恩恵を最も受ける可能性が高い。
褐色脂肪組織はエネルギー恒常性の調節因子であるだけでなく、線維芽細胞増殖因子21(FGF21)アディポネクチン、インターロイキン6(IL-6)などの代謝調節因子またはアディポカイン(バトカインとも呼ばれる)を分泌する内分泌器官でもある[30]。興味深いことに、FGF21はラットの高脂肪食誘発性認知障害を逆転させ [31]、db/dbマウスの血液脳関門障害を減少させ [32]、ラットの初代脳神経細胞におけるグルタミン酸誘発性興奮障害に対する神経保護剤として作用し [33], [34]、試験管内でのアミロイドβ42毒性から保護することが示されている [35]。
我々の知る限りでは、アルツハイマー病の文脈での褐色脂肪組織熱発育の刺激を調査した研究はない。褐色脂肪組織はアルツハイマー病の発症に複数の経路で関与していることから、我々は褐色脂肪組織刺激による体温調節障害を是正することで、アルツハイマー病のマウスモデルにおいて代謝および神経病理学的エンドポイントに利益をもたらす可能性があると仮説を立てた。繰り返し短期寒冷暴露(RSCE)は、褐色脂肪組織の成長と活性を刺激するための標準化された手順であり、げっ歯類[36]、[37]、[38]およびヒト[39]、[40]、[41]において、エネルギー消費を増加させ、グル経過耐性とインスリン感受性を改善することが示されている。
我々はこのようにして、代謝と体温調節の両方の障害を再現し、脳内のタウとアミロイド病理の発達を伴うアルツハイマー病のマウスモデル(3xTg-ADマウス)にRSCEを適用した[12], [18], [21], [42]。我々の目的は、褐色脂肪組織熱発育を刺激することがアルツハイマー病における潜在的な治療戦略となり得るかどうかを決定することであった。
2. 方法
2.1. 動物と食生活
当グループの動物施設で生産された13ヶ月齢3xTg-アルツハイマー病(APPswe、PS1M146V、tauP301L)マウスを、各群の雄および雌の等しい数で使用した。我々のコロニーで生産されたマウスには、繁殖期から 13ヶ月齢まで同じチャウ(Teklad 2018,Harlan Laboratories、カナダ)を与えた。13ヶ月から 16ヶ月までの間、マウスは、ヒトの「西洋食」をより代表するように、および以前に古い3xTg-ADマウスで観察された代謝欠陥を増強するために、総脂肪の20%(w/w)の食事を与えられた[18]。この食事は、Research Diets Inc. (New Brunswick, NJ)によって製造され、表S1に詳細に記載されている。一貫性を確保し、バッチ間のばらつきを排除するために標準化された精製された食事製剤を使用し、多量栄養素、ビタミン、およびミネラルの測定された濃度を含んでいた。すべての実験は、動物ケアに関するカナダ評議会に準拠して実施し、センターホスピタリエ-デ-l’Université Laval(CHUL)の施設委員会によって承認された。
2.2. 寒冷暴露
15ヶ月から 16ヶ月の間、すべての動物は相互加熱を避けるために、ケージごとに1つずつ収容された。対照群は、研究の期間中、収容温度(22℃)にとどまった(図1A)。急性」群は、体温調節能力を評価するために、犠牲になる直前に、適応せずに、4℃で24時間の曝露を受けた。繰り返し」群は、4℃で4時間(午前10時から午後2時まで)週5日、4週間のRSCEを受けた。このRSCEプロトコルは、寒さに短時間曝露する4時間のセッションの合計18回を要約したものである。その後、「反復」群の動物は、4週目の終わりに4℃で最終的な24時間の暴露を受けた(午前9時から午前9時まで、「急性」群と同じ)(図1A)[36]、[37]、[38]。グループ間のストレス変動を最小化するために、すべての動物を収容室から寒冷室の隣の部屋に移動させた。体温は、一日の同じ時間に低温曝露セッションの前後に直腸プローブと結合した電子温度計を用いて決定した。すべてのマウスは、以前に記載されているように、それぞれの温度(4℃または22℃)で心臓内灌流によって犠牲にした[12]。麻酔は体温に影響することが知られているが[43]、倫理的な理由から心臓内灌流の数分前にケタミン/キシラジンi.p.注射(100mg/kgケタミン、10mg/kgキシラジン)ですべてのマウスを深部麻酔下に置いた。頭蓋間褐色脂肪組織、腓腹筋、および脳を急速に解剖し、処理されるまで-80℃で凍結した。
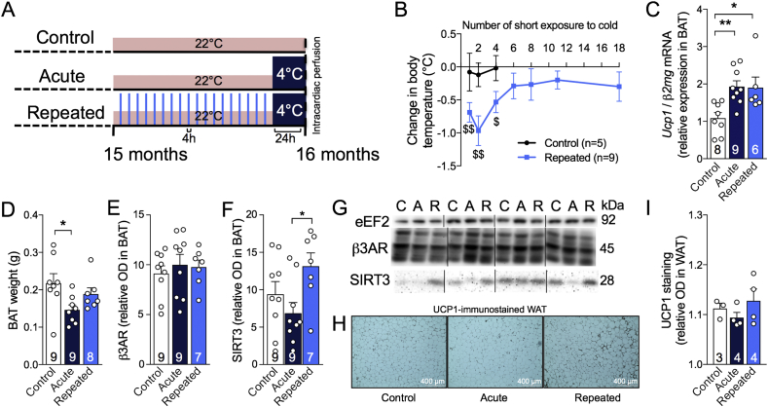
図1 短時間の低温曝露を繰り返すことで、熱発育が促進され、寒さによる体温低下から3xTg-ADマウスを保護することができる
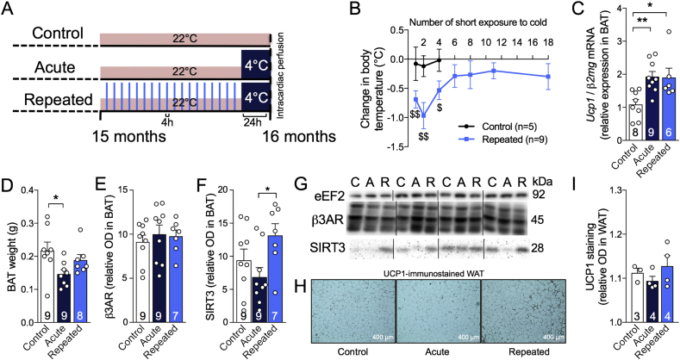
A:RSCEを含む研究のタイムライン。B:生後15〜16ヶ月の間の各短期寒冷曝露(4時間、4℃)の前後に撮影した、曝露マウスおよび非曝露マウスの直腸温の差。マウスの体温を、第1回、第2回、第4回、第6回、第8回、第13回および第18回(最後の)反復短時間寒冷曝露(RSCE)(4時間、4℃)の前後に記録した。C:β2mgに正規化された褐色脂肪組織 Ucp1 mRNA発現(qPCR)。D: 解剖直後の褐色脂肪組織の重量。E:β3ARおよびF:ウエスタンブロットにより褐色脂肪組織中で測定したSIRT3タンパク質のレベル。G:ウエスタンブロットの例。ホモジナートはすべて同じゲル上で実行したが、すべての代表的な写真例について連続したバンドは撮影されなかった。H:WAT切片上のUCP1の免疫組織化学。I: WATにおけるUCP1染色の定量。データは平均±SEM(n/グループはバーで示す)で表されている。統計解析。1標本のt検定対0: #p < 0.05; ##p < 0.01. 一方向ANOVA, Tukeyのポストホック検定. *p < 0.05; **p < 0.01. コントロール(C):22℃;急性(A):24時間、4℃;反復(R):4週間4時間、4℃+24時間、4℃。略語
β2mg:β2マイクログロブリン、β3AR:β3アドレナリン受容体、褐色脂肪組織:褐色脂肪組織、eEF2:真核細胞伸長因子2,Ucp1:アンカップリングタンパク質1,SIRT3:サーチュイン3,WAT:白色脂肪組織。
2.3. グル経過耐性試験
グル経過耐性試験(GTT)は、15回目の短い寒冷曝露セッションの後、または3週間のRSCEの後、短い寒冷曝露のない数日間に実施した(図1A)。”コントロール “群と “急性 “群を “コントロール “群の下にプールしたのは、GTTの時点では、”急性 “マウスはまだ寒冷曝露(24時間、4℃)を受けておらず、”コントロール “群(22℃)と同じ条件であったからである。また、最終的な24時間の急性寒冷曝露後のマウスは、すぐに4℃で生け贄にされたため、試験することができなかった。16ヶ月齢の3xTg-アルツハイマー病非曝露マウスとRSCEマウス(15回目の曝露後)を6時間絶食させ、グル経過(1 g/kg)をi.p.注射し、伏在静脈から採取した血滴を用いて、グルコメーター(OneTouch UltraMini; LifeScan, Milpitas, CA)を用いて2時間にわたって血糖値を測定した。
2.4. タンパク質の抽出
頭頂側頭葉皮質については、タンパク質抽出法により、TBS可溶性の細胞内・細胞外画分(細胞質画分)洗剤可溶性画分(膜画分)洗剤不溶性画分(ギ酸に再懸濁したもの)が得られる。海馬については、凍結サンプルを洗浄剤を含む溶解緩衝液中で直接ホモジナイズし、洗浄剤可溶性画分(細胞質画分および膜画分)を得た。超遠心分離から残ったペレットをギ酸に再懸濁した(洗剤不溶性画分)。褐色脂肪組織および腓腹筋からのタンパク質は、溶解緩衝液のみで抽出した。
2.5. ウエスタンイムノブロッティング
ウェスタンイムノブロット法の詳細な方法は別の場所に記載されている[18]。我々の実験で使用した一次抗体および二次抗体のリストは、補足表4に記載されている。ホモジネートはすべて各実験のために同じゲル上で実行した。タウKOマウスの海馬から抽出されたタンパク質は、他の場所で説明したように、陰性対照としてタウ抗体を用いた免疫ブロッティング実験で追加された[45]。
2.6. アミロイドβ40およびアミロイドβ42の定量
β-アミロイドELISAには、頭頂葉皮質からのタンパク質抽出物を使用した。アミロイドβ40 および アミロイドβ42 は、ヒト β-アミロイド ELISA 法(和光市、大阪府、日本)を用いて、製造者の指示に従い TBS 可溶画分および洗剤不溶画分を測定した [44]。プレートは SynergyTM HT マルチディテクションマイクロプレートリーダー(Biotek, Winooski, VT)を用いて 450 nm で読み取った。
2.7. 定量的リアルタイムPCR
アンカップリングプロテイン1(Ucp1,TaqMan Gene Expression Assays、Mm01244861_m1,Life Technologies)Ffg21(TaqMan Gene Expression Assays、Mm00840165_g1,Life Technologies)およびβ2-ミクログロブリン(β2mg、Mm00437762_m1,Life Technologies)のmRNAの発現量を、前記[11]と同様に逆転写リアルタイム定量PCR(RT-qPCR)を用いて褐色脂肪組織中で測定した。β2mgを対照遺伝子として用いて、群間の相対的な遺伝子発現の差を評価するために、デルタデルタCt(ddCT)法を用いた。結果は、対照群に対する Ucp1/β2mg または Fgf21/β2mg cDNA の相対的な比率として示されている。
2.8. FGF21アッセイ
FGF21 のレベルは、非絶食マウスの心臓内灌流前に採取した血漿および 褐色脂肪組織 タンパク質抽出物中の FGF21 Quantikine ELISA キット(MF2100,R&D システムズ、ミネアポリス、MN)を用いて測定した。
2.9. トリグリセリド測定
トリグリセリドのレベルは、Thermo Scientific Triglycerides Reagent assay(TR22421,Thermo Fisher Scientific、Waltham、MA、米国)を使用して、非絶食マウスの心臓内灌流前に採取した血漿中のトリグリセリドのレベルを測定した。
2.10. 組織学とUCP1免疫染色
内臓脂肪(子宮周囲および精巣上体脂肪)と皮下脂肪(鼠径部脂肪)を採取し、重量を測定した。精巣上体脂肪は、4%パラホルムアルデヒド(pH7.4)中で48時間後に固定した。サンプルは、パラフィンに埋め込むまでPBSで転送した。サンプルは、10μm厚のスライスで切断し、マウントした。脂肪細胞の定量化のために、スライスは、他の場所で説明したようにヘマトキシリンとエオジン(H&E)で染色した[21]。脂肪細胞の面積と数は、ImageJソフトウェア(バージョン1.50i、NIH(アメリカ国立衛生研究所)、ベセスダ、マサチューセッツ州、米国)を使用して定量化した。UCP1免疫染色のために、スライスは最初に脱パラフィン化され、30分間沸騰10mMクエン酸ナトリウム緩衝液(pH 6.0)と30分間メタノール中の3%過酸化水素と内因性ペルオキシダーゼの阻害と抗原の検索に続いていた。マウントされたスライスは、その後、30分間PBS-T溶液中の5%馬血清でブロッキングする前に,0.4%トリトンX-100(PBS-T)と10分間1%馬血清でPBS中で2回洗浄した。スライスは、1%の馬血清PBS-T溶液中のウサギUCP1抗体(1:200,Ab10983,Abcam、ケンブリッジ、イギリス)と湿度の高いチャンバーで4℃で一晩インキュベートした。切片は、その後、ヤギ抗ウサギビオチン化抗体(1:200,ジャクソンイムノリサーチ、PA、米国)と1時間のインキュベーション期間の前に10分間PBS-Tで2回洗浄した。マウントした切片をPBS-Tで2回洗浄し、アビジン/ワサビペルオキシダーゼ複合体(ABC Elite Kit; Vector Laboratories, Burlington, ON, Canada)を製造業者のガイドラインに従って35分間添加した。2回の洗浄後,0.3 mg/mL 3-アミノ-9-エチルカルバゾール(AEC) (Sigma-Aldrich, St Louis, MO, USA)と0.03%過酸化水素をアセテートバッファー中に添加して検出した。反応は、PBSでの広範な洗浄によって停止し、切片をMowiol培地でカバースリップさせた。画像は、EVOS® FLオートセルイメージングシステム(サーモフィッシャーサイエンティフィック、ウォルサム、マサチューセッツ州、米国)で撮影した。光学密度は、ImageJソフトウェア(NIH(アメリカ国立衛生研究所)、バージョン1.50i)を使用して定量化した。
2.11. コルチコステロン ELISA 法
コルチコステロン濃度は、製造者の指示(Ab108821, Abcam, Cambridge, United Kingdom)に従って、絶食していないマウスの伏在静脈から採取した血漿中のコルチコステロン濃度を測定した。
2.12. 統計解析
データは、データが平均±標準偏差(SD)として示されている表S2およびS3を除き、平均±標準誤差(SEM)として表されている。統計解析およびグループあたりのマウス数は、各図に明記されている。グループ間の分散の不等式を除外するために、バートレットの検定を使用した。つ以上のグループを比較する場合は、一方向(1つの独立変数)または双方向(2つの独立変数)ANOVAを使用した。ANOVAは、分散が等しい場合には、Tukeyのポストホック分析に続いて行われた。不均等分散の場合には、Kruskal Wallisに続いてDunnのポストホック検定が実施された。ボンフェローニの事後検定に続く反復測定の双方向ANOVAを、同じ動物での再発測定を比較するために実行した。2つのグループのみを比較した場合は、非対をとったStudentのt-検定を実施した。平均を理論値と比較するために、1標本のt-検定を使用した。変数間の相関は、線形回帰分析を用いて調査した。すべての統計解析は、Prism 5 (GraphPad ソフトウェア、サンディエゴ、カリフォルニア州、米国) または JMP (バージョン 12.1.0; SAS Institute Inc.、カリー、イリノイ州、米国) ソフトウェアを用いて実施し、統計的有意性は p < 0.05 とした。
3. 結果
3.1. 短時間の寒冷曝露を繰り返すと褐色脂肪組織の発熱能力が増強され、高齢の3xTg-ADマウスを寒冷による体温低下から保護する。
RSCEは褐色脂肪組織の成長と熱発育活性を刺激するための標準的な手順である[36], [37], [38]。1回目と13回目のRSCEの前後に採取した血漿中のコルチコステロン濃度を測定し、寒冷曝露マウスと非曝露マウスの間でストレスが同等であることを確認した(図S1)。まず、RSCE群のマウスは、6回目以降の寒冷曝露前後の体温変化が有意ではないことから、寒冷曝露による体温低下に抵抗性を示すことを確認した(生データは図1B、図S2)。褐色脂肪組織におけるUcp1 mRNA発現は、単一の急性エピソード(4℃で24時間)の後、またはRSCEセッションの終了時に、低温曝露によって増加したことを確認した(図1C)が、β3アドレナリン受容体(β3AR)はRSCEによって影響を受けなかった(図1E,G)。褐色脂肪組織重量は急性寒冷曝露によって減少したが、これはおそらく熱を産生するために脂質が消費された後の褐色脂肪球の収縮によるものであろう(図1D)。また、空腹時または低温曝露後の褐色脂肪組織のミトコンドリアに発現するタンパク質であるSIRT3の増加を、低温曝露を繰り返したマウスの褐色脂肪組織で発見した(図1F,G)[46], [47], [48]。RSCE は 褐色脂肪組織 刺激だけでなく全身の熱発 生を改善する可能性があるため、サルコリピン蛋白質(表 S2)を用いて筋肉の非戦 争活性を評価した(表 S2)[49]。しかし、熱発育に関与する筋タンパク質の有意な増加は観察されなかった。最後に、低温曝露を繰り返したマウスの白色脂肪組織(WAT)では、UCP1 染色の光学濃度の定量化はコントロールマウスと統計的には差がなかったが(図 1I)”褐変 “の表現型の傾向が観察された(図 1H)。
3.2. 繰り返しの短い低温暴露は16ヶ月齢の3xTg-ADマウスの耐糖能を改善する
褐色脂肪組織熱産生活性の亢進は、げっ歯類における耐糖能を含む代謝転帰の改善につながる[38]。我々は、3xTg-ADマウスを西洋食にした場合、加齢に伴って代謝異常を示すという事実を利用した[18]。すべての動物は、西洋式食餌の導入後に体重が増加し(約15%)RSCEは最終的な身体または白色脂肪組織の重量を有意に変化させなかった(図2A,B,F)。白色脂肪細胞の数および面積は、RSCEによって有意に変化しなかった(図2G-I)。しかしながら、RSCEマウスは、空腹時インスリンの修飾なしに、非曝露の3xTg-ADマウス(図2C,D)と比較して、注射30分後の血糖値の大きな減少および曲線下面積の小さい値を示したので、RSCEは耐糖能を改善した(図2E)。最後に、循環トリグリセリドレベルは、RSCEと急性低温曝露(4℃、24時間)の両方によって半減した(図2J)。
図2 繰り返しの短い低温暴露は、16ヶ月齢の3xTg-ADマウスの耐糖能を改善し、白色脂肪デポに影響を与えずに血漿トリグリセリドを減少させる
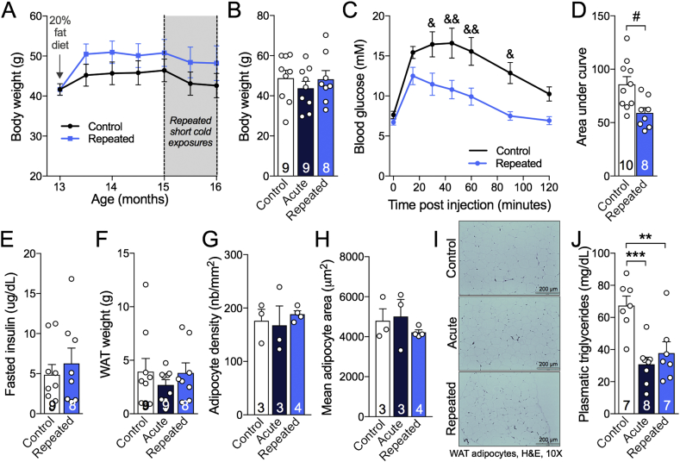
A:食事療法と一連の繰り返しの短い低温曝露中の体重。B:実験終了時の体重。C,D:第15回短い低温暴露セッションの後に実行されるグル経過耐性試験。E:6時間絶食後(GTT前)に採取した血漿中で測定したインスリンのレベル。F:16ヶ月齢3xTg-ADマウスの内臓(精巣上体脂肪および肛門周囲脂肪)および皮下(鼠径部)脂肪組織を、解剖直後に体重を測定した。G,H:精巣上体脂肪における脂肪細胞の数と平均表面。I: 白色脂肪細胞の写真(H&E染色パラフィン切片)。J:非絶食マウスの犠牲時にサンプリングした血漿中のトリグリセリドのレベルを測定した。データは、平均±SEM(n/グループはバーで示されている)として表される。統計解析。反復測定二元配置ANOVA、ボンフェローニのポストホック検定: &p < 0.05; &&p < 0.01. Unpaired Student t-検定。#p < 0.05. 一方向ANOVA, Tukeyのポストホック検定. **p < 0.01; ***p < 0.001. コントロール:22 °C; 急性。24時間、4℃;反復。4時間、4週間+24時間、4℃。注:GTTと計量の時点では、”Acute “マウスはまだ寒さへの急性曝露(24時間、4℃)を受けておらず、”Control “グループ(22℃)と同じ条件であったため、”Control “グループと “Acute “グループは、AとCの “Control “グループの下にプールされた。
3.3. 短時間の寒冷曝露を繰り返すことで、高齢の3xTg-ADマウスは寒冷誘導タウリン酸化から保護される。
タウリン酸化は、アルツハイマー病 の主要な神経病理学的特徴の一つであり、死後の認知障害と強く相関している [1], [2]。寒冷化誘導タウリン酸化は、非トランスジェニックマウスおよびADマウスモデルで繰り返し観察されている [8], [9], [10], [11], [12]。本研究では、まず、3xTg-アルツハイマー病 マウス(pSer394/404. +87%; pSer202. +211%; pSer202/Thr205. +183%; pThr181. +対非曝露マウス:+49%)(図3A〜G)。予想通り、タウリン酸化は、犠牲時に記録された体温と強く相関していた(図3H-J)。興味深いことに、RSCEマウスのタウリン酸化レベルは非曝露マウスと同程度であったため、RSCEは海馬の寒さによるタウの高リン酸化を完全に防ぐことができた(図3A-G)。これらの結果から、RSCEを用いた褐色脂肪組織訓練を受けた3xTg-ADマウスは、24時間の寒冷下で体温を維持するのに十分な発熱能力を有しており、非暴露マウスと同様のタウリン酸化レベルを維持していたことが示唆された。しかし、海馬の不溶性タウのレベルは、3xTg-ADマウスの暴露と非暴露の間で変化しなかった(図3K-O)。
図3 短時間の低温曝露を繰り返すことで、3xTg-ADマウスは寒さによる可溶性タウのリン酸化に対して保護される

A-G: 16ヵ月齢3xTg-ADマウスの海馬可溶性タウリン酸化。H-J: 海馬可溶性タウリン酸化と犠牲時体温との相関。K-O:海馬不溶性タウリン酸化。すべてのホモジネートを同じゲル上で実行したが、すべての代表的な写真の例について連続したバンドを撮影していない。データは、平均±SEM(n/グループはバーで示されている)として表される。統計分析。一方向ANOVA、Tukeyのポストホック検定。*p < 0.05; **p < 0.01. ピアソン r 相関。#p < 0.05; ##p < 0.01. コントロール(C):22℃;急性(A):24時間、4℃;反復(R):4時間、4℃を4週間+24時間、4℃。
次に、海馬におけるタウのリン酸化に関与するキナーゼおよびホスファターゼに対するRSCEの影響を調べた(図4A-I)。我々は、ホスホ-GSK3β(Ser9)が急性低温曝露(4℃、24時間)後に増加したが、RSCE後はコントロールレベルと同等のレベルにとどまり、タウのリン酸化と同じパターンをたどっていることを発見した(図4A)。対照的に、ホスホ-GSK3β(Tyr216)のレベルは、すべてのグループで同様のままであった(図4B)。phospho-JNKおよびphospho-AKTのレベルもまた、急性寒冷曝露後に増加したが、RSCEによる有意な影響はなかった(図4C,D)。p25/p35,pCAMKII、pMAPK、およびPP2Acについては有意な変化は認められなかった(図4A-H)。
図4 低温曝露を繰り返すと、タウリン酸化に関与するキナーゼのレベルが変化する

A-I: 16ヶ月齢3xTg-ADマウスの海馬でウエスタンブロットで測定したキナーゼおよびホスファターゼのレベル。すべてのホモジネートを同じゲル上で実行したが、すべての代表的な写真例について連続したバンドを撮影しなかった。データは、平均±SEM(n/群はバーで示す)として表される。統計分析。一方向ANOVA、Tukeyのポストホック検定。*p < 0.05; **p < 0.01. コントロール(C):22℃;急性(A):24時間、4℃;反復(R):4時間、4℃で4週間+24時間、4℃。
略語
AKT:プロテインキナーゼB、CAMKII:カルモジュリン依存性プロテインキナーゼII、GSK3β:グリコーゲン合成酵素キナーゼ3β、JNK:c-Jun N末端キナーゼ、MAPK(ERK1/2):マイトジェン活性化プロテインキナーゼ、p25/35:プロテインキナーゼ25/35,PP2Ac:プロテインホスファターゼ2A、触媒サブユニット。
3xTg-ADマウスではアミロイド病理が徐々に蓄積していく [42]。ここでは、RSCEと急性寒冷曝露(4℃、24時間)は、マウスの頭頂側頭葉皮質で測定されたアミロイドβ40またはアミロイドβ42の可溶性または不溶性のいずれの形態にも影響を与えなかった(図S3)。
3.4. 短時間の低温暴露の繰り返しは血漿中のFGF21の蓄積につながる
近年、褐色脂肪組織はバトカインの分泌を介して脳を含む他の組織とコミュニケーションをとる分泌器官として発表されている[30]。最近の研究では、このホルモンが神経保護作用を持つことが示されているため、ここではFGF21に注目した [31], [33], [35]。RSCE後の血漿中FGF21レベルは対照と比較して66%増加した(図5A)。驚くべきことに、血漿中のFGF21濃度は、3xTg-ADマウスの海馬における可溶性タウpSer231濃度と負の相関を示した(図5B)。さらに、FGF21の血漿レベルは、犠牲になる直前に記録された体温と相関していた(図5C)。褐色脂肪組織はFGF21を分泌することができるので、我々は、古い3xTg-ADマウスの褐色脂肪組織中のFGF21の発現を測定し、24時間の寒冷チャレンジのみを受けたマウスは、より高いFGF21発現に向かう非統計的に有意な傾向を示したことを発見した(図5D)。
図5 短時間の低温暴露を繰り返すと、褐色脂肪組織によるFGF21産生が増加する

A: 非絶食マウスの心腔内灌流直前に採取した血漿中のFGF21レベルをELISA法で測定。B,C: 血漿FGF21と海馬のタウリン酸化Ser231位と体温との相関。D: qPCRによって測定した褐色脂肪組織におけるβ2mg遺伝子発現上のFgf21の比率。E:主要な結果のスキーマ。データは平均値±SEM(n/グループはバーで示す)で表した。統計解析。一方向ANOVA、Tukeyの事後検定。*p < 0.05. ピアソン r 相関。#p < 0.05. コントロール: 22 °C; 急性。24時間、4℃;反復;4時間、4℃を4週間+24時間、4℃。
4. 議論
体温調節障害がアルツハイマー病の発症に寄与することを示唆する以前の研究 [11], [12] に基づいて、我々は、褐色脂肪組織の熱新生を刺激することで代謝および体温調節障害、ならびにアルツハイマー病の動物モデルにおけるアルツハイマー病様神経病理を打ち消すことができるかどうかを決定しようとした。我々は、褐色脂肪組織に特異的ではないが代謝研究の分野で日常的に使用されているRSCE(RSCE)という非薬理学的な熱形成刺激手段を選択した[36], [37], [38]。まず、私たちは、3xTg-ADマウスを用いて、RSCEが褐色脂肪組織の発熱能を増加させ、耐糖能を向上させるのに有効であることを発見した。特に、RSCEを用いて訓練した3xTg-ADマウスは、アルツハイマー病患者の症状の重要な相関関係である寒冷化によるタウの高リン酸化から完全に保護された。最後に、RSCEは代謝改善と神経保護の両方に関与するバトカインである血漿FGF21レベルを増加させた[30], [31]。
4.1. 老齢マウスにおけるRSCE後の熱発育能力の増加
本データは、RSCEが褐色脂肪組織 Ucp1発現の増加とマウスの寒冷誘導体温低下に対する抵抗力によって示されるように、褐色脂肪組織の発熱能を増加させたことを示している。また、WATは「褐変」表現型を採用することにより、肩甲骨間褐色脂肪組織に比べて低い程度ではあるが、熱発育に寄与することができる[36]。ここでは、繰り返し曝露したマウスのWATにおけるUCP1染色の増加傾向を通して、このような表現型を観察した。RSCEは褐色脂肪組織だけでなく全身の熱発育や寒冷順化を刺激するため、筋の熱発育のマーカーも測定したが、寒冷に繰り返し曝露したマウスでは対照マウスと比較して変化は見られなかった。ヒトにおけるRSCEや寒冷順化は、エネルギー消費と褐色脂肪組織の発熱活性を増加させることが示されている[39], [40], [41]。しかし、高齢者を対象とした研究は不足しており、その集団では寒冷曝露に関連したリスクがあるためであろう。また、高齢者マウスでは体温調節機能が低下しており、褐色脂肪組織の発現が低下しており、高齢者マウスは若年者マウスに比べて寒冷曝露によって誘導されるタウの高リン酸化に対して脆弱である[11], [25]。しかし、我々のデータは、RSCEが高齢マウスでも褐色脂肪組織刺激の効果を調べるための適切な研究ツールであることを確認している。
ここで注意すべきは、我々の施設では22℃で飼育されており、これはマウスの体温28℃と推定されるマウスの体温よりも低い温度である[62]。先行研究では、3xTg-アルツハイマー病の老齢マウスにおいて、1週間後に体温中性化が行動やアルツハイマー病の病態を改善することが示されている[12]。また、マウスを熱中性温度で収容すると、熱発育や交感神経緊張が停止する一方で、脂肪率が上昇することが知られている[50]。したがって、今回の結果は軽度の熱発育を経験しているマウスの文脈で有効であり、他の環境温度では異なる可能性がある。
4.2. RSCEによる末梢代謝障害の改善
熱発育能力を高めることは、異なるメカニズムを介してアルツハイマー病を改善する可能性がある。第一に、より高い熱発育能で得られるグル経過および脂質代謝、ならびにインスリン感受性の改善は、アルツハイマー病において治療的である可能性がある。2型糖尿病や肥満は、現在では代謝性疾患として認知されつつあるアルツハイマー病発症の危険因子として広く挙げられているが、これは脳のグル経過代謝やインスリンシグナル伝達に障害があるためです[14], [15], [16]。末梢代謝障害はまた、実験的糖尿病の誘導[21]、[51]の後に悪化するアルツハイマー病神経病理学のマウスモデルで再現されている。RSCEを3週間にわたって延長した(4時間の低温曝露を15回)ことで、16ヶ月齢の3xTg-ADマウスの耐糖能を改善するのに十分であった。このような結果は、低温順応がげっ歯類やヒトでグル経過代謝を改善することを示したいくつかの研究と一致している[38], [41]。ここで、3xTg-ADマウスの耐糖能異常は、欧米化された食事との組み合わせで中枢神経系にトランスジェニック遺伝子が発現したことで生じるアルツハイマー病神経病理に起因している可能性が高いことが示唆された [18], [21]。このことは、代謝性疾患の分野で長い歴史を持つ褐色脂肪組織刺激が、中枢性アルツハイマー病神経病理に起因する末梢性代謝エンドポイントを修正できる可能性を示唆している[24]。
4.3. RSCEは寒冷化誘導タウのリン酸化を抑制した
第二の重要なメカニズムとして、褐色脂肪組織刺激は、体温がタウの高リン酸化を誘発することが知られている低体温閾値以下に下がるのを防ぐことで、中心的な治療効果を発揮する可能性がある [11], [12]。げっ歯類を用いたいくつかの研究では、外部寒冷曝露、麻酔、冬眠、またはグル経過欠乏などのさまざまな手段によって誘導される体温の低下に続いて、タウリン酸化が増加することが示されている[8], [9], [10], [11], [12], [52]。ここでは、4℃に24時間曝露する前にRSCEトレーニングを行うと、3xTg-ADマウスの寒冷誘導タウリン酸化が完全に抑制された。このことは、熱発育能力の向上が、この神経病理学的障害に対する完全な保護を与えることを示している。我々の知る限りでは、寒冷誘導タウリン酸化の生体内試験での上昇を抑制する介入が海馬で示されたのはこれが初めてであり、体温調節とタウリン酸化の間に重要な関連性があることを示している。
すべての研究がヒトにおけるタウと認知の間の相関を発見したわけではないが、死後のタウ病理が死後の記憶障害と相関しているという強い証拠があり、この関連は通常、アミロイドβ [1], [2], [53], [54], [55], [56]よりも強くなっている。ここで評価されたタウタンパク質のphospho-epitopes、具体的にはpSer396/404とpThr231は、それらが臨床診断やエピソード性記憶を含む死亡前の認知障害と相関するため、アルツハイマー病の観点から重要である[1], [2]。実際、我々は以前に、臨床的に特徴づけられたボランティアの Religious Order 研究の同じシリーズで、頭頂皮質からの抽出物を使用して、グローバル認知スコア(エピソード記憶を含む)とpThr231/Server235とpSer396/404リン酸化タウの両方との間の負の相関を観察した[2]。これらの関連は、総タウを調整した後でも有意なままであり、アルツハイマー病認知障害におけるこれらの部位での可溶性タウリン酸化の重要性を強調している[2]。さらに、Ser396/404エピトープはまた、神経原線維性タングルの広がりやBraak診断と強く相関している[1]。In vitroでの証拠は、これらのホスホエピトープがタウの病理学的凝集にも関与していることを示している[57]。したがって、これらの特定部位での高リン酸化を防ぐことで、タウタンパク質の凝集とそれに伴う認知障害を防ぐことができるのではないかと推測される。
麻酔のような様々な手段による体温の急性低下は、タウリン酸化の持続的な劇症的上昇を誘発すると仮定されている [8], [10]。低体温を含む一日中の体温の頻繁で顕著な変動は、高齢者、特にアルツハイマー病患者で観察されている [5], [6]。我々は以前に、マウスの寒冷誘導タウリン酸化が加齢によって増強されることを示した [11]。したがって、タウリン酸化は日中に体温とともに変動し、高齢者では長期的にタウの高リン酸化と凝集を引き起こす可能性があると考えるのが妥当である。ここでは、4週間の期間にわたってRSCEは、体温が最初の暴露(-0.5〜-1℃)の間に減少した場合でも、不溶性タウリン酸化を増加させませんでした。このことは、寒さへの短い暴露がタウ凝集を誘導しないことを示し、熱発育の刺激が体温の一過性の低下の悪影響を打ち消す可能性があることを示している。
タウのリン酸化は様々なキナーゼやホスファターゼの活性によって制御されている。我々は、RSCE暴露マウスの海馬においてPP2Aレベルの変化を認めなかったが、PP2A活性は低温によって直接的に阻害されることが示されている[9]。一方、GSK3βのpSer9はタウのリン酸化と非常によく似たパターンをたどっており、RSCEによる保護に関与している可能性が示唆された。このような見解は、このリン酸化部位が低体温に敏感であるという事実と一致している[58]。
4.4. RSCE による FGF21 産生の増加
我々のデータは、FGF21が褐色脂肪組織熱発育活性の増加とアルツハイマー病における潜在的な利益をリンクする第三の潜在的な治療標的であり得ることを示唆している。FGF21がアルツハイマー病に関心があるという考えは、このバトカインが肥満誘発性記憶障害およびアミロイドβ42毒性から保護することを示唆する以前の研究と一致している[31], [35]。RSCEマウスが寒冷誘導タウリン酸化から完全に保護されたという事実は、確かに寒冷チャレンジ中に体温を維持する老齢マウスの能力の増加と関連しているが、褐色脂肪組織と脳との直接的なクロストークが少なくとも部分的に関与している可能性がある。FGF21の血漿中濃度は、3xTg-ADマウスの海馬におけるタウリン酸化と逆相関しており、このような関連性を支持するものではあるが、因果関係を証明するものではない。したがって、組換えFGF21の直接投与やFGF21受容体を標的とした薬剤の投与など、ADモデルにおけるFGF21の効果についてのさらなる検討が望まれる。
今回の研究では、褐色脂肪組織トレーニングが認知能力の向上につながるかどうかは確認されていない。ここで使用したRSCEパラダイムは、低温曝露直後や低温曝露中にマウスをテストすることができないため、行動テストとは適合しない。実際、運動量や探索行動は寒冷環境によって影響を受ける [59], [60]。したがって、マウスはほとんどの行動パラダイムで期待通りの行動をすることができず、克服できないバイアスがかかってしまう。しかし、代謝障害に対するRSCEの有益な効果が以前に報告されていることを考えると、我々は短い寒さにさらされていない数日間の間に耐糖能試験を行うことを選択した。それにもかかわらず、RSCE後の本研究で観察された効果は、以前に認知を促進する特性と関連していた。実際、循環FGF21の増加 [31] およびグル経過恒常性の改善 [61] は、糖尿病性げっ歯類における認知パフォーマンスの改善と関連している。
4.5. 結論
以上の結果から、RSCEによる褐色脂肪組織熱発育刺激が高齢マウスにおいて効率的であり、グル経過代謝の改善と寒冷化によるタウの高リン酸化からの保護をもたらすことが初めて示された。このように、代謝性疾患に対して開発された褐色脂肪組織熱発育を刺激することを目的とした治療法は、認知症の治療に再利用できる可能性がある。