Contents
Potential Effects of Melatonin and Micronutrients on Mitochondrial Dysfunction during a Cytokine Storm Typical of Oxidative/Inflammatory Diseases
pubmed.ncbi.nlm.nih.gov/33919780/
公開日:2021年4月14日
要旨
酸化ストレスと炎症の亢進は、酸化/炎症性疾患の本質的な特徴である。酸化ストレスと炎症の亢進は,同時にミトコンドリア機能障害の原因でもあり,これら3つの要因が悪循環に陥っている。しかし、メラトニンや微量栄養素を含むいくつかの天然物質は、ミトコンドリアの損傷を防止または軽減し、一般的な酸化的・炎症的状態を管理することで、最適な健康状態を維持することができる。
この総説では、複数の疾患の発症と進行におけるミトコンドリアの重要な役割と、ミトコンドリア機能不全、酸化ストレス、サイトカインストームの密接な関係を説明することを目的としている。同様に、メラトニンといくつかの微量栄養素(ビタミンとミネラル)の強力な効果に関する主な知見をまとめている。これらの栄養素は、敗血症を含む酸化的/炎症的な病態のほか、心血管障害、腎障害、神経変性障害、代謝障害などの治療薬として(単独または組み合わせて)有用であると考えられる。
キーワード
ミトコンドリア機能障害、サイトカインストーム、メラトニン、微量栄養素、ビタミン、ミネラル、酸化炎症性疾患、COVID-19
1. はじめに
ミトコンドリア機能障害は、免疫・炎症反応の低下と関連している。ミトコンドリア機能障害によって引き起こされる炎症は、炎症性サイトカインの爆発的な放出の原因となることが示唆されており[1]、敗血症、神経変性疾患、炎症性腸疾患、心血管・代謝性疾患、COVID-19による合併症や死亡を含む呼吸器疾患など、複数の酸化・炎症性疾患の原因となっていることが現在の最も関連性の高い例として挙げられている。これらの病態で通常観察される全身性の炎症亢進は、サイトカイン・ストームまたはマクロファージ活性化症候群として知られている[2]。
注目すべきは、健康的な生活習慣、薬理学的な薬剤、栄養補助食品などによってミトコンドリアの健康を維持することで、ミトコンドリアの動態や活性が著しく改善され、炎症や酸化ストレスが軽減されることである[1]。
この点、メラトニンや微量栄養素は、人間を含む生物が最適な健康状態を維持するための複数の代謝・生理機能を果たすために必要な必須元素であることが知られている[3,4]。興味深いことに,メラトニンや微量栄養素の多くは,その作用のいくつかをミトコンドリアレベルで発揮している[5]。
この総説では、ビタミンB9(葉酸)C、D、E、亜鉛、セレン、マグネシウム、マンガン、銅、そして特にメラトニンの作用に焦点を当て、いくつかの酸化性/炎症性疾患に見られるミトコンドリア機能障害、酸化ストレス、サイトカインストームに対する微量栄養素の影響について考察する。
2. サイトカイン・ストームの意味、病因、特徴、およびその結果
サイトカイン・ストームとは、炎症性サイトカインが無制限かつ無秩序に産生される、深刻で有害な免疫反応のことである。この言葉は、COVID-19をきっかけに一般的に知られるようになった。しかし、医学的には新しい概念ではない[6]。このプロセスは、関節リウマチなどの自己免疫疾患[7]、エルシニア・ペスティスなどの細菌による感染[8]、その他の種類のウイルスによる感染[9,10]、その他の酸化的/炎症的疾患などのために、他の状況でも発生する。
サイトカインは、さまざまな細胞から放出される低分子量のタンパク質で、異なる細胞間のメッセンジャーとして働き、自己作用、パラ位作用、内分泌作用を持つ。サイトカインはさまざまな細胞で合成されるが、マクロファージとTヘルパー(Th)リンパ球が主な供給源である。サイトカインの合成は、通常、他のサイトカインを産生する標的細胞を刺激するカスケード作用に関与している[11]。これらのサイトカインは、感染症に応じて効果的な免疫反応を調整し、炎症プロセスを制御する役割を担っている。サイトカインは、自然免疫反応および獲得免疫反応において重要な役割を果たしており[12]、マクロファージやリンパ球にシグナルを伝達し、炎症部位を狙い撃ちする。特に、インターロイキン(IL)のIL-1α、IL-1β、IL-6,腫瘍壊死因子(TNF-α)単球走化性タンパク質(MCP-1)などのサイトカインは、正常な宿主の防御に大きく貢献している。生理的条件下では、これらが作用を発揮して病原体が排除されると、免疫系は正常に戻る。しかし、敗血症などの一部の状況では、免疫系は制御不能に陥る。さらに、血流中に放出されたサイトカインは、増加する免疫系の細胞を活性化することで、遠位の臓器に損傷を誘発する[13]。
サイトカイン・ストームは、大量の白血球(マクロファージ、好中球、マスト細胞)が活性化され、炎症性サイトカインを大量に放出することで始まる。このプロセスのメカニズムは、炎症性サイトカインであるIL-1の自己誘導が関与している現象に依存している。このサイトカインは、自身の遺伝子の発現を誘導するとともに、TNF-αやIL-6などの他の炎症性サイトカインの産生を誘導することができる。さらに、IL-1は、炎症細胞の組織への移動を仲介する化学吸引性分子の遺伝子発現を誘導する。一方、IL-6は、多くの細胞(マクロファージ、Tリンパ球、Bリンパ球、内皮細胞など)で産生され、T細胞の活性化と分化を開始し、Bリンパ球の免疫グロブリン産生細胞としての分化を促進する[14]。これらの過程を経て、IL-6は、免疫系細胞上の膜受容体(mIL-6R)および可溶性受容体(sIL-6R)と結合し、急性期反応を制御する役割を果たすことから、急性炎症における重要なプレーヤーとなっている[15]。両者の相互作用は、自身の発現を刺激するだけでなく、様々な走化性分子の大量分泌にもつながる[16,17]。この現象は、より多くの免疫細胞を感染部位に呼び寄せる増幅サイクルを生み出し、サイトカインストームの特徴であるサイトカインの無秩序な産生にも寄与する。
TNF-αについては、A型インフルエンザウイルスに感染したマウスを用いた前臨床試験において、抗TNF-α抗体を用いてこの因子をブロックすると、炎症細胞(マクロファージや好中球)の肺への動員が減少することが示されている。また、TNF-αの遮断は、T細胞による炎症性サイトカインの産生を低下させ、活性化B細胞のκ光鎖の核転写因子(NF-κB)のシグナル伝達経路のカスケードに関与するタンパク質の発現を低下させるとともに、ウイルスの排出を妨げることなく、疾患の重症化を抑制した。さらに、TNF-αをブロックすることで、宿主によるウイルス複製の制御がより強化された[18,19]。NFκBは、炎症性遺伝子の発現を誘導することができるため、サイトカインストームの開始にも重要な役割を果たしている。この核因子は、炎症性サイトカイン(IL-1β、TNF-α)細胞内のプロオキシダント状態、ウイルスや細菌の抗原に関連する刺激など、さまざまなメカニズムによって活性化される[20,21,22]。
重症急性呼吸器症候群-新型コロナウイルス(SARS-CoV-2)を病原体とするCOVID-19感染症では、サイトカインストームが、最も重篤な感染症に特徴的な急性呼吸器症候群(ARDS)を引き起こす主要な病態プロセスである可能性がある[23,24]。COVID-19に関連するサイトカイン・ストームの病態生理学的メカニズムは完全には解明されていない。しかし、正のフィードバック作用を持つ制御されていない全般的な炎症反応が提案されている[25]。
ウイルス感染時には、免疫系の関与を強調することが重要だ。自然免疫系の細胞は,Toll様受容体(TLR)などのパターン認識受容体を発現している。これらの受容体は,異物そのものの脂質,タンパク質,核酸など,病原体関連分子パターン(PAMPs)に相当する固有の分子を認識する[26,27,28]。SARS-CoV-2や他のコロナウイルスに関しては、PAMPsはそのRNAと関連しており、いくつかのTLRによって認識される[28,29]。その結果,様々なシグナル伝達経路やNFκBなどの転写因子が活性化される。この過程で,NFκBは核に移動し,多数の炎症性サイトカインの転写を活性化する。COVID-19患者では、血清IL-6レベルの上昇は、最も重篤なケースでは呼吸不全やARDSと相関している[30,31]。IL-6は、この種のコロナウイルスの重症感染症の血清バイオマーカーとして使用される急性期タンパク質であるC反応性タンパク質(CRP)の発現を刺激する。
同様に、抗体産生とTリンパ球を介した体液性免疫反応は、ウイルス感染時に非常に重要な役割を果たしている[28,32]。SARS-CoV-2感染に対する体液性免疫反応に関するデータによると、細胞障害性(CD8+)細胞とヘルパー(CD4+)細胞の両方を含むTリンパ球の特異的な反応が見られ、感染がより初期の段階では免疫グロブリンM(IgM)が産生され、後期の段階では免疫グロブリンG(IgG)が産生される。
このような反応は、免疫細胞の活性化とウイルスによる標的細胞への直接的な細胞傷害作用の両方に由来し、深刻な臓器障害をもたらす。結果的に、感染を制御しようとする免疫反応によって引き起こされる付随的な損害は、病原体そのものよりも危険な場合がある。
3. サイトカインストームとミトコンドリア機能不全の相互関係
3.1. ミトコンドリアの 機能、ダイナミクス、および機能不全
ミトコンドリアは、細胞の恒常性維持に必要な多くの機能を担う細胞小器官である。ミトコンドリアは、酸化的リン酸化によってアデノシン三リン酸(ATP)を合成し、エネルギー代謝に重要な役割を果たしている。グルコースや脂肪酸の代謝物は、トリカルボン酸(TCA)サイクルに入り、ATPを生成する[33]。また,ミトコンドリアは,細胞のカルシウム恒常性やアポトーシスの制御にも関与しており,活性酸素種(ROS)の重要な供給源でもある。ミトコンドリアのATP生成は、輸送鎖(ETC)に沿った電子の移動に依存しており、ETCはミトコンドリア内膜を横切るプロトン輸送と結合して、ATP合成を駆動することができる電気化学的勾配を確立している。ミトコンドリアは、生理的・病理的な刺激に応じて形態を変化させ、その機能にも影響を及ぼすダイナミックなオルガネラである。ミトコンドリアの動態は,ミトコンドリアの生合成,融合,分裂,マイトファジーといったいくつかのプロセスからなる[34]。心血管疾患,代謝性疾患,炎症性疾患などの多くの病的状況は,ミトコンドリアの機能障害と関連している。ミトコンドリアの生理機能の異常は、エネルギーおよび/またはダイナミクスの変化の結果であると考えられる。ミトコンドリアETCの障害は、ATP生産量の減少だけでなく、ミトコンドリアの形態の変化にもつながる[35]。さらに、ミトコンドリアダイナミクスの不均衡は、ミトコンドリアのエネルギー産生の効率を低下させる[33,36]。最後に、ミトコンドリアの機能不全は、細胞内の活性酸素の主な発生源と考えられており、炎症を含む多くの病態の発生と進行に寄与している(図1)[37]。
図1 サイトカインストーム:炎症とミトコンドリア機能障害の関連性
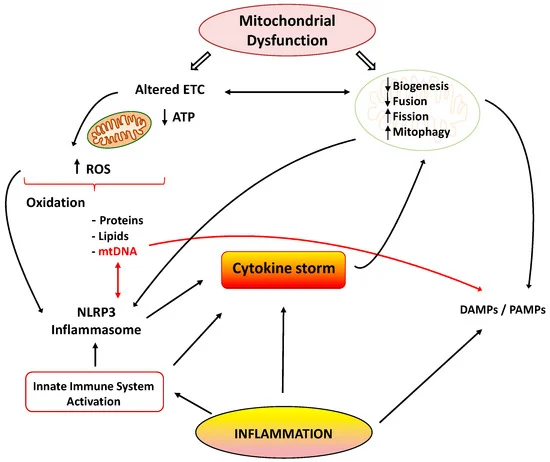
ETC:電子輸送鎖,ROS:活性酸素種,NLRP3:NOD-, LRR- and pyrin domain-containing 3,DAMPS/PAMPS:損傷/病原体関連分子パターン.
3.2. 炎症とミトコンドリアの機能不全
炎症は、感染症や組織の損傷に対する生体の複雑な防御反応である。炎症反応には、損傷した組織を修復し、特定のメディエーターを分泌して病原体から身を守るための免疫系の活性化が含まれる。しかし、炎症が持続すると、多くの疾患で組織の損傷を生み出す。
炎症プロセスとミトコンドリア機能障害の関連性については、多くの報告がなされている。炎症はミトコンドリアの機能障害を促進し、機能障害を起こしたミトコンドリアはいくつかのメカニズムを介して炎症の発症に関与し、炎症を再発させる悪循環を確立している可能性がある[38]。いくつかの炎症性疾患の発症と進行には、ミトコンドリアの機能障害と活性酸素生成の亢進が伴う[39]。急性および慢性の炎症性疾患はいずれも、酸素ベースの活性種が過剰に生成されることを特徴としており、これらの活性種は、ミトコンドリアのタンパク質、脂質、およびミトコンドリアDNA(mtDNA)に損傷を与える(図1)。これらの変化は,正常なミトコンドリアの機能と動態に悪影響を及ぼす[40]。また、炎症中のミトコンドリアでは、誘導性一酸化窒素合成酵素(iNOS)の活性が上昇し、ミトコンドリアのNO産生と反応性窒素種(RNS)の増加につながる。ROSとRNSはともに、呼吸鎖活性とATP産生を低下させ、mtDNAの変化を生じさせ、最終的には細胞の損傷と死につながる[41,42]。
3.2.1. 炎症はミトコンドリアのエネルギーを変化させる
炎症性メディエーターもTCAサイクルの活動を変化させる。TNF-αおよびIL-1は、ピルビン酸デヒドロゲナーゼ(PDH)活性を低下させ、同時に複合体IおよびIIの活性も低下させる[43]。炎症性サイトカインによるPDH活性の低下は、心筋細胞、肝細胞、骨格筋細胞、敗血症の刺激を受けた細胞など、いくつかの種類の細胞で確認されている[44]。PDH活性が低下すると,アセチル-コエンザイムAの生成量が減少するため,ミトコンドリア機能障害が悪化する。さらに、この状況は、ミトコンドリアがメラトニンを内在的に産生する能力を低下させ、その結果、炎症プロセスも悪化させる[45,46]。メラトニンは強力な抗炎症物質であり、ミトコンドリアレベルでの消失は、確実に炎症反応を誇張することになる。α-ケトグルタル酸デヒドロゲナーゼ(KGDH)は,TCAサイクルの律速酵素であり,ミトコンドリアETCの重要な要素でもある[47]。KGDHの活性低下は,アルツハイマー病の神経組織の炎症を含む炎症状態で観察されている[48]。
酸化的リン酸化(OXPHOS)では,TCAサイクルで生成されたNADHが酸化され,ETCに電子が供給される。複合体I~IVのサブユニットやATP合成酵素をコードする遺伝子の発現が低下することは、いくつかの病的な炎症状況で観察されている。リポポリサッカライド(LPS)の静脈内投与によって引き起こされる急性の全身性炎症は、酸素酸化反応を抑制する効果がある[49]。LPSを投与した筋肉細胞や肝臓細胞では、ETC複合体I,II,IVのmRNAおよびタンパク質レベルが低下していた[50].ネズミの全身にLPSを投与すると,TLR4を介して炎症性サイトカインが放出され,これがミトコンドリアのエネルギー産生を変化させる。最近の研究では,TNF-αが複合体I,III,IVの活性を低下させ,ATP産生を低下させることが示された[51]。TNF-αはまた、ペルオキシソーム増殖剤活性化受容体-γ共役者1α(PGC-1α)の発現を低下させることで、様々な細胞型や組織におけるミトコンドリア生合成の制御を変化させる[52]。
3.2.2. 炎症はミトコンドリアの動態と細胞死経路を変化させる
炎症性物質がミトコンドリアの動態に及ぼす悪影響については多くの研究がある。TNF-αが脂肪細胞のミトコンドリア機能不全を誘発し,小さく凝縮したミトコンドリアを伴う形態変化を引き起こすことが報告されている[53]。この効果は,分裂タンパク質であるFis1の発現が増加し,融合タンパク質であるOpa1の発現が減少することに関連していると考えられる.Opa1の発現低下もまた、ミトコンドリアの断片化をもたらした[54]。さらに,IL1-βは,アストロサイトにおいて,分裂タンパク質Drp1を介して,ミトコンドリアの断片化と呼吸障害を誘導することができた。また、IL-6は、悪液質の初期段階におけるペルオキシソーム増殖剤活性化受容体-γ共役分子1α(PGC-1α)と融合タンパク質Mfn1および2の発現低下にも関与している[55]。最後に、他の報告でも、炎症とマイトファジーの相互作用が、アポトーシスや細胞死につながることを裏付けている(図1)[56]。
3.2.3. ミトコンドリアの機能不全が炎症を促進する
前述したように、炎症とミトコンドリア機能障害は相互に破壊的な作用を持ち、機能低下の悪循環を誘発する。ミトコンドリアの構造的・機能的変化は、炎症性メディエーターの産生を刺激し、その結果、ミトコンドリアの機能をさらに低下させる。活性酸素は,NLRP3(NOD-, LRR- and pyrin domain-containing 3)フラクタソームを介して炎症を促進することが示されている[57]。さらに、ミトコンドリアは、NLRP3インフラマソームの主要な活性化因子と考えられており、自然免疫の制御や炎症反応において重要な役割を果たしている。実際、mtDNAとNLRP3-インフラマソームの活性化の相互関係は、ミトコンドリア機能障害を伴う疾患における自然免疫経路の関与を裏付けるものである[58]。NLRP3インフラマソームは、ミトコンドリア機能障害のセンサーとして機能する。この複合体が活性化されると、IL1βが産生され、ミトコンドリアの膜電位が低下し、ATPレベルが低下し、活性酸素が発生することになる。これらの知見は、サイトカインがミトコンドリアの機能障害を引き起こし、悪循環的な変性サイクルにつながるという考え方を支持するものである[38]。ミトコンドリアの機能障害が炎症反応を引き起こすもう一つのメカニズムとして、細胞質への損傷関連分子パターン(DAMPs)の放出が挙げられる。DAMPsは、感染症やストレスの際に、局所的な炎症反応を引き起こすことができる高分子である[59]。細菌のDNAとの類似性から、変化したmtDNAはDAMPとみなすことができる。さらに、mtDNAは自然免疫反応に関与しており、したがって、特定の炎症性病態はmtDNAの変化に直接関係している[60]。正常な状態では、欠陥のあるミトコンドリアのmtDNAは、マイトファジーによって分解・除去される。しかし、ミトコンドリアの損傷が高まると、mtDNAは効果的に排除されず、NLRP3インフラマソーム依存性経路を活性化してしまう[61]。
TLR-9経路の活性化は、mtDNAが炎症反応を引き起こし、その後、一酸化窒素やTNF-αが生成されるもう一つのメカニズムである[62]。TNF-αの存在下では、正常なミトコンドリアがマクロファージを活性化し、サイトカインを産生することに留意することが重要である。このように、損傷したミトコンドリアは、活性酸素の産生とDAMPsの放出を通じて、誇張された炎症反応を誘発し、有害な悪循環に陥ると結論づけることができる(図1)。
3.3. 敗血症およびCOVID-19における炎症の病因とミトコンドリア機能不全の関連性
敗血症は、感染に対する反応として最初に急性の炎症亢進期があり、その後、免疫寛容な低炎症期が続く、全般的な炎症状態である[63]。各相では、いくつかの代謝プロセスが再プログラムされ、2つの相の病態生理学的症状に異なる役割を果たしている。炎症性亢進期では、単球を含む多くの細胞タイプにおいて、好気的な解糖能力とETCの酸素消費量が増加することが特徴的である。呼吸数の活性化とエネルギー産生は、宿主防御機構の重要な要素であるサイトカイン産生と貪食の促進に不可欠である[64]。この初期段階は、自然免疫細胞の病原体殺傷能力を高め、感染の拡大を抑制しようとするために、宿主組織がエネルギー産生を強化する反応で構成されている[65]。
低炎症性の免疫寛容期の後期は、免疫細胞の酸素化反応が亢進することが特徴です [66]。敗血症の第2期では、ミトコンドリアの呼吸とATP産生が部分的に回復する。この代謝低下状態は、細胞保護と免疫抑制の効果があるが、実際には回復と感染制御が損なわれる[65]。この段階は、サイトカインストームの減少とサーチュイン活性の回復と関連している。サーチュインの3型、4型、5型はミトコンドリアに局在し、抗炎症作用や抗酸化作用があることが知られている。サーチュインの活性が高まると、酸素化が促進され、解糖が減少する[65,66]。したがって、ミトコンドリア生合成メディエーターであるPGC-1α、ミトコンドリア転写因子A(TFAM)核呼吸因子1(NRF-1)は、敗血症の第2期に発現が増加する[67]。前述したように、免疫細胞から大量のサイトカインやケモカインが放出されると、持続的な全身性の炎症反応が生じ、COVID-19患者の急性呼吸窮迫症候群の原因となる。実際、重度の呼吸器感染症の患者は、症状の軽い患者に比べてサイトカインのレベルが高い[68]。SARS-CoV-2が引き起こすサイトカインストームには、ミトコンドリアが関与しているようである。最近、SARS-CoV-2に感染した肺細胞株の遺伝子発現を解析したところ、ミトコンドリアのサイトカインシグナルに関与する遺伝子のアップレギュレーションと、ミトコンドリアの組織化、呼吸、オートファジーの遺伝子のダウンレギュレーションが確認された[69]。最後に、COVID-19関連敗血症の炎症亢進期には、免疫細胞はその代謝を順応させ、ATP産生のためにOXPHOSよりも解糖を優先させる。このような代謝の変化は、マクロファージの貪食作用を高め、サイトカインやケモカインの合成を促進し、一種の自己増殖サイクルとなっている[70]。これらの知見を総合すると、COVID-19関連の敗血症では、ミトコンドリアの機能障害が免疫反応を低下させ、炎症や重症度を高めることが明らかになった。ミトコンドリアにおける酸素酸化反応やTCAサイクルの阻害は、メラトニンを含む特定の分子の合成を低下させることにも言及しておく。このことは、COVID-19の重症度を軽減するための潜在的な補助的治療戦略としてのメラトニンの使用と利点を支持している[70]。この点については、後述する。
4. サイトカインストームに伴うミトコンドリア機能不全の軽減におけるメラトニンの役割
さまざまな治療の結果、松果体メラトニンが抑制されると、炎症性疾患中の免疫細胞における好気的な解糖と好中球の誘引が促進され、これらの病態に特徴的なサイトカインストームとミトコンドリア機能障害の一因となる[71,72]。高レベルのATPと、好気的な解糖で生成される生体分子の豊富な供給は、サイトカインストームに寄与する有害分子、例えばサイトカインの合成と放出をサポートする[70]。逆に,血中メラトニン濃度が上昇すると,サーカディアン遺伝子Bmal1が誘導され,ピルビン酸デヒドロゲナーゼ複合体が活性化されるため,ミトコンドリアレベルでの酸化的リン酸化が促進されることになる。これは、細胞の代謝が解糖系から酸化的リン酸化に切り替わる際に、細胞の表現型に変化(反応性から静止性へ)が生じる免疫細胞では、特に興味深いことである[71,73,74]。メラトニンの外因性投与が好気的解糖を逆転させるもう一つの手段は、mTORとHIF-1αの両方を抑制することで、ピルビン酸デヒドロゲナーゼ複合体の活性を阻害し、ミトコンドリアでのメラトニン生成に関与するアセチル-コエンザイムAの合成を可能にすることである。ミトコンドリアで生成されたメラトニンは、外因性のメラトニンと組み合わせることで、サイトカインストームの強さとそのダメージを軽減する相乗効果を発揮する[70]。このように、メラトニンは、ミトコンドリアへの作用を通じて、免疫反応を制御しているのである[71]。実際、炎症性疾患時のメラトニン投与による有益な効果の多くは、メラトニンのミトコンドリアに対する作用によるものと考えられる。健康な細胞では、メラトニンは、ミトコンドリアマトリックスに局在するアラルキルアミンN-アセチルトランスフェラーゼ/セロトニンN-アセチルトランスフェラーゼによってミトコンドリア内で合成される。さらに,ミトコンドリア外のメラトニンはミトコンドリアに蓄積され,血中濃度よりも高い濃度に達する[75]。これはおそらく,このインドールがミトコンドリアのトランスポーターを介して活発に取り込まれることに関係していると思われる。興味深いことに、従来の抗酸化物質は、ミトコンドリアへのアクセスが限られているため、メラトニンよりも効果が低いことが観察された。
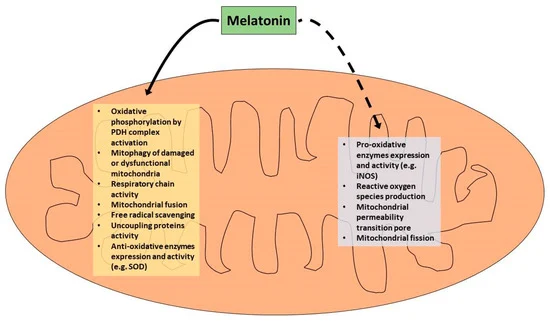
メラトニンは、ミトコンドリアの伝染性遷移孔の阻害、活性酸素の除去、アンカップリングタンパクの活性化など、いくつかの作用によってミトコンドリアを保護する。そのため、メラトニンは、ミトコンドリアの膜電位を最適に保ち、ミトコンドリアの機能を維持する。また、メラトニンは、ミトコンドリアのバイオジェネシスとダイナミクスを制御し、ミトコンドリアの分裂を抑え、融合を高める。さらに、メラトニンはマイトファジーを促進し、ミトコンドリアのホメオスタシスを改善する[76,77,78,79,80,81,82,83]。
敗血症は、ヒトを含め、メラトニンの投与によって顕著に抑制される[84,85]。さらに敗血症マウスでは、ジスルフィド/グルタチオン比、脂質過酸化レベル、グルタチオンレドックス循環酵素活性などの分析により、呼吸鎖活性が大きく阻害され、ミトコンドリアの酸化ストレスが上昇していることがわかった。このミトコンドリア障害は、敗血症時にミトコンドリアの一酸化窒素合成酵素の誘導性アイソフォームの発現が増加し、このレベルで高濃度の一酸化窒素とペルオキシナイトライトが生成されることに起因すると考えられる。メラトニン投与はこれらの変化をすべて打ち消し、レドックスホメオスタシスを再構築し、この重篤な全身性炎症疾患で観察されるミトコンドリア機能障害を減弱させる。これらのメラトニン効果は、おそらく敗血症中の誘導性ミトコンドリア一酸化窒素合成酵素の発現および活性のダウンレギュレーションによって媒介されていると考えられる[42,86,87,88,89,90,91]。また,メラトニンは,NFκBの活性化やサイトカインの発現を抑制し,敗血症のような条件で培養した内皮細胞のグルタチオン濃度,ミトコンドリア膜電位,代謝活性を維持した[92]。さらに,敗血症は,複合体IIIのスーパーコンプレックス構造に関連した変化を引き起こし,ミトコンドリア密度が低下する。このような条件下で,敗血症マウスにメラトニンを投与すると,再びミトコンドリアの機能障害が予防された。さらに,メラトニンはシトクロムbの含有量を改善し,複合体IIIのスーパーコンプレックス構造の組み立てを促進した[93]。ミトコンドリア機能障害は,敗血症性心筋梗塞の炎症性病態に関与していることが示唆されている.ラットの敗血症モデルを用いて行われた研究では、メラトニンがシトクロムcオキシダーゼ活性を上昇させ、心臓の収縮機能を高め、これらの動物の死亡率を低下させることが示された[94]。また,別の報告では,メラトニンに加えて,MitoQやMitoEなどのミトコンドリア作用を有する抗酸化物質を投与すると,ラットの急性敗血症モデルにおいて,ミトコンドリア障害,臓器機能障害,炎症反応が軽減されたが,一部の測定項目ではメラトニンよりも効果が低かったことが示されている[95].このように、メラトニンの抗酸化作用は、通常、抗炎症作用と一致しており、スーパーオキシドディスムターゼなどの抗酸化酵素のアップレギュレーションと、一酸化窒素合成酵素などのプロオキシド酵素のダウンレギュレーションが関与している一方で、フリーラジカルスカベンジャーとして直接機能しており[96,97]、ミトコンドリア機能不全はサイトカインストームと密接に関連している。このように、活性酸素は、特に新生児の敗血症や肝機能障害の病態に重要な役割を果たしている。この点に関して、メラトニンは、H2O2(敗血症障害のフリーラジカルメディエーター)にさらされた新生児ラットの肝細胞を保護する効果があった。これらのデータを総合すると、メラトニンは重度の敗血症感染時に多くの臓器の機能を維持することがわかる。
また、メラトニンは、アルツハイマー病やパーキンソン病、心血管疾患などの複数の重篤な疾患の発症の主な要因である加齢に関連する疾患の予防および軽減にも有用であると考えられる。老化のプロセスには、酸化ストレスや損傷、ミトコンドリア機能障害、神経再生能力の低下などがある。また、老化には慢性および急性の炎症プロセスが関与しており、これらはしばしば「炎症老化」と呼ばれている[98,99,100,101]。メラトニンは、その抗酸化作用と抗炎症作用により、降圧作用と動脈保護作用も有している[102,103,104]。同様に、耐糖能異常、高インスリン血症、肥満、脂質異常症などの心血管疾患のいくつかの危険因子(総称してメタボリックシンドロームと呼ぶ)は、ミトコンドリア機能障害と制御されていない炎症に密接に関係している。したがって、メラトニンはこの症候群の管理に有用であると考えられる[105,106,107]。虚血再灌流障害は、急性心筋梗塞や脳卒中などの多くの心血管疾患や外科手術中に起こる通常の合併症である。虚血再灌流障害は、主に活性酸素の発生が悪化することによって引き起こされることが多くの証拠によって示されている。その結果、フリーラジカルは過剰な炎症反応を引き起こし、遠隔地の臓器に障害をもたらすこともある。これに関連して、虚血再灌流に対する抵抗力は、発生した時間帯に依存している可能性があり、暗から明への移行期(メラトニンの血漿レベルが急激に低下する時期)に発生した場合には、著しく重篤になることが観察されている。これは、メラトニンには強力な抗酸化作用と抗炎症作用があることに加えて、再灌流時にミトコンドリアの伝染性遷移孔を阻害する能力があり、これは虚血再灌流傷害の軽減に不可欠であるためである[108,109,110]。外傷性脳損傷の際、メラトニンは、mTOR経路を介してマイトファジーを増加させることにより、損傷または機能不全を起こしたミトコンドリアを排除することができ(これによりIL-1βの分泌が減少する)その結果、この病態で観察される炎症の悪化を抑制することができる。したがって、メラトニンは、この免疫病理学的損傷後の神経細胞死を著しく減少させ、行動障害を克服する[111]。
メラトニンは、酸化ストレス、サイトカインストーム、ミトコンドリア機能障害、および小胞体ストレスの顕著な増加を特徴とする変性関節疾患である変形性関節症の生理病理および治療に有益な効果があると報告されている[112]。同様に,脂肪性肝炎の進行に伴って見られる肝ミトコンドリアの脂肪毒性(肝細胞への脂質の浸潤が悪化することで生じるミトコンドリア機能障害)や,それに伴う酸化ストレスの増加,炎症の亢進も,メラトニンによって抑制される[113]。さらに、炎症誘発性の急性肝不全の試験管内試験モデルでは、メラトニンがAkt/Sirt3軸の活性を有意に上昇させることが証明されている。このプロセスにより、ミトコンドリアのホメオスタシスが維持され、ミトコンドリア機能障害を伴う炎症環境下でも肝細胞の生存率を回復することができる[114]。緑内障、白内障、糖尿病性網膜症、黄斑変性症など、多くの視神経疾患や加齢性眼疾患の生理病理は、少なくとも部分的には、ニトロ酸化ストレス、炎症亢進、オートファジーの結果であるため、メラトニンを治療に用いることも有益であると考えられる[115,116,117,118]。
先に述べたように、インフラマソームは、さまざまなストレスシグナルに反応して活性化される細胞内タンパク質複合体であり、複数の炎症性疾患に関連するサイトカインストームの引き金となる重要な役割を担っている。この意味で、慢性閉塞性肺疾患(COPD)は、強いプロオキシダント状態とミトコンドリア機能障害を特徴としており、これがNLRP3インフラマソームの活性化を引き起こし、その結果、この肺の病理で通常観察されるサイトカインストームを引き起こすのである。この点について、COPDの生体内試験および試験管内試験モデルにメラトニンを投与すると、細胞内の抗酸化物質であるチオレドキシン-1が活性化され、いくつかのシグナル伝達経路によって、インフラマソームの活性化が抑制され、全般的な抗酸化および抗炎症状態が回復した[119]。COPDの予防と治療に関しては、メラトニンは、COVID-19やその他の炎症亢進を特徴とする呼吸器疾患の初期段階とより重度の段階の両方においても有用であると考えられる[120,121,122]。
ミトコンドリアにおけるメラトニンの主な役割を図2にまとめた。
図2 ミトコンドリアにおけるメラトニンの役割。連続線は「刺激」を、破線は「抑制」を示す。
5. 微量栄養素のミトコンドリア作用による酸化・炎症性疾患の治療への貢献
ミトコンドリア病(全般的なミトコンドリア機能障害を引き起こす一連の遺伝性疾患)の患者では、不十分な食事による栄養失調がミトコンドリア機能障害の増大を引き起こし、既に存在する症状を悪化させることが観察されている[123]。十分な栄養は、最適な免疫状態を維持し、炎症や酸化を促進する感染症やその他の要因の影響を軽減することがよく知られている。微量栄養素の多くは、免疫系の機能を強化し、様々な脅威に対する抵抗力を高める上で重要な役割を果たす。この目的を達成するためには、ビタミンやミネラルを補給することが一般的に安全で安価な手段となる。しかし、サプリメントは健康的な食生活を補完するものでなければならず、推奨される安全基準の範囲内でなければならない[124,125]。
微量栄養素の摂取(食事またはサプリメント)に基づく自然療法は、ミトコンドリアレベルで作用するため、炎症性/酸化性疾患の治療に使用できる可能性があるものがいくつかある[126]。例えば,ビタミンB群はトリカルボン酸サイクルに不可欠であり,セレンとα-トコフェロール(ビタミンE)は電子伝達系の正常な機能を促進することが示唆されている。さらに、セレンはミトコンドリアの生合成にも関与している[5]。これらの治療法を構成する重要な微量栄養素の一部をここにまとめてみた。
5.1. ビタミン類
ビタミンB9(葉酸)の濃度が低下すると、mtDNAが不安定になり、このオルガネラに障害が発生する。そのため、ミトコンドリア病の一部の患者では、葉酸の補給が有効であると報告されている[127,128]。実際,酸化ストレスや炎症が積極的に関与している疾患である心肥大のマウスにおいて,ミトコンドリアの酸化能力,脂肪酸酸化,ミトコンドリア生合成の転写カスケードの変化が,葉酸を補給した食事によって有意に改善された[129]。細胞レベルでは、葉酸はホモシステインのメチル化にも関与しており、ホモシステインはメチオニンになる。メチオニンはグルタチオン生成の重要な中間体であり、細胞内の重要な抗酸化物質の1つである。したがって、葉酸は、細胞内の固有の抗酸化物質濃度を高めることで、酸化ストレスによるミトコンドリアの損傷を防ぎ[130]、酸化/炎症性疾患の発症や進行を回避することができる。
アスコルビン酸(ビタミンC)も重要な天然抗酸化物質で、フリーラジカルのスカベンジャーとして働くことで、特に血管機能障害時に見られる脂質の過酸化損傷を防ぎ、血管内皮の機能を回復させる。血管機能障害は、心血管疾患、代謝性疾患、炎症性疾患、神経疾患など、いくつかの酸化的/炎症的な病態の発症および進行につながる可能性がある[131]。さらに、ビタミンC、セレン、亜鉛、メラトニンなどの微量栄養素の投与は、敗血症性ショックの治療において、ミトコンドリア機能を正常に回復させることができる「代謝蘇生剤」となる可能性があり、この酸化的/炎症的疾患の患者の生存率を向上させることが示唆されている[132,133,134,135]。注目すべきは、敗血症は通常、急性のビタミンC欠乏と関連していることが観察されていることである[136]。さらに,複数の動物およびヒトを対象とした研究の結果から,敗血症に伴うミトコンドリア機能障害の治療には,微量栄養素の投与に基づくミトコンドリアを標的としたいくつかの治療法があることが示唆されている。しかし、これらの微量栄養素の最適な投与量や適切な組み合わせはまだ決まっていない[137]。
ビタミンEは、トコトリエノールとトコフェロールの両方の形で、重要な抗酸化作用と抗炎症作用を持っており、加齢に伴う心血管疾患とその関連病理の治療と予後を改善するための魅力的な微量栄養素となっている[138]。また、複数の脳領域における神経炎症、ミトコンドリア機能障害、脂質過酸化を伴うてんかん発作の治療において、ビタミンEの大きな治療効果が認められている。これに関連して、ビタミンEは強力な細胞性抗酸化物質であり、多価不飽和脂質の代謝および炎症性シグナル伝達経路に関与するいくつかの酵素の補因子として作用することが明らかにされている[139]。さらに、3つの異なる形態のビタミンE(α-トコフェロール、MitoVitE、Trolox)も、敗血症の試験管内試験モデルにおいて、炎症、ミトコンドリア、および酸化的損傷から保護した[140]。
ビタミンDに関しては、ミトコンドリアがこの微量栄養素の受容体と機能的なレニン・アンジオテンシン・システムの両方を持っていることが実証されている。ビタミンDの血漿レベルの上昇は、レニン・アンジオテンシン系の活性を抑制または減衰させ、高血圧、糖尿病、神経変性疾患、骨・腎臓疾患、癌などの酸化的/炎症的な病因を持つ複数の慢性疾患の際に、ミトコンドリアの作用により、ミトコンドリア機能の低下を改善することができる[141]。さらに,ある研究では,ビタミンDが,神経レベルでのビタミンD受容体の発現や抗酸化酵素の活性の増加,フリーラジカル生成の減少を通じて,ホモシステインによる神経細胞の酸化・炎症性傷害を予防することが明らかにされた[142]。同様の結果が、ホモシステインによってミトコンドリア機能障害が誘発された心臓スライスの試験管内試験モデルでも得られており、ここでもビタミンDが酸化/炎症に基づく心血管病態の治療に有用であることが示されている[143,144]。さらに、ビタミンDは、オートファジー、ミトコンドリア機能不全、炎症、酸化ストレス、DNA障害、およびCa2+とROSのシグナル伝達の変化とエピジェネティックな変化を含む多くの加齢関連プロセスを制御している。このため、加齢速度や、アルツハイマー病やパーキンソン病、多発性硬化症などのあらゆる加齢性病態の発症は、少なくとも部分的にはビタミンDの状態に依存していると推測されている。一般的に、ビタミンDの血漿レベルが正常な人は、ビタミンDが不足している人よりも老化速度が遅いとされている[145,146]。さらに、ビタミンDは、ミトコンドリア機能障害の改善とオートファジーの調節を通じて、アンギオテンシンIIによって誘発された腎傷害を軽減する可能性があり、ビタミンDが慢性腎臓病の治療のための新しい治療薬として有用であることが示唆されている[147]。ビタミンDの欠乏は、COVID-19のリスク増加にも関係している可能性がある。このウイルス性疾患は、急性の炎症過程と誇張された酸化ストレスを引き起こし、重篤な呼吸器系の影響を受け、死に至ることもある。SARS-CoV-2感染症は、ミトコンドリア機能障害、酸化ストレス、サイトカインストーム、アポトーシスを伴う。逆に、ビタミンDはこれらの変化したパラメータを正常化し、この呼吸器疾患で観察されるレニン・アンジオテンシン・アルドステロン系の過剰活性化さえも抑え、感染患者の予後を改善する[148,149,150,151,152,153]。
5.2. ミネラル
亜鉛やセレンなどの微量栄養素は、それ自体は抗酸化物質ではないが、いくつかの抗酸化酵素の活性化に必要である[154]。特にセレンは、セレノプロテインと呼ばれる少なくとも25種類の細胞内酵素(グルタチオンペルオキシダーゼ、チオレドキシンレダクターゼ、メチオニンスルホキシドレダクターゼなど)の活性部位を構成しており、これらの酵素は重要な抗酸化作用や抗炎症作用を有している。実際、いくつかの研究では、ヒトおよび動物モデルの両方において、血清セレン濃度と免疫系の状態との関連性が示されている[155]。食事で摂取したセレンは、主にセレノプロテインに取り込まれ、免疫と炎症に重要な役割を果たしている。この微量栄養素の十分な濃度は、免疫反応の悪化(サイトカインストーム)や慢性炎症を抑制する。セレンの欠乏は、免疫細胞の活性化、分化、増殖に悪影響を及ぼす可能性がある。これは主に酸化ストレスの増加と関連している。同様に、過剰な量のセレンを取り入れることでも、免疫細胞の機能に影響を与え、多くの種類の炎症および免疫プロセスに影響を与える可能性がある [155,156,157]。注目すべきは、セレンとセレノプロテインは、酸化/炎症性の神経変性疾患の際に神経保護効果を発揮することである。マウス海馬の神経細胞培養において、グルタミン酸によって誘発された酸化的および炎症的な細胞損傷は、これらの細胞におけるセレノプロテインHの過剰発現によって逆転することが観察されている[158]。同様の結果は,3-ニトロプロピオン酸(酸化的損傷の誘発物質)にさらされたマウスの皮質神経細胞を亜セレン酸ナトリウムで前処理した場合にも得られ,亜セレン酸ナトリウムはフリーラジカルによる損傷からこれらの細胞を保護し,グルタチオンペルオキシダーゼ活性を刺激した[159]。また、セレノプロテインは、複数のフリーラジカルを除去することで、NLRP3インフラマソームの活性化を防止または抑制することが観察されている[160]。セレンを基にした抗酸化化合物であるセレネペジルは、アルツハイマー病におけるミトコンドリア機能障害、酸化、炎症に起因する神経認知機能障害の減弱において、ドネペジルよりも高い活性を示した[161]。別の研究では、敗血症患者において、血漿中の亜鉛およびセレンの濃度が有意に低下していることが明らかになった[162]。ビタミンC、E、セレン塩、有機セレン化合物は、敗血症の動物モデルと敗血症患者の両方において、酸化ストレスと炎症を弱めるのに有効でした [163,164]。セレンは、ミトコンドリアの転写因子であるTFAMの発現を上昇させることで、大腸細胞のミトコンドリア保護を促進する。したがって、高用量のセレンは、炎症性腸疾患における潜在的な治療薬として有用であると考えられる[165]。また、十分なセレンの摂取がSARS-CoV-2のプロテアーゼを阻害する可能性も示唆されており、これはCOVID-19疾患の予防および治療におけるセレンのもう一つの有益な効果である[166,167]。ビタミンC、E、マグネシウムもまた、抗炎症作用と抗酸化作用を持つことから、COVID-19の治療におけるアジュバントとして有用であることが証明されている[168,169,170,171,172]。
亜鉛は、グルタチオンペルオキシダーゼとメタロチオネインの生合成を増加させ、スーパーオキシドディスムターゼ抗酸化酵素(CuZn-SOD)の補酵素として(銅とともに)作用することで、酸化ストレスから細胞を保護する。この酵素は主に細胞質に存在するが、ミトコンドリアにも存在し、酸化・炎症性疾患のミトコンドリア機能不全時に多く発生する有害なフリーラジカルであるスーパーオキサイドアニオンを代謝する役割を担っている。このため、亜鉛が欠乏すると、炎症性腸疾患のように、フリーラジカルの発生が増加し、炎症が制御できなくなることが多い [173,174]。メラトニンと同様に、亜鉛も変形性関節症で見られるミトコンドリアの機能障害、オートファジー、炎症の悪化を抑制し、この酸化的/炎症的病理の進行を遅らせる[175]。また、亜鉛は、NFκBシグナル伝達経路の阻害と調節性T細胞機能の調節により、COVID-19で観察されたサイトカインストームを抑制する抗炎症作用も有している。特に興味深いのは、亜鉛の状態は、亜鉛欠乏を特徴とする加齢、免疫不全、メタボリックシンドロームなど、重篤なCOVID-19の多くの危険因子とも密接に関係していることである。したがって、亜鉛は、炎症や酸化などを抑えることで、COVID-19の治療におけるアジュバントとして作用する可能性がある[176,177,178,179,180,181]。また、腎臓の虚血/再灌流障害の動物モデルでは、亜鉛の投与により、抗酸化酵素レベルの上昇、タンパク質および脂質の酸化の減少、炎症性サイトカインレベル(IL-1β、MCP-1,IL-6)の減少が見られ、ミトコンドリア機能障害を減衰させ、細胞のアポトーシスを回避した[182]。
先に述べたように、CuZnSODはミトコンドリアに位置しており、ミトコンドリア機能不全に関連した酸化的/炎症的疾患の予防と治療のための主要なターゲットオルガネラのひとつである[183,184]。しかし,銅はミトコンドリア内でSODの機能に必要なだけでなく,別の金属酵素,すなわち,呼吸電子輸送鎖の最後の酵素であるシトクロムcオキシダーゼの十分な活性にも必要である。銅の濃度が低いためにこの金属酵素が機能不全に陥ると、酸化性疾患や炎症性疾患の際にフリーラジカルが過剰に生成される原因にもなる[185,186,187]。また、SODに結合していない銅は、フリーラジカルの発生を促進する可能性がある。
ミトコンドリアレベルでは、マグネシウムは、プロトンポンプ(複合体I、III、IV)を改善して、ミトコンドリア外のNADHの酸化を刺激し、ミトコンドリアの膜電位の結合を高め、その結果、細胞の生存に必要なH+ -結合ミトコンドリアのNADPHとATPの合成を増加させる[190]。したがって、マグネシウムの欠乏は、フリーラジカル産生の無秩序な増加や、ミトコンドリア機能障害、炎症亢進プロセス、内皮機能障害などの作用の発現に直接影響する[191,192]。さらに、マグネシウムの欠乏は、ミトコンドリアがATPを合成するのに必要なエネルギー生成に悪影響を及ぼし、また、細胞の一般的な抗酸化能力を低下させるため、フリーラジカルによる損傷による老化を促進する可能性がある。慢性炎症と酸化ストレスの両方が老化の重要な要因であることが確認されており、代謝性疾患、神経変性疾患、心血管疾患などのいくつかの加齢性疾患では、顕著なマグネシウムの欠乏が観察されている[193,194,195]。これに関連して、神経変性を誘発する試験管内試験モデルでは、細胞の生存率がマグネシウム濃度と大きく相関していることが観察された。したがって、低用量のマグネシウムで処理すると、活性酸素のレベルが上昇してATP産生と細胞生存率が低下し、その逆も同様でした[196,197]。同様に、心不全や2型糖尿病の患者のほとんどが低マグネシウム血症であることも観察されている。マグネシウムを補給すると、ミトコンドリア機能障害に関連した酸化的・炎症的プロセスが減少し、これらの患者の心機能とインスリン抵抗性が改善された[198]。低マグネシウム血症は、COVID-19患者にも共通する特徴である。さらに、マグネシウムはビタミンDの活性化に重要だ。したがって、マグネシウムとビタミンDが十分な免疫機能に不可欠であることを考慮すると、どちらかが欠乏するとCOVID-19感染症におけるサイトカインストームの一因となる可能性がある。したがって、COVID-19の予防と治療のために、特にリスクのある集団においては、マグネシウムの補充は魅力的な戦略となるであろう[199,200]。
銅や亜鉛と同様に、マンガンもスーパーオキシドディスムターゼ酵素(MnSOD)の補酵素として働く。したがって、マンガンの欠乏は、スーパーオキシドディスムターゼの機能低下に直接関係し、その結果、酸化ストレスや炎症の亢進を引き起こすことになる[201]。これに関連して、神経変性疾患、癌、乾癬などの多くの酸化的/炎症的病態において、MnSODレベルが低下している。逆に、腫瘍細胞でMnSODを過剰発現させると、悪性の表現型を著しく弱める可能性がある[202]。銅やセレンと同様に、マンガンや亜鉛の過不足は、ミトコンドリアのコンパートメントや機能(膜電位、酸化的リン酸化、トリカルボン酸サイクル、グルタチオン代謝)を変化させ、活性酸素生成量の増加や細胞死を引き起こすことがよく知られている[203,204,205,206,207]。
6. 結論と今後の展望
酸化ストレスと炎症の悪化は、複数の病態の発生と進行の原因となる最も重要な標準的プロセスであり、現在の人口における罹患率と死亡率の重要な原因となっていることを示す証拠がある。そのため、この2つの現象に対する解決策を見出すことは非常に重要だ。
近年、ミトコンドリアは、特に天然由来の抗酸化剤や抗炎症剤の重要な標的器官として注目されている。ミトコンドリアの複雑さと、このオルガネラで起こる様々なシグナル伝達経路のおかげで、酸化的/炎症的疾患を様々なアプローチで攻撃することが可能になっている。自然の叡智により、ミトコンドリアは、内因性ホルモン(メラトニンなど)や自然食品に含まれる栄養物質(ビタミンやミネラルなど)に反応する受容体や酵素を介して、細胞のホメオスタシスを最適に維持している。
また、微量栄養素や天然のサプリメントの摂取は、不足しても過剰しても害になることがあるので、極端な場合は避けてください。そのため、日々の生活の中でバランスをとり、自分の特徴や必要性に応じて最適な健康状態を実現することが重要だ。
そこで、重症度の異なる酸化・炎症性疾患の患者を対象に、微量栄養素とメラトニンの同時投与による相乗的な有益性の可能性を検討することが興味深い(図3)。
図3 酸化的/炎症的疾患におけるメラトニンと微量栄養素のミトコンドリアへの影響
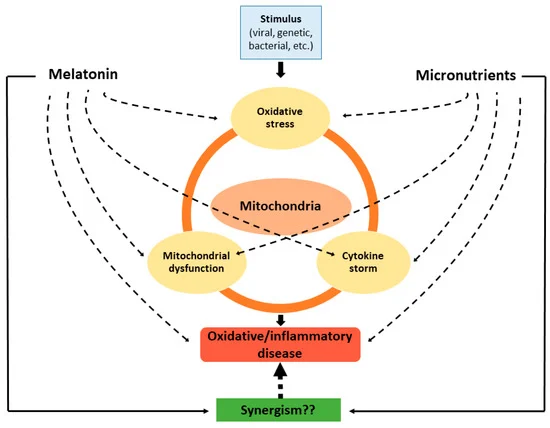
破線は「阻害」を示す。
