Contents
Pharmacological plasticity—How do you hit a moving target?
www.ncbi.nlm.nih.gov/pmc/articles/PMC6868654/
Michael J. Parnham(マイケル・J・パーナム)corresponding author 1 and Gerd Geisslinger
概要
Paul Ehrlichが提唱した「魔法の弾丸」は,単一の薬剤が単一の受容体と相互作用することによって薬理作用を誘発するというもので,1世紀にわたって薬理学の強力な推進力となってきた。しかし,治療対象となる生物は非常にダイナミックであり,標的分子は決して固定的ではないという事実によって,この概念は常に妨げられてきた。この記事では、薬物標的とそのリガンドとの相互作用の可動性と可塑性を変化させ、その原因となる要因のいくつかを取り上げ、これらがどのように薬物の予期せぬ効果(の欠如)につながるかを論じている。
これらの要因には、遺伝子、エピジェネティック、表現型の変動性、細胞の可塑性、時間生物学的リズム、時間、年齢と病気の解決、性別、薬物代謝、流通などが含まれる。私たちは、薬理学的な可塑性の影響を最小限に抑えるために、単独または組み合わせて取ることのできる4つの既存のアプローチを強調する。第1に,疾患に近い状態を目標にして特異性を高めること,第2に,複数の目標を同時に,あるいは逐次的に狙うこと,第4に,食事,心理,トレーニング,バイオリズムを同期させて薬物療法を最適化することである。
キーワード
クロノバイオロジー、薬物代謝・分布、薬物標的、薬物療法、標的変動性
略語
CNR2カンナビノイド受容体2中枢神経系中枢神経系COXシクロオキシゲナーゼDNAデオキシリボ核酸EAEexperimental autoimmune encephalomyelitisFCAFreund’s complete adjuvantGLP-1glucagon-like receptor-1GPCRsG-protein-coupled receptorHBVhepatitis B virusHDAChistone deacetylaseHIVhuman immunodiciency virusmTORmeter ヒト免疫不全ウイルスmTORmammalian target of rapamycinNFκBnuclear factor κBNSAIDsnonsteroidal anti-inflammatory drugsOATPsorganic anion-transporting peptidesPGprostaglandinSCFAshort-chain fatty acidsSFBsegmented filamentous bacteriaTHP-1spontaneously immortalized monocyte-like cell line, 幼少期の急性単球性白血病患者の末梢血から得られた自然不死化単球様細胞株WHOW世界保健機関
1. 序論
2015年8月、ドイツのフランクフルト・アム・マインにおいて、フランクフルト大学の初代薬理学・実験治療学研究所の創設者であり、現在は腫瘍生物学・実験治療学研究所の本拠地となっている化学療法研究所Georg-Speyer-Houseの初代所長であるPaul Ehrlichの没後100年を記念した(図(1).1)。エールリッヒは、世界で初めて血球を染色した科学者である。また、梅毒治療用のヒ素化合物であるサルバルサン(図(2),2)を発見し、メチレンブルーがマラリアの治療に使えることを示した1。彼は、化合物を魔法の弾丸(Zauberkugel)のように使って、病気の原因となる生物を選択的に殺すことができると提案し、その考えは、近年のモノクローナル抗体治療薬の爆発的な発展により、部分的には実現された2。化学薬品のように正確かつ迅速に標的を攻撃したいと思っても、治療対象は動き回るという厄介な習性がある。
図1

(A) ポール・エーリックの没後100年を記念して 2015年にフランクフルト大学病院に建立されたポール・エーリックと彼の魔法の弾丸理論(Zauberkugel)の記念碑(Photo: MJ Parnham) (B) フランクフルト・アム・マインのポール・エーリック通りにあるゲオルク・シュパイアー・ハウス(Photo: MJ Parnham)。
図2

Farbwerke vorm(alig) Meister Lucius & Brüning(後のHoechst AG)(Hoechst am Main)のNeosalvarsan Dosierung III(サルバルサン0.3g)のオリジナルバイアル(Photo: MJParnham)
科学研究は本質的に合理的な職業であり、現象はしばしば研究可能な最も単純なシステムに還元される。主要な生物医学雑誌を見ると、インタラクティブなプロセスを単純化した魅力的なカラー図がまず目に飛び込んできる。私たちは、生物がダイナミックな相互作用と適応の連続状態にあることを忘れがちである。生化学物質は瞬間的に合成されては消滅し、細胞は成長と死を繰り返し、ほとんど絶え間なく移動し続けている。細胞表面と細胞質内の分子を同時に可視化すると、おそらくラッシュアワーのタイムスクエア、ピカデリーサーカス、エトワール広場をスピードアップした映像のようになるだろう。この魅惑的な移動性は、薬理学的な薬剤の効果を検討する際に、特に治療中に動的なホメオスタシスのバランスを維持する場合に、より考慮しなければならない。
動く標的とは何を意味するのであろうか?薬剤で狙う分子は、場所を移動したり、臓器から臓器へ移動したり、体内を移動したりするので、薬剤の送達が非常に重要になる。ある個人や病気の結果、その分子の発現率が高くなることがある。また、一塩基多型などの遺伝子の違いにより、その分子が存在せず、被験薬が効かない場合もある。補足すると、標的自体は動かなくても、治療を受けた生物が薬物を分解するなどして薬物を変化させることができるため、「弾丸」は勢いを失い、標的にほとんど到達しないということになる。また、輸送タンパク質(P-glycoproteinなど)が発現し、薬物を標的細胞の外に戻す。薬剤の中には、狙った標的とは無関係の効果が現れるものもある。これは、医学的な「ハンター」が知らないうちに「ショット」がスライスされ、全く予期しない標的に当たってしまったためで、いわゆる「オフターゲット効果」につながる。このようなオフターゲットの変化は、治療の再現性を著しく低下させるため、医薬品の精度に著しい影響を与える3, 4。癌に限らず、標的分子は、異なるアイソフォームやコンフォメーションを形成したり、細胞刺激や病態生理学的プロセスに応じて変化したり、発現量が異なったりすることがある。このような標的の性質の変化は、薬物治療の精度を変化させる5ため、ある試験や集団では有効性を正しく評価しているように見えても、異なる条件下ではそうではなくなってしまう。
オフターゲット効果は、既知の薬剤を新たな治療目的に再利用することへの関心の高まりに貢献している6。しかし、薬理学上の弾丸がターゲットを外れて別のものに当たり、望ましくない毒性が生じた場合、動くターゲットの機能不全はすぐに明らかになる7。ここ数年、この種の巻き添え被害の別の側面が、多くの研究(その多くは評判の高い学術誌に掲載されている)の再現性が低いという事実によって明らかになった8, 9。この原因としては、実験計画や実験方法の不備、不適切なサンプリング、統計の誤った使用、適切なコントロールの欠如、あるいは単にデータの公開を急ぎすぎたことなどが挙げられる。この場合、ターゲットの設定が正しくないため、グラグラしたり、完全に倒れてしまったりする。このような表面的な科学への対策として,米国の国立衛生研究所,英国の国立研究動物センター,欧州神経精神薬理学カレッジ,さらにはいくつかの有力ジャーナルなど,さまざまな組織が取り組んでいる9, 10。これにより,ロバスト性と再現性の両方が向上することが期待される。しかし,研究対象となる生物や細胞の条件や遺伝子発現の違い,投与する時間帯や化学物質の代謝動態の違いなども,結果に矛盾を生じさせる要因となる。
ここでは、特に炎症と(自己)免疫の分野での個人的な経験をもとに、薬理学的な可塑性をもたらす薬物標的の移動性とリガンドとの相互作用(図(3)3)の理由をある程度検討した。ここでは、標的分子自体の固有の化学的動態や、神経細胞の可塑性については考慮していない。中枢神経系は本質的に非常に可塑的である。感情的な経験、環境的なストレスや学習、病気、外傷、条件付けなどに応じて、新たな神経細胞の結合や経路が生成されたり、失われたりするが、このテーマについては広く取り上げられている12, 13。その方法の多くはすでに知られている。私たちは、ほとんどの慢性疾患が呈する「生物学的な交通渋滞」に対処するために、薬を開発したり、その効果を説明したりする際に、多様な条件のほとんどまたはすべてを総合的に考慮することの重要性を強調している。
図3 薬理学的可塑性の要因
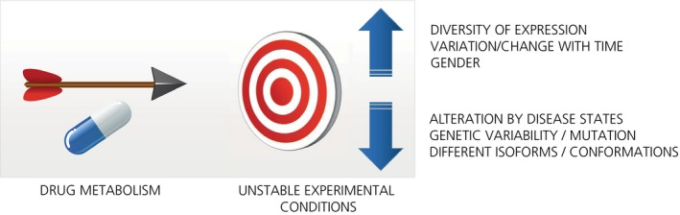
2. 遺伝子と表現型の多様性
標的分子がその姿や形を変えたり、あるいは消滅したりする最も重要な方法の一つが、その遺伝子発現の変化である。
2.1. 突然変異
遺伝子の突然変異は、薬剤に対する反応の多様性の原因として最も広く認識されているものの一つである。ほとんどの細胞には効果的なデオキシリボ核酸(DNA)修復機構があり、免疫モニタリング機能もあるため、突然変異が起こる頻度は比較的低いのであるが、環境や選択圧の下では、突然変異率が高まる。しかし、環境や選択の圧力の下では、突然変異率が上昇する。免疫防御の観点からは、エピトープドリフトが起こり、宿主の免疫攻撃の対象となる抗原が失われることになる。ウイルスはおそらく、ワクチンや薬剤による破壊を避けるために突然変異することにかけては、最も優れていると思われる16。最近のインフルエンザ、重症急性呼吸器症候群、エボラ出血熱、ジカ熱などのパンデミックにより、世界的な関心が高まっており、効果的な抗ウイルス剤の必要性が高まっている。最も気まぐれなウイルスであるヒト免疫不全ウイルス(HIV)に対しては、多価ワクチンを用いて異なる部位のウイルスを攻撃することが最も有望な方法であると考えられている17。この多価ワクチンによるアプローチは、HIV感染症の薬物療法においても有効であることが証明されている。非ヌクレオチド系およびヌクレオチド系逆転写酵素阻害剤、プロテアーゼ阻害剤、ウイルス侵入阻害剤など、少なくとも3種類の薬剤を組み合わせた「高活性抗レトロウイルス療法」の導入により、効果的に変異率を低下させることができ、多くの慢性的なHIV感染者が比較的正常な生活を送れるようになった18。このような特定のウイルスを標的とした併用療法は、B型肝炎ウイルス(HBV)をはじめとする他のウイルス感染症の治療においても幅広く検討されており、最近では4剤併用療法が販売されている19, 20。 しかし、C型肝炎NS5Bタンパク質阻害剤であるソボスブビルを抗ウイルス剤の併用療法に用いることで、すべてのジェノタイプのC型肝炎の治療成功率が飛躍的に向上しており、重要な標的を特定して治療することの価値が示されている21。
もし、標的が特定されておらず、治療兵器がショットガンのように無差別に使用された場合、長期的な治療結果は、当初標的としていた疾患よりも悪化する可能性がある。1962年にレイチェル・カーソンが著した「沈黙の春」に登場するDDT(ジクロロ-ジフェニルトリクロロエタン)の無差別使用は、1960年代に環境破壊を引き起こし、エコロジー運動のきっかけとなった。これと同じように、家畜の栄養補給やウイルス感染に抗生物質を無差別に使用することで、薬剤の排出やメチル化など、細菌の耐性メカニズムが促進されている22。抗生物質に対する耐性菌が世界的に増加し、その結果、多くの感染症に対する治療の選択肢が失われるという警告は、現在、一般的になっており、政府や産業界はこの問題に対処するための共同の取り組みを開始している23, 24。この状況は、マルチターゲットのアプローチをとることの重要性を浮き彫りにすると同時に、特異性を高め、潜在的な病因となる微生物を特定するために、より効果的で迅速な診断方法を開発することも重要である。
細胞膜に存在するGタンパク質共役型受容体(GPCR)は、様々な薬剤の主要なターゲットとなる分子群である。最近、英国の国民健康保険サービスにおける68,496人の医薬品処方・販売データを分析した結果、これらの人々の平均3%が、GPCR薬物標的の活性部位に変異を持つ少なくとも1つの対立遺伝子を保有していることが明らかになった25。カンナビノイド受容体2(CNR2)では86%以上、グルカゴン様ペプチド1(GLP1)受容体では69%以上の人が、それぞれ活性部位に少なくとも1つのミスセンス変異した対立遺伝子を保有している。この2つのGPCRはそれぞれ、一般的な制吐剤であるナビロンや、エキセナチドなどのいくつかの抗糖尿病薬の標的となっている。これらの薬剤や他のクラスの薬剤では、突然変異の発生率から、GPCRに作用する薬剤に対する反応が遺伝的に誘発され、差異が生じたり、あるいは消失したりする傾向が集団内に広く存在することが示唆されている。著者らは、ミュー・オピオイド受容体とコレシストキニンA受容体のいくつかの変異体を実際に実験し、完全作動薬(モルヒネ)部分作動薬(ブプレノルフィン)拮抗薬(ナロキソン)内因性作動薬であるエンドモルフィン-1に対して、野生型受容体での反応とは異なる反応が得られることを確認している25。
癌は、感染症や生活習慣病と並んで、世界的に医薬品開発の主要な適応症となっている。がんは、感染症や生活習慣病と並んで、世界的に重要な医薬品開発の対象となっている。このような変化には、腫瘍細胞における成長の恒常性制御のアンカップリング、P糖タンパク質などの排出トランスポーターの過剰発現などによる薬物療法への抵抗性、周辺組織への積極的な浸潤などがある。キナーゼ阻害療法や免疫チェックポイント療法などの新しいアプローチが効果を発揮し始めているが、細胞傷害性薬剤の使用は依然として腫瘍治療の柱となっている。26 , 27 ここでも、これらの薬剤は、幅広い細胞増殖プロセスに影響を及す。細胞障害性薬剤の副作用は、特に消化器系への影響が顕著であるが、より深刻な長期的な遺伝的影響が生じることもある。例えば、化学療法剤であるシクロホスファミド、マイトマイシンC、プロカルバジンをマウスに投与したところ、子孫の精子や骨髄で単純タンデムリピート変異頻度が有意に上昇するなど、明らかにゲノム全体が不安定になった28。このように、抗がん剤治療の世代間効果は、治療を受けた親の子供を危険にさらす可能性があり、化学療法を受ける妊娠可能年齢の患者には、子孫への影響の可能性を警告する必要があると考えられる。感染症と同様に、非特異的な細胞静菌療法による副次的なダメージは、将来の世代の健康を脅かす可能性が十分にあり、高度に特異的なマルチターゲティングがより良い選択肢である可能性がある。実際、最新の情報に基づく研究では、様々な種類の腫瘍において、翻訳後に制御不能となった機能的なマスターレギュレータータンパク質からなる再発性の制御構造が存在することが示唆されている29。このマスターレギュレータータンパク質のネットワークを多重に標的とすることは、試験管内試験のスクリーニングから始めることも可能であり、がん治療の先鞭をつけることができるかもしれない。
2.2. 生物学的システムの不均一性と動的変動性
色盲の狙撃手にとって、赤や緑の色を使って標的を特定することは、明らかに狙いにくいものである。しかし、標的分子の遺伝的変異は、薬理学者にとってはるかに複雑な問題である。多くの実験条件下では、ハイブリドーマ細胞株や近親交配した実験動物種を使用することで、どこで実験を行っても細胞や生物の遺伝的背景が類似していることが保証される。遺伝的背景をある程度一定に保つことで、標準化された条件下での細胞や生理的反応も比較的一定に保たれることが期待されている。しかし、残念ながら必ずしもそうとは限らない。
遺伝的背景が同じであっても、異なる細胞培地を使用したり、細胞株の継代を変えたり、培養条件を変えて増殖速度を変えたりした場合、遺伝子発現はどうなるのであろうか?多くの細胞生物学者は、細胞株を長期間培養すると、何らかの遺伝子サイレンシングによって反応しなくなるという事実をよく知っている。しかし、最近の研究では、炎症や虚血などでpHや酸素濃度が変化すると、細胞の反応が大きく異なることが明らかになっている。その結果、試験薬の効果も変わってくる(www.ddw-online.com/therapeutics/p315005)。さらに、細胞刺激は、最終的に同じ細胞産物を生成し、同じような結果になるという理由で、科学者たちによってまとめられることが多い。例えば、マクロファージによるプロスタグランジン(PG)E2の産生は、何十年もの間、「炎症刺激」に対する反応を示す実験的な指標として用いられてきた30。これは病理学的な状況と一致しているが、抗原抗体複合体、カルシウムイオンフォア、または貪食作用によるマクロファージの刺激後のPGE2の産生は、異なるシグナル伝達経路の影響下で、異なる表現型の細胞から生じる。最も重要なことは、PGE2が抗炎症作用を発揮することである。これには、ファゴサイトーシスの抑制や、急性炎症が治まる解決期のトリガーが含まれる。31, 32, 33 したがって、炎症刺激の種類、細胞を採取する時間と炎症段階、および測定される反応の種類によって、試験される化合物の効果が著しく変化する可能性がある(セクション5.時間、年齢、および疾患の消失も参照)。標準化された細胞または生物学的試験系から特定の薬理学的または表現型の反応を引き出すために定義された刺激を使用することは、上述の問題の多くを解決するように思われる。様々な研究室で、薬理学的介入に対する反応をより簡単に比較することができる。問題は、自然は公平ではないということであり、一つの疾患症候群は、様々な異なる誘因物質の結果である可能性がある。したがって、薬物スクリーニングは、可能な限り対象となる疾患環境を反映した環境下で実施する必要がある。
マクロファージの遺伝子発現は、翻訳後のエピジェネティックな修飾の影響を受けやすく、ある遺伝子は抑制され、別の遺伝子は活性化される34, 35。その結果、マクロファージは、古典的な炎症性のM1から、抗炎症性で代替的に活性化するM2マクロファージまで、幅広い表現型を発現することができる。さらに、マクロファージが特定の表現型に分極することは、代謝によって厳密に制御されているため、グルコースやpHなどの栄養素が変化すると、細胞の遺伝子発現プロファイルも変化する37。これは、炎症刺激によるクエン酸(Krebs)サイクルの「再配線」と関係しているようで、クエン酸、コハク酸、フマル酸などのサイクルの単純な生成物が、マクロファージや樹状細胞の機能に顕著な変化を及ぼしている38。また、最近、ヒトの初代マクロファージとTHP-1マクロファージ細胞株の安静時の極性状態が異なり、後者の方がM1状態に偏っており、それに伴って遺伝子発現プロファイルが変化することを明らかにした39。このように、細胞株や初代細胞、特に白血球など、同じ細胞でも形態が異なれば、必ずしも同じような反応を示すとは限らない。したがって、この種の細胞に対する薬理作用をより正確に評価するためには、生理学的に関連したさまざまな刺激下で、遺伝子発現、細胞シグナル伝達、表面分子の発現変化を評価し、分泌物を測定しながら、さまざまな細胞の表現型を選択することが重要である。様々な薬剤が試験管内試験および生体内試験でマクロファージの表現型を変化させることが報告されている40, 41ので、薬理学的メカニズムの違いを明らかにするためには、反応のスペクトルを注意深く分析する必要がある。
2.3. エピジェネティックな変化
ヒストンのアセチル化やメチル化、DNAのメチル化など、エピジェネティックなメカニズムによる遺伝子制御は、多くの細胞で広く報告されている。このようなメカニズムは、がんの病因に重要な役割を果たしていることが報告されており、いくつかの種類のがんにおける腫瘍増殖の阻害剤として、ヒストン脱アセチル化酵素(HDAC)阻害剤であるボリノスタット、ロミデプシン、ベリノスタット、パノビノスタットが導入された42。しかしながら、これらの薬剤は、それぞれ特異性や機能が異なる異なるHDACタイプの汎阻害剤であるため、臨床的には顕著な副作用があるとされている。さらに、ヒストンだけでなく、アセチル化を受ける他のタンパク質もHDAC活性の影響を受ける可能性がある。興味深いことに、転写因子である核内因子κB(Nuclear Factor κB)の阻害剤を用いてがん関連の炎症を抑制すると、HDAC阻害剤と相乗的に作用して副作用が軽減される可能性があり、疾患に対する薬物療法の併用が有効であることが示されている43。
健康な細胞や形質転換した細胞に見られるエピジェネティックな変化は、しばしば数時間または数日しか実験的に研究されないことがある。このような場合、エピジェネティックな変化は、遺伝的な変化というよりも、むしろ細胞のシグナル伝達の反応として捉えるべきである。エピジェネティックな遺伝性を評価するには、長期的な変化を評価する方がよい。これは、ゼブラフィッシュや昆虫では、世代交代が哺乳類よりもはるかに速いので、非常に効果的に行うことができる44, 45。しかし、鎮痛剤をはじめとする他の種類の薬剤は、ヒストンのアセチル化やDNAのメチル化などのエピジェネティックなマーカーを修飾することができる46, 47。したがって、遺伝子の翻訳後のサイレンシングやアクティベーションは、次の世代にも引き継がれる可能性がある。この点については、雄のマウスに標準的な化学療法剤を投与すると、子孫が世代を超えて不安定になるという前述の知見があり、警告が発せられている28。自然集団における変動は、環境や感染によって引き起こされる翻訳後の遺伝子修飾によって引き起こされることが多く、薬物治療も修飾因子の一つに含める必要がある可能性が高い48。
3. 自動免疫
可変性は、免疫反応の本質的な特徴であり、適応免疫が膨大な抗原決定基のレパートリーに向けられることを可能にする。細胞表面分子の発現、細胞の表現型、および亜集団は頻繁に変化し、細胞は血液やリンパ液中だけでなく、粘膜を越えて、臓器や組織に出入りしながら、体内を絶えず移動している。しかし、それに加えて、十分に考慮されていない多くの要因もまた、予想外の変動を引き起こし、自己免疫疾患の病態の調査を危うくしている。交通機関の例え話をすると、免疫治療薬は、免疫反応を止めたり、遅らせたり、方向転換させたりするために導入される交通信号と見なすことができる。
3.1. 自己免疫のモデル
自己免疫疾患の実験モデルの誘導に対する感度は、使用する動物の系統の遺伝的背景に大きく影響され、しばしば薬剤に対する反応が異なる表現型をもたらす。例えば、多発性硬化症の実験モデルとしては、実験的自己免疫性脳脊髄炎(EAE)が広く用いられている。これは、C57BL/6マウスに、中枢神経系の重要な自己抗原であるミエリンオリゴデンドロサイト糖タンパク質を、免疫学的アジュバントであるフロイント完全アジュバント(FCA、パラフィン油中で結核菌を殺したもの)で投与し、血液脳関門を伝染性にするために百日咳毒素を含む、または含まない状態で、免疫学的チャレンジを行うことにより、一般的に誘発されるものである。動物は進行性の麻痺を起こし、それを記録することができる49。このモデルでの活性に基づいて、さまざまな活性化合物や市販薬が開発されていた。しかし、多発性硬化症患者のうち、慢性進行型の疾患を示すのは少数派である。患者の85%が発症する、より一般的な再発型は、SJLマウスにFCAでミエリンプロテオリピドタンパク質を百日咳毒素でチャレンジした後や、ダークアグーチラットにFCAでラット脊髄ホモジネートをチャレンジした後に、よりよく再現することができる。我々は最近、既に市販されている薬剤を評価する場合でも、全てのEAEモデルが既に承認されている治療法に対して同様の反応性を示すわけではないことを示した50。しかし、クリニカルスコアの評価ではほとんど反応性を示さないモデルであっても、行動や社会的相互作用など、より臨床的に関連性の高い変数を同時に使用することで、予想外の有効性が明らかになった。また、EAEの機械的な痛みに対する感受性も、SJLマウスとC57BL/6マウスで異なることが報告されている51。ここから得られる教訓は、実験モデルの遺伝的および表現型の多様性を部分的に考慮して、遺伝的に感受性の高いさまざまな系統と、翻訳に適した評価方法を選択することで、薬効をより正確に把握できる有効性プロファイルを作成できるということである。
免疫攻撃に対するウイルスの感受性と同様に、エピトープドリフトや遺伝子拡散も自己免疫疾患の発症時に起こり、薬効の解釈を複雑にする。その結果、免疫系は、最初に特異的な免疫反応が誘導された特定の外部化学物質の抗原分子を超えて、抗原分子を認識するようになる52。したがって、多くの慢性自己免疫疾患の後期段階では、根本的な欠陥を特定することは困難である。遺伝子やバイオマーカーの研究は、HLA-DR4変異体や関節リウマチの抗シトルリンタンパク質抗体のように、疾患の共通因子を浮き彫りにすることがあり、それが治療のために患者を層別化するのに役立つ53が、薬物療法の効果を評価する際には、様々な疾患の評価が必要であることを改めて強調している。しかし、エピトープドリフトは、自己免疫の実験モデルの使用を複雑にする。私たちの一人(MJP)は、何年も前に、アジュバント誘発関節炎を発症したLewisおよびWistar系ラットのリンパ節リンパ球の組織傷害効果に関する一連の研究を行ったことをよく覚えている54, 55。その際、おそらくエピトープドリフトのために、時間とともにリンパ球の反応性が徐々に失われ、プロジェクトを中止せざるを得なかった。これらの観察結果は、2つの異なる業者から入手したSprague Dawleyラットに誘発されたアジュバント関節炎に関する他の著者による研究結果によっても支持されている56。2つの業者から入手したラットは、関節炎に対する感受性、免疫反応(各種炎症性サイトカイン)および内分泌反応(血漿ACTHおよびコルチコステロン)が異なっていた。著者らは、2つのコロニーにおける異なるタイプの遺伝子ドリフトが原因である可能性を示唆しているが、これは以前の論文でも指摘されている57。この反応性はかなり異なると推測され、研究者が必ずしも同じ反応を評価していないことを示している。
3.2. 食事、微生物叢、免疫反応
バランスのとれた食生活は、代謝や心血管の健康に不可欠であるが、食生活の変化は(自己)免疫にも顕著な影響を与える。さらに、T細胞、マクロファージ、樹状細胞の機能の変化は、それらの代謝状態と密接に関連していることが明らかになっている。38, 58 ほとんどの実験動物は標準的な実験食を与えられているため、免疫反応の変化は一般的に投与された免疫刺激によるものであるが、これは食事条件が大きく変化する臨床状況には必ずしも当てはまらない。ヒトのボランティアを対象とした第1相臨床試験では食事をコントロールすることができるが、後期の臨床試験ではそのような食事のコントロールははるかに困難である。様々な種類の脂肪酸、微量元素、ビタミンを豊富に含む果物の摂取は、すべて免疫反応に影響を与える。例えば、亜鉛とセレンを十分に摂取することは、免疫系が効果的に機能するために必要である59。特に亜鉛は、T細胞シグナル伝達の補因子として重要であり、それによってTリンパ球の分化と成熟を促進し、食細胞とNK細胞の機能を促進する59。セレンは、抗酸化物質であるグルタチオンペルオキシダーゼファミリーの酵素や、チオレドキシンリダクターゼなどの内因性セレノプロテインの機能に不可欠である。セレンの欠乏は好中球やリンパ球の欠陥と関連しているが、これはおそらく酸化的な損傷から膜が十分に保護されていないことが原因である62。また、乳酸菌などのプロバイオティクスは、腸内細菌叢の構成を変化させるだけでなく、自然免疫を促進するという証拠も増えている。このようにして、プロバイオティクスは間接的に適応免疫を高めることができるのである。私たちの一人(MJP)が関与したある研究では、必須脂肪酸欠乏食を与えた実験用ラットのさまざまな実験で得られた血小板と炎症性滲出液から、PGE2を含むエイコサノイド代謝物を数年間にわたって測定した。66 結局、その原因は、飼料メーカーが必須脂肪酸の欠乏を保証するために使用する油の供給源を予告なしに変更したことであることが判明した。
一方、食事に含まれる脂肪酸の種類を変えることで、生成されるエイコサノイドの構造上の種類に顕著な影響を与えることがわかってきた。例えば、魚類に多く含まれるオメガ3脂肪酸の摂取量を増やすと、n-6系脂肪酸であるアラキドン酸がPGE2などの代謝物に変換される量が減り、生物学的活性が異なる、あるいは限定された代謝物が合成されるようになるほか、炎症性メディエーターの産生をそれ自体で抑制する効果を発揮する59, 67 さらに、オメガ3脂肪酸は、腸内細菌叢の構成を変化させ、炎症を起こしにくい細菌を促進する68。SFBは、腸のパイエル板において、粘膜IgAの産生とTh17エフェクター細胞の形成を促進する。この結果、大腸炎、自己免疫性脳脊髄炎、関節炎のマウスモデルでは炎症が悪化するが、糖尿病からは保護される。69 薬物の代謝と効果に対する腸内細菌叢の影響については、7章で検討する。
意外なことに、食事の有無が薬物の経口吸収に影響することはよく知られているが、さまざまな食事成分が薬物への反応に及ぼす影響を調べる研究はほとんど行われていない。ラットの妊娠中に亜セレン酸ナトリウムを補給すると、サリチル酸ナトリウムの同時投与による胚毒性からの生存率が高まることが報告されているが、そのメカニズムは不明である70。実験的に肺腫瘍を誘発したヌードマウスに高脂肪食(リノール酸12%wt/wt)を与えたところ、NSAIDであるインドメタシンを併用することで腫瘍の成長が有意に抑えられることが分かった71。しかし、906人の大腸がん患者を対象とした縦断的な臨床研究では、低脂肪食とアスピリン投与ががん発生率に及ぼす正の相互作用は観察されなかった72。このように、食事成分の変化は免疫反応に顕著な影響を与えるが、そのような食事の変化が薬効を変化させるかどうかを評価するには多くの課題が残されている。このような試みは、生物学的交通機関が使用する燃料を、より「環境に優しい」形に変更する試みとみなすことができるかもしれない。
4. クロノバイオロジー
分子や細胞の柔軟性や移動性だけで、すべての薬理学的可塑性を説明できないのは確かである。外部環境の変化は、エピジェネティックプロファイル、栄養状態、腸内細菌叢の変化に加えて、標的とその薬物への反応をも変化させる。例えば、旅行好きの現代人には、さらなる制約がある。時差ボケ、不眠、集中力の欠如、季節や日照時間の変化への適応の難しさなど、大陸間の空の旅がもたらす身体的な問題については、ほとんどの人が知っていることであろう。73 時差ぼけは、主に、体内時計の主役である視交叉上核が光によって変化し、それが周辺部の変化に影響を与えることで起こる。73 時差ぼけは、主に光によって視交叉上核が変化し、それが末梢の変化に影響を与え、松果体からのメラトニンの分泌が変化して睡眠・覚醒サイクルが変化することで生じる。光によって松果体ホルモンのメラトニンが分泌されることで、私たちの睡眠行動が調整されるだけでなく、病気の経過も光によって調整される75。
例えば、リウマチ性疾患によく見られる症状である「朝のこわばり」は、視床下部-下垂体-副腎軸の日中の調節と内因性の抗炎症作用を持つコルチゾールレベルが患者の中で乱れていることに起因しており、ラットの実験的関節炎におけるコルチコステロンでも見られる76。コルチゾールレベルは早朝に患者で不適切に低下し、これは、逆の概日周期を持つ末梢血単核細胞数と炎症性サイトカインの変化に反映される77。正常な概日リズムの回復は、昔、リウマチ性疾患の患者が日当たりの良い国の療養所に送られるとかなり改善した理由であり、様々な疾患における睡眠の再生効果の一部を説明するのに役立つだろう。また、末梢の細胞や組織におけるグルココルチコイドの受容体の発現は、HPA軸の概日リズムに応じて変化するため、治療用コルチコステロイドに対する組織の感受性も変化する。さらに、血圧も概日リズムに支配されており、最適な効果を得るためには、降圧治療を就寝時に行うべきであると提唱されている79。
痛みにも概日リズムが存在し、最も重要なことは、メラトニン自体が鎮痛作用を発揮すると考えられていることである81。同様に、呼吸器系疾患、アレルギー反応、胃腸障害も光の変化に左右される。重度の敗血症で何日も集中治療室に入れられている患者では、概日リズムが乱れているという証拠が増えている。コントラストを強めて明暗の差を最小にしたり、メラトニンを投与したりして明暗サイクルを修正すると、病状の改善に有益な効果が得られる。75, 82, 83 少なくとも免疫炎症性疾患では、強力な抗酸化剤であり抗炎症剤でもあるメラトニンの循環濃度が免疫病理に直接影響を及ぼす可能性があることを指摘しておく必要がある。
このような周期的な変化は、24時間の明暗期間に生じる日周性のものだけではなく、日照時間が短くなったり長くなったりした結果、季節性(周年性)の変化が生じる。実験動物は管理された状態で飼育されているので、このことに大きな意味はない。しかし、人間の多くの薬物に対する薬理反応は、概日リズムと日周リズムの両方に依存している可能性が高いと考えられている。最近、白血球や脂肪組織の免疫系に関連する400の遺伝子が非常に顕著な概日変動を示すことが明らかになった85。ヨーロッパでは、抗炎症性概日転写因子であるアリル炭化水素受容体核トランスロケーター様などの抗炎症性遺伝子の発現が7月にピークを迎え、インターロイキン6などの炎症性遺伝子の発現が12月に逆に低下する。オセアニアではその逆のパターンが見られる。
少なくとも人間の場合は、健康的な食事、規則正しい睡眠、運動を導入することで、多くのバイオリズムを同期させ、創薬ターゲットを安定させることができる。興味深いことに、このような生活習慣の改善は、生物学的老化の程度を反映するクロマチンの変化に明らかな影響を与える。86 この発見は、加齢による劣化や有害な突然変異に関連するエピジェネティックなプロセスを、薬物、食事、運動によって修正する可能性を示すさらなる証拠となる。
5. 時間、年齢、そして病気の解決
バイオリズムが創薬ターゲットの特性を変化させるだけでなく、生理学的・病理学的プロセスも時間とともに変化する。生体分子、特にタンパク質は、非常にダイナミックで相互作用的であり、その位置を変化させ、修飾を受ける。87 一般的に、神経変性疾患におけるタウタンパク質やプリオン、動脈硬化におけるリポタンパク質のように、時間の経過とともに動きが鈍くなり、柔軟性が失われたり、機能が低下したりするが、これは主に酸化ストレスの増加によるものである88, 89 時間が経過すると、タンパク質の受容体の脱感作や細胞の老化が原因で、薬効が失われるタキフィラキシーが起こり、ターゲットにヒットしても効果が認められなくなる90, 91 交通機関に例えると、交通機関の一部がゆっくり動き出したり、故障したりして渋滞が発生する。このように、時間の影響が最も顕著に現れるのは、高齢化社会で大きな問題となる加齢の影響である。
高齢者は病気にかかりやすい。これは正常な生理機能(特に腎機能)が低下していることに加えて、防御・修復機構が機能していないことが原因である。高齢者では、自然免疫系のすべての細胞に影響を及ぼす自然免疫老化の進行に伴って、粘膜のバリア機能が徐々に低下していく92。94 スコットランドのTayside地域で、成人310,000人を対象に15年間にわたって行われた地域調剤の処方データを横断的に分析したところ、1日に15種類以上の調剤を受けている患者の81%が深刻な相互作用を経験したのに対し、2〜4種類の薬剤が処方されている患者では11%しか経験しなかった95。このような状況は、前述の「小さな的を狙うために散弾銃を持っていくと、不必要な巻き添えを食らう」という例に似ている。多くの高齢者のためにも、定期的に薬の数や量を見直すことは非常に望ましいことである。筆者らは、薬の投与量を大幅に減らしたところ、病状が大幅に改善した高齢患者を何人か知っている。少ない方が良い場合もある。実際、最近の報告では、糖尿病患者の薬物治療の複雑さを軽減したところ、血糖値のコントロールが改善したことが報告されている96。しかし、著者らは、複数の病的状態を抱える高齢患者の場合、これらの患者を適切に治療するために「適切なポリファーマシー」が必要になる可能性があることをよく理解している97。ほとんどの場合、複数の疾患を併発している患者において、個々の疾患のみを対象としたそれぞれのガイドラインで推奨されている薬剤を単純に組み合わせて使用することは不適切である。
市販されている医薬品の多くは、特定の作用機序に基づいて導入されており、多くの場合、1つの主要な標的が関与している。薬剤の開発段階では、比較的新しい標的メカニズムの病態生理学的な役割が十分に理解されていないことがある。後になって、多くの場合、薬の臨床使用の結果として、疾患プロセスにおける標的メカニズムの病理学的役割が明らかになる。この明確化には、標的メカニズムが最も密接に関与し、したがって薬理学的介入を最も受けやすい疾患プロセスの時間またはフェーズも含まれる。残念ながら、薬理学の理解が深まっても、有効性の最適化というよりは、副作用の抑制という観点から、既存の薬剤使用が変更されることが多いため、薬剤投与の最適なタイミングについての理解が深まっても、必ずしも疾患治療の変更につながるとは限らない。薬効発現のタイミングの重要性を示す例を2つ挙げることができる。
アセチルサリチル酸(アスピリン)は、150年近く前から抗炎症、鎮痛、解熱剤として使用されてきたが、現在では抗血小板剤や抗がん剤としても使用されている。年間2000トンのアセチルサリチル酸が合成されていると推定されているが、多くの場合、他の非ステロイド性抗炎症薬(NSAIDs)とともに、明らかに過剰に使用されている。98 ほとんどの患者、そしておそらく処方する医師が気づいていないのは、NSAIDsは一般的に痛みや炎症を対症療法的に緩和するだけで、急性炎症の時間経過にはほとんど影響しないという事実である。この場合、初期の炎症症状を軽減し、活発に生成される内因性の分解促進脂質メディエーターを阻害する可能性を避けるために、NSAIDsを短期間のみ使用することが望ましい100。
炎症の収束を促進する薬剤としては、分解能力の高いマクロファージM2表現型の生成を促進するアジスロマイシンなどのマクロライド系抗生物質がある。マクロライド系抗生物質は、市中肺炎や慢性閉塞性肺疾患の急性増悪などの呼吸器感染症や、稀な炎症性肺疾患であるびまん性汎細気管支炎の治療に特に有効であることが知られている。マクロライド系抗生物質は、白血球に蓄積し、最初に好中球の機能を刺激して抗菌作用を発揮する。その結果、数日間の投与で済むマクロライド系抗菌薬は、限られた炎症性疾患において、より長期的に使用されるようになった。さらに、アジスロマイシンがM2マクロファージの表現型を促進する能力は、脳虚血傷害の治療にも役立つ可能性があることが示されている103。治療を成功させるためには、治療対象となる疾患の時期や段階も重要である。
薬剤の作用時間は、標的との相互作用を評価する上でのさらなる要因となる。この記事では、薬物標的分子の分子内ダイナミクスについてはあまり触れなかったが、薬物の作用時間に影響を与える薬物-リガンド結合の1つの側面については言及する価値がある。薬物-標的滞留時間モデルは、薬物とその分子標的との相互作用を説明する上で、この10年間で受け入れられるようになってきた。104 これまでは、薬物の受容体への親和性が理論的考察の中心であったが、新しい理論では、薬物が受容体に関与する時間という観点から薬物-受容体相互作用を評価する。薬物が標的となる受容体から解離するのが遅ければ遅いほど、その作用時間は長くなる。潜在的には、薬物がその作用部位に留まっていれば、その効果が長くなるはずである。アジスロマイシンの場合、白血球に急速に蓄積されるが、細胞からゆっくりとしか放出されないため、溶解促進作用や免疫調節作用を発揮する時間が確保されることから、実際にこのようなケースが考えられる105。受容体への内在性活性が中程度で作用時間が長い薬剤と、内在性活性が高い強力な短時間作用型薬剤の有効性を比較することは、特に慢性疾患の治療において、非常に興味深いことである。何かサプライズがあるかもしれない。
6. 性差
かつては、内因性のホルモン変化による感度の「不都合な」変化を避けるために、薬剤候補の前臨床試験はもっぱら雄の動物を用いて行われてた。しかし、薬物に対する女性の反応が男性のそれとは異なることが明らかになっていた。これらの違いは、疾患感受性の性差に始まり、おそらくは性染色体の結合に起因するものであるが、ホルモンや代謝の違い、体質、性別特有の生活習慣にも起因する。このことは、男性よりも女性に多く見られる自己免疫疾患に顕著に表れている。全身性エリテマトーデスやシェーグレン病は主に女性に発症するが、全身性硬化症は男性よりも女性の方が4倍、関節リウマチは2〜3倍、多発性硬化症は2倍多く発症する107, 108 また、女性は男性よりも一般的に高い抗体反応を示し、ワクチン接種による副反応も多く見られる109。一方、敗血症は女性ではあまり顕著ではなく111,ヒトの急性血管炎症の生理的解決は、男性よりも女性の方が効果的であるようである112。このことは、女性において慢性炎症性疾患の後遺症がより重篤になるのは、このような効果的な解決メカニズムの破綻が、少なくとも部分的には原因であることを示唆している。
興味深いことに、性ホルモンの神経免疫系への影響は、よく知られている女性の慢性的な痛みの発生率の高さや痛みに対する感受性の増加も説明しているようである113。統合失調症は、若い男性(2:1)の方が女性よりも頻度が高いが、エストラジオールの保護作用のためか、成人になるとこの比率は逆転する114。したがって、その後の臨床開発、特に自己免疫疾患や神経疾患の観点からは、初期の化合物試験に雌の動物、少なくとも両性の動物を使用することがより適切である115。実際、米国国立衛生研究所は、前臨床研究において、動物と細胞の性別をバランスよく配置することを推奨している116。米国連邦医薬品局は、製薬会社や医療機器メーカーに対し、男女両方の臨床試験データを提供することを奨励している117。ただし、これは統計上の理由から、試験に参加する動物や被験者の数が増えることを意味し、各国の規制当局はこの事実を考慮する必要がある。
薬物の薬理作用にも性差があり、特に心血管系への影響に関連して、その一部が最近見直されている118。この変動は部分的には遺伝的なものであるが、例えばβ受容体の感受性には性差があることが示唆されている。118 この総説の著者は、性に基づく反応を区別できるように臨床試験をデザインし、性ホルモンの交絡効果を明確に評価することが極めて重要であることを強調している。
7. 薬物の代謝と分布
薬物に対する反応の可塑性の最も確立された原因であり、薬物が標的を逃す主な理由は、体内での動態にある。例えば、性ホルモンは、胃腸管のpHや運動性だけでなく、酸化代謝酵素や膜輸送タンパク質の発現にも影響を与える118。もっと広く言えば、多くの薬物代謝酵素の遺伝子多型は、臨床試験における適切な投与量の決定をかなり複雑にする。シトクロムP450(CYP)による酸化的代謝における多型は、非常によく知られており、併用する薬物療法間の代謝干渉という観点から、潜在的な薬物間相互作用の評価に関する明確なガイドラインの基礎となっている94, 119, 120。先に述べたように、このような代謝相互作用は、高齢者ではさらに重要になる。高齢者では、ポリファーマシーが一般的であり、代謝率が低下するため、相互作用が起こりやすくなる。94 運動やスポーツは一方で、喫煙などの要因は代謝酵素の発現に大きな影響を与える。このような影響には、血液や骨格筋の細胞における重要な代謝調節酵素であるアデノシン一リン酸活性化プロテインキナーゼのメチル化の不連続な変化などがある121。その結果、ライフスタイルの変化は、時間生物学との関連で前述したように、病気に対する感受性に影響を与えるだけでなく、薬物の代謝にも影響を与える可能性がある。
腸内細菌叢は、薬物の代謝に大きな影響を及す。尿毒症の溶質、胆汁酸、ステロイドホルモンの腸内細菌叢による代謝は、第I相CYPを介した酸化反応と、グルタチオン-S-トランスフェラーゼや硫酸転移酵素などの第II相薬物共役酵素の両方を変化させ、多くの薬物の代謝に影響を与える122。逆に、細菌の酵素はいくつかの薬物を直接代謝し、その効能に影響を与える。例えば、大腸に存在する細菌のアゾレダクターゼは、炎症性腸疾患であるクローン病や潰瘍性大腸炎に用いられる薬剤であるスルファサラジンを分解し、活性代謝物である5-アミノサリチル酸(5-ASA)とスルファピリジンを生成する。しかし、ラットの2,4,6-トリニトロベンゼンスルホン酸(TNBS)誘発大腸炎モデルでは、スルファサラジン自体が、短鎖脂肪酸(SCFA)産生菌や乳酸産生菌の増加やプロテオバクテリアの減少など、TNBS誘発の腸内細菌叢の異常を回復させ、大腸炎を改善させることができた123。また、腸内細菌によるSCFA産生の促進は、2型糖尿病治療薬であるメトホルミンが糖代謝や心血管反応を変化させるメカニズムの一つであると考えられている124。このように、食事や生活習慣の違いによる腸内細菌叢の変化は、同じ系統のげっ歯類であっても、薬物の代謝や効果を変化させる可能性がある。56 実際、2つのサプライヤーから提供された3つの異なるマウス系統の腸内細菌叢を広範に配列解析したところ、サプライヤーが異なる同じ系統の間で細菌組成にかなりの違いがあることが明らかになった125。
薬物トランスポーター蛋白質の多型は、薬物の代謝挙動だけでなく、臓器、組織、細胞への特異的な分布にも影響を及ぼすため、より微妙な問題となる。一方、薬物トランスポーターの違いは、薬物の肝輸送や腎臓からの排泄に影響を与えることが知られているが、これらのトランスポータータンパク質が他の組織や臓器への薬物輸送にも影響を与えることは注目に値する。例えば、有機アニオン輸送ポリペプチド(OATP)は、マクロライド系抗生物質の腸管吸収を制御している128。OATP 1A2は、脳で最も多く発現しており、血液脳関門を通過する薬物輸送を制御しているようである129。患者のOATP多型をスクリーニングすることで、関連する薬剤による治療を最適化できる可能性がある。
このように、ファーマコビジランスは、偶発的または予期せぬ薬物-薬物代謝相互作用の臨床報告を評価するだけでなく、文献から得られた新しいデータに基づいて、保護措置またはスクリーニング措置を推奨したり、高齢者のように既存の処方行動を修正するように求めたりして、積極的に実施する必要がある。
薬物の作用時間を長くするために、特にその処方において、薬物代謝の変動に対抗するために、様々な技術的アプローチが可能である。これには、吸収を遅らせたり、製剤から有効成分を徐放することができる賦形剤を使用したり、輸送メカニズムを乗っ取ったりすることが含まれる131, 132。薬物分子に水素の代わりに重水素(重い水素原子)を導入すると、炭素との結合が強くなるため、質量分析による薬物分析のための参照化合物の合成に広く用いられている。また、ドパミン減少薬であるテトラベナジンは、ハンチントン病だけでなく、運動機能亢進症の治療薬としても古くから使用されている。テトラベナジンの分子に重水素を導入することで、その部位での代謝を遅らせ、血漿中のピーク濃度と潜在的な副作用を低減できることが示された133, 134。
8. 結論と今後の展望
薬理学的薬剤に対する哺乳類生物の膨大な変動性と可塑性を考慮すると、薬剤が常に我々の期待する利益をもたらすとは限らないことは全く不思議ではない。実際、新薬が発売されても、多くの人々におけるその有効性についてはほとんど分かっていないことを認めざるを得ない。そのため、多くの医薬品が不適切な状態で頻繁に処方され、患者はそのような治療を必要としない状態でも薬を飲みたがる。これに加えて、ノンアドヒアランスも大きな問題となっている。
モノクローナル抗体のような特異性の高い薬剤を除けば、Ehrlichの魔法の弾丸のように、単一の標的に単一の特異的な薬剤を使用するという合理的な薬物療法のアプローチを再考する価値があるかもしれない。むしろ、ターゲットにヒットさせることを困難にしている複数の要因を考慮し、段階的、多因子的、マルチターゲティング的なアプローチを用いてみるべきである。この手法は自然界にも十分な例がある。雌ライオンが動きの速いカモシカを狩るときは、集団で狩りをする。最初はカモシカが動ける範囲を狭め、一人が怪我をさせて獲物の動きを鈍らせてから、他の人が仕留めるという方法である。軍事行動でも同じように、優勢な相手の動きを鈍らせたり、ダメージを与えたりすることで、破壊しやすくする。冒頭の比喩を使えば、主要道路の交差点で時々起こる車の異常な動きは、車を特定の車線に強制的に誘導し、協調的な信号機を導入することでコントロールすることができる。渋滞の可能性が大幅に減る。
薬理学的には、異なる薬剤を協調して使用することで達成される。例えば、著者らは、PGE2の生成と作用(ホスホリパーゼA2による基質の放出、シクロオキシゲナーゼとミクロソームPGE合成酵素によるアラキドン酸の代謝、最終的にPGE2のさまざまな受容体への作用)の異なる段階で作用する低用量の抗炎症性鎮痛薬を組み合わせて使用することを提案した。このようにして、NSAIDsによるシクロオキシゲナーゼの顕著な阻害に起因する胃や心血管への悪影響を大幅に軽減することができる。また、光やメラトニンを用いて免疫反応や神経障害を制御し、最終的なターゲットを治療しやすくすることも可能である。また、制御不能ながんなどの細胞の成長を遅らせて、より特異的なメカニズムを標的とするための時間を確保することもできる。このように、2〜3種類の薬理作用を持つ薬剤を連続して使用することで、標的メカニズムの本質的な不安定さのために限られた患者にしか効果がない単一の強力な薬剤よりも、より高い効果が得られると考えられる。このようなアプローチは、高血圧症の治療において、例えば利尿薬にサルタンやカルシウム拮抗薬を併用することで、一貫して血圧を低下させることができるという点で、すでに有効に活用されている137。
私たちは、薬理学的可塑性の影響を最小限に抑えるために、単独または組み合わせて取ることができる、すでに存在する4つのアプローチ(図(図4)4)を強調する。
図4 薬理学的可塑性を抑えるための薬物治療法の提案
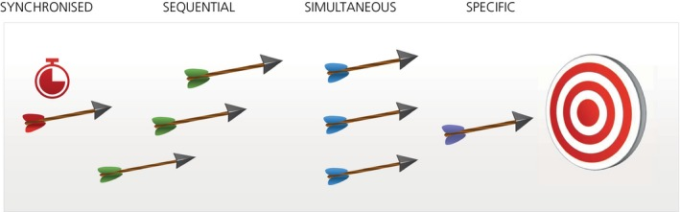
SPECIFIC/特異性
薬物を単一または複数の標的に向ける場合、その目的は正確でなければならず、オフターゲット効果を回避できる可能性が高くなる。薬物の標的化には長い歴史があり、何年もかけて改良されてきたにもかかわらず、薬物設計の段階で化学的特異性を向上させる余地が残されている。興味深いことに、最近、300万個以上の化合物を用いた詳細なドッキング研究により、単一の受容体に作用する化合物の効果を、下流のシグナル伝達プロセスのいずれかに偏らせることが可能であることが明らかになった。μ-オピオイド受容体にドッキングしたところ、Gタンパク質Giを介したシグナル伝達を優先的に活性化し、明らかな鎮痛作用を示した化合物が、呼吸抑制、便秘、耐性などの副作用を伴うβ-アレスリン経路のシグナル伝達を避けて同定された138。
さらに、スクリーニングの条件は、想定される疾患ターゲットの身近な環境で起こっていることをできる限り反映させる必要がある。最近のレビューでは、適切な試験管内試験スクリーニング細胞システムを構築するために、ゲノムの背景、細胞の不均一性、培養条件、関連する刺激などの一般的な原則が示されている139。 既知の薬剤を新たな適応症に再利用することでも、より特異性を高めることができる。この観点から、治療上有益な可能性のあるオフターゲットの薬理作用を明確にするために、様々なオフターゲット作用を有するキナーゼ阻害剤の試験管内試験の選択を容易にするガイドラインが提案されている。このようなコントロールしにくい変数を把握するためには、参照化合物を有効に活用することが不可欠である。そのためには、基準化合物の反応がどのような条件下でも変わらないかどうか、また、試験状況から得られる薬理学的反応が期待通りのものであるかどうかを確認する必要がある。また、参照化合物はオフターゲット効果を持つ可能性があるため、その作用機序を示すバイオマーカーを含める必要がある。
SIMULTANEOUS/同時
複数のメカニズムを一度に標的とすること。現在は、複数の薬剤を用いて疾患を治療するのが一般的である。高齢者の場合、この方法では問題が生じることがわかっている。個々の薬剤が複数の関連する作用を持つように開発できることが望ましい。最近の研究では、単一の低分子化合物で複数の標的を同時に攻撃できる可能性が示唆されている。最近、代謝性疾患の治療薬として、部分的なPPARγアゴニスト、強力なCOX-2アンタゴニスト(ナノモルIC50値)中程度の15-LOXインヒビター(マイクロモルIC50値)の作用を持つグリタゾン化合物が報告されている。これらの化合物は、試験管内試験のマクロファージおよび生体内試験の急性炎症において抗炎症作用を示した141。この活性がすべての作用機序を必要とするのか、あるいは1つか2つの作用機序だけに起因するのかは、まだ確立されていない。マルチターゲティングの他のアプローチとしては、光に反応するロドプシンで特定の遺伝子をマークすることで神経回路を調節するオプトジェネティクスのようなネットワークターゲティング142や、単一のターゲットに基づくアッセイではなく、機能的な読み出しを用いた表現型アッセイがある。例えば、ベンジルピペリジン-アミノピリジンであるNSI-189は、試験管内試験でヒト海馬由来の神経幹細胞の一般的な神経発生を刺激し、認知やうつ病に対してマルチドメイン効果を発揮することが報告されており、表現型のマルチターゲティングが中枢神経系疾患にも有効であることが示唆されている145。課題は、臨床症状から逆算したリバース・ファーマコロジーにより、最初のスクリーニングで機能ターゲットとなりうる表現型や症状を特定することである。その後、活性のあるヒット化合物やリード化合物が同定されると、潜在的な作用機序を調べるために、ターゲットの分解を行わなければならない。最近では、疾患に関連する遺伝子発現プロファイルなど、疾患に関連する分子特性やシグネチャーの同定から始まる「翻訳可能性の連鎖」の確立が提案されている146。
また、さまざまなアッセイや測定結果を用いて、システムバイオロジーの手法でデータのパターンを評価することもできる。50, 147, 148 疼痛のように、標的が相互作用する複雑なメカニズムで構成されている場合、機能ゲノミクスに基づいた計算機的アプローチは、精度の向上に役立つ。
SEQUENTIAL/順序
ヒット/キルに移行する前に、上流の1つまたは複数のターゲット、下流の1つまたは複数のターゲットを順に狙うことで、ターゲットの動きを遅くすること。例えば、ジヒドロプテロ酸合成酵素の阻害剤であるスルファメトキサゾールと、ジヒドロ葉酸還元酵素の阻害剤であるトリメトプリムは、古くから単剤で使用されていた。これらは相乗的に作用して、細菌によるテトラヒドロ葉酸の合成を阻害する。さらに、このアプローチの例として、細胞シグナルパスウェイの異なる段階で作用する薬剤を順次組み合わせていく方法がある。いくつかの成長因子は、細胞の増殖と血管新生に重要な役割を果たすホスホイノシトール-3-キナーゼ/プロテインキナーゼB経路を介して作用する。この経路の下流のエフェクターは、制御タンパク質であるmammalian target of rapamycin (mTOR)である。抗がん剤であるドセタキソールを試験管内の腺がん細胞に24時間投与した後、mTOR阻害剤であるテムシロリムスを投与すると、mTORのリン酸化を抑制し、肺がん細胞株の増殖を抑制することで高い相乗効果が得られた150。同様の方法で、チロシンキナーゼ阻害剤に抵抗性を示す転移性腎細胞がん患者を対象に、チューブリン重合阻害剤であるBNC105PとmTOR阻害剤であるエベロリムスを併用する第2相試験が実施された151。
慢性疾患においては、エピジェネティックな変化を抑制し、その結果、クロマチンの老化プロセスを遅らせることが可能になり、患者は他の種類の治療を受けやすくなると考えられる。
SYNCHRONIZED/同期
薬物療法を最適化するために、食事、心理、トレーニング、バイオリズムの同期化を同時に行い、時間や年齢による反応の変化を考慮して(標準化して)行う方法
病院では、病気の患者さんを治療するために、さまざまな薬理学的、物理的、栄養学的、その他の処置が行われている。しかし、これまで述べてきたような様々な要因に同期した治療プログラムは稀である。前述の薬物代謝との関連で述べたように、腸内細菌叢を調整して薬効を向上させることには大きな可能性があると思われる。このように、腸内細菌群を調整することで、現在の抗がん化学療法の効果を高め、その毒性を低減することができるという証拠が増えてきている152。もちろん、人間のあらゆる病気の治療において、薬物療法は通常、患者の健康状態を改善するための手段の一つにすぎない。しかし、前臨床試験では、支持療法を実施するための最適な条件を評価することはあまりない。例えば、短期的な体重減少を引き起こすために臨床的に使用されている食欲抑制剤、ジエチルプロピオンの効果は、ラットの活動が最も活発な夜間に投与し、さらに高脂肪食の制限を行った場合に大きくなった153。例えば、慢性閉塞性肺疾患では、栄養と運動を組み合わせた介入を薬物療法と組み合わせて効果的に行うことができるという証拠が増えてきている154。いずれにしても、既存の薬であっても、薬の処方や使用方法に影響を与える可能性のある新しい知見を認識し、警戒することが重要だ。
