Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC9823263/
A cellular and molecular biology-based update for ivermectin against COVID-19: is it effective or non-effective?
Inflammopharmacology.2023 Jan 7 : 1-15.
doi:10.1007/s10787-022-01129-1
pmcid:pmc9823263
概要
コロナウイルス感染症2019(COVID-19)に対する地域ワクチン接種と死亡率の低下にもかかわらず、この病気の治療法にはまだ課題がある。SARS-CoV-2ウイルスの継続的な変異と新型の出現により、流行に対抗するための既存の抗ウイルス薬の使用における多様性は、重要な治療チャンスとなっている。
イベルメクチンは、幅広い抗寄生虫・抗ウイルス剤として、従来からDNAおよびRNAウイルス感染症を含む多くの種類の疾患の治療に使用されていた。しかし、イベルメクチンが重症急性呼吸器症候群新型コロナウイルス型(SARS-CoV-2)の治療に有効な抗ウイルス剤の一つとして使用できるかどうかは、現在入手可能なデータからはまだ議論の余地がある。
本研究の目的は、COVID-19の治療において、イベルメクチンの安全性,有効性,副作用を含む包括的な情報を提供することである。
キーワードCOVID-19、イベルメクチン、SARS-CoV-2、ファビピラビル、リバビリン、ファモチジン
はじめに
コロナウイルス感染症2019(COVID-19)は、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)による致死性の呼吸器疾患である(Esakandari et al.2020; Khezri et al.2022; Khomari et al.2021; Zhou et al.2020)。
COVID-19は、2019年12月、中国湖北省武漢市で原因不明の肺炎が発生したことから始まった。発症源の初期の報告はすべて、水産物、生きた鳥、野生動物を販売する華南海産物卸売市場からだった。発熱、頭痛、咳、息切れは、多臓器不全を伴うCOVID-19の一般的な症状である(Hui et al.2020)。
また、最近の研究では、COVID-19が複数の癌や他の疾患の進行につながる可能性が示唆されている(Zalpoorら2022a,2022b,2022c,2022d,2022e,2022f,g)。
SARS-CoV-2のプロテオーム解析および遺伝子解析により、SARS-CoV-2と他のSARS種との非構造タンパク質のアミノ酸配列および核酸構造の類似性がそれぞれ94.6%および79.5%であることが示された。
SARS-CoV-2は、ウイルスタンパク質に直接翻訳される配列を持つ正鎖RNAウイルス(+ ssRNAウイルス)である。RNAゲノムの5つの遺伝子セグメントは、クローニング酵素と、スパイクプロテイン(S)、膜タンパク質(M)、エンベロープタンパク質(E)、ヌクレオカプシドタンパク質(N)という4つの構造タンパク質である。
レプリカーゼ遺伝子(ORF1ab遺伝子)は、21kb以上の大きさの16種類の非構造タンパク質(NSP116)をコードし、pp1abポリタンパク質に翻訳されている。RNA依存性RNAポリメラーゼ(RdRp)であるリプリカーゼ(pp1a)は、ゲノム複製時にネガティブセンス抗原を合成し、それを鋳型として新規ポジティブセンスウイルスゲノムが生成される。
NSP1タンパク質は、細胞内でリボソームの40Sサブユニットに結合し、宿主細胞での翻訳を阻害する。NSP1タンパク質は、宿主細胞での遺伝子発現を抑制することで、感染細胞でのウイルス遺伝子発現を促進し、宿主の免疫反応を回避している。
NSP2タンパク質は、宿主のPHBとPHB2分子との相互作用を通じて、細胞の生存伝達経路の制御に関与している。この2つのタンパク質は、ミトコンドリア機能を安定化させ、ストレスから細胞を保護する重要な役割を担っている。NSP3の隣に位置するPLPRO は、脱ユビキチン化活性または脱ISGilating 活性を有し、免疫応答の抑制に関与している。
NSP2 タンパク質は、宿主のPHBとPHB2 分子の相互作用により、細胞の生存伝達経路の制御に関与している。この2つのタンパク質は、ミトコンドリア機能を安定化させ、ストレスから細胞を保護する重要な役割を担っている。NSP3の隣に位置するPLPRO は、脱ユビキチン化活性または脱ISGilating 活性を有し、免疫応答の抑制に関与している。
また、このタンパク質は、NSP4タンパク質とともに、ウイルスの複製に必要な膜小胞の形成に関与している。NSP3 タンパク質は、リン酸化、二量体化、核-細胞質転移を阻害することにより、1型インターフェロンの誘導や自然免疫の抑制を行う。
このタンパク質は、核内因子κB (NF-κB)のメッセージ伝達の抑制に関与している。スパイクプロテインは、受容体と結合するためのS1タンパク質と、ウイルスエンベロープと宿主細胞膜の融合を行うためのS2タンパク質の2つのサブユニットを持つ。
ウイルス感染は、S1タンパク質がhACE2受容体(アンジオテンシン変換酵素2)に結合してS糖タンパク質の立体構造変化を起こし、その後、S2融合ペプチドを持つCatB/L(カテプシンBおよびL)およびTMPRRS2によってS糖タンパク質がタンパク質分解され、ウイルスが活性化されることで開始される。膜はエンドソームに組み込まれる(Mielech et al.2014; Payandeh et al.2021; Wang et al.2020; Wu et al.)
イベルメクチンは、FDによって承認された広域駆虫薬、抗菌薬、抗ウイルス薬である(Campbell and Benz1984; Crump and Omura2011)。この薬剤は、SARS-CoV-2を含むいくつかのDNAおよびRNAウイルスに対して、試験管内試験で有効であることが示されている。イベルメクチンは、病原性タンパク質/ウイルスゲノムが宿主細胞の核に入るのを防ぐことによって、SARS-CoV-2に作用する(Calyら2020; Lvら2018; Razaら2020; X. Wangら2019)。
今回の総説では、COVID-19に対するイベルメクチンの前臨床試験および臨床試験の過去および現在の使用法,メカニズム,経過をまとめた。SARS-CoV-2に対するイベルメクチンの生体内試験活性を説明するのに十分なデータはないが、SARS-CoV-2に対するイベルメクチンの活性を説明するのに十分なデータはある。
SARS-CoV-2に対するイベルメクチンの試験管内試験での抗ウイルス活性と他の類似ウイルスに対する生体内試験での効果を実証した結果は、COVID-19の治療に対するイベルメクチンの使用に関する実験室および臨床研究がまだ進行中であるという十分な確信を研究者に与えている。
イベルメクチンがSARS-CoV-2の宿主細胞への侵入を阻止する
SARS-CoV-2が宿主細胞に付着する前に、イベルメクチンの2分子が「テール」モードで相互作用し、電離層活性塩化物チャンネルを形成して、アポトーシスと浸透圧細胞死を誘発する(Dominguez-Gomezら2018; Dueñas-González and Juárez-Rodríguez2021; Rizzo2020)。
さらに、SARS-CoV-2に対するイベルメクチンの効果に関するin silico研究により、いくつかの戦略によってウイルスが宿主細胞に侵入するのを防ぐことが示されている。まず、イベルメクチンは、S糖タンパク質のロイシン91領域と宿主細胞のACE2受容体(SARS-CoV-2の特異的受容体)のヒスチジン378領域に結合する(Nabi-Afjadiら2022)。
さらに、イベルメクチンは、S糖タンパク質、RdRp、NSP14、TMPRSS2の活性部位に対して、イベルメクチン、クロロキン、ファビピラビル、レンデシビル、ヒドロキシクロロキンと比較して高いH結合形成で最も親和性を示した(Choudhury et al.2021; Eweas et al.2021; Lehrer and Rheinstein2020; Zaidi and Dehgani-Mobaraki2021)。
Choudhuryらは、その関連リガンドを結合する能力を妨害することにより、イベルメクチンがヒトプロテアーゼ、レプリカーゼ、およびTMPRSS2受容体に対しても有効であることを実証した(Choudhuryら、2021)。
インポーティンα(IMP α)は、SARS-CoV-2に対するイベルメクチンのもう一つの分子標的である。イベルメクチンは、HIV-1の複製やデング熱感染において、IMP α/βを介した核内輸送を特異的に阻害することが示されている。
したがって、前述のウイルスにおける同じメカニズムによって、イベルメクチンはSARS-CoV-2を阻害することが期待された(King et al.)Youngらの研究により、イベルメクチンが宿主細胞内のIMPαに作用することが確認された。
彼らは、イベルメクチンがIMPαとIMPβの相関関係を阻害することを示したが、IMPα/βヘテロダイマーを解離させることも可能であった。続いてCDスペクトルを用いた研究から、IMPαのアルマジロ(ARM)リッチドメインがイベルメクチンの特異的結合部位であることが判明した。
また、イベルメクチンの濃度が高くなると、ARMのαヘリックスの切断が有意に増加したが、IMPβの構造に変化はなかった。さらに、イベルメクチンによるIMPαへの作用は、デングウイルスNSP5を含むNLSとの結合を阻害することが実証された。
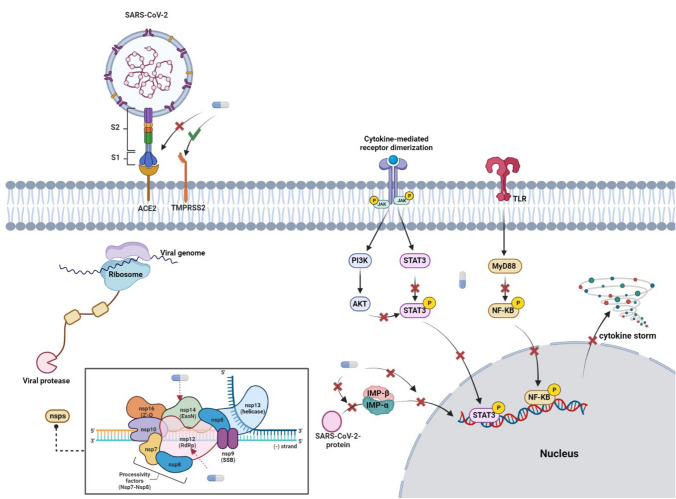
したがって、SARS-CoV-2に対するイベルメクチンの効果は、IMPαとのNの相互作用の防止と同様であると言える(S. N. Yang et al.2020a,b)(図1)。
図1 JAK/STAT、PI3K/ACT、NF-κBシグナル経路およびSTATとNF-κBの転写活性を標的としたSARS-CoV-2の宿主細胞への侵入、生殖、抗炎症反応に対するIvermectinの効果について
イベルメクチンはSARS-CoV-2の繁殖を抑制する
宿主細胞に侵入できた他のウイルスは、他のイベルメクチンのスキームによって影響を受ける可能性がある。前述のように、イベルメクチンはNSP12上に位置するRdRP(結合エネルギー-9.7 kcal/mol)と相互作用し、SARS-CoV-2の複製および転写において重要な酵素として機能する。
また、イベルメクチンはNSP14と相互作用し、修正エクソリボヌクレアーゼおよびメチルトランスフェラーゼ活性により、ウイルスRNAのキャッピングとして働く。このように、イベルメクチンは、ウイルスの重要なタンパク質/複製因子を阻害することにより、SARS-CoV-2の複製を阻害する。
宿主細胞では、SARS-CoV-2のRNAはポリプロテインに翻訳され、そのポリプロテイン中の特定の酵素が自己タンパク質分解的に切断され、ウイルスの複製に関わる酵素がポリプロテインから容易に分離される。キモトリプシン様プロテアーゼ(3’cl pro/Mpro)は、イベルメクチンの結合を阻害する酵素の一つである。
また、MproとSARS-CoV-2 PLproの2つのタンパク質に効率よく結合する。このように、ウイルスのポリタンパク質の翻訳後修飾を防ぐ役割を担っている。さらに、イベルメクチンは、翻訳後プロセシングに重要なプロテアーゼとして、SARS-CoV-2ポリタンパク質のMproおよびPLproに結合する(Eweasら2021;Maら2015;Modyら2021;Sgargiary2020;V‘kovski ら2021)。
オートファジーは、SARS-CoV-2の宿主細胞への侵入と増殖を促進し、イベルメクチンによって悪化させる可能性が示唆されている(Yang and Shen2020)。
さらに、イベルメクチンがAKT/mTORシグナル伝達経路を介してオートファジーを誘導する可能性があることが研究で示されている(Dou et al.2016; Liu et al.2019)。
したがって、これらの知見は、イベルメクチンが諸刃の役割を果たす可能性を示唆しており、イベルメクチンの宿主細胞におけるSARS-CoV-2の侵入および複製に対する正または負の効果を確認するためにさらなる研究が必要である。
イベルメクチンの免疫系反応における役割と抗炎症作用
イベルメクチンは、NF-κB、AKT/mTOR、STAT3、インターフェロン依存性経路を阻害することで抗炎症剤として働き、炎症に関連するタンパク質の産生を抑え、COVID-19の重症度と死亡率を著しく低下させる。
例えば、TNF-α、IL-1ss、IL-4、IL-5、IL-6、IL-13などである。研究により、イベルメクチンが、様々な細菌、ウイルス、寄生虫、および新生物疾患の細胞媒介性および体液性免疫応答を調節することが示されている(Sajidら、2006;Stankiewiczら、1995)。
イベルメクチンは、NF-κB活性の上昇を抑制し、TNF-α、IL-1およびIL-6の産生を阻害することにより、生体内試験および試験管内試験で抗炎症作用を有することが示されている(Zhangら,2008)。NF-κBは、パターン認識受容体を介してSARS-CoV-2によって活性化される(Nabi-Afjadiら、2021)。
SARS-CoV-2がACE2に結合すると、細胞表面でACE2が減少し、その結果AngIIの発現が増加する。SARS-CoV-2感染によるNF-κB活性化に加え、1型アンジオテンシン受容体軸は、disintegrin and metalloprotease 17(ADAM17)を介してTNF-αおよび可溶性IL-6Ra(sIL-6Ra)の産生を誘導する役割を担っていると考えられる(Eguchi et al.2018 )。
非免疫細胞では、IL-6はsIL-6Rに結合し、シグナルトランスデューサおよび転写活性化因子3(STAT3)を活性化する(Joshiら、2021a、b)。
STAT3およびNF-κBは、IL-6エンハンサーを活性化して、単球走化性タンパク質(MCP1)、IL-8、および血管内皮増殖因子(VEGF)を含む他の炎症性サイトカインおよびケモカインを産生し得る(Murakami et al.2019)。
PAK1がJAK1とSTAT3の両方に結合すると、PAK1/STAT3複合体が形成され、COVID-19感染時のサイトカインストームに必要なIL-6遺伝子の転写を活性化する(Kim et al.2019)。
イベルメクチンは、Akt/mTORシグナルを阻害し、ユビキチンを介したPAK1分解を促進することにより、STAT3活性およびIL-6産生を阻害し、COVID-19のサイトカインストームを減衰させることが示されている(Dou et al.2016)。
SARS-CoV2が宿主細胞に侵入すると、宿主細胞の機能を遮断し、宿主細胞のIFNを介した抗ウイルス応答を阻害する。ORF3a、ORF6、およびNSP1を含むSARS-CoV-2タンパク質は、IFNIシグナル伝達を遮断する(Konno et al.2020;Yangら2020a、b)。このため、感染細胞の周囲の細胞はIFN防御シグナルを受け取ることができず、SARS-CoV-2が自由に拡散・増殖することを許してしまう。IFIT1、IFIT2、IF144、ISG20、OASL、IRF9など、多くのIFN関連遺伝子がイベルメクチンによって誘導されることが示されている(Seth et al.2016)。
集合的に、利用可能な証拠に基づいて、抗ウイルス効果に加えて、イベルメクチンは保護的なIFNシグナル伝達を改善する可能性があり、抗炎症特性を有し、コロナウイルスに関連するサイトカインストームおよび炎症反応の副作用を低減するのに有効である可能性がある。
それにもかかわらず、イベルメクチンはP2X7受容体の活性化および下流のシグナル伝達を誘導し、炎症および病理学的作用をもたらす可能性がある。イベルメクチンは、PX24受容体においてATP感受性を高め、ATP解離後の電流の不活性化を遅らせることが示されている。
これは、P2X7受容体におけるATP誘導電流およびCa2 +シグナルの増強と同時に起こる(Juarezら、2018)。
また、Zalpoorら(Zalpoor et al.2022c)は、SARS-CoV-2感染における病的・炎症反応にP2X7受容体の過剰活性化が関与する可能性を報告している。したがって、COVID-19患者におけるイベルメクチンの炎症作用または抗炎症作用を承認するためには、より多くの研究が必要である。
COVID-19に関連するエネルギー代謝経路におけるイベルメクチンの効果
最近の解析では、COVID-19の間、解糖、TCAサイクル、酸化的リン酸化鎖が活性化することが示されている(Gardinassi et al.2020)。Codoらは、COVID-19患者のSARS-CoV-2感染気管支肺胞洗浄単球の培養において、解糖に関与する遺伝子の発現が上昇することを示した(Codoら、2020)。
さらに、別の同様の研究により、SARS-CoV-2感染が単球に特異的に解糖を刺激することが示された。COVID-19感染症によっては、その経路の変化が病態や重症化に寄与している可能性がある。クレブスサイクルはマクロファージの免疫代謝の中心であると考えることができる。
クレブスサイクルの中間産物であるコハク酸やクエン酸は、炎症性マクロファージに蓄積される。これらの代謝産物の非代謝的なシグナル伝達の役割は、炎症性遺伝子の発現に重要な役割を果たす(Ryan and O’Neill2020)。
したがって、これらの代謝プロセスを標的とすることで、COVID-19中の炎症反応と副作用を緩和するための潜在的な治療法の開発に役立つ可能性がある。イベルメクチンは最近、エネルギー代謝経路の主要酵素、特に解糖ホスホフルクトキナーゼ、血小板(PFKP)、イソクエン酸脱水素酵素[NADP(+)]2(IDH2)に作用することにより、分子ネットワーク全体で重要な役割を果たすことが示されている。
[NAD(+)] 3-非触媒サブユニットβ(IDH3B)、シトクロムb(CYTB)、NADHデヒドロゲナーゼ2(ND2)、(ND5)およびユビキノールシトクロムc還元酵素ヒンジ蛋白(UQCRH)の酸化のクレブスサイクルリン酸化、モノカルボン酸トランスポーター1(MCT1)と乳酸シャトルのMCT4(Zhan and Li2021).したがって、イベルメクチンがエネルギー代謝経路を変化させ、炎症反応を抑え、COVID-19の副作用の一部を軽減することによって、COVID-19の治療効果を発揮するのではないかと考えた(図2)。
図2 COVID-19に関連するエネルギー代謝経路(クレブスサイクル、解糖、電子輸送鎖(ETC)、酸化的リン酸化(OXPHOS)におけるイベルメクチンの効果について
イベルメクチンは、いくつかの研究によると、酸化ストレスやアポトーシスを引き起こす役割も担っている(Atakisi et al.2009; El-Far2013)。
例えば、イベルメクチンは、Shican Zhouらの報告(Zhou et al.2021)にあるように、活性酸素を介したミトコンドリアアポトーシスを促進し、S期停止を引き起こすことによって、大腸がん細胞の細胞増殖を抑制する。
さらに、細菌のDNAやRNAの複製を阻止する抗生物質や駆虫薬は、ミトコンドリアを標的としてヒトのがん細胞に作用する。グリオブラストーマ細胞や脳内皮細胞では、イベルメクチンはミトコンドリア機能障害によりミトコンドリアスーパーオキシドレベルを増加させる。
神経膠芽腫と内皮細胞では、抗酸化物質の存在がイベルメクチンの阻害作用を逆転させることが示された(Liu et al.2016)。
妊娠の初期段階において、イベルメクチンは、一定の曝露と蓄積されたレベルにより、正常な胎盤形成プロセスを妨害する可能性もある。著者らは、イベルメクチンが、細胞周期停止、アポトーシス、ミトコンドリア伝染性、カルシウム蓄積、内皮機能障害、ミトコンドリア機能障害による細胞恒常性の乱れなど、pTrおよびpLE細胞に悪影響を及ぼすことを示した。このように、SARS-CoV-2に感染した妊婦に対して、イベルメクチンをより検討する必要がある(Lee et al.2019)。
イベルメクチンの臨床試験
イベルメクチンについては、ヒトでの臨床エビデンスが不十分であるため、その有効性を判断するためには、より多くの臨床試験が必要である。イベルメクチンがCOVID-19の治療に役立つとする研究者がいる一方で、効果がないと報告する研究者もいる。
例えば、Rajterらは、2020年3月15日から5月11日まで、フロリダのBroward Healthの4つの病院で、COVID-19の患者280人を対象に研究を行った。この研究では、患者を2 群に分けた。
173人の患者がイベルメクチンを投与され、107人が対照薬を投与された。ヒドロキシクロロキン、アジスロマイシン、または両薬剤を対照群と介入群に併用投与した。その結果、イベルメクチンは一般および重症肺疾患患者の死亡率を対照群に比べ有意に低下させることができた。入院期間については、両群間に有意差はなかった(Rajter et al.2021)。
しかし、この入院の結果は、Shahbaznejadらによる無作為化二重盲検試験とは異なる。イランのMazandaranで、COVID-19の患者69人を対象にイベルメクチンの単回投与が検討された。この研究では、イベルメクチンを投与した患者において、平均呼吸困難、持続性咳嗽、入院、リンパ球減少症の発生が有意に減少したことが示された(Shahbaznejadら、2021b)。
イベルメクチンのウイルス量減少率および安全性を検討するため(Ahmed et al.)バングラデシュ・ダッカの入院患者72名を対象に、無作為化二重盲検プラセボ対照試験を実施した。この試験では、患者を3群に分けた。
第1群にはイベルメクチン12 mgを1日1回5日間投与し、第2群には初日にイベルメクチン(12 mg)とドキシサイクリン200 mgを単回投与し、翌日はドキシサイクリンのみ12時間ごとに100 mg投与した。
その結果,イベルメクチンの安全性と有効性が確認されるとともに、成人軽症COVID-19に対するイベルメクチンのウイルス消失率および臨床症状改善効果が認められた(Ahmedら、2021)。
Okumusらは、重症COVID-19肺炎患者におけるイベルメクチン代謝とその毒性に影響を与える遺伝子変異を見つけること、および変異のない患者におけるイベルメクチンの有効性と安全性を評価することを目的とした。
本研究は、前向き無作為化単盲検試験で、試験群および対照群を設定した。その結果,イベルメクチンは、重症COVID-19患者の臨床的回復を改善し、予後検査指標を改善し、死亡率を低下させる可能性があることが報告された。彼らは、イベルメクチンをCOVID-19疾患の治療の代替薬として、あるいは既存のプロトコルの補完薬として検討することを提案した(Okumuşら、2021)。
これらの結果にもかかわらず、Mohanらは、125人の軽度から中等度のCOVID-19の入院患者を対象とした無作為二重盲検比較試験の検索により、イベルメクチンのウイルス量減少における有益な効果に反論している。
この研究では、患者をイベルメクチン(1日24 mgまたは12 mg)投与群とプラセボ投与群の2群に無作為に分けた。5日後の逆転写酵素-ポリメラーゼ連鎖反応(RT-PCR)検査では、イベルメクチン24 mg群47.5%,イベルメクチン12 mg群35.0%,プラセボ群31.1%で陰性であった。
群間差は統計学的に有意ではなく、p値=0.30であった。プラセボと比較して、イベルメクチン経口投与により、COVID-19投与患者におけるRT-PCR検査の陰性化またはウイルス量の減少が認められたが、これらの群間差は統計学的に有意ではなかった(18).
Ravikirtiらにより、インドの軽症から中等症のCOVID-19患者を対象とした別の二重盲検無作為化プラセボ対照試験が行われた。介入群の患者は1日目と2日目にイベルメクチン12 mgを投与され、対照群の患者はプラセボを投与された。6日目に介入群の約4分の1(23.6%)、プラセボ群の3分の1(31.6%)がRT-PCRでSARS-CoV-2陰性と判定された。
この差は統計学的に有意ではなかったが。イベルメクチン群の患者は全員退院に成功し、プラセボ群は93%の成功率であった。Mohan.らは、COVID-19患者の治療レジメンにイベルメクチンを含めることは、この試験の結果に基づいて決定的に確認できない;なぜなら、患者の退院が成功するというわずかな利点を除いて、他の利点は観察されなかったからである、と報告した(Mohan et al.2021)。
Chee Loon Limらは、高リスクのCOVID-19患者の重症化予防におけるイベルメクチンの有効性を調査するために、マレーシアの様々な公立病院のCOVID-19患者490人を対象に、別のオープンラベル無作為化臨床試験を計画した。
試験患者は、標準治療に加え、イベルメクチン(0.4 mg/kg体重/日)を5日間経口投与された。その結果、両群間に有意差は認められなかった。また、イベルメクチン投与群の21.6%が重症化し、対照群(標準治療のみ)の17.3%が重症化したと報告された。したがって、COVID-19の初期にイベルメクチンを投与しても、重症化することを防ぐことはできなかった(Limら2022a)。
Vallejosらは、2020年8月19日から2021年2月22日の間にアルゼンチンのコリエンテスでCOVID-19で入院していない501人を対象に行った研究でも同様の結果を報告している(Vallejos et al.2021)。
LópezMedinaらは、中等度のCOVID-19患者におけるイベルメクチン療法の効果を見るために、コロンビアのカリで無作為化二重盲検一点試験を実施した。参加者は、州の保健機関からCOVID-19の症候性で検査室が特定された患者の電子データベースから無作為に選ばれた(2020年7月15日から11月30日)。
試験参加者は、300g/kg.B.Wのイベルメクチン溶液または同量のプラセボを5日間経口投与された。イベルメクチン群では、症状緩和期間の中央値が10日であったのに対し、プラセボ群では12日であった。21日目までに、イベルメクチン服用患者の82%、プラセボ服用患者の79%に症状が見られなくなった。
最も多く報告された副作用は頭痛で、イベルメクチン服用患者の52%、プラセボ服用患者の56%から報告された。研究グループは、イベルメクチンを5日間使用しても、中等度のCOVID-19患者の症状緩和を有意に改善することはないと結論付けた。
しかし、他の臨床的に関連する結果に対するイベルメクチンの効果を理解するために、さらなる試験が必要かもしれない(López-Medinaら、2021)。
Samahaらは、100人の無症候性レバノン人COVID-19患者の無作為化対照試験で、SARS-CoV-2ウイルス量の減少におけるイベルメクチンの有益な効果について調査した。イベルメクチン投与前の参加者のCt値の差は有意ではなかった(p= 0.06)ことから、参加者のウイルス量は同じであることが示唆された。
2群に分け、1群にはイベルメクチンを服用させた。食事開始72時間後、イベルメクチン補給群では対照群に比べ、Ct値が有意に上昇した。また、対照群では臨床症状を発症した患者がより多かった。彼らは、イベルメクチンが治療効果を発揮し、症状の軽減、ウイルス量の低下、入院の減少につながったようだと結論付けた(Samahaら、2021)。
言及された臨床試験を表Table11にまとめた。
表1 イベルメクチンの抗COVID-19効果を検討した臨床試験
| 患者数 | 研究対象国 | イベルメクチン投与量 | 内容・成果 | 参考文献 | |
|---|---|---|---|---|---|
| ポジティブな反応を示した研究 | 280 | 米国 | 200mg/kg/日 | 1) 一般および重症肺疾患患者の死亡率を対照群と比較して低下させた
2)入院期間については、対照群と比較して有意差なし |
ラジターら(2021) |
| 69 | イラン | 0.2mg/kg/日 | 平均的な呼吸困難、持続的な咳、入院、およびリンパ球減少症の発生を有意に減少させた。 | Shahbaznejadら(2021a)。 | |
| 72 | バングラデシュ | 12 mg | イベルメクチンの安全性と有効性を確認するとともに、ウイルスクリアランス率や臨床症状の改善効果についても確認した | アーメッドら(2021) | |
| 66 | トルコ | 200μg/kg/日 | 臨床的回復の改善、予後検査指標の改善、死亡率の低下 | オクムシュら(2021) | |
| ネガティブな反応を示す研究 | 125 | インド | 12および24mg/日 | COVID-19を投与された患者において、RT-PCR検査陰性化の増加またはウイルス量の減少が見られたが、プラセボ群と比較して統計的に有意な差は認められなかった。 | モハンら(2021) |
| 490 | マレーシア | 0.4mg/kg/日 | コントロールと比較して有意差はなく、COVID-19の初期段階でのイベルメクチンによる治療では、より深刻な段階への進行を防ぐことはできなかった | リムら(2022b) | |
| 501 | アルゼンチン | 12および18mg/日 | コントロールと比較して有意な差はない | ヴァレホスら(2021) | |
| 476 | コロンビア | 300g/kg/日 | COVID-19の症状改善効果は顕著ではない | López-Medinaら(2021)。 | |
| 100 | レバノン | 9mg、12mg、150μg/kg | 1)対照群と比較して有意に高いCt値
2)対照群と比較して、症状が軽く、ウイルス量も少なく、入院も少なかった。 |
サマハら(2021) |
* *
COVID-19に対するイベルメクチンの予防効果の可能性
COVID-19に対するイベルメクチンの18のランダム化比較試験において、この薬剤はウイルスのクリアランス時間、臨床回復時間、および死亡率の減少において統計的に有意な役割を果たすと報告された。さらに、いくつかの対照予防試験で、イベルメクチンがCOVID-19に感染するリスクを大幅に低減できることが示されている(Koryら、2021)。
Beheraらの最近の研究では、化学予防剤としてイベルメクチンを2回に分けて医療従事者に経口投与(300mcg/kg、72時間ごと)すると、その後1カ月間にCOVID-19に感染するリスクが83%減少した(Beheraら、2021)。
したがって、イベルメクチンはCOVID-19の治療だけでなく、医療従事者などの高リスク職業群や免疫などの原疾患を持つ患者などのCOVID-19重症化の高リスク群に対する化学予防薬としても利用できるのではないかと考えられる。
欠乏症や悪性腫瘍を解消してCOVID-19に感染するリスクを低減する。Okumushらの研究では、イベルメクチンは、COVID-19の治療に利用できる現在の治療プロトコルの代替または補完的な選択肢となる可能性があることが示されている。これにより、重症のCOVID-19患者であっても、予測される検査パラメータの改善、臨床的回復の促進、死亡率の減少が期待できる。
MDR1/ABCB1および/またはCYP3A4変異を持たない患者へのイベルメクチン投与は安全であり、重篤な副作用を引き起こすことはないと考えられ、適切な治療により副作用を軽減する可能性がある(Okumuş et al.2021)。
イベルメクチンは、体内に最も広く分布する薬物の一つとして、経口で速やかに吸収され、肝臓(シトクロムP450系)で代謝され、健常者ではアルブミンなどの血漿タンパク質に強く結合する。一方、COVID-19患者では、肺損傷の重症度と低アルブミン血症が関連している。
したがって、このような観察から、血漿中のイベルメクチン遊離画分の利用可能性を高めることができるのではないかと考えられた。イベルメクチンは、体内に最も広く分布する薬物の一つとして、経口で速やかに吸収され、肝臓(シトクロムP450系)で代謝され、健常者ではアルブミンなどの血漿タンパク質と強く結合する。
一方、COVID-19患者では、肺損傷の重症度と低アルブミン血症が関連している。したがって、この観察により血漿中のイベルメクチン遊離画分の利用可能性が高まる可能性があると仮定した(Canga et al.2008; Klotz et al.1990; Wu et al.2021)。
イベルメクチンと抗生物質、抗ウイルス剤、および副腎皮質ステロイドとの共投与は、効果を高め、高用量の必要性を回避し、毒性および副作用のリスクを用量依存的に低減させる可能性がある。したがって、イベルメクチンは、COVID-19;SARS-CoV-2ウイルスに対するイベルメクチン機構の多機能薬として、安全な治療法として期待できる可能性がある。
イベルメクチンは、幅広い生物学的活性を有する薬剤である。当初は動物用の多目的用途に使用されていたが、30年以上にわたってヒトの寄生虫感染症の治療に成功した(大村2008)。
もともと獣医学および医学において、オンコセルカ症(Fodjo et al.2019; Hopkins2005; Otabil et al.2019)、強皮症(Henriquez-Camacho et al.2016; Igual-Adell et al.2004)、リンパ系フィラリア症(Beng et al.2020; Brown et al.2000; Kazura1993)、疥癬(Anderson and Strowd2017; Rosumeck et al.2018)の治療用に提案された。
現在、イベルメクチンは、眼窩筋症、トリチノーシス、マラリア、リーシュマニア症、アフリカトリパノソーマ症、喘息、てんかん、神経疾患、特定の癌、およびウイルスによって引き起こされる広範囲の疾患を含む様々な病気を抑えるために使用できることが実証されている(Li et al.2021)。
また、ZIKV、デング熱ウイルス、ベネズエラ馬脳炎ウイルス(VEEV)などの陽性一本鎖RNAウイルスを含む、広範囲のRNAおよびDNAウイルスに対するイベルメクチンの有益な効果に関する研究情報もある。
同様に、他のウイルスタンパク質/ゲノムの宿主細胞への核侵入の阻害(Heidary and Gharebaghi2020)は、同様のゲノム特性を有するSARS-CoV-2の導入を促進する。
この点に関して、現在、SARS-CoV-2に対するイベルメクチンの抗ウイルス作用が発表されている(Caly et al.)イベルメクチン単回投与により、SARS-CoV-2に感染したVero/hSLAM細胞において、投与48時間後にウイルスRNAを約5000倍減少させることが示された(Caly et al.)しかし、この結果は、世界中の研究者から大きな注目を集めている。
この研究は、試験管内試験でのSARS-CoV-2に対するイベルメクチンの抗ウイルス効果を調べたに過ぎないため、この結論には注意が必要である(Schmith et al.2020)。
COVID-19に対するイベルメクチンの効果を検討した最初の生体内試験のひとつがSabeena(Ahmedら)である。この研究では、患者にイベルメクチンを5日間投与し、治療した患者はプラセボと比較して、ウイルスのクリアランス率が有意に高く、疾患の重症度指標(CRPとLDH)が有意に減少することを見出した(Kazura1993)。
また、メタアナリシスでは、イベルメクチンが入院患者の死亡率を68%減少させることが示された(Chen et al2020)。
イベルメクチンの抗ウイルス効果を考慮すると、この薬剤は、細胞外ウイルス粒子の不活性化、宿主細胞へのウイルス侵入経路の妨害、ウイルス複製、タンパク質生産、翻訳後変化などの確率的経路を通じて、COVID-19の病態に直接的または間接的に影響を及ぼすことが示唆されている。新型コロナウイルス感染症に対する本剤の正確な作用機序はまだ解明されていないが、いくつかの機序についてはすでに言及されていますので、以下に簡単に説明する。
イベルメクチンと他剤との併用について
ドキシサイクリン
イベルメクチンと他の薬剤との併用効果について説明した研究は数多く発表されている。これまでの研究では、イベルメクチンとドキシサイクリンの併用により、回復期間と進行する患者の割合が減少する可能性があることが示されている。さらに、この組み合わせは、14日目にRT-PCRを用いた COVID-19 テストで陰性であった(Mahmud ら、2021)。
Hashimらはまた、イベルメクチンとドキシサイクリンの組み合わせによる治療が、重症患者の死亡率を低下させる可能性があると結論付けた(Hashimら、2020)。
亜鉛
Buttersの研究では、イベルメクチンの抗ウイルス活性は、亜鉛のサプリメントと併用することで改善される可能性があることがわかった。亜鉛レベルを上げることで、COVID-19患者の感染と戦い、回復を早めることができると示唆されている(Butters and Whitehouse2021)。
ニタゾキサニド・リバビリン
Elalfyらは、自宅で治療を受けている軽症から中等症のCOVID-19症例を対象に、イベルメクチンの独自の組み合わせの効果を検討した。その結果,イベルメクチンとニタゾキサニド,リバビリン,亜鉛の併用により、鼻咽頭ぬぐい液中のCOVID-19ウイルス量が減少することが示された。
亜鉛
亜鉛と抗ウイルス剤の併用による相乗効果は、C型肝炎ウイルス,小児ウイルス性下痢症,ヒトパピローマウイルス,ヒト免疫不全ウイルスなど、他のウイルス感染症でも実証されている。この研究では、この併用療法を受けた患者の88%が、感染15日目のRT-PCRの結果が陰性であった(Elalfy et al.2021)。
アジスロマイシン
臨床試験では、アジスロマイシンがサイトカインの放出を抑制し、炎症反応を減衰させ、免疫グロブリン反応を増強することが示されている。その抗ウイルス作用と抗炎症作用によっては、アジスロマイシン単独で初期のCOVID-19に有効な治療法となる可能性がある(Andreani et al.2020)。
アジスロマイシンの抗ウイルス活性は、感染細胞の構造的および機能的なリソソーム損傷、SARS-CoV-2のACE2などの受容体への結合を促進するリソソームプロテアーゼの阻害、およびウイルスがホスト細胞に侵入するなど、いくつかのメカニズムに起因する(Al-Kuraishy et al.、2020)。
イベルメクチンとアジスロマイシンの間には明確な相互作用はなく、トルサドジェニック効果は認められなかった(Al-Kuraishy et al.2020)。したがって、COVID-19患者にはアジスロマイシンとイベルメクチンの併用が有効であると考えられる。
また、抗ウイルス剤と細胞標的に作用する薬剤や異なる作用機序を用いる薬剤との併用は、抗ウイルス療法中の薬剤耐性や毒性を最小限に抑えるのに役立つ(Day and Siu2016)。
レムデシビル
HIV-1およびC型肝炎ウイルスの治療には、いくつかの効果的な薬剤の組み合わせがある(Ghany et al.2019;2018)レムデシビルとイベルメクチンは、COVID-19の治療で大きな関心を集めている2つの再利用薬である。レムデシビルは、RNAウイルスに作用し、RNAポリメラーゼを阻害するプロドラッグ(ヌクレオチド類似体)である。
SARS-CoV-1および中東呼吸器症候群(MERS-CoV)に対して試験管内試験で有効な阻害活性を示した(Agostini et al.2018; Sheahan et al.2017 )。さらに、レムデシビルは、流行の初期にSARS-CoV-2に対して試験管内試験で抗ウイルス効果を有することが示され、その後、ヒトで臨床評価された(Pizzorno et al.2020)。
ジェフリーズら(Jeffreys et al.2020)は、レムデシビルとイベルメクチンとの相乗的相互作用により、試験管内試験でSARS-CoV-2に対する抗ウイルス活性が高まったことを報告した。
レムデシビルとイベルメクチンの併用は、ウイルスRNAポリメラーゼ阻害剤としてのレムデシビルの抗ウイルス特性を高める一方で、イベルメクチンの抗炎症特性および/または免疫調節特性の利用を容易にする可能性がある。しかし、COVID-19に対するイベルメクチンとレムデシビルの複合効果を評価するためには、さらなる研究が必要である。
ファビピラビル
2014年の日本におけるインフルエンザ流行時に使用が認められた抗ウイルス薬であるFavipiravirは、試験管内試験でSARS-CoV-2に対して強力な抗ウイルス活性を示した。本剤は、幅広い治療安全性を示している。
COVID-19臨床試験によると、ロピナビル/リトナビル(LPV/RTV)よりも早くウイルス感染を除去し、ウミフェノビルよりも早く回復する。結局、ファビピラビルは中国、ロシア、日本での臨床試験で有効性が証明された。さらに、米国、英国、インドなど数カ国で臨床試験が進行中である(Joshi et al.2021a、b)。
最近の研究では、ファビピラビルとイベルメクチンは、相乗効果、かなり高い安全性プロファイル、および入手のしやすさから、COVID-19の治療のための臨床試験テストに有望な薬剤組み合わせとして特定されている(Jitobaom et al.2021)。
リバビリン
グアノシンのアナログであるリバビリンは、DNAおよびRNAウイルスに対して顕著な抗ウイルス活性を有している。リバビリンの正確な作用機序は解明されていないが、考えられる機序の1つは、ウイルス複製時のmRNAキャッピングの阻害と変異の誘発である。このようなメカニズムは、ウイルスの増殖を制限することができる(Crottyら、2001;GraciとCameron、2006)。
研究者は、SARS-CoV-2および中東呼吸器症候群(MERS)コロナウイルスに対する過去の臨床経験に基づいて、SARS-CoV2感染に対する有効な抗ウイルス剤の可能性としてリバビリンを調査した(Al-Tawfiqら2014; Boothら2003;Elalfyら2021)。
リバビリンが中国政府によってSARS-CoV-2感染症の治療に推奨された後、SARS-CoV-2感染症の治療におけるその有効性を評価するために多数の臨床試験が実施された(Hung et al.2020)。研究によると、リバビリンはインターフェロン-αまたはロピナビル/リトナビルと併用した場合、COVID-19の治療効果が高いことが示されている(Yousefi et al.2020、Zhong et al.2020)。
しかし、リバビリンのみを用いた研究では、対照薬と比較してその有効性が低下した(Elalfy et al.2021)。そのため、リバビリン単剤療法ではCOVID-19の治療効果は限定的であり、効果を高めるためには投与量を増やす必要がある。一方、増量により肝障害や血液障害などの副作用が生じる可能性がある(Sanders et al.2020)。
リバビリン,ニタゾキサニド,亜鉛
Elalfyらは、イベルメクチン,リバビリン,ニタゾキサニドの共投与と亜鉛の補給により、鼻咽頭のSARS-CoV-2を対症療法よりも有意に早く消失させた(Elalfyら、2021)。
したがって、イベルメクチンとリバビリンの併用療法は、イベルメクチン単剤療法と比較して相乗効果があり、用量依存的な副作用のリスクも低く、COVID-19の有効な治療法となり得ると結論付けることができる。同時に、これらの薬剤の併用効果を確認するために、さらなる研究が必要である。
ファモチジン
ファモチジンは、ヒスタミン2受容体拮抗薬として、頭頂細胞におけるヒスタミンの作用を阻害し、最終的に胃酸分泌を抑制する(Freedberg et al.2020)。以前、試験管内試験でHIV.1複製を阻害することが報告された(Bourinbaiar and Fruhstorfer1996)。
米国で行われた最近の研究では、ファモチジンがCOVID-19の入院患者1620人の臨床転帰を改善し、死亡のリスクを減らすのに役立ったと報告されている(Freedberg et al.2020)。Sen Guptaらのデータ(Sen Gupta and Rana2020)から、ファモチジンとイベルメクチンの併用は相乗効果がある可能性が示唆された。
第一段階のバリアとして、ファモチジンはウイルスの侵入を阻害する。そしてイベルメクチンが第二の障壁として、宿主細胞内でのウイルス複製を阻止することで、ウイルスを完全に抑制する(Sen Gupta and Rana2020)。
さらに、これらの薬剤は、安全性、入手性、費用対効果の面でより魅力的である。しかし、COVID-19の有望な治療法として、イベルメクチンとファモチジンの併用療法による相乗効果を確認するためには、さらなる研究が必要であることが示唆された。
将来の変種に対するイベルメクチン
SARS-CoV-2ワクチンはスパイクプロテインの生態をターゲットにしているため、最近報告された「ワクチン接種が困難な株」への懸念が高まっている。このような状況において、イベルメクチンは、デルタ、新たに出現したオミクロン変種、そしておそらく将来の超変種など、ワクチンによる免疫を回避できるこれらの新種(Zaidi and Dehgani-Mobaraki2021)に対して述べた戦略で機能するかもしれない。
しかし、SARS-CoV-2スパイクプロテインに結合し、ACE2、CD147、ニューロピリン-1などを含む確立した宿主細胞受容体への結合をブロックする新興変種に対するイベルメクチンの有効性を評価するための新しい研究が必要である(Zalpoorら2022c)。
オミクロンはさまざまな変異を含んでいる。デルタ変異型と比較して、そのスパイクプロテイン内だけでも少なくとも32の変異がある。これらの新しく発見された変異に加え、オミクロン変異株は、ウイルス複製をNSP12に、メチルトランスフェラーゼとエキソリボヌクレアーゼ活性をNSP14に依存していることが判明した。
従って、ウイルスRNAの複製に好影響を与えることができる。オミクロン変異株は、オリジナルのSARS-CoV-2と比較して少なくとも3倍以上の感染力を持ち、おそらくデルタ変異株よりもさらに高い感染力を持つと考えられている(Raj2021; Saxena et al.2022)。
一方、イベルメクチンは、ウイルス複製に非常に必要なNSP14およびRNA依存性RNAポリメラーゼ(RdRp)の予測される活性部位に高親和性で結合する(Zaidi and Dehgani-Mobaraki2021)。
一方、イベルメクチンは、これまでの変種に見られるように、オミクロンのスパイクプロテインに結合する可能性があると推測される。そこで、molegro virtual dockerを用いて、NSP14、RdRp、TMPRSS2、デルタ、オミクロンのスパイクプロテインの活性部位に結合するイベルメクチンのシミュレーションを行ったところ、イベルメクチンはこれらのタンパク質に高親和的に結合するだけでなく、デルタスパイクプロテインよりもオミクロンスパイクプロテインに高い親和性をもって結合することが分かった(図3)。
図3 aspike デルタ (score: 120),bspike オミクロン (score: 124),cRdRp (score: 137),dNSP14 (score: 147)とイベルメクチンのドッキングの様子。スコアリング関数の単位はmoldockscore。エネルギーは molegro virtual dockerを用いて求めた。
結論と今後の方向性
イベルメクチン単独または他の薬剤との併用により、SARS-CoV-2感染に有益な効果があると思われる。さらに、イベルメクチンは、様々な戦略/経路を通じて、ウイルスRNAの宿主細胞への侵入と複製を阻害することが知られている。
しかし、私たちは、イベルメクチンがオートファジーを促進することによって、SARS-CoV-2の複製能力を高めることができると仮定している。イベルメクチンは抗炎症作用を有するが、P2X7受容体およびその下流のシグナル伝達経路の刺激を増加させることにより、COVID-19投与中に病的合併症および炎症反応を誘発することができる。
さらに、代謝過程を変化させる役割にもかかわらず、活性酸素を誘発する可能性があり、COVID-19の治療におけるイベルメクチンの他の副作用の1つである可能性がある。イベルメクチンと他の薬剤を併用することで、副作用を軽減し、COVID-19の治療効果を発揮できる可能性があると思われる。
謝辞
本研究は倫理委員会(倫理コード:IR.ASAUMS.REC.1400.011)の承認を受け、アサダバード医科大学の研究助成(助成番号70)の支援を受けている。著者は金銭的な利益相反の申告はしていない。
資金調達
本研究は、アサダバド医科大学の研究助成金(助成番号70)の支援を受けて実施した。
宣言文
利益相反
他のすべての著者は、利益相反を宣言していない。