Contents
The Replication-Transmission Relativity Theory for Multiscale Modelling of Infectious Disease Systems
www.nature.com/articles/s41598-019-52820-3
2019年11月8日オンライン公開
Winston Gariracorresponding author
要旨
感染症システムのマルチスケールモデリングを発展させ、その範囲を拡大するためには、理論に基づくことが必要であるというのが我々の主張である。このような理論は、感染症システムをそのスケールと組織レベル、および相互関係の観点から記述する能力を向上させるだろう。
本稿では,感染症システムのマルチスケールモデリングのための相対論的理論として,物理学における相対性原理の拡張と考えられる複製-伝達相対論と呼ばれる理論を紹介する。この複製・伝達相対性理論は、感染症システムのどのレベルの組織においても、疾患のダイナミクスを決定する特権的・絶対的なスケールは存在せず、ミクロスケールとマクロスケールの間の相互作用のみが存在するとするものである。
このような相対論は、マルチスケールモデリングを用いて感染症システムをシステムレベルで記述するための科学的根拠を提供するものである。この相対論的理論の中心的な考え方は、感染症システムのあらゆるレベルの組織において、ミクロスケールとマクロスケールの相互影響により、病原体の複製-伝播のマルチスケール・サイクルが確立されるというものである。
我々は、ミクロスケールとマクロスケールの相互作用を、その関連性の条件の系統的な違いから2種類に区別している。ミクロスケールとマクロスケールの関係が相互影響形態の一つで記述される場合、宿主レベルで展開される鉤虫感染症のマルチスケールモデルを用いて、複製-伝播相対化理論の妥当性を示す。
主題用語 非線形力学、寄生虫感染症、応用数学
はじめに
これまで100年以上にわたって、感染症システムの研究は、主に2つの理論によって支えられてきた。すなわち、感染症の原因を説明するために(新しい知識の出現とともに)徐々に改良されてきた一連の理論である感染症原因論と、感染症の伝播メカニズムの知識を用いて感染症ダイナミクスの定量的モデルを開発しようとする感染症伝播メカニズム論である。以下では、この2つの理論のそれぞれについて簡単に説明する。
感染症原因説
感染症システムの原因を説明するために、1つの理論ではなく、段階的に改良された一連の理論である。歴代の感染症原因説は、感染症原因に関する新しい知識が開発されるにつれ、挑戦と変化を繰り返し、感染症原因に関する人々の見方を変えていった。当初の感染症原因説は、近代医学が台頭する以前、感染症が罪深い行動やモラルの弱さに対する神からの罰、あるいは魔術の結果など、さまざまな霊的、悪魔的な力に起因するとされていた時代から、近代医学の時代へと変化していったのである。近代医学の時代には、感染症の原因論は超自然的な力(悪魔説、懲罰説)に基づくものから、自然のプロセスによって引き起こされるものと見なされるようになった。これは、医学を魔法から科学的根拠に基づくものへと移行させるものであった。
この時代の感染症原因論は、ある種の土地、特に低湿地から発生する空気が感染症の原因であるという推論に基づく瘴気説から、感染症は細菌・微生物・病原体が原因であるという細菌説、そして現在の感染症システムは三つのサブシステムの相互作用の結果であるという疫学三分説に移行していったのである。(その結果、感染症システムは、細胞レベルからマクロ生態系レベルまでの階層的なマルチレベル・マルチスケール複合システムとして構成されることになった。したがって、疫学的三段論法は、現代の感染症原因説を構成している。感染症原因説の変遷の詳細については、1.感染症原因説の変遷を参照。
感染症伝播機構説
感染症の動態は、細胞レベル、組織レベル、宿主レベルなどの各階層における感染症を主要な動態過程とし、特定の組織レベルの感染症システムを研究するために、特定の感染症モデルを開発することができるという考え方に基づく理論である。このような感染モデルの開発における標準的なアプローチは、集団(細胞レベルでは細胞集団、組織レベルでは肉芽腫などの組織集団、ホストレベルではホスト集団)を、個体(細胞、組織、ホストなど)が均質な挙動をする区画に分類することである。これらのモデルは、感染症伝播のダイナミクスの理解を助け、より少ない資源で感染症を制御する能力を高めるために使用されてきた。この理論では、感染症の動態は、以下の3つの主要な感染メカニズムの結果であると考えられている。
(i) 直接的感染機構:感染症システムの各階層(細胞レベル、組織レベル、宿主レベルなど)において、集団(細胞、組織、宿主など)を感受性、曝露、感染、回復(SEIR)およびこのパラダイムの変形(SI、SIS、SEI、SEIS、SIR、SIRS、SEIRSなど)に区分けした上で、感染モデルを構築しているものである。
(ii) 環境感染機構:集団(細胞、組織、宿主など)を、感受性、曝露、感染、回復、環境病原体負荷(SEIRP)に区分して感染モデルを構築するもので、このパラダイムの変形(SIP、SISP、SEIP、SEISP、SIRP、SIRSP、SEIRSP、など)である。直接感染する感染症システムの感染モデルと環境感染する感染症システムの感染モデルの明らかな違いは、後者は通常、環境中の病原体の動態を記述する方程式を少なくとも一つ余分に持っていることである。
(iii) 媒介性感染:病原体が複雑な生活環を持つため、その生活環を完結させるために2つの宿主(脊椎動物宿主と媒介宿主)が必要であることから生じる感染機構。これらの感染症は、例えば住血吸虫症では、宿主を感受性、曝露、感染、回復、環境病原体負荷(SEIRP)に区分し、このパラダイムのバリエーション(SIP、SISP、SEIP、SEISP、SIRP、SIRSP、SEIRSPなど)によって環境的に伝播するモデルが開発されている。 また、マラリアなどの直接感染では、二宿主感染(脊椎動物宿主と媒介動物宿主)の文脈で、宿主レベルの感染モデルが、宿主集団を感受性、曝露、感染、回復(SEIR)およびこのパラダイムの変形(SI、SIS、SEI、SEIS、SIR、SIRS、SEIRSなど)に区分けすることによって開発されている。)
しかし、現在の感染症原因論は、疫学的三段論法という形で感染症の原因を説明するには十分であるが、感染症伝播を主要な動的疾患過程と考える感染症伝播機構論は、マルチスケールモデリングのアプローチによる感染症システムをシステムレベルで記述することは不可能であるとされている。したがって,時間的・空間的に変化する感染症現象や異なるスケールの感染症現象を記述するためには,感染症伝播メカニズム論は適切ではない。これは、感染症システムのどのレベルの組織(細胞レベル、組織レベル、宿主レベルなど)での感染もシングルスケールの疾患過程であるため、予想されることである。
時間的・空間的に変化する感染症現象を異なるスケールで記述するために、感染を引き起こすイベント(つまり、病原体の複製)を取り込み、時間的・空間的な変化に対応する新しい理論を提案する。病原体の複製を取り入れた、感染症システムのマルチスケールモデリングのための新しい理論の提案は、複製-感染相対性理論と呼ばれる。この相対性理論では、感染症システムのどのレベルの組織においても、疾患のダイナミクスを決定する特権的・絶対的なスケールは存在せず、ミクロスケールとマクロスケールの間の相互作用のみが存在するとするものである。
この相対性理論では、感染症システムのどのレベルにおいても、病原体が感染症システムの特定のレベルで拡散・持続するためには、ミクロスケール(病原体の複製がよく起こる)とマクロスケール(病原体の伝播がよく起こる)の両方で成功しなければならないことを認めている。この複製-伝播相対性理論は、マルチスケールモデリングの手法を用いて感染症システムのシステムレベルの記述を展開するための強力な支援概念ツールである。これは、物理学における相対性原理の延長線上にあるものである。物理学における相対性原理は、物体の運動や位置・速度・加速度などの物理量を決定するための絶対的・特権的な参照枠は存在しないという強力かつ具体的な主張である(詳しくは2参照)。複製伝達相対性理論は、物理学における相対性原理を拡張し、感染症システムのあらゆる組織レベルにおいて、観測のスケール(すなわち、ミクロスケールとマクロスケール)を特徴づける参照枠として考慮することを要求するものである。
我々の考える感染症システムのマルチスケールモデリングのための相対性理論は、レベルとスケールを区別している。あるレベルの中に、隣接する2つの限界的な感染スケール3,4,すなわち、ミクロスケールとマクロスケールが存在すると仮定するのである。複雑系の特徴として,マルチレベル,マルチスケールであることが挙げられるが,これらの複雑系は,ある複雑系ではスケールとレベルが同じであり,他の複雑系ではレベルとスケールが異なるというように,異なる構成になっている.感染症システムなどは、スケールとレベルが異なる複雑系の一例である。しかし、感染現場での免疫応答システムのような複雑なシステムでは、レベルとスケールが同じになるものもある。したがって、感染部位の免疫応答システムについては、例えば、感染部位の免疫応答システムは、(i)分子レベル/スケール、(ii)細胞レベル/スケール、(iii)組織レベル/スケールという3つの主要なレベル/スケールに組織化されていると述べるとき、レベルとスケールという言葉を互換的に使用することができる。感染症システムのような複雑なシステムでは、レベルとスケールが異なる場合、各レベルはミクロスケールとマクロスケールの2つの限界的な隣接スケールに分解することができる3,4。このことは、ある特定のレベルの感染症システムのダイナミクスが、ミクロスケールとマクロスケールを含むマルチスケールループであることを意味する。したがって、感染症システムのマルチスケールダイナミクスを考えるには、ミクロスケールとマクロスケールの2つの隣接するスケールでのダイナミクスを考慮する必要がある。
感染症システムの階層的な組織化レベル
感染症システムの階層性、マルチレベル性、マルチスケール性については、これまでの著作3,4で詳しく述べられているが、ここでは、この基礎研究をもとに、感染症システムは主に7つの階層レベルで構成されていることを提案する。この感染症システムの7つの階層構造を概念的に表したのが図1である。図1より、感染症システムの各階層は、ミクロスケールとマクロスケールという2つの限界的な隣接スケールを有していることがわかる。
このように、感染症システムの7つの主要なレベルのそれぞれにおいて、あるレベルを隣接する2つのスケール(ミクロスケールとマクロスケール)に分割するオープンスケール境界(スケール間の情報の双方向の流れを可能にする)が存在し、各階層レベルにおける感染症ダイナミクスは、マクロスケールとミクロスケールの相互影響(すなわち双方向)を含むマルチスケールループになっている。
図1の感染症システムを構成する7つのレベルのそれぞれと、関連する2つの限界隣接スケール(ミクロスケールとマクロスケール)について、以下に簡単に説明する。
- (i) 細胞レベル このレベルの組織は、細胞内スケールと細胞間スケールをそれぞれミクロスケールとマクロスケールとして持つ。CD4+T細胞(HIV)や赤血球(マラリア)など、感染症ダイナミクスのマルチスケールダイナミクスにおいて、細胞内スケールと細胞間スケールを統合すると、異なる種類の標的細胞を考慮することができる。
- (ii) 組織レベル このレベルの組織は、組織内スケールと組織間スケールをそれぞれミクロスケールとマクロスケールとして持っている。感染症システムのマルチスケールダイナミクスで考えられる組織の種類としては,結核の肉芽腫5や一部の細菌感染症による微小膿瘍6などがある.
- (iii) 臓器・解剖学的コンパートメントレベル このレベルの感染症システムのミクロスケールとマクロスケールは,臓器内/解剖学的コンパートメントスケールと臓器間/解剖学的コンパートメントスケールである。このレベルの感染症システムは、単一の病原体種/株と複数の臓器/解剖学的コンパートメントという観点から記述される。このレベルの感染症システムの組織で考えられる臓器/解剖学的区画としては、肺、脳、腸、腎臓、筋肉、心臓、膵臓、胃、肝臓、脾臓、骨、副腎、皮膚、脂肪、血液がある。
- (iv) ミクロエコシステムレベル 感染症システムのこのレベルの組織では、異なる臓器/解剖学的区画(肺、腸、腎臓、心臓、胃、肝臓、皮膚、血液など)が生態系とみなされる。したがって,このレベルの感染症システムは,複数の臓器/解剖学的区画と複数の病原体種/株で記述される。このレベルの感染症システムの組織におけるミクロスケールとマクロスケールは、それぞれミクロ生態系内スケールとミクロ生態系間スケールである。このレベルでは複数の病原体種・株が相互作用するため、複数の病原体種・株間の競合的な種・株相互作用や相互作用など、生態学的なプロセス・相互作用が感染症動態に影響を与える。
- (v) 宿主・生物レベル このレベルの組織は、宿主内スケールと宿主間スケールをそれぞれミクロスケールとマクロスケールとして持っている。このレベルの感染症システムは、単一の病原体種/株、単一の宿主種、単一のコミュニティという観点から記述される。このレベルを用いて、宿主内スケール(ミクロスケール)と宿主間スケール(マクロスケール)の相互影響形態が、超感染、すなわち宿主が感染から回復する前に感染を繰り返すこと(宿主間スケールが宿主内スケールに及ぼす影響)と病原体の排出・脱落(宿主内スケールが宿主間スケールに及ぼす影響)の両方である場合の複製-伝達相対性理論の有効性を鉤虫症システムのマルチスケールモデルを使って説明する。
- (vi) 地域社会レベル このレベルの感染症システムにおけるミクロスケールとマクロスケールは、地域内スケールと地域間スケールである。このレベルの感染症システムは、単一の病原体種/株、単一の宿主種、複数のコミュニティという観点から記述される。このレベルの感染症システムの構成で考えられる共同体としては、地域共同体(村、地区、町、県など)領域共同体(すなわち国家)地域共同体(例えば、世界保健機関(WHO)の世界6地域など)がある。アフリカ地域、アメリカ地域、東南アジア地域、ヨーロッパ地域、東地中海地域、西太平洋地域)。
- (vii) マクロエコシステムレベル このレベルの感染症システムにおいては、異なるコミュニティ(地方、国、地域など)が生態系とみなされる。したがって,このレベルの感染症システムは,複数のコミュニティおよび/または複数の病原体種/株で記述される。このレベルの感染症システムを構成するミクロスケールとマクロスケールは,それぞれマクロ生態系内スケールとマクロ生態系間スケールとなる.このレベルの感染症システムでは、複数の生物種が相互作用しているため、捕食者・被食者の相互作用、病原体・宿主種の競合、複数の病原体・宿主種間の相互作用など、生態学的プロセス・相互作用が感染症ダイナミクスに影響を及ぼしていると考えられる。
図1にはレベル間の相互作用も示されているが(点線の付いた紫色の太い矢印と白い太い矢印で示されている)レベル間の相互作用に関する議論は本稿の範囲外である。レベル間の相互作用の中で注目すべきは、ミクロエコシステムレベルとマクロエコシステムレベルの相互作用(点線付きの太い白矢印で示す)であり、感染症システムの生態と進化のマルチスケールモデリングに関連するものである。
図1 感染症システムの7つの階層的な組織と、各階層に関連するマクロスケールとミクロスケールの概念図
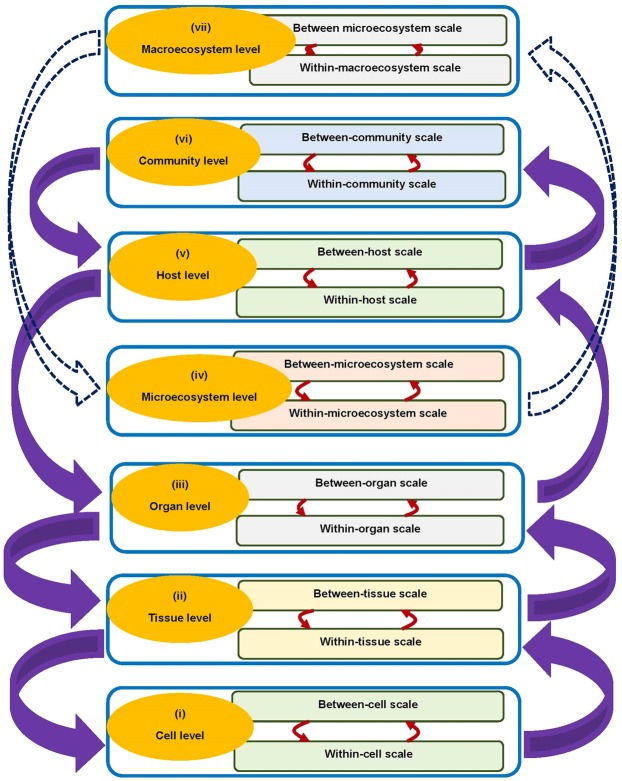
感染症システムの階層レベルにおけるマクロスケールとミクロスケールの相互作用
本稿で提示した感染症システムのマルチスケールモデリングのための複製-伝達相対性理論は、感染症ダイナミクスが7つの階層構造のそれぞれにおいて疾患プロセスの循環的因果関係に直面していることを意味する。これは,これらの各階層組織において,ミクロスケールとマクロスケールが相互に影響を及ぼし合っているためである.感染症システムの各階層構造において、ミクロスケールとマクロスケールが相互に影響し合う基本的なメカニズムは、以下の4つの主要な疾患プロセスの相互作用を通じてもたらされる。すなわち、(i) 病原体による感染/超感染、(ii) 病原体の複製、(iii) 病原体の排泄/放出、(iv) 病原体の伝播の4つの主要な疾患プロセスの相互作用である。感染症システムの各階層では、病原体の複製-伝播のマルチスケール・サイクルが病態のダイナミクスに関与している。この複製-伝達のマルチスケールサイクルは、感染症システムの各階層において、病原体の複製と伝達が起こる特徴的なスケールが一致しないことが多いため起こる。各階層において、マクロスケールは感染/超感染(マクロスケールからミクロスケールへの病原体の移動を伴う)を通じてミクロスケールに影響を与え、ミクロスケールは病原体の排出/排泄(これもミクロスケールからマクロスケールへの病原体の移動を伴う)を通じてマクロスケールに影響を与える。したがって、感染症システムの各階層において、感染・超感染と病原体の排出・排泄は、ミクロスケールでの病原体の複製とマクロスケールでの病原体の伝播の間にマルチスケールな影響サイクルを導入することになる。このため、各階層におけるミクロスケールのみ、あるいはマクロスケールのみの疾病動態は、複製-伝播のマルチスケール・サイクルの一部に限定される。感染症システムの各階層における疾患ダイナミクスを完全に理解するためには、複製-伝達マルチスケールループを閉じて、ミクロスケールの病原体複製過程とマクロスケールの伝達過程の間の完全なフィードバックを考慮する必要がある。複製-伝達相対性理論の文脈で、我々は、ミクロスケールとミクロスケールの間の相互影響には2つの異なるタイプ(タイプI相互影響とタイプII相互影響)が存在することを提案する。図2は、これら2種類のミクロスケールとマクロスケールの間の相互影響を概念的に表したものである。これらの相互影響の性質をまとめると、以下のようになる。
マクロスケールとミクロスケールの間のタイプIの相互影響
このタイプの相互作用では、病原体の排出・放出を通じて、ミクロスケールがマクロスケールに影響を与える。この場合、病原体はミクロスケールからマクロスケールさらに、マクロスケールは、ミクロスケールの初期感染を通じてミクロスケールに影響を与えるが、これには、マクロスケールからミクロスケールへの病原体の移動が含まれる。この場合、マクロスケールはミクロスケールのサブモデル変数の初期条件(初期感染)を通じてミクロスケールに影響を与えるというのが数学的な見方である。
Type II 階層内におけるマクロスケールとミクロスケールの相互影響
このタイプの相互影響では,ミクロスケールも病原体の排出・拡散を通じて,マクロスケールに影響を与える.タイプIの相互影響と同様に、病原体がミクロスケールからマクロスケールしかし、スーパーインフェクション(宿主が感染から回復する前に感染を繰り返すこと)により、マクロスケールがミクロスケールに影響を与える。数学的な観点からは、マクロスケールはマクロスケールの変数やパラメータを縮小することでミクロスケールに影響を与える。
図2 感染症システムの階層的な組織レベルにおけるマクロスケールとミクロスケールの間の2つの異なるタイプの相互影響に関する概念図
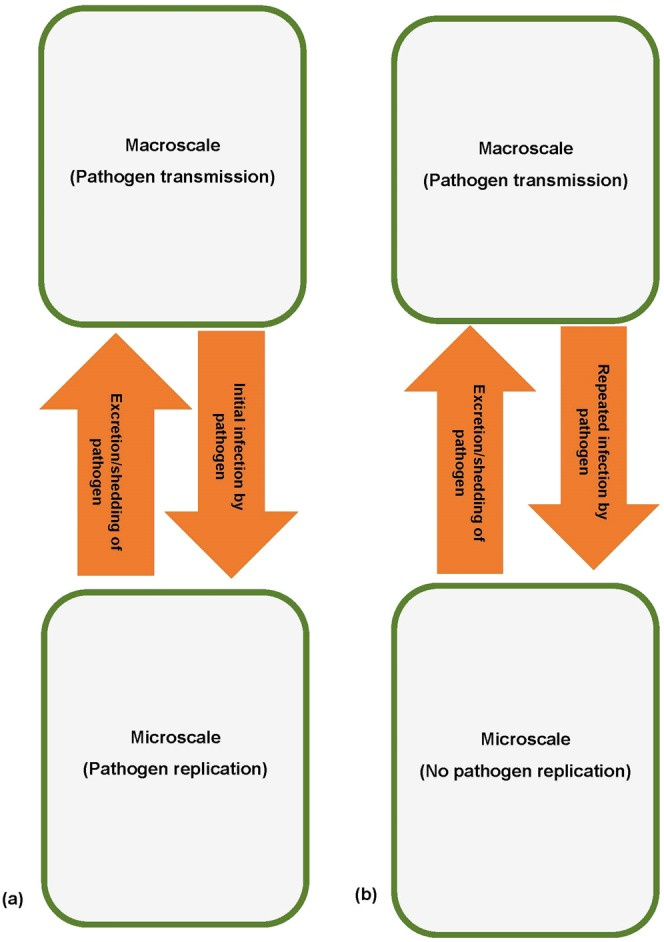
(a) 階層レベル内のマクロスケールとミクロスケールの間のタイプIの相互影響と、(b) 階層レベル内のマクロスケールとミクロスケールの間のタイプIIの相互影響。
複製・伝播相対性理論に含まれる、感染症システムの階層レベルにおけるミクロスケールとマクロスケールの相互作用(双方向性)を用いると、3,4で示した感染症システムのマルチスケールモデルをより正確に5つのカテゴリーに分類することが可能となる。3,4で感染症システムのマルチスケールモデルを分類した時点では、現在複製伝達相対性理論で規定されているタイプIの相互影響の存在については知らなかった。そのため、入れ子型マルチスケールモデルやハイブリッド型マルチスケールモデルは、マクロスケールがミクロスケールに影響を与えないマルチスケールモデルであると考えられていた。しかし、ミクロスケールとマクロスケールの間には常に相互の影響があるとする複製伝達相対性理論に照らし、我々は以下のように感染症システムのマルチスケールモデルを5つに分類して正確に記述している3,4)。
カテゴリーI
個体ベースマルチスケールモデル(IMSM)。ミクロスケールサブモデルとマクロスケールサブモデルがタイプ I の相互影響によって統合された個人の異質性を取り入れながら、感染症システムの特定の組織レベルにおける感染症ダイナミクスを簡略化して記述するマルチスケールモデルの一般的なカテゴリーである。このカテゴリーのマルチスケールモデルでは、マクロスケールは、しばしば、ミクロスケールの実体の創発的な振る舞いとして観察される。
カテゴリーII
入れ子型マルチスケールモデル(NMSM). マルチスケールモデルの一般的なカテゴリーで、感染症システムの特定のレベルの組織における感染症ダイナミクスを記述する簡便な手段を提供するもので、ミクロスケールのサブモデルとマクロスケールのサブモデルがタイプ I の相互影響によって統合されたものである。ミクロスケールサブモデルとマクロスケールサブモデルは、同じ形式または数学的表現で記述されなければならない。
カテゴリーIII
組み込みマルチスケールモデル(EMSM): ミクロスケールサブモデルとマクロスケールサブモデルがタイプ II の相互影響により統合されている感染症システムの特定の組織レベルにおける感染症ダイナミクスを簡略化して記述するマルチスケールモデルの一般的なカテゴリーである。ミクロスケールサブモデルとマクロスケールサブモデルは、同一の形式または数学的表現で記述される必要がある。
カテゴリーIV
ハイブリッドマルチスケールモデル(HMSM)。マルチスケールモデルの一般的なカテゴリーであり、感染症システムの特定の組織レベルにおける感染症ダイナミクスを記述する簡便な手段を提供する。このモデルでは、ミクロスケールサブモデルとマクロスケールサブモデルがタイプI相互影響またはタイプII相互影響によって統合されている。ただし、この場合、ミクロスケールサブモデルとマクロスケールサブモデルは、異なる数学的表現で記述される。このようなペアの形式主義の例としては、決定論的/確率論的、離散時間/連続時間、機械論的/現象論的、ODE/PDE、ODE/ABM、ODE/CA 等がある。
カテゴリーV
マルチスケール連成モデル(CMSM): マルチスケールモデルの一般的なカテゴリーであり、シングルスケールのサブモデルとカテゴリーI、II、III.のいずれかのマルチスケールモデルを統合することにより、感染症システムの複数の組織レベルにおける感染症のダイナミクスを簡略化して記述する手段を提供する。とIV(奇数である2つ以上のスケールを統合したマルチスケールモデル)またはカテゴリーI、II、III、IVのいずれかのマルチスケールモデルを、タイプI相互影響、タイプII相互影響、またはその両方の組み合わせによって統合したものである(偶数である2つ以上のスケールを統合したマルチスケールモデル)。このカテゴリーで開発されたマルチスケールモデルは、複数の病原体株感染、および/または複数の病原体種感染、および/または複数の宿主グループ感染、および/または複数の宿主種感染、および/または複数のコミュニティ感染、および/または複数の器官/解剖学的区画感染を考慮したものである。カテゴリーI、II、III、IVとは異なり、マルチスケールモデリングにおける感染症システムの関係のうち、(i)1宿主、(ii)1病原体種/株、(iii)1レベルの組織の特定の組み合わせに焦点を当てたものである。したがって,レベル間の相互影響は,結合マルチスケールモデルによって特徴づけられる。
この5つの感染症システムのマルチスケールモデルの分類は、3,4でマクロスケールからミクロスケールへの影響がないとした分類を、複製伝達相対性理論の仕様に沿って、マクロスケールとミクロスケールの間にタイプIの相互影響があることを明示した以外は、3,4と同様である。感染症システムの各階層で開発された5種類のマルチスケールモデルの詳細なレビューについては、3.を参照されたい。本稿では、環境感染型感染症システムである鉤虫感染症のマルチスケールモデルを用いて、ミクロスケールとマクロスケールの関係を、感染症システムの宿主レベルでのタイプII相互影響によって記述した場合の複製・伝播理論の有効性を説明する。一般に,環境感染型感染症システムとは,地理的環境の物理的実体(土壌,水,接触面,空気,食物など)において,感染物質(病原体)が何らかの自由生活ステージを持つ感染症システムである。このような感染症システムのダイナミクスを宿主レベル(宿主内スケールと宿主間スケールをそれぞれミクロスケールとマクロスケールとする)で考えた場合、宿主間スケールでの感染症伝播は、地理的環境の物理的実体(土壌、水、接触面、空気、食物など)において病原体が自由に生きていることにより促進される。我々は、環境感染型感染症システムを3つのタイプに分類している。
タイプI:環境感染型感染症システム
ミクロスケール(宿主内スケール)での病原体の複製が存在しない環境感染型感染症で、住血吸虫症7,ギニアワーム8,鉤虫症9などの土壌感染型蠕虫症などがある。特に蠕虫の感染症では、一部の例外(Strongyloides、Trichinella、一部のサナダムシ幼虫)を除き、蠕虫は宿主内でミクロスケール(宿主内スケール)での複製により数を増やすことがないからである。これらの感染症では、宿主内スケールの病原体負荷は、環境(水、土壌、食物、空気、接触表面など)において宿主が遭遇する(すなわち宿主に取り込まれる)感染ステージの数に直接関係し、スーパーインフェクション(すなわち宿主が感染エピソードから回復する前に感染を繰り返すこと)を通じて、宿主の感染力を高める。このような環境伝搬型の感染症システムでは、宿主の行動が、特定のコミュニティにおける疾病負担に影響を与える主要因となる。なぜなら、特に衛生面に関して特定の行動をとることで、疾病伝播がより大きくなるからである。このような感染症システムは、宿主レベルのミクロスケールとマクロスケールの関係を記述するII型相互影響モデルを組み込んだマルチスケールモデルによってモデル化することが可能である。
タイプII環境感染型感染症システム
病原体がミクロスケール(宿主内スケール)のみで複製される環境感染型感染症システムである。インフルエンザなどのウイルス感染症10や、結核菌11,結核菌12などの細菌感染症は、このタイプ2の環境感染型感染症システムの好例である。このような感染症システムは、感染症システムの宿主レベルのミクロスケールとマクロスケールの関係を記述するタイプIの相互影響という、入れ子のマルチスケールモデルによってモデル化することが可能である。
タイプIII環境感染型感染症システム
病原体がミクロスケール(宿主内スケール)とマクロスケール(宿主間スケール)の両方で複製される環境伝搬型感染症システムである。コレラ13,サルモネラ菌14,炭疽菌15などの日和見感染症がその例である。これらの感染症システムにおいては、タイプIの相互影響とタイプIIの相互影響の組み合わせが、感染症システムの宿主レベルのミクロスケールとマクロスケールの関係を記述する。
以下では、宿主レベルの鉤虫感染症のマルチスケールモデルを構築し、後に、ミクロスケールとマクロスケールの関係をタイプII相互影響によって記述した場合の複製・伝播相対性理論の有効性を説明する。先に述べたように、タイプII相互作用は、(i)スーパーインフェクション(宿主が感染エピソードから回復する前に感染を繰り返すこと)-宿主間スケールが宿主内スケールに及ぼす影響-と(ii)病原体の排出・放出-宿主間スケールに及ぼす影響-から構成されている。ただし、マルチスケールモデリングは、環境感染するI型感染症システムの一般的なマルチスケールモデルを宿主レベルで開発することから始める。この一般的なマルチスケールモデルを、パラダイムとして鉤虫感染症に適用する。この一般的なマルチスケールモデルを開発することで、I型の環境感染型感染症システムに対して独自のマルチスケールモデルを開発し、感染症システムのホストレベルの組織における複製-伝播相対性理論の有効性を実証しようとする人々が、どこから始めればよいかがわかるようにする。
I型の環境感染型感染症システムの一般的なマルチスケールモデル
複製伝達相対性理論では、感染症システムの7つの主要な階層構造のいずれにおいても、必ずミクロスケールとマクロスケールの間に相互影響があるとされているが、このようなミクロスケールとマクロスケールの間の相互影響の性質を立証するツールは、(i)直接感染、(ii)環境感染、(iii)媒介感染といった異なる感染経路を持つ感染症システムに対してさらに開発することが必要である。宿主が病気の状態によって感受性宿主SHと感染宿主IHに区分され、感染宿主の自然回復がないI型の一般的な環境伝搬型感染症システムを考えてみよう。ここで、Y0=PFを環境中の最初のライフステージの病原体集団、Yn=PHを環境中の最後のライフステージ(感染性ライフステージとも仮定)の病原体集団、Y1,Y2,……、Yn-1を環境中の他の中間ライフステージ(すなわちマクロスケールでの)の病原体集団と仮定する。さらに,X0=Pfは感染宿主の最初のライフステージの病原体集団,Xm=Phは感染宿主の最後のライフステージ(環境中に排泄されるライフステージでもある)の病原体集団,X1,X2,……,Xm-1は感染宿主の他の中間ライフステージ(すなわち,ミクロスケール)の病原体集団であると仮定する.宿主間スケール(マクロスケール)のSH, IH, Y0, Y1, …, Ynと宿主内スケール(ミクロスケール)のX0, X1, …, Xmを統合したマルチスケールモデルを開発する。
環境感染型感染症システムの感染に関与する宿主種が1種のみのI型環境感染症が存在すると仮定すると、宿主レベルでのヒト-環境、環境-ヒトの感染要素を含むマルチスケールモデルとなる。このような宿主レベルの環境感染型感染症システム構築のための基礎理論・科学は、前論文7で環境感染型媒介感染症システム、特にヒト住血吸虫症の文脈で紹介したとおりである。ここでは、このマルチスケールモデリングのアプローチをより一般的な方法で確立するために、いくつかの改良を加えている。宿主レベルのI型環境感染症システムにおけるミクロスケールとマクロスケールの相互影響のマルチスケールモデリングについて、7から得られた2つの主要な教訓は、この相互影響は次のようにモデル化できることである。
(i)宿主間スケール
(宿主レベルのマクロスケール)が超感染を通じて宿主内スケール(宿主レベルのミクロスケール)に及ぼす影響は、宿主間スケールの環境中への取り込みを、宿主への集団レベルの感染による速度βHλH(PH)SHから個々の宿主への繰り返し感染による速度βHλH(PH)[SH(t)-1]ΦH[IH(t)+1]にダウンスケールしてモデル化することが可能だ。しかし、この超感染の表現は、2つの点で7におけるアプローチを洗練させたものである。まず、7 のアプローチでは、λH(PH)の関数形式を規定している。ここでλH(PH)は一般的な関数クラスであり、その性質については後述する。次に、in7のアプローチでは新規感染者数を過大評価しているが、ここでは新規感染者数は既存の累積感染者数の割合ΦHであると仮定している。
(ii) 宿主内スケール
(宿主レベルのミクロスケール)が病原体の排出・排泄を通じて宿主間スケール(宿主レベルのマクロスケール)に及ぼす影響は、宿主内スケールから宿主間スケールへαhPhの割合で宿主個人の排泄・排泄をアップスケールすることでモデル化することが可能である。この病原体の排泄/排出のアップスケールは、[IH(t) + 1]αhPh(t)でモデル化される。
このような基本的な考え方に基づき、7で述べたミクロスケールとマクロスケールの状態変数の間のカジュアルなリンクを、宿主レベルのI型環境感染症システムの一般的なマルチスケールモデルに再構成することができる。
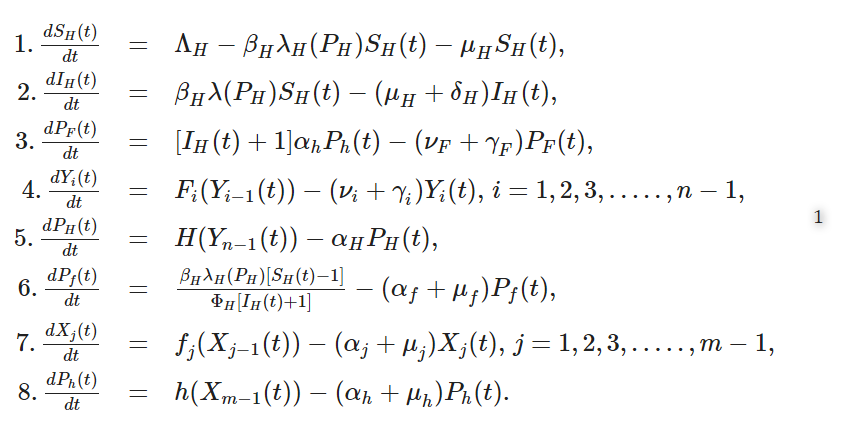
一般的なマルチスケールモデル(1)では、I型の環境感染型疾患系の感染率はβHλH(PH)という式でモデル化される。この関数λHは次のような仕様を持っている:λH: [0, ∞] → [0, 1] は環境感染性レザバーPHに曝露したときに宿主が感染する確率を表す。さらに、関数λHは以下の2つの望ましい性質を持つ必要がある16。
i.性質I
感染確率は病原体がないときには消滅し(すなわち、λH(0)=0)環境中の病原体の負荷が大きくなると1に近づく(すなわち、limPH→∞λH(PH)=1)。
ii.性質II
感染確率λH(PH)は環境病原体集団PHとともに増加する、すなわち、λ’H(PH)>0,ここで、素数は引数に対する微分を表す。
λH(PH)には、上記の2つの性質を満たす関数がいくつかあり、次の2つの典型的な例がある。
a.負の指数関数的な感染応答関数。この関数は次のような形式をとる16
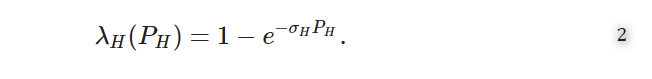
b.シグモイド型感染症応答関数。この関数は次の式で表される17
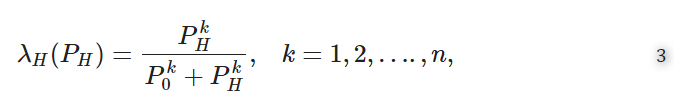
ここで、パラメータkはシグモイド感染性応答の急峻さを定義する。
上記(a)(b)において、P0は50%の感染確率を与える環境病原体量であり、σH=ln(2P0)18である。しかし,本研究で示された環境伝搬型感染症システムのマルチスケールモデリング手法は,まだ基礎の段階である.そのため、経験則に基づいて性質IとIIを持つλH(.)の特定の解析形式を選択するための環境感染型感染症システムに関するデータ収集はまだできていない。したがって、λH(.)の解析形式の選定は、上記の性質Iと性質IIを満たすことができるものに限定される。
環境感染型感染症システムの一般的なマルチスケールモデル(1)において、式(1)と式(2)は、一般的なマルチスケールモデル(1)の式(5)で与えられる環境中の病原体負荷に対して、感染力応答関数(2)または(3)3)に基づき感染力が規定されるホスト間スケールでのI型感染症システムの伝播を記述している。一般的なマルチスケールモデル(1)の式(3〜5)は、宿主外環境における様々なライフステージの病原体集団の動態を記述するものである。これらの式の中で、Eq. (3)は宿主外環境における第一ライフステージの病原体群の動態を記述し、(4)は宿主外環境における第二ライフステージの病原体群の動態を記述する。(5)は、宿主外環境における最後のライフステージにおける病原体群の変化を記述している。式(4)は、宿主外環境における中間ライフステージ(すなわち、宿主間スケール)の病原体集団のダイナミクスを記述するものである。これらの式(すなわち、(3-5))において、あるライフステージから別のライフステージへの移行(Fi(Yi-1(t))i = 1, 2, …, n – 1,およびH(Xn-1(t)によりモデル化)は、次のライフステージへの発生的変化、または宿主外環境における病原体の複製を伴う前のライフステージから次のライフステージを生成することにより、どちらかのライフステージに移行すると考えられる。一般的なマルチスケールモデル(1)の最後の3つの式、すなわち式(6-8)は、宿主内環境における異なるライフステージでの病原体群の動態、すなわち宿主内スケールでの動態を記述している。これらの式において、Eq. (6)は宿主内環境の第一ライフステージにおける病原体群の動態を表し、(6)は宿主内環境の第二ライフステージにおける病原体群の動態を表す。(8)は、宿主内環境の最終ライフステージにおける病原体群の変化を記述している。式(7)は、宿主内環境の中間ライフステージにおける病原体群の動態を記述している。宿主内環境では、病原体はあるライフステージから別のライフステージへ移行する(fj(Xj-1(t), j = 1, 2, …, m – 1, h(Xm-1(t)) でモデル化される)が、それは発生上の変化のみで、環境感染型のI型感染症システムで予想される宿主内環境での病原体の複製は起こらない。一般マルチスケールモデル(1)の変数は表1にまとめられている。
表1 一般的なマルチスケールモデル(1)の変数の概要
一般的なマルチスケールモデルの変数の要約(1)。
| いいえ。 | 変数 | 説明 |
|---|---|---|
| 1.1。 | S H(t) | 時間tでの感受性の高い人間の人口 |
| 2.2。 | I H(t) | 時間tでの感染した人間の人口 |
| 3.3。 | P F(t) | 時間tにおける外部宿主規模の環境病原体の最初のライフステージの個体数 |
| 4.4。 | P H(t) | 時間tにおける外部宿主規模の環境病原体の最後のライフステージの個体数 |
| 5.5。 | Y i(t)、i = 1、2、3、…。n − 1 | 時間tで最初と最後のライフステージではない外部宿主規模の環境病原体の中間ライフステージの集団 |
| 6.6。 | P f (t) | 時間tにおける宿主内規模の環境病原体の最初のライフステージの個体数 |
| 7。 | P h(t) | 時間tにおける宿主内規模の環境病原体の最後のライフステージの個体数 |
| 8.8。 | X j(t)、j = 1、2、3、…。m − 1 | 時間tで最初と最後のライフステージではない、宿主内規模の環境病原体の中間ライフステージの集団 |
図3 鉤虫感染症システムのマルチスケールモデルの概念図
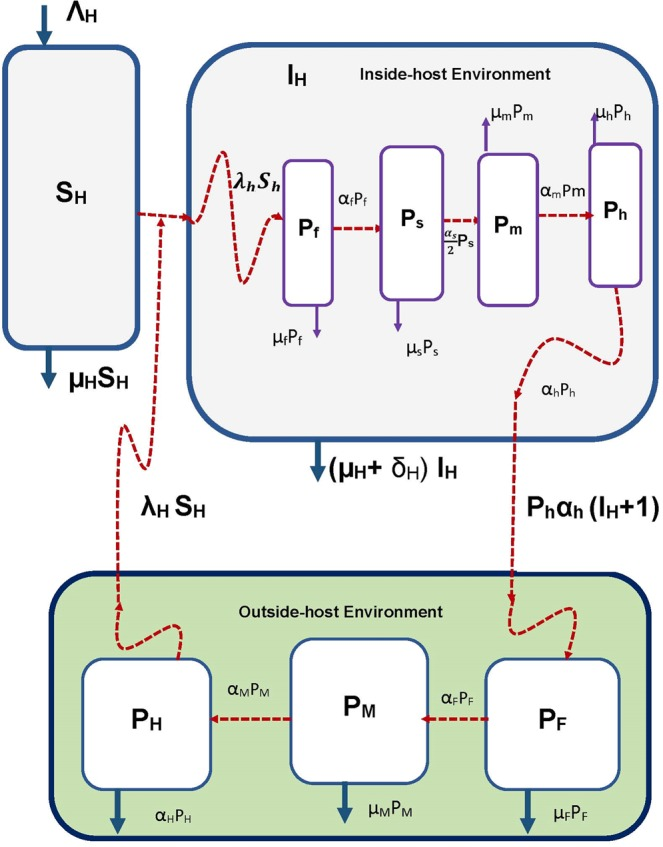
この図ではλhSh=βHPH(t)[SH(t) -1][P0+PH(t)]ΦH[IH(t)+1] である。
7に従うと、以下の2つの重要な結果を容易に導き出すことができる。
a.正のパラメータを持つ一般的なマルチスケールモデル(1)の変数は、すべてのt≧0およびΛH>μHにおいて非負のままであり、生物学的現実の基本的性質に反することはない。
b.感染応答関数(2)(3)の中から選ばれた特定のλH(PH)に対して、一般マルチスケールモデル(1)の解は、ΛH > μHに対して境界が設定されたものである。
したがって、一般的なマルチスケールモデル(1)はΛH > μHに対して数学的・生物学的に良好な解を持つことになる。以下すべてにおいて、(特に断らない限り)ΛH>μHと仮定することにする。
パラダイムとしての一般的マルチスケールモデルの鉤虫感染症への応用
鉤虫感染症は、鉤虫と呼ばれる土壌伝染性線虫によって引き起こされる感染症システムである。この病気は、世界の熱帯地域全体で10億人もの人々がこの腸内寄生虫に感染していることから、公衆衛生上重要な病気である19。ヒトへの感染のほとんどを占めるのは、(i) Ancylostoma duodenale – 皮膚からの侵入と経口摂取の両方によって感染し、より温帯で優勢である- と (ii) Necator americanus – 経口摂取によってのみ感染し、熱帯環境に適応している-の2種である。鉤虫のライフサイクルには主に7つの段階があり、そのうち4つは人体内(すなわちミクロスケール)で、残りの3つは地理的環境内(すなわちマクロスケール)で起こる。鉤虫のライフサイクルの詳細については、発表された論文20に詳細が記載されている。この節では、マルチスケールモデリングに関連する簡単な説明のみを提供する。本節では、前節で開発したI型環境感染症の一般的なマルチスケールモデルを鉤虫感染に適用し、鉤虫の7つのライフステージをマルチスケールモデルに明示的に組み入れる。図3は、寄生虫の集団動態(各ライフステージにおける病原体負荷)の観点から、鉤虫の7つのライフステージを明示的に組み込んだ鉤虫感染症のマルチスケールモデルの概念図である。ヒト宿主における鉤虫の4つのライフステージのうち、最初のライフステージ(すなわちミクロスケール)は、このライフステージにおける寄生虫負荷の観点から、図3ではX0 = Pfと表記し、超感染(宿主が感染エピソードから回復する前に感染を繰り返すこと)で始まるとしている。これは、土壌中に生息するヒト宿主(第3期幼虫またはL3として知られている)への感染ライフステージである地理的環境(すなわちマクロスケールまたは宿主間スケール)において、その最終ライフ(このライフステージにおける病原体量の観点から図3のYm = PHで示される)の鉤虫の移動に関係するものである。宿主侵入後、この第1生活段階は消化管消化管内では、この第1生活段階は、μfの想定速度で自然死するか、またはαfの想定速度で脱皮して、第2生活段階または第1中間生活段階(図3では、この生活段階における病原体負荷の観点から、X1=Psと表記)を形成するか、のいずれかである。この第2生活段階Psは、想定される速度μsでの自然死、または速度αs/2で第2脱皮を受けることによって減少し、図3においてX2=Pmで示される鉤虫の第2中間生活段階の人口を確立し、これは自然死速度μmを有すると想定される成虫の人口である。1/2倍したαsは、未成熟虫の半数は雌であり、宿主内スケールの鉤虫の最終ライフステージである鉤虫卵を生み出す疾病動態においては、雌虫の性成熟までの発育速度のみを考慮するという仮定をモデル化したものである。雌の虫は、宿主内スケールの鉤虫の最後のライフステージである卵を産む。宿主内スケールの虫卵の集団(図3ではXm=Phと表記)は、想定される速度μhで分解されるか、あるいは想定される速度αhで地理的環境(すなわちマクロスケール)に排泄/流出されるかのいずれかである。鉤虫卵の排泄/放出は、宿主間スケールでの鉤虫の第1生活段階を確立する。この宿主間スケールの鉤虫の第1生活段階(図3ではY0=PFと表記)は、マクロスケール環境において卵が想定速度μFで分解されて枯渇するか、卵が想定速度αFで孵化して第1期幼虫(L1)(図3ではY1=PMとも表記)という最初で最後の中間生活段階を生じさせる可能性もある。L1はαMの速度で脱皮し、第3期幼虫(L3)と呼ばれる宿主間スケールの鉤虫の最後の生活段階を生じ、これはヒト宿主に感染性を持ち、超感染によりヒト宿主に第1期を定着させて再び鉤虫繁殖サイクルを開始させる。この鉤虫の最後の感染性生活段階は、この生活段階における病原体負荷の観点から、図3においてYn=PHと示され、地理的環境において平均寿命が1/αHであることによって枯渇している可能性がある。4節で一般的なマルチスケールモデル(1)に対して指定した感染応答関数(2)(3)から、λH(t)=βHPH(t)P0+PH(t)を選ぶとする。とすると、宿主内スケールで鉤虫の第1生活期の集団を導入する超感染(X0=Pfとする)は、βHλH(PH)[SH(t)-1]ΦH[IH(t)+1]=βHPH(t)[SH(t)-1][P0+PH(t)]ΦH[IH(t)+1]によりモデル化される。これらの仕様と記述をすべて考慮すると、鉤虫感染のマルチスケールモデル(図3にも概念的に表現されている)は次のようになる。
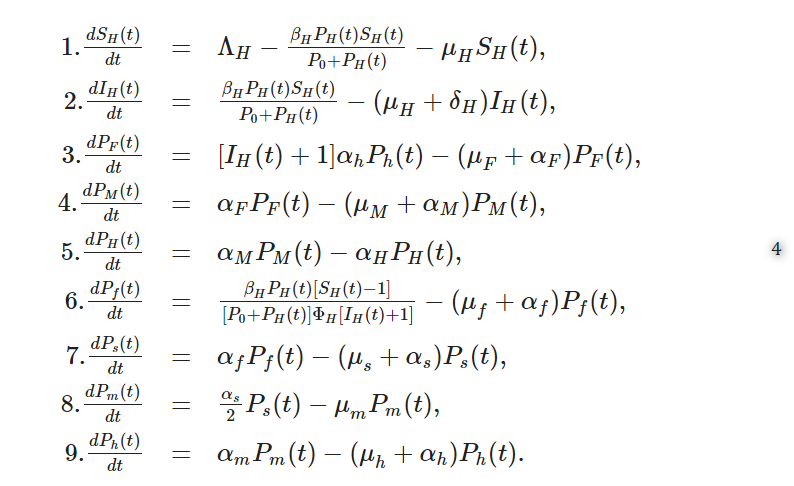
マルチスケールモデル(4)のパラメータを表2にまとめた。しかし、すべてのモデリングに制約がないわけではない。マルチスケールモデル(4)の限界の一つは、評価に用いるパラメータを単一のパンデミック状況から選択することができないことである。H*]と記された人口統計学的パラメータは、発展途上国の値の範囲内になるように選ばれた。同様に、鉤虫感染症に特化した疫学パラメータが見つからない場合は、[R*]と記されたパラメータを使用した。R*」と記載されたパラメータは、蠕虫感染の値の範囲内で選択された。この論文におけるマルチスケールモデリング手法のさらなる限界は、異質性や、選択、突然変異、宿主-病原体相互作用における共進化の一形態である病原体に対する免疫反応の発達といった、感染症システムの生態学と進化における他の現実的特徴を取り込んでいないことである。したがって、本稿のマルチスケールモデリングのアプローチは、本稿のマルチスケールビジョンを活用して、(i)ネットワークベースマルチスケールモデル(IMSM)3,4など、グラフ理論やネットワークモデリング技術を用いて開発することにより、拡張の機会を提供するものである。あるいは、(ii) データベースマルチスケールモデル(D-MSM)-階層的な実証データをモデル化するための統計モデリング技術を用いて開発されたもの、あるいは、(iii) シミュレーションベースマルチスケールモデル(S-MSM)-異種性、突然変異、選択などを説明するためのエージェントベースモデル(ABM)セルラーオートマトン(CA)とペトリネット(PN)などを含む計算アルゴリズムに基づいているものである。感染症システムのマルチスケールモデリングに利用されている。
表2 (4)で与えられるマルチスケールモデルのパラメータ値の表。
| いいえ。 | パラメータ | 意味 | 値[探索範囲] | 単位 | ソース/合理的 |
|---|---|---|---|---|---|
| 1.1。 | Λ H | 出生および移民による感受性の高い人間の採用率 | 0.0001 [0.0001–0.0003] | -1日目 | [ H * ] |
| 2.2。 | β H | 人間の感染率 | 0.1 [0.3000–0.00300] | -1日目 | [ R * ] |
| 3.3。 | μ H | 人間の自然死亡率 | 0.00001 [0.0001–0.00001] | -1日目 | [ H * ] |
| 4.4。 | δ H | 病気による死亡率 | 0.004 [0.004–0.0001] | -1日目 | [ H * ] |
| 5.5。 | P 0 | 鉤虫感染の飽和定数 | 1000 [100–10000] | -1日目 | 想定 |
| 6.6。 | α H | 感染性幼虫の自然崩壊 | 0.2000 [0.1000–0.3333] | -1日目 | 25 |
| 7。 | α F | 卵が孵化する速度 | 0.7000 [0.5000–1.000] | -1日目 | 26 |
| 8.8。 | μ F | 地理的環境におけるフックワーム卵の自然崩壊率 | 0.183561 [0.079472–0.260274] | -1日目 | 9 |
| 9.9。 | Φ H | 新しい感染の割合 | 0.03000 [0.003–0.3000] | -1日目 | 想定 |
| 10.10。 | α M | 未熟なワームが感染性のワームになる割合 | 0.200 [0.0714–0.500] | -1日目 | 27 |
| 11.11。 | μ M | 地理的環境における未熟なワームの自然死 | 1.427397 [0.805479–2.276712] | -1日目 | 9 |
| 12.12。 | μ F | ヒト宿主における最初のライフステージフックワームの自然死亡率 | 0.0400 [0.0200–0.0600] | -1日目 | [ R * ] |
| 13.13。 | α F | 最初のライフステージのフックワームの小腸への移動速度 | 0.0250 [0.0200–0.0357] | -1日目 | [ R * ] |
| 14。 | μ 秒 | 小腸における未熟なワームの自然死亡率 | 0.0400 [0.02–0.0800] | -1日目 | [ R * ] |
| 15。 | α S | 成熟したワームの発育率 | 0.0250 [0.0200–0.0357] | -1日目 | 28 |
| 16.16。 | α メートル | 成虫のメスのワームが卵を産む速度 | 10000.0 [3000.0–20000.0] | -1日目 | 25 |
| 17.17。 | μ メートル | ヒト宿主内の成熟したメスのワームの自然死亡率 | 0.000833 [0.000685–0.000913] | -1日目 | 28 |
| 18.18。 | α H | 地理的環境への鉤虫の卵の排泄率 | 0.320548 [0.019178–1.369863] | -1日目 | 29、 30 |
| 19。 | μ H | ヒト宿主における鉤虫卵の自然崩壊 | 0.0400 [0.0400–0.0001] | -1日目 | [ R * ] |
マルチスケールモデルの解析によるマクロスケールとミクロスケールの相互影響の証拠
この節では、マルチスケールモデル(4)の解析から得られた、ミクロスケールとマクロスケールの相互作用に関する2つの証拠を紹介する。以下の2つの節で、マルチスケールモデル(4)の再生産数と常在平衡の解析から得られた2つの証拠である。
再生産数から見たマクロスケールとミクロスケールの相互作用の証拠
マルチスケールモデル(4)の基本再生産数を次世代演算子アプローチで決定する21。21のアプローチに従って、マルチスケールモデル(4)は次のような形式で書くことができる。
ここで
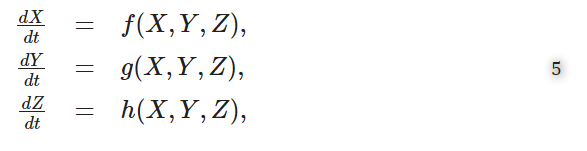
i. X=(SH)は、感染していない個体の全区画を表す。
ii. Y = (IH, Pf, Ps, Pm, Ph, PF, PM) は、他人に感染させる能力のない感染個体の全区画を表す。
iii. Z = (PH)は他人に感染させることが可能な感染者の区画をすべて表す。
21の他の追加ステップに従って、マルチスケールモデル(4)の基本再生産数を示すことができる。
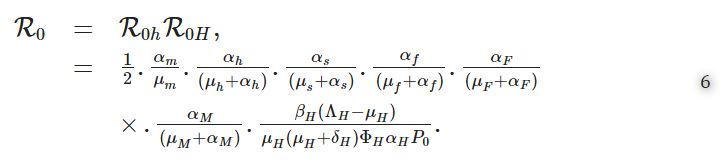
(6)のR0の式において、R0hは宿主内スケール部分再生産数、R0Hは宿主間スケール部分再生産数で、次の式で表される。
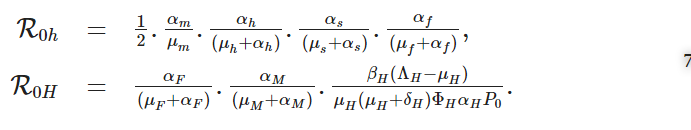
鉤虫感染の基本再生産数の式(6)から、それは宿主内スケールパラメーターと宿主間スケールパラメーターの両方の関数であると結論づけられる。したがって、ここで得られた結果は、ミクロスケール(宿主内スケール)とマクロスケール(宿主間スケール)が、鉤虫感染に対して相互に影響を及ぼし合っていることを示している。
風土病平衡によるマクロスケールとミクロスケールの相互影響の証拠
ここで、宿主内スケールと宿主間スケールの相互影響の根拠を確立するために、マルチスケールモデル(4)の常在平衡を見ることにする。ここで
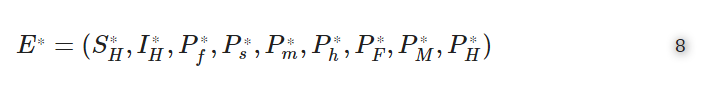
は、マルチスケールモデル(4)の固有値解となる。そして、S⁎H,I⁎H,P⁎f,P⁎s,P⁎m,P⁎h,P⁎F,P⁎M を P⁎H で表すと、以下のようになる。
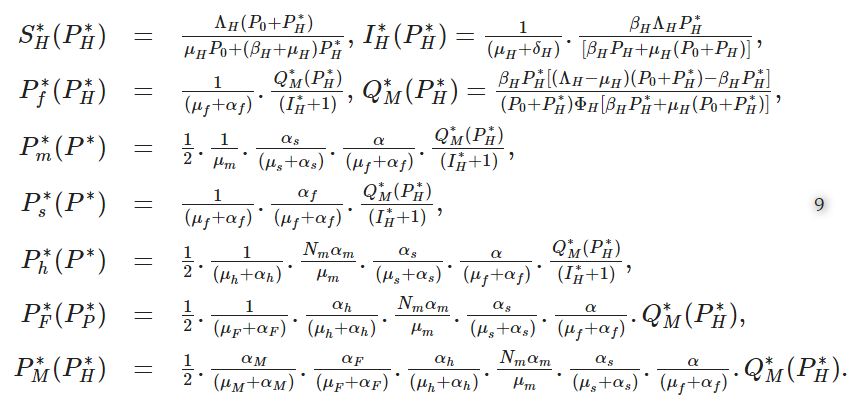
式(1)を代入する。(9)を次式で与えられるPHの式に代入する。
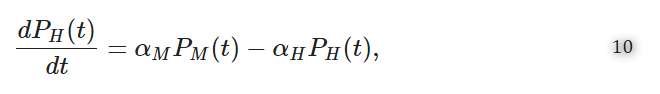
を得ることができる。

ここで
である。
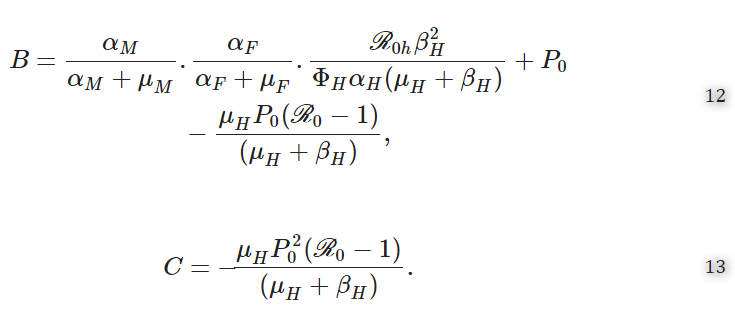
したがって
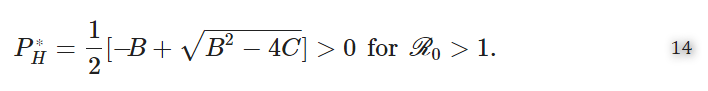
なお、R0>1ではC<0,Bは正または負のどちらかである。そうすると、マルチスケールモデル(4)はR0>1に対して1つの正の常在平衡を持つと結論づけられる。さらに、S⁎H,I⁎H,P⁎F,P⁎M,P⁎Hのホスト間スケールパンデミック表現は、ホスト内スケール疾患パラメータとホスト間スケールパラメータによって決まり、順番に推論する。P⁎f, P⁎s, P⁎m, P⁎h のホスト内スケールパンデミック表現は,ホスト内スケールとホスト間スケールの両方のパラメータに依存している.したがって、ここで得られた結果は、ミクロスケール(ホスト内スケール)とマクロスケール(ホスト間スケール)が相互に影響し合っていることも示している。
マルチスケールモデルの数値シミュレーションによるミクロスケールとマクロスケールの相互影響の証拠
ここでは、マルチスケールモデル(4)の数値シミュレーションの結果を用いて、マクロスケールとミクロスケールの相互影響の証拠を提示する。マルチスケールモデル(4)のシミュレーションは以下の2つのサブセクションで紹介される。マルチスケールモデル(4)のシミュレーションに使用した初期条件は以下の通りである。SH(0)=20000, IH(0)=0, PF(0)=0, Pm(0)=0, PH(0)=200, Pf(0)=20, Pm(0)=0, Ps(0)=0, Ph(0)=0, 病気のパラメータ値は表2に示す通りである.
鉤虫感染症における宿主内スケールパラメータが宿主間スケール変数に与える影響のエビデンス
このサブセクションでは、鉤虫感染に関するマルチスケールモデル(4)を用いて、選択されたホスト内スケールパラメータ(αh、αf、αm)がホスト間スケール変数(IH、PF、PM、PH)に与える影響の証拠を提示する。鉤虫感染症について、ホスト内スケールパラメータがホスト間スケール変数に与える影響を調べた結果を図4に示すと、以下のようになる。
αhがIH、PF、PM、PHに及ぼす影響:図4(a)は、αhの値が異なる場合のIH、PF、PM、PHの変化を示す:αh = 0.3202 、αh = 0.03202 、αh = 0.003202 。
IH、PF、PM、PHに対するαfの影響:図4(b)は、αfの値が異なる場合(αf=0.25,αf=0.025,αf=0.0025)におけるIH、PF、PM、PHの推移を示すものである。
αmがIH、PF、PM、PHに与える影響:図4(c)は、αmが異なる場合:
αm=100,αm=1000,αm=10000のIH、PF、PM、PHの推移を示すもので、
αm=100,αm=1000,αm=10000は、IH、PF、PM、PHに与える影響が大きい。
41598_2019_52820_Fig4_HTML.jpg
図4
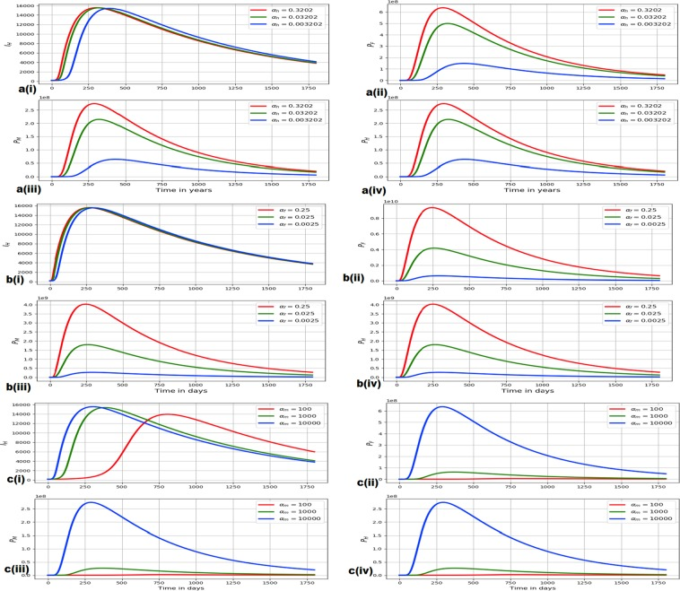
(a) αhの値を変えたときのIH、PF、PM、PHの変化を示す
αh = 0.3202, αh = 0.03202, αh = 0.003202. (b) αfを変化させた場合のIH、PF、PM、PHの変化を示す:αf = 0.25, αf = 0.025, αf = 0.0025. (c) αm = 100, αm = 1000, αm = 10000の各値におけるIH, PF, PM, PHの変化を示す。
図4の3組の数値結果(すなわち、図4(a-c))から、ホスト内スケールパラメータαh、αf、αmが変化すると、ホスト間スケール変数IH、PF、PM、PHも変化することが分かる。また、図4は、記事の大きさを考慮して、いくつかの宿主内スケールパラメータを選択した結果であるが、他の宿主内スケールパラメータ(ここでは結果を報告しない)でも、宿主間スケール変数IH、PF、PM、PHに同様の影響を与えることが確認された。このことは、鉤虫感染症の疾病動態において、in-host scaleがinter-host scaleに影響を与えることを示唆している。
鉤虫症における宿主間スケール変数が宿主内スケール変数に影響を与える証拠
この節では、鉤虫感染に関するマルチスケールモデル(4)を用いて、選択されたホスト間スケールパラメータ(βH、αH、ΦH)がホスト内スケール変数(Pf、Ps、Pm、Ph)に及ぼす影響の証拠を提示する。鉤虫感染症について、ホスト間スケールパラメータがホスト内スケール変数に与える影響を調べた結果を図5に以下のように示す。
βHがPf,Ps,Pm,Phに及ぼす影響:図5(a)は,βHを0.1,βHを0.01,βHを0.001に変化させたときのPf,Ps,Pm,Phの変化を示している.
αHのPf、Ps、Pm、Phへの影響:図5(b)は、αHの値が異なる場合のPf、Ps、Pm、Phの変化を示している:αH = 0.8 、αH = 0.2 、αH = 0.002 である。
Pf、Ps、Pm、Phに対するΦHの影響:図5(c)は、ΦHの値を変えた場合のPf、Ps、Pm、Phの変化を示している:ΦH = 0.3, ΦH = 0.1, ΦH = 0.03である。
図5
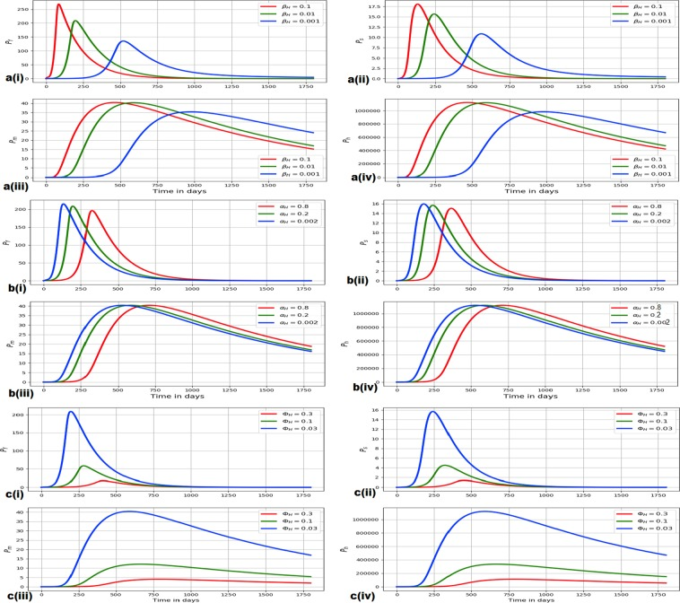
(a) βH = 0.1, βH = 0.01, βH = 0.001 の各値における Pf, Ps, Pm, Ph の推移を示す。(b) αH = 0.8, αH = 0.2, αH = 0.002 の場合の Pf, Ps, Pm, Ph の変化を示す。(c) ΦHの値を変えた場合のPf、Ps、Pm、Phの変化を示す: ΦH = 0.3, ΦH = 0.1, ΦH = 0.03。
図5の3組の数値結果(すなわち、図5(a〜c))から、ホスト間スケールパラメータβH、αH、ΦHが変化すると、ホスト内スケール変数Pf、Ps、Pm、Phも変化することが分かる。また、図5では、原稿の大きさを考慮し、いくつかのホスト間スケールパラメータを選択したが、他のホスト間スケールパラメータ(ここでは結果を報告しない)でも、ホスト内スケール変数Pf、Ps、Pm、Phに同様の影響を与えることが示された。
図4と図5に示した数値結果を総合すると、鉤虫症の病期には、宿主内スケール(ミクロスケール)と宿主間スケール(マクロスケール)の間に相互の影響があることがわかる。これらの数値結果は、第6節で示した、鉤虫感染の再生産数と常在平衡の両方が、宿主内スケールパラメータと宿主間スケールパラメータの両方の関数であることと一致する。したがって、6節と本節の結果は、鉤虫感染症に宿主間スケールと宿主内スケールの相互作用が存在することを示す有力な証拠となる。
考察と結論
本稿では、感染症システムのどのレベルの組織においても、疾患のダイナミクスを決定するような特権的/絶対的スケールは存在せず、ミクロスケールとマクロスケールの間の相互作用のみが存在するとする複製-伝達相対性理論を検討した。この複製・伝達相対性理論により、感染症システムのマルチスケールモデリングは健全な理論的基盤の上に成り立っている。この複製・伝達相対性理論の中心的な考え方は、感染症システムのどのレベルの組織においても、病原体の複製・伝達のマルチスケールループが存在し、それは(i)病原体の排出・放出-ミクロスケールからマクロスケールへの移動を伴う-によって維持されているということである。病原体による感染/超感染:病原体がマクロスケールからミクロスケールに移動することで、マクロスケールとミクロスケールの連鎖を構成する。したがって、本稿で示した複製-伝達相対性理論は、感染症システムの様々な階層レベルのマルチスケールモデルを開発する上で、極めて重要なフレームワークであると言える。本稿では、宿主レベルで開発した鉤虫感染症システムのマルチスケールモデルを用いて、複製・伝播相対性理論の有効性を示した。この理論の有効性は、以下の特徴を持つマルチスケールモデルを用いて説明されたが (i)鉤虫感染症という特定の疾患系に対するマルチスケールであること、(ii)環境感染症という特定の感染メカニズムを持つ疾患に対するマルチスケールであること、(iii)宿主レベルという感染症系の特定の組織レベルで開発されたマルチスケールモデルであること、が本理論の特徴である。我々は、鉤虫感染症で得られた結果を一般化して、感染症システムにとってこのミクロスケールとマクロスケールの相互影響は、ある種の複製-伝達相対性であり、物理学における相対性原理の拡張として考えることができると考える。それは、感染症システムのどのレベルの組織においても、他のスケールでの出来事を決定する特権的/絶対的スケールが存在せず、ミクロスケールとマクロスケール間の相互作用のみが存在するという提案であり、以下の検討の結果である。
a.最近発表された2つの論文22,23では、公衆衛生上の新たな指標であるコミュニティ病原体の概念を用いて、環境感染型および直接感染型の感染症システムを宿主レベルで同じ手法を用いてモデル化できることが示されている。これらの論文では、直接感染する感染症システム(宿主体内の細胞、組織、臓器、体液、全身などの生物学的実体がコミュニティ内の感染病原体の貯蔵庫となる)のマルチスケールモデリング科学基盤を、本稿で紹介する環境感染症システム(宿主体外の地理的環境である土壌、空気、形成物・接触面、食品、水などの物理的実体がコミュニティ内の感染病原体の貯蔵庫となる)のマルチスケールモデリング科学基盤と同等のものとして確立した。彼らは、community pathogen load(詳細は22,23を参照)と呼ばれる新しい公衆衛生指標を定義することでこれを達成した。このコミュニティ病原体負荷は、環境病原体負荷と同等の意味を持ち、このアプローチは、集団(細胞、組織、宿主など)を感受性、曝露、感染、回復(SEIR)およびこのパラダイムのバリエーション(SI、SIS、SEI、SEIS、SIR、SIRS、SEIRSなど)に区分して開発された直接感染する感染症系の伝搬モデルを、環境感染する感染症系の等価な伝搬モデルに変換するために使用することができる。 また、集団(細胞、組織、宿主など)を感受性、曝露、感染、回復、環境病原体負荷(SEIRP)に区分して開発された環境感染型感染症システムの等価感染モデル、およびこのパラダイムのバリエーション(SIP、SISP、SEIP、SEISP、SIRP、SIRSP、SEIRSPなど)にも適用される。) 環境病原体負荷と同様にコミュニティ病原体負荷もまた、コミュニティ全体の感染性リザーバーのプールの指標であり、病原体が増殖・成長して感染力を持つようになるコミュニティ内の小さな均質な生息地・環境が宿主であるという仮定を置いて導き出される。このような宿主内部の環境(直接感染する病原体の唯一の生息地)は、コミュニティの病原体負荷がコミュニティ全体の疾病伝播の指標となるが、宿主外部の環境(環境感染する病原体の生息地でもある)と同様の役割を果たしていると考えられる。このことは、本論文のマルチスケールモデリングビジョンを直接感染する感染症システムに拡張することで、宿主レベルでのミクロスケールとマクロスケールの相互影響を説明できることを意味する。
b.感染症システムが他の複雑系と異なる点は、感染症システムのあらゆるレベルの組織で同じことが起こっている点である。ほとんどの複雑系では、各レベルの組織のメカニズムやプロセスが異なるため、通常、個別の分析が必要となる。しかし、感染症システムのメカニズムやプロセス(感染、複製、病原体の排出、感染・超感染)は、感染症システムをマルチスケールで観察する各階層で共通であり、感染症システムの主要な組織レベルの感染症ダイナミクスを記述するマルチスケールモデルには、以下の類似のカテゴリーがある3,4)。
(i) 個体ベースマルチスケールモデル(IMSM)
(ii) 入れ子マルチスケールモデル(NMSM)
(iii) 埋め込みマルチスケールモデル(EMSM)
(iv) ハイブリッドマルチスケールモデル(HMSM)
(v) 結合マルチスケールモデル
である。
これらのマルチスケールモデルは,感染症システムの連続する組織レベルにおいて,複製-伝達の相対性によって規定されるミクロスケールとマクロスケールの間の不変的な関係を記述する。
これら2つの議論を総合すると、複製・伝播相対性理論は、特定の感染症システム、特定の伝播機構を持つ特定の感染症システム、特定の感染症システムの組織レベルに限定されるものではないことが分かる。したがって、我々が提唱する感染症システムの複製・伝達相対性理論は、細胞レベルからマクロエコシステムレベルまでのマルチスケールな現象を対象としている。このことは、相対性原理の応用として目新しいものではない。相対論的量子論は、原子核のレベルから有機分子の3次構造のレベルまでの現象を扱い、顕著な成功を収めている24。今後、複製・伝達相対性理論は、細胞レベルからマクロな生態系まで、感染症システムのマルチスケールモデリングの基礎理論として定着していくことが予想される。したがって、理論が確立されたことにより、感染症システムのマルチスケールモデリングが進化し、その範囲を拡大することが期待される。
謝辞
南アフリカ国立研究財団(NRF)助成金番号IPRR(UID 81235)からの財政支援に感謝する。
競合する利益
著者らは、競合する利害関係を宣言しない。
