Contents
Observed Improvement in Cognition During a Personalized Lifestyle Intervention in People with Cognitive Decline
Heather Sandisona,*、Nini G.L. Callanb、Rammohan V. Raoc、John Phippsb、Ryan Bradleyb,d a Solcere, Encinitas, CA, USA
bヘルフゴット研究所、国立自然医学大学、ポートランド、オレゴン州、米国 cアポロヘルス、バーリンゲーム、カリフォルニア州、米国
d カリフォルニア大学サンディエゴ校、ハーバート・ヴェルトハイム公衆衛生・人間長寿科学大学院、
米国カリフォルニア州ラホヤ
2023年5月16日受理
プレプレス 2023年6月19日
要旨
背景 アルツハイマー病(AD)は、進行性の客観的認知機能障害(OCI)を特徴とする慢性疾患である。この疾患は多因子性であり、多剤併用療法が必要であることを示唆している。
目的 認知機能低下の潜在的要因(例:栄養状態、感染症など)に基づいた個別化された多剤併用ケア計画によって、OCI患者の認知機能が変化するかどうかを検討した。
方法 参加者(n=34)をカリフォルニア州サンディエゴ地域から募集した。生活習慣の改善(運動、食事、ストレス管理など)、栄養補助食品によるサポート、薬物療法など、多面的な介入を行った。この介入は、4回の臨床訪問を経て実践的に実施され、ベースライン時、1ヵ月後、3ヵ月後、6ヵ月後(主要エンドポイント)の4回の臨床訪問でアウトカムの測定が行われた。研究参加者は研究参加期間中、栄養サポートのために毎週電話を受けた。アウトカム評価には、Cambridge Brain Sciences(CBS)バッテリー、Montreal Cognitive Assessment(MoCA)などが用いられた。
結果 6ヵ月後、MoCAの平均得点は19.6 3.1から21.7 6.2に改善した(p = 0.013)。CBSの記憶領域の平均点[25.2点(SD 23.3点)→35.8点(SD 26.9点);p<0.01]とCBSの総合認知スコア[24.5点(SD 16.1点)→29.7点(SD 20.5点);p=0.02]に有意な改善がみられた。すべてのCBS領域が改善した。
結論 介入6ヵ月後に認知機能の複数の尺度が改善した。この結果は、OCIに対する多方面からの個別化された治療アプローチの実行可能性と影響を支持するものであり、さらなる研究が必要である。
キーワード アルツハイマー病、ケンブリッジ・ブレイン・サイエンス、臨床試験、認知症、軽度認知障害、モントリオール認知機能評価
はじめに
アルツハイマー病(AD)は、米国で約600万人、世界で約5,000万人が罹患している衰弱性疾患である。
[1]. ADは生活の質と人間関係の完全性に大きな影響を及ぼし、2020年には3050億ドル以上の医療費と、さらに何十億ドルもの間接的な介護費用が社会的支出となる[2]。人口動態が高齢者へとシフトするにつれて、ADを含む加齢に関連した疾患の影響は、社会的罹患率の増加を引き起こし、成人の割合が増加するにつれて、高機能な生活の年数が損なわれることになる [3] 。
AD分野の主要な目標は、効果的な治療法の開発に向けられているが、残念ながら、これまでのADの治療法候補に関する臨床試験の結果は圧倒的なものであり、ADに対する単剤療法的アプローチが最適なものであるかどうかを疑問視する声もある[4]。これまでのところ、200以上の薬剤候補が臨床試験に失敗しており、ADが確立されると臨床的に重要な改善を達成することが困難であることを示している [4]。薬剤が失敗する理由としては、以下のようなものが考えられる:
- 1)ADは長い発症前症候期から始まるにもかかわらず、治療開始は一般に疾患後期である [5] ;
- 2)ADは複雑な疾患であり、いくつかの異なるサブタイプによって特徴づけられる [6-9] ;
- 3)代謝性疾患、炎症、毒素、栄養遮断、および/または脳外傷など、ADに関連する認知症には多数の潜在的な要因が存在する [6, 8, 10] ;
- 4)潜在的な薬剤が設計されているにもかかわらず、ADの認知症が進行している可能性がある;
- 5)アミロイドやタウを標的とする薬剤が開発されているが、単剤療法は失敗しており、疾患の進行を改善するためには、より早期の介入や根本的に異なるアプローチが必要であることが示唆されている [4, 11-14] 。
多くの独立したグループからの最近のエビデンスによると、ADのサブタイプ、異なる遺伝学、エピジェネティクス、生化学のために、ADは個人によって様々な症状を示すようである。最近の臨床試験や観察研究では、これらの変数の大部分に同時に対処することで、優れた転帰が得られることが示されている [7, 15-23] 。したがって、多剤併用による個別化医療のアプローチで認知機能低下のすべての要因を特定し、それに対処することは、単一の薬剤によるアプローチよりも効果的な戦略である可能性がある。
軽度認知障害(MCI)は、客観的認知機能障害(OCI)と主観的認知機能低下の両方を含む正式な診断であり、AD発症の予測因子として知られている [24] 。特にOCIは、将来のAD診断の最良の予測因子であることが判明しており、このような予防手段を採用するための出発点となりうるものである [25, 26]。したがって、ADと診断される前にOCIを予防および/または回復させる研究が必要である。
ここで紹介する研究の目的は、OCIに対する多剤併用、個別化医療のアプローチを探求し、AD患者にも参加を拡大することである。ここで発表された実用的介入試験の主な目的は、OCI治療のための多剤併用、個別化医療アプローチのモデルを説明すること、および有効な認知機能測定器による治療前後の変化に関する予備的データを収集することであった。
方法
デザイン
実臨床における実施可能性を検証し、効果を推定するために、プロトコル主導の非対照実地試験を行った。この研究は、国立和漢医薬大学の施設審査委員会(IRB)の承認を得て、ClinicalTrials.govにNCT04284449として登録された。参加者は最低4回の臨床見学に参加し、必要に応じて臨床見学を追加した。募集は2020年2月に開始されたが、SARS-CoV-2のパンデミックと全国的な隔離措置により一時中断された。募集は2020年8月に再開され、2022年3月に終了した。
ベースライン評価後、認知機能低下の要因(栄養状態、感染症、毒物負荷、血管の健康状態、睡眠時無呼吸、外傷性脳損傷など)を特定し、多方面からの個別ケア計画が作成された。データ収集は、4回の診察(ベースライン、1ヵ月、3ヵ月、6ヵ月)と12ヵ月の追跡診察で行われた。6ヵ月後の診察が主要エンドポイントとして事前に指定された。研究参加者は、6ヵ月間の研究参加および積極的なデータ収集期間中、ヘルスコーチおよび/または臨床研究スタッフから毎週電話で栄養サポートを受けた。ケア計画は研究参加期間中、個々の参加者の反応に基づいて変更された(すなわち、担当臨床医がアドヒアランスや実現可能性などの課題を考慮してケア計画を調整した)。
また、スクリーニング時にMoCA(Montreal Cognitive Assessment)スコアが12~16(中等度の障害を示す)の参加者については、代理人の同伴が必須条件であった[27]。さらに、すべての参加者および/またはその医療代理人は、本研究に登録する前に、カリフォルニア大学サンディエゴ校のBrief Assessment of Capacity to Consent [28]に合格する必要があった。
参加者と包含/除外基準
参加者の募集は、チラシ、ソーシャルメディア、電子メール、医師の紹介、口コミにより地域ごとに行われた。
包含基準: 年齢45歳以上、MoCA(Montreal Cognitive Assessment)が12~23で示される認知障害、自立して意思決定ができるか、法的な医療代理人がいること、インフォームド・コンセントと正式な適格性スクリーニング、ベースライン調査受診、その後6ヵ月間毎月1回の受診、12ヵ月間のフォローアップ受診(9回の受診)のために臨床施設まで安全に移動できること、手首に装着する活動量計を装着し、定期的に充電しておくことができること; 高卒または同等の学歴、電子メールによるコミュニケーション能力、コンピュータが実施する質問票に単独で記入する能力、治療計画の遵守、コンピュータを用いた検査の実施、脳波計による脳波検査の実施、および各訪問時の血液検査のための指穿刺の実施に意欲があり、Formal Eligibility Screenの結果を検討した後、臨床研究責任者の判断により試験参加資格があると認められた。
除外基準: MoCAスコア23点以上または12点未満、英語の読み書きができない、コンピューター画面を読むことができない視覚障害、全聾、先天性の認知障害または身体障害、アルコールまたは薬物乱用、重篤な身体疾患、認知機能低下の急性発症、または急激な神経障害、インフォームド・コンセントの相談に関係者を同伴できない、麻薬および/または大麻を現在使用している、または試験期間中に使用した、MCIまたは認知症に対して本試験で使用したプロトコールまたはよく似た方法で治療を受けたことがある、または継続中である。本試験以外で処方され、服用された薬やサプリメントは、試験参加期間中追跡された。
臨床検査の内容
各参加者に対して90分の初診が行われ、その後の診察時間は45~75分であった。臨床面会は通常、研究面会と同じ日に行われたが、参加者は研究面会とは別の日に臨床面会を行う柔軟性を有していた。ベースラインの臨床面談では、システムの完全なレビュー、薬、サプリメント、ライフスタイル、食事、運動のレビューを含む徹底的な医療摂取が行われ、サプリメント、食事、ライフスタイルのカウンセリングを含む、すべての参加者が受ける基本的な治療計画についての話し合いが行われた。2回目の臨床面会はベースラインから1ヵ月後に行われ、検査結果の検討、最初の治療計画に対する参加者の反応についての臨床評価、そして面会の最後に行われた治療計画の個別化部分(検査結果に基づく)の検討で構成された。残りの臨床面会(3ヵ月目と6ヵ月目)は2回目の面会と同様で、患者の必要性や治療に対する反応に応じて治療計画を変更した。参加者は、各臨床検査で質問したり、懸念事項について話し合ったりする機会が与えられた。
臨床検査評価
診断と個々の治療計画の立案を支援するために、血液、尿、毛髪、便のサンプルの広範な分析が、市販の臨床検査サービスを通じて行われた。これらには、環境毒物暴露、血糖調節異常、胃腸の健康状態、栄養状態、心血管疾患、全身性炎症、慢性感染症、ホルモン調節異常のバイオマーカーが含まれた(補足表1のリストを参照)。
評価した環境暴露には、金属(水銀、鉛、ヒ素、カドミウムなど)、化学汚染物質(石油化学物質、フタル酸エステル、除草剤、殺虫剤、グリホサートなど)、生物毒素(オクラトキシン、グリオトキシン、トリコテセン、ゼアラレノン、アフラトキシン)が含まれる。
ベースライン時の便分析では、消化吸収障害、細菌叢異常、腸内特異的炎症、腸管免疫機能障害、感染症のマーカーが用いられた。
全身性の炎症はhs-CRP、フェリチン、LpPla2を用いて評価した。
認知機能の低下と関連する慢性感染症(単純ヘルペス、P. gingivalis、Borg、ジンジバリス菌、ボレリア菌、バベシア菌、バルトネラ菌、慢性副鼻腔炎)などが含まれる。CBC、CMP、HgA1c、マイコトキシン検査、化学毒性物質、便検査、栄養検査、慢性感染症、その他の検査室が提供する基準範囲を適用した。
血中ホルモン値、甲状腺パネル、ホモシステイン、脂質値、水銀、カドミウム、ヒ素、鉛については、個人に合わせた解釈が適用された(補足表1の参照範囲を参照)。
異常値は、個別の治療計画に従って4~12週間ごとに再検査され、試験期間中の変化を追跡し、治療を調整した。
参考記事

介入 個別治療
介入は、実社会で行われるような、多剤併用による個別化医療(すなわち、統合医療モデルの特徴であるアプローチ)の治療計画で構成された。表1 研究参加者の人口統計学的特徴
カテゴリー数(サンプルの割合)
OCIに寄与すると思われる因子の有無(補足表3、4参照)。評価とその結果としての治療の目標は、神経機能に関連する生体マーカーとライフスタイルの選択を同定し、最適化することであった。
臨床医は、以下のような日常的な臨床過程に従った:完全な病歴聴取;完全な臨床検査評価(補足表1参照);
- 個別の治療計画の立案;
- 生活習慣の変更(身体運動、睡眠など)、食事の変更、サプリメント/栄養補助食品、および必要に応じて処方薬を含む治療計画の推奨事項についての参加者との話し合い。
- すべての参加者に、向精神薬ブレンド(成分については補足表2を参照)、オメガ3脂肪酸、ビタミンD、プロバイオティクス、ケトジェニック食への切り替え支援、
- 水分補給のために体重の半分のオンス数を目指すよう提案するなどの栄養サポートが提供された。
すべての参加者は、最初にこれらのサプリメントを同じ量処方され、その後、検査結果と個人の反応に応じて投与量が調整された。さらに、すべての参加者は、運動またはエクササイズの習慣を増やし、または変更し、定期的にマインドフルネスの練習に取り組むよう求められた(図1参照)。
各参加者は、生体情報、身体的状態、物流能力に基づいて、さらに個別の治療計画を受けた。治療チームには、臨床医だけでなくヘルスコーチも含まれていた。
1ヵ月分のピルボックスには、参加者が推奨するサプリメントがあらかじめ充填され、研究および/またはクリニックの受診時に参加者に提供された。その後、参加者は1ヵ月後にピルボックスを研究担当者に返却し、未使用のサプリメントはピルボックスに残した。研究担当者は未使用のサプリメントを数え、次の月のサプリメントをピルボックスに詰め替え、それを参加者に返却した。服薬アドヒアランスは、自己申告による治療計画日誌、研究スタッフによるピルボックスの残錠数カウント、研究スタッフによる各訪問時の追加治療アドヒアランス質問票で測定された。服薬アドヒアランスについては医療代理人に相談した。
ライフスタイル治療
参加者には、定期的に有酸素運動と筋力トレーニングを行うことを目標に、運動を増やし、新しい運動習慣を取り入れることが奨励された。運動の推奨は、参加者のリスク、利用しやすさ、可能な最大影響を評価した後に行われた。ベースライン時の参加者の活動レベルに応じて、これらの推奨は変化した(例えば、参加者がすでに筋力トレーニングを行っていた場合は、有酸素運動を追加するなど)。試験登録時に参加者が運動をしていなかった場合は、出発点として毎日歩くことが推奨された(そのタイミングは上記の評価に依存する)。運動推奨の焦点は、参加者にとっての新規性と運動量の増加であった。自己申告による運動日誌が毎月収集された。
参加者には、教会のグループなど、仲間との社会的交流を増やすことが奨励された。
表
参加者23人のベースライン時および6ヵ月目における年齢およびジェンダーで標準化したaスコアのパーセンタイル(全体および領域別)。平均パーセンタイル(標準偏差)
a 各個人のテスト得点は、参加者の年齢とジェンダーに適合した個人の集団分布に基づいて標準化されている。次に、4つの領域内の標準化された得点の平均をパーセンタイルに変換する。 bベースライン時と6ヵ月目のパーセンタイルを比較するt検定のp値。**p値は0.05以下である。
図1. 認知機能低下の潜在的な要因を特定し、それに対処することは、認知機能の健康維持に役立つ。
図に示すのは、検査や個別化治療に先立ち、OCIを回復させ脳の健康を最適化するためのベースライン戦略と治療計画である。
COVID-19のリスク軽減を念頭に置いて、参加者全員は、趣味や活動を通して、OCIを回復させることを目指した。すべての参加者は、参加者の希望に応じて、毎日の瞑想や祈りなど、マインドフルネスの実践に取り組むよう勧められた。キルタン・クリヤ瞑想を毎日12分間行うことが全参加者に推奨された [29] 。宗教的な理由でキルタン・クリヤに抵抗のある人には、マインドフルな親切な行為および/または毎日の祈りの実践が推奨された。
参考記事

食事療法
代謝を最適化するために、すべての参加者にケトジェニック食が推奨された [30-32] 。ヘルスコーチは、血中ケトン体濃度が1.0mmol/L以上となるように炭水化物を制限し、非澱粉質野菜を多く摂り、脂肪を多く摂るというケトジェニック食を患者に支持した [30-32]。
参加者の最後の食事から睡眠までの3時間を含め、毎晩最低12時間の絶食期間が奨励された。
有機農産物、天然の低水銀魚(サケ、サバ、アンチョビ、イワシ、ニシン)、有機放牧卵と鶏肉、有機乳製品、100%牧草飼育肉の摂取が奨励された。
参加者は試験期間中、アルコール、加工食品、穀物を摂取しないよう求められた。
自己申告による食事日誌が毎月収集され、臨床および研究訪問時に血中ケトン体濃度が測定された。公認ヘルスコーチによるフォローアップの電話が毎週行われ、その間に参加者は治療計画で何か問題に直面していないか質問され、その後、参加者がアドヒアランスを向上させるための話し合いが行われた。この電話では、サポートや励ましが提供され、ケトジェニック食、運動、睡眠、その他臨床医が推奨するライフスタイルの変化に関する質問をしたり、それに答えたりする機会が設けられた。
参加者全員に、ハーブや栄養素、オメガ3、ビタミンDを含む市販の向精神薬ブレンドが投与された(補足表2参照)。投与量は、耐性、錠剤の疲労、検査での栄養素レベルなど、参加者のニーズに応じて調整された。
環境暴露の治療
(ハーブ、補助栄養素、グルタチオン)、結合剤(例:コレスチラミン、クロレラ、木炭、ゼオライト、粘土)、キレート剤(例:EDTA、チオール官能化シリカ)、サウナ、リンパ動員(例:振動、マッサージ、運動)などであった。治療法の選択は、検査値に加えて、参加者のアクセス、能力、許容度によって決定された。
胃腸の健康治療
指示された場合、消化酵素、プロバイオティクス、ハーブベースおよびサプリメントの抗炎症剤(クルクミン、プロレゾルビン)、腸を癒す栄養素(例:アロエ、デグチルリチン)の使用により、大栄養素および微量栄養素の消化と同化の改善を促した、 アロエ、脱グリチルリチン化甘草、グルタミン)、腸管免疫サポート(コロストラム、ビタミンA、ビタミンD、プロバイオティクス)、医薬品および/またはハーブ系抗菌薬(ニタゾキサニド、オレガノオイルなど)を、症状および総合的な便分析によって指示された通りに使用した。
全身性炎症治療
全身性の炎症は、毒素の減少、感染症の治療、食生活の改善、運動、オメガ3系食品、追加的な栄養補助食品(クルクミン、グルタチオン、ビタミンB群、ビタミンC、α-リポ酸など)など、炎症の原因を減らすことによって治療された。
睡眠治療
睡眠衛生をサポートし、Garmin Vivo Smart 4を用いて追跡し、一晩あたりの睡眠時間と睡眠の質、酸素飽和度を測定した。睡眠中に酸素飽和度が85%を下回った参加者全員は、睡眠時無呼吸症候群の可能性をさらに評価し治療するため、睡眠医学に紹介された。睡眠をサポートするサプリメント(例:メラトニン、テアニン、トレオン酸マグネシウム、イノシトール、プロゲステロン)は、個々の必要性と反応に基づいて提供された。

外傷性脳損傷(TBI)治療
外傷性脳損傷または脳卒中の既往歴のある患者には、ホスファチジルコリン、ホスファチジルセリン、オメガ3、メチルB12、ニコチンアミドアデニンジヌクレオチド(すなわちNAD+)の経口補給が行われた。
ホルモン治療
バイオアイデンティカルホルモン補充および/またはハーブによるホルモンサポートは、検査でホルモンレベルの低下が確認された参加者に対して開始された [33] 。甲状腺ホルモン補充は、臨床的に適切な場合に処方された。
慢性感染症治療
認知機能低下に関連する再発性または慢性感染症を有する参加者は、治療を受けた。ヘルペスの発生は、リジンの補充とバラシクロビルまたはアシクロビルで予防し、前駆症状の最初の徴候がみられた時点で使用した。ダニ媒介性感染症陽性の場合は、ハーブ系抗菌薬(ベルベリン、オレガノオイル、ニンニク、グレープシードエキス、ブラックウォールナッツなど)と免疫サポートで治療した。P. gingivalisが確認された参加者は、ディープクリーニングのために歯科医に紹介され、口腔衛生に関する指導を受けた。
アウトカム評価
研究の主要アウトカムは認知スコアの変化であった。実施可能性は定性的に評価された。ベースライン時、1ヵ月目、3ヵ月目、6ヵ月目、12ヵ月目の来院時に、臨床研究スタッフが以下の評価を行った:
認知機能検査(主要評価項目)
Cambridge Brain Sciences(CBS)評価が、試験期間中、認知機能の主要評価項目として用いられた。CBS認知機能検査は、4つの認知領域(記憶力、推論力、言語能力、集中力)の機能を測定するためにデザインされた12の評価項目からなる有効な検査である。各領域は、参加者がコンピュータ上で行う複数のタスクで評価され、個々のタスクから領域の複合スコアが算出される[34]。全バッテリーは35~45分で完了する。CBS評価は300以上の査読付き論文で使用されており、神経変性疾患や脳構造異常を含む様々な健康状態における認知機能の評価に使用されている [35-37]。
モントリオール認知機能評価(MoCA)
MoCAは、認知状態の評価とスクリーニングに臨床的に広く使用されている、簡潔で1ページ、有効かつ信頼性の高い30項目のスクリーニングテストである [38, 39]。MoCAは、OCIの参加者を同定するために使用された。MoCAスコアは、適格性の基準として使用され、認知機能の変化を追跡するために、試験1ヵ月目の受診を除き、試験受診ごとに実施された。
有害事象
有害事象は、標準化された有害事象質問票により、試験および臨床の各訪問時に収集され、参加者は有害事象が発生した場合、試験訪問の間に試験スタッフに連絡するよう奨励された。有害事象は有害事象記録(Adverse Events Log)に記録され、予期せぬ有害事象および/または重篤な有害事象は有害事象発生時にIRB(Institutional Review Board)に報告された。すべての有害事象は、継続審査の一環として毎年IRBに報告された。
統計解析
この非対照試験では、ベースライン値とエンドポイント値の前後差を算出した。6ヵ月のエンドポイントが本試験の主要エンドポイントであった。p<0.05のα閾値が統計的に有意であるとみなされた。予備的、実用的介入試験として、目標サンプルサイズは25人とした。目標サンプルサイズは効果量のみに基づいて決定され、n=25はそれぞれ0.5-0.8のCohen’s d [40]に基づく中程度から大きな効果量の検出を可能にした。
各CBS検査(合計12項目の検査)の標準化された個人得点は、4つの領域得点(集中力、記憶力、推論力、言語能力、各領域は12項目のバッテリーの中からいくつかの領域別検査の複合得点を表す)に変換され、1つの総合/複合認知得点にも変換された。これらのスコアは、ベースライン時と主要エンドポイント(6ヵ月目)の間で、個人レベルおよび群レベルで対のt検定を用いて比較された。MoCAスコアの変化は、記述的およびWilcoxon符号順位検定を用いて分析した。
次に、ベースラインのCBS値を、CBSデータリポジトリ(75,000人以上の認知的に健康な成人が全世界で実施した800万件の検査結果からなる)から算出した規範平均値と比較し、パーセンタイルで表した[41]。我々の集団は認知機能が低下しており、認知機能低下の典型的な臨床経過は、静止したままか、さらに低下することであるため、これらのパーセンタイル内の標準値への変化は臨床的に価値があると考えられ、そのように示された[42, 43]。
結果
参加者の年齢は46~86歳で、平均年齢は70歳、四分位範囲(すなわち、参加者の75%が該当)は68~76歳であった。ジェンダーは女性17名、男性6名であった。民族は黒人3人、白人18人、ヒスパニック1人、フィリピン人1人であった。ベースライン時のMoCAスコアは12~23点で、平均は19.8点、四分位範囲は17~22点であった。
募集された173人の参加者のうち、OCIを有する34人(約20%)がカリフォルニア州サンディエゴ郡の1つの臨床試験施設に登録された。23人のOCI患者が試験を完了した。11人の参加者が脱落または試験から脱退し(登録者全体の32%)、試験の解析には含まれなかった: 6人(55%)はプロトコールを遵守する意思がなく、3ヵ月の研究訪問の前に脱落した;2人(18%)は興味を失った;1人(9%)は情状酌量の余地のない健康状態であった;1人(9%)はSARS-CoV-2に感染した;1人(9%)はベースラインの臨床訪問で、参加者がすでにBredesenのプロトコールを遵守していたことが判明し、治験責任医師によって脱落させられた[6, 14]。
2人の参加者は登録時にアセチルコリンエステラーゼ阻害薬を使用しており、1人はNMDAグルタミン酸受容体拮抗薬を使用していた。治験責任医師はこれらの参加者に対して、これらの薬剤の服用を中止しないように勧めた。試験期間中にこれらの薬剤または同様の薬剤の服用を開始または中止した参加者はいなかった。
合計210件の有害事象が報告された: 63.4%が軽症、32.3%が中等症、4.3%が重症であった。有害事象の大部分は予測されたものであり、栄養補助食品を摂取することで起こりうる反応(胃腸症状、頭痛、皮膚反応、睡眠障害など)、食習慣を変えケトジェニック食を摂取することで起こりうる反応(体重減少、過敏性、ストレスなど)、認知機能の低下および/または加齢に伴ってしばしば経験される状態(不安、抑うつ、錯乱、月経不順など)であった。
重篤な有害事象のうち、試験に関連した処置に起因すると判断されたものはなかった。認知機能は、t=0、1、3、6ヵ月目にCBS神経認知検査バッテリーを用いて評価され、臨床的にはMoCAを用いて評価された。ベースラインから6ヵ月間、CBS神経認知検査測定値の平均パーセンタイルは以下のように変化した:
集中力:+7.1%(p=0.16)、記憶力:+10.6%(p<0.01)、推理力:+4.7%(p=0.17)、言語能力:+4.8%(p=0.22)であった。すべての領域が統計的に有意な変化を示したわけではないが、4つの領域すべてが6ヶ月の介入期間中に増加した(表2)。次に、4つのドメインすべてを組み合わせて、総合的な認知力の変化を分析し、年齢とジェンダーで標準化されたパーセンタイル範囲内に収まる平均複合CBSスコアとして表した。総合的な認知力のパーセンタイルの平均変化は、5.2%の統計的に有意な増加を示し(p<0.02;表2および図2参照)、参加者は24パーセンタイルから29パーセンタイル以上に移動した。
注目すべきは、参加者の50%以上が、CBSテストの4つの領域それぞれで改善したことである。「集中力」は54.6%(n=12)、「記憶力」は81.8%(n=18)、「推理力」は63.6%(n=14)、「言語能力」は68.2%(n=15)で改善した。総合的な複合スコアは、73.9%(n=17)の参加者で改善を示し、26.1%(n=6)の参加者は低下した(疾患進行の自然な経過に伴って予想されるように[44])。CBSスコアに基づくと、ベースライン時と6ヵ月後とで認知能力が同じレベルであった参加者、すなわち「不変」であった参加者はいなかった。
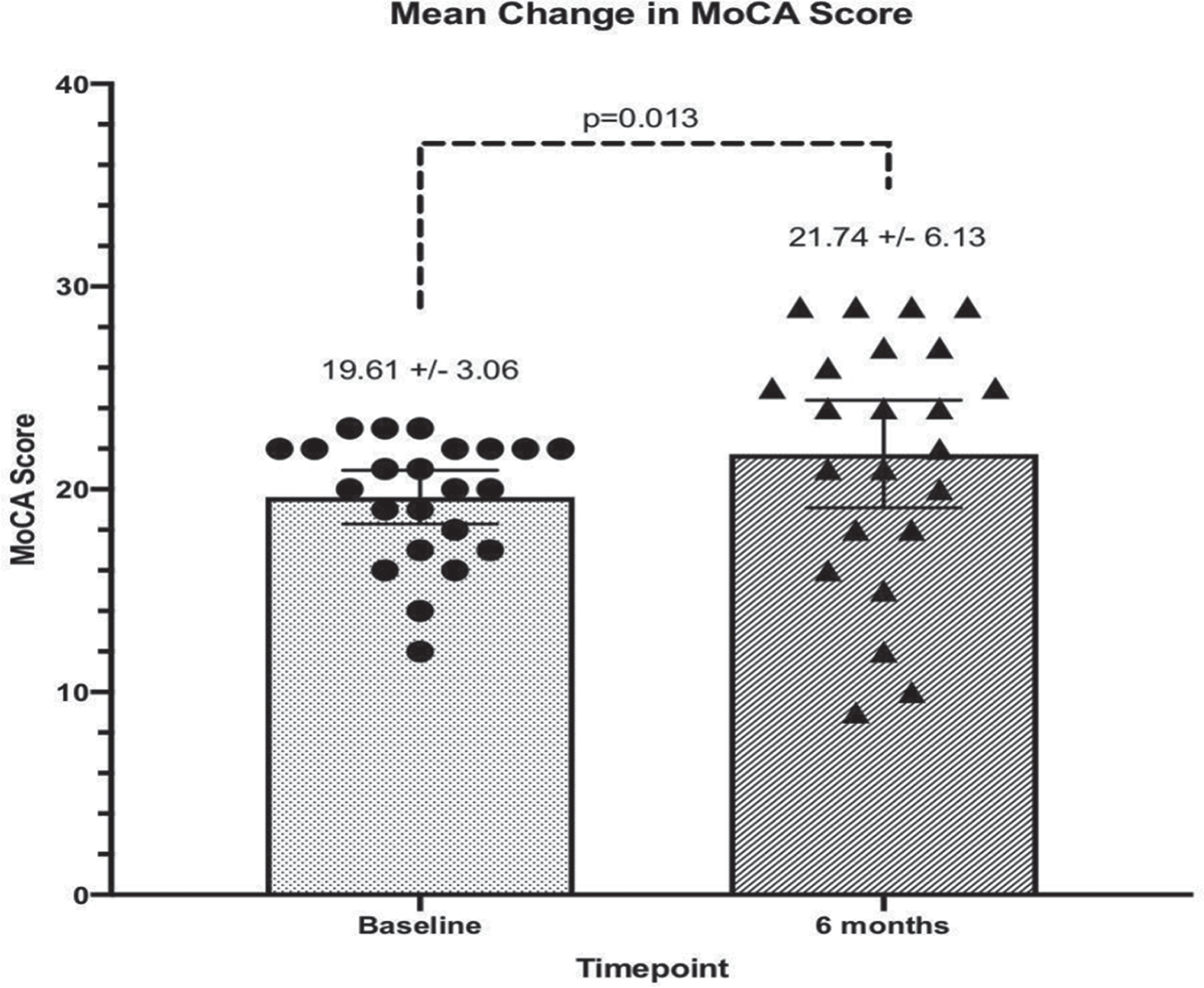
図2. ベースライン時と治療開始6ヵ月後の参加者(n=23)のMoCAテストスコア
ベースライン時のMoCAテスト得点は12~23点で、6ヵ月目には統計学的に有意な差がみられた(p = 0.013、Wilcoxon符号順位検定)。
MoCAのスコアはCBSの所見を概ね裏付けている。ベースライン時と比較した6ヵ月後のMoCAスコアは、73.9%(n=17)で増加または横ばいであったが、26.1%(n=6)では減少した(表3)。その結果、MoCA得点の変化の効果量はCohenのd=0.44であった。平均して、MoCAスコアはベースラインから6ヵ月目まで有意に増加し、ベースライン時の中央値20点から6ヵ月目には24点となった(p=0.013、Wilcoxon符号順位検定)。
考察
認知機能が低下した人を対象に、複雑で多方面にわたる個別化された医療ケア計画を実施することを目的とした概念実証試験として、この介入は実現可能性において成功を収め、より大規模で対照的な多施設臨床試験を支持するものであった。さらに、ここで報告された結果は、現在の文献を裏付けるものであり、認知機能低下治療における多剤併用個別化医療の進歩の根拠となるものである。例えば、最近発表されたToupsらの研究では、同様の個別化医療に基づく介入を9ヵ月間受けた認知機能低下のある25人の参加者における認知機能の改善が報告されている [6] 。彼らの集団には、MoCAスコアが19点以上で、介入期間が9ヵ月の参加者が含まれていた。われわれは同様の方法を拡張し、これらの結果に追加した。
表
ベースラインから6ヵ月目までに、各CBS領域、CBS総合得点、MoCA得点について認知機能が改善、維持、または低下した参加者、n(%)。
17 (73.9)点(すなわち、12~23点)であり、介入期間が短かった(6ヵ月対9ヵ月)。
MoCAの改善は、臨床医から独立してオンラインで実施されたCBSバッテリーを用いた客観的認知測定によって補強された。神経認知検査のCBSバッテリーは、全体的な認知の有意な改善と、記憶の有意な改善を示した。ベースライン時の全体的な認知能力は、健常人の大規模なCBSデータセット(すなわち、n=75,000以上、50パーセンタイルが平均的な認知能力に相当する)の年齢とジェンダーをマッチさせたスコアと比較して、24パーセンタイルであった。したがって、本試験の認知障害者サンプルは、全体的な認知スコアが平均より25%低く、最低四分位範囲にある状態からスタートした。そのため、今回報告された5.2%の認知スコアの増加は、全体的な認知機能の改善と正常な認知機能への大幅な向上を示している。ADは診断の数十年前から始まる進行性の疾患であり、ADの前駆症状であることが多い認知障害も進行性であることが広く認められている [45] 。したがって、正常値への改善は臨床的に重要であると考えられる。同様に、我々の集団におけるベースライン時の記憶力は25パーセンタイル(健常者のCBSデータベースと比較して客観的な障害を示す)であったが、35パーセンタイルまで有意に改善した。このことは特に重要である。というのも、健忘性MCI-すなわち記憶障害を伴うMCI-は、ADに進行するMCIで最も一般的にみられ、さらに健忘性MCIは、非健忘性MCIと比較して、MCIからADへの年間進行率を増加させるからである[46-51]。このように、参加者をMCIのサブタイプに分類することは本研究の範囲外であったが、AD発症のハイリスクと考えられる機能障害のカテゴリーで改善を示した結果には勇気づけられる。CBSの結果によって示された認知機能の改善は、認知機能障害を逆転させる介入の概念実証を支持するものであり、さらに研究を進めることで、将来ADと診断されることが多い進行性の症状を治療する選択肢を提示できるかもしれない。さらに、測定可能な認知機能障害を有する参加者のMoCAスコアは着実に低下すると予想される。
そのため、今回報告された介入期間中に観察された変化は、一般に認められている低下率とは逆の進行の変節を明らかに示しており、介入には真の効果があったという結論を支持している [42, 43]。比較対象として、モノクローナル抗体を用いた最近の臨床試験では、認知機能の低下速度は遅くなったが、認知機能の改善は認められなかった [52, 53]。
われわれは、通常の集団における認知症患者を比較的反映した参加者集団を募集した。参加者のジェンダー分布は74%が女性であり、認知症患者の65%が女性であるという認知症統計を反映している。17人の女性のうち4人は有色人種の女性で、そのうち3人はアフリカ系アメリカ人、1人はアジア系アメリカ人であった。男性参加者の5人は白人で、1人はヒスパニック系であった。
今回報告された臨床所見は全体的に重要であったが、いくつかの限界があることは認識している。第一に、サンプルサイズが小さく、研究デザインは非制御、非ランダム化であり、単一の臨床施設に限定されている。しかし、この結果は、実現可能性と中程度のエフェクトサイズの概念実証を示しており、さらなる研究の正当性を示している。今後の研究では、無作為化、対照群の追加、複数の研究施設を含めることなどが強化されるであろう。第2に、この研究ではADが進行した参加者に対する介入の影響は評価されていない。MoCAの得点が12点以下の試験参加者は参加から除外された。第3に、この研究は臨床ケアの場で行われた。この特徴は実用的であり、長所となりうるが、一般化可能性を証明するものではなく、したがって限界と考える必要があると認識している。最後に、32%(11/34)の離脱率は高いが、レカネマブ治療を受けた参加者を評価したSwansonらの研究 [54] でみられた36%の離脱率よりは低い。将来の試験では、30%の離脱率は予期されるべきではなく、酌量の余地のある合併症を有する参加者を除外することで軽減できるであろう。さらに、この特別な試験の実施時期がCOVID-19の流行と重なったため、多くの成人が一般的に医療機関へのアクセスを制限しようとし、開院している診療所に様々な制約が課されたため、参加者の維持にさらなる困難が生じた。リスクの高い高齢者の参加者の募集は、このような状況の中でさらなる課題を生み出した。最後に、介入は複雑であり、日常生活の変更が容易でない集団の行動変容を必要とした。
本研究で介入に用いたケアモデルは、個人にとって大きな経済的負担となる可能性があり、アドヒアランスのための時間的負担が大きいことを認めたい。さらに、このような個別的で統合的なケアアプローチには、ケアを行う臨床医に高度で専門的なトレーニングが必要である。したがって、この介入を広範な規模で利用できるかどうかについては疑問が残る。それでも、本研究は認知障害患者におけるケアモデルの概念実証を提示するものである。今後の研究では、このようなケアが効果的で、拡張可能で、さらに一般化できるかどうかをモデル化する。更なる研究によって、アクセス方法の改善など、アプローチの目標最適化がなされれば、認知機能低下の影響を受けているより多くの人々にとって、潜在的な恩恵がより身近なものとなるだろう。
本試験で報告された結果は、認知機能障害患者の認知機能を改善しないまでも安定させる可能性のある、臨床的に提供される多剤併用による個別化医療介入を実証することにより、この分野を前進させる可能性を秘めている。この試験は、認知機能低下に対する治療選択肢に関する文献的なギャップを解決するための追加データを提供するものである。すなわち、マルチモーダルな個別化医療による治療アプローチが認知機能低下集団において臨床的に可能であること、そしてそのようなアプローチが認知機能低下の領域と全体的な認知機能を逆転させる可能性があることである。認知機能低下と認知症の進行性を考慮すると、可能な最大限の効果(すなわち、この治療アプローチによって認知機能低下をどの程度逆転させることが可能か)と、その効果の持続期間を決定するためには、無作為化試験において介入期間と追跡期間を長くする必要性があることも示された。この研究は、マルチモーダルな個別化医療がポジティブな影響をもたらす可能性を明らかにしつつある、広範な研究の一部である。アルツハイマー病と認知機能低下に対する効果的な治療法を開発するための数十年にわたる努力が失敗に終わったという背景を考えると、この研究結果は、研究、医学、そして最も重要な患者にとって、刺激的で希望に満ちた方向性を示すものである。
謝辞
Nova Biomedical Corp、Quicksilver Scientific、Diagnostic Solutions Laboratory、DHA Labs、Xymogen、ReadiSorb、Pure Encapsulations、Douglas Labs、およびNeurohacker CollectiveとIntegrative Therapeuticsの研究室とサプリメントの割引と寄付に感謝する。
資金提供
匿名の篤志家より資金提供を受けた。
本研究の指導は、米国国立衛生研究所のNational Center for Complementary and Integrative Healthからの助成金#K24AT011568により行われた。
利益相反
本原稿は、他のジャーナルで検討されているものではなく、出版されたものでもない。Heather Sandison博士は診療所と高齢者施設のオーナーである。他の著者は、報告すべき利益相反はない。
データの利用可能性
我々の実験によって生成されたすべてのデータは、出版物、抄録、プレゼンテーションの形で共有される。複雑なデータセットの場合は、出版物の補足データとして、あるいは学術研究者の要請に応じて利用できるようにする。可能であれば、一次データは研究プロジェクト終了後10年間、地域のリソース(データベース)に電子フォーマットで安全に保管する。第三者のリソースに提出されたデータについては、必ずローカルコピーを保持する。
補足資料
補足資料は本論文の電子版に掲載されている: dx.doi.org/ 10.3233/JAD-230004.
参考文献
- [1] (2022) 2022 Alzheimer’s disease facts and figures.
- Alzheimers Dement 18, 700-789.
- [2] Wong W(2020)アルツハイマー病の経済的負担とマネージドケアに関する考察。Am J Manag Care 26, S177-S183.
- [3] Jaul E, Barron J (2017) 85歳以上の人口に対する加齢関連疾患と臨床的・公衆衛生的意味合い。Front Public Health 5, 335-341.
- [4] Yiannopoulou KG, Anastasiou AI, Zachariou V, Pelidou SH (2019) Reasons for failed trials of disease-modifying treatments for Alzheimer disease and their contribution in recent research. Biomedicines 7, 97-112.
- [5] Dubois B, Hampel H, Feldman HH, Scheltens P, Aisen P, Andrieu S, Bakardjian H, Benali H, Bertram L, Blennow K, Broich K, Cavedo E, Crutch S, Dartigues JF, Duyckaerts C, Epelbaum S, Frisoni GB, Gauthier S、 Genthon R, Gouw AA, Habert MO, Holtzman DM, Kivipelto M, Lista S, Molinuevo JL, O’Bryant SE, Rabinovici GD, Rowe C, Salloway S, Schneider LS, Sperling R, Teichmann M, Carrillo MC, Cummings J, Jack CR, Jr. , The Preclinical State of AD(ADの前臨床状態)」に関する国際ワーキンググループ(IWG)および米国アルツハイマー病協会の会議録;2015年7月23日;米国ワシントンDC(2016年)前臨床アルツハイマー病: 定義、自然史、診断基準。Alzheimers Dement 12, 292-323.
- [6] Toups K, Hathaway A, Gordon D, Chung H, Raji C, Boyd A, Hill BD, Hausman-Cohen S, Attarha M, Chwa WJ, Jarrett M, Bredesen DE (2022) Precision Medicine approach to Alzheimer’s disease: パイロットプロジェクトは成功した。J Alzheimers Dis 88, 1411-1421.
- [7] Bredesen DE, Sharlin K, Jenkins D, Okuno M, Youngberg W, Cohen SH, Stefani A, Brown RL, Conger S, Tanio C, Hathaway A, Kogan M, Hagedorn D, Amos E, Amos A, Bergman N, Diamond C, Lawrence J, Rusk IN, Henry P, Braud M (2018) Reversal of cognitive decline: 100 patients. J Alzheimers Dis Parkinsonism 8, 1-6.
- [8] Bredesen DE (2016) Inhalational Alzheimer’s disease: 認識されていない-そして治療可能な-伝染病である。Aging (Albany NY) 8, 304-313.
- [9] Bredesen DE (2015) Metabolic profiling distinguishes three subtypes of Alzheimer’s disease. Aging (Albany NY) 7, 595- 600.
- [10] Seto M, Weiner RL, Dumitrescu L, Hohman TJ (2021) Protective genes and pathways in Alzheimer’s disease: 精密介入へ向けて Mol Neurodegener 16, 29- 44.
- [11] Breijyeh Z, Karaman R (2020) Comprehensive review on Alzheimer’s disease: 原因と治療。Molecules 25, 5789-5816.
- [12] Badhwar A, McFall GP, Sapkota S, Black SE, Chertkow H, Duchesne S, Masellis M, Li L, Dixon RA, Bellec P (2020) A multiomics approach to heterogeneity in Alzheimer’s disease: そのロードマップは以下の通りである。Brain 143, 1315-1331.
- [13] Xu W, Tan L, Wang HF, Jiang T, Tan MS, Tan L, Zhao QF, Li JQ, Wang J, Yu JT (2015) Meta-analysis of modifiable risk factors for Alzheimer’s disease. J Neurol Neurosurg Psychiatry 86, 1299-1306.
- [14] Rao RV, Subramaniam KG, Gregory J, Bredesen AL, Coward C, Okada S, Kelly L, Bredesen DE (2023) Rationale for a multi-factorial approach for the reversal of cognitive decline in Alzheimer’s disease and MCI: A review. Int J Mol Sci 24, 1659-1681.
- [15] Rao RV, Kumar S, Gregory J, Coward C, Okada S, Lipa W, Kelly L, Bredesen DE (2021) ReCODE: 認知機能低下を回復させるための、個別化された、標的化された、多因子治療プログラム。Biomedicines 9, 1348-1356.
- [16] Schneider N, Yvon C (2013) A review of multidomain interventions to support healthy cognitive ageing. J栄養健康老化17、252から257まで。
- [17] Bredesen DE, Amos EC, Canick J, Ackerley M, Raji C, Fiala M, Ahdidan J (2016) Reversal of cognitive decline in Alzheimer’s disease. Aging (Albany NY) 8, 1250-1258.
- [18] Kivipelto M, Solomon A, Ahtiluoto S, Ngandu T, Lehtisalo J, Antikainen R, Backman L, Hanninen T, Jula A, Laatikainen T, Lindstrom J, Mangialasche F, Nissinen A, Paajanen T, Pajala S、 Peltonen M, Rauramaa R, Stigsdotter- Neely A, Strandberg T, Tuomilehto J, Soininen H (2013) The Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER): 研究デザインと進捗状況。Alzheimers Dement 9, 657-665.
- [19】Schechter G, Azad GK, Rao R, McKeany A, Matulaitis M, Kalos DM, Kennedy BK (2020) A comprehensive, multi-modal strategy to mitigate Alzheimer’s disease risk factors are improves aspects of metabolism and offsets cognitive decline in individuals with cognitive impairment. J Alzheimers Dis Rep 4, 223-230.
- [20] Lista S, Dubois B, Hampel H (2015) Paths to Alzheimer’s disease prevention: 修正可能な危険因子からバイオマーカー強化戦略まで。J Nutr Health Aging 19, 154-163.
- [21] Ross MK, Raji C, Lokken KL, Bredesen DE, Roach JC, Funk CC, Price N, Rappaport N, Hood L, Heath JR (2021) ケーススタディ: 多因子性認知症とアルツハイマー病に対する精密医療アプローチ。J Alzheimers Dis Parkinsonism 11, 18-36.
- [22] Fotuhi M, Lubinski B, Trullinger M, Hausterman N, Riloff T, Hadadi M, Raji CA (2016) A personalized 12-week “Brain Fitness Program” for improving cognitive function and increasing the volume of hippocampus in elderly with mild cognitive impairment. J Prev Alzheimers Dis 3, 133- 137.
- [23] Nguyen SA, Oughli HA, Lavretsky H (2022) Complementary and integrative medicine for neurocognitive disorders and caregiver health. Curr Psychiatry Rep 24, 469-480.
- [24] Davis M, T OC, Johnson S, Cline S, Merikle E, Martenyi F, Simpson K (2018) Estimating Alzheimer’s disease progression rates from normal cognition through mild cognitive impairment and stages of dementia. Curr Alzheimer Res 15, 777-788.
- [25] Brodaty H, Aerts L, Crawford JD, Heffernan M, Kochan NA, Reppermund S, Kang K, Maston K, Draper B, Trollor JN, Sachdev PS (2017) Operationalizing the diagnostic criteria for mild cognitive impairment: 認知症発症の予測における客観的尺度の重要性。Am J Geriatr Psychiatry 25, 485-497.
- [26] Skov Neergaard J, Dragsbaek K, Christiansen C, Asser Karsdal M, Brix S, Henriksen K (2017) Objective cognitive impairment and progression to dementia in women: Prospective Epidemiological Risk Factor Study(前向き疫学的危険因子研究)。J Prev Alzheimers Dis 4, 194-200.
- [27] Nasreddine ZS, Phillips NA, Bedirian V, Charbonneau S, Whitehead V, Collin I, Cummings JL, Chertkow H (2005) The Montreal Cognitive Assessment, MoCA: A brief screening tool for mild cognitive impairment. J Am Geriatr Soc 53, 695-699.
- [28] Rosen A, Weitlauf JC (2015) Different diagnosis, shared vulnerabilities: 同意能力の疾患横断的検証の価値。J Alzheimers Dis 46, 11-13.
- [29] Khalsa DS (2015) ストレス、瞑想、アルツハイマー病予防: 証拠はどこに立っている。J Alzheimers Dis 48, 1-12.
- [30] Cunnane SC, Sieber CC, Swerdlow RH, Cruz-Jentoft AJ (2021) 軽度認知障害: 栄養が脳のエネルギーレスキューに役立つとき-EuGMS2020大会からの報告。Eur Geriatr Med 12, 1285-1292.
- [31] Phillips MCL, Deprez LM, Mortimer GMN, Murtagh DKJ, McCoy S, Mylchreest R, Gilbertson LJ, Clark KM, Simpson PV, McManus EJ, Oh JE, Yadavaraj S, King VM, Pillai A、 Romero-Ferrando、Brinkhuis M、Copeland BM、Samad S、Liao S、Schepel JAC(2021)アルツハイマー病における修正ケトジェニック食の無作為クロスオーバー試験。Alzheimers Res Ther 13, 51-62.
- [32] Kapogiannis D, Avgerinos KI (2020) Brain Glucose and ketone utilization in brain aging and neurodegenerative diseases. Int Rev Neurobiol 154, 79-110.
- [このことは、アルツハイマー病の病態生物学と予防におけるエストロゲンの役割の可能性を示唆している。Am J Transl Res 1, 131-147.
- [34] Gregory MA, Gill DP, Shellington EM, Liu-Ambrose T, Shigematsu R, Zou G, Shoemaker K, Owen AM, Hachinski V, Stuckey M, Petrella RJ (2016) 自己報告による認知機能愁訴を有する高齢者におけるグループベースの運動および認知-身体トレーニング: Multiple-Modality, Mind-Motor (M4)研究プロトコル。BMC Geriatr 16, 17-30.
- [35] Nichols ES, Wild CJ, Owen AM, Soddu A (2021) Cognition across the lifespan: 年齢、性別、その他の社会人口統計学的影響を調査する。Behav Sci (Basel) 11, 51-66.
- [36] Nicholson AA, Hayward MW (1988) Case of the month. 倒れた原因。Br J Radiol 61, 649-650.
- [37] Nichols ES, Erez J, Stojanoski B, Lyons KM, Witt ST, Mace CA, Khalid S, Owen AM (2021) Longitudinal white matter changes associated with cognitive training. Hum Brain Mapp 42, 4722-4739.
- [38] Smith T, Gildeh N, Holmes C (2007) The Montreal Cognitive Assessment: 記憶クリニックにおける妥当性と有用性。Can J Psychiatry 52, 329-332.
- [39] Ciesielska N, Sokolowski R, Mazur E, Podhorecka M, Polak-Szabela A, Kedziora-Kornatowska K (2016) 60歳以上の軽度認知障害(MCI)検出において、モントリオール認知アセスメント(MoCA)検査はミニメンタルステート検査(MMSE)よりも適しているか?メタアナリシス。Psychiatr Pol 50, 1039-1052.
- [40] Sullivan GM, Feinn R (2012) Using effect size or why the P value is not enough. J Grad Med Educ 4, 279-282.
- [41] Sternin A, Burns A, Owen AM (2019) Thirty-five years of computerized cognitive assessment of aging-where are we now? Diagnostics (Basel) 9, 114-126.
- [42] Han L, Cole M, Bellavance F, McCusker J, Primeau F (2000) ミニ精神状態検査を用いたアルツハイマー病における認知機能低下の追跡: メタアナリシス。Int Psychogeriatr 12, 231-247.
- [43] Miyakawa-Liu M, Feehan AK, Pai S, Garcia-Diaz J (2022) 100人のアルツハイマー病患者における認知機能低下の割合。Ochsner J 22, 129-133.
- [44] Wilson RS, Segawa E, Boyle PA, Anagnos SE, Hizel LP, Bennett DA (2012) The natural history of cognitive decline in Alzheimer’s disease. Psychol Aging 27, 1008-1017.
- [45] Liss JL, Seleri Assuncao S, Cummings J, Atri A, Geldmacher DS, Candela SF, Devanand DP, Fillit HM, Susman J, Mintzer J, Bittner T, Brunton SA, Kerwin DR, Jackson WC, Small GW, Grossberg GT、 Clevenger CK, Cotter V, Stefanacci R, Wise-Brown A, Sabbagh MN (2021) プライマリケアにおける症候性アルツハイマー病(MCIおよび認知症)のタイムリーで正確な診断のための実践的推奨事項: レビューと総合。J Intern Med 290, 310-334.
- [46] Petersen RC, Doody R, Kurz A, Mohs RC, Morris JC, Rabins PV, Ritchie K, Rossor M, Thal L, Winblad B (2001) 軽度認知障害における現在の概念。Arch Neurol 58, 1985-1992.
- [47] Mitchell AJ, Shiri-Feshki M (2009) 軽度認知障害の認知症への進行率-41の頑健な初回コホート研究のメタアナリシス。Acta Psychiatr Scand 119, 252-265.
- [48] Tifratene K, Robert P, Metelkina A, Pradier C, Dartigues JF (2015) Progression of mild cognitive impairment to dementia due to AD in clinical settings. Neurology 85, 331-338.
- [このような認知機能障害では、認知症への進行や正常な認知機能への回帰は、遅発性の精神神経症状が関与している。Neurology 98, e2132-e2139.
- [50] Albert MS, DeKosky ST, Dickson D, Dubois B, Feldman HH, Fox NC, Gamst A, Holtzman DM, Jagust WJ, Petersen RC, Snyder PJ, Carrillo MC, Thies B, Phelps CH (2011) The diagnosis of mild cognitive impairment due to Alzheimer’s disease: アルツハイマー病の診断ガイドラインに関する全米加齢研究所-アルツハイマー病協会ワークグループからの提言。Alzheimers Dement 7, 270-279.
- [51] Jessen F, Wiese B, Bachmann C, Eifflaender-Gorfer S, Haller F, Kolsch H, Luck T, Mosch E, van den Bussche H, Wagner M, Wollny A, Zimmermann T, Pentzek M, Riedel- Heller SG, Romberg HP, Weyerer S, Kaduszkiewicz H, Maier W, Bickel H, German Study on Aging C, Dementia in Primary Care Patients Study G (2010) Prediction of dementia by subjective memory impairment: 重症度の影響と認知障害との時間的関連性。Arch Gen Psychiatry 67, 414-422.
- [このような背景のもとで、日本では、認知症患者を対象として、レカネマブによる早期アルツハイ マー病の治療が行われている。N Engl J Med 388, 9-21
- [53]ヘリングWL、グールドIG、フィリットH、リンドグレンP、フォレスタルF、トンプソンR、ペンバートン-ロスP(2021)早期アルツハイマー病患者におけるアデュカヌマブの予測生涯健康アウトカム。Neurol Ther 10, 919-940.
- [この研究は、アルツハイマー病患者を対象に、抗アベータ原線維抗体レカネマブを用いた無作為化二重盲検第2b相概念実証臨床試験として実施された。Alzheimers Res Ther 13, 80-93.

