rwmalonemd.substack.com/p/nobel-prize-for-physiology-or-medicine
Nobel Prize for Physiology or Medicine: Factcheck
2023/10/03

そう、ついに実現した。 そしてその発表とともに、私の信頼性に対する荒らしやボットによる攻撃がまたもや押し寄せた。 ソーシャルメディアでは、この出来事についてコメントするよう求められている。 私は情けない性格なので、一般的にコメントは好まない。 ジルと私は一日、ただ呼吸を整え、その意味と含意について話し合い、世界中の友人や同僚から寄せられた多くの親切で支持的なコメントや哀悼の意を処理し、それに応えることにした。
まず最初に、カリコ博士とワイズマン博士、おめでとうございます。 今回の受賞は、ラスカー賞、スペイン政府およびイスラエル政府からの同様の賞の受賞に続くものです。
一日経って思うのは、ノーベル委員会の決定に関する公式発表の真偽を検証することが、この件についてコメントする適切な方法であるということだ。
まず第一に、核心的な立場として、カリコとワイズマンが免疫反応(ワクチン接種)を誘発するためにmRNAを使用することの創始者あるいは発明者であるとは断言していないことだ。この点にはわずかながら妥当性があると思う。私がポッドキャストや記者会見で何度も説明してきたように、ワクチン目的のmRNAの製造、構造、使用に関する発明者資格は、米国特許商標庁によってかなり前に決定されており、私(1987-1991)や同僚(1990-1991)の研究に基づいて多くの米国特許や外国特許が発行されている。この事実はノーベル委員会でも争われていない。ノーベル生理学・医学賞が、アイデアや技術を生み出し、最初の概念実証を行った者を表彰しないのは極めて異例である。今回の場合は、受賞の範囲をCOVID-19 mRNAワクチンそのものに限定し、プラットフォーム技術の発見や発明者には限定しないことで、この問題が回避されたように見える。
委員会の主な声明は、彼らの発表ツイートとそれに対応する図に引用されている:
“COVID-19に対する効果的なmRNAワクチンの開発を可能にしたヌクレオチド塩基修飾に関する発見に対して”
この発言には3つの論理的要素がある。
- 「ヌクレオチド塩基に関する発見」とは、試験管内試験で転写された(合成された)mRNA全体に、ウリジンの代わりにシュードウリジンを組み込むことを指す。 その結果、天然のmRNAとは多くの重要な生物学的性質が全く異なる分子ができたが、それでもタンパク質に翻訳することができる。 この研究は3つの出版物と特許に記載されている。 私のオリジナルの研究と特許とは対照的に、最初の出版物の15年前に起こったワクチン開発への利用については、どれも触れられていない。
Karikó, K., Buckstein, M., Ni, H. and Weissman, D. Toll様受容体によるRNA認識の抑制:ヌクレオシド修飾の影響とRNAの進化的起源。 Immunity23, 165-175 (2005).
mRNAにシュードウリジンを組み込むと、翻訳能と生物学的安定性が向上し、優れた非免疫原性ベクターが得られる。Mol Ther16, 1833-1840 (2008).
アンダーソン、B.R.、村松秀樹、ナラガトラ、S.R.、ベヴィラクア、P.C.、サンシング、L.H.、ワイズマン、D.およびカリコー、K. mRNAへのシュードウリジンの導入は、PKRの活性化を低下させることにより翻訳を促進する。Nucleic Acids Res.38, 5884-5892 (2010).
- 「有効なmRNAワクチンの開発を可能にした」というのは、実は誤った表現である。 シュードウリジンの組み込みは、既存の技術水準を「可能にする」改善ではなかった。このことは、シュードウリジンを組み込んでいないCureVac SARS-CoV-2ワクチン候補に対する強固な臨床(ヒト)適応抗体ワクチン反応によって実証されている。CureVac社が臨床試験で採用したmRNA製剤の用量(そして明らかに毒性)は、モデルナ社やBioNTech社が採用したものより低く、抗体価も低かった。 しかし、それでも相当なものである。 抗体価がSARS-CoV-2感染やCOVID-19疾患からの臨床的防御につながるという証拠はないが、この事実にもかかわらず、CureVac製品が劣っていると広く推測され、公表された。 おそらく十分な資金がなかったためと思われるが、COVID-19ワクチン競争に参加することを基本的に諦めたのである。 しかし、送達されたmRNAが適応免疫(抗体)反応を引き起こすためには、シュードウリジンの組み込みは必要ないという事実に異論はない。 まとめると、シュードウリジンの組み込みが先行技術(特許や発明者の言葉である)を「可能にする」改善であるという主張は、この理由から明らかに誤りである。
- 「COVID-19に対する効果的なmRNAワクチン」というのは、非常に議論のある声明である。委員会がこの主張の根拠として挙げているのは、対応するプレスリリース(以下に添付)である。「約95%の防御効果が報告された」というのは、得られた臨床試験結果の最初の解釈のことであり、その解釈と試験自体が不正であったことがその後明らかになっている。 この記述は、これらの臨床試験結果に関する現在の理解とは一致せず、むしろ、その後非常に誤解を招くことが明らかになった当初の宣伝文句を反映したものである。 「ワクチンは何百万人もの命を救い、さらに多くの重症化を防いできた」というのも事実に基づいておらず、むしろよく繰り返されるプロパガンダである。 この主張は、SARS-CoV-2感染の症例致死率3.4%を示唆する初期分析およびモデル化データと、症例致死率の現在の最良推定値との差に基づくものである。 この差はワクチンの有効性の結果であると主張されてきたが、実際の臨床疫学データからは支持されていない。 全死因死亡率データに基づく現在の解析では、ワクチンの有効性はないか、あるいは否定的な有効性が示されている(複数の研究により、ワクチン接種キャンペーン(一般型とmRNA遺伝子型の両方)の開始は、全死因死亡率の減少ではなく、増加と相関していることが示されている )。 加えて、多くの異なるデータベースからのデータは、これらのmRNAベースの製品について、投与後2~7カ月から負の有効性を示している。 この場合の負の有効性とは、COVID-19を投与された患者は、これらのmRNAベースの製品を投与されなかった患者よりも入院する可能性が高いという観察結果を指す。
- 1987年から1991年にかけての、私と私の共同発明者の研究に関連する改良があったとすれば、それはブリティッシュコロンビア大学のピーテル・カリス博士と同僚による製剤の改良だろう。 シュードウリジンの配合ではない。 カリス博士と同僚は今回の受賞決定には含まれていない。
- これらのmRNA製剤の著しく迅速な開発・展開は、他の従来型のCOVID-19ワクチン(「スプートニク」シリーズなど)が達成したタイムラインと並行し、対応している。 これはmRNA/シュードウリジン技術の結果ではなく、安全性と有効性を評価するために必要な通常のワクチンの非臨床および臨床開発プロセスを、世界中の規制当局が進んで中断したことによる。委員会は、これらのワクチンが2020年12月に「承認」されたと主張しているが、これも虚偽である。これらの製品は、通常の試験、プロセス、審査の一時停止を経て緊急使用承認されたものである。
- ノーベル賞委員会がこの受賞を正当化するために用いた明白な虚偽は、この決定が科学的・医学的事実に基づいておらず、むしろ委員会が引用していない非科学的・医学的な考慮が反映されていることを示している。
- ファイザーはカロリンスカ研究所への大口寄付者である。
以下は、長い全死因死亡率分析シリーズの最新版へのリンクである:

要旨
赤道直下および南半球の17カ国(アルゼンチン、オーストラリア、ボリビア、ブラジル、チリ、コロンビア、エクアドル、マレーシア、ニュージーランド、パラグアイ、ペルー、フィリピン、シンガポール、南アフリカ、スリナム、タイ、ウルグアイ)を調査対象とし、これらの国は世界人口の9.10%、世界のCOVID-19ワクチンの10.3%(1人当たりの接種率1.91回、全年齢)を占め、事実上すべてのCOVID-19ワクチンの種類と製造業者が存在し、4大陸にまたがっている。
17カ国において、COVID-19ワクチンの有益な効果を示す全死因死亡率(ACM)の時系列データの証拠はない。COVID-19ワクチン接種とACMの比例的減少との間に時間的関連はない。その反対である。
17カ国すべてが、COVID-19ワクチンが配備され、投与されるときに発生する高ACMの体制に移行している。17カ国のうち9カ国は、世界保健機関(WHO)が2020年3月11日にパンデミック宣言を出してから、ワクチンが配備されるまでの約1年間は、ACMの過剰が検出されない(オーストラリア、マレーシア、ニュージーランド、パラグアイ、フィリピン、シンガポール、スリナム、タイ、ウルグアイ)。
ACMの前例のないピークは、南半球と赤道直下の国々で2022年の夏(1月~2月)に発生し、それはCOVID-19-ワクチンのブースター投与(3回目または4回目)の急速な展開と同期しているか、またはその直前である。この現象は、十分な死亡率データがあるすべてのケース(15カ国)に見られる。調査国のうち2カ国は、2022年1月~2月の死亡率データが不十分である(アルゼンチンとスリナム)。
チリとペルーの詳細な死亡率とワクチン接種のデータから、年齢別と接種回数別に分類することができる。2022年1月~2月(さらに、チリでは2021年7月~8月、ペルーでは2022年7月~8月)に観察された、両国および各高齢者年齢層における全死因死亡率のピークが、時間的に関連した急速なCOVID-19-ワクチン・ブースター投与展開以外の原因によるものとは考えにくい。同様に、南半球と赤道緯度の17カ国すべてにおいて、COVID-19ワクチンの展開と持続的な投与と時を同じくして、高ACMの体制に移行したことも、ワクチン以外の原因によるものとは考えにくい。
ACMの多くのピーク(17カ国、4大陸、すべての高齢者年齢層、異なる時期)とそれに関連する急速なブースター展開の間の共時性は、因果関係に関するこの3つの確固たる結論と、COVID-19-ワクチンの毒性の正確な定量化を可能にする。
全年齢のワクチン投与致死率(vDFR)は、ある集団で投与されたワクチン量に対するワクチン誘発死亡の推定比率であり、2022年1月~2月のACMピークについて定量化したところ、0.02%(ニュージーランド)から0.20%(ウルグアイ)の範囲に収まった。チリとペルーでは、vDFRは年齢とともに指数関数的に増加し(約4歳ごとに約2倍になる)、最新のブースター投与で最大となり、90歳以上の年齢層では約5%に達する(投与量4の注射20回につき1人が死亡)。以前の論文(インド、イスラエル、米国)で見られたように、北半球でも同様の結果が得られている。
17カ国の全年齢vDFRは(0.126±0.004)%であり、2023年9月2日までの135.0億回の注射により、全世界で170万±0.5百万人のCOVID-19ワクチンによる死亡があったことになる。これは、世界人口の(0.213±0.006)%が死亡し(3年未満で、生存者470人あたり1人が死亡)、死亡を予防することができなかった大量異所性事象に相当する。
実際の集団におけるCOVID-19ワクチンの注射による死亡リスク全体は、全死因死亡率の超過とその展開との同期性から推測すると、世界的に広範であり、臨床試験、副作用モニタリング、死亡診断書からの死因統計で報告されているよりもはるかに大きく、3桁(1,000倍)も大きい。
主要なCOVID-19ワクチンの種類と製造業者をすべて使用し、4大陸の17カ国を対象としたこの研究で定量化された大きな年齢依存性とvDFRの大きな値は、有効なリスク・ベネフィット分析が行われるまで、COVID-19ワクチンの接種を高齢者に優先させるという根拠のない公衆衛生政策を直ちに中止するよう各国政府に促すべきである。
以下は、委員会(カロリンスカ研究所のノーベル総会)が発表した、この受賞を正当化する正式なプレスリリースである。
プレスリリース
2023-10-02
を授与することを決定した。
2023年ノーベル生理学・医学賞
共同で
カタリン・カリコ、ドリュー・ワイズマン
COVID-19に対する効果的なmRNAワクチンの開発を可能にしたヌクレオシド塩基修飾に関する発見に対して。
2人のノーベル賞受賞者による発見は、2020年初頭に始まったパンデミックにおいて、COVID-19に対する効果的なmRNAワクチンの開発に不可欠であった。mRNAが我々の免疫系とどのように相互作用するかについての我々の理解を根本的に変えた彼らのブレイクスルー発見を通して、受賞者たちは、現代における人類の健康に対する最大の脅威のひとつであるパンデミックにおいて、前例のないワクチン開発に貢献した。
パンデミック前のワクチン
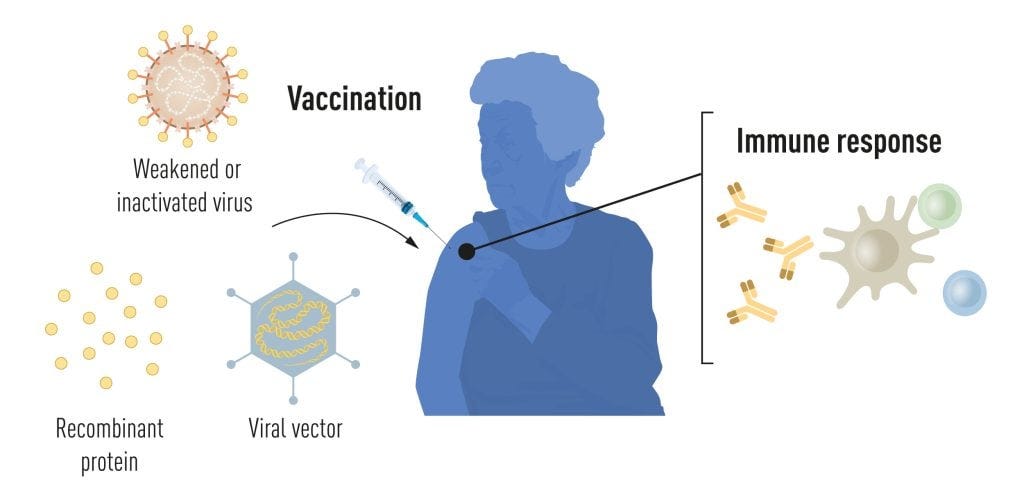
ワクチン接種は、特定の病原体に対する免疫反応の形成を刺激する。こうすることで、後で病気にかかったときに、体が病気と闘うためのスタートを切ることができる。ポリオ、麻疹、黄熱病のワクチンに代表されるように、死滅させたウイルスや弱毒化させたウイルスに基づくワクチンは古くから利用されてきた。1951年、マックス・タイラーが 黄熱病ワクチンの開発でノーベル生理学・医学賞を受賞した。
ここ数十年の分子生物学の進歩により、ウイルス全体ではなく、個々のウイルス成分に基づくワクチンが開発されてきた。ウイルスの遺伝暗号の一部、通常はウイルス表面に見られるタンパク質をコードしているものが、ウイルスをブロックする抗体の形成を刺激するタンパク質を作るために使われる。例えば、B型肝炎ウイルスやヒトパピローマウイルスに対するワクチンである。また、ウイルスの遺伝コードの一部を無害なキャリアウイルスである。「ベクター」に移すこともできる。この方法はエボラウイルスに対するワクチンに使われている。ベクター・ワクチンを注射すると、選択されたウイルス・タンパク質が私たちの細胞内で産生され、標的ウイルスに対する免疫反応を刺激する。
全ウイルス、タンパク質、ベクターベースのワクチンを製造するには、大規模な細胞培養が必要である。この資源集約的なプロセスは、アウトブレイクやパンデミックに対応した迅速なワクチン製造の可能性を制限する。そのため、研究者たちは長い間、細胞培養に依存しないワクチン技術の開発を試みてきたが、これは困難であることが判明した。
図1 COVID-19パンデミック前のワクチン製造法 © The Nobel Committee for Physiology or Medicine.Ill.マティアス・カーレン
mRNAワクチン:有望なアイデア
私たちの細胞内では、DNAにコードされた遺伝情報がメッセンジャーRNA(mRNA)に伝達され、これがタンパク質生産の鋳型となる。1980年代には、細胞培養なしでmRNAを生産する効率的な方法が導入され、試験管内試 転写と呼ばれるようになった。 この決定的な一歩は、いくつかの分野における分子生物学的応用の発展を加速させた。mRNA技術をワクチンや治療に利用するアイデアも浮上したが、その前に障害が待ち構えていた。試験管内で 転写されたmRNAは不安定で、送達が困難であると考えられていたため、mRNAをカプセル化する高度なキャリア脂質システムの開発が必要であった。 さらに、試験管内で産生されたmRNAは炎症反応を引き起こした。そのため、臨床目的のmRNA技術開発に対する熱意は、当初は限られたものであった。
このような障害にもめげず、ハンガリーの生化学者カタリン・カリコーは、mRNAを治療に利用する方法の開発に没頭していた。彼女がペンシルバニア大学の助教授だった1990年代初頭、研究資金提供者にプロジェクトの意義を納得させるのが困難だったにもかかわらず、彼女はmRNAを治療薬として実現するというビジョンに忠実であり続けた。カリコーの大学の新しい同僚に免疫学者のドリュー・ワイズマンがいた。彼は、免疫監視とワクチン誘発免疫応答の活性化において重要な機能を持つ樹状細胞に興味を持っていた。新しいアイデアに刺激され、2人の間ですぐに実りある共同研究が始まり、異なるタイプのRNAが免疫系とどのように相互作用するかに焦点を当てた。
ブレークスルー
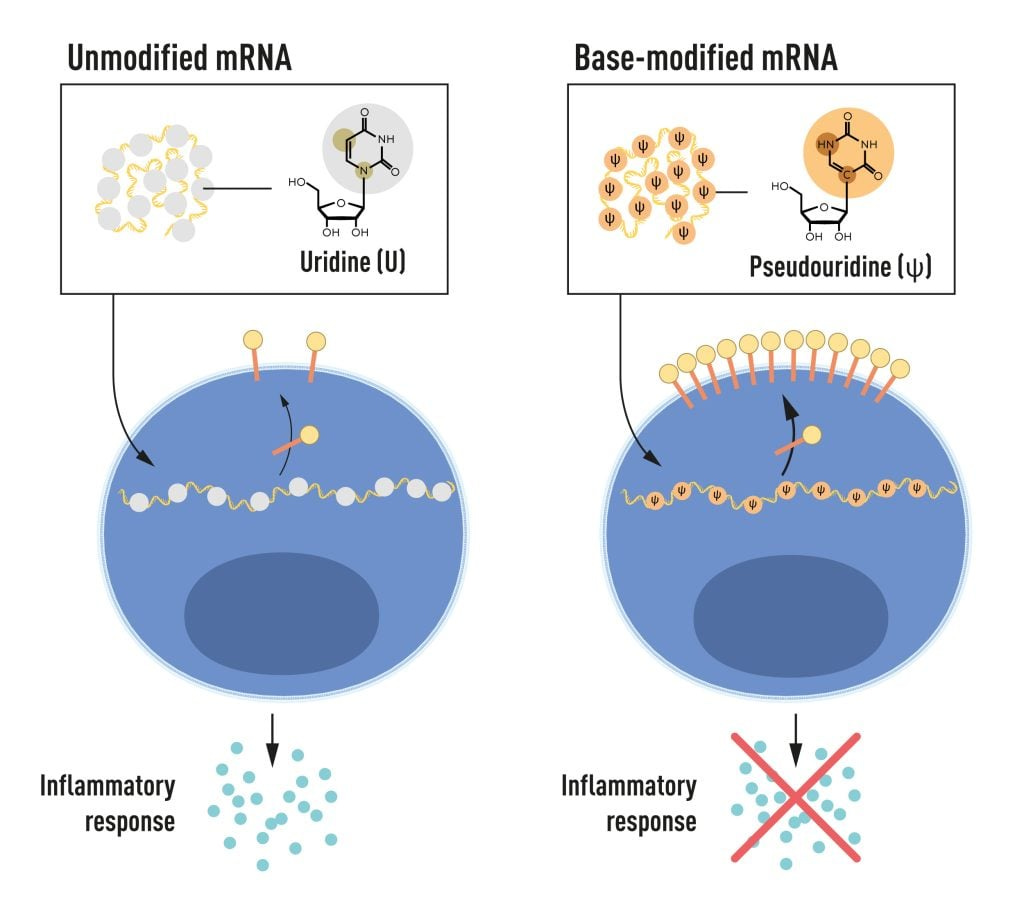
カリコーとワイズマンは、樹状細胞が試験管内で転写さ れたmRNAを異物として認識し、活性化と炎症シグナル分子の放出につながることに気づいた。 彼らは、なぜ試験管 哺乳類細胞からのmRNAは同じ反応を起こさないのに、内で転写された mRNAは異物として認識されるのか 不思議に思った。 カリコーとワイズマンは、いくつかの重要な性質が異なるタイプのmRNAを区別しているに違いないと考えた。
RNAにはA、U、G、Cの4つの塩基があり、DNAのA、T、G、Cに対応している。カリコーとワイズマンは、哺乳類細胞のRNAの塩基は頻繁に化学修飾されるが、試験管内で 転写されたmRNAの塩基は化学修飾されないことを知っていた。彼らは、試験管内で転写されたRNAの塩基が変化していないことが、 好ましくない炎症反応の説明になるのではないかと考えた。 これを調べるため、研究チームは塩基に独自の化学修飾を施したさまざまな変異型mRNAを作製し、樹状細胞に投与した。結果は驚くべきものだった:mRNAに塩基修飾を加えると、炎症反応はほとんど消失したのである。これは、細胞がどのようにしてさまざまな形のmRNAを認識し、それに反応するかという我々の理解にパラダイムをもたらすものであった。カリコーとワイズマンは、自分たちの発見がmRNAを治療に利用する上で重大な意味を持つことをすぐに理解した。このブレイクスルー成果は、COVID-19の大流行が起こる15年前の2005年に発表された。
図2 mRNAには、A、U、G、Cと略される4つの異なる塩基が含まれている。 ノーベル賞受賞者たちは、塩基を修飾したmRNAを細胞に送達することで、炎症反応の活性化(シグナル分子の分泌)を阻害し、タンパク質の産生を増加させることができることを発見した。© The Nobel Committee for Physiology or Medicine.イルマティアス・カーレン2008年と2010年に発表された更なる研究で、KarikóとWeissmanは、塩基を修飾して作成したmRNAを送達すると、修飾していないmRNAに比べてタンパク質生産が著しく増加することを示した。この効果は、タンパク質産生を制御する酵素の活性化が抑制されたことによるものであった。カリコーとワイズマンは、塩基修飾が炎症反応を抑制し、タンパク質産生を増加させるという発見を通して、mRNAの臨床応用への道を阻む重要な障害を取り除いたのである。
mRNAワクチンの可能性
mRNA技術への関心が高まり始め、2010年には数社がこの手法の開発に取り組んでいた。ジカウイルスとMERS-CoVに対するワクチンが開発され、後者はSARS-CoV-2と密接な関係がある。COVID-19パンデミックの発生後、SARS-CoV-2の表面タンパク質をコードする2種類の塩基修飾mRNAワクチンが記録的なスピードで開発された。約95%の予防効果が報告され、両ワクチンは2020年12月に承認された。
mRNAワクチンの素晴らしい柔軟性と開発スピードは、この新しいプラットフォームを他の感染症に対するワクチンにも利用する道を開くものである。将来的には、この技術は治療用タンパク質の送達や、ある種の癌の治療にも使われるかもしれない。
SARS-CoV-2に対する他のいくつかのワクチンも、異なる方法論に基づいて急速に導入され、合わせて130億回以上のCOVID-19ワクチンが世界中で接種された。このワクチンによって何百万人もの命が救われ、さらに多くの人々の重症化を防ぐことができた。今年のノーベル賞受賞者たちは、mRNAにおける塩基修飾の重要性という基本的発見を通じて、現代最大の健康危機のひとつであるこの変革的発展に決定的に貢献した。