Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC6465949/
Marcia H. Ratner、 Vidhya Kumaresan、 and David H. Farb*.
要旨
記憶障害は、多くの神経学的・精神医学的疾患に見られる症状であるが、記憶の基本的なメカニズムや記憶障害に関連した回路機能の変化状態は、未だに未解明の領域である。内因性ニューロステロイドが発見されたことをきっかけに、脳機能の正常・疾患におけるニューロモジュレーターとしての役割を解明することが求められている。
このレビューでは、我々自身の研究の観点から、GABA-A型(GABAANMDA、および非NMDA型グルタミン酸受容体の正および負のニューロステロイドアロステリックモジュレーターの発見に至るまでの進歩を、歴史的および概念的な枠組みでまとめている。
我々は、神経回路機能のニューロステロイド変調が記憶と記憶障害にどのように影響を与えるかについての最先端の見解に向けて分析を拡張する。疾患モデル動物を用いた複数の研究室の結果と、精神神経疾患や加齢に伴う神経変性疾患に関するヒト臨床研究の結果を集約することで、回路レベルでの見解の要素が浮かび上がってくる。
最後に、内因性に活性なニューロステロイドと外因性に投与されたニューロステロイドの、女性と男性の寿命に渡る神経ネットワークへの影響から、これらのニューロモジュレーターが多様な変化した精神状態の中で記憶を調節するように作用する薬理学的なコネクトームの可能性が示唆された。
キーワード:ニューロステロイド、記憶、不安、うつ病、統合失調症、アロプレグノラノロン、硫酸プレグネノロン、アルツハイマー病
序論
身体的に放出される腸ペプチドが中枢神経系(中枢神経系)機能を変化させる可能性があるという最初の発見以来、神経科学における主要な問題は、身体が脳機能に影響を与えたり調節したりすることができるかどうか、そしてどのようにしてできるかということに関連している。神経内分泌学の科学は、チロトロピン放出ホルモン(TRH)(1、2)とサブスタンスP(3、4)という腸内ペプチドが内因性神経調節物質として視床下部で合成、貯蔵、放出されることを実証した、Schally、Leeman、Reichlinの独立した発見によって、50年前に概念的に進歩した。中枢神経系内での神経ペプチドの局所合成の実証は、全身循環を介した輸送および血液脳関門(BBB)を越えた輸送を伴わない、シナプスで化学的神経伝達物質として作用する腸ペプチドの非定型的なメカニズムを提示した。
BBBは、腸ペプチドと同じ程度に中枢神経系への性ステロイドのアクセスを損なうことはない。プロゲステロン、エストラジオール、テストステロンなどの親油性ステロイドホルモンは、BBBを通過し、中枢神経系へのアクセスを容易に獲得する(5)。1980年代初頭には、Etienne、Baulieu、Robel(6-9)によるいくつかの証拠が、神経活性ステロイドは排他的に末梢的に合成されるという中心的なドグマに挑戦し、ステロイドが中枢神経系内のコレステロールから合成できることを初めて実証した。
このようなステロイドはニューロステロイドと呼ばれ、どのステロイドがこのグループに属するのかを特定し、その機能を定義するための集中的な研究が始まった。初期の手掛かりは、ステロイドが麻酔作用を持つ可能性があることを示したSelye (10) の研究から得られた。40年後の1983年、Sapolsky、McEwen、Rainbowによるラジオラベリング研究により、海馬のオリエンス層と先端樹状突起領域でのコルチコステロンの取り込みが明らかになり、これらの領域のGABA作動性介在ニューロンがコルチコステロン受容体を持っている可能性が示唆された(11)。コルチコステロン治療は海馬におけるGABAの取り込みに影響を与えることが示されており、記憶のホルモン調節のメカニズムを示唆している可能性がある。一見無関係に見える研究では、合成ステロイド麻酔薬アルファキサロンの薬理学的作用機序を調査している間に、HarrisonとSimmonds(12)は、アルファキサロンとバルビツール酸塩がGABAAR作用を増強することで共通の作用機序を共有していることを実証した。その後の複数の研究者による研究では、プロゲステロンとデオキシコルチコステロンのいくつかの還元代謝物が、ベンゾジアゼピン(18、19)と同様に、GABAARの正のアロステリックモジュレーターとして作用することが実証された(13-17)。他の研究(20、21)では、神経ステロイドが抑制性のGABA作動性神経伝達を調節することができるかもしれないことも示唆されている。
1980年代半ばにアンドリュー・ヘルツォークが行った臨床研究の中で、カタルーニャ性てんかんにおけるエストロゲンとプロゲステロンの役割の可能性について新しい考えが出てきたので(22)、私たちはプロゲステロンがGABAARの正のアロステリックモジュレーターとして作用するのではないかと仮説を立てた。これが、私の研究室の呉峰仙とテレル・ギブスの初期の研究(23)につながり、プロゲステロンが実際にGABAAとグリシン受容体を調節していることを示した。意外なことに、我々はまた、プレグネノロン(PREG)の硫酸化(PREG)から派生した新しい負に帯電したステロイドであるプレグネノロン硫酸塩(PREGS)は、N-メチル-D-アスパラギン酸受容体(NMDAR)機能を増強することを発見した(24)(図1と表1)。
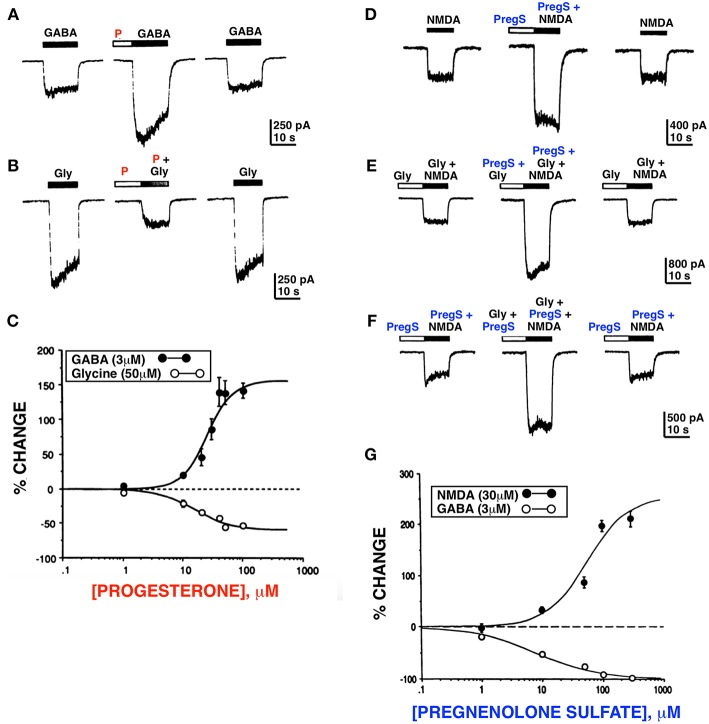
図1
プロゲステロンとプレグネノロン硫酸塩は、GABA、グリシン、NMDAによって誘導される全細胞電流を異なる方法で調節する。プロゲステロン(P)(100μM)は、GABA応答(A)を増強し、グリシン(B)応答を阻害する。C)GABAとグリシン電流のプロゲステロン変調のための用量応答曲線、プロゲステロンによるGABA応答の強化は、グリシン応答の阻害と同じ濃度範囲で発生する。D)プレグネノロン硫酸塩(100μM)は、NMDA応答(正常なメディア[Gly])を増強する。E)プレグネノロン硫酸塩およびグリシンは、異なるメカニズムでNMDA応答を増強する。F)グリシンの最大濃度(10μM)の存在下では、プレグネノロン硫酸塩(100μM)は(179±17.1%、n = 4)NMDAの30μMによって誘導される応答を増強し、(F)プレグネノロン硫酸塩(100μM)の近くの最大濃度の存在下では、グリシン(10μM)は可逆的に(210±36.5%、n = 4)NMDA応答を増強する。G)NMDAおよびGABA電流のプレグネノロン硫酸塩変調のための用量応答曲線。プレグネノロン硫酸塩によるNMDA応答の増強は、GABA応答の阻害と同じ濃度範囲で起こる(各トレースの上の水平バーは、薬物の適用期間を表す)[許可を得てWuら(23、24)から改変]。
表1 プレグレンシリーズ神経ステロイドの歴史的発見
参考文献 システムと方法論 主要な知見と新しい成果
- Majewska and Schwartz (21); Majewska、 (25) ラット脳シナプトソーム調製物における標識塩化物のGABA媒介取り込みの阻害の測定 GABAA受容体の阻害剤としてプレグネノロン硫酸塩の可能性のある受容体標的の実証
- 培養ニワトリ脊髄ニューロンにおけるNMDARs電流の全細胞パッチクランプ プレグネノロン硫酸塩と関連するプレグネンシリーズの硫酸化ニューロステロイドは、グルタミン酸シナプス伝達における機能的な神経調節物質として作用するNMDARsを増強する。
- (rwin er al)。 (27) ラット海馬の神経細胞培養における細胞内カルシウムの顕微分光フッ素測定 プレグネノロン硫酸塩などの神経ステロイドは中枢神経系の興奮抑制バランスを調節する
Floodら(28-30); Plesciaら(31); Plesciaら(32); Abdel-Hafiz、 (33) Behavioral assays in rodent models Pregnene group neurosteroid-mediated enhancement of cognitive function. その後の研究では、PREGとその代謝物であるPREGSが記憶力を高めることがさらに実証されている。 - Park-Chungら(34)培養ニワトリ脊髄ニューロンにおける全細胞パッチクランプ プレグネノロン硫酸塩のサブユニット特異的効果の解明と、プレグネン系ニューロステロイドが興奮性イオントロピー性GluRを調節することを実証。
- Park-Chungら(35、 36)培養ニワトリ脊髄ニューロンにおける全細胞記録。培養ニワトリ脊髄神経細胞の全細胞記録を用いた構造活性研究 プレグネノロン硫酸塩結合部位の同定 ステロイドがNMDARの細胞外部位に結合して機能することを初めて実証。
- Yaghoubiら(37); Malayevら(38); Cameronら(39)Xenopus卵母細胞で発現した組換えNMDARの電圧クランプ記録。細菌培養。固有蛍光分光法。 プレグネノロン硫酸塩はGluN2AおよびGluN2Bを含むNMDARを正に修飾する。プレグネノロン硫酸塩はGluN2C-およびGluN2D含有NMDARおよびAMPA/カイネイト受容体を阻害する。
- PartridgeとValenzuela、(40);Sliwinskiら(41);Sabetiら(42)海馬スライス電気生理学を用いた長期増強の測定 プレグネノロン硫酸塩は、学習と記憶に重要なシナプス強度を変調する。
- Jangら(43);Horakら(44);Kostakisら(45) 電気生理学;分子モデリング;Xenopus卵母細胞で発現させた部位指向突然変異誘発により残基を変化させた組換えキメラNMDAR。 プレグネノロン硫酸塩は、NMDARの構造的多様性により、豊富な制御レパートリーを有している。細胞外ステロイド調節部位(SMD1)は、J/Kらせんと隣接するTMD4を含む。TMD3とTMD4の間の細胞外ループは興奮性と抑制性の両方の効果を媒介する。
- Petrovicら(46)NR1/NR2B NMDARを発現するHEK293細胞と培養ラット海馬ニューロンにおける電圧クランプ研究。 プレグネノロン硫酸塩はリン酸化依存性のメカニズムを介してNMDAR依存性の応答に影響を与える。
- Kostakisら(47); Smithら(48) 卵母細胞で発現した組換え受容体の全細胞記録と、胚性皮質ニューロンの初代ニューロン培養物を用いた[Ca2+]iイメージング。ピコモル濃度は細胞内Ca2+を増加させるのに十分な濃度である。細胞内Ca2+の増加は表面GluN1-NMDARとCREBの活性化を増加させる。プレグネノロン硫酸塩を介したNMDARsの調節は、非カノニカルなGタンパク質とCa2+依存的な方法を介して遅延発症の増強をもたらす。この増強は、GluN2BのJ/KらせんとTMD4がGluN2Dのそれに置換された場合には存在しないことから、プレグネノロン硫酸塩のサブユニット依存性作用と重要なプレグネノロン硫酸塩の細胞外結合部位が確立された。
- Smith er al)。 (48); Adamusová er al)。 (49) [Ca2+]iイメージング研究 ラット初代海馬ニューロン培養物とHEK293細胞を用いた研究 ピコモル~フェムトモル濃度のプレグネノロン硫酸塩は、細胞内Ca2+を増加させる。
- 認知機能の向上を目的とした臨床効果 統合失調症や統合失調感情障害におけるPREGの併用療法は、陰性症状を軽減し、言語記憶や注意力の陽性症状を改善することが示されている。治療後のアロプレグナノロンとプレグネノロン硫酸塩の上昇は認知機能の強化と相関している。PREGからプレグネノロン硫酸塩への代謝は、統合失調症に関与するNMDARの機能低下を改善する可能性が高い。
Wilding er al)。 (54) HEK 293細胞における組換えキメラGluNおよびGluK2受容体コンストラクトを用いた全細胞記録と分子モデリング 結合部位の確認と特定の受容体ドメインとの関係を明らかにした。プレグネノロン硫酸塩の細胞外指向性結合部位を確認した。ポア形成にはTMDが必要である可能性が高い。 - Paulら(55); Linsenbardtら(56) 試験管内試験(in vitro)およびex vivo電気生理学的手法を用いた治療薬としての合成プレグネノロン硫酸塩アナログおよびオキステロールの検討 脳由来の主要なコレステロール代謝物である24(S)-ヒドロキシコレステロールは、細胞内サイトに結合することでNMDARを調節する。この細胞内オキシステロール結合部位は、プレグネノロン硫酸塩を結合する細胞外部位とは異なる。
- Vyklickyら(57)HEK細胞で発現しているhGluN2Bのde novoミスセンス変異の電気生理学的調査。 膜ドメインに位置するhGluN2Bサブユニットのミスセンス変異は、ステロイドによって修正可能なNMDARの機能喪失によって発現する複数の欠陥につながる。
- Chisariら(58)海馬スライス電気生理学、培養海馬ニューロンおよびXenopus卵母細胞からの試験管内試験(in vitro)電気生理学的記録。 組換えNMDARを発現する。 プレグネノロン硫酸塩の特性を示すことが示されているKK169などのプレグネノロン硫酸塩とオキシステロールのアナログ。
その後25年の間に、内因性ニューロステロイドは学習・記憶機能、海馬の情報処理、シナプス可塑性に関与してきた(28、 29、 48、 59-63)。また、ニューロステロイドは、統合失調症、うつ病、不安症を含む特定の神経精神疾患に関連する学習・記憶障害の病因と治療にも関与している(50、64-66)(表2)。
表2 ヒトの神経学的および精神神経疾患におけるニューロステロイド
障害 ニューロステロイド 臨床反応 記憶
アルツハイマー病
- 側頭皮質。Naylorら(67) DHEAとPREGの増加はアロプレグナノロンレベルを減少させる アロプレグナノロンレベルはBraakとBraak神経病理学的ステージNRと逆相関する。
- 線条体と小脳:視床下部 線条体と小脳の皮質βアミロイドとプレグネノロン硫酸塩との負の相関性 pTauとDHEASの負の相関性 NR
- DHEAS。Carlsonら(68) DHEASと関連しない血漿中ADリスクの増加 記憶力の向上
コルチゾール。Csernanskyら(69) 血漿中での増加 疾患の進行がより迅速になる 記憶力の向上 - コルチゾール。Carlsonら(68) 血漿中の減少 ADリスクとの関係はない 遅延ルートリコールの増加
- 女性のDHEA。Rasmuson ら (70) 血清中の増加は AD リスクと関連している NR
男性のDHEAとDHEAS。Aldred and Mecocci (71) 血漿中の減少はADリスクと関連している NR - 男性ではコルチゾール Rasmusonら(70) 血清中の増加はADリスクと関連している NR
男性のaMCI。Cherrierら(72) テストステロン治療 うつ病の軽減 言語記憶の改善
気分障害
- 高齢者のGAD。Mantellaら(73) 唾液コルチゾールの増加 症状と唾液コルチゾールの正の相関性 NR
- 男性における一般化した社会的恐怖症:Heydari and Le Mellédo (74) 一般化した社会的恐怖症の被験者では血漿中のプレグネノロン硫酸塩のプレグネノロン硫酸塩レベルが低下した NR
- 女性のPTSD。Rasmussonら(75) 脳脊髄液 アロプレグナノロン アロプレグナノロン/DHEAの低下はPTSDおよびProfile of Mood Statesの抑うつ抑うつ抑うつスコアと負の相関がある NR
- 男性のPTSD。Rasmussonら(76) アロプレグナノロンとプレグレナノロン 脳脊髄液 アロプレグナノロン+プレグレナノロンと症状の重症度との間には負の相関がある NR
急性ストレス。Droogleever Fortuynら(77) 血漿アロプレグナノロン末梢性ベンゾジアゼピン受容体濃度上昇 血小板NR - 高齢者の急性心理社会的ストレス。Wolfら(78) DHEAを50mg/kg/日で2週間DHEASが若年成人より低い。DHEA置換はDHEASを増加させる;注意力の強化;宣言的記憶と想起は損なわれるが、空間記憶は損なわれない。
- ジスフォリア。月経前 Girdlerら(79) 血漿中のアロプレグナノロン/プロゲステロンの増加 月経前不安のより大きなレベル NR
- 産後うつ病。Kanesら(80、81) アロプレグナノロン ハミルトン・ディプレッション評価尺度スコアの減少。 NR
シゾフレニア
- Marxら(50) Adjunctive PREG 陰性症状を改善し、認知障害を改善する NR
(51) 8週間のPREG投与で血清PREGとその代謝物であるアロプレグナノロンとプレグネノロン硫酸塩を増加させる 血清PREGの増加はBACSスコアと一致している。
カタメニアルエピレプシス
- Herzog (22) Herzog and Frye (82) プロゲステロンと関連したプロゲステロン アロプレグナノロン プロゲステロン治療を受けた女性の血清 アロプレグナノロン と発作頻度との間に関連はなかった。
- 部分難治性てんかん。併用プロゲステロン 緊張性発作または非緊張性発作には効果なし NR
NR、報告されていない。
記憶障害は、アルツハイマー病(AD)などの加齢に伴う神経変性疾患と併存することが多い(84)。治療の観点から、記憶障害に対する有効な治療法の欠如は、神経変性疾患にとどまらず、うつ病や統合失調症などの幅広い神経精神疾患にまで及んでいる。
記憶障害は、生産的で健康的な生活を送るために必要な日常業務の遂行に深刻な影響を与え、有意義な雇用を維持する能力や治療計画を遵守する能力を含む(85)。本レビューでは、過去30年にわたる我々自身の研究の観点からこの分野を要約し、統合失調症、うつ病、不安障害の患者に見られる記憶障害における神経ステロイドの役割に関する最新の知見をまとめようとしている。ステロイドが神経ネットワーク活動をどのように調節するかをより深く理解することで、システムレベルの “薬理学的コネクトーム “を中心とした脳内のニューロステロイド作用に関する統一的な理論の基礎を築くことができると信じている。
ニューロステロイドの合成、構造、輸送、細胞標的
合成と転座
神経ステロイド合成は、ステロイド原性急性調節タンパク質(StARタンパク質トランスロケータータンパク質(TSPO電圧依存性アニオンチャネル(VDAC)タンパク質、アデニンヌクレオチドトランスポーター(ANT)タンパク質などの輸送タンパク質によるミトコンドリア膜を介したコレステロールの移動を伴う(86-89)。コレステロールのPREGへの変換は、ヒトでは15番染色体上に位置する酵素チトクロームP450側鎖切断(P450 scc)によって触媒される(90)。ニューロステロイドの生合成に関与する他の酵素には、5α-還元酵素と3α-ヒドロキシステロイド脱水素酵素がある(91-93)。これら2つの酵素は、アロプレグナノロンおよびテトラヒドロデオキシコルチコステロン(THDOC)の生合成に関与している。げっ歯類の大脳皮質、海馬、嗅球、扁桃体、および視床においてこれらの酵素を発現するニューロンが同定されたことから、アロプレグナノロンおよびTHDOCは中枢神経系内の前駆体から局所的に合成されることが示唆される(94)。
神経ステロイドの硫酸化および脱硫は、これらの内因性神経調節薬の薬物動態および薬力学的特性の両方をさらに変化させる(95)。ヒトでは、PREGからプレグネノロン硫酸塩への硫酸化はSULT2B1aによって触媒されるが、SULT2B1bは3beta-ヒドロキシステロイドの硫酸化を優先的に触媒する。霊長類の非ヒト研究では、これらの酵素の発現における年齢依存的な変化が認知機能の加齢に伴う変化に関与している可能性が示唆されている(96、 97)。
ニューロステロイドおよびその硫酸化抱合体は、プレグナン、プレグナン、アンドロステイン、プロゲステロン、およびデオキシコルチコステロンとして、それらのコアバックボーン構造に基づいて特徴付けることができる。これらのそれぞれのサブカテゴリの神経ステロイドは、以下のものを含む:
- プレグネガノロン
- プレグネガノロン硫酸塩;PREGPREGS;
- ヒドロエピアンドロステロン(DHEA)
- デヒドロエピアンドロステロン硫酸塩(DHEAS);
- プロゲステロン
- アロプレグナノロン
- デオキシコルチコステロンおよびTHDOC(98)
硫酸化ニューロステロイドの神経学的機能の解明は神経内分泌学のフロンティアであるが、過去数十年の間にいくつかの根本的な進歩があった。
生理学的作用
ニューロステロイドの生理的効果は、神経伝達物質の受容体およびトランスポーターとの直接的な相互作用を介して、またセカンドメッセンジャーのシグナル伝達カスケードの促進を介して間接的に媒介される(47、 48、 99-103)。これらの迅速な非ゲノム効果は、表面膜に位置する抑制性および興奮性受容体のアロステリックな調節を介して発揮される。いくつかのケースでは、ニューロステロイドは、細胞内ステロイド受容体の活性化によって、少なくとも部分的にゲノム効果を発揮する(104)。ニューロステロイドがゲノム効果および非ゲノム効果をもたらす程度は、それらが代謝される程度(例えば、PREGからプロゲステロンへのPREGおよび親分子およびその神経活性代謝物が細胞外受容体および細胞内受容体を調節する程度に依存する(104)。
ニューロステロイドによるGABA作動性神経伝達の調節は、GABAAR上のアロステリック部位との相互作用によって媒介され(105-109ニューロステロイドは、特定のGABAARサブユニットの発現を調節する役割を果たしているようである(63)。古典的な無荷電ニューロステロイドは、抑制性のGABA受容体および神経伝達を調節する。GABA作動性神経伝達の比較的強力な陽性モジュレーターであることが知られている神経ステロイドには、アロプレグナノロン、プレグノロン、およびTDHOCが含まれる。
プレグネノロン硫酸塩はNMDAR介在性シナプス伝達の比較的強力な正のアロステリックモジュレーターであり、一方、硫酸プレグレナノロンはNMDAR介在性グルタミン酸神経伝達の比較的強力な負のアロステリックモジュレーターである(24、 35、 110)。
プレグネノロン硫酸塩は、NMDARを増強する最も広く研究されているニューロステロイドである(111、112)。17-ヒドロキシプレグは、チトクロームP450 17α-ヒドロキシラーゼ/17、20-リアーゼによってDHEAに代謝される。DHEAの硫酸化形態は、PREGの硫酸化形態(すなわち、PREGS)と同様に、NMDAR増強剤でもある。ゼノパス卵母細胞で発現した組換えNMDARの電気生理学的研究は、プレグネノロン硫酸塩の効果がNMDARサブユニット組成に依存していることを確立した。プレグネノロン硫酸塩 は GluN2A および GluN2B-NMDAR を増強する一方で、GluN2C および GluN2D-NMDAR を負に修飾する(38)。NMDAR の一過性の活性化は、長期増強(LTP)やシナプス伝達の強化、長期抑圧(LTD)やシナプス伝達の弱体化の誘導に必要であることが知られている(113)。NMDARの活性化は、海馬や他の脳核における学習や記憶に関与する多くの形態の活動依存性可塑性にとって重要である(114-118)。
プレグネノロン硫酸塩はまた、GABA、グリシン、カイナート、およびα-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸(AMPA)受容体の負のアロステリックモジュレーターとして作用する(34)。プレグネノロン硫酸塩の合成アナログ、PREGヘミスコハク酸、および負の電荷を有する他の関連するPREG誘導体は、NMDA応答を増強する(119)。この観察は、NMDARの正の調節が硫酸基によってそれ自体が媒介されていないことを示唆している。プレグネノロン硫酸塩の他の合成アナログを用いた追加の研究では、C3位の負に帯電した部位がNMDARの正の調節に必須であることが明らかになった(35)。プレグネノロン硫酸塩はまた、リン酸化依存性のメカニズムを介してNMDAR依存性の応答に影響を与える可能性がある(46)。低ナノモル濃度の プレグネノロン硫酸塩 は、細胞内 Ca2+ ([Ca2+]i)依存性の非定型的なメカニズムを介して、NMDA に対する神経細胞応答の遅延発現を増加させ、細胞表面への NMDAR の移動を誘導する(47) (図 2)。さらに、低ピコモルのプレグネノロン硫酸塩濃度は、[Ca2+]iとCREBのリン酸化を増加させるのに十分であるように見える(48)。
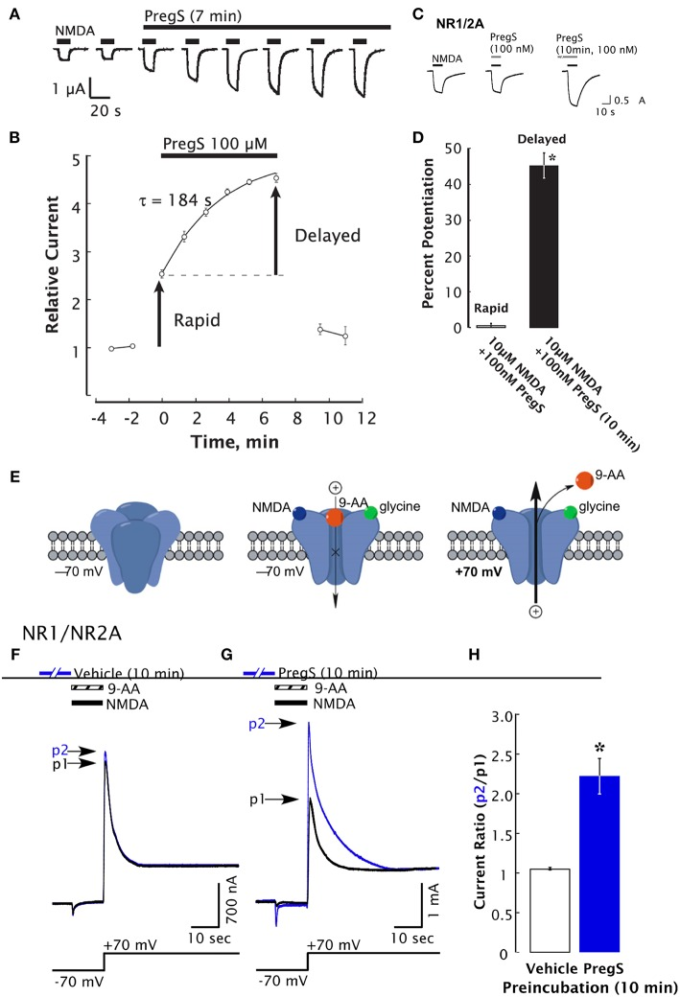
図2
NMDARの遅発性増強はプレグネノロン硫酸塩によって誘導される。プレグネノロン硫酸塩(100μM)とNMDA(300μM)の適用後のNR1/2Aサブユニットを発現するXenopusの卵母細胞からの二電極全細胞電圧クランプ記録。A)プレグネノロン硫酸塩によるNMDA応答の増強。黒いバーは、NMDAの連続的なアプリケーションを示している。B)(A)のように決定されたピークNMDA誘導電流は、t = 0で始まるプレグネノロン硫酸塩の適用前の平均応答に正規化されている。 平滑な曲線は、指数フィット(t = 184秒)を反映している。エラーバーはS.E.M.を示す(n = 3)。矢印は、増強の急速および遅延成分を示す。D)NR1/2A受容体を発現する卵母細胞では、遅延増強はあるが、急速増強はない100 nM プレグネノロン硫酸塩によって誘導される。D)急速および遅延増強のための正規化されたピーク電流応答の平均値。NMDAと同時に添加した場合、プレグネノロン硫酸塩はNMDA応答のごくわずかな増強(1±2%)をもたらすのに対し、100nM プレグネノロン硫酸塩を10分前にインキュベートした後、NMDAに対する応答は45±3%増強された。エラーバーはS.E.M.(n = 8-10)を示す。*急速増強と遅延増強の間の有意差を示す(P < 0.0005)。E)漫画は、NR1/2A受容体を発現するXenopus卵母細胞にNMDAと9-アミノアクリジン(9-AA)(100μM)を共適用すると、NMDA活性化チャネルが9-AA(電圧依存性オープンチャネルブロッカー)によってブロックされているように過渡的な内向き電流の結果を示している。保持電位が-70から+70 mVに切り替わると、9-AAによるNMDARチャネルのブロック解除を反映した外向きの尾電流が生じる(黒の痕跡)。細胞は、その後、ビヒクル(Ba-リンガー)(F)またはプレグネノロン硫酸塩(G)に10分間曝露し、9-AAブロックおよびアンブロックシーケンスを繰り返した(青のトレース)。ベースライン減算後のピークテール電流は、同じ細胞(p2/p1)からのコントロール電流(黒のトレース)に対する相対的な表現である。H)プレグネノロン硫酸塩処理卵母細胞のピーク電流比p2/p1(青バー、n = 8)は、ビヒクル処理卵母細胞(白バー、n = 6)よりも有意に高いである。*相対電流P < 0.00001、非対数2-tail t-検定[Kostakisら(47)より許可を得て]。
NMDARに対するプレグネノロン硫酸塩の効果は多様である(15)。NMDARは少なくとも2つの異なる調節部位を持っている(38)。プレグネノロン硫酸塩はNMDA媒介チャネル開通の頻度および持続時間を増加させる一方で、AMPAおよびGABAARを阻害する(24、 110)。プレグネノロン硫酸塩の効果はNMDARのサブユニット構成に依存する(45、 120)。プレグネノロン硫酸塩は、GluN1-1a/GluN2Bのステロイド調節ドメインを介して、GluN2Bのステロイド調節ドメインを介して、GluN1-1a/GluN2Bと組換えNMDARを増強する。プレグネノロン硫酸塩を介したGluN-2C-NMDARsの増強は、同様にpH依存性である。一方、GluN2Aと2D-NMDARはpHが低下すると増強される。GluN1-1bサブユニットのN末端エキソン5スプライシングインサートの存在は、プロトン依存的なプレグネノロン硫酸塩の増強の程度を調節している(43、 45)。プレグネノロン硫酸塩による調節に対するNMDARアイソフォームのpH感受性の違いは、中枢神経系の健康や疾患におけるプロトンセンサーの重要性を考える上で重要であると考えられる(45)。プレグネノロン硫酸塩は、プレグネノロン硫酸塩部位とは異なる部位で作用し、サブユニット組成に関係なくNMDARを阻害する(35、38、46)。
プレグネノロン硫酸塩は、自発的興奮性シナプス後電流(sEPSC)の周波数を増加させるが、振幅は増加させない。このことは、プレグネノロン硫酸塩が介在するシナプス前の自発的グルタミン酸放出の調節を実証しており、海馬機能に対するプレグネノロン硫酸塩の潜在的な重要な影響を指摘している。プレグネノロン硫酸塩によるプレシナプス一過性受容体電位チャネル(TRPチャネル)受容体の活性化は、グルタミン酸放出を調節し、歯状回の急性分離した海馬ニューロンにおけるsEPSCを増加させるが、この増加はTRPチャネルアンタゴニストによってブロックされる(121)。Dongら(122)は、以前にプレグネノロン硫酸塩のシナプス前効果を実証した。Leeら(121)は、Ca2+誘導Ca2+放出(CICR)を介して細胞内Ca2+を変化させることにより、プレシナプス可塑性を誘発するプレグネノロン硫酸塩の役割を同定した。さらに、プレグネノロン硫酸塩は神経可塑性の鍵となるCICRを調節している。プレグネノロン硫酸塩は、NMDARやL型電圧ゲーテッドCa2+チャネル(L型VGCC)の活性化によって間接的にCICRに影響を及ぼす可能性があり、Ca2+放出活性化Ca2+チャネルタンパク質1(ORAI1)や間質相互作用分子1(STIM1)の直接的な活性化によっては影響を及ぼさない。
PREGと構造的に類似しているDHEAは、ヒトの体内で最も豊富に発現しているニューロステロイドである。このニューロステロイドは脳内で合成され、血漿中よりも脳内の方が高濃度である(123)。DHEAとDHEASはNMDAとAMPA受容体を介して作用し、神経保護作用を持つ(124、 125)。DHEAはまた、神経栄養チロシンキナーゼ受容体との相互作用を介して、神経細胞の分化およびプログラムされた細胞死においても役割を果たしているようである(126、 127)。DHEASは、ステロイドDリング上のC17でアセチル基のためにカルボニル酸素が置換されている以外はプレグネノロン硫酸塩に構造的に類似しており、NMDA媒介のCa2+電流を増強し、GABAAR媒介の塩化物電流を阻害する(124、 128-131)。神経ステロイドは神経保護作用を有し、神経炎症を減少させる(124、 125、 132、 133)。
調節性認識部位
ニューロステロイドの受容体への直接的な結合およびニューロモデュレーションを支えるメカニズムに関する情報は少ない(39、 134)。ニューロステロイドが特定のカテゴリーやサブタイプのニューロン受容体に結合して活性化する能力は、以下のような影響を受けます。(1)親分子と硫酸基との共役、(2)形状(平面対曲面)、および(3)電荷(38、 119)。ニューロステロイドが媒介する効果の複雑さ、例えばGABAARのゲーティング(109、 135-139)およびグリシンおよびNMDARのサブユニット特異的調節(140)は、増強および抑制効果に寄与する複数の結合部位の可能性を示唆している(39)。GABAARに対するニューロステロイドの効果はまた、強直抑制に役割を果たすδサブユニット含有受容体の調節にも関与しているようである(141-145)。
受容体の膜貫通ドメインは、NMDAR(43)(図3)およびGABAAR(109、146、147)のニューロステロイド媒介の調節に役割を果たしている。GABAARsのα1サブユニットM1および/またはM2膜ドメイン内の残基は、ニューロステロイド作用に重要である(109)(図4)。 ニコチン性アセチルコリン受容体のホモログである五量体リガンドゲートイオンチャネル(GLIC)を用いた最近の研究では、膜貫通ドメイン内のアロプレグナノロンのサブユニット間およびサブユニット内のニューロステロイド結合部位が同定されている(134)(図5)。この革新的なアプローチを用いて、Chengら(134)は、ニューロステロイドバックボーン上の12および15の位置での置換がGLICチャネル活性の変調を変化させ、両方のサイトの機能的な役割を実証することを発見した。ニューロステロイドのGABAARとの相互作用は立体選択的であり、これらの化合物の結合部位が特定の寸法および形状であることを示唆している(12、 34、 148)。
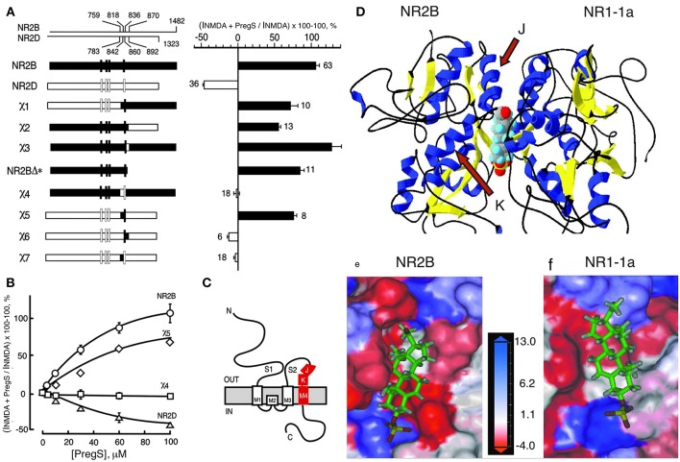
図3
NMDARのステロイド調節ドメイン。A)(左)野生型NR2B、NR2D、およびNR2B、NR2Dキメラの模式図。NR2BとNR2Dのキメラへの寄与度をそれぞれ黒と白で示す。上段の目盛りは、野生型サブユニットの接合部の残基数を示す。縦棒は4つの疎水性膜ドメインを示す。右)100μM PSの存在下でのNMDAグリシン応答(300μM NMDAとNR1-1aとNR2サブユニットを発現する卵母細胞で50μMグリシンによって誘発される)のパーセント増加を示している。エラーバーはSEMである。エラーバーに隣接する数字は、研究で使用される卵母細胞の数を示す。B)NR2B(○NR2D(Δχ4(χ5(♢)を含む受容体に対するプレグネノロン硫酸塩変調の濃度-応答曲線を、NMDA(300μM)およびグリシン(50μM)の飽和濃度の存在下で決定した。NR1-1a χ4およびNR1-1a_NR2BのEC50(NMDA)はともに22±1μMであり、EC50(グリシン)はそれぞれ0.30±0.02および0.10±0.02μMである。C)NR2Bサブユニットのトポロジカル表現と同定されたセグメントの位置を赤で描いている。膜ドメインは、M1-M4として示されている。アミノ末端(N)は細胞外側に、カルボキシル末端(C)は細胞内側に位置している。D)プレグネノロン硫酸塩の潜在的な結合ポケットの分子モデリング。NR2BとNR1-1aのS1/S2ドメインからなる二量体は、2つのサブユニット間の界面にプレグネノロン硫酸塩がドッキングしたヘリックス(青)とシート(黄)の3次元リボン構造で描かれている。JとKのらせん(矢印参照)とNR2BサブユニットのM4の両方がPSの増強を与えるために必要であるという我々の発見は、M4はまた、細胞外結合領域からゲーティング機構にアロステリックな変調をカップリングするために重要であることを示している。E)NR2B上のプレグネノロン硫酸塩の潜在的な結合ポケットの詳細図。F)NR1-1a上のプレグネノロン硫酸塩のための潜在的な結合ポケットの詳細図。NR1-1aまたはNR2Bは、それぞれNR2B(E)またはNR1-1a(F)上の疎水性ポケットを示すためにモデルから削除されている。受容体表面は、疎水性残基が赤色で、荷電残基が青色である疎水性スケールに従って着色されている。プレグネノロン硫酸塩は棒状に描かれており、原子の種類によって色分けされており、白は水素、緑は炭素、赤は酸素、黄色は硫黄となっている。JおよびKらせん(矢印参照)とNR2BサブユニットのM4の両方がPS増強を付与するために必要であるという我々の発見は、M4がまた、細胞外結合領域からのアロステリック変調をゲーティング機構に結合する上で重要であることを示している[許可を得てJangら(43)から]。
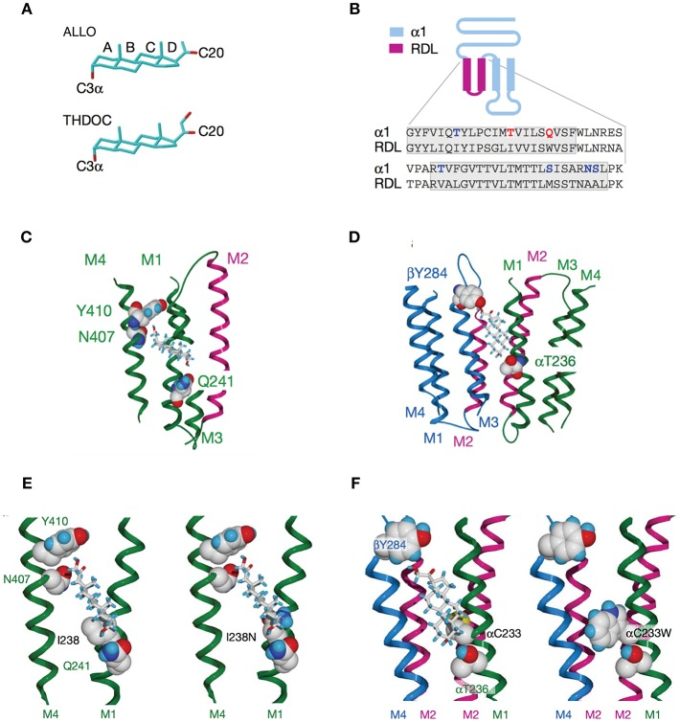
図4
アロプレグナノロンやTHDOCなどの神経ステロイドによるGABAARの活性化は、膜貫通ドメイン上の活性化部位と増強部位の両方の占有に依存する。A)GABAARの制御は、Aリング上のC3a水酸基とDリング上のC20ケトンに依存している。B)ニューロステロイド活性は、αサブユニットM1ドメイン残基によって決定される。マウスα1およびβ2サブユニットの膜ドメインM1からM2の末端までを、それぞれキメラαRおよびβRを形成するRDLサブユニットからの対応する配列で置換することは、それらのGABARの薬理学を確立するために使用される最初の改変であった。THDOCおよびアロプレグナノロンによるGABAARの増強および直接活性化は、αRを組み込んだキメラ受容体では無効であり、βRを含む受容体は野生型と区別がつかなかった。α1の極性残基(青)は太字で、Thr 236とGln 241(赤)は強調表示されている。膜貫通ドメインは箱で囲まれている。C)神経ステロイドの増強にはαサブユニットM1とM4の膜ドメインが必要である。脂質二重層から見たαサブユニットのリボン構造は、αGln 241、αAsn 407、およびαTyr 410がTHDOC分子とドッキングしていることを示している。M2膜ドメインを覆うチャネルは紫色で示されている(わかりやすくするためにM3ドメインのセクションを省略している)。D)ニューロステロイド活性化結合部位はβ/αサブユニット界面にまたがっている。THDOC分子が結合した膜貫通領域(細胞外ドメインおよび細胞質ドメインを除去した)の眺め。αThr 236を非水素結合性のイソロイシンまたはバリンで置き換えると、アロプレグナノロンおよびTHDOCのアゴニスト活性が低下する。E)神経ステロイドの増強はαサブユニットM1およびM4膜ドメインを必要とする。デビッド:以下はαまたはβ記号を示すべきか?]αサブユニットのM1とM4膜ドメインの間の増強部位に結合したTHDOCのホモロジーモデル(わかりやすくするために図からM3膜ドメインを削除した)。イル238は、THDOCのAリングの近くにあると予測される(左)。アスパラギンとの置換のような残基238で同様のサイズの、しかし極性のある側鎖の導入は、ステロイドを撃退する(右)。F)Cys 233(左)をトリプトファン(右)に置換することで、βTyr 284とαThr 236へのTHDOCの結合に対する立体障害が増加している[Hosieら(109)の図1、3、4より]。
図5
アロプレグナノロンのドッキング位置と光標識試薬は、サブユニット間およびサブユニット内のサイトで。(A) インターサブユニットドッキングサイト;Glu-272(5α-6-AziP、5α-12-AziP、5α-15-AziP)とPhe-267(KK200)のための光標識残基を紫色の球体で示す。(B)サブユニット内ドッキング部位;光標識された残基、Tyr-194(5α-6-AziP)およびAsn-307(KK200)を紫色の球として示す[Chengら(134)より、許可を得て]。
この結果は、細胞外ドメインと膜貫通ドメインの間の相互作用が、ニューロステロイドの正および負の調節作用において本質的な役割を果たすことを示唆している(149)。細胞機能のニューロステロイド依存性調節を決定するもう一つの重要な因子は、ニューロステロイドの局在である。最近の研究では、内因性ニューロステロイドとその合成アナログの両方を用いて、この側面の研究が始まっている。細胞膜を透過することができるニューロステロイドは、異なる細胞内コンパートメント内に局在化することができる。このコンパートメント化は、ニューロステロイドの治療機能にとって重要であると考えられる(150)。
ニューロステロイドの他の既知の分子標的は、様々なTRPチャネル(151、152セロトニン受容体およびL型VGCC(42)を含む。哺乳類で発現するTRPチャネルのサブタイプには、TRPC(カノニカルTRPV(バリノイドTRPM(メラスタチンおよびTRPA(アンキリン)チャネルが含まれる。プレグネノロン硫酸塩は、膵臓β細胞のTRPM3チャネルを介してCa2+流入を調節する(151)。さらに、これらの研究では、TRPM3は関連物質PREG、DHEAおよびDHEA硫酸によっても活性化されている。ChenおよびWu(153)による以前の研究は、プレグネノロン硫酸塩がカプサイシン受容体としても知られるTRPV1を活性化することを示唆しているが、Wagnerおよび同僚によって試験されたTRPVおよびTRPMサブファミリーの他のメンバーは、プレグネノロン硫酸塩によって活性化されなかった。
TRPM3チャネルは、新生児プルキンエ細胞のグルタミン酸シナプスで発現している(154)。AMPA受容体媒介の小型興奮性シナプス後電流(mEPSC)周波数に対するプレグネノロン硫酸塩の効果は、非選択的TRPチャネルブロッカーであるランタニド3+によってブロックされ(155グルタミン酸放出のプレグネノロン硫酸塩調節の標的としてのTRPM3の支持を提供している。Valenzuelaら(156)は、プレグネノロン硫酸塩がTRPチャネル依存的にCa2+の流入を促進し、シナプス前のグルタミン酸放出を増加させ、シナプス後膜へのAMPARの挿入を促進することでサイレントシナプスを活性化することを実証した(図6)。これらの結果に基づいて、Valenzuelaらは、グルタミン酸シナプスにおけるプレグネノロン硫酸塩の作用を説明するための作業モデルを開発した(図7)。このモデルは、Kostakisら(47)によって報告されたNMDA応答の遅発性増強の最近の発見と一致している。我々はその後、プレグネノロン硫酸塩によって誘導されるNMDAR応答の遅延発症増強現象が、生理学的に適切なピコモル濃度で発生し、学習や記憶機能に関連した下流のシグナル伝達経路に結合していることを実証した(図8、 、99)。

図6
プレグネノロン硫酸塩はサイレントシナプスを活性化する。A)P3ラットから海馬スライスのCA1錐体ニューロンから全細胞パッチクランプ記録のサンプルトレースは、25μMのプレグネノロン硫酸塩曝露後にmEPSCsを明らかにした。コントロール条件下では存在しないこの効果は、ウォッシュアウトによって逆転されない。B)図(A)に示す記録のための時間経過の描写。NBQXはこの効果をブロックし、それがAMPA受容体によって媒介されていることを示していることに注意してほしい。C)累積確率プロット。10対25分でのmEPSCのイベント間の間隔の分布は、プレグネノロン硫酸塩の曝露に影響されない。平均mEPSCトレースは、これらの時点でmEPSC振幅にプレグネノロン硫酸塩の影響がないことを示している。D)時間の関数としてのイベントの数(n = 8-12)にビヒクル(DMSO)とプレグネノロン硫酸塩(灰色のバーで表されるアプリケーション)の効果を示す要約図[許可を得てValenzuelaら(156)から]。

図7
未熟なCA1海馬錐体細胞におけるグルタミン酸シナプスにおけるプレグネノロン硫酸塩と関連するニューロステロイドの作用のワーキングモデル。A)コントロール条件下では、新生児CA1海馬錐体細胞は、シナプス後AMPAR(青)とNMDAR(赤)の両方を含むグルタミン酸シナプスの混合物を持つことができる(アクティブなシナプスまたはシナプス後NMDARのみを含む(安静時のサイレントなシナプス)。サイレントシナプス」を拡大したもの。シナプス前NMDARはオレンジ色で示されている。B)プレグネノロン硫酸塩はシナプス前NMDARを介してCa2+の流入を増加させ、グルタミン酸放出の確率の増加とシナプス後NMDARの活性化につながる。これらのシナプス前およびシナプス後のNMDARはNR2Dサブユニットを含んでおり、Mg2+ブロックの影響を受けにくくなっていると考えられる。C)グルタミン酸放出確率は、プレグネノロン硫酸塩ウォッシュアウト後のベースラインレベルに戻る。パネルBに示す[Ca2+]のシナプス後の増加は、”サイレントシナプス “でのみAMPARの遅延挿入を誘発する[許可を得てValenzuelaら(156)から]。

図8
プレグネノロン硫酸塩のピコモル濃度が初代培養大脳皮質ニューロンの[Ca2+]iを増加させる。A)大脳皮質ニューロンのフィールドの位相コントラスト(左蛍光(中およびマージ(右)画像。B)50 pM プレグネノロン硫酸塩の適用前(上、0秒)と適用後(下、19秒)。ニューロン細胞体として形態的に定義された関心領域は、白でアウトライン化されている。C)(B)の3つのニューロンについて、同じ細胞の平均初期強度(F/FO)に正規化された平均6 S.E.M.蛍光強度。D)ベースラインCa2+蛍光を(左)のトレースに示す。PREG(50 pM)は[Ca2+]Iを増加させない(中央トレース)一方、50 pM PREGの存在下での50 pM プレグネノロン硫酸塩の後続適用は[Ca2+]Iを増加させる。右トレース)(平均6S.E.M.、30ニューロン)。(E) 50 pM プレグネノロン硫酸塩は初代培養海馬ニューロンの[Ca2+]iを増加させる。(A、B)のスケールバー:10 mm。スミスら(48)より許可を得て掲載]。

図9
pM プレグネノロン硫酸塩によって誘導された[Ca2+]iおよびpCREBの増加の原因となりうる経路を示す模式図。図は、電位依存性Na+チャネル、NMDAR、およびCa2+Lを介して50pM プレグネノロン硫酸塩刺激による[Ca2+]iの増加、およびシナプスNMDARおよびERK活性化を介して50pM プレグネノロン硫酸塩誘発性pCREBの増加を示している。本研究で使用した阻害剤は太字である。*KN93はプレグネノロン硫酸塩誘導性pCREB増加を阻害しなかった。許可を得てSmithら(48)より)]。
TRPチャネルの調節は、ADなどの加齢に伴う神経障害の治療標的として提案されている(157)。TRPA1チャネルは、アストロサイトの安静時Ca2+および抑制性シナプスの効力を調節する(158)。TRPA1チャネルはまた、ADのマウスモデルにおけるアストロサイトの多動とAβによって媒介されるシナプス機能不全にも関与している(159)。種の違いによるTRPA1チャネルの認識された違いは、前臨床のげっ歯類モデルからの結果の翻訳の価値を混乱させるものとして引用されてきた(160)。例えば、ヒトのTRPA1活性はカフェインによって抑制されるが、マウスのTRPA1チャネルは活性化される(161)。脳内で発現するTRPの異なるサブタイプの機能的調節因子としてのニューロステロイドの役割を完全に解明するためには、さらなる研究が必要である。
細胞膜を介した負電荷ステロイドの輸送
硫酸化ステロイド、すなわち プレグネノロン硫酸塩 と DHEAS は、非常に負に帯電しているため、特定のトランスポーターなしでは細胞膜を通過しないという点でユニークである。そのため、プレグネノロン硫酸塩やDHEASが細胞内に存在する受容体に特異的な膜トランスポーターを持たずに迅速に結合することは不可能ではないが、その可能性は低いと考えられる。我々の結果は、プレグネノロン硫酸塩が細胞外で作用し(35)、PREGはモジュレーターとして不活性であることを示している(36-38、 162)。これらの理由から、プレグネノロン硫酸塩は、親分子が完全に正の電荷を持ち、細胞外に向けられた認識部位でのみ活性化されるアセチルコリンのような古典的な神経伝達物質の特性に、より密接に似ているが、即時の分解生成物(コリン+酢酸)は不活性である。しかし、神経細胞膜に関しては、全細胞パッチクランプ記録構成(47)を介して同じ濃度のプレグネノロン硫酸塩を内部的に透析した培養皮質および海馬ニューロン(27、48)に細胞外適用した場合でも、プレグネノロン硫酸塩は完全な効果を示す。
エストロゲン(ERプロゲステロン、およびその代謝物アロプレグナノロンなどのステロイドの認識部位は、現在、比較的よく知られている。例えば、ERαのような膜結合型ER受容体は、細胞表面に局在し、中枢神経系で産生されるERによって媒介される細胞シグナルを制御している。興味深いことに、これらの膜受容体の活性化は、迅速な非ゲノム効果をもたらし、中枢神経系における神経細胞の可塑性を制御する(166-171)。
ラット海馬およびニワトリの初代培養中の初代海馬およびニワトリの脊髄ニューロン、ならびにキノープスの卵母細胞で発現した受容体の内因性NMDARに対するプレグネノロン硫酸塩の細胞外活性化部位は、Farbらによって実証されている(26)。プレグネノロン硫酸塩の細胞外適用はNMDARを活性化するが、プレグネノロン硫酸塩を用いた細胞内透析では、ニューロン応答を誘発することも、細胞外適用されたプレグネノロン硫酸塩を阻害することもできない(35)。細胞外で誘導されたプレグネノロン硫酸塩-結合ドメインと義務的膜貫通ドメインTM4は、神経伝達物質のコ・アゴニストであるグルタミン酸とグリシンによるNMDAR活性化の正のアロステリックな調節に関与している[(43、 44) and review by (62、 172)]。
これらの知見は最近Wildingら(54)によって確認され、拡張されたものであり、彼はNMDARの特定のドメインを非神経細胞HEK293細胞で発現したカイナト受容体の相同ドメインで置換することによってキメラ受容体を生成し、細孔形成およびNMDARのアロステリック調節に対する特定のドメインの寄与を解明した。対照的に、ジヒドロキシステロールによる増強はリガンド結合ドメインを必要とせず、代わりにNMDARのカルボキシ末端ドメインの膜近位部分を必要とすることから、細胞内での受容体活性化のための部位が指示されていることが示唆された。最近、Chisariら(58)は、KK169のようなプレグネノロン硫酸塩の化合物アナログの特徴付けを記載している。プレグネノロン硫酸塩と同様に、KK169は、NMDARの機能を増強する能力を有し、細胞表面指向の活性化ドメインにおけるプレグネノロン硫酸塩および関連する硫酸化ステロイドの作用と一致するいくつかの特性を有している(35、 43)。興味深いことに、KK169はNMDARのオキステロール増強を阻害しないが、これは細胞外に指向された結合部位(プレグネノロン硫酸塩と同様)での作用と一致している。しかし、培養海馬ニューロンでは、KK169のいくつかの隔離が観察され、膜輸送と蓄積の可能性のあるメカニズムが明らかになった。
これらの考察はまた、特定の膜貫通型トランスポーターが必要とされるであろうという明確な期待をもって、プレグネノロン硫酸塩がBBBを越えることができるかどうかという疑問にも関連している。実際には、このようなトランスポーターは、非包囲された脳内毛細血管(173-177)で観察されており、グリアおよび/またはニューロンに存在する可能性があり、隔離に向けた可能性のある経路を提供している。
神経ステロイドと記憶機能
PREGは当初、他のステロイドの前駆体としてのみ考えられており、アクティブなモジュレーターとしては考えられなかった。PREGと関連する硫酸化ニューロステロイド3α-ヒドロキシ-5β-プレグナン-20-1の結合の蛍光分光学的研究は、NMDAおよびAMPA受容体を差動的に変調するが、電流の流れに対するこれらの硫酸化ニューロステロイドの差動的な効果は、これらの受容体のSIS2およびアミノ末端ドメインでの結合に関連している可能性があることを示唆している(39)。カンナビノイド受容体1(CB1)は、PREGの分子標的として同定されている(178)。大麻の活性成分であるテトラヒドロカンナビノールまたはTHCは、CB1受容体依存的な方法でPREG合成を誘導する。PREGはその後、大麻中毒を改善するように作用する脳内の自己分泌・副分泌ループにおけるCB1受容体のアロステリック・ネガティブ・モジュレーターとして作用する。CB1受容体の活性化は、神経伝達物質の放出を抑制することで学習や記憶機能を調節することはよく知られている。興味深いことに、2つのカンナビノイド受容体媒介シグナル伝達カスケードが同定されている:1つはPREG感受性で、小胞性タンパク質Munc-18-1を標的とし、それによって伝達物質の放出を抑制する。統合失調症と診断された患者に補助的に投与すると、PREGは陰性症状を改善し、認知障害を改善する(50)。
全身投与された硫酸化ニューロステロイドがBBBを通過する能力についてはまだ論争があるが、NMDARの正のアロステリックモジュレーターとして作用することがよく知られているPREGSによる急性治療は、学習および記憶機能の改善と関連している(21、 24、 31、 34、 35、 162、 180-185)。硫酸化化合物の流入は、BBBや脈絡叢に位置する有機陰イオン輸送ペプチド(OATP)などのトランスポーターに依存している(173、 177、 186)(図10)。

図10
DHEASおよびプレグネノロン硫酸塩の輸送に関与するABCおよびSLCトランスポーターとその局在を示す模式図。(A) DHEASとプレグネノロン硫酸塩の構造。(B、C) ATP結合カセット(ABC)と溶質輸送体(SLC)タイプの膜タンパク質は、BBBや脈絡叢(CP)での神経ステロイドの輸送を促進する。溶質キャリアであるOAT3(SLC22A3OATP1A2(SLCO1A2OATP2B1(SLCO2B1OSTa/ß(SLC51A/B)は、神経細胞やグリア細胞からの硫酸化ステロイドの分泌、BBBやCP内の血液-脳脊髄液バリアを越えた輸送に関与している。矢印は基質輸送の方向を示す。また、基底膜や先端膜での発現や局在性についてはほとんど議論の余地がないタンパク質は、明るいオレンジ色で破線で示している。DHEASとプレグネノロン硫酸塩の濃度勾配は、BBBとCPを横切って右に描かれている[許可を得てGrubeら(177)から]。
負に帯電した硫酸ステロイドが中枢神経系からBBBを横切って全身循環に流出する際のこれらのトランスポーターの役割はかなり確立されているが、硫酸ステロイドの全身投与が学習や記憶機能の改善を含む認知への効果をもたらすことがわかっているにもかかわらず、脳への流入に関連する特定のメカニズムは完全には解明されなかった(31、 173、 176)。17α-ヒドロキシラーゼ/C17-20-リアーゼやヒドロキシステロイドスルホトランスフェラーゼの発現を調べた研究から、DHEASのような硫酸化ステロイドがヒト海馬内でde novoに合成される可能性は低いことが示唆されていた(186)。この研究により、硫酸化神経ステロイドは末梢から中枢神経系に輸送されなければならないという示唆につながっているが、この仮説は検証されていない(186)。ラット脳灌流in situを使用して、Qaiserら(176)は、プレグネノロン硫酸塩はDHEASよりも迅速に脳に入り、両方の硫酸化ステロイドは、BBBの毛細管画分に位置するスルファターゼによって媒介される広範な脱硫を受けることを発見した。これらの複雑な関係を解明するためには、より多くの研究が明らかに必要であるが(95)、共役ニューロステロイドの全身投与は、それにもかかわらず、非硫酸化ニューロステロイドの中枢神経系レベルの増加をもたらすことができる(176)。
認知機能増強効果がプレグネノロン硫酸塩またはPREGによるものかどうかは、まだ決定されていない。しかし、健康な被験者におけるPREGの認知機能増強効果は、PREGの代謝物であるアロプレグナノロンによるものである可能性は低い。逆に、アロプレグナノロンは、統合失調症やその他の神経ネットワーク活動が制御されている神経疾患や神経学的障害の患者に見られるPREGの効果に役割を果たしている可能性がある(51)。
合成医薬品とは異なり、学習・記憶機能におけるニューロステロイドの役割について報告されている文献には、内因性レベルの役割を調べた研究もあれば、全身投与されたニューロステロイドの効果を調べた研究もある。このため、これらの研究の結果を解釈する際には、以下のようないくつかの重要な要素を考慮しなければならない。(1) 親ニューロステロイド分子の代謝と活性代謝物の作用機序が異なる可能性があること、(2)投与スケジュールが急性または慢性である可能性があること、(3) ニューロステロイドと循環ステロイドホルモンの内因性レベルとの間の薬物動態および薬力学的相互作用が時間の経過とともに変動する可能性があること、などである。
記憶機能のテストにおけるパフォーマンスもまた、訓練またはテストとの関係で神経ステロイドが投与される時期に依存する。例えば、訓練前に神経ステロイドを投与すると、新しい情報の獲得と統合の両方に影響を与えるが、訓練後に投与すると統合と想起には影響を与えるが、獲得には影響を与えないと予想される。評価される記憶機能の種類(例えば、作業記憶と長期記憶)もまた、ニューロステロイドの効果に対して多かれ少なかれ敏感であるかもしれない。最後に、研究対象者の年齢と認知状態を考慮しなければならない。これらの要因については、以下で詳しく説明する。
親分子の作用機序と活性代謝物への代謝
ニューロステロイドは他のニューロステロイドに代謝され、神経機能にも影響を与える。例えば、PREGはアロプレグナノロンの親油性前駆体であり、プロゲステロンの代謝物でもある。PREGの負荷用量の投与は、血清アロプレグナノロンレベルの上昇と関連している(192)。PREGは優先的にアロプレグナノロンに代謝されるが、プロゲステロンおよびDHEAにも代謝される(51、52、104)。PREGのようなニューロステロイドがプロゲステロンに代謝される程度、およびその逆は、投与量が細胞外受容体または細胞内受容体を調節して非ゲノム対ゲノム効果をもたらすかどうかを決定する(104)。
フィナステリドなどの5αリダクターゼ阻害薬の投与は、プロゲステロンのアロプレグナノロンへの代謝を阻害し、それによって内因性および外因性の神経ステロイド源の神経調節効果に影響を及ぼす可能性がある(193-195)。基底核へのプレグネノロン硫酸塩の直接注入を見ている研究は、このニューロステロイドがラットの空間記憶機能を改善し、基底側扁桃体と前頭頂皮質でアセチルコリン放出を増加させることを示している(196)。これらの promnestic 効果にもかかわらず、サルファターゼによる プレグネノロン硫酸塩 などの硫酸化ニューロステロイドの代謝は、BBB を横切る限られた輸送と相まって、新しい治療法としてこの化合物の開発を妨げている。この制限は、合成アナログを使用することによって克服することができる(132)。
急性対慢性投与スケジュール
アロプレグナノロンの急性投与はADの1つのマウスモデルにおいて記憶機能を改善する(197)が、げっ歯類モデルを用いた他の研究では、アロプレグナノロンへの慢性的な曝露が実際に記憶障害を引き起こし、疾患関連の機能障害を悪化させる可能性があることを示唆している(198-200)。アロプレグナノロンが野生型ラットにおいてCREBリン酸化を一過性に増加させ、神経新生の指標を増加させるという観察(201)は、急性効果と慢性効果が同じではない可能性を示唆している。これらの観察結果のヒトへの翻訳的関連性は不明である。なぜなら、男性は血清アロプレグナノロンの年齢に関連した減少を示すが、このニューロステロイドの循環レベルの同様の年齢依存性の減少は女性には見られないからである(202)。逆に、女性はアロプレグナノロンの循環レベルの変化を示し、それはステロイドホルモンの循環レベルの一過性の変化と相関している(202)。興味深いことに、アロプレグナノロンの急性全身投与は、意味的または作業記憶機能を損なうことなく、健康な女性のエピソード記憶機能を妨害するようである(203)。
記憶機能に対する神経ステロイドの脳領域特異的な効果を調べた研究は、これらの神経調節物質が情報の獲得、統合、検索において果たす役割をさらに解明するのに役立っている。GABAAR陽性モジュレーターであるアロプレグナノロンをマウスに全身投与すると、海馬依存性の新規物体認識タスクにおける情報の獲得と統合が阻害される(204、 205)。アロプレグナノロンは齧歯類モデルにおいて、獲得試行の前にマグノセルリス基底核に注射されると、記憶の獲得/符号化が障害される。受動的回避パラダイムの獲得段階の後、CA1亜領域にアロプレグナノロンを海馬内投与しても、記憶保持には測定可能な効果はない(206)。
ニューロステロイドの年齢に依存した効果
神経活性ステロイドホルモンのレベルは、発育中、加齢に伴って、また発情期に渡って変化する(207、 208)。記憶機能に対する神経ステロイドの年齢に依存した影響は、げっ歯類やヒトで見られる。例えば、雌ラットの新生児のエストラジオールへの曝露は、成人期におけるアロプレグナノロンの脳レベルの低下と学習および記憶機能の改善と関連している(209)。主に動物モデルでの研究に基づいて、プロゲステロンやその代謝物などのステロイドホルモンへの発育期の曝露によって誘導されるGABAARs発現の永続的な変化が、海馬の神経細胞の興奮性、および性依存性神経精神障害や記憶障害の病因に関与していることが示唆されている(209-211)。5α-還元酵素阻害剤フィナステリドを妊娠ラットの仔ガメに妊娠後期に投与すると、その仔ガメの認知機能と神経内分泌機能が障害される(210)。新生児の雌ラットにエストラジオールを投与すると、シナプス外α4/δサブユニット含有GABAARの発現が増加し、成人期のモリス水迷路でのパフォーマンスが改善される(209)。
ヒトでは、アロプレグナノロンの血清レベルは通常、生後2年間は安定している(212)。肥満児はアロプレグナノロンの循環レベルが上昇していることが報告されているが、このことが後年の学習および記憶機能にどのような影響を及ぼすかは明らかにされていない(213)。閉経後の女性では、気分に対するアロプレグナノロンの効果は用量依存性であり、逆U字型の治癒を示すようである(214)。アロプレグナノロンの内因性レベルの主な原因は卵巣の黄体であり、驚くことではないが、アロプレグナノロンの血清レベルは思春期および多嚢胞性卵巣症候群(PCOS)で増加する(202、 212、 215-218)。機能画像研究では、PCOSを持つ未治療の女性のワーキングメモリタスクの実行中に右上頭頂葉と下頭頂葉内の活動が増加していることが示されている。観察されたニューロン活動の増加は、抗アンドロゲン療法によって減衰する(219)。
ヒトの月経周期中、アロプレグナノロンとプロゲステロンの濃度は一緒に上昇し、黄体期に最高濃度に達する(202、 220-223)。感情記憶のエンコーディングは、卵胞期よりも黄体期の方が優れているようである(207)。循環ステロイドホルモンレベルの周期的な変動は、感情的刺激のエンコードと想起に影響を与え、したがって、心的外傷後ストレス障害(PTSD)症状の発現に役割を果たしている可能性が示唆されている(224、 225)。
げっ歯類では、思春期の発症は、CA1海馬錐体細胞の樹状突起上の発現α4βδGABAARsの増加に関連付けられている(226-228)。シナプスの剪定が思春期の間にニューロステロイドの影響を受けることを示唆する証拠もある。最適な背骨密度は、思春期の間にα4βδGABAARsの発現と変調に部分的に依存している可能性があり、それは順番に成人期の最適な学習と記憶機能に必要と思われる(229)。発情周期は雌げっ歯類の記憶機能に影響を与える(230)。げっ歯類の発情期の朝に観察される空間学習と記憶障害は、CA1錐体細胞樹状突起上のα4βδGABAARの発現増加と関連している(230)。げっ歯類の妊娠中にCA3海馬亜領域のパルバルブミン含有介在ニューロンにおけるδ-GABAARの発現に可逆的な減少があり、この変化はアロプレグナノロンのレベルの増加と関連している(231)。δ-GABAARの発現の減少とアロプレグナノロンの増加は、強直阻害が維持されるように、妊娠中に互いにカウンターバランスをとるのに役立つかもしれない。この微妙なバランスの調節障害がγ周波数範囲の皮質活性を変化させ、皮質γ活性の薬物誘発変化を測定することで、薬理学的介入の効果を予測するための非侵襲的な客観的バイオマーカーとして機能することが示唆されている(231)。この種の非侵襲的な客観的バイオマーカーは、オープンラベル試験において非常に有用であることが証明される可能性がある。
記憶機能への影響とニューロステロイド投与のタイミングの関係
学習・記憶機能は、以下の3つのフェーズに分けられる。(1)獲得;(符号化);(2)統合;および(3)検索(想起)である。その結果、それらのユニークで時に複雑な作用機序に加えて、ニューロステロイドの投与のタイミングはまた、学習と記憶機能の異なる側面に敏感な特定のテストでのパフォーマンスに影響を与えることができる。例えば、プレグネノロン硫酸塩後の投与は、グルタミン酸神経伝達のこの肯定的なモジュレーターは、統合を容易にすることを示す、受動的な回避パラダイム上の齧歯類の改善された保持に関連付けられている(206)。プレグネノロン硫酸塩の全身投与は獲得を高める(31)が、訓練の30分前に側中隔にこの神経ステロイドの直接注入は獲得を妨害するように見えるが(185)。2つの研究の間のこの矛盾は、おそらく、海馬海綿体の相互作用とプレグネノロン硫酸塩によって誘発された興奮の増加および/または海綿体中隔内の興奮の減少の複雑さによって説明することができる(232)。
評価されている記憶機能の特定のタイプ
しかし、特定のタスクで評価されている記憶機能の特定のタイプについてはどうであろうか;これは神経ステロイドに対する行動反応の解釈にどのように影響を与えるかもしれないか?異なるタイプの記憶は、異なる脳領域の活性化を必要とする。活性化における脳領域の変化は、特定の神経精神疾患や神経学的障害にも関連している。注意力、集中力、意欲の問題は、新しい情報のエンコーディングを妨げ、その結果、記憶機能のテストでのパフォーマンスを妨げることがある(233)。海馬は学習と記憶機能のほとんどの側面に関与しているが、ある種の記憶は他の領域よりもこの脳領域の活性化に依存していないようである(234)。
意味記憶機能におけるニューロステロイドの役割は、世界について知っていることを口頭で表現する固有の能力を持つヒトにおいてのみ効果的に研究することができる(235)。人間はまた、エピソード記憶の時間的側面を見るテストで、非エピソディック戦略を使用することができる(236)。この区別は、ニューロステロイドの効果を解析するときに非常に重要であることができる。例えば、アロプレグナノロンの全身投与は、健康な成人女性における作業記憶や意味記憶機能には影響しないが、エピソード記憶には影響する(203)。統合失調症における意味記憶機能に対する神経ステロイドの効果は明らかにされていないが、PREGはアロプレグナノロンとPREGSに代謝され、この患者集団ではどちらも作業記憶機能を改善するようである(51、 52、 65、 237、 238)。パフォーマンスに対するこの効果がPREG、アロプレグナノロン、またはプレグネノロン硫酸塩単独で媒介されるか、または3つのニューロステロイドのすべての組み合わせを介して媒介されるかどうかは決定されていない。
恐怖を誘発する刺激の学習と記憶に対する神経ステロイドの効果は、男性と女性では異なるようである。ベースラインでアロプレグナノロンのレベルが低い男性では、末梢筋の床核(BNST)でアロプレグナノロンのレベルを増加させると、文脈的な凍結が促進される。対照的に、ベースライン時の脳内アロプレグナノロンレベルが高い女性のBNST内アロプレグナノロンレベルを低下させると、文脈的凍結の発現が促進される(239)。ニューロステロイドのベースラインレベルの性差による反応の違いに加えて、記憶機能の異なる側面は、異なる脳領域のリクルート、および海馬内の異なる小領域(例えば、背側海馬と腹側海馬)の活性化に依存する(240)。
協調運動の学習と記憶には小脳の活性化が関与しており、ここではプルキンエ細胞によって神経ステロイドがde novoに合成される(241-243)。最近、17β-エストラジオールが雄性ラットの小脳運動記憶形成にも役割を果たしている可能性が示唆されている(244)。また、動物実験では、肝不全による高アンモニア血症の被験者の小脳と大脳皮質において、グルタミン酸-一酸化窒素-環状GMP経路が障害されていることが示唆されている。この経路のアンモニア誘発性障害は、運動性能の最適化に部分的に依存するある種の手続き的タスクの性能低下に関与している。脳内の経路とサイクリックGMPレベルを回復させることで、学習能力が回復する。小脳機能と運動技能の獲得における神経ステロイドの役割は完全には解明されていない。GABA作動性ニューロステロイドのレベルの上昇は肝不全と関連しており、この患者集団に見られる高アンモニア血症に伴う運動協調や記憶障害の治療にプレグネノロン硫酸塩が臨床的に有益である可能性が示唆されている(245)。
ニューロステロイドは、薬理学的コネクトーム内のどこで、生体内の学習および記憶機能の異なるタイプを調節するために作用するのであろうか?当然のことながら、これらの異なるタイプの記憶に関与する脳領域へのアゴニストおよびアンタゴニストの直接注入は、学習および記憶機能を増強または抑制することができる。例えば、強力な感情を誘発する刺激や恐怖を誘発する刺激への暴露に関連した記憶の獲得と消滅に関するニューロステロイドアロプレグナノロンの効果は、それが扁桃体と海馬に注入されたときには状態に依存しないが、BNSTに注入されたときには状態に依存する(246)。扁桃体基底部のGABAA受容体の高濃度のために、この脳領域へのアロプレグナノロンなどのGABA作動性ニューロステロイドの注入は、雄性ラットにおける文脈的および聴覚的手がかり誘発性凍結反応の獲得および発現を妨害する(246)。
試験時の被験者の年齢と認知状態
ニューロステロイドは、学習および記憶機能における年齢および疾患状態依存性の障害に関与している(247-249)。高齢の被験者は、うつ病や加齢に伴う神経変性疾患など、記憶機能に影響を与える神経精神疾患を併存している可能性があるため(250)、記憶機能の加齢に伴う変化におけるニューロステロイドの役割を理解することで、このユニークな患者集団に適した潜在的な治療ターゲットに光を当てることができる。
アロプレグナノロンの脳内レベルの低さは、ADと診断されたヒト被験者と同様に、高齢ラットの記憶障害と関連している(67、 248)。さらに、ADを持つヒト被験者の死後の研究では、DHEAとPREGの脳レベルが上昇していることが明らかになっている(67)。ヒトにおける剖検研究では、アルツハイマー病患者の脳内テストステロンレベルが健常者に比べて低いことが示されており(251)、遊離テストステロンは臨床診断基準に基づいてADの可能性が高い危険因子として示唆されている(252)。しかし、低テストステロンは健常男性の認知障害に関与しているが、テストステロン補充療法は、低テストステロンの認知障害高齢男性の記憶機能を有意に改善するようには見えない(253)。今後の研究では生体内試験(in vivo)バイオマーカーがAD型認知症の診断の病態生理学的特異性を高めることが期待されているが、記憶機能におけるニューロステロイドの役割を調べたこれまでの研究のほとんどは、可能性のある/可能性のあるAD型認知症の診断に中核となる臨床基準を用いていることを指摘しておくことが重要である。ヒトを対象とした研究では、剖検時に最終的にADの確定診断基準を満たさない被験者を含めることが交絡因子となる可能性があるため、このような結果の解釈は妨げられている。
DHEAとDHEASの血漿中濃度の低下もADを持つヒトで報告されている(71)。DHEASのベースラインレベルが高いADの可能性がある臨床基準を満たしている患者は、レベルが低い患者よりも記憶課題で優れたパフォーマンスを発揮する可能性があり、対照的にコルチゾールの循環レベルが低い患者は血漿コルチゾールが高い患者よりも優れたパフォーマンスを発揮する可能性があることが示唆されている(68)。疾患の臨床的特徴に基づくADの可能性のある男性は、健康な高齢男性には見られない03時00分に有意な増加を特徴とするコルチゾールレベルの日内変化を示す。このコルチゾールレベルの上昇は、副腎皮質刺激ホルモンのレベルがわずかに低下しているにもかかわらず起こる(70)。DHEA、副腎皮質刺激ホルモン(ACTHおよびインターロイキン-6(IL-6)のレベルの増加は、ADと一致する臨床症状を持つと診断された女性では午前中に見られる(70)。コルチゾールレベルは異なる睡眠段階に重要である。
睡眠障害はADに関与しているが、前述のコルチゾールの日中の変化が睡眠と記憶の統合にどのように影響するかは完全には明らかではない。睡眠は記憶の統合に役割を果たしており、プレグネノロン硫酸塩やアロプレグナノロンなどのニューロステロイドは、睡眠の調節に関与している錐体突起核などの脳領域内の活動を調節することができる(248、 254、 255)。プレグネノロン硫酸塩などの神経ステロイドは、ADのげっ歯類モデルにおける睡眠障害および認知機能障害に関与している(247、256)。プレグネノロン硫酸塩の促進効果は、パラドキシカル(別名、急速な眼球運動;REM)睡眠の増加によって媒介されることが示唆されているが(257、258神経精神疾患や加齢性神経変性疾患を有する被験者の記憶機能に対するプレグネノロン硫酸塩の効果が、REM睡眠および/または非REM睡眠の増強によって媒介されるかどうかは、完全には解明されていない(259、260)。
高親和性シグマ-1(σ-1)受容体選択的PETトレーサー[18F]1-(3-フルオロプロピル)-4-[4-シアノフェノキシ)メチル]ピペリジン([18F]FPS)をラジオリガンドとして用いた陽電子放射断層撮影(PET)研究は、DHEAを含む神経ステロイドが生体内でσ-1受容体に結合することを示唆している(261)。σ-1受容体はNMDA媒介応答を調節する(262、 263)。σ-1受容体のアゴニストは、ミトコンドリアと関連した小胞体膜上で分子シャペロンとして作用し、ADのげっ歯類モデルにおいて神経保護を提供するようである(264)。
放射性物質[carbonyl-(11)C]WAY-100635を用いたPETスキャンは、プロゲステロンとDHEASが生体内試験(in vivo)でセロトニン1A(5-HT1A)受容体結合を調節することを示している(265、 266)。ADにおける破壊されたセロトニン神経伝達の証拠があるが(267)、この加齢に関連した神経変性疾患の進行におけるDHEASなどの神経ステロイドの役割は、完全に解明されていない。
内耳皮質回路や海馬回路の過活動もまた、ADや軽度認知障害(MCI)などの神経変性疾患の根底にあると考えられている(268-272)。初期のシナプス機能不全または内耳皮質とCA3海馬小領域内の抑制性介在ニューロンのレベルでの “シナプトパチー “は、AD神経病理(例えば、タウオパチー)の進行に役割を果たしているように見える錐体細胞の過活動につながる(271、 272)。この多動性は、GABA作動性抑制入力に対する錐体細胞の応答性の低下に一部起因している可能性がある(272)。他の研究では、ラットの加齢性MCIモデルにおけるGABA作動性介在ニューロンの消失が示唆されており、複数のメカニズムが役割を果たしている可能性、および/または相互作用して多動性に寄与している可能性が示唆されている(273、 274)。末期アルツハイマー病患者のヒト組織を用いた研究では、記憶機能に影響を及ぼす可能性のある受容体サブユニットの発現における海馬のサブ領域および層特異的な変化が明らかになっている(275)。例えば、学習と記憶機能に関与するα5サブユニットの発現は、CA1サブ領域の錐体層とオリエンスで増加している。さらに、鎮静に関与するα1サブユニットの発現は、CA3サブ領域のすべての層と歯状回の顆粒細胞層と海綿体で増加している。不安に関与しているα2サブユニットの発現の増加は、CA3亜領域のオリエンスと放射状回で見られた。α2の発現はCA1亜領域のオリエンスで増加しているが、錐体層では減少している。歯状回の顆粒層と分子層ではβ3サブユニットの発現が減少しているが、α3とβ1サブユニットの発現は変化していない。
アロプレグナノロンは早期ADに関与する多動性を減衰させるのに有用であろう(201、 276)。マウスモデルでは、アロプレグナノロンは神経新生を増加させ、アミロイド沈着を減少させ、学習および記憶テストのパフォーマンスを改善するようであり、再生治療薬として機能する可能性があることを示唆している(197、 277-279)。アロプレグナノロンの臨床試験が進行中である。他の研究では、作用機序の中にグルタミン酸神経伝達の低下を含むリルゾールの慢性治療が、げっ歯類モデルでのタウ症の広がりを減衰させることが示されている(280)。硫酸プレグレナノロンやその合成アナログであるヘミスコハク酸プレグレナノロンなど、グルタミン酸神経伝達をネガティブに調節する神経ステロイドが、ADや加齢性MCIの治療にも応用される可能性があるのではないであろうか。
TSPO発現のアップレギュレーションは、神経精神疾患や神経変性疾患に関与している(281-283)。酸化ストレスはヒトの脳における神経ステロイド生合成の誘導と関連しており(284抗不安作用も示すTSPOリガンド(N、N-ジアルキル-2-フェニルインドール-3-イルグリオキシルアミド)は、神経ステロイド合成の促進を介してグリア細胞の酸化ストレスとプロ炎症性酵素の減少を促進する(133)。ADなどの記憶障害を伴う神経変性疾患の進行におけるこの経路の役割は十分に解明されていない。しかしながら、オリゴデンドロサイトをβアミロイドで処理することによって酸化ストレスを増加させることは、DHEAの合成の増加と関連しており(284)、これはADの齧歯類モデルにおいてある程度の神経保護を提供している(285)。
ラジオリガンドは、生体内でのTSPO発現を測定するために使用されている。放射性標識トレーサーとして11C-PBR28を用いたPETスキャンは、TSPOへの結合が遅発性疾患の患者よりも早期発症アルツハイマー病患者において大きいことを示している。TSPOへの結合はまた、すべてのアルツハイマー病患者における灰白質体積と認知機能の測定値のパフォーマンスと逆相関している。早期発症患者は後期発症患者よりも11C-PBR28結合が大きい。さらに、TSPO 結合の増加は、これらの患者がピッツバーグ化合物 B PET スキャンと MRI スキャンの容積分析によって評価される海馬萎縮によって評価されるアミロイド病理学の増加を示しているにもかかわらず、年齢関連の MCI 患者では見られない (282)。これらのグループにおけるTSPO結合の最大の違いは、側頭皮質と頭頂皮質に見られる。
これらの所見は、加齢に伴う神経変性疾患における神経ステロイドの治療的利用の可能性をまとめて示唆している。ニューロステロイドのユニークな調節特性により、これらの患者集団に共存する不安や抑うつ、記憶障害を標的とした治療には特に適していると考えられる。
ストレスおよび不安障害に伴う記憶障害におけるニューロステロイドの役割
3つの大規模な主要神経ネットワーク(デフォルト・モード・ネットワーク、中央執行ネットワーク、サリエンス・ネットワーク)は、ヒトの脳内の認知処理に寄与し、中枢神経系の適応的な反応を促進するために共に機能する(286)。デフォルトモードネットワークは、エピソード記憶機能や自伝的記憶を含む自己関連認知活動において役割を果たしている。海馬、扁桃体、内側前頭前皮質を含むデフォルトモードネットワーク内の主要な機能ノードは、ADとてんかんに関与している(287、 288)。中央執行ネットワークの前頭頂部接続は、注意、作業記憶、および実行機能を制御する。
中枢幹部ネットワーク内の接続は統合失調症に関与している(289)。感情の変化や報酬刺激に対する反応は、前頭葉、前帯状皮質と扁桃体、腹側索野、視床が一緒に機能し、行動を誘導するために、内的刺激と外的刺激の中で最も関連性が高く報酬の高いものを分離するサリエンス・ネットワークの機能が損なわれていないかどうかに依存している。感覚ネットワーク内のより強い接続性は、不安の増加と関連している(290、 291)。サリエンスネットワークとデフォルトネットワークの病的活性化は、これら2つのネットワーク間の切り替えプロセスを妨げる可能性があり、これは気分と記憶機能に差動的な影響を与えるであろう。したがって、ニューロステロイドは、記憶処理の中心となるこれらの3つの主要な神経ネットワークを差異的に変調させることができる。
神経ステロイドは、不安、および特定の不安障害に関連する学習および記憶障害において役割を果たしている。急性心理社会的ストレス下にある被験者をDHEA(50mg/日)で治療すると、注意力は改善されるが、宣言的記憶機能も損なわれる(78)ことから、この用量では、ある認知領域における利点が別の領域における障害によって相殺される可能性があることが示唆されている。中心扁桃体におけるGABA作動性神経伝達のニューロステロイドによる調節は不安に関与しており(131)、アロプレグナノロンの不安に対する効果は、扁桃体内の活動の調節を介して部分的に媒介されているようであり、その結果、学習および記憶機能に関与する脳領域の神経活動に影響を与える(64、 192、 292)(図11、 12)12)。不安障害に伴う記憶障害における5αリダクターゼ阻害の役割は完全には解明されていないが、それにもかかわらず、5αリダクターゼ阻害によりアロプレグナノロンの血清レベルおよび脳レベルが上昇することが示唆されている。
図11
機能的MRIの研究では、PREGによる治療は、Shifted-attention Emotion Appraisal(SEAT)パラダイムによって測定されるように感情調節に関与する神経回路の活性化を高めることが示されている。SEATタスクは、屋内または屋外のシーンの画像に重畳中立、怒り、または恐怖表現を描いた画像の提示に応答して感情調節の複数の側面をプローブするように設計されている。16名の被験者がPREGで、15名がプラセボ(PBO)で治療された。被験者はMR対応のゴーグルを通して刺激を見て、MRI対応のボタンボックスを使って反応した。各条件における脳活性化のマップは以下のことを示した。A)扁桃体[モントリオール研究所(MNI)冠状(y)平面座標= 2]と右島皮質[MNI軸方向(z)平面座標= -6]での薬物の有意な(p < 0.05)主効果があったように、PREGとの治療は、すべての条件と顔の種類にわたって、これらの2つの領域での活動を減少させた。B)PREGを用いた治療は、評価時に背内側前頭前野皮質(dmPFC)[MNI矢状(x)平面座標=0]の活性化を増加させた。(C) PREG治療はまた、評価時にdmPFCと左扁桃体の機能的結合を有意に増加させた(p < 0.001)。自己申告した不安は、PREG群のdmPFCと扁桃体の機能的接続性と逆相関(r = -0.52、 p = 0.046)していた。信号変化率は各図の横に表示されている[許可を得てSripadaら(192)から改変]。

図12
女性被験者を対象としたイベント関連fMRI研究で、プロゲステロンが顔の記憶の符号化と検索に関与する脳領域に及ぼす影響を示した。被験者間の脳の異なる領域の神経活動と記憶能力との関係についての連関分析の結果。(A) 顔の記憶のエンコーディング中、プロゲステロン投与は右扁桃体(MNI冠状(y)平面座標=-12; p < 0.001、 未補正)および房状回(MNI冠状(y)平面座標=-52)の活動の低下と関連しており、これは被験者全体の記憶性能の低下を予測していた。B)各有意な接続クラスタ内の平均活性のパラメータ推定値(SH = 後続ヒット、SM = 後続ミス、AU = 任意の単位、平均 ± SEM)。C)プロゲステロン誘発性扁桃腺活動の減少は、被験者全体の記憶性能の低下を予測した[認識記憶精度=d′]。(D-F) 右房状回における主効果と記憶性能の有意な連動についての同一図。プロゲステロンは、房状回および下前頭前野の活動を低下させ、顔の記憶の検索時のパフォーマンスを損なう。G)記憶の主効果(すなわち、ヒット>ミス)と薬物の主効果(すなわち、プラセボ(顔>ヌル事象)>プロゲステロン(顔>ヌル事象))の右房状回における有意な連関[MNI冠状(y)平面座標= -56; p < 0.001、無補正]。H)接続クラスターのパラメータ推定値(任意の単位;平均±SEM)。(I)プロゲステロン誘発性の筋状回活動の低下は、被験者全体の記憶性能の低下を予測した[認識記憶精度(d′)]。J-L)左下前頭前野回[MNI冠状(y)平面座標= 26]の主な効果の有意な結合のための同一図。H、ヒット; M、ミス; A.U.、任意の単位。H、ヒット; M、ミス; a.u.、任意の単位[許可を得てファンウインゲンら(64)から修正]。
拡張扁桃体とも呼ばれるBNSTは、海馬からの入力を受け、視床の傍室核との相互投影を共有する(246、293-296)。この脳領域は、恐怖を誘発する刺激に対する視床下部-下垂体-副腎軸(HPA軸)の適応反応に役割を果たしている(239、 246、 296)。恐怖を誘発する刺激に関連した海馬依存性記憶の獲得および消滅に対するアロプレグナノロンの効果は、BNSTへのこのニューロステロイドの直接注入後、状態依存性であるように思われる。条件付けやテスト中のBNSTへのアロプレグナノロンの直接注射は文脈的恐怖を抑制したが、この効果は両方の手順でBNSTにニューロステロイドを注射したときには見られなかった(246)。
選択的セロトニン再取り込み阻害薬(SSRI)は、ヒトおよび動物においてアロプレグナノロンの脳レベルを上昇させ、SSRIの抗不安作用が、この内因性GABA作動性調節薬の中枢神経系レベルへの作用に一部関連している可能性を示唆している(93、 297-301)。不安障害の患者はしばしばエタノールで自傷行為を行う。エタノールへの急性曝露もまた、アロプレグナノロンの脳レベルを上昇させる(302)。対照的に、ラットモデルの前臨床研究では、エタノールへの慢性的な断続的曝露が海馬におけるアロプレグナノロンレベルの低下と関連していることが示唆されている。タンパク質レベルは報告されていないが、この研究では、5αリダクターゼと3α-HSDのmRNAレベルがラットの海馬で減少していることが指摘されている。神経ステロイド産生(304)やステロイド代謝を標的とすることは、共存する不安障害やアルコール使用障害を呈する患者の治療に有効な戦略となりうるだろうか?
健常者や大うつ病患者と比較すると、全般性不安障害(GAD)の高齢患者は短期記憶機能のテストでより多くの障害を示す(305)。GADの重症度は、高齢者の唾液中のコルチゾールレベルと正の相関があることがわかっている(73)。高齢者の唾液中コルチゾール濃度の上昇は、記憶機能テストのパフォーマンス低下と関連している(306)。GADおよびSSRIによるベースラインのコルチゾール上昇を呈する高齢者の治療は、不安の減少と相関する唾液コルチゾールの減少と関連している(307)。SSRIはアロプレグナノロンのレベルを増加させる(299)。ADは非認知的な行動や心理的症状と関連しており、その中には被害妄想や不安などが含まれることがある。
コルチゾールは、曝露ベースの集団療法を受けた小集団(男性と女性)で治療成績を向上させるようである(310)。さらに、クモ恐怖症の女性患者では、内因性エストラジオールの高値と低値のエストラジオールが、曝露療法の治療成績の向上と相関している(311)。ヒト被験者の頭蓋内脳波を用いた神経ネットワーク活動の研究は、扁桃体と海馬の間のβ周波数コヒーレンス(13-30Hz)が気分の変化をコードしていることを示している(312)。ストレスは思春期初期の気分と認知の変化を媒介し、成人期の精神病理の発現に役割を果たしている可能性がある。ストレスの間、コルチコトロピン放出ホルモンは副腎皮質刺激ホルモンの放出の増加を促進する。これは、ステロイド原性急性調節タンパク質の活性化を介して、副腎皮質細胞の内側ミトコンドリア膜のコレステロール濃度の上昇を促進する。コレステロールはその後、PREGとそのステロイド代謝物(PREGS、コルチゾール、コルチコステロン、DHEA、およびアロプレグナノロンを含む)に変換される(77、87、313、314)。
DHEAおよびDHEASは、女性および男性のワーキングメモリ機能に対するコルチゾール増加の負の効果をそれぞれ打ち消すようである(315、316)。DHEASに対する用量依存的な逆U字型の反応が、男性マウスの学習および記憶機能の試験で観察されている(30)。対照的に、DHEAはより広い範囲の用量で有効であり、治療薬としてより良い選択であることを示唆している(30)。DHEASと認知機能との間の正の相関は女性と男性で観察されているが、ヒトにおける学習および記憶機能に対するDHEAおよびDHEASの効果が性、用量、および病状に依存するかどうかを決定するためには、より多くの研究が必要である(30、 317、 318)。
ストレスに対する反応は、一部では循環するステロイドホルモンの影響を受けているようである。ストレスは雄ラットの海馬における連想学習と樹状突起棘密度を増加させるが、雌ラットでは連想学習が損なわれ、棘密度が減少する(319)。不安障害の発達に対する神経ステロイドの潜在的な影響は、生殖ホルモンのレベルの増加だけでなく、GAD、社会不安、パニック発作を含む多くの精神疾患の発症にも関連している思春期に観察することができる(320-326)。不安症状は思春期中期から後期にかけて増加することがわかっており(323)、特に思春期の女児の間で報告されたすべての不安障害の有病率が高い(324、 327、 328)。このような状況で特に関心があるのは、ストレスに反応して脳内でも産生される生殖ホルモンであるプロゲステロンの代謝物である神経ステロイドのアロプレグナノロン(ヒトおよびラット)とプレグネガノロン(ヒトのみ)である(79、 329)。
動物研究では、アロプレグナノロンへの発育期の曝露が、成人期の抗不安薬に対するその後の反応性に影響を与えることが示唆されている(206、330-332)。急性ストレスは血漿中アロプレグナノロンレベルの上昇と関連しており、これは末梢性ベンゾジアゼピン受容体としても知られるTSPOの発現量の増加と相関している。TSPOはステロイド生成に役割を果たすため、不安障害の治療標的として考えられていた(77、 333)。興味深いことに、PTSDなどの慢性ストレス障害を持つ女性の脳脊髄液において、アロプレグナノロンレベルが対照と比較して低下していることが明らかになっている(75)。このグループによるその後の研究では、男性における総GABA作動性ニューロステロイドレベル(アロプレグナノロン+プレグネサノロン)の脳脊髄液レベルとPTSD症状との間に負の相関が観察された(76)。この研究では、PTSDと男性におけるアロプレグナノロンの5αリダクターゼ媒介生合成の減少との関連も発見されており、これは、PTSDの女性で以前に観察された3α-HSDでのブロックとは対照的である。他の研究では、パニック障害と診断された人に乳酸ナトリウムと胆汁毒素テトラペプチドを投与すると、プレグネノロンとアロプレグナノロンの両方の血漿中濃度が低下し、機能的拮抗異性体である3β、5α-テトラヒドロプロゲステロンの濃度が上昇することが明らかになっている(334)。これらの知見は、急性ストレスと慢性ストレスの両方が、男性と女性のアロプレグナノロンレベルに独特の影響を与えることを示唆している。閉経後の女性を対象とした研究では、短期記憶機能のテストでは何の有益性も示されなかったが、それにもかかわらず、このニューロステロイドを補充することは、加齢に関連した記憶障害を持つ特定の集団の記憶機能に有益な効果があるかもしれないことが示唆されている(335、 336)。
妊娠キセノバイオティクス受容体(PXR)とエンドカンナビノイド系によって媒介されるステロイド生成の調節を介して変化した内因性ニューロステロイドレベルの回復は、ニューロステロイドの直接投与に代わるものとして提案されている(89、 178、 337)。PREGはすべてのステロイドホルモンの前駆体であるため、ストレス時のコルチゾール合成の促進が他のステロイドホルモンの合成を減衰させる可能性があることはもっともらしいと思われるが、この示唆は立証されていない。
これらの所見は、年齢、性別、ストレス、およびSSRIの投与に関連した神経ステロイドの内因性脳レベルの変化が、特定の不安障害における薬理学的介入の発症および臨床反応において重要な役割を果たしている可能性を示唆している。この仮説を支持する知見は、アロプレグナノロンのゴナドトロフィン放出ホルモン(GnRH)に対する効果に関するものであり、思春期の発症と性的成熟に関与する主要な化学伝達物質である(338)。中心性思春期早発症はアロプレグナノロンと関連しており、GABAARのアロステリックな調節を介して視床下部のGnRHの放出を抑制することが明らかになっている(339、 340)。GnRH放出の抑制は思春期前および成人期にアロプレグナノロン投与によって増加するが、思春期には逆説的に減少する(212)。
思春期におけるGnRH放出の減少は、海馬領域CA1の錐体細胞の興奮性の増加にも関連している。この効果は、思春期の間に海馬のCA1領域で通常よりも高いレベルで発現しているα4含有GABAARの阻害に部分的に起因しているようである。γサブユニットの代わりにδサブユニットを持つα4β2δサブタイプのGABAARは、歯状回や大脳皮質などの領域で強直抑制の役割を果たしている(341)。GABAAR介在性コンダクタンスは通常抑制性であるが、歯状回顆粒細胞におけるGABAAR介在性シナプス後電流の反転電位は安静時の膜電位に対して「正」であり、この領域ではGABAARの膜過分極化は考えにくい。シャントの阻害はこのプロセスを克服する役割を果たしているようで、そのような非過分極化抑制性コンダクタンスは、近位膜抵抗を減少させることによってシナプス後電位の脱分極効果を減少させる(342)。歯状回および大脳皮質では、GABA作動性電流は内向き(すなわち、塩化物フラックスは外向き)であり(342、343したがって、これらの領域での抑制はアロプレグナノロンによって増強される。しかし、CA1海馬亜領域では電流は通常外向きであり(344したがってα4β2δ GABA受容体の発現の増加は逆説的にアロプレグナノロンが抑制を増強するのではなく、むしろ減衰させる結果となる。α4β2δGABAARにおけるアロプレグナノロンによって生成される電流の減少は、α4の細胞内ループにおけるアルギニン353の存在に依存しており、ここでは塩化物調節部位として機能する可能性がある(345)。アロプレグナノロンによって媒介されるこの極性依存的な抑制の減少は、不安障害に伴う記憶障害へのアプローチ方法に重要な意味を持ち、α4β2δサブタイプのGABAARの発現および/または活性を標的とした治療戦略に適合することが証明されるかもしれない(346)。
うつ病に関連した記憶障害における神経ステロイドの役割
ニューロステロイドレベルの変化は、うつ病の発症やうつ病の治療に用いられる薬物の作用に関与している。アロプレグナノロンの合成アナログを用いた動物実験では、神経ステロイドレベルの変動がドーパミン経路の調節を通じて学習意欲にも影響を与えることが示唆されている(347)。女性の気分に対するアロプレグナノロンの効果は逆U字カーブを描いているようである(214)。SSRI治療はアロプレグナノロンの脳レベルの上昇と関連しており、この患者集団におけるSSRIの記憶増強効果が、このニューロステロイドの作用に一部関連している可能性が示唆されている(93、 297、 348、 349)。前臨床動物研究では、DHEAによるGABA作動性神経伝達の調節が、うつ病に関連した記憶障害の治療にも可能性があることが示唆されている(350)。
GABA作動性神経伝達の陽性アロステリックモジュレーターであるアロプレグナノロンが、この患者集団の記憶機能を改善するためにどのように作用するかは完全には明らかではないが、GABA受容体発現レベルのストレス誘発性変化がうつ病の病因に役割を果たしている可能性が示唆されている。この仮説は、早期の人生における外傷性ストレスが、成人ラットの脳における慢性的な不安、空間記憶障害、GABAARサブユニットの発現低下と関連していることを示す前臨床研究によって支持されている(351)。
PREGとその代謝物は、うつ病性障害の治療に有効である可能性が示唆されている。うつ病の治療にはいくつかの課題があり、これは双極性障害(BPD)におけるうつ病の治療において特に当てはまる。Brownら(352)が実施した研究では、BPDと抑うつ気分状態を有する成人80人を対象に、12週間のアドオン療法としてPREGまたはプラセボを投与した。アウトカム指標には、17項目のハミルトンうつ病尺度、ハミルトン不安評価尺度(HRSAヤングマニア評価尺度が含まれていた。ベースライン時と治療終了時(12週目)の血清ニューロステロイド濃度の評価により、PREG治療群ではニューロステロイドのベースラインから出口までの大きな変化が認められた。PREG群では、プラセボ群とは異なり、HRSAの変化はアロプレグナノロンおよびPREGレベルと負の相関を示し、不安の減少を示した。被験者はリチウム、抗うつ薬(不特定鎮静催眠薬・抗不安薬(不特定抗精神病薬(不特定覚せい剤(不特定)を含む多種多様な薬物を服用しており、うつ病のために服用している薬物に基づいて層別化されていなかったため、この小規模な研究の結果は注意して解釈されるべきである。
統合失調症に伴う記憶障害におけるニューロステロイドの役割
統合失調症に関連する認知障害は複数の要因によって引き起こされており、その原因となっている認知要素の一部を解明することは、記憶を理解し、治療法を発見するための基礎となるだろう。神経回路に基づく研究では、GABA作動性介在ニューロン(パルバルブミン、SOM/NPY/CCK/発現介在ニューロン)に影響を及ぼす大脳皮質の抑制が統合失調症の重要な因子であることが明らかになっている。GAD67欠損はGABAAR発現の変化、特にα2サブユニットの変化とともに知られている(353-356)。NMDARの機能低下、特に抑制性パルバルブミン(PV)介在ニューロンにおけるNMDARの機能低下(357)は、錐体ニューロンの抑制機能の低下につながり、疾患の進行を開始させる可能性がある。抑制性介在ニューロンにおけるNMDARの機能低下は、観察されているGABA作動性障害に関与している(358-364)。動的不均衡や回路の制御異常を引き起こす特定の経路がどのようなものであれ、結果として下流の錐体ニューロンの過活動が最終的には神経ネットワーク活動の制御異常、興奮毒性、そして最終的には神経細胞の直接的な損失につながるのである。また、錐体ニューロン自体に発現するNMDARの機能低下も考えられることに留意されたい(365)。睡眠中の神経ネットワーク活動の障害(睡眠紡錘体活動の低下を含む)は、統合失調症における睡眠依存性記憶の定着障害と関連している(260)。
PV介在ニューロンの同期的な活動は、認知課題の遂行中に観察されるガンマ振動を発生させる。認知障害は、皮質PV介在ニューロンへの興奮性駆動力の低下(366、 367)とそれに伴うネットワークの非同期性(368、 369)により、これらのガンマ域の高周波数振動の障害から生じると考えられている。α5型GABAARやナトリウムチャネルなどの様々な受容体の操作は認知を高めることが示されている(356)。統合失調症のグルタミン酸仮説は、神経精神疾患におけるNMDARの重要性を強調している。NMDARはガンマ振動の発生に重要であり、機能不全のNMDARは精神病や特定の認知領域の欠損をもたらす。NMDARを欠損した遺伝子組み換えマウスでは、習慣化、作業記憶、連想学習に欠損が見られる(370)。
したがって、NMDARの機能を強化することは、健常者や神経精神疾患を持つ人の認知力を向上させるために不可欠である(111)。しかし、これまでのところ、NMDARの神経伝達を強化する試みは成功していない(371)。現在利用可能なNMDAR陽性アロステリックモジュレーターの最近のメタアナリシスでは、認知障害の緩和には効果がないことが明らかになっている(371)。NMDAR活性化における臨界バランスを維持することは、NMDAR刺激の負の結果を回避するために最適であり、プレグネノロン硫酸塩、DHEASおよびそれらのアナログを非常に適した候補としている。サブユニット選択的なモジュレーションは、過剰刺激なしに受容体機能を増強する能力と相まって、プレグネノロン硫酸塩はNMDARのポジティブモジュレーターとして非常に適している可能性が高い(111、 371)。
PREGとアロプレグナノロンは、統合失調症に伴う記憶障害を治療するための潜在的な治療法として研究されている(50、 65、 238)。クロザピンまたはオランザピンの急性投与は、アロプレグナノロンおよびPREGSの前駆体であるPREGの脳および血漿中濃度を上昇させる(372)。副腎摘出術はクロザピンによる海馬PREGの増加を防ぐ。対照的に、ラット海馬におけるPREGレベルの有意な増加は、アリピプラゾール、クエチアピン、またはジプラシドンの急性投与後には観察されない。このことは、記憶機能に対する第二世代抗精神病薬の効果が、PREGおよび/またはPREGSの脳内レベルの上昇に一部起因している可能性を示唆している(28、 48、 51、 62、 373)。
我々は以前に、低ピコモル濃度のプレグネノロン硫酸塩が[Ca2+]iおよびCREBリン酸化を増加させるのに十分であることを実証した(48)。スルホトランスフェラーゼ4A1ハプロタイプ1(SULT4A1-1)陽性の被験者が、SULT4A1-1陰性の被験者よりもオランザピンに対してより良い反応を示すという証拠がいくつかある。しかし、このスルホトランスフェラーゼアイソザイムが、第二世代抗精神病薬で治療された統合失調症患者におけるPREGからのプレグネノロン硫酸塩の形成および学習・記憶障害の改善に果たす正確な役割は、まだ確立されていない(374)。また、GABA作動性神経伝達のアロプレグナノロンによる調節は、齧歯類モデルにおけるクロザピンやオランザピンの抗精神病薬効果にも関与していると考えられている(375-377)。
複数の臨床研究および前臨床研究では、ニューロステロイド、PREG、PREGS、DHEAの記憶および他の認知属性への影響が検討されている。認知障害は統合失調症の中核的特徴である(378)。統合失調症患者を対象とした最近の臨床試験では、追加療法としてPREGを投与することで認知障害が緩和されることが示唆されている(50)。PREGを投与されている患者では、その即時代謝物であるプレグネノロン硫酸塩(NMDARsの陽性調節因子)とアロプレグナノロン(GABAARsの陽性調節因子)の血漿レベルが上昇しており、学習と記憶機能の改善におけるプレグネノロン硫酸塩の役割の可能性が示唆されている(50)。先行研究(28)では、プレグネノロン硫酸塩の認知機能向上効果も報告されている(29)。
神経ステロイド、ドーパミンノックアウトマウスモデルと統合失調症
ドーパミン(DA)は神経調節因子であり、統合失調症、注意欠陥多動性障害、うつ病(379-381)など、認知障害が特徴的ないくつかの神経障害のキープレイヤーである。ドパミントランスポーター(DAT)は、細胞外DAの再取り込みを仲介し、DA受容体の活性化を終了させる。DATは、神経伝達物質トランスポーターのNa+/Cl–依存性ファミリーの一員である(382)ため、統合失調症やその他の疾患の主要な治療標的となっている(383-385)。DATの発現や機能の変化、あるいはDAT遺伝子の変異を利用したいくつかのトランスジェニックモデルが作成されている(386)。これらのモデルは、神経精神疾患の神経伝達物質および神経調節因子の機能(または機序的基盤)を解明する上で極めて重要であることが証明されている(381、 387)。
Wongら(373)は、統合失調症に特徴的な症状を示すDATノックアウト(DAT KO)マウスモデルを用いて、プレグネノロン硫酸塩治療が学習および記憶機能に及ぼす影響を調べている。その結果、BBBを越えることができるプレグネノロン硫酸塩を全身投与することで、DAT KOマウスの陽性・陰性症状が緩和されるとともに、認知機能の障害も軽減された。プレグネノロン硫酸塩の長期全身投与により、DAT KOマウスの障害されたエピソード記憶と識別能力の低下が、副作用なしに回復した。認知障害の観察された減少と一致して、長期的なプレグネノロン硫酸塩の治療は、海馬の義務的なNMDARサブユニットGluN1の発現を増加させる。これまでに、我々の研究室では、NMDARサブユニットの発現増加に関与するメカニズムのいくつかを特徴づけ、プレグネノロン硫酸塩が非カノニカルGPCRおよびCa2+依存的な方法で組換えNMDARサブユニットを発現する卵母細胞の表面GluN1を増加させることを実証していた(47)(図2)。
潜在的な認知機能強化剤としての合成ニューロステロイド
ここで検討された知見は、統合失調症、うつ病、不安障害の患者に見られる記憶障害が、内因性ニューロステロイドレベルの変化に影響されていることを示唆している。全身に投与される内因性ニューロステロイドのすべてが容易にBBBを通過するわけではなく、また、これらの化合物は異なる作用機序でホルモン活性ステロイドに代謝されるため、これらの化合物の治療の可能性は限られている。このため、代謝に対してより耐性があり、BBBを横断することができる神経ステロイドの合成アナログが、抗不安薬、抗うつ薬、認知増強剤、麻酔薬、および抗痙攣薬としての使用のために研究されている(132、 388、 389)。例えば、ヘミスコハク酸基を有する合成神経活性ステロイドは、対応する硫酸エステルよりも加水分解に対して耐性があり、生理的なpHで部分的に結合し、BBBを横切ってより多くの通過を可能にする。そのような合成神経活性ステロイドの1つであるヘミスコハク酸プレグノロンは、マウスやラットで鎮静と神経保護を生成する(132)。Weaverら(132)は、海馬ニューロンの一次培養において、プレグレナノロンヘミスコハク酸(PAHS)がNMDA誘導電流および細胞死を阻害することを実証した。さらに、局所脳虚血後のラットへのPAHSの非鎮静化用量の投与は、皮質および皮質下の梗塞サイズを減少させる(図13)。
図13
プレグノロンヘミスコハク酸塩(3α5βHS)は生体内試験(in vivo)脳卒中モデルにおける神経保護作用を有する。ラットにビヒクルまたは3α5βHS(6.9mg/kg/h、負荷量6.9mg/kg)を、内側脳動脈閉塞開始直後または30分後に投与した。3α5βHSの注入は、ラットを安楽死させ、その脳を収穫し、2、3、5-トリフェニルテトラゾリウムClで染色した時点で、追加の22時間継続した。A)虚血の開始直後に車両または3α5βHS注入を受けた動物からの代表的な冠状切片。梗塞部は青白く見える。B)虚血発症直後に3α5βHSを投与すると、皮質梗塞の体積は206±22から110±21mm3に有意に減少し(P<0.005皮質下梗塞は103±6から76±6mm3に減少した(※P<0.005)(ビヒクル、n=9、3α5βHS、n=10)。C)虚血発症後30分後に3α5βHSを投与した場合、皮質梗塞の体積は173±15から106±15mm3(*P<0.005;n=13)に減少したが、皮質下領域では明らかな減少は見られなかった[Weaverら(132)より許可を得て]。
アロプレグナノロンの経口生物学的に利用可能な合成アナログであるガナキソロン(3-ヒドロキシ-3-メチル-5-プレグナン-20-オン)は、GABAARの陽性アルロステリックモジュレーターであり、PTSDの潜在的な新規治療法としての基礎的および初期段階の臨床結果が有望である(388、390-392)。ガナキソロンの作用機序および前臨床動物モデルでの研究に基づき、アンヘルマン症候群の動物モデルにおける空間記憶機能の改善が示唆されている(393)ことから、不安障害におけるこの薬物の臨床的価値を検討する将来の調査が必要であると考えられる。アロプレグナノロンのもう一つの合成アナログである3β-エテニル-3α-ヒドロキシ-5α-プレグナン-20-オン(Co 3-0593)は、げっ歯類の皮下投与および経口投与の両方でベンゾジアゼピン系薬剤に匹敵する抗不安作用を示すことがわかっている。この合成神経活性ステロイドに対する耐性がないことは、慢性的な投与で効果が維持されたという観察から示唆されている(394)。
プレグネノロン硫酸塩 の機能への現在の研究は、選択的/特異的なアンタゴニストの欠如と検証された結合部位(s)の知識の欠如によって妨げられている。これらの欠点は、本質的な3-ヒドロキシ硫酸のスルファターゼによる加水分解に対する感受性によってさらに悪化している。これらの限界を克服するために、我々や他の研究者はプレグネノロン硫酸塩アナログを用いて、学習や記憶機能に対するプレグネノロン硫酸塩媒介の効果のメカニズムを解読している。私たちは最近、低ナノモル濃度のプレグネノロン硫酸塩が、細胞内([Ca2+]i)依存性のメカニズムを介して、NMDAに対する神経細胞の応答とNMDARの細胞表面へのトラフィッキングを遅発的に増加させることを報告した(47) (図2)。さらに、我々は、低ピコモルプレグネノロン硫酸塩が[Ca2+]iとCREBのリン酸化と自発的な興奮性シナプス後電流の頻度を増加させることを実証した(48)(図8、 、9).9)。プレグネノロン硫酸塩の合成アナログであるPREGヘミスコハク酸塩が、PREGSの全身投与に関連する制限を克服する可能性があるかどうかを判断するためには、さらなる研究が必要である。
結論
神経精神疾患や神経疾患における記憶機能におけるニューロステロイドの効果は、特にGABAやグルタミン酸受容体などを構成する特定のサブユニットのアミノドメインや膜貫通ドメインに選択的に結合することで発揮される調節相互作用を反映している。ニューロステロイドの内因性レベルの年齢および疾患状態依存性の変化は、特定の神経精神疾患およびそれに関連する記憶障害に関与する独特の機能的不均衡の出現に役割を果たしているように思われる。これらの知見を、記憶の符号化と想起に関与する様々な神経ネットワークと神経ステロイドの相互作用を反映した薬理学的コネクトームの観点から考えることは有用であろう。神経回路の枠組みは、記憶障害の神経治療薬としてのニューロステロイドとその合成アナログの潜在的な役割についての将来の研究の指針になると考えている(図14)。

図14
ニューロステロイドによる記憶機能の調節に関与する薬理学的接続経路。海馬への投射および/または海馬との相互接続を共有する神経ネットワークは、神経伝達物質と同様に神経ステロイドによって調節される。その結果、学習および記憶障害は、神経ステロイドが関与している神経学的および神経精神疾患の多くに関連している。不安障害に関与する扁桃体(赤で示されている)は、海馬(緑で示されている)と相互に接続を共有している。アロプレグナノロンに代謝されるプロゲステロンは、扁桃体の活動に影響を与えることで感情記憶機能を調節する(64)。恐怖を誘発する刺激に対する学習および記憶に対する神経活性ステロイドの効果は、ベースラインでもアロプレグナノロンの脳レベルが異なる男性と女性では異なるようである(395)。抑制性神経伝達を増強するアロプレグナノロンなどの神経活性ステロイドは、感覚ネットワークと扁桃体のネットワーク内接続性を減少させることで、不安からの症状緩和をもたらす可能性がある(75、 192、 290、 291)。アロプレグナノロンは、複雑な社会的・非社会的刺激の処理に関与する扁桃体と前頭前野(青色で示されている)間の機能的接続性の増加を誘導する。しかし、アロプレグナノロンの高レベル化に伴う抑制の増加は、海馬と楔前野(図示せず)の間の無傷の機能的接続性に依存するエピソード記憶機能を妨げる可能性もある(203)。興味深いことに、アロプレグナノロンに代謝されるPREGとNMDARの陽性モジュレーターであるプレグネノロン硫酸塩の両方が、前頭前野のPV介在ニューロン上の興奮性NMDARの機能低下による皮質の抑制が関与している統合失調症患者において、作業記憶機能を改善することが示唆されている(51、 52、 65、 237、 238)。三シナプス回路を含む傍海馬と海馬の構造は、それぞれ視床(オレンジ色で示されている)と扁桃体を介して感覚モダリティからの感覚入力と感情入力を受け取る(396-398)。強力な感情喚起刺激の影響は、アロプレグナノロンを扁桃体と海馬に注入した場合には状態に依存しないが、BNSTに注入した場合には状態に依存する(灰色で示されている) (246)。海馬三シナプス回路のニューロステロイドに対する応答は、ニューロステロイド生合成と受容体発現の疾患状態依存性の変化にも依存する(399-401)が、ステロイドホルモンレベルの加齢に関連した変化は、内因性および外因性のニューロステロイドおよびその合成アナログに対するこの回路の応答性に影響を与えるように収束する(229、 401-403)。
用語集
略語
ACTH 副腎皮質刺激ホルモン
AD アルツハイマー病
アロプレグナノロン アロプレグナノロン
AMPA α-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸
ANT アデニンヌクレオチドトランスポータータンパク質
BBB血液脳関門
脊髄条床核
CB1カンナビノイドレセプター1
CICR Ca2+誘導Ca2+放出
中枢神経系
DAドーパミン
DATドーパミントランスポーター
DAT KO ドーパミントランスポーターノックアウト
DHEAデヒドロエピアンドロステロン
DHEASデヒドロエピアンドロステロン硫酸塩
GABAγ-アミノ酪酸
GAD全般性不安障害
GLIC グロエバクターのリガンドゲートイオンチャネル
GnRH ゴナドトロフィン放出ホルモン
HPA軸視床下部-下垂体-副腎軸
HRSAハミルトン不安評価尺度
IL-6インターロイキン-6
L型VGCC L型電圧ゲーテッドCa2+チャネル
LTD 長期うつ病
LTP長期増強
エムシーアイ
NMDA N-メチル-D-アスパラギン酸
OATPs 有機陰イオン輸送ペプチド
ORAI1 Ca2+再放出活性化Ca2+チャネルタンパク質1
PAHSプレグレナノロンヘミスコハク酸塩
pCREBリン酸化CREB
PETポジトロン断層撮影
PCOS 多嚢胞性卵巣症候群
プレグプレグネノロン
プレグネノロン硫酸塩 プレグネノロン硫酸塩
心的外傷後ストレス障害
PVパルバルブミン
PXRプレグナン異生物学的受容体
P450 scc シトクロムP450側鎖切断
sEPSC 自然興奮性シナプス後電流
5-HTセロトニン
SSRI選択的セロトニン再取り込み阻害薬
StARタンパク質 ステロイド原性急性調節タンパク質
STIM1 間質相互作用分子1
THDOC テトラヒドロデオキシコルチコステロン
チロトロピン放出ホルモンTRH
TRPチャネル 一過性受容体電位チャネル
TSPOトランスロケータータンパク質
VDAC 電圧依存性アニオンチャネル。

