Contents
Molecular mechanisms involved in the positive effects of physical activity on coping with COVID-19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7471545/
要旨
目的
身体活動(身体活動)は、代謝性疾患や感染症などの炎症状態の増加を特徴とする疾患に対する最初の防御線となる。逆に、肥満、2型糖尿病、心血管疾患と関連した座りっぱなしのライフスタイルは、感染症への感受性を含む一般的な健康状態に悪影響を与える。SARS-CoV2感染が大パンデミックしている時期に、多臓器クロストーク(すべての臓器やシステムの病態生理に関与するメカニズムとして広く受け入れられている)の文脈の中で、我々は、免疫系を含む骨格筋収縮が媒介する複雑な相互作用を調べ、これが健康状態を制御し、ウイルス感染に対抗するためにどのように貢献しているかを検討する。本研究では、骨格筋収縮を介した免疫系の複雑な相互作用が、健康状態のコントロールやウイルス感染症対策にどのように寄与しているのかを明らかにするとともに、骨格筋収縮によって制御される分子の分子機構や発現を検討する。
研究方法
本研究では、SARS-CoV2などのウイルス感染症に影響を与える可能性のある身体活動の分子機構やメディエーターを明らかにするために、文献の批判的レビューを行った。
結果
我々は、骨格筋、免疫系、脂肪組織間のクロストークが関与する生物学的プロセスの制御を通じて、ウイルスの悪影響に対する中等度の定期的な身体活動の媒介効果を示した。また、炎症マーカーの発現を調節することによって媒介される効果の証拠が提供された。
結論
身体活動と炎症状態の低下との間には密接な関係があり、SARS-CoV2感染症の効果的な対策が可能になる。そのためには、活動的な生活を続けるように説得することが必要である。
キーワード
身体活動、炎症、サイトカイン、COVID-19,健康的な生活習慣、代謝障害、免疫系
序論
2020年1月以降、新型重症急性呼吸器症候群コロナウイルス(SARS-CoV2)のパンデミック波がほぼすべての国を襲っている。2020年7月27日に更新されたデータでは、コロナウイルス疾患2019(COVID-19)について、全世界で16,481,022例、653,296人の死亡が報告されている(https://www.worldometers.info/coronavirus/)。COVID-19は感染率が高く、現在のところ特定のワクチンがないため、第二波の可能性を排除できない。
ウイルスの拡散を防止し、制限するために、ほとんどすべての国の保健モニタリング部門は、社会的距離を置くこと、頻繁な手洗い、フェイスマスクの使用、旅行の制限、身体活動やレクリエーション活動の停止などを含む「ロックダウン」政策を採用している。さらに、非常に高い再生産数(R>2)の場合には、多くの政府が検疫を課している。4週間から8週間の自宅隔離は、いくつかの方法で人口に悪影響を与えている。課された隔離の結果には、座り仕事の増加および体重増加を特徴とするライフスタイルの大幅な変化が含まれる(Martinez-Ferran et al 2020;King et al 2020;Narici et al 2020)。このような長時間の運動制限は、年齢、性別、および民族に関係なく、すべての人に悪影響を及ぼし、特に摂食性および高齢者の対象者に悪影響を及ぼす。一般的に身体活動(身体活動)が低下している高齢者は、SARS-CoV2感染の優先的な標的であることが証明されているが、子供は軽症であることが多く、その死亡例は極めて稀です(Ludvigsson 2020)。転帰が非常に異質なもの(無症状、軽度の症状、または重度の呼吸器症候群で死亡に至る)である理由はほとんどわかっていない(Lai er al)。 2020)が、いくつかの併存疾患が伝染率の増加と関連していること、および疾患の予後の悪化と関連している(Rodriguez-Morales er al)。 2020)。併存疾患の多くは、代謝関連疾患および/または免疫異常であり、両方とも炎症状態の増加と関連しており、常に定期的な身体活動の影響を受けていることは注目すべきことである。一方で、座りっぱなしのライフスタイルは、ウイルス感染症を含む多くの疾患の明確な危険因子となっている(Knight 2012)。
このシナリオでは、定期的な身体活動は、新しい仮説的パンデミックの波に対抗するための正しい分子装置を提供するのに役立つ。本論文では、レギュラー身体活動が免疫系、骨格筋、脂肪組織に及ぼす分子効果について、特に炎症性サイトカインが媒介するクロストークに焦点を当てて、現在の科学的知見をレビューする。我々の知る限りでは、SARS-CoV2患者の重篤な症状の予防に対する身体活動の影響に関する具体的なエビデンスは得られていない。そこで私たちは、SARS-CoV2感染による重篤な症状を緩和する可能性のある身体活動の分子効果を初めて検討した。
SARS-CoV2感染症の一般的な特徴と合併症
コロナウイルス(CoV)は、コロナウイルス亜科に属し、α-コロナウイルス、β-コロナウイルス、γ-コロナウイルス、δ-コロナウイルスの4つの属に分類される(de Groot et al 2013;Li et al 2005)。これら4つのサブファミリーのうち、αおよびβCoVのみがヒトに感染し、軽度のインフルエンザから重度の呼吸器疾患までの幅広い臨床表現型を有する呼吸器疾患を引き起こし、最悪の場合には死に至る(Hashem er al)。 CoVは、26kbから32kbの範囲の陽性の大型一本鎖RNAを有する大型エンベロープ型ウイルスである(PerlmanおよびNetland 2009)。2つのβCoV、すなわちSARS-CoVおよびMERS-CoVは、それぞれ2002年および2012年に重篤なパンデミック性呼吸器症候群を引き起こした(Ahn er al)。 2020)一方で、SARS-CoV2は2019年に出現し、出現から数ヶ月以内にパンデミックプロポーションに達した。CoVのリザーバーはコウモリであり、SARSとMERSの中間宿主はそれぞれマスクドパームシベットネコとラクダで同定されているが、SARS-CoV2の中間宿主はまだ同定されていないが、パンゴリンとミンクが候補となる可能性がある(Xu er al)。 2020)。
SARS-CoV2は、アンジオテンシン変換酵素2(ACE2)膜貫通タンパク質と結合するSpikeと名付けられたその表面糖タンパク質を介してヒト上皮細胞に感染する(Spinelli et al 2020);ACE2は、細胞内へのウイルスの侵入を媒介する。ACE2は血管内皮、腎・心血管組織、骨格筋、小腸・精巣の上皮に発現しているが、肺胞上皮細胞での高発現が肺感染症の特異性や呼吸器症状の原因となっている(Jia er al)。 2005)。最近、SARS-CoV-2 Spikeのモデリング構造は、この糖タンパク質がヒトジペプチジルペプチダーゼ4(DPP4)とも相互作用し得ることを予測している(Bassendine et al 2020)。スパイクタンパク質は、ウイルス表面から突出したホモトリマーを形成し、従って宿主細胞と接触する。スパイクモノマーは、2つのドメイン、S1およびS2からなる:前者は、受容体の会合および安定化を媒介し、後者は、膜融合を促進する(Perrotta et al 2020)。
生理学的には、ACE2は、アンジオテンシンII(Ang II)をアンジオテンシン1-7(Ang 1-7)に変換し、それは、Mas受容体を介して、いわゆる「カウンターレギュレーター」または「血管拡張剤」レニンアンジオテンシンシステム(RAS)経路を活性化する:それは、急性肺損傷に対する自然な保護を提供し、血管拡張作用、抗増殖作用、心保護作用、抗炎症作用および抗線維化作用を含む多臓器の有益な効果を促進する(Gaddam et al 2014; Nunes-silva et al 2020)。2014; Nunes-silva et al 2017)。) この血管拡張剤RAS経路の活性化は、血管収縮、細胞増殖、臓器肥大およびアルドステロン放出に関連するACE、AngⅡおよびアンジオテンシン1型(AT1)受容体が関与する「古典的な」RAS経路の分子的および細胞的効果に対抗する(Nunes-silva et al 2017)。
SARS-CoV2感染中、ウイルスは、細胞への侵入の結果としてACE2タンパク質のダウンネクストを誘導し、その結果、ACE2-Mas受容体経路の有益な血管拡張作用を減少/阻害し、呼吸器症候群の発症に寄与する(Cheng er al)。 2020)。ウイルスの複製自体は、自然免疫系の活性化および一本鎖RNAなどのウイルス成分によるサイトカイン発現の誘導に起因する急性炎症反応を引き起こす。したがって、COVID-19患者は、「高サイトカイン血症」と呼ばれる高レベルの循環サイトカインを有し、これは疾患の重症度に直接相関する(Wu er al)。 非常に重篤な症例では、高レベルの循環サイトカインは「サイトカインストーム」と呼ばれる。興味深いことに、臨床的な悪化は、炎症状態の顕著な増加と関連している(Jamilloux et al 2020)。
上述したように、感染性は高いが、SARS-CoV2は、高齢者および/または加齢に伴う併存疾患を有する人の間でより高い罹患率を有する。文献データは、有病率は国別データと同様に異なる研究で変動しているが、代謝性疾患がCOVID-19患者の罹患率および死亡率を増加させることを示している(Guan er al)。 2020; Wang er al)。 2020; Pecoraro er al)。 2017; Li er al)。 2020)。Singhal(2020)は、高血圧、2型糖尿病、および心血管障害の有病率をそれぞれ21%、11%、7%と報告している(Singhal 2020)。同様に、46,248人の患者を対象とした研究では、Yangら(2020)は、高血圧、2型糖尿病、心血管疾患の有病率をそれぞれ患者の17%、8%、5%と報告している。中国疾病管理予防センターの疫学ワーキンググループは、SARS-CoV2の影響を受けた患者20,982人を調査し、高血圧、2型糖尿病、心血管疾患の有病率はそれぞれ13%、5%、4%であったことを明らかにした[”The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China” 2020]。Onderらによるイタリアの研究(2020)では、SARS-CoV2患者355人のうち、2型糖尿病は36%、心血管疾患は43%であった。2型糖尿病患者のリスクについての同様の証拠は、2002年のSARSと2012年のMERSという2つの以前のCoV感染症についても報告されている(Yang er al)。 2006; Yu er al)。 2006 Badawi and Ryoo 2016)。さらに、血糖値および2型糖尿病は、SARS患者の死亡率および罹患率の独立した予測因子である。H1N1インフルエンザであっても、代謝障害は症状の重症度および死亡率と関連している(Papp et al 2002;Sun et al 2016)。肥満は、コロナウイルス疾患2019(COVID-19)の転帰不良の危険因子を悪化させることができる併存疾患に追加されている(Vaduganathan et al 2020)。
ウイルス感染症(SARS-CoV2を含む)に対する臓器の反応に対する身体運動の影響
ウイルス感染下での免疫系と身体活動の相互作用
身体活動は、仕事、移動、構造化された運動トレーニングなど、日常的に行われるすべての活動を含み、平衡化された食事との関連で、健康的なライフスタイルの主要な構成要素となる。定期的な中等度の身体活動は、心肺体力を高め、心血管死亡のリスクを減らし、心理社会的ウェルビーイングを向上させる(Sigal et al 2006)。
第一の宿主防御システムである自然免疫は、ウイルス、細菌、真菌の感染に関連する一般的なパターンを認識し、病原体に損傷を受けた細胞を排除することができる(Amano er al)。 具体的には、病原体に曝露した後、抗原を提示する細胞は、感染した宿主細胞の貪食を介してその複製をブロックする;特に、防御システムは、病原体の成分を結合するToll様(TLR)およびヌクレオチド結合オリゴマー化ドメイン(NOD)様受容体(NLR)などのパターン認識受容体(PRR)を介して作用する(Amano er al)。 2014)。このメカニズムを介して、長期的かつ高度に特異的な適応免疫応答も誘発することができる。さらに、シグナル伝達カスケードの迅速なPRR活性化は、炎症反応を開始する異なるサイトカインおよびケモカインの放出を導く。
臨床的証拠は、多くの慢性炎症性疾患が感染症の非常に悪い転帰に寄与していることを示しており、一方で、感染症は代謝性慢性疾患の予後を悪化させることを示している(Fezeu er al)。 したがって、免疫不全の被験者は、好中球および単球の機能不全を含む自然免疫系の障害により、COVID-19を含むヒト病原体感染症に対して高い感受性を有する(Guan and Zhong 2020)。基礎となるメカニズムは、おそらくプロテインキナーゼCの活性化およびTLRの過剰発現が関与しており、その結果、好中球機能の阻害および貪食能の低下を伴うものと考えられる(Gupta er al)。
特定の集団(すなわち、肥満および/または糖尿病患者およびHIV患者)に焦点を当てた、免疫系活性が運動の種類、強度および持続時間によって正の影響を受けるというエビデンスが増加している(Nieman and Wentz 2019; Bermon et al 2017)。定期的かつ適度な強度(〜60%VO2max〜60分)で行われる身体活動は、組織マクロファージの機能と作用を改善し、免疫グロブリン、抗炎症性サイトカイン、好中球、NK細胞、細胞障害性T細胞、未熟B細胞などの主要な免疫系因子の活性化と再循環を促進することで、免疫系を刺激する。分子レベルでは、中等度の身体活動は、TLR発現のダウンレギュレーションおよび/またはTLR活性化の阻害、特に単球TLR4発現の減少を誘導する(Collao et al 2020)。
中等度の強度の運動および高い心肺体力レベルが、肥満、糖尿病、癌、心血管疾患および認知機能障害における異なる免疫マーカーの発現に正の影響を与えることは注目に値する(Zbinden-Foncea et al 2020)。
さらに、身体活動は、おそらくCOVID-19を含む、さまざまなウイルス感染症のリスク、期間および重症度を減少させることによって、免疫系に対する強力な効果を引き出す(Zbinden-Foncea et al 2020)。H1N1ウイルス感染症の肥満マウスを用いて行われた最近の研究では、著者らは、身体活動が宿主の免疫防御における肥満に関連した免疫系の変化を逆転させることを実証した(Warren et al 2015)。これらの結果は、肥満マウスにおける障害された免疫系応答の刺激に対する運動の好ましい効果を支持し、したがって、ウイルス感染からのより良い回復を促進する(Luzi and Radaelli 2020)。
時間の経過とともに、これらの好ましい変化は、感染性病原体に対する免疫サーベイランスを改善し、感染症の症状を保護または緩和することができる(Nieman and Wentz 2019; Davison er al)。 2016; Zheng er al)。 2015);逆に、高強度トレーニング(> 70-75% VO2max)、競技スポーツ、および関連する生理学的、代謝的および心理的ストレスは、免疫応答、炎症、酸化ストレス、および疾患のリスクの増加における一時的な負の変化と強く関連している(Laddu er al)。 2020)。この点では、健康な若年者および/または高齢者対象者、さらには免疫不全患者において、慢性的な運動が免疫能力に及ぼすプラスの効果を示す証拠が増えていることを強調することが重要である(Sellami er al)。 2018)。一方で、高強度トレーニング後の日和見感染症のリスクが高いことや免疫機能の障害は、矛盾するデータのために議論が続いている:急性運動が感染症を増加させると報告している研究は慎重に検討する必要がある(Campbell and Turner 2018)。感染症、特に呼吸器感染症に対するこのような感受性は、急性運動ではなく、他の制限要因(長期にわたるストレス状態、栄養不足、不健康な環境への曝露など)に起因している可能性がある。
免疫系の感染症に対する感受性と運動(定期的な中等度から高強度)との間には議論の余地のある関連性があるにもかかわらず、身体活動は免疫応答を改善し、したがって人間の生活の質を向上させることができる有効な免疫療法的予防戦略である(Rada et al 2018)。
ウイルス感染下での筋/身体活動の相互作用
運動と炎症との関連を扱ったいくつかの研究は、定期的な中等度身体活動(65〜85%HRmax)(Hammami er al)。 2020)が炎症状態を低下させ、肥満や糖尿病などの代謝性疾患の侵襲を打ち消し、高齢者や心血管疾患などの炎症状態が上昇した被験者の健康状態を改善することを肯定している(Nicklas er al)。 2008; Park er al)。 2014; Lancaster and Febbraio 2014; Allen er al)。 2015; Pedersen 2017)。
通常の身体活動によって誘導される抗炎症反応は、筋肉由来のサイトカイン(ミオカイン)の放出を介した骨格筋の収縮によって媒介される。適度な身体活動は、IL-10,IL-1受容体アンタゴニスト(IL-1raおよびIL-37などの炎症の調節に関与するサイトカインの血清レベルの著しい増加を誘導する(PedersenおよびFebbraio 2008; Fernandes et al 2019; Abbasi et al 2014; Nold et al 2010)。一方、別のミオカインであるIL-6は、いくつかの組織におけるプロ炎症性サイトカインの分泌を抑制するように作用し、運動後数時間の抗炎症環境の構築に寄与する。
一般集団における身体活動の抗炎症効果の裏付けとして、運動誘発性IL-6産生は、活性化核T細胞因子(NFAT)とグリコーゲン-p38(MAPK)によって活性化されたマイトジェネリックプロテインキナーゼ(mitogenic protein kinase activated by glycogen-p38)の2つの経路の相互作用によって制御されることが示されている(Muñoz-Cannoves er al)。 2013);その結果、炎症反応が長期化している間は、TNF-αまたはNF-kBの発現が増加する(Pedersen and Febbraio 2008; Pedersen 2017)。同様に、健康な運動をしている人では、筋肉に存在するサブタイプ1(M1)のプロ炎症性マクロファージの減少があり、サブタイプ2(M2)の抗炎症性マクロファージの増加がある。また、1回の運動負荷後に急激に増加するPGC1αの発現は、マクロファージの親炎症性M1から抗炎症性M2への分極を生み出すことも示されている(Dinulovic er al)。 さらに、PGC1αは、炎症性サイトカインの発現を抑制し、抗炎症性サイトカインの発現をそれぞれ増加させることも可能である(Eisele et al 2015)。
通常の身体活動の抗炎症効果を支持する別のメカニズムは、単球およびマクロファージ上のTLR発現の調節に起因し得る(Rada et al 2018; FlynnおよびMcFarlin 2006)。過去10年間で、TLRの発現の増加、座り仕事のライフスタイル、炎症状態、および疾患との間の関連が集約されてきた。McFarlinらはまた、身体活動的な若年者および高齢者被験者において、リポ多糖刺激性全身性産生のIL-6,IL1β、TNF-α、高感受性C反応性タンパク質(hsCRP)およびTLR4発現の有意な減少を示した(McFarlin et al 2006)。しかしながら、骨格筋において身体活動によって誘導されるすべての正の抗炎症効果を媒介する上で重要な役割を果たし得る分子は、活性化ミトゲンプロテインキナーゼ(AMPK)である。骨格筋の収縮時に活性化されるこの燃料感知酵素は、解糖や脂肪酸酸化などのエネルギー生成経路を刺激し、タンパク質や脂質の生合成などのエネルギー消費プロセスを減少させる(Richter and Ruderman 2009)。身体活動 媒介 AMPK シグナルは、エネルギー代謝を活性化し、NF-κB によって誘導される炎症反応を間接的に抑制するという二重の目的を達成する。このメカニズムは、慢性ストレスと関連しており、同様に2型糖尿病および肥満と同様にメタボリックシンドロームで発生している(Liu and Chang 2018)。図 1 は、筋肉および脂肪組織におけるサイトカインの放出と自然免疫および適応免疫の要素の活性化を介して 身体活動 によって制御される炎症性および免疫イベントを示している。
図1 SARS-CoV2 感染における身体活動と抗炎症反応
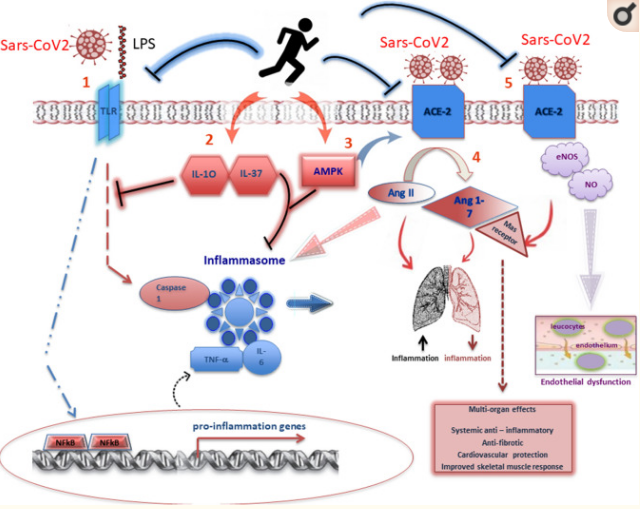
定期的な身体活動は、少なくとも5つのメカニズムを通じて急性炎症反応を低下させる可能性がある。
- (1) TLRによって媒介される炎症性シグナル伝達経路を減少させること、
- (2) IL-10やIL-37などの抗炎症性サイトカインを増加させることで、TLR-炎症性シグナル伝達カスケードを阻害し、イ ンフラナソームによって生成される炎症作用を緩和すること、
- (3) AMPKの活性化を介して肺の炎症を減少させ、Ang IIからAng 1-7への変換を促進すること、
- (4) ACEの活性化を介して肺の炎症を減少させること、(4) ACEの活性化を介してAng IIからAng 1-7への変換を促進すること、である。(4) おそらく、ACE2-Mas受容体の血管拡張経路の活性化により、肺の炎症を減少させ、いくつかの有益な多臓器効果を促進することにより、
- (5) おそらく、内皮機能障害を打ち消すために、一酸化窒素(NO)レベルを回復させることにより、肺の血管拡張および抗血栓活性に貢献する。
最後に、定期的な身体活動の心臓および心血管系へのプラスの効果も考慮する必要がある;身体活動がCV疾患のリスクを減少させ、内皮機能障害の進行を遅らせ、血流と臓器の灌流を改善することは十分に確立されている(Broderick er al)。2019)。
しかし、心血管系の健康に対する身体活動の有益な効果の頑健な証拠があるにもかかわらず、心肺体力を促進し、心血管疾患リスクを低下させるメカニズムは、完全に解明されているには程遠い。
身体活動は、心臓および血管系の両方に正の適応を誘導し、血圧、安静時心拍数およびアテローム性マーカー発現の低下を導く(NystoriakおよびBhatnagar 2018; Platt et al 2015; Vega et al 2017)。特に、運動誘発性心臓有益応答に関与する細胞シグナリング分子経路は、心臓生理学的肥大成長の重要なメディエーターであるホスホイノシチド3-キナーゼ(PI3K)/Akt経路を含む(Fukazawa et al 2003;McMullen et al 2003);IGF-1R、および/またはインスリン受容体(IR)を介した細胞シグナリングであり、心臓の代謝適応を誘導することができる。さらに、成長因子ニューレグリン-1によるErbB2/ErbB4チロシンキナーゼ受容体の活性化は、PI3Kシグナル伝達を刺激することができ(D’Uva et al 2015;Fukazawa et al 2003したがって、成人心臓における心臓再生を促進する(Bersell et al 2009;D’Uva et al 2015)。ニューレグリン-1の発現は、運動後の心臓においてアップレギュレーションされる(Cai er al)。 2016; Waring er al)。 2014);しかしながら、運動に対する心臓の適応におけるこの分子の正確な役割は、まだ明らかにされていない。
一酸化窒素(NO)は、心臓および血管系の両方において運動の有益な効果の重要なメディエーターであることが知られている(Nystoriak and Bhatnagar 2018; Platt er al)。 2015; Vega er al)。 2017)。運動中に内皮一酸化窒素合成酵素(eNOS)によって生成されたNOは、可溶性グアニル酸シクラーゼ(sGC)を活性化し、cGMPの増加とプロテインキナーゼG(PKG)の活性化につながる:この経路の活性化は、心保護効果があることが示されている(Rainer and Kass 2016)。さらに、運動誘発性の心臓および循環NOの増加は、虚血/再灌流傷害から保護する(Calvert et al 2011)。最後に、eNOSは、ミトコンドリア生合成とPGC-1a発現の両方を増加させることにより、運動に対する心臓の代謝適応に寄与するという証拠がある(Vettor et al 2014)。
最後に、このプロセスの基礎となるメカニズムはまだ解明されていないとしても、定期的な身体活動は血管新生を誘導し得る;おそらく、運動後のNOの発現増加は、プロ血管新生因子、特に血管内皮成長因子(VEGF)のアップレギュレーションを誘導し、その結果、血管新生が増加し、内皮機能にプラスの効果をもたらす(Prior et al 2004年;Leosco et al 2008)。
SARS-CoV-2は、炎症の正のフィードバックラウンドにおける炎症性サイトカインの活性化および出口につながるサイトカインストームを引き起こし得る;IL-6,C反応性タンパク質(CRPDダイマーおよびフェリチンは、SARS-CoV-2の予後不良の予測因子として使用される主なサイトカインである(田口および向井2019; Donath et al 2019; Quirch et al 2020)。その上、疾患の悪化の間、IL-6のさらなる漸進的な増加が観察され、死亡した患者において極めて高いレベルが観察されている(Ye er al)。 2020; Zheng er al)。 2015)。
さらに、SARS-Cov2を含むウイルス感染症はまた、eNOSおよび一酸化窒素(NO)の両方の発現が低下し、異常に急速な血液凝固を伴う内皮機能不全を特徴とする。定期的な身体活動は、ウイルスによって引き起こされるプロ炎症作用を打ち消す可能性がある;実際、eNOSに関係なくNOの回復が内皮機能障害を打ち消し、肺血管拡張と抗血栓活性に寄与する可能性があるという仮説が立てられている(Green 2020)。また、NOはコロナウイルスSタンパク質とその宿主受容体であるACE-2との結合を阻害することも報告されている。NOは、ウイルス細胞の侵入に重要なイベントである、ウイルスのシステインプロテアーゼおよびホストのセリンプロテアーゼであるTMPRSS2の両方のS-ニトロシル化を調節しているようである(Hoffmann er al)。 2020; Shulla er al)。 2011)。
さらに、ACE-2は、急性肺損傷時の血管透過性に対するVEGF効果を阻止する;より高いVEGF濃度が報告されているSARS-Cov-2感染では、ACE-2はダウンレギュレートされ、したがって、VEGF-A効果を打ち消すことができず、血管透過性の増加および内皮損傷の悪化につながる(Turkia M. COVID-19,血管内皮増殖因子(VEGF)およびヨウ化物(2020年6月3日)。SSRN: ssrn.com/abstract=3604987 または dx.doi.org/10.2139/ssrn.3604987 で入手可能)。)
今日まで、ヒトにおけるACE2 /Mas受容体血管拡張因子RAS経路に対する身体活動の効果は調査されていないが、いくつかの実験研究では、運動が血管拡張因子である対抗制御RAS経路を刺激し、同時に古典的なRAS経路の作用を阻害し、その結果、上述したACE2の有益な多臓器効果を促進するという考えが支持されている(Nunes-Silva er al)。
さらに、ACE2のリン酸化は、AMPKを介して、肺内皮細胞におけるAng1-7を改善し、それにより肺高血圧を減少させることが、最近多くの研究で実証されている(Yan er al)。 Prataらは、ブレオマイシン誘発性肺線維症を有するマウスによって行われた中等度の身体活動が、肺病変においてACE2を介してAng1-7を増加させ、これらのマウスを病気にかかりにくくすることを実証した(Prata et al 2017)。
最後に、グラム陰性菌の細胞壁の病原性成分であるLPS、そしておそらくSARS-CoV2の病原性成分であるLTRを介して、炎症のカスケードを誘発し得る。このTLR媒介の細胞内プロ炎症性シグナル伝達には、カスパーゼ1を刺激し、核内因子κB(NF-κB)を介して、インフラマソームの活性化およびプロ炎症性遺伝子の転写を誘導することができるいくつかのタンパク質が関与している(Zbinden-Foncea et al 2020)。
図2は、上述の身体活動媒介分子機構を要約したもので、SARS-COV2感染における炎症の打ち消しにおける身体活動のポジティブな効果の証拠を提供している。
図2 筋肉および脂肪組織における身体活動と抗炎症反応

身体活動は、細胞(例えば、マクロファージサイトカイン[例えば、インターロイキン(ILs)]およびアディポカイン(例えば、アディポネクチン)の関与を介して、筋肉および脂肪組織において抗炎症応答を誘導する。
ウイルス感染下での脂肪組織/身体活動の相互作用
定期的な身体活動は、脂肪沈着、炎症状態、免疫応答および内分泌活動を制御することにより、脂肪組織の生理を維持する上で重要な役割を果たしている(Boa et al 2017)。その結果、身体活動は運動の種類、持続時間、強度に応じて脂肪組織の炎症状態を低下させる(Golbidi and Laher 2014; Nigro er al)。 逆に、エネルギー摂取量の増加とともに運動不足は、脂肪細胞の肥大、免疫細胞のリクルート、およびプロ炎症性アディポカインの放出をもたらす(Kirk er al)。 毎週の運動の回数とその強度は、脂肪組織の健康に対する身体活動のポジティブな効果を見る際に考慮すべき追加的な要因であり、特にウイルス感染に対抗することを目的としている場合には、考慮すべきである。インフルエンザウイルスのパンデミックでは、低~中程度の強度での運動はインフルエンザ関連の死亡リスクの低下と関連している(運動をしない場合や滅多に行わない場合と比較して)が、頻繁に高強度で運動しても効果はない(Wong er al)。 2008)。
一方、脂肪組織の健康は、肥満や2型糖尿病などの非伝染性疾患と、ウイルス感染症などの伝染性疾患の両方に直接影響を与える。肥満は、COVID-19においても予後不良の危険因子を悪化させることができる主要な併存疾患に追加され(Vaduganathan et al 2020; Klang et al 2020非パンデミックおよびパンデミックインフルエンザにおける重症度および死亡率の増加の危険因子として同定されている(Honce and Schultz-Cherry 2019)。
脂肪組織生理学とSARS-CoV2などのウイルス感染症との間の関連性の根底にあるメカニズムは部分的にしか知られていない;一つは、脂肪細胞で発現し、除脂肪者と比較して肥満および/または2型糖尿病患者の脂肪細胞で過剰発現しているACE2の関与であるかもしれない(Kruglikov and Schererer 2020)。ACE2を発現する脂肪細胞はまた、H1N1,A型インフルエンザおよびSARS-CoVなどのいくつかのウイルスの侵入口の一つとして報告されているが、我々の知る限りでは、脂肪細胞を介してSARS-CoV2が侵入したという証拠はない(Gu and Korteweg 2007; Maier er al)。 2018; Ryan and Caplice 2020)。これに加えて、脂肪組織は持続的なウイルス感染をサポートする(Ryan and Caplice 2020)。これは、H5N1ウイルス感染ですでに証明されているように、脂肪組織はウイルスのリザーバーとして機能する可能性があることが報告されているからである(Nishimura er al)。
脂肪組織の健康とウイルス感染とを結びつけるもう一つのメカニズムは、内分泌機能である。アディポカインとして知られる、脂肪組織から分泌されるいくつかのホルモンは、エネルギー貯蔵、免疫機能、炎症反応を含む多くの生物学的プロセスの調節に関与している(Mancuso 2016)。アディポカインの産生とは別に、脂肪組織はまた、総称してアディポミオカインと呼ばれるIL-6,MCP1およびTNF-αを含む多くのサイトカインを合成することができる(Görgens er al)。 2015)。集合的に、これらのメディエーターは、全身の炎症性および免疫状態を調節することにより、ウイルス感染症との戦いに参加することができる(Bourgeois et al 2019)。肥満および糖尿病の被験者では、活性免疫細胞の増加はまた、マクロファージ(M1表現型)の浸潤をさらに促進し、T細胞のリクルートおよび活性化を媒介するプロ炎症性因子の放出にも関与する(SaltielおよびOlefsky 2017)。IL-6のようなこれらの因子のいくつかは、循環中に全身的に放出され、一方、TNF-αのような他の因子は、主に脂肪組織中に保持され、そこで局所的なホルモン環境中で作用し、アディポカイン産生の調節障害を導く(Desruisseaux er al)。 2007; Corbi er al)。 2019)。
さらに、限られたデータは、肥満によって誘発された全身性炎症(上述)が、感染によって誘発された場合に、非常に激しいサイトカインストームを生成するために免疫系をプライミングすることを示唆している(Ramos Muniz et al 2018)。サイトカインストームは、最も重篤なCOVID-19症例において同定されており、肥満のCOVID-19患者におけるさらに激しいストームは、これらの患者における予後不良および死亡率の上昇を部分的に説明する可能性があることを強調することが不可欠である(Coperchini et al 2020)。以上のことから、不健康な脂肪組織は、少なくとも部分的には、すでに機能不全に陥っている免疫系との関連で、COVID-19のようなウイルス感染症に対する性質および予後の悪化に寄与している可能性がある(Desruisseaux er al)。 2007)。
脂肪組織の生理学的状態を維持または回復するための最も強力なツールは身体活動である。脂肪組織に対する定期的な身体活動の抗炎症効果は、いくつかの基本的な分子メカニズムに要約することができる(Pedersen and Febbraio 2008; Mathur and Pedersen 2008; Flynn and McFarlin 2006)。第一のメカニズムは、脂肪量の減少および体組成の改善に起因して、TNF-α、レチノール結合タンパク質4,レジスチンおよびレプチンなどのプロ炎症性サイトカインおよびアディポカインの循環レベルの減少、およびアディポネクチンおよびIL-10などの抗炎症性サイトカインおよびアディポカインの増加レベルの増加をもたらすことに起因し得る(Gonzalez-Gil er al)。 2019; Mujumdar er al)。 2011; Ben Ounis er al)。 2009; Lim er al)。 2008; Metsios er al)。 2020; Nigro er al)。 2014; Orrù er al)。 2017)。) 重要なことに、このアディポカインレベルの調節は、身体活動の強度と期間に依存する:慢性的で中程度の強度の身体活動は、アディポカイン分泌の適切なバランスを有利にするという点で、高強度の運動よりも優れた働きをする(Görgens et al 2015; Lehnig and Stanford 2018)。
第二に、脂肪組織の内分泌機能に対する身体活動の調節効果は、直接的(上記のように)または間接的に、筋肉組織からのミオカインの作用を介して、アディポカインの放出だけでなく、脂質およびグルコース代謝に影響を与える可能性がある(Laurens et al 2020)。他のミオカインの中でも、IL-6,IL-8,FGFは、アディポカイン産生を好むだけでなく、免疫細胞の脂肪組織への浸潤を制御し、脂肪対非脂肪細胞のアンバランスを回避することに最も関与しているように思われる(Laurens et al 2020)。
さらに、肥満身体活動は、肥満誘発性炎症反応の主な誘因の一つであるTLR活性化を抑制する血漿中FFAレベルの低下を介して炎症の抑制に関与している(Flynnn and McFarlin 2006; Gleeson er al)。 2011; Ringseis er al)。 2015; Rada er al)。 2018)。具体的には、飽和脂肪酸は、TLR4,TLR2を活性化することができ、TLR1またはTLR6とともに形質膜中でヘテロダイマーを形成し、多くのサイトカインの合成を誘導する(RogeroおよびCalder 2018)。
最後に、以前の研究では、有益な身体活動は、脂肪細胞からのFAの放出および動員を誘導して、それらを働く筋肉に送達し、脂肪組織脂質の量および組成の変化に寄与することができることが報告されている(Mika er al)。 2019)。
図3は、COVID-19の下での脂肪組織と身体活動の間のクロストークを模式的に報告している。
図3 脂肪組織のウイルス感染に対する応答に対する身体活動の影響

肥満の脂肪組織は、除脂肪組織とは対照的に、抗ウイルス反応を損なういくつかの変化(すなわち、免疫細胞の増加、プロ炎症性サイトカインの増加、ACE2の過剰発現)を特徴としている。定期的な身体活動は、これらのメカニズムの大部分(すなわち、脂肪量の減少、免疫機能の改善、脂質代謝の改善)を改善し、ウイルスのクリアランスを助ける。
結論
SARS-CoV2感染によるパンデミック感染の時代にあって、代謝障害が感染症への感受性に負の影響を与えることを考えると、活動的な状態を維持するように人々を説得することは不可欠である。実際、COVID-19の致死的転帰を制限し、重篤な症状を予防するための有望なアプローチは、良好な免疫健康と一致した生活習慣の採用である。この点で、身体活動は、感染症への感受性に悪影響を及ぼす代謝障害に対する最初の防御線となる。それにもかかわらず、過去のインフルエンザのパンデミックからの教訓は、座りっぱなしのライフスタイルがウイルス感染のためのポジティブな環境を作り出すことに寄与していることを示唆している。SARS-CoV2に罹患した患者の重篤な症状の予防に対する身体活動の影響に関する具体的なデータは現在のところ得られていないが,本レビューは,定期的な身体活動が生存者の予後を改善する非薬理学的ツールであることを示す強力な証拠を提供するものである.
抗COVID-19ワクチンや新しいCoVに対する最も有望な治療法を待つ中で、定期的かつ構造化された身体活動は、免疫応答を積極的に調節することを目的とした補完的な予防介入であり、COVID-19感染における合併症の負の影響を軽減することが可能である。近い将来にパンデミックが収束するとは思えないことを考えると、ウイルスの蔓延を食い止めるためには、介入手段を特定することが重要であろう。
