Contents
A Timely Call to Arms: COVID-19, the Circadian Clock, and Critical Care
www.ncbi.nlm.nih.gov/pmc/articles/PMC7882674/
オンラインで2021年2月11日に公開。 doi: 10.1177/0748730421992587
概要
現在,感染力の高い新型コロナウイルスである重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)を原因とするコロナウイルス感染症2019(COVID-19)の世界的パンデミックの真っ只中にある。ここでは、SARS-CoV-2の生物学と病理学の側面、およびこれらが宿主の概日時計とどのように相互作用するかについて考察する。さらに、集中治療室への入院を余儀なくされるような重篤な症状にも焦点を当てる。COVID-19の最も一般的な重篤な合併症は、時計によって制御される人間の生理機能に関連している。パンデミックを利用してどのように概日時計に関する知見を得ることができるか、さらに重要なことは、COVID-19の疾患発現と臨床経過を緩和するために概日時計の知識をどのように利用できるかについて推測している。
キーワード:概日時計、クリティカルケア、COVID-19,SARS-CoV-2,栄養、ツァイトゲーバー、リズム
はじめに
コロナウイルス感染症2019(COVID-19)は、新しいパンデミック呼吸器疾患であり、無症状の感染から重篤な呼吸器および多臓器不全まで、非常に多様な臨床症状を示する(Wang et al 2020b;Zhou et al 2020a)。COVID-19は、1億人以上の感染者と200万人以上の死亡者を出しており 2020年に最も死亡率の高い感染症の一つとなっている(世界保健機関 2020)。COVID-19とその原因物質である重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2; Zhu et al 2020)の病態生理については、この病気を食い止めるために世界中で多大な努力が払われているが、未だに多くのことが解明されていない。ここでは、重症のCOVID-19患者の予防、リスク軽減、予後、およびリハビリテーションに対する時系列生物学分野の貢献の可能性について議論する。この作業は、欧州生体リズム学会が主催するChronobiology and COVID-19に関するワークショップ(Chronobiology of COVID-19 CARE Conference)での議論に基づいている。2020年7月に招集されたこの仮想ワークショップには、世界中から250人の研究者や臨床医が集まった。彼らは、クロノバイオロジーとCOVID-19の病態がどのように関連するのか、どのようなモデルシステムが必要なのか、そして、そのような関連性を探るために臨床データをどのように活用するのが最善なのかを考えるために、幅広い対話を行った。ここでは、COVID-19の概要を説明し、COVID以前の既存の文献に基づいて、概日リズムの影響を受けやすい要素に重点を置いている。最後に、重症のCOVID-19患者に関連する、重症患者と集中治療環境が概日出力にどのように影響するかについてレビューする。
COVID-19の概要
COVID-19の原因ウイルスであるSARS-CoV-2は,新規のβ-コロナウイルスであり,世界的に懸念されている過去の2つのパンデミック性コロナウイルスと遺伝的および臨床的に類似している.2002年に登場したSARS(重症急性呼吸器症候群)と 2012年に登場したMERS(中東呼吸器症候群)である(Drosten et al 2003,de Groot et al 2013,Haagmans et al 2014,Coronaviridae Study Group of the International Committee on Taxonomy of Viruses 2020,Kim et al 2020,Zhu et al 2020)。3つのコロナウイルスはいずれも、ヒトにおいて低酸素性呼吸不全という類似した症状を引き起こし、人工呼吸が必要になると20%~70%の致死率となるが(Yam et al 2003;Alsolamy and Arabi 2015;Auld et al 2020;Richardson et al 2020)SARS-CoV-2だけがパンデミックの拡大を達成した。これは、SARS-CoV-2が、感染者が自己隔離するような全身疾患の症状を引き起こすことなく、鼻咽頭で生産的に複製する能力が高いことに関連していると考えられる(Wölfel er al)。 ほとんどの国では包括的なウイルス検査が行われておらず、偽陰性率が変動するため、無症候性の広がりの範囲に関する疫学的な情報は依然として不完全である。症状のある患者のうち、およそ81%は軽症、14%は入院が必要な中等症、5%は入院に加えて集中治療室(ICU)での高度な呼吸器サポートが必要となる。慢性肺疾患の既往は重度のCOVID-19の強力な危険因子を表しているが、COVID-19の危険因子のほとんどは肺外にあり、高齢、肥満、高血圧、糖尿病、心血管疾患などが含まれる(Wang et al 2020a;Zheng et al 2020)。
SARS-CoV-2の感染は上気道で始まり、分化した気道上皮細胞が初期の感染部位となり、特に多繊毛細胞と分泌(クラブ)細胞が中心となる(Hui er al)。 感染は導管を通って肺胞腔まで遠位に進み、I型およびII型の肺細胞や肺胞マクロファージに感染する(Grant et al 2020,Hou et al 2020,Hui et al 2020)。SARS-CoV-2は不死化細胞では細胞毒性を示すが、急性呼吸窮迫症候群(ARDS;Thompson et al 2017;Bryce et al 2020;Schaller et al 2020)として知られる急性肺損傷および肺胞構造の破壊に主に関与すると考えられているのは、宿主の炎症反応である。ARDSの出現により、生命維持のために人工呼吸を開始することが頻繁に必要となるが、この介入が課す気道圧力の上昇は、それ自体が傷害となり、第2の炎症の「打撃」を意味する(Slutsky and Ranieri, 2013)。宿主の免疫系がウイルス感染を早期に制御することに成功すれば、ARDSの肺の病理は完全に解決することができる(Doglioni er al 2020)。しかし、一部の個体では、ARDSの肺病理は、肺を機械的に硬くし、換気を恒久的に損ない、呼吸の仕事を持続的に増加させる線維増殖段階に進む(Thompson et al 2017)。剖検調査によると、SARS-CoV-2による死亡の主たる原因は通常、呼吸不全であるが、重篤な患者では多臓器の機能障害も頻繁に発生する(Bryce et al 2020,Schaller et al 2020,Wang et al 2020b)。
重症のCOVID-19では、2つの形態の全身性病理が特筆される。1つ目は、マクロファージの過剰活性化であり、インターロイキン6(IL-6;Moore and June, 2020)などの高レベルの循環炎症性サイトカインの精緻化をもたらす。サイトカインストーム」という用語がCOVID-19に適用されているが、この状態がこの疾患に特有のものであるか、あるいはこの疾患のほとんどの患者を代表するものであるかどうかは不明である(Lukan 2020,Mudd er al 2020)。機械的に人工呼吸をしているCOVID-19患者は、I型インターフェロン反応が抑制されている可能性を示唆する新たな証拠があり、単純な高サイトカイン血症よりも複雑な病態を示唆している(Giamarellos-Bourboulis et al 2020,Hadjadj et al 2020,Mudd et al 2020)。全身の病理の第2の形態は、凝固亢進であり、微小血栓の形成と、やや直感に反するが出血をもたらす(Al-Samkari et al 2020;Bryce et al 2020)。より一般的に知られている播種性血管内凝固症候群(DIC)と特徴を共有する一方で、COVIDによって誘発される凝固性亢進は、循環フィブリノゲンのレベルが維持され、活性化または損傷した内皮細胞からのvon Willebrand因子のレベルが大量に増加するなど、ユニークな側面を示する(Ward et al 2020,Zhang et al 2020)。臨床的には、COVID-19患者は、脳卒中、心筋梗塞、肺および深部静脈血栓塞栓症、および大出血のリスクが劇的に増加する(Helms et al 2020b;Castro and Frishman 2021)。COVID-19の血栓症のメカニズムはまだ解明されていないが、最近、患者において血小板機能の欠陥が報告されている(Iba et al 2020;Zaid et al 2020)。
COVID-19の予後は、呼吸不全の重症度に大きく左右される。軽症から中等症の患者は2週間以内に臨床的に回復するようであるが、多くの患者ではウイルスRNAがより長期間にわたって検出される(Sun et al 2020,Wölfel et al 2020)。現時点では、人工呼吸に移行した患者は、中央値で10~17日間、挿管された状態で過ごす(Almeshari er al 2020)。重症のCOVID-19患者の長期的な回復についてはまだ記録されていないが、退院後の数週間は衰弱が長引くという報告が一般的である(Lambert and Corps, 2020; Halpin et al, 2021)。一般的に、重篤な疾患からの生存は、退院後1年経っても続く長引く機能障害や認知障害を伴う(Shelling et al 1998;Bein et al 2018)。
SARS-CoV-2の簡単な概要
SARS-CoV-2(図1)はエンベロープ型の一本鎖RNAウイルスで、コロナウイルスに典型的に見られるように、電子顕微鏡写真でウイルス粒子の周囲に王冠のような突起を形成するスパイク(S)タンパク質によって形態的に区別される(Masters and Perlman, 2013; Brahim Belhaouari et al, 2020)。さらに、ウイルス粒子には、膜に存在するマトリックス(M)タンパク質とエンベロープ(E)タンパク質、ゲノムRNAを巻き取って保護するヌクレオカプシド(N)タンパク質の3つの構造タンパク質が存在する(Masters and Perlman, 2013; Kim et al, 2020)。Sタンパク質は、ウイルスの侵入を触媒し、組織や種のトロピズムの主な決定要因と考えられている(Dinnon er al)。 それは、細胞表面のアンジオテンシン変換酵素2(ACE2)と係合するN末端(S1)セグメントと、三量体化を促進し、膜融合ペプチドを含むC末端のS2セグメントの2つのセグメントからなる顕著な細胞外領域を有するI型膜貫通タンパク質である(Cai et al 2020,Ou et al 2020)。融合ペプチドの生理活性は、TMPRSS2などの細胞外プロテアーゼやリソソームのカテプシンによって触媒されるSタンパク質の切断によって促進される(Hoffmann et al 2020,Ou et al 2020)。
図1 SARS-CoV-2ウイルスのライフサイクル
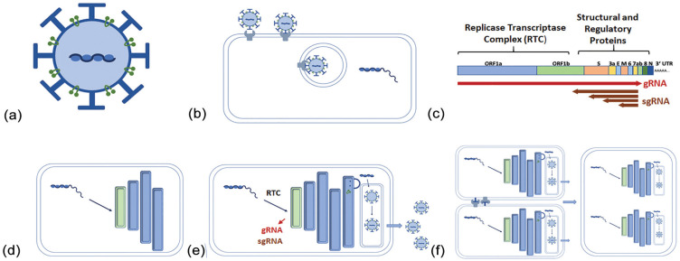
(a) スパイク(![]() )エンベロープ、マトリックス(
)エンベロープ、マトリックス(![]() )タンパク質は、この一本鎖RNAウイルスの表面に発現している。ヌクレオカプシドタンパク質は、(b)ウイルスがスパイクタンパク質と細胞内のACE2との相互作用を介して細胞内に侵入するまで、ゲノムRNA(gRNA)を結合して保護する。(c) 正鎖RNAのgRNAが単一のORFとして転写・翻訳され、RTCが得られる。続いて、構造タンパク質がgRNAの5’末端(サブゲノム、sg)から転写される。(d) RTCは小胞体と統合して二重膜小胞(DMV)を形成する。(e) この構造によってウイルスが生成され、放出される。(f)局所的なウイルス負荷により、局所細胞の表面にスパイクやACE2タンパク質が結合することで、多核巨細胞が形成される。略語の説明 SARS-CoV-2=重症急性呼吸器症候群新型コロナウイルス,ORF=オープンリーディングフレーム、RTC=レプリカ・トランスクリプターゼ複合体、ACE2=アンジオテンシン変換酵素2。
)タンパク質は、この一本鎖RNAウイルスの表面に発現している。ヌクレオカプシドタンパク質は、(b)ウイルスがスパイクタンパク質と細胞内のACE2との相互作用を介して細胞内に侵入するまで、ゲノムRNA(gRNA)を結合して保護する。(c) 正鎖RNAのgRNAが単一のORFとして転写・翻訳され、RTCが得られる。続いて、構造タンパク質がgRNAの5’末端(サブゲノム、sg)から転写される。(d) RTCは小胞体と統合して二重膜小胞(DMV)を形成する。(e) この構造によってウイルスが生成され、放出される。(f)局所的なウイルス負荷により、局所細胞の表面にスパイクやACE2タンパク質が結合することで、多核巨細胞が形成される。略語の説明 SARS-CoV-2=重症急性呼吸器症候群新型コロナウイルス,ORF=オープンリーディングフレーム、RTC=レプリカ・トランスクリプターゼ複合体、ACE2=アンジオテンシン変換酵素2。
SARS-CoV-2のゲノムは、長さ約30kbの1本の正鎖RNAからなり、その長さの3分の2を占める1つのオープンリーディングフレーム(Orf1a/1b)が支配的である(Kim er al 2020)。Orf1a/1bは、ゲノムRNAから単一のポリペプチドとして翻訳され、自己分解されて複数のサブユニットからなる「レプリカ・トランスクリプターゼ複合体」(RTC、Kim er al 2020)を形成する。RTCは、その後のウイルス複製のすべてのステップを担うと考えられている(Masters and Perlman, 2013)。ウイルスカプシドを構成する構造タンパク質は、感染後に、共通の3’末端を持ち、ウイルスゲノムの5’末端に由来する同一のリーダー配列を持つ一連のサブゲノムRNA(sgRNA)として発現する(Masters and Perlman, 2013; Kim et al 2020)。このリーダー配列によって、すべてのウイルス転写物のキャッピングと翻訳が可能になる(Masters and Perlman, 2013; Kim et al 2020)。
SARS-CoV-2の複製の次のステップでは、二重膜小胞(DMV)構造と呼ばれる小胞体(ER)と連続した特殊なオルガネラの設立が行われる(Klein et al 2020)。DMVは、ウイルスの複製を調整し、ウイルス因子を細胞質内の自然免疫センサーから遠ざける役割を果たしていると考えられている(Klein er al)。 注目すべきは、DMV膜がオートファゴソーム膜に超微細構造的に類似しており、SARS-CoV-2感染細胞ではオートファジーマーカーがアップレギュレートされていることである(Stukalov er al)。
コロナウイルスによるウイルスRNA合成は、一般に、ウイルスゲノムの3’末端から始まる相補的な負鎖RNAテンプレートの生成を伴う(Masters and Perlman, 2013; Kim et al 2020)。全長テンプレートは、子孫+RNAウイルスゲノムの合成に使用され、短いsgRNAテンプレートは、4つのウイルス構造タンパク質に加えて、ウイルスと宿主の相互作用に役割を果たす可能性のある付属タンパク質の発現を駆動する(Masters and Perlman, 2013; Liu et al 2014)。コロナウイルスは、RNAスプライシングを行うのではなく、翻訳に不可欠なゲノム5’リーダー配列を各sgRNAに確実に含める独自の方法を用いている。各構造遺伝子の本体のすぐ上流には、5’リーダー配列(TRS-L)のモチーフと同一の保存された「転写制御配列」(TRS-B)がある。RTCが負鎖RNAの合成に関与すると、ポリメラーゼは、各新生sgRNAテンプレートのコーディング配列の上流に位置するTRS-BモチーフからTRS-L配列へとクロスオーバーすることができ、それによって各RNAにゲノムの5’末端を付加することができる。その結果、コロナウイルスはそのライフサイクルを遺伝子の組み換えに大きく依存しており、ウイルスの進化が急速に進む傾向がある(Banner and Lai, 1991)。これを反映して、SARS-CoV-2の優勢な遺伝子型は、ウイルスが中国からヨーロッパやその他の地域に広がるにつれて、感染力を高めながら変化していったようだ(Korber et al 2020)。同じ感染者であっても、SAR-CoV-2のゲノムは、呼吸器系内の解剖学的なサンプリング位置に基づいて変化する可能性がある(Wölfel er al 2020)。
SARS-CoV-2のライフサイクルの最後のステップは、ビリオンの組み立てと放出である。コロナウイルスの場合、ウイルスエンベロープの構造タンパク質(S、M、Eタンパク質)がER膜に共翻訳的に挿入され、ER-ゴルジ中間コンパートメント(ERGIC; Masters and Perlman, 2013; Klein er al)。 そこで、Nタンパク質が結合した子孫ゲノムからなるヌクレオカプシドがエンベロープタンパク質と相互作用し、ERGICの内腔に出芽ます。ウイルスはバルク輸送によって細胞外空間に到達すると考えられているが、最近ではリソソームのコンパートメントを経由する方法も提案されている(Ghosh et al 2020)。Sタンパク質の一部は細胞膜に到達し、近隣の感染細胞との細胞融合を引き起こし、COVID-19の肺病理に特徴的な多核巨細胞が形成される(Masters and Perlman, 2013; Bryce er al)。
要約すると、SARS-CoV-2は重度の感染症の際に、感染した宿主に複数のレベルで関与し、宿主の生理学的プロセス、免疫反応、基本的な細胞機構に自らを挿入する。これらの生物学的組織のすべての層は、概日リズムの影響を受けている。概日リズムの基本的な構造については、で説明する。
概日時計組織の特徴
概日時計は、数え切れないほど多くのプロセスに24時間の時間構造を課している(Zhang er al 2014)。1972年、Arnold Eskinは、サーカディアンクロックが入力経路、発振器、出力経路を有すると概念化した(Eskin, 1979)。現在では、これがシステムの単純化しすぎであることがわかっているが(Roenneberg and Merrow, 1998; Duguay and Cermakian, 2009; Ince et al 2019; Reinke and Asher, 2019)概日組織を概念化するための有用なツールであることに変わりはない。入力経路は、ツァイトゲーバーの信号を処理する。ツァイトゲーバーとは、生物や細胞が時間帯に同期するために用いる、環境から発せられる規則的で予測可能な信号のことである。人間の行動にとって、光は主なツァイトゲーバーであり、視床下部の視交叉上核(SCN)(人間の行動のペースメーカー)を直接支配する特殊な網膜細胞を介して作用する。人間の同期化を妨げる要因としてよく知られているのは、自然の光環境が脳に忠実に表現されないように、光への露出を自己規制したり、社会的に規制したりすることである。これは、寝るときに電気を消して目を閉じたり、室内で生活することで明暗サイクルの振幅を変化させたり、極端な例では、シフトワークによって光環境のタイミングを変化させたりすることで行われる。「誤った時間に生活する」(シフトワーク)ことがもたらす影響は深刻である。長期のシフト勤務者は、メタボリックシンドローム、冠状動脈性心疾患、およびある種のがんのリスクが高まる(Schernhammer et al 2001,2003,2006,Vetter et al 2016)。社会的時差ぼけと呼ばれる現象は、社会的時計(学校や職場など)と体内時計の不一致によるタイミングのずれが一般的に小さくなることを指す(Roenneberg er al)。 社会的時差ぼけは、行動的・生理的な障害によっても特徴づけられる。比較的短時間の非同期状態であっても、代謝障害が生じることは注目に値する。強制的な非同期化と呼ばれる実験プロトコルでは、被験者を短周期または長周期のツァイトゲーバーサイクルに同期できない状況に追い込むのだが、その結果、被験者は1日24時間程度の生理的振動を示し続けるが、糖尿病予備力であることが明らかになった(Scheer et al 2009)。経度的な旅行やシフトワークで発生するような制御された位相シフトの一般的な結果は、概日時計の振幅の減少である(Dijk er al 2012)。
生物全体の同期に加えて、我々の中の各細胞も概日時計を持っている。実際、生物の時計は、個々の細胞の概日時計の上に成り立っている。これらの時計は、内因性ツァイトゲーバーのカクテルに反応して、その同期を図っている。すでに2000年にBasolobre et al 2000b)は、環状アデノシン一リン酸(cAMP)アナログ、デキサメタゾン、プロテインキナーゼC、およびCa2+が、Rat-1線維芽細胞における時計遺伝子の振動を同期させ、位相をシフトさせることを示した。これが人間の同調と時計制御遺伝子の発現に関係することは、グルココルチコイドを1日1回、午後に投与することで、末梢血単核細胞(PBMCs;Cuesta er al 2015)における時計遺伝子発現の再同調が生じることで示された。重要なのは、栄養摂取のタイミングが、肝臓での時計遺伝子発現のタイミングに顕著な影響を与えることである。実験では、末梢器官におけるリズミカルな遺伝子発現のタイミングや位相が、組織やツァイトゲーバーの相対的な強さに応じて、SCNのそれ(光を用いてエントレイン)や肝臓のそれ(食物を用いてエントレイン)に似てくることが示された(Stokkan er al)。 細胞時計は、生物レベルで観察されているように、不規則なツァイトゲーバーのタイミングによって振幅が減衰し(Cuesta et al 2015年)概日システムの調節不全につながる可能性がある。明らかに、同調または同期は、概日時計の支配的な特徴である。
振動子のメカニズムに関して、遺伝子データは、転写因子ネットワークが活性化と抑制の間でトグリングして、分子レベルで毎日のタイミングを実行することを示している(Aryal er al 2017)。他のすべての既知の転写因子と同様に、時計は大規模な多量体タンパク質複合体で動作する。この式は、毎日のタイミングを微調整するための多くの機会を生み出す。時計調節因子のいずれかの転写、翻訳、翻訳後修飾のタイミングの変化、およびツァイトゲーバーの時間構造の変化により、発振器の特性が根本的に変化し、その結果、同期特性が変化する可能性がある。
出力経路は時計の針のようなもので、時計制御の制御に影響を与える。リズミカルな遺伝子発現-プロセスの中心にあると考えられている転写因子を超えて-は、一般に組織特異的である(Zhang er al 2014)。歴史的には、精巣や胸腺という、時計制御の遺伝子発現を欠く組織があることが報告されている(Alvarez and Sehgal, 2005)。最近では、ヒヒのトランスクリプトームがこれらの組織でリズムを示していた(Mure er al 2018)。すべての組織が、分子レベルで日常的な時間構造を示しているのかもしれない。外挿により、すべての組織が機能的で組織特異的な概日時計制御を示すことを示唆している。
SARS-CoV-2の生物学および病理学と概日時計の関連性
重症のCOVID-19患者の感染から病状までのプロセスに、リズムを関連付ける理由はあるのだろうか?これについては、ウイルスが(さまざまな程度の)病態を引き起こす生物学的なレベルから、概日時計が症状の抑制や悪化にどのように寄与しているか、さらには臨床的な重症患者の環境を考慮して検討することができる。これらの側面のいずれもが、介入のための新たな機会につながる可能性がある。
ウイルスの生物学に関して、ACE2,TMPRSS2,FURINの時計は細胞内で制御されているのであろうか?我々は、若くて健康なオスのヒヒの24時間にわたる64の組織での遺伝子発現を記載したデータベースを照会した(表1;Mure er al 2018)。これらの遺伝子は広く発現しており、BACE2(ヒヒのACE2オルソログ)とFURINは、すべてのアッセイした組織でシグナルを与えている。TMPRSS2も同様に、海馬、後頭葉、網膜を除いて広く発現している。しかし、これらの遺伝子に対応するRNAの発現にリズムが生じることは稀である。ACE2の遺伝子は腹筋でのみ発現が見られる。TMPRSS2のRNAは、卵巣脂肪組織でのみリズミカルに発現する。FURINをコードするRNAは、9つの組織(膀胱、角膜、心臓、腓腹筋、睾丸、甲状腺、脳の3つの領域)でリズミックに発現していた。ホモジナイズしたマウスやヒトの肺サンプルで測定したACE2遺伝子の発現は、リズミカルな発現を示さなかった(Zhang et al 2014,Ruben et al 2018)。しかし、肺は40以上の細胞タイプからなる高度な細胞の多様性を有している(Franks et al 2008,Montoro et al 2018,Reyfman et al 2019)。ACE2が特定の細胞型で、刺激物に吸入暴露された患者で、あるいは慢性肺疾患の設定で、リズミカルに発現する可能性は残されている。
表1 ヒヒから分離した組織における重症急性呼吸器症候群新型コロナウイルス関連遺伝子の発現の日周リズム(Mure er al)。
| 遺伝子 | 組織 |
|---|---|
| BACE2(BABOON ACE2) | 腹筋 |
| TMPRSS2 | 大網脂肪 |
| フーリン | 膀胱 |
| 角膜 | |
| 心臓 | |
| 淡蒼球内側 | |
| 腓腹筋 | |
| 前頭前皮質 | |
| 睾丸 | |
| 甲状腺 | |
| 視床下部腹内側核 |
略語 ACE2 = angiotensin-converting enzyme 2(アンジオテンシン変換酵素2)。
ACE2(アンジオテンシン変換酵素2)は、重要な抗炎症作用を持つアンジオテンシン2をアンジオテンシン1-7に加水分解することを触媒する(Kuba er al)。 その結果、ACE2レベルとCOVID-19の臨床的重症度の関係は、一見しただけではわからないほど複雑である。例えば、ACE2およびアンジオテンシン1-7レベルは、臨床的に重篤なCOVIDのリスクが高い高齢者では低下する傾向がある(AlGhatrif et al 2020,Miller et al 2020)。この場合、ウイルス侵入時にACE2レベルが低下することで得られる利益は、高齢者ではアンジオテンシン1-7の量が減少することで生じる宿主の炎症反応の拡大によって明らかに打ち消されている。肺でのACE2レベルのリズムはまだ示されていないが、血液中のACE2は日内変動を示す(Veglio et al 1987)。RASはまた、PER2やBMAL1などの中核的な時計遺伝子の発現を調節することによって、概日時計に影響を与えることが示されている(Nonaka et al 2001)。
細胞内のウイルス処理に関与する生物学的機能(リソソーム、エンドサイトトラフィッキング、および様々な細胞外プロテアーゼ)は、一般的に活動の概日振動を示す(Mazzoccoli et al 2015,Cuddapah et al 2019,Chang et al 2020)。一般的に、ウイルスの細胞生物学における単一のリズミカルな律動制限ステップは、プロセス全体にリズミカルさを課すのに十分である。したがって、生体内試験のウイルス処理にリズムをもたらす可能性は数多くある。
COVID-19を発症した重症患者の病態悪化に概日時計がどのように関与しているかについては、いくつかの症状が特に重要である。これらの患者は、呼吸不全、微小血液凝固現象、サイトカインストームを経験する可能性がある。これらのそれぞれに関わる分子機構は、概日時計によって制御されている。例えば、ヒトの呼吸機能では、力学(気道抵抗と流れの特性)過呼吸に対する換気反応、吸入アレルゲンに対する気道反応に時計の調節が見られる(Shimoda and Semenza, 2011)。COVID-19で起こりうる低酸素性呼吸不全に関しては、概日時計が低酸素誘導因子1α(HIF1a;Adamovich et al 2017;Peek et al 2017)の作用を介して細胞の酸素化状態に敏感であることに留意することが重要である。そのため、COVID-19の呼吸不全とその治療は、他の急性肺損傷で説明されているのと同様に、肺における時計制御遺伝子の発現を変化させる可能性が高い(Jafri et al 1992;Richardson Jones et al 1996;Bremner et al 2000;Numminen et al 2000)。凝固カスケードに関しては、凝固機能と凝固因子の両方が複雑な時間帯の違いを示している。いくつかの研究では、ヒトの血小板機能(血小板数および活性化)内皮機能、およびいくつかの凝固・線溶パラメータ(活性化第VII因子、第IX因子、β-トロンボグロブリン、血小板第4因子、およびフィブリノゲン;Rosing et al, 1970年、Tofler et al 1987年、秋山 et al 1990年、Willich et al 1992年、1993年、Etsuda et al 1999年、Ündar et al 1999年、Guagnano et al 2000,Ringqvist et al 2000,Gaenzer et al 2001,Osmancik et al 2004,Otto et al 2004,Rudnicka et al 2007)がある。) 概日時計は、内在性および外在性の凝固経路を調節することが示されており、異なる凝固パラメータのリズムの位相関係は、動脈硬化(例えば 動脈(心筋梗塞、心臓突然死、脳梗塞、Willich et al 1993年、Montagnana et al 2009)および静脈(深部静脈血栓症、肺塞栓症など)の血栓塞栓症イベントや出血現象(脳内出血、大動脈瘤の破裂、Maemura et al 2006,Maas et al 2020c)の頻度が概日変化することが知られているが、これに貢献している可能性がある。
サイトカインの発現に関しては、サイトカインをコードする遺伝子の転写も、サイトカインの放出の促進も、時間的に強く制御されている。時計タンパク質は、ある種のサイトカインの活性化因子であり、ある種のサイトカインの抑制因子であることが知られている(Timmons er al 2020)。時計の調節は、マクロファージや単球(図2)だけでなく、T細胞についても行われているため、これらの細胞の病原体に対する免疫応答に影響を与えている(Scheiermann er al 2018)。機械的に換気されたCOVID-19患者は、I型インターフェロン応答が抑制されている可能性が示唆されている(Hadjadj et al 2020)。ここでのズレがサイトカインストームの発生確率に影響を与える可能性がある。この点については、COVID-19に関する時計と免疫系の関連論文で述べられている。
図2 重症患者のサーカディアンリズム
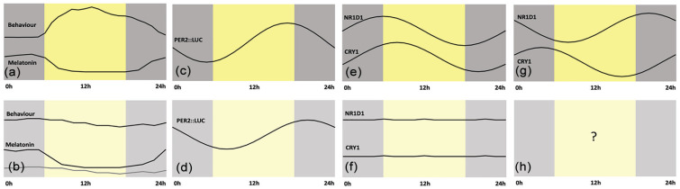
(a) 健康な人の日常行動とメラトニンプロファイル。(b) 神経系や全身の重症患者の集中治療室では、行動リズムは見られず、メラトニンリズムは重症度(グラスゴー・コーマ・スケールで特徴づけられる)や投薬(加圧剤の使用の有無)に応じて様々な変化を示す。データはMaas et al 2020c)より。(c) 肺のレベルでは、マウスを用いた実験により、低酸素状態ではPER2::LUCトランスジーン(d)の発現が約4.5時間遅れることが示されている。Manella et al 2020)のデータ。(e)末梢血単核細胞は、重症患者の細胞では見られないNR1D1およびCRY1遺伝子発現のリズム(f)を示す。Maas et al 2020a)のデータ。(g)これらの同じ遺伝子、NR1D1とCRY1は、健康なヒトから得られた単球では、発現の位相に8時間の差がある。Wittenbrink et al 2018)のデータ。(h)重篤な患者のこれらの細胞における分子リズムの状態はわからない。時間は外部時間(ExT)として表現されており、これは午前0時から24時間実行される慣例である(Daan er al 2002)。
COVID-19と時間薬理学
COVID-19を緩和する治療法の開発は、非常に注目されている分野である。現在、重症患者が利用できる治療法には、グルココルチコイドやトシリズマブなどの抗炎症薬、レムデシビルなどの直接抗ウイルス薬、そして回復期血漿から得られるSARS-CoV-2中和抗体などがある。COVID-19患者におけるこれらの薬剤の有効性に、時間帯が関与しているかどうかは不明である。しかし、多くの薬剤の薬物動態や薬力学は24時間で変化することが知られており、それに伴い、化学療法の効果や耐性(Dallmann et al 2016年)ワクチン接種の抗体反応(Long et al 2016)も同様である。最近の研究では、現在使用されているすべての薬剤の約50%が、概日制御下にある遺伝子の産物を標的としていることが示されている(Anafi et al 2017)。最後に、ある種の手術(大動脈弁置換術など;Montaigne et al 2018)の結果も時間帯によって異なる。時間帯の違いは、最大の有効性と成功の時間を反映しているのかもしれないし、代わりに最小の副作用の時間を反映しているのかもしれない(Ballesta er al)。
最近では、WHO Rapid Evidence Appraisal for COVID-19 Therapies(REACT)ワーキンググループによるプロスペクティブ・メタアナリシスでは、7つの試験、合計1703人の患者のデータがプールされ、全身性コルチコステロイドの投与は、重症のCOVID-19患者における28日死亡率の低下と関連することが示された(Horby et al 2020,Sterne et al 2020)。強力な抗炎症作用で一般的に知られているグルココルチコイドは、ほとんどの細胞で細胞の概日時計を同期させる作用もある。興味深いことに、デキサメタゾンはSCNの時計には作用せず、非ペースメーカー細胞の時計にのみ作用する(Balsalobre et al 2000a)。理論的には、グルココルチコイドの投与は、患者の末梢時計を同期させる可能性があるが、重篤な疾患の環境下でグルココルチコイドがこれを可能にすることを示した研究はない。COVID-19に対するグルココルチコイドの有益な効果が、概日リズムの調節に起因するかどうかは不明だが、今後の調査課題である。COVID-19の研究者が注目したのは、概日リズムのもう一つの強力な同調者であるメラトニンである(Cardinali et al 2020,Zhou et al 2020b)。COVID-19の疑いで検査を受けた患者の大規模な登録では、メラトニンの日常的な使用はCOVID-19定量的ポリメラーゼ連鎖反応(qPCR)の結果が陰性であることと統計的に関連しており、メラトニンがSARS-CoV-2の複製を抑制する可能性が示唆された(Zhou er al)。 メラトニンは現在、SARS-CoV-2の抗ウイルス療法の可能性として研究されている(Rodríguez-Rubio et al 2020)。
COVID-19に対するクリティカルケア環境とサーカディアンクロックの影響
ICUの環境が患者の概日時計に影響を与える可能性は、何年も前から認められている。このことは、通常の環境因子への曝露が制限された状態で長期のICU滞在を必要とするCOVID-19重症患者に特に関係している可能性がある。ICUは、低い、非循環または弱い循環の光環境と、機器やアラームによる過剰なノイズを特徴とすることがよく知られており、正常な睡眠を妨げる条件となっている(Boyko er al 2017)。さらに、多くの患者は様々な医学的問題のために鎮静状態にあり、明暗サイクルの行動制御が妨げられている。さらに、栄養補給は、より生理的なボーラスではなく、静脈内で継続的に行われる。さまざまな方法により、ICU患者の多くが概日リズムを抑制しているか、あるいは不適切に同期していることが確認されている。例えば、(Gazendem et al 2013)は、APACHE IIIスコアが高いことで定義される重症患者では、体温のリズムの位相がより多くの時間ずれていることを示した。最近の論文では、この一般的な知見が確認されたが、心拍変動を指標として用いている。(Knauert et al 2015)は、ほとんどの患者(80%以上)が毎日のリズムを示しているが、ICUでの最初の2日間ですでに、リズムの位相が対照集団に比べてずれていることを発見した。これらの観察結果から、COVID-19の重症患者の多くは概日リズムを持っている可能性があるが、巻き込み位相(自然日に対する同期)は正常ではなく、現在の情報では予測が困難であると予想される。
特定の重篤な疾患では、環境とは無関係に概日時計の調節が乱れることがある。神経学的または全身性の重症患者は、発病とともに急速に深い行動静止状態に入ることが示されており、その間、休息-活動リズムは重度の時間的混乱とメラトニンリズムからの解離を示した(Maas et al 2020c)。メラトニン振幅の減衰は、脳症の悪化と関連しているが、脳症の改善はメラトニン振幅の対応する変化とは関連していなかった(Maas er al)。 肺における酸素化状態の変化は、肺における時計遺伝子発現の位相をシフトさせることができる(図2cおよびand2d;2d;(Manella er al 2020))。さらに、ICUでは概日遺伝子の発現が減衰する(図2eおよびand2e;2e; (Maas et al 2020a))。サイトカインの産生を介して急性炎症に関与し、サイトカインストームに寄与する可能性のある細胞における時計の状態に関しては、重要な問題が残っている。現在までに報告されている最も振幅の大きい概日リズムのいくつかは、腹膜マクロファージで発生している(Keller er al 2009)。PBMCの単球サブセットは、全血球集団と比較して時計遺伝子発現の間に明確な位相関係を示す(図2g vs vs2e;2e; (Wittenbrink et al 2018))。これらの細胞が重症患者やICUにいる患者でどのように機能しているかは知られていない(図2h)。
興味深いことに、強い生理的ストレス因子は、動物モデルにおいて睡眠に似た行動静止状態を誘発することができ、これは、細胞のホメオスタシスを回復し、細胞のストレスから回復する保護メカニズムと同時に起こる(Hill et al 2014,Iannacone and Raizen 2016,Nath et al 2016,Trojanowski and Raizen 2016)。重症時には、従来の脳波(EEG)上の正常な睡眠アーキテクチャが頻繁に消失し、健康な状態の睡眠でも覚醒でもないさまざまな異常パターンに置き換えられる。そのため、従来のEEGによる睡眠のスコアリング法を適用し、根本的な睡眠関連の神経生理学的プロセスを重症患者に推測することは困難である(Watson, 2007; Watson et al 2013; Schabus et al 2018; Wislowska er al)。
ICUに入院した患者の30%近くがせん妄を発症し、死亡リスクが高まる(Salluh er al 2015)。COVID-19患者は、(1)中枢神経系(CNS)への直接的な侵襲、(2)中枢神経系炎症メディエーターの誘導、(3)非脳器官系不全の二次的影響、(4)鎮静戦略の効果、(5)機械的換気の延長、(6)固定化、(7)家族のいない隔離、などの複数の要因により、せん妄のリスクが高まる(Kotfis et al 2020)。したがって、COVID-19感染の重症患者では、せん妄の割合が高い(最大84%)ことが報告されている(Helms er al 2020a)。基礎研究では、概日時計とせん妄の関連性が示唆されている。動物モデルでは、恒常的な光曝露、炎症、ミダゾラムの曝露により、せん妄様の表現型(すなわち、実行機能と記憶機能の低下)が誘発され、SCNにおけるPER2の発現が低下する。このせん妄様の表現型は、PER2エンハンサーであるノビレチンによって消失した(Gile er al)。
概日時計がICUで挑戦されていることは明らかであるが、重症患者の概日症状の起源がICU環境にあるとは断定できない。例えば、重症患者は、ICU環境に関係なく、概日時計に直接的な影響を与える可能性がある。さらに、我々は、無傷の概日システムは常に最適であるというバイアスを持って活動してきた。これは、短期的な時計の乱れによる代謝の乱れや、長期的な乱れによる慢性的な病態の増加が観察されていることも理由の一つである(Schernhammer et al 2001,Scheer et al 2009)。ストレスによって引き起こされる概日リズムの乱れや行動の静止は、むしろ別の適応メカニズムであると考えられる。これが正しいとすれば、生理的変数の日内リズムを回復させることは有害である可能性がある。言い換えれば、重症患者の「生体リズムの最適な状態」は、健康時のそれとは異なる可能性がある。
健康と知識のためのクリティカルケアパラダイムへのサーカディアンクロックの組み込み
ICUでのサーカディアンクロックの状態の発見
時間生物学者は、概日リズムが存在することが好ましい状態であると考えるように偏りがちである。ここでは、検証可能な仮説をもって、曖昧な状況を明らかにした。我々の代替仮説は、概日時計をZeitgebersでサポートすることで、同調と日内リズムが得られ、これがよりよい結果につながるというものである。帰無仮説は、リズムの存在は増悪であり、重篤な疾患で時々見られるリズムの抑制は適応的であるというものである。これらの仮説は、ICUのステーションから連続的なデータを収集し、転帰と相関するリズム性と適切な同調位相を分析することで、記述的に検証することができる。ICUで日常的に収集されるデータ(体温、酸素飽和度、心拍数など)は、健常者でも概日リズムを示す。これらのデータを利用し、分析することができれば、膨大な量の情報を得ることができる。仮説は実験的に検証することもできる。例えば、体温リズムの概日リズムの位相、振幅、頑健性が、重度のCOVID-19による患者の転帰と関連するかどうかを調べることができる。
COVID-19で最もよく見られる合併症(凝固亢進/出血、サイトカインストーム)のメディエーターが概日時計によって広範囲に制御されていることを考えると、それらが1日のうちの別々の時間帯に起こることが予想される。このことを理解すれば、予防的な治療が可能になる。特にICUにおける内因性の概日時計の特性についてより深い知識がなければ、これらの合併症の時計制御を正しく判断することはできない。必要とされているのは、血圧、心拍数、体温などの低侵襲的な測定と、少なくとも2サイクルにわたる連続的な末梢血サンプリングを含む、ICU患者の潜在的な概日出力の包括的なアトラスである。このデータセットから、ICUに適した概日時計のバイオマーカーを導き出し、患者の概日プロファイル(リズミック/ノンリズミック、振幅、位相)を決定し、合併症のリスクが最も高い体内時間や、最適な薬の投与スケジュールを評価することができる。
ICUでのツァイトゲーバーサイクルの実施
鎮静状態や敗血症の患者に、明暗や半減期が24時間未満のコルチコステロイドの投与など、振幅の大きいツァイトゲーバーを投与することは困難である。グルココルチコイドの投与は、免疫抑制などの生命を脅かす可能性のある副作用とのバランスを考慮する必要があり、夜間に患者のために暗い環境を作ることは、患者のケアを妨げる可能性がある。一方、栄養補給のタイミングを変更することは、多くの患者にとってICUでは可能であり、末梢時計を整える可能性がある。鎮静状態の患者に、通常の摂食行動を模倣してICUで断続的に食事を提供する試みは知られていない。ICUでの食事はどのようにして行われ、栄養療法はどのようなものか?重症患者の栄養療法に関する臨床試験やガイドラインは、最適なタイミング(開始時期が早いか遅いか)投与経路(胃ろうか空腸か非経口か)カロリー・タンパク質の目標値に主眼が置かれている。重症患者の人工栄養療法としては、経腸栄養法(EN)が推奨されている。自発的な摂取を維持できない重症患者では、腸閉塞、活動性消化管出血、および脾臓循環の悪化など、ENを遅らせる理由がない限り、24~48時間以内に早期のENという形で栄養支持療法を開始することが推奨される(Taylor et al 2016,Singer et al 2019)。
ENの投与には、連続法、周期法、間欠法、ボーラス法などいくつかの方法が存在する。連続給餌は、給餌ポンプを補助して24時間にわたって1時間ごとにENを投与することを含み、周期的給餌は、一般的に給餌ポンプを補助して24時間未満の期間にわたってENを投与することを含み、断続的給餌は、ポンプ補助または重力補助を介して4〜6時間ごとに20〜60分にわたってENを投与することを含み、ボーラス給餌は、注射器または重力点滴を使用して4〜10分にわたってENを投与することを含む。
実際には、誤嚥、摂食不耐性/高胃酸残量、過少摂食、下痢などのENに関連する合併症を軽減するために、重症患者にはポンプアシストによる連続栄養補給が一般的に受け入れられている。しかし、この実践を支持する研究は限られている(Hiebert et al 1981年、Kocan and Hickisch、1986年、Ciocon et al 1992年、MacLeod et al 2007)。人工呼吸器を装着した重症の成人を対象にボーラス栄養と連続栄養を比較した小規模な無作為化対照研究では、連続栄養のほうが中断が少なく量も多いことが示されているが、患者の転帰に関しては栄養法の間に有意な差はない(Hiebert et al 1981年、KocanとHickisch、1986年、Ciocon et al 1992年、Bonten et al 1996年、Steevens et al 2002,MacLeod et al 2007)。既存のエビデンスに基づいて、クリティカルケア医学会(SCCM)および米国非経口・経腸栄養学会(ASPEN)は、摂食不耐性の場合にボーラスから間欠的なENに切り替えることを提案しているが、欧州臨床栄養・代謝学会(ESPEN)はボーラスENではなく連続的なENを推奨している(グレードB-強いコンセンサス;Taylor et al 2016)。
時間制限付き摂食(TRF)は、末梢組織の代謝同調を介して生体リズムをリセットするアプローチである。ENを受けている重症患者に対して、昼夜のサイクルに関連して給餌のタイミングを最適化することで、サーカディアンリアライメントを追求する可能性を探る時期に来ているのかもしれない(Sunderram et al 2014)。現在のところ、ICUにおけるボーラス栄養または連続栄養における給餌のタイミングの効果を調査した研究は行われていない。今後の調査では、臨床現場で収集可能な末梢組織におけるリズムのバイオマーカー候補(マイクロバイオーム、メタボロミクス/トランスクリプトミクスなど)や、臨床的に意味のあるアウトカム変数を熟考して選択する必要がある。
まとめ
COVID-19パンデミックには、無症候性キャリアの行動、病人の臓器生理、感染細胞内でのウイルスのライフサイクル、宿主の免疫反応など、概日リズムやその他の生物学的リズムと関係があると思われる多くの側面がある。生物学的には妥当であるにもかかわらず、健康的な睡眠とサーカディアンリズムの潜在的な保護効果については、あまり注目されていない。興味深いことに、ICU環境や重症患者に関するデータを検討すると、睡眠や同期した時計が治癒に寄与するかどうか、またどのように寄与するかを示すデータがないことが指摘される。概日リズムの乱れが病気につながった例は数多くあるが、同期が治癒につながった例はほとんどない。タイムスタンプ付きのデータを適切に収集すれば、今回のパンデミックを利用して、概日時計が重篤な疾患にどのように関与しているかをより深く理解することができる。また、概日時計の状態を知ることで、COVID-19のすべての段階を緩和することができると提案している。
