Contents
Exercise immunology: Future directions
www.ncbi.nlm.nih.gov/pmc/articles/PMC7498623/
オンラインで2019年12月30日公開
概要
運動免疫学の分野では、数十年にわたる研究により、免疫系が急性および慢性の運動トレーニングに高い反応を示すことが明らかになっている。適度な運動は、免疫モニタリング機能を高め、長期的に繰り返すことで、複数の健康上の利点をもたらす。2010年以前に行われた研究のほとんどは、免疫機能に関連するいくつかの成果を対象としたものであった。過去10年間の技術的進歩により、運動免疫学にマルチオミクスとシステムバイオロジーのアプローチが可能になった。この記事では、運動免疫学に関連するメタボロミクス、リピドミクス、プロテオミクスの概要を、免疫代謝に焦点を当てて説明する。また、腸内細菌叢の組成や多様性が運動によってどのように影響を受けるかをまとめ、ヒトの健康や免疫への応用についても紹介している。運動による免疫機能の向上は、免疫老化や慢性疾患の発症に対抗する上で重要な役割を果たすと考えられるが、新たなオミックス技術によって、そのメカニズムがより明確に解明されることであろう。本レビューでは、運動免疫学に対するマルチオミクスのアプローチについて、現在わかっていることをまとめ、研究者のために今後の方向性を示す。
キーワード
運動、免疫学、リピドミクス、メタボロミクス、プロテオミクス
グラフィカルアブストラクト

1. はじめに
Journal of Sport and Health Science(JSHS)が最近発表した運動免疫学のレビュー1では、運動が免疫系に及ぼす急性および慢性的な影響、運動と免疫の関係がもたらす臨床的効果、運動に対する免疫反応に対する栄養の影響、免疫老化に対する運動の影響など、いくつかの重要な分野で研究成果がまとめられている。これらの知見は、「2010-未来」を含む4つの特徴的な時間軸に整理されている。技術の進歩により、将来的にはメタボロミクス、プロテオミクス、リピドミクス、腸内細菌叢の特性解析、運動免疫学へのゲノムアプローチなどが注目されるだろうという見解が示された。
これらのマルチオミクス手法を統合し、大量の低分子代謝物、脂質、タンパク質などの分子を同時に測定・同定することで、運動に対する多面的な免疫・代謝反応をシステム全体として捉えることができる2。同時に、これらのオミックス分野間のデータ統合戦略は、成功する精密医療の開発を向上させる3。
本レビューでは、免疫代謝の概要と、メタボロミクス、リピドミクス、プロテオミクスなどのシステムワイドなアプローチによる最近の知見を、運動免疫学に関連して紹介する。また、この総説では、腸内細菌叢の構成と多様性が、運動を含むさまざまな要因によってどのように影響を受けるか、そして、これらの要因が免疫機能とヒトの健康にどのように影響するかについてもまとめている。
2. イムノメタボリズム:運動による免疫細胞のエネルギー要求
細胞代謝と免疫学は半世紀以上前から関連しており、病原体によって引き起こされる免疫細胞の代謝変化を調べる研究は、少なくとも1950年代半ばまでさかのぼることができる6。しかし、ここ10年ほどの間に、免疫代謝と名づけられた分野への関心が爆発的に高まり、細胞の代謝リプログラミングと免疫細胞の機能との新たな関連性を報告する論文が、一流の科学雑誌に日常的に掲載されるようになった。
代謝による免疫の制御は複雑で、最近では多くの包括的なレビューが行われているが、免疫細胞にはいくつかの特徴があるようだ。免疫系細胞の活性化は、ほぼ共通して、解糖プログラムの強化によって支えられている。グルコース代謝は、マクロファージや樹状細胞における炎症反応7,8や、ヌクレオチド結合オリゴマー化ドメイン、ロイシンリッチリピート、ピリンドメイン含有(NLRP3)インフラマソームの活性化9,さらには、クラスター分化(CD)4+およびCD8+ T細胞やその他のリンパ球におけるエフェクター機能の基盤となっている10。11, 12, 13 このような解糖系の亢進は、脂肪酸代謝14では維持できない、免疫活性化時の急激なエネルギー需要を支えるものと考えられており、最大運動時に筋肉で見られるグルコース需要の増加に似ている。
対照的に、酸化的リン酸化の活性化は、一般的に免疫系の抗炎症、記憶、耐性プログラムをサポートする。M2マクロファージ15,16や制御性T細胞10,17は、持続性CD8+メモリーT細胞と同様に、酸素消費量や脂肪酸代謝の増加を示している18。これらの変化は、ミトコンドリア生合成やミトコンドリア機能の向上19や、脂肪酸トランスポーターであるカルニチンパルミトイルトランスフェラーゼ(CPT)1A20などの脂肪酸酸化遺伝子のアップレギュレーションによって特徴づけられることが多く、細胞寿命の延長や炎症の解決をサポートする機能プログラムを促進すると考えられている14。また、ペントースリン酸経路、トリカルボン酸(TCA)サイクル、さまざまなアミノ酸代謝経路や脂肪酸合成経路も、免疫機能の制御や免疫細胞の表現型の決定に重要な役割を果たしている。これらの経路の詳細な検討については、最近の包括的なレビューを参照されたい14。
トランスレーショナルな観点から見ると、免疫代謝の異常はさまざまな疾患と関連している。肥満は、脂肪組織への免疫浸潤を特徴とし、炎症によるインスリン抵抗性を引き起こし、最終的には糖尿病を発症させる21。肥大した脂肪組織に浸潤する免疫細胞は、主に炎症性の性質を持ち、解糖系代謝に依存し、腫瘍壊死因子-α、インターロイキン(IL)-1β、IL-6などのサイトカインを大量に産生するエフェクターCD4+、CD8+、M1様マクロファージサブタイプが増加している。免疫細胞の代謝に影響を及ぼす遺伝的変化は、マクロファージ22,23や制御性T細胞で明らかにされているように、インスリン抵抗性などのメタボリックシンドロームの指標を制御する。24 免疫細胞の代謝リプログラミングは、さらに、さまざまな心血管疾患にも関与している25,26。例えば、酸化した低密度リポタンパク質でマクロファージを刺激すると、解糖系の活性化27が促進され、泡沫細胞の形成が誘導される28。最後に、生理的加齢に伴う免疫代謝の変化は、樹状細胞31,単球32,33,34,T細胞35など、いくつかの種類の免疫細胞で研究されており、これらの研究のいくつかでは、ミトコンドリア機能障害が加齢に伴う免疫老化に特徴的な免疫細胞機能の変化に関与している、あるいは関連しているとされている。免疫細胞の代謝リプログラミングと疾患の進行が密接に関連していることを考えると、免疫代謝を標的とした介入は、様々な疾患の治療に多大な可能性を秘めている。
運動が代謝に与える基本的な影響と、運動が免疫機能に与える影響はよく知られているが、運動と免疫代謝に関する研究はこれまでほとんど行われていない。いくつかの研究では、運動をしている人の末梢血単核細胞において、ミトコンドリア機能の向上を示す転写反応が示されている37,38。この観察結果は、運動トレーニングが、免疫細胞をより酸化的な表現型に偏らせることで、抗炎症効果の一部を媒介する可能性と一致している。このことは、高強度インターバルトレーニングと中強度連続トレーニングの両方が、激しい運動によって誘発されるミトコンドリア機能の低下を抑制するという知見によっても裏付けられている39。運動が免疫代謝に及ぼす急性期の影響についてはほとんど知られていないが、ある研究では、運動中に炭水化物を補給することで、単球におけるリポ多糖刺激後の特徴的な酸素消費量の抑制を無効にすることが示されている40。
運動と免疫代謝に関する文献は少ないが、既存の研究と身体活動の既知の効果との間には多くの関連性があり、運動が免疫細胞の代謝(ひいては機能)を強力に調節する可能性が示唆されている。多くの収縮誘発性のミオカインと非筋肉由来のエクセルカイン(Exerkine)が免疫代謝を制御することが知られているが、これを実証した研究は運動の状況では検討されていない。特に、IL-6とIL-10は運動後に増加し41,42,酸化的代謝を促進する経路を介してマクロファージの抗炎症反応を促進する43,44。IL-1raは、炎症を起こすTヘルパー(TH)17細胞のグルコース代謝を抑制し、その機能を制限する45。また、ミオネクチンは、細胞内の代謝調節因子であるプロテインキナーゼB(Akt)を阻害することで、マクロファージの炎症反応を抑制する46。
細胞内の栄養センサーもまた、免疫代謝の調節に大きな役割を果たしており、したがって、運動は、栄養摂取量の変化やこれらの細胞内シグナル分子への直接的な影響を通じて、免疫細胞の代謝プログラムを変化させる可能性が高い。免疫系では、AMPKはマクロファージ50,51,樹状細胞8,T細胞の炎症活性化を抑制する役割を果たしている。AMPKはまた、ラパマイシンの機械的標的(mTOR)の活性を制限する役割も果たしている55。mTORは、運動によって制御される細胞のエネルギーセンサーでもあり56,免疫系では、複数の白血球サブタイプにおいて解糖系経路を活性化し、炎症やエフェクター機能を高める役割を果たしている57, 58, 59。12,61 HIF-1αは、運動時の低酸素状態によっても刺激され62,低酸素誘導HIF-1αは、脂肪組織におけるマクロファージの極性を調節することが示されている63。最後に、ニコチンアミドアデニンジヌクレオチド(NAD+)センサーであるサーチュイン1(SIRT1)は、複数の免疫細胞タイプにおいて抗炎症および寛容プログラムを促進し64, 65, 66,T細胞67やミエロイド細胞では脂肪酸酸化を促進する。
最近では、特定の中間代謝産物が免疫機能の制御に果たす役割にも注目が集まっている。特に、解糖系とクレブ系の副産物である乳酸とコハク酸は、さまざまな種類の免疫細胞の活性を変化させることが明らかになっている。コハク酸は、クレブスサイクルの中間体としての役割に加えて、炎症反応を引き起こす化学的メッセンジャーとして機能し69,乳酸は、T細胞70では炎症性表現型を促進し、単球では抗炎症性表現型を促進する71。また、最近、乳酸はマクロファージにおいてヒストンを直接修飾することが明らかになっており73 、免疫機能のエピジェネティックな制御に関与していると考えられている。さらに、クレブスサイクルからアコニット酸が切り離されて生成される代謝物であるイタコン酸(Itaconate)は、マクロファージにおいて強力な抗炎症作用を示すことが最近報告された。今日まで、運動がイタコン酸に与える影響を調べた研究はない。したがって、この分子は、免疫代謝物と運動の研究を進める上で、すぐに役立つものである。
したがって、運動免疫学と免疫代謝学の間には、多くの興味深い未解決の問題がある。運動トレーニングによるミトコンドリア機能の向上、脂肪酸酸化の増加、および抗炎症性免疫の極性化の間の潜在的な関連性を扱う研究が必要であり、また、激しい急性運動による一時的な代謝リプログラミングと一過性の免疫抑制の間の関連性を調査する必要がある。運動は、ミオカインやエクセルカインの分泌、細胞のエネルギーセンサーの調節、免疫代謝調節物質の蓄積、あるいはその他の手段によって、免疫細胞の代謝を再プログラムする可能性がある。これらの分野のメカニズムを知ることで、免疫細胞の特定の代謝経路を狙い撃ちして、必要に応じてその機能を高めたり抑えたりするために、運動(栄養や医薬品との併用も可能)戦略を用いた臨床試験を行うことができる。さらに、肥満、心血管疾患、一部の癌など、運動で改善可能な疾患における免疫代謝を研究することで、身体活動がその既知の効果を媒介するメカニズムに光を当てることができる。
3. マルチオミクスとシステムワイドなアプローチ
免疫系は、運動負荷による生理的ストレスに反応する。適度な運動は、リンパ組織と循環系の間で行われる免疫細胞の交換を促進し、免疫モニタリングと免疫防御活動を向上させる。一方、高負荷の運動とそれに伴う生理的・代謝的ストレスは、一過性の免疫障害、炎症、酸化ストレス、筋肉の損傷、病気のリスクの上昇につながる1。このパラダイムシフトは、測定技術とバイオインフォマティクスの飛躍的な進歩によってもたらされたものである。3 マルチオミクス手法から得られるデータは、運動が免疫機能に与える影響についての将来的な理解を大きく変えることになるであろう(図1)。
図1
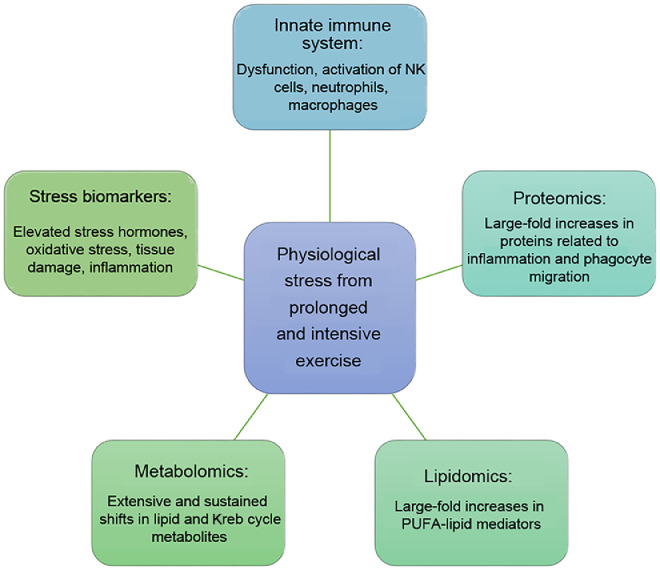
長時間の激しい運動による生理的ストレスを測定するための、免疫、ストレス、マルチオミクスのアプローチ。NK=ナチュラルキラー、PUFA=多価不飽和脂肪酸。
3.1. メタボロミクス
77,78 ヒトのメタボロームは、ペプチドやアミノ酸、脂質、核酸、炭水化物、有機酸、生体アミン、ビタミン、ミネラル、異生物や薬物など、人間が接触するその他の化学物質を含む114,000以上の同定および予想される代謝物で構成されている79。
ハイスループットなメタボロミクスを実現するためには、何千もの化学標準物質を備えた高感度の質量分析プラットフォーム、厳格なサンプル抽出および処理手順、正確な品質管理およびメタボライト同定プロトコル、高度なバイオインフォマティクスサポートが必要です77,81。メタボロミクスで使用される主な分析プラットフォームには、核磁気共鳴、ガスクロマトグラフィー分光分析 (GC-MS)、液体クロマトグラフィーとタンデム質量分析の組み合わせ (LC-MS/MS) がある。LC-MS/MSは、核磁気共鳴に比べて10~100倍の感度を持ち、分析プラットフォームとして好まれている82。
40,83,84,85,86,87,88,89,90,91 メタボロミクスに基づいたアプローチは、多様な経路の何百もの代謝物の変化を同時に測定することができるため、運動と栄養の介入を組み合わせた研究において特に有効である。過去10年間に発表された24の質の高い論文を系統的にレビューした結果、メタボロミクスに基づく運動研究の主な焦点は、長時間の高強度有酸素運動による急性期の代謝物の変動であることがわかった83。
LC-MS/MS分析プラットフォームを用いた典型的な研究では、2時間以上の激しい運動を行ったヒトのアスリートから採取した血漿サンプルにおいて、300種類以上の同定された代謝物の変化を測定することができる40,83,90,91。この反応には、運動後の血漿中・長鎖脂肪酸、ケトン体、脂肪酸酸化産物、硫酸化胆汁酸の増加と、血漿トリアシルグリセロールエステル、一級・二級胆汁酸、リン脂質の減少が含まれる83,91。
図2は、長時間の激しい運動によって生成される最も重要な代謝物を表すターゲットパネルとして選択された26種類の代謝物の平均倍数増加をまとめたものである85,91。このターゲットパネルは、ターゲットを絞らない方法と比較して、長時間の運動をベースにした研究に低コストで使用することができる。運動後に増加した26種類の代謝物のうち、重要度が2.0以上のものは1種類を除いてすべて脂質スーパー経路のものであった。血漿中のグリセロールが並行して増加していることから、持久系アスリートが集中的な持久運動を行った後、脂肪酸が大量に動員されていることがわかる。長時間の集中的な運動後の血漿中の代謝物の変化のほとんどは、数時間以内に最下点に達し、1日後の回復時にはほぼ消失している。
図2

長時間の激しい運動によって誘発されるグローバルな代謝物の増加を示す、厳選されたターゲットパネルに含まれる26の代謝物の平均倍数増加85。
この論文の免疫代謝のセクションで強調されているように、運動後の血漿TCA代謝物の増加は、免疫および炎症の制御を促進し、それによって生理的ストレスからの回復を促進する可能性がある69,73。血漿中のアミノ酸濃度(ロイシン、イソロイシン、アスパラギン、メチオニン、リジン、アラニンなど)は、グルタミン酸、芳香族アミノ酸、オルニチンなどの尿素サイクル関連代謝物を除いて、一般的に長時間の激しい運動の直後に減少する。しかし、グルタミン酸、芳香族アミノ酸、オルニチンなどの尿素サイクル関連代謝物は例外で、持続的な運動から回復する1〜3日の間に、ほぼすべてのアミノ酸の血漿濃度が上昇する。このような運動後の血漿アミノ酸の変化は、グリコーゲンの枯渇に対応したグルコーゲン生成やTCAサイクルを介したアデノシン三リン酸の生成などの代謝要求をサポートする。83,85 リソリピドや胆汁酸の代謝に関連する代謝物の運動後の減少も起こるが、その生理的意義は現在のところ不明である。激しい運動は、主に細胞膜の内側の脂質二重層に存在するリン脂質の一種であるいくつかのホスファチジルエタノールアミン(PE)の有意かつ持続的な減少と関連している85。
イムノメタボリズムは、代謝物が免疫機能やその他の正常な生理学および病態生理学にどのような影響を与えるかについて新たな知見を提供している。代謝物は、アミノ酸、生体アミンホルモン、オキシリン、腸内由来のフェノール類や短鎖脂肪酸、乳酸、グルコース、コハク酸、クエン酸、トリカブト、ステロイドホルモンなど、化学的メッセンジャー、燃料、緩衝剤として、細胞の分化・活性化、免疫シグナル、炎症、病原体の検出・殺傷など、多くの免疫プロセスを制御するために使用される4,5,92。このような代謝産物の変化と運動による免疫反応との関連を示す直接的な証拠は限られており、今後の活発な研究課題となる。
3.2. リピドミクスとオキシリピン
リピドミクスは 2003 年に初めて紹介されたメタボロミクスの一分野である。93 脂質代謝物は 8 つのカテゴリーに分類され、それぞれが独自の下位分類の階層と識別番号 (www.lipidmaps.org) を持っている。8つの脂質カテゴリーには、脂肪アシル、グリセロ脂質、グリセロリン脂質、スフィンゴ脂質、ステロール脂質、プレノール脂質、サッカロリピド、ポリケチドが含まれる。
リノール酸(LA)(18:2n6)は、脂肪組織やヒトの食生活によく含まれる多価不飽和脂肪酸(PUFA)である。94 LAは摂取後、細胞の小胞体でより長い不飽和脂肪酸に変換される。エイコサペンタエン酸(20:5n3)とドコサヘキサエン酸(DHA)(22:6n3)は魚介類から直接摂取できるが、ヒトでは限られた範囲ではあるが、α-リノレン酸(ALA)(18:3n3)から合成することも可能である。
95, 96, 97, 98, 99 オキシリビンのほとんどは脂肪アシルであり、エイコサノイド、ドコサノイド、オクタデカンノイドに分類される。最も研究されているオキシリピンは、アラキドン酸(ARA)(20:4n6)から生成されるエイコサノイドである。また、LAやALAから生成されるオクタデカノイド、ジホモ-γ-リノレン酸(20:3n6)やエイコサペンタエン酸から生成されるエイコサノイド、アドレナリン酸(AdA)(22:4n6)やDHAから生成されるドコサノイドなども一般的なオキシリビンである96。
近年の質量分析技術の進歩により、検出されるオキシリピンの数は増加しており、多くの生理学的プロセスにおけるオキシリピンの重要な調節機能に対する認識が高まっている。95,98,99 オキシリピンは、生理的状況に応じて、有益なシグナル伝達物質として機能することもあれば、免疫機能障害や炎症のメディエーターになることもある。95,100 オキシリピンは、傷害や炎症などのストレス状態で、厳密に制御されて生成される。膜リン脂質のPUFAは、ストレス関連の刺激による細胞の活性化に応じて、ホスホリパーゼA2によって最初に放出される。放出されたPUFAは、シクロオキシゲナーゼ、リポキシゲナーゼ、シトクロムP450(CYP)酵素系によって代謝され、多数の多様なオキシリピンに変化する95,96。
100, 101, 102, 103, 104, 105 急性および慢性的な運動がオキシリピン生成に及ぼす影響は、新たな科学的試みの分野である106, 107, 108, 109, 110, 111, 112 運動による筋肉組織の損傷と炎症は、顆粒球、単球、マクロファージが関与する迅速かつ強固な自然免疫反応と関連している。データは限られているが、LAとALAの脱飽和経路に含まれる12種類のPUFAは、それぞれ集中的かつ長時間の運動時に動員される。40,90,114,115 運動に関連した多くのオキシリピンが産生され、その多くは回復後数時間の間に血漿や筋肉中で測定できるほど安定している(図3)。
図3
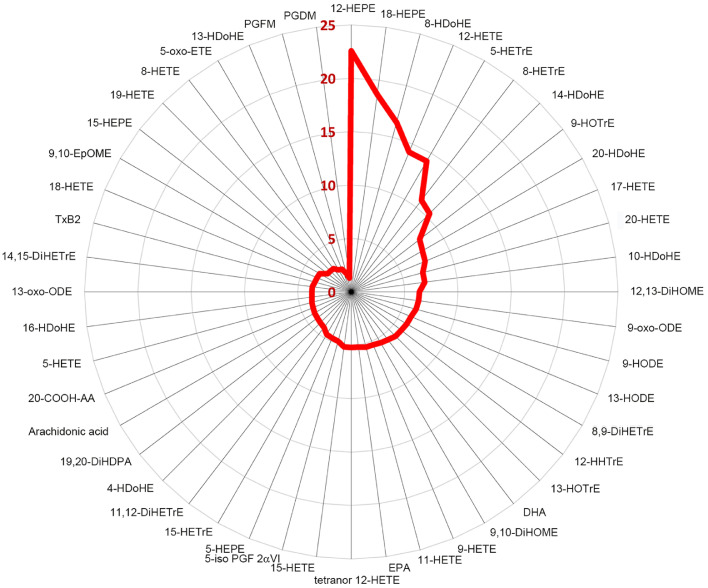
n=45種類のオキシリピンと基質脂肪酸であるアラキドン酸(ARA)EPA、DHAの運動誘発性増加(赤線で示した運動直後と運動前の比の値)104一晩絶食状態で75kmのサイクリングをした20名のアスリートから血液を採取した。5-iso PGF2αVI = (8ß)-5,9α,11α-trihydroxy-prostadienoic acid, 5-oxo-ETE = 5-oxo-eicosatetraenoic acid, 12-HHTrE = 12-hydroxy-heptadecatrienoic acid, 20-COOH-AA = 20-carboxy arachidonic acid; DiHDPA = ジヒドロキシ-ドコサペンタエン酸; DiHETrE = ジヒドロキシ-エイコサトリエン酸; DiHOME = ジヒドロキシ-オクタデセン酸; DHA = ドコサヘキサエン酸; EPA = エイコサペンタエン酸。EpOME = エポキシ-オクタデセン酸; HDoHE = ヒドロキシ-ドコサヘキサエン酸; HEPE = ヒドロキシ-エイコサペンタエン酸; HETE = ヒドロキシ-エイコサテトラエン酸; HETrE = ヒドロキシ-エイコサトリエン酸; HODE = ヒドロキシ-オクタデカジエン酸、HOTrE = ヒドロキシ-オクタデカトリエン酸、oxo-ODE = オキソオクタデカジエン酸、PGDM = プロスタグランジンD2代謝物、PGFM = 13,14-ジヒドロ-15-ケト-プロスタグランジンF2α、TxB2 = トロンボキサンB2。
今後の研究により、運動中および運動後における各タイプのオキシリピンの役割が明らかになると思われる。115,116 9,10-および12,13-ジヒドロキシ-オクタデセン酸はいずれもペルオキシソーム増殖因子活性化受容体リガンドであり、好中球の走化性を刺激するなど、幅広い作用を有する115。プロスタノイド(例:プロスタグランジンE2(PGE2)プロスタグランジンF2α(PGF2α))は、炎症促進効果を発揮したり、筋肉の適応や血流調節のための急性のシグナル分子として機能することがある107,117,118。激しい運動をした後に最も多く発生するオキシリピンは、n-6 PUFA基質であるARAから発生し、これらのエイコサノイドには、リポキシゲナーゼやCYP酵素から発生する少なくとも15種類のヒドロキシエイコサテトラエン酸やジヒドロキシエイコサトリエン酸(DiHETrE)が含まれる103,107,110。ヒドロキシエイコサテトラエン酸とDiHETrEは、白血球の移動と走化性の調節、マクロファージの排出と組織の修復、炎症、ペルオキシソーム増殖剤活性化受容体の活性化、血管の緊張、血小板の調節など、運動回復時に複数の役割を果たす可能性がある95,119。
n-3 PUFAの特殊なプロレスリングメディエーター(SPM)には、レゾルビン、プロテリン、マレシンなどがある。120,121 ARA由来のリポキシンもまた、強力な抗炎症作用と分解促進作用を持つ脂質メディエーターである。120 運動中や運動後に血漿や筋肉組織にSPMが蓄積することを示す研究はまだ一貫して行われていないが、これは方法論上の問題もあるだろう。SPM前駆体の中間体は、運動後の血漿や筋肉のサンプルで測定されている110,111。例えば、運動は、レゾルビンE1前駆体である18-ヒドロキシ-エイコサペンタエン酸を増加させる。レゾルビンE1は、運動後のヒトの血漿や筋肉組織には蓄積されないようだが、このSPMが生成されれば、炎症や痛みを和らげる可能性がある120,121。運動によって、ヒドロキシドコサヘキサエン酸と呼ばれるDHAの複数の自動酸化産物の血漿や筋肉組織のレベルが上昇する。これらは、SPMの前駆体として機能するかどうかは別として、酸化ストレスの指標として機能する111,120,121。
最近の研究では、ARAから生成されるCYP関連オキシリピンは、栄養介入によって影響を受けることが示されており、今後の研究対象となる。101 75kmのサイクリングタイムトライアルの前と最中に炭水化物を摂取すると、ARAの動員とオキシリピン、特にCYP酵素系で生成されるオキシリピンの生成が強く抑制された。エポキシエイコサトリエン酸は,ARAにエポキシゲナーゼと呼ばれるCYP酵素が作用することで生成される。このエポキシエイコサトリエン酸は、可溶性のエポキシドヒドロラーゼによって速やかにDiHETrEに変換される。DiHETrEは炎症を促進する作用があり、ヒト単球の単球化学誘引タンパク質1(MCP-1)に対する化学走性反応を促進する。122 運動後の血漿中のDiHETrE濃度に対する炭水化物摂取の対策効果は、IL-6や血中好中球数の減少など、炭水化物に関連する他の抗炎症反応と一致している。今後の研究では、他の栄養戦略(例:フラボノイド)が運動中にARA-CYPで生成されたオキシリピンを緩和するかどうかを明らかにする。
3.3. プロテオミクス
プロテオミクスとは、タンパク質とプロテオームの大規模な研究であり、初期の研究は1970年代にまで遡ることができる123。プロテオームとは、生物やシステムが生成・改変するタンパク質全体を指す。プロテオミクスのデータは、異なる遺伝子の発現後に翻訳されたかどうかにかかわらず、タンパク質の存在を確認するものである。プロテオゲノミクスは、プロテオミクスとゲノミクスを融合させることで、精密医療をはじめとする様々な分野の意思決定を向上させることを目的とした新しい分野です124。
125 最近では、指先で血液を採取して乾燥させたDBS(dried blood-spot)サンプルを用いて、800種類以上のタンパク質を検出することができるようになった126。
The Universal Protein Resource (www.UniProt.org) は、タンパク質のアノテーションと機能情報を網羅した、自由にアクセスできるリソースである。130 The Search Tool for the Retrieval of Interacting Genes/Proteins (STRING) (www.STRING-db.org) は、既知および予測されるタンパク質-タンパク質相互作用の生物学的データベースであり、自由にアクセスできるウェブリソースである。131 STRINGデータベースは 2000以上の生物から960万以上のタンパク質の情報を含んでいる。STRINGデータベースには 2000以上の生物の960万以上のタンパク質の情報が含まれている。タンパク質-タンパク質相互作用ネットワークは、STRINGによって可視化され、システムレベルの細胞プロセスに関する重要な情報や、今後の実験研究の方向性を提供する。
127,132,133,134,135 筋組織、筋繊維、筋セクレトームのプロテオミクス解析の進歩は、トレーニング適応に関わる分子メカニズムの解明に大きく貢献している133。筋組織内のプロテオミクス研究によると、慢性的な運動トレーニングの主な反応は、ミトコンドリアの電子輸送鎖、トリカルボン酸サイクル、ミトコンドリア呼吸鎖複合体Iの組み立てに関わるタンパク質の濃度が高くなることである136。
これらのプロテオミクス研究により、骨格筋が運動時の主要な分泌器官であり、人体に健康効果をもたらす1つの手段であることも明らかになった132,133,136。運動すると、細胞外小胞に封入されていることもあって、多くのミオカインが血液中に放出される。Whithamら132は、1時間の運動により、300種類以上のタンパク質の濃度が上昇することを示した。これらのタンパク質の多くは細胞外小胞に含まれており、組織間のクロストークを促進する。
127,132,134,137,138 図4は、2.5時間の集中的なランニングまたはサイクリングを行った際に、急性に発現した29種類のタンパク質について、STRINGタンパク質-タンパク質相互作用を示したものである。好中球は、激しい運動後に炎症部位に移動する最初の細胞の一つであり、エラスターゼ、S100-A8,S100-S12,ディフェンシン、リゾチーム、白血球エラスターゼインヒビター、カテリシジン抗菌ペプチドなど、複数のタンパク質が好中球の活動状態の高まりを反映している127,134,137。138, 139 運動後のプロフィリン-1とアクチン(細胞質1)の増加は、好中球のアクチンフィラメント形成をサポートし、関与する組織への移動を促進する127, 132
図4
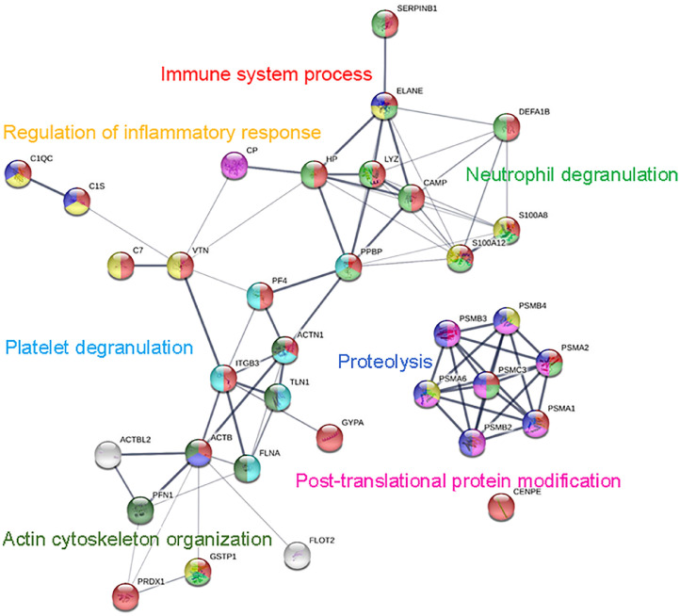
70%VO2maxで2.5時間のランニングまたはサイクリングを行った直後に増加する免疫関連タンパク質(n=29,一次)を用いたSTRINGタンパク質-タンパク質相互作用121 アスリート(n=10)の運動前後に乾燥した血痕サンプルを採取し、グローバルプロテオミクスの手順で分析した。ACTB=細胞質アクチン1,ACTBL2=βアクチン様タンパク質2,ACTN1=αアクチニン-1,C1QC=補体C1qサブコンポーネントサブユニットC、C1S=補体C1sサブコンポーネント、C7=補体成分C7,CAMP=カテリシジン抗菌ペプチド。CENPE = セントロメア関連タンパク質E; CP = セルロプラスミン; DEFA1B = ディフェンシン、アルファ1B; ELANE = 好中球エラスターゼ; FLNA = フィラミンA; FLOT2 = フロチリン-2; GSTP1 = グルタチオンS-トランスフェラーゼP; GYPA = グリコフォリンA。HP = ハプトグロビン; ITGB3 = インテグリンβ3; LYZ = リゾチームC; PF4 = 血小板因子4; PFN1 = プロフィリン-1; PPBP = 血小板基本タンパク質; PRDX1 = ペルオキシレドキシン-1; PSM = プロテアソームサブユニット、タイプA1,A1,A6,B2,B3,B4,C3。S100A8=タンパク質S100-A8,S100A12=タンパク質S100-A12,SERPINB1=白血球エラスターゼ阻害剤、STRING=Search Tool for the Retrieval of Interacting Genes/Proteins、TLN1=タリン-1,VO2max=最大酸素消費量、VTN=ビトロネクチン。
これらのタンパク質は、免疫防御や急性期反応、補体の活性化、循環免疫グロブリンを介する体液性応答などに関与している127。急性期反応とは、感染症、外傷、筋肉にダメージを与える運動などのストレスに対する全身反応のことである。140,141 急性期反応では、血清アミロイドA、補体タンパク質、C反応性タンパク質、輸送タンパク質、抗プロテアーゼ、凝固・線溶性タンパク質など多くのタンパク質が産生され、ストレスのかかる運動後数日間の血中濃度を測定することができる。127
4. 運動、腸管免疫機能、およびマイクロバイオーム
142 2007年に米国国立衛生研究所がヒトマイクロバイオームプロジェクト(HMP)を立ち上げたことで、この分野の研究は大きく加速した。HMPが始まった当時は年間400件にも満たなかったマイクロバイオームという言葉を使った論文は、現在では年間10,000件以上に達している。大規模なHMPのマイクロバイオームコホート分析143とそれに関連するマイクロバイオーム研究の枠組み144が同時に発表されたことで、多くの研究室でシーケンシングの取り組みが爆発的に増加し、ヒトのマイクロバイオームの変化が多くの疾患と関連するようになった。
HMPの設立に先立ち、Turnbaughら145は、肥満マウスとヒトの腸内細菌叢が、ファーミキューテス類とバクテロイデーテス類の比率の増加などの変化を起こすことを示すブレイクスルー論文を発表した。「肥満」の腸内細菌叢を移植すると、痩せたマウスも体重が増加し、肥満のような表現型になることから、腸内細菌叢が疾患の発症に異なる役割を果たしている可能性が示唆された。同様に、腸内でのL-カルニチンの微生物による代謝は、動脈硬化を促進することが明らかになっており146,赤身肉の摂取と心臓病との関連性をメカニズム的に説明することができる。150 微生物の多様性は、自己免疫疾患、151,152 アレルギー反応、153,154 ウイルス感染、155 ワクチン接種など、さまざまな免疫反応と相関している。156,157 マイクロバイオームと疾患との間には多くの関連性があることから、腸内細菌叢を調節して健康を増進したり、疾患を予防したりする治療法が注目されている。
2012年にHMPの結果が発表され、その後、食事などの他の生活習慣因子がマイクロバイオームに与える影響が大きいことを示す著名な論文が発表されると158,運動がマイクロバイオームに与える影響への関心が急速に高まった。2014年には、運動による腸内細菌への影響を詳細に記した注目すべき論文が初めて発表された。Kangら159は、食事と運動がそれぞれ独立してマイクロバイオームに影響を与えることを明らかにし、その変化をマウスの不安や認知能力の変化と関連付けた。これに先立ち、高脂肪食を与えたマウスでは、運動によって細菌の多様性が門レベルで変化するという報告160がなされており、この効果が、運動によって見られた体重減少や脂肪率の低下に影響を与えていると推測されていた。また 2014年には、Clarkeらが、運動と微生物の変化を関連付ける最初の研究を発表した161。Clarkeらは、プロのラグビー選手において、腸内細菌の門レベルの違いと多様性の増加が生じることを横断的な研究で示した。その後も、1型糖尿病患者162や、過体重・肥満の女性163,閉経後の女性164など、さまざまな集団において、運動とマイクロバイオームの変化に関連する横断研究が多数発表されている。
マイクロバイオームの横断的研究の主な限界は、食事などのマイクロバイオームを調整する他の行動因子を容易にコントロールできないことである。この問題を解決するために、いくつかのヒト縦断的研究が試みられている。乳がん生存者を対象とした3か月間の縦断的な運動介入におけるマイクロバイオームの変化を調べたところ、心肺機能のフィットネスと微生物の多様性との関係が明らかになったが、分析には運動をしている被験者と座っている被験者がプールされており、マイクロバイオームの調節における運動介入の有効性に関しては決定的な結論は得られなかった165。Allenら166は、6週間のトレーニング研究において、これまで座りっぱなしだった成人において、研究前の状態である痩せ型または肥満型に応じて、微生物種に対する影響が異なることを実証した。この研究では、便中の酪酸濃度が運動によって増加したのは、痩せ型の被験者のみであった。同様に、Croninら167は、過体重または肥満の成人に8週間の運動介入を行ったところ、微生物の多様性に変化の傾向がみられたと報告しているが、微生物の代謝経路にはほとんど影響がなかったようである。さらに、主にげっ歯類を対象とした様々なトレーニング研究でも、運動によるマイクロバイオームの変化が示されており、これらについては別の場所で広くレビューされている168。
現在、運動による腸内細菌叢の変化を示した文献は数多く存在するが、この分野では多くの疑問が残されている。様々な運動モードが腸内細菌集団に与える影響の違いはほとんど知られておらず、このことは、マイクロバイオームを対象とした運動介入の処方に大きな影響を与える可能性がある。Allenら169は、強制的なトレッドミル走行(FTR)と自発的なホイール走行(VWR)がマウスの腸内細菌叢に与える影響が大きく異なることを示し、運動様式の違いがマイクロバイオームに異なる影響を与えるという仮説を支持している。同様に、腸内の微生物代謝に対する運動の影響にも大きな関心が寄せられている。いくつかの研究では、運動によって短鎖脂肪酸である酪酸が増加することが示されているが166,170,ほとんどの運動研究は微生物の配列に焦点を当てており、他の微生物の代謝物のレベルに対する運動の影響については、基本的にまだ調査されていない。
おそらく、現在未解明の問題の中で最も興味深いのは、「運動した」マイクロバイオタを使って病気を治療したり治癒したりできるかどうかということだろう。糞便微生物叢移植(FMT)は、少なくとも15年前から重度のClostridium difficile感染症の治療法として用いられており171,FMTに関する近代的な文献は1950年代後半にさかのぼる172が、最近になって、他の疾患の治療にFMTを用いることへの関心が爆発的に高まっている。FMTは、潰瘍性大腸炎やクローン病、173,174 メタボリックシンドローム、175および自閉症176,177の治療に一定の効果を示しているが、これらの分野で実施された研究の多くはサンプル数が少なく、十分な再現性が得られていない。しかし、運動が腸内細菌叢に及ぼす一般的な効果を考えると、運動をしている人の腸内細菌叢を様々な慢性疾患を患っている人に移植することで、それらの疾患の症状を緩和したり、さらには治療につなげたりすることができるのではないかと考えたくなる。
これを裏付けるものとして、マウスの大腸炎に関する一連の研究がある。Cookら178は2013,デキストラン硫酸ナトリウムで誘発される大腸炎に対して、VWRとFTRが相反する効果をもたらすことを示し、VWRは保護効果を媒介するのに対し、FTRは大腸炎の症状を悪化させることを明らかにした。Allenら179は、その数年後に、VWRとFTRが腸内細菌叢に相反する効果をもたらすことを示した。同様に、Laiら181は、肥満マウスに運動した痩せ型マウスの微生物群を移植すると、代謝プロファイルが改善することを示した。これらの報告は、運動によってマイクロバイオームを「鍛える」ことが、治療的FMTの効果を高める有効な手段であることを示唆しているが、これらの初期の結果は、再現性とヒトでの研究への移行が必要である。
近年、多くの研究室が、さまざまな運動様式が腸内細菌群に影響を与えることを明らかにしている。これらの研究は十分に多く、説得力を持っているが、これらの変化の背後にあるメカニズムとその意味合いについては、あまり明らかになっていない。特に、運動によって引き起こされる微生物代謝の変化をプロファイリングすれば、運動によって引き起こされる腸内細菌叢の変化が疾患にどのように影響するかについて、重要な知見が得られる可能性がある。同様に、将来の個人に合わせた運動処方のためには、さまざまな運動様式が微生物集団に及ぼす相対的な影響をより詳細に調査する必要がある。最後に、糞便微生物叢移植の前処理として運動を行うことは有望な研究分野であるが、特にヒトの集団においてこの戦略が有益であることを実証するには、さらに多くの研究が必要である。
5. 将来の可能性
この総説では、技術的な進歩と、メタボロミクス、プロテオミクス、リピドミクス、マイクロバイオミクスの手法を用いた統合的なマルチオミクスアプローチによって、運動が免疫系にどのような影響を与え、それによって健康、老化プロセス、疾患の有病率にどのような影響を与えるかについての理解が進んだことを述べている。今後の運動免疫学の研究では、大規模なデータセットを作成するためのさまざまな新技術も重要になるだろう。いくつかの研究室では、ゲノムワイドなメチル化解析を用いて、運動によって末梢免疫細胞に生じるエピジェネティックな変化を調べており、また、急性または慢性運動後のマイクロRNA発現の変化をプロファイリングする取り組みも進められている182。クロマチン免疫沈降シークエンス(ChIP-Seq)183(タンパク質とクロマチンの相互作用を調べる)トランスポーズアクセス可能クロマチンのシークエンス184(クロマチンアクセス性を調べる)バイサルファイトアンプリコンシークエンス(全ゲノムのメチル化を調べる)185などの次世代シークエンス技術によって可能になったエピゲノムプロファイリングは、運動免疫学の研究者が免疫細胞の複雑な細胞内変化をプロファイリングし、運動によるこれらの細胞の既知の機能的変化と関連付けることを可能にする。さらに、新たに発見された免疫細胞の表現型は、シングルセルRNAシーケンシング186やマスサイトメトリー187などの技術を用いた研究室で日常的に報告されており、これらの技術は、循環免疫細胞サブセットの運動誘発性変化が注目される運動免疫学研究にもすぐに応用されることになるだろう。
6. 結論と健康への応用
74, 75, 76 多くの情報が不足しているが、これらの運動誘発性の免疫関連効果は、免疫老化や慢性疾患の発症に対抗する上で重要な役割を果たしている可能性がある74。74, 75, 76,188, 189, 190 細胞のエピジェネティックな変化、代謝の変化、タンパク質の発現の変化を高解像度でプロファイリングする新しいオミックス技術は、これらの変化の背後にあるメカニズムの発見に重要な役割を果たすと考えられる。この総説では、これらの分野におけるこれまでの主要な進歩をいくつか紹介したが、米国国立衛生研究所のコモンファンドが支援するMolecular Transducers of Physical Activity in Humans(MoTrPAC)プロジェクト191などの連携した取り組みは、さらに重要な貢献をすることが期待される。しかし、ここで紹介したような未解決の問題が数多くあることや、この分野で研究している国際的な科学者の数が比較的少ないことから、今後数年間で運動免疫学が飛躍的に発展する余地があると考えられる。
