Contents
Minocycline: far beyond an antibiotic
www.ncbi.nlm.nih.gov/pmc/articles/PMC3651660/
オンラインで公開2013年4月25日
N Garrido-Mesa, A Zarzuelo, and J Gálvez
概要
ミノサイクリンは、第2世代の半合成テトラサイクリンであり、グラム陽性菌およびグラム陰性菌の両方に対する抗生物質として、30年以上にわたり治療に使用されてきた。主に尋常性ざ瘡(にきび)や性感染症の治療に用いられている。
近年、テトラサイクリン系薬剤は、抗炎症作用、抗アポトーシス作用、タンパク分解抑制作用、血管新生抑制作用、腫瘍転移抑制作用など、抗菌作用とは別の様々な生物学的作用を示すことが報告されている。
最近、ミノサイクリンには、皮膚炎、歯周炎、動脈硬化、関節リウマチや炎症性腸疾患などの自己免疫疾患など、炎症を伴うさまざまな疾患の実験モデルにおいて有益な、複数の非抗生物質的生物学的作用があることが判明しており、これらの知見はミノサイクリンに特に関係している。
中でもミノサイクリンは、テトラサイクリン系化合物の中で最も神経保護効果の高い化合物として注目されている。この効果は、虚血、外傷性脳損傷、神経因性疼痛の実験モデルや、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症、アルツハイマー病、多発性硬化症、脊髄損傷などの神経変性疾患の実験モデルで確認されている。
さらに、他の前臨床試験では、悪性細胞の増殖やヒト免疫不全ウイルスの活性化・複製を抑制する作用や、骨吸収を防ぐ作用などが示されている。
以上のように,この総説ではミノサイクリンの薬理学におけるこれまでの最も重要なトピックを取り上げ,ここで述べた多くの疾患に対する新たな治療法としてのミノサイクリンの評価を支持するものである。
キーワード
ミノサイクリン,テトラサイクリン,抗生物質,抗炎症,免疫調節,神経保護
はじめに
テトラサイクリン系抗生物質は、好気性および嫌気性のグラム陽性菌およびグラム陰性菌のほか、リケッチア、クラミジア、原虫、肺炎マイコプラズマなどの微生物に幅広く作用することから、ブロードスペクトラム抗生物質と考えられている(図1)。テトラサイクリン系抗生物質の作用機序は、主に細菌の30Sリボソームサブユニットに結合し、タンパク質合成を阻害することにある。テトラサイクリン系抗生物質の効果を高めるために、様々な構造変化が採用されてきた。例えば、半合成化合物であるミノサイクリンやドキシサイクリンの高い効果の根拠となっている、炭素数7~9のD環修飾が挙げられる(Nelson, 1998)。ミノサイクリン(7-ジメチルアミノ-6-ジメチル-6-デオキシテトラサイクリン)は、第二世代の半合成テトラサイクリンアナログで、30年以上にわたって使用されている(Yong er al)。 グラム陽性菌とグラム陰性菌の両方に対する有効性を保持しており、尋常性ざ瘡(にきび)の治療薬として医薬品・医療製品規制庁(Medicines and Healthcare Products Regulatory Agency)から、また、一部の性感染症と関節リウマチの治療薬として米国食品医薬品局(FDA)から承認されている(Good and Hussey, 2003; Blum er al)。 ミノサイクリンは、第一世代のテトラサイクリン系薬剤よりも優れた薬物動態プロファイルを示し、高齢者であっても迅速かつ完全に吸収され、半減期が長く、組織への浸透性に優れ、ほぼ完全なバイオアベイラビリティを有している(Barza et al 1975年、Kramer et al 1978年、KleinとCunha、1995)。また、親油性の高い分子であるため、血液脳関門を容易に通過することができ(Brogden et al 1975年)その結果、脳脊髄液および中枢神経系の細胞への蓄積が促進され(Aronson、1980年、Yrjänheikki et al 1999年、Kielian et al 2007年)多くの中枢神経系疾患の治療に使用することができる(Saivin and Houin、1988年、Wang et al 2003,Yong et al 2004)。さらに、ミノサイクリンは慢性的に使用した場合の安全性も良好である。米国FDAが推奨する最高用量である200mg-day-1までのミノサイクリンの長期投与は、ヒトにおいて一般的に安全であり、忍容性も良好である。ミノサイクリンの最も一般的な副作用として知られている吐き気、めまい、軽度のめまいは、主に投与後早期に発生し、治療を中止するとすぐに消失する。しかし、British National Formularyによると、6カ月以上継続する治療の場合、3カ月ごとに肝毒性、色素沈着、全身性エリテマトーデスのモニタリングを行うことが推奨されており、これらが発現した場合、または既存の全身性エリテマトーデスが悪化した場合には治療を中止することが推奨されている。ミノサイクリンは、他のテトラサイクリン系薬剤と比較して、エリテマトーデス様症候群や不可逆的な色素沈着のリスクが高いため、ヒトの感染症への広範な使用が制限されており、現在は尋常性ざ瘡の治療にのみ適応されている(Williams et al 1974;Klein and Cunha、1995)。
図1 ミノサイクリンとその親であるテトラサイクリンの化学構造
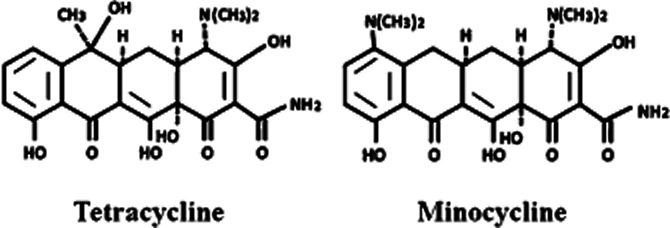
テトラサイクリンの抗生物質としての性質は1940年代後半に報告されたが、最近では非抗生物質としての性質に注目した研究が数多く行われている。実際、テトラサイクリン類は、抗炎症作用や抗アポトーシス作用、タンパク質分解や血管新生、腫瘍転移に対する阻害作用など、抗微生物活性とは独立した様々な生物学的作用を発揮することが報告されている(Golub et al 1991年、1992年、Greenwald and Golub、1993年、Sapadin and Fleischmajer 2006)。これは、ミノサイクリン(Zemke and Majid, 2007; Kielian et al, 近年、ミノサイクリンは、酒さ、水疱性皮膚炎、好中球性疾患、壊疽性膿皮症、サルコイドーシス、大動脈瘤、癌の転移、歯周炎、関節リウマチや強皮症などの自己免疫疾患など、炎症を基盤とする疾患に有効であると考えられている(Sapadin and Fleischmajer, 2006; Soory, 2008; Griffin et al 2010に記載)。ミノサイクリンは、神経保護に最も効果的なテトラサイクリン誘導体として、虚血の実験モデルで確認されている(Yrjänheikki et al, 2005年)外傷性脳損傷(Sanchez Mejia et al 2001年)神経障害性疼痛(Raghavendra et al 2003,Mei et al 2011)などの実験モデルや、パーキンソン病などのいくつかの神経変性疾患(Du et al 2001,Thomas and Le 2004,Du et al 2011)で確認されている。2001; Thomas and Le, 2004; Abdel-Salam, 2008) やハンチントン病 (Chen et al 2000; Thomas et al 2004) 、筋萎縮性側索硬化症 (Zhu et al 2002) 、アルツハイマー病 (Choi et al 2007) 、多発性硬化症 (Multiple Sclerosis) など、いくつかの神経変性疾患にも有効である。2007)多発性硬化症(Brundula et al 2002;Nessler et al 2002)脊髄損傷(SCI)(Golub et al 1991;Yong et al 2004;Festoff et al 2006)などである。これらの前臨床試験により、ミノサイクリンは神経疾患患者を対象とした臨床試験で評価され、有望な神経保護特性を示している(Lampl er al)。 さらに、ミノサイクリンへの関心の高まりから、炎症性腸疾患(Huang et al 2009b;Garrido-Mesa et al 2011a,b)糖尿病(Bain et al 1997;Wang et al 2003)など、他の多くの実験的疾患モデルにおいてもミノサイクリンの治療効果が評価されている。1997; Wang et al 2003; Cai et al 2011)脆弱性X症候群(FXS)(Paribello et al 2010)心筋虚血(Scarabelli et al 2004)ヒト免疫不全ウイルス(HIV)感染(Szeto et al 2010; Campbell et al 2011)などの疾患モデルがある(図2)。
図2 抗生物質活性、抗アポトーシス作用、抗炎症作用、免疫調節作用、そして非抗生物質作用と抗微生物作用の両方が関連していることによるミノサイクリンの臨床的可能性
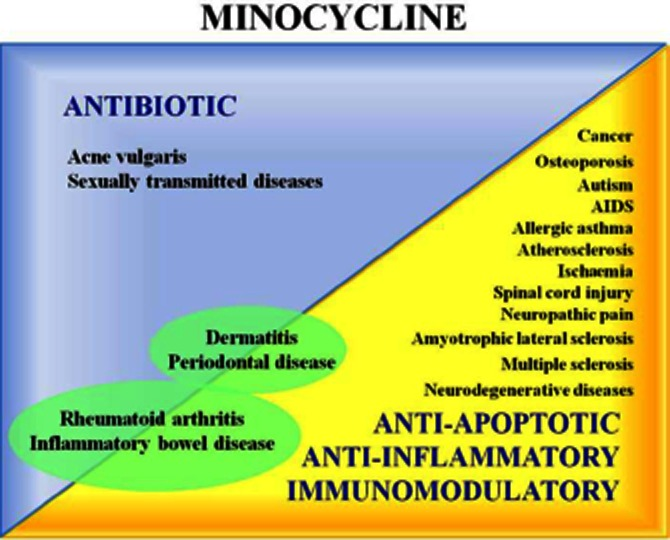
これらの研究の多くは、ミノサイクリンの抗炎症作用、免疫調節作用、神経保護作用に関与していると考えられるメカニズムを提案している。例えば、(i)iNOS(Amin et al 1997年)MMP(Golub et al 1991年)PLA2(Pruzanski et al 1992)などの主要酵素の活性阻害作用、(ii)ペルオキシナイトライト消去作用によるタンパク質のチロシンニトロ化の抑制(Whiteman and Halliwell、1997年)(iii)カスパーゼ-1およびカスパーゼ-3の活性化の抑制(Chen et al 2000年)(iv)ミノサイクリンの抗炎症作用、免疫調節作用、神経保護作用の増強(Chen et al 2000)などが挙げられる。(iv)Bcl-2由来の作用を増強し、アポトーシスから細胞を保護する(Wang et al 2003,DomercqとMatute 2004,Jordan et al 2007年)、(v)p38 MAPKのリン酸化を抑制する(Corbacella et al 2004年)、(vi)PARP-1活性を阻害する(Alano et al 2006年)。テトラサイクリン類は、Ca2+やMg2+と結合することが知られており、これらの陽イオンがキレート化されて細胞内に輸送されることで、これらの生物活性の一部を担っていると考えられる(White and Pearce, 1982)(図3)。
図3 ミノサイクリンの抗炎症作用に関わるメカニズム
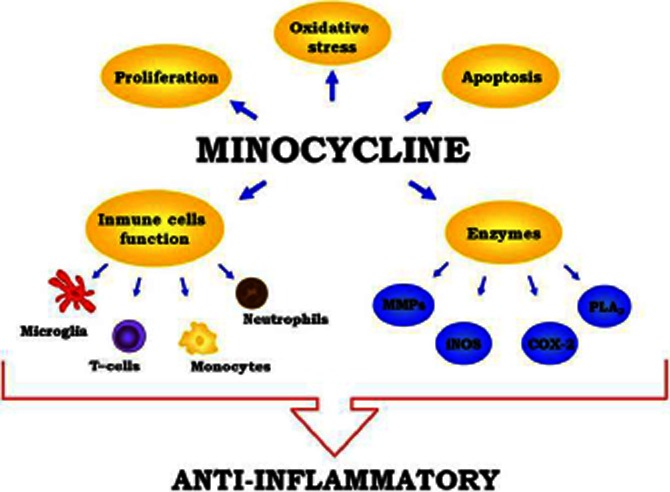
iNOS、MMP、COX-2やPLA2などの酵素活性の阻害作用、カスパーゼ-1やカスパーゼ-3の活性化の抑制やBcl-2由来の作用の増強によるアポトーシスの抑制、抗酸化作用、免疫細胞の活性化や増殖の抑制など。
この総説では、ミノサイクリンの非抗生物質としての効果がさまざまな実験モデルで報告されていることをまとめ、免疫反応の乱れに関連する疾患の新たな治療法として評価することを目的としている。この化合物は、免疫調整作用と抗菌作用の両方を併せ持つことから、免疫反応の変化と微生物が原因となっている疾患において、さらなる価値を持つと考えられる。
皮膚炎に対するミノサイクリンの効果
ミノサイクリンを含むテトラサイクリン系薬剤は、好中球の走化性を低下させることが報告されているため(Esterly et al 1978年、1984年)皮膚炎に対するミノサイクリンの効果を評価した研究がある。Ishikawa et al 2009)は、ミノサイクリンが、血清中で治療的に得られる濃度(5または10μM)(Agwuh and MacGowan, 2006)と同程度の濃度で、プロテアーゼ活性化受容体2を介したIL-8の産生を減少させ、その結果、表皮ケラチノサイトの炎症プロセスを弱めることを報告した。彼らは、プロテアーゼ活性化受容体2の活性化がケラチノサイトの細胞内Ca2+レベルを一過性に増加させ、下流のNF-κBのDNAへの結合を誘発することから、テトラサイクリンのCa2+をキレートする能力がこれらの効果に寄与しているのではないかと提案した(Macfarlane et al 2005; Stefansson et al 2008)。公開臨床試験では、ミノサイクリンの非感染性皮膚炎への有効性が確認され(Humbert et al 1991年)炎症性ニキビ、酒さ、水疱性皮膚炎、好中球性皮膚炎などの様々な皮膚疾患への臨床使用が支持された(Sapadin and Fleischmajer 2006)。しかし、これらの症状の寛解を維持するためには、コルチコステロイドの併用が必要となることが多い。しかし、これらの報告の多くは、一般的に非プラセボ対照試験または非対照試験であり、対象となる患者数も少ない。しかし、これらの報告の多くは、非対照試験または非対照試験であり、少数の患者を対象としたものである。したがって、より多くの患者を対象とした無作為化比較試験による評価が必要である。最後に、前述の皮膚疾患にはミノサイクリンの使用が推奨されているが、現在の治療では、ミノサイクリン治療に頻繁に見られる薬物過敏症症候群、色素沈着、めまいなどの副作用の発生率が低く、これらの症状の治療に同様の効果を持つドキシサイクリンの使用に移行している(Bachelez et al 2001,Sapadin and Fleischmajer 2006,Korting and Schöllmann 2009)。
歯周病に対するミノサイクリンの効果
テトラサイクリンの薬理作用は、抗微生物作用に加えて、抗炎症作用や抗アポトーシス作用を併せ持っているため、よく知られている微生物性の病因に加えて、炎症性のプロセスを特徴とする歯周病の治療に適している(Soory, 2008)。従来、血漿や歯肉溝液で検出されていたレベルでは、ミノサイクリンは骨芽細胞を著しく刺激し、一方、テトラサイクリンにこれらの細胞を長期的に曝すと、ミネラル化した骨基質が比例して増加する(Gomes and Fernandes, 2007)。これらの効果は、ヒト歯肉線維芽細胞、上皮細胞、歯根膜線維芽細胞の生存率やタンパク質発現に影響を与えることなく達成されている(Suzuki er al 2006)。これらの効果は、抗菌作用と合わせて考えると、特にミノサイクリンを100〜200mg-day-1の用量で7〜14日間投与した場合に、疾患の進行を抑え、歯周病の治癒を促進する効果を説明できるかもしれない(Kirkwood et al 2007,Basegmez et al 2011)。
ミノサイクリンの関節リウマチに対する効果
ミノサイクリンの抗コラゲナーゼ活性は、Golubら(1983)によって最初に報告され、その後Greenwaldら(1987)によってヒトのリウマチ組織や滑膜の培養で確認されたため、過去40年間の多くの研究は、関節リウマチに対するミノサイクリンの効果に焦点を当てていた。関節リウマチのアジュバント関節炎モデルでは、テトラサイクリンは炎症組織のコラゲナーゼ活性を低下させたが、ラットでは抗炎症作用を示さなかった(Greenwald et al 1992)。同じ試験で非ステロイド系抗炎症薬と併用した場合、テトラサイクリンは相乗効果を発揮し、分解酵素活性の完全な阻害と放射線による骨損傷の正常化が認められた。同様に、それらは試験管内試験および生体内試験の両方で軟骨プロテアーゼの合成および/または活性を阻害することが示された(Arsenis et al 1992)。別の研究では、Zernickeら(1997)は、テトラサイクリン誘導体が、ラットの大腿骨の機械的強度に対するアジュバント病の有害な影響を逆転させることができると報告した。これらの研究がきっかけとなり、ミノサイクリンを含むさまざまなテトラサイクリンを用いた臨床試験が行われた。当初、2つの二重盲検プラセボ対照試験が行われた。1つはKloppenburgら(1994年)もう1つはminocycline in rheumatoid arthritis試験(Tilley et al 1995)である。前者では、ミノサイクリンが関節リウマチ患者において臨床的に有用な抗炎症作用を持ち、プラセボよりも優れていることが実証されたが、後者では明確な結論は導き出されなかった。その数年後、Langevitz et al 2000)は、過去に行われた2つのオープン試験と3つの二重盲検対照試験の結果をまとめた。その結果、ミノサイクリンは、関節リウマチ患者さんの関節の腫れや圧痛、臨床検査値、患者さんの評価などに有益な効果を示し、特に関節リウマチの初期や軽度の患者さんに投与すると有効である可能性があると結論づけている。2002年までに行われた臨床試験の結果をまとめた2003年のメタアナリシスでは、これらの有益な効果が確認された(Stone et al 2003)。このように有望な結果が得られ、関節リウマチに対する半合成テトラサイクリン系薬剤がFDAに承認されたにもかかわらず、Greenwald(2011)は最近のレビューで、テトラサイクリン系薬剤の弱い抗炎症作用は他の多くの薬剤によって容易に凌駕されることを認めている。しかし、変形性関節症の治療におけるテトラサイクリン系薬剤の可能性は依然として魅力的であり、試験管内試験におけるミノサイクリンの軟骨分解抑制効果は、今後の発展に向けた確かな根拠を示している。
中枢神経系疾患に対するミノサイクリンの効果
前述のように、ミノサイクリンは高い脂溶性(Good and Hussey, 2003)のため、血液脳関門を容易に通過し(Brogden et al 1975; Saivin and Houin, 1988; Yong et al 2004)、近年では、中枢神経系疾患の動物モデルに有効であることが示されている。これらの研究の多くは、当初、神経新生や神経細胞の生存に悪影響を及ぼすプロセスであるミクログリアの活性化を阻害するミノサイクリンの能力に基づいており、神経炎症および/または神経変性疾患の治療におけるミノサイクリンの潜在的な有効性を正当化していた(Yrjänheikki et al 1998年、Chen et al 2000,Du et al 2001,Zhu et al 2002,Metz et al 2004,Tomás-Camardiel et al 2004)。実際、様々な試験管内試験研究において、ミノサイクリンは、LPSで刺激された炎症性サイトカインの分泌と、BV-2ミクログリア由来の細胞株および成体マウスの脳から分離したミクログリアにおけるToll-like-receptor(TLR)-2の表面発現を阻害することが報告されている。また、ミノサイクリンは、IL-6,IL-1β、主要組織適合性複合体(MHC)II、TLR-2などの炎症性遺伝子のmRNAの発現を抑制した(Nikodemova et al 2006,Henry et al 2008)。
ミノサイクリンは、全身性の炎症時に脳内でのサイトカインの発現を抑制することができるため、認知機能や行動障害の予防に有用であると考えられる。実際、ミノサイクリンは、海馬と大脳皮質の神経炎症マーカーおよびインドラミン2,3-ジオキシゲナーゼ(IDO)mRNAの発現の減少と並行して、LPSによる神経炎症に伴う病的行動および快感消失を軽減する(Henry er al)。 これらのデータは、成体のCD-1マウスにおいてIDO活性と急性うつ病の因果関係を示した別の報告と一致している。その報告では、ミノサイクリンがIDOの誘導を阻害することで、うつ状態のような無動状態を防ぐことができた(O’Connor et al 2009)。また、ミノサイクリンの前処理は、LPSによる脳内IL-1β産生を減弱させる一方で、血漿中のIL-1β濃度には影響を及ぼさなかったことから、ミノサイクリンには脳内での抗炎症作用があり、それが病気からの回復や神経行動学的合併症の頻度の減少につながっていることが示唆された。
ミノサイクリンは、その抗炎症作用と同様に、全体性および局所性の虚血モデルにおいて神経保護剤として作用することが報告されている。スナネズミの前脳虚血モデルでは、ミノサイクリンは虚血後に投与を開始しても、ミクログリアの活性化を防ぎ、梗塞サイズを縮小し、海馬ニューロンの生存率を高めた。これらの効果は、罹患した脳領域におけるIL-1β変換酵素、COX-2およびiNOSのmRNAレベルの減少を伴っていた(Yrjänheikki et al 1998;1999)。Koistinaho et al 2005)は、ミノサイクリンのこの効果がMMP依存性であることを示した。ミノサイクリンは、野生型マウスでは永久脳虚血から保護されるが、MMP-9欠損マウスでは保護されなかった。さらに、(Park et al 2011)は、ミノサイクリンが他のMMP阻害剤と同様に、実験的な光血栓性大脳皮質虚血後の神経炎症に有効であることを報告している。虚血前後にミノサイクリンを投与したところ、虚血した大脳皮質の梗塞サイズと神経炎症メディエーターの発現が有意に減少したことから、これまでの報告(Romanic et al 1998年、Koistinaho et al 2005)と同様に、MMP阻害による効果であることが明らかになった。
前臨床試験では、ミノサイクリン投与による脳内炎症メディエーターの発現低下が繰り返し報告されており、虚血モデルにおける梗塞サイズの抑制効果や、神経炎症プロセスに関連する行動合併症への好影響が示唆されている。これらの有望な実験結果を踏まえ、これらの中枢神経系疾患に対するミノサイクリンの有用性について新たな知見を得るためには、トランスレーショナルリサーチが必要である。
パーキンソン病、アルツハイマー病、ハンチントン病に対するミノサイクリンの有効性が提案されている。(Chen et al 2000)は、ハンチントン病のトランスジェニックR6/2マウスモデルを用いてミノサイクリンの効果を評価し、ミノサイクリンが病気の進行と死亡を遅らせることを報告した。そのメカニズムは、カスパーゼ-1とカスパーゼ-3の発現を抑制し、iNOSの活性化を低下させることで、これらの酵素がハンチントン病で発揮する有害な作用を防いでいると判断された(Ona er al)。 さらに、ミノサイクリンを投与したマウスでは、内因性のハンチントン切断断片の生成が有意に抑制され、脳内の成熟IL-1β濃度も低下した。ミノサイクリンの抗炎症作用は、パーキンソン病の試験管内試験および動物モデルの両方で観察された有益な効果の説明にもなる。ミノサイクリンは、1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP)モデルのパーキンソン病マウスにおいて、線条体および側坐核におけるドーパミン減少の防止に関連する黒質線条体ドーパミン神経変性を防止し、iNOSおよびカスパーゼ-1の発現の顕著な減少と関連することが見出された(Du et al 2001)。また、別の研究では、ミノサイクリンの黒質ドーパミン神経細胞保護作用は、MPTPによるミクログリアの活性化の抑制、成熟したIL-1βの形成の抑制、NADPHオキシダーゼおよびiNOSの活性化と関連していた(Wu er al)。 さらに、中脳、小脳顆粒ニューロン(CGN)およびグリアの初代培養細胞を用いた試験管内試験では、ミノサイクリンが1-methyl-4-phenylpyridinium(MPP+)を介したiNOSの発現およびNOによる神経毒性を抑制することが確認された。この効果は、CGNにおけるp38 MAPKの活性化を抑制することと関連していた(Du er al 2001)。これらの結果から、ミノサイクリンは、p38 MAPKのリン酸化を阻害することにより、MPTP/MPP+によるグリアのiNOS発現と神経毒性を間接的に阻害することで、生体内試験でのMPTP神経毒性をブロックすることが示唆された。一方で、ハンチントン病(Diguet et al 2003,2004)やパーキンソン病(Yang et al 2003,Diguet et al 2004)の動物モデルを用いた研究では、ミノサイクリンの効果がないことや有害な作用が報告されている。したがって、ミノサイクリンは、これらの神経疾患の種やモデルによって効果が異なり、矛盾しているようにも見える。これらの矛盾は、使用した投与方法や用量の違いによるものではないだろうか?ハンチントン病やパーキンソン病においてミノサイクリンが神経保護作用を持つかどうかを判断するためには、さらなる臨床試験を行う前に、さらなる実験を行う必要がある(Diguet et al 2004b)。
筋萎縮性側索硬化症の発症には、カスパーゼ-1,カスパーゼ-3,iNOS、p38 MAPKなどのさまざまな炎症性シグナルの発現や活性の上昇が関係していることから(Friedlander et al 1997年、Li et al 2000年)ミノサイクリンがこの疾患に有効であることも根拠があると考えられる。実際、ミノサイクリンは、変異型ヒトSOD1-G93Aトランスジーンを発現させた筋萎縮性側索硬化症の実験モデルにおいて、疾患の発症を遅らせ、生存期間を延長した。このモデルでは、ミノサイクリンがミトコンドリアの伝染性遷移を介したシトクロムcの放出を抑制しており、この作用機序は試験管内試験の細胞および単離されたミトコンドリアの両方で確認された(Zhu er al)。 同様の結果は、Kriz et al 2002)およびVan Den Bosch et al 2002)によって報告されており、ミノサイクリンが運動ニューロンの変性および筋力低下の開始を遅らせ、筋萎縮性側索硬化症マウスの寿命を延ばすことが示された。さらに試験管内試験の研究では、ミノサイクリンが筋萎縮性側索硬化症を含む運動ニューロン疾患患者の培養ニューロンのアポトーシスを減少させることが明らかになった(Tikka er al 2002)。しかし、ハンチントン病やパーキンソン病の場合と同様に、この神経疾患におけるミノサイクリンの有用性については、依然として議論の余地がある。これらの動物モデルでは有望な結果が得られたが、多施設共同無作為化プラセボ対照第3相試験では、ミノサイクリンに有害な作用があることが明らかになった。ミノサイクリンを投与された筋萎縮性側索硬化症の患者は、対照群の患者に比べて有意に早く症状が悪化した(Gordon et al 2007)。
pubmed.ncbi.nlm.nih.gov/17980667/
前臨床試験では、ミノサイクリンの薬理学的プロファイルがアルツハイマー病の治療に有用であることが確認されている。2004年には、μ-p75-saporinをi.c.v.に注射したマウスを用いたアルツハイマー病の実験モデルにおいて、ミノサイクリンの効果が報告された。ミノサイクリンは、コリン作動性細胞の減少を改善し、免疫毒素の投与後に起こるミクログリアとアストロサイトの同時活性化を抑え、炎症性メディエーターの転写をダウンレギュレートし、認知障害を緩和した(Hunter et al 2004)。また、ミノサイクリンの投与は、アミロイド前駆体タンパク質(APP)トランスジェニックマウスにおけるIL-1β、IL-6,TNFおよび神経成長因子のミクログリア産生を抑制するが、このモデルにおけるアミロイドβペプチド(Aβ)沈着には影響を与えないことが報告されている(Seabrook et al 2006)。さらに、Choi et al 2007)は、ミノサイクリンがeukaryotic initiation translation factor 2 alpha(eIF-2α)のリン酸化を抑制することを報告している。これは、シナプス可塑性に必要なde novoタンパク質合成の効果を低下させることにより、最終的に認知機能を損なう可能性がある(Harding et al, 2000; Chen et al 2003; Taylor et al 2005)カスパーゼ-12の活性化を低下させることにより、認知機能を低下させる可能性がある。また、2つの動物モデルにおいて、p-eIF2aの増加はミノサイクリンの投与によって抑制された。Aβ1-42を投与したラットとTg2576マウスでは、ミノサイクリンの投与により、神経細胞死が減少し、認知機能障害が改善され、学習・記憶の障害が軽減された(Choi er al)。 同様に、ミノサイクリンを投与すると、アルツハイマー病類似のトランスジェニックラットモデルにおいて、行動障害が改善され、プラーク前の初期の炎症過程において、炎症マーカーやAβ三量体のレベルが低下した(Cuello er al)。 Aβの蓄積は、MHC II、iNOS、COX-2などの炎症マーカーのアップレギュレーションとともに、アミロイド斑のない大脳皮質および海馬において認知障害や生化学的変化を引き起こすのに十分であり、これらの反応はミノサイクリンによってうまく阻止された(Cuello et al 2010)。このように、ミノサイクリンの投与は、さまざまな作用によってアルツハイマー病の特徴である認知機能障害や学習・記憶障害を改善するものであり、今後は患者さんでの有用性を見極めることが必要である。
最後に、より重要な点として、ミノサイクリンの単独あるいは他の薬剤との併用により、多発性硬化症の重症度や進行を改善する可能性を示す実験的証拠が増えていることが挙げられる。この結果は、多発性硬化症の動物モデルである実験的自己免疫性脳脊髄炎(EAE)で得られた有望な結果に基づいている。2002,2つの異なるグループが、ミノサイクリンがEAEの臨床的および組織学的な重症度を低下させることを発表した。(Popovic et al 2002)は、治療プロトコルに従ってミノサイクリンを投与すると、暗黒アグーチラットに誘発されたEAEにおいて、進行中の疾患活動が抑制され、疾患の進行が制限されたと報告している。同様に、(Brundula et al 2002)は、ミノサイクリンが、MMP活性を阻害する能力によると思われるが、臨床症状の発症後に投与しても、EAEで発生する臨床症状の開始を遅らせ、神経炎症の重症度を軽減することを示した。その後、(Nikodemova et al 2007)は、ミノサイクリンを症状発現時に投与を開始すると、病変の数と大きさの両方が減少し、疾患の臨床経過の重症度が大幅に低下することを報告した。この効果は、末梢から中枢神経系へのマクロファージの移動が減少し、その結果、脊髄の実質への白血球の浸潤が減少し、ミクログリアのMHC IIの発現と増殖が減少することと関連していた。さらに、これらの神経保護効果は、高濃度のミノサイクリンを中枢神経系に局所的に投与した場合に向上した(Xue er al)。
また、ミノサイクリンは、スタチン系薬剤であるアトルバスタチンとの併用も有効であった(Youssef er al)。 併用療法は、急性期および慢性期のいずれにおいても、個々の薬剤を単独で使用した場合と比較して、炎症、脱髄、軸索の脱落が抑制され、疾患の重症度が大きく低下した(Luccarini et al 2008)。
EAEにおけるミノサイクリンの薬理作用のメカニズムは、T細胞活性への影響、ミクログリアの活性化を抑制する作用、神経保護作用である。In vitro試験では、ミノサイクリンは、ヒトT細胞に提示するための抗原処理(Kalish and Koujak, 2004)T細胞の増殖と炎症性サイトカインの産生(Kloppenburg et al 1995; 1996)フィブロネクチンマトリックスバリアを通過するT細胞の移動を、MMPの阻害を介して阻害することが明らかになった。In vivoの実験では、この抗生物質が1型ヘルパーT細胞(Th1)から 2型ヘルパーT細胞(Th2)への免疫分化を促進し、EAEに対する感受性を調節することがわかっている(Popovic et al 2002)。ミクログリアの活性化について、(Popovic et al 2002)は、再発性EAEにおいて、ミノサイクリンを投与したラットでは活性化したミクログリアが見られないことを発見した。さらに、ミノサイクリンは、ミクログリアのMHC II発現とそれに続くT細胞の再活性化を抑制し、その結果、EAEの臨床的重症度が減衰し(Nikodemova et al 2007)、Tリンパ球の中枢神経系実質への浸潤が減少した(Brundula et al 2002; Popovic et al 2002)。さらに、ミノサイクリンの直接的な抗酸化作用は、試験管内試験での活性酸素種(ROS)による神経細胞および軸索の破壊を弱め(Wilkins et al 2004年)ミノサイクリン処理したEAEラットで観察されたように、Ca2+をキレートする能力は、カルパインの活性化を防ぎ、軸索の完全性を維持する可能性がある(Stirling 2004,Yong et al 2004,Maier et al 2007)。実験モデルでの多発性硬化症治療におけるミノサイクリンの成功を受けて、ヒトでの第I/II相臨床試験が行われた。その結果、ミノサイクリンの有益な効果が確認され、安全性と忍容性も高いことがわかった(Metz et al 2004,2009,Zabad et al 2007)。その結果、ミノサイクリンは、再発率、MRIの活動性病変、局所脳萎縮を有意に減少させた。また、これらの試験では、ミノサイクリンに対する臨床反応には、多発性硬化症の制御に望ましいと思われる有益な免疫系の変化が伴うことが示された。したがって、今回検討したすべての神経疾患の中で、ミノサイクリンは多発性硬化症の治療に最も効果があると考えられる。ミノサイクリンの多発性硬化症の重症度と進行度を低下させる能力は、実験的にも強く裏付けられており、これまでに行われた臨床試験でも確認されている。今後、第3相臨床試験を実施し、多発性硬化症治療薬としての可能性を検討する必要がある。
神経因性疼痛に対するミノサイクリンの効果
神経障害性疼痛の感作開始や末梢神経損傷による神経障害性疼痛に対するグリア細胞の寄与については、よく知られている(Inoue and Tsuda, 2009; Zhuo er al)。 先に述べたように、ミノサイクリンは、様々な病態において、アストログリアや神経細胞に影響を与えることなく、ミクログリアの活性化を抑制し(Yrjänheikki et al 1998; Tikka et al 2001)、このことは、脊髄に適用した場合に神経障害性動物モデルの神経細胞の感作を逆転させるという報告を正当化していると考えられる(Tikka et al 2001; Raghavendra et al 2003)。実際、ミノサイクリンは、末梢神経の損傷、炎症、脊髄損傷によって引き起こされる実験的な神経障害性疼痛に対して、全身(i.p.)および局所(髄腔内)に投与することで、抗侵害受容作用を発揮することがいくつかの研究で明らかになっている(Raghavendra er al)。 このような場合のミノサイクリンの有益な効果は、できるだけ早期に、特に開始段階で投与することで明らかに向上する(Ledeboer et al 2005,Owolabi and Saab 2006,Mei et al 2011)。同様に、ミノサイクリンは最近、腹側後外側の視床に注射することで、坐骨神経痛に続発するミクログリアの反応性と熱痛を逆転させることがわかっている(LeBlanc er al)。 特に注目されているのは、糖尿病性神経障害の発症におけるミノサイクリンの効果である。Pabreja et al 2011)は、ミノサイクリンの慢性投与により、糖尿病ラットの冷アロディニアおよび熱痛覚過敏が有意に抑制されることを報告した。この効果は、これらの糖尿病動物の脊髄における炎症性サイトカインの減少と酸化ストレスバランスの減衰に関連していた。さらに、糖尿病におけるミノサイクリンの有益な効果は、おそらく糖尿病によって誘発されるサイトカインおよびサイトトキシンの産生を抑制することによる、網膜合併症の予防と関連していた(Krady er al)。 この知見と一致するように、Wang et al 2005)は、ミノサイクリンが、網膜ミクログリアにおける細菌性LPSに起因するIL-1β、TNF-αおよびNOのアップレギュレーションと放出増加を抑制することを示した。Cai et al 2011)は、糖尿病性脳障害に対するミノサイクリンの神経保護メカニズムを調査し、糖尿病ラットの糖代謝の変化による行動障害を改善することを報告した。さらに、NF-κB経路の上流にあるシグナル伝達分子を阻害し、酸化ストレスを軽減することで、海馬で増加したAβを抑制することを明らかにした。その後、ミノサイクリンの抗侵害受容作用は、さまざまな神経障害性疼痛モデル(脊髄神経切断、末梢神経損傷、炎症、坐骨神経痛、脊髄損傷)で確認され、特に開始段階で投与された場合には、ミクログリアの活性化を抑制することに起因するとされている。糖尿病では、ミノサイクリンが糖尿病性神経障害の改善に加えて、網膜合併症を予防し、行動障害を改善した。ヒトでの臨床試験はまだ行われていないが、入手可能な実験データによれば、ミノサイクリン療法はこれらの症状に対する合理的なアプローチと思われる。
脊髄損傷に対するミノサイクリンの効果
ミクログリアの活性化に起因する神経障害性疼痛と運動機能低下がSCIの侵害受容性過敏症の引き金になっていると考えられるので、ミノサイクリンはこの症状の合併症を治療するための合理的なアプローチとなりうる(Colburn et al 1999)。この命題の支持は、ミノサイクリンが脊髄損傷後の神経因性疼痛を軽減する可能性を示す様々な研究結果から得られる。しかし、ミノサイクリンが脊髄損傷後の運動回復を促進する能力に関するデータはほとんどなく、この可能性については議論の余地がある。ネズミの脊髄損傷モデルにおいて、ミノサイクリンの投与は、後肢の機能と筋力を有意に改善し、脊髄の総病変サイズを減少させ、軸索の温存を誘発した。ミノサイクリンを投与したマウスは、ヒトの急性SCIの治療法として承認されているメチルプレドニゾロンを投与したマウスよりも優れた行動回復を示した(Wells et al 2003)。脊髄損傷ラットにおいて、ミノサイクリンはミトコンドリアからのシトクロムcの放出を阻害し、長期的な後肢の運動能力を顕著に向上させた(Teng et al 2004)。さらに最近では、Saganová et al 2008)が、ミノサイクリンの短期および長期の投与が、損傷の震源地の直近の脊髄に対して神経保護効果を持つことを示した。以前のデータでは、ミノサイクリンは、病変の震源地よりも吻側および尾側の両方の部位で、白質および運動ニューロン数の保護効果を発揮することが示されていた(Teng er al 2004)。
ミノサイクリンは、ミクログリアによる神経成長因子の産生を抑制することで、外傷性脊髄損傷後のオリゴデンドロサイトの死やアポトーシスを減少させ、脊髄損傷後の機能回復を改善することも示されている。また、SCI後のp75ニューロトロフィン受容体の発現およびRas homolog gene family member A(RhoA)の活性化を抑制した(Yune er al)。 さらに、Festoff et al 2006)は、ミノサイクリンがミクログリオシスを減少させ、カスパーゼの発現を抑制することでSCIにおいても神経保護効果を発揮する可能性があると報告している。最近の研究では、胸部SCIのラットモデルにおいて、運動ニューロンの回復および神経因性疼痛に対するミノサイクリンの効果が報告されている(Cho er al 2011)。この研究では、ミノサイクリンを投与した動物は、対照動物に比べて、術後2日目に運動スコアが高くなり、機械的痛覚過敏が軽減されたことが明らかになった。神経障害性疼痛行動の減少と運動機能の回復は、それぞれミクログリアとアストロサイトの活性化の減少と相関していた。実験データによると、ミノサイクリンはSCIにおいて、痛みを和らげたり、病変発生後の運動機能の回復を促進したりするなど、さまざまな効果を発揮することが明らかになった。しかし、ミノサイクリンをヒトの脊髄損傷に適用するための臨床研究はまだ行われていない。
虚血に対するミノサイクリンの効果
ミノサイクリンは、試験管内試験および生体内試験の両方で、虚血時に腎臓、心臓、肺、神経細胞の組織損傷を抑制することが明らかになっている(Yong et al 2004,Stirling et al 2005,Sutton et al 2005,Jordan et al 2007)。脳卒中を考えると、脳卒中後の血液脳関門の破綻は、水腫を増やし、出血を引き起こすことで、虚血性傷害を悪化させる。ミノサイクリンは、おそらくミクログリアの活性化を阻害する能力があるため、実験的に脳卒中を発症したマウスにおいて、血液脳関門の破壊と出血が著しく減少した結果、梗塞体積と神経学的障害を軽減することができた(Yenari er al)。 この予備的な証拠に基づいて、脳卒中患者を対象とした臨床研究が行われた。Lampl et al 2007)は、ミノサイクリン(200mg)を5日間経口投与し、脳卒中発症後6〜24時間を治療期間とすることで、プラセボと比較して良好な転帰が得られたと報告している。この有益な効果は、これまでの報告(Kraus et al 2005)と同様に、虚血組織の酸化ストレスの顕著な鈍化と関連していると考えられる。もう一つの虚血状態である心筋虚血再灌流(I/R)傷害では、MMPやセリンプロテアーゼの活性化に関連した損傷が見られたが、ミノサイクリンは保護効果を発揮し、様々な前臨床試験で確認された。生体外の心臓システムや培養心筋細胞を用いた評価では、ミノサイクリンがアポトーシスの細胞経路に影響を与えることが明らかになった(Scarabelli et al 2004)。様々な生体内試験研究でも、ミノサイクリンの心臓保護作用が報告されている。I/Rを受けたラットに抗生物質を事前および事後に投与すると、梗塞サイズが有意に減少し、MMP-9活性と酸化ストレスの減少を伴う効果が得られた(Romero-Perez er al 2008)。これらのアッセイは、梗塞心筋におけるテトラサイクリン類の蓄積が組織損傷の程度に直接関連しているという以前の結果を裏付けるものであった(Holman er al)。1973; Holman and Zweiman, 1975)。実際、心筋に蓄積したミノサイクリンのレベルは、血漿中のレベルよりも数倍高く、正常心筋に比べて虚血心筋での蓄積量が増加していた。このように、ミノサイクリンの心筋保護作用の一部は、ミノサイクリンの組織レベルが高く、標的に顕著な効果を与えることができることに起因している可能性がある。ミノサイクリンの心筋保護作用の一部は、ミノサイクリンの組織レベルの高さに起因すると考えられる。最近の研究では、ミノサイクリンの心筋虚血およびI/R損傷に対する保護効果は、I/R損傷時の炎症および細胞損傷の初期メディエーターとして作用することがわかっているタンパク質である高可動性グループボックス1(HMGB1)の発現抑制にも起因するとされている(Andrassy et al 2008,Hu et al 2010)。PARP-1の阻害は、ミノサイクリンの心筋保護作用のメカニズムとしても提案されている(Tao er al)。 心筋のI/R傷害時には、活性酸素や窒素種が増加し、酸化的なDNA損傷が生じ、PARP-1などの核内修復酵素が活性化される。これらの酵素は、通常の状態ではDNA修復を促進するが、過剰になると細胞死に至る可能性がある(Zhang and Niu, 1994; Yu et al 2002; Alano et al 2006)。酸素-グルコース欠乏を用いてI/R傷害を模擬したラット成体培養心筋細胞において、ミノサイクリンはマイクロモル濃度で、細胞死およびPARP-1活性化の生化学的マーカーを有意に減少させ、ミトコンドリア伝染性遷移を防止した(Tao er al)。 さらに、ミノサイクリンは、ラットの虚血誘発心室性不整脈の予防にも有効であることが報告されている。心室細動の発生率、心室頻拍に加えて識別できない低電圧QRSコンプレックスのエピソードの持続時間と回数、および不整脈の重症度は、ミノサイクリンの投与によって有意に減少した(Hu er al 2011)。この研究で著者らは、ミノサイクリンの抗不整脈効果は、PI3K/Aktシグナル伝達経路およびミトコンドリアKATPチャネルの活性化と関連しているのではないかと推測している。これらのシグナル伝達経路は、心筋虚血時の虚血または薬理学的プレコンディショニングによる抗不整脈効果に関与することが知られている(Végh and Parratt, 2002; Gourine er al)。 ミノサイクリンは、試験管内試験および生体内試験の実験モデルで示された心筋作用、抗酸化作用、心筋保護作用を考慮すると、脳卒中患者で示されたのと同様の臨床効果が心筋虚血患者にも期待できる。
動脈硬化に対するミノサイクリンの効果
ミノサイクリンは、血管細胞の細胞保護作用に関連して、動脈硬化を予防することがさまざまな研究で提案されている。ミノサイクリンは、糖尿病性微小血管合併症を予防し(Krady et al 2005年)ラット頸動脈の急性血管損傷後の大血管疾患における新生内膜形成を減少させることが示されている(Pinney et al 2003)。これらの研究では、ミノサイクリン投与後に血管平滑筋細胞(VSMC)の数の減少が見られ、これはMMP活性およびサイトカインによるVSMCの移動の阻害によるものと考えられている(Pinney et al 2003,Yao et al 2004)。さらに、ミノサイクリンは、試験管内試験のヒト大動脈VSMCにおいて、VEGFによって誘導されるMMP-9のmRNAの転写およびタンパク質の活性化を阻害することが示されている(Pinney et al 2003,Yao et al 2004)。さらに最近では、Shahzad et al 2011)が、ミノサイクリンがPARP-1およびp27Kip1依存的なメカニズムにより、食事誘発性動脈硬化症のプラークサイズおよび血管狭窄を減少させることを示した。In vitroのアッセイでは、ミノサイクリンがヒト大動脈平滑筋細胞(HASMC)やネズミの初代大動脈VSMCなど、さまざまな種類の細胞の増殖過程を抑えることが明らかになった。これらのデータは、ミノサイクリンを投与したApoE-/-高脂肪食(HFD)マウスの動脈硬化プラーク内で観察されたVSMCの数の減少を説明するものと思われる(Shahzad et al 2011)。彼らはまた、ミノサイクリンのVSMCにおける抗増殖効果がp27Kip1に依存することを明らかにした。ミノサイクリンは試験管内試験ではVSMCとHASMCの両方で、ex vivoでは動脈硬化プラークで発現を誘導したからである。注目すべきは、マウス大動脈初代細胞でp27Kip1をノックダウンすると、ミノサイクリンの抗増殖効果が消失したことである。さらに、ミノサイクリンは、ApoE-/-HFDマウスの上腕骨動脈のプラークにおいて、PARP-1活性のマーカーであるポリADPリボース形成を減少させ、特に低密度リポタンパク質処理したHASMCにおいて、PARP-1の発現を著しく減少させた。ミノサイクリン投与後のアテローム性動脈硬化プラークサイズの減少は、主にVSMCに対する抗増殖作用によるもので、ミノサイクリンの血管合併症への応用の可能性を示唆している。しかし、まだ臨床試験は行われていない。
炎症性腸疾患に対するミノサイクリンの効果
実験的大腸炎に対するミノサイクリンの効果は 2009年に(Huang et al 2009b)によって初めて報告された。彼らは、デキストラン硫酸ナトリウム誘発大腸炎の予防と治療にミノサイクリンを使用し、死亡率を有意に減少させ、疾患の重症度を軽減したと報告した。これらの有益な効果は、腸管組織におけるiNOSおよびMMPの発現低下と関連していた。これらの結果を受けて、Garrido-Mesa et al 2011a)は、マウスとラットの大腸炎実験モデルにおいて、ミノサイクリンの腸管抗炎症作用を確認し、免疫調整作用はないものの、従来からヒトの炎症性腸疾患の治療に用いられてきたメトロニダゾールなどの他の抗生物質よりも高い効果があることを示した(Perencevich and Burakoff, 2006)。その研究では、ミノサイクリンの免疫および微生物学的パラメータの両方を調整する能力が、その有益な効果に寄与していることが提案された。後者については、実験的大腸炎の特徴である腸内細菌叢の不均衡がミノサイクリンの投与により回復したが、他の抗生物質ではそのような効果が見られなかった。さらに、再燃した大腸炎のマウスモデルでは、ミノサイクリンと、これらの腸内環境で有益な効果を示すことが報告されているプロバイオティクスEscherichia coli Nissle 1917とを関連付けることで、個々の治療法よりも大きな腸内抗炎症効果を発揮し、さらに、大腸炎の再燃を抑制することができた(Garrido-Mesa er al)。l., 2011b)。したがって、ミノサイクリンの免疫調整作用と抗菌作用の併用は、炎症性腸疾患のような多因子疾患の治療に非常に有用であると考えられる。
アレルギー性喘息に対するミノサイクリンの効果
最近、Joks et al 2010)は、ミノサイクリンが、IgM、IgG、IgAの反応に影響を与えずに、進行中のヒトおよびマウスのIgE反応を抑制することを示した。また、BPO-KLH感作マウスの脾臓および腸間膜リンパ節細胞のメモリーIgE抗体形成反応の試験管内試験誘導をミノサイクリンが強く抑制することを報告している。その抑制効果は用量依存的で、IgEアイソタイプ特異的であった(Joks er al 2010)。さらに最近では、ミノサイクリンが喘息患者の末梢血単核細胞(PBMC)による試験管内試験のIgE産生を抑制するが、非喘息患者のPBMC培養ではIgEレベルに変化がなかったことが報告されている。アレルギー性喘息患者のPBMCによるIgE反応をミノサイクリンが抑制するためには、CD4+およびCD8+ Tリンパ球の両方の存在が必要であることがわかった。最後に、これらのミノサイクリンを介したIgE反応の低下は、これらの患者のTリンパ球におけるp38 MAPKの抑制と関連していた(Joks and Durkin, ,b)。これらの効果は、無作為化二重盲検プラセボ対照クロスオーバー試験において、ミノサイクリン治療後にアレルギー性喘息患者に観察された改善効果を説明するものと思われる(Daoud er al 2008)。この試験では、患者さんの喘息症状と気管支症状が有意に改善され、ステロイドの経口投与量も減少したことから、ミノサイクリンの喘息治療への有用性が期待されている。
HIV感染症に対するミノサイクリンの効果
ミノサイクリンは、ミクログリア、マクロファージ、リンパ球におけるHIVの活性化、増殖、ウイルス複製を阻害することが試験管内試験の研究で示されている(Si et al 2004,Zink et al 2005,Nikodemova et al 2007)。同様に、いくつかの実験モデルにおいても、ウイルス感染や免疫反応を抑制することが示されている(Si et al 2004,Zink et al 2005,Follstaedt et al 2008,Ratai et al 2010,Szeto et al 2010)。ミノサイクリンをHIV感染症に使用する可能性を示した最初の研究の1つは、HIV関連の神経障害の類人猿(SIV)モデルで行われた(Zink et al 2005)。ミノサイクリンを投与したSIV感染マカクは、脳炎の重症度が低く、中枢神経系の炎症マーカーの発現が減少し、軸索変性が減少したことが指摘された。また、ミノサイクリンを投与することで、髄液や血漿中のウイルス量、脳内への細胞障害性リンパ球の浸潤が有意に減少したことが分かった。In vitroのアッセイでは、ミノサイクリンは、MCP-1/CCL2産生の減少と関連して、ヒト初代リンパ球におけるp38活性化とHIV複製も減少させることが明らかになった(Zink er al 2005)。この結果を受けて、後天性免疫不全症候群(AIDS)臨床試験グループ(http://clinicaltrials.gov/ct2/show/NCT00361257)では、ミノサイクリンがHIV感染者の認知機能を改善するかどうかに焦点を当てた研究が行われた。また、Szeto et al 2010)は、ヒト初代CD4+T細胞において、ミノサイクリンが有意な抗HIV作用を有することを示した。抗生物質の投与により、シングルサイクル複製、初代CD4+T細胞由来のHIV潜伏モデルからの再活性化、基準株HIV NL4-3でのde novo感染後のウイルスRNA発現が減少した。これらの生体外実験では、ミノサイクリンが高活性抗レトロウイルス治療(HAART)中のHIV感染者の静止CD4+リザーバーからのウイルス発現を減少させる能力があること、ミノサイクリンの抗HIV効果が実験室株と臨床株の両方のHIVに適用されることが初めて示された(Zink er al)。 ミノサイクリンは、CD4+T細胞に対して、HIVの寛容性や潜伏期からの再活性化を抑えることで、HIVを障害する多くの効果があることが示されている。ミノサイクリンは、T細胞の活性化を変化させ、HIVの複製を制御する活性化経路に重要な活性化/増殖マーカーの発現やサイトカインの分泌の変化を鈍らせることが示されている。一方、ミノサイクリンはHIVの複製にも影響を与え、DNAの組み込みや転写を阻害することで、用量依存的にウイルスの生産量を減少させることが明らかになっている。これらのデータは、ミノサイクリンが、HAARTと組み合わせた新しい維持療法として有効であることを裏付けている(Szeto er al)。
CD4+T細胞とウイルス複製に対するミノサイクリンの効果に加えて、この抗生物質によって引き起こされる単球/マクロファージの活性化の減少は、SIV-AIDSにおいて神経保護の役割を果たすことができる。Ratai et al 2010)は、神経性AIDSを加速させた非ヒト霊長類モデルにおいて、ミノサイクリンを投与した動物がSIV脳炎を発症しなかったことを報告している。さらに最近では、Campbell et al 2011)が、ミノサイクリンのT細胞に対する作用だけでなく、単球の活性化を抑制する作用が、SIV神経エイズにおける神経細胞の保護と相関していると結論づけている。著者らは、ミノサイクリン投与後、試験管内試験でCD14+単球のウイルス複製が減少することは、これらの細胞の脳内への交通が阻害されることと直接関連していると観察した。したがって、ミノサイクリンによる活性化単球の拡大と神経細胞の保護には相関関係があった。このことは、アカゲザルにおけるSIV-neuropathogenesisの迅速なモデルで示されたように、生体内試験でHIVやSIVのCD14+CD16+標的細胞の複製や豊富さの低下につながる可能性がある。このモデルでは、ミノサイクリンの投与により神経細胞が保護された。ミノサイクリンは、単球の活性化と投与動物のリンパ節への蓄積を抑え、単球の交通と機能に重要ないくつかのマーカー(CCR2,CD163,CD11b、CD64)の発現を抑制した。これらの結果から、ミノサイクリンの抗ウイルス作用は、単球の活性化とウイルス感染に対する耐性を低下させる能力と関連していると考えられる。
残念なことに、前述のような証拠があるにもかかわらず、小規模なパイロット研究では、ミノサイクリンが未治療の慢性HIV-1感染症における脳脊髄液のHIV感染や免疫活性化を調節できなかったことが報告されている(Ho et al 2011)。この研究に参加した患者の慢性感染は、中枢神経系や全身のマクロファージの活性化や脳脊髄液感染にミノサイクリンがほとんど効果を示さなかったことから、ミノサイクリンが修飾するには弱すぎるレベルの免疫活性化とウイルス複製を示していた可能性がある。さらに、脳炎がないということは、標的となる中枢神経系疾患が少なかった可能性がある。生物種の違い(ヒトとマカク)と疾患ターゲットの違い(疾患期間と脳炎の有無)を考慮する必要がある。さらに、著者らは、研究デザインの限界(規模が小さいこと、期間が短いこと、未治療の対照群がないことなど)を認めており、そのために第2種エラーが生じ、ミノサイクリンの効果を検出する力が低下した可能性がある。しかし、ミノサイクリンの神経保護作用がHIV感染に伴う認知障害の治療に有用であることは、Sacktor et al 2011)が最近行った臨床試験でも否定されている。これらの結果と前述の試験の限界を考慮すると、AIDS患者のこれらの指標に対するミノサイクリンの有効性を十分に検証するには、より大規模な研究が必要である。さらに、ミノサイクリンの効果が試験管内試験および実験モデルで報告されていることから(Zink et al 2005,Szeto et al 2010年)例えば、免疫活性化のレベルが部分的に低下している良好な治療を受けている患者や、抗レトロウイルス薬との併用など、さらなる研究の基礎があるかもしれない。
自閉症に対するミノサイクリンの効果
FXSは、認知障害や自閉症スペクトラムの最も一般的な遺伝的決定因子である(Koukoui and Chaudhuri, 2007; Penagarikano et al 2007)。ミノサイクリンは、実験動物やヒトを対象とした様々な研究から得られた証拠に基づき、新たなFXS治療薬の可能性があることが近年明らかになった。FXSモデルマウスにおいて、ミノサイクリンは海馬の樹状突起棘の成熟を促進し、不安や記憶の障害を抑制したが、これはMMP-9を特異的に阻害したことによると考えられている(Bilousova er al)。 さらに、SillerとBroadie(2011)は、FXSのモデルであるショウジョウバエを用いて、神経回路構築の欠陥がミノサイクリンの投与によって緩和され、正常なシナプス構造が効果的に回復することを示した。この結果は、ミノサイクリンがFXSの治療薬として有望であることを裏付けるものであり、以前に報告されたように、ミノサイクリンがMMP阻害を介して作用する可能性を確認した(Bilousova er al)。 実際、ミノサイクリンはFXS患者を対象とした非盲検追加試験において、イライラ、ステレオタイプ、多動性、不適切な発話の下位尺度など、様々な症状がミノサイクリンの投与により改善されたことが報告されている(Paribello er al 2010,Utari er al 2010)。
骨粗鬆症に対するミノサイクリンの効果
ミノサイクリンは、いくつかの方法で骨の生理機能を改善する。閉経後骨粗鬆症のモデルである卵巣摘出ラットにおいて、ミノサイクリンは海綿骨の骨形成を増加させ、骨量を減少させ、エストロゲン療法と同様の効果を示した(Williams et al 1996)。その後の研究では、ミノサイクリンの投与により、卵巣摘出後に誘発された骨密度の低下が防止され、大腿骨の海綿骨領域に誘発された有害な効果が廃止された(Williams et al 1998)。この研究では、ミノサイクリンは、骨吸収をわずかに減少させると同時に、骨形成を大幅に促進するという二重の効果を示した。さらに、ミノサイクリンは、卵巣摘出ラット由来の骨髄間質細胞のコロニー形成効率を刺激することが判明しており、これが骨形成促進効果の説明になっていると考えられる。また、ラットの骨修復同期モデルでは、ミノサイクリンは骨膜と骨芽細胞の層の両方の崩壊を著しく阻害し、骨芽細胞の合成活性を維持し、間質のコラゲナーゼ活性を阻害し、その結果、骨吸収を抑制した(Klapisz-Wolikow and Saffar, 1996)。最後に、テトラサイクリンの特徴である自然な骨刺激性は、破骨細胞や骨腫瘍細胞が産生するMMPを阻害する効果を高める(Saikali and Singh, 2003)。
ミノサイクリンの癌に対する効果
MMPによる細胞外マトリックスの分解は、がんの浸潤・転移において重要な現象である(Hua et al 2011)。テトラサイクリン類のMMPに対する強力な阻害効果を考慮して、メラノーマ、肺がん、乳がん、前立腺がんなど、さまざまながんでその抗がん作用が研究されている(Lokeshwar, 2011)。ミノサイクリンは、マウス腎腺癌(MRAC-PM2)細胞の試験管内試験浸潤および実験的肺転移を阻害することが示されている(Masumori er al)1994)。また、MRAC-PM2細胞をマウスにi.v.注射した際、ミノサイクリンをi.p.投与すると、肺への転移結節の数が減少した。また、ミノサイクリンはMRAC-PM2細胞のIV型コラーゲン分解活性を抑制し、このことがMRAC-PM2細胞の転移能の抑制に寄与していると考えられる(Masumori er al)。 ミノサイクリンは、その骨指向性を考慮すると、骨内の腫瘍細胞が産生するMMPを抑制するのに非常に有効であった(Saikali and Singh, 2003)。さらに、セレコキシブとの併用により、ミノサイクリンは腫瘍細胞死を増加させ、MMP-9とVEGFの腫瘍発現を減少させることで、ヌードマウスにおける乳がんの骨転移を抑制した(Niu er al)。 さらに、ミノサイクリンは、試験管内試験および実験的マウスモデルの両方で神経膠腫の成長を抑制し、その効果は神経膠腫に関連するミクログリアにおける膜型1 MMP(MT1-MMP)の発現を強く抑制することと関連していたことから、悪性神経膠腫に対する補助療法の有望な新規候補であることが示されている(Markovic er al)。 さらに、ミノサイクリンは、C6グリオーマ細胞の異種移植モデルにおいて、腫瘍の成長を阻害することが報告されている。この効果は、オートファジーによる細胞死の誘導と関連していたが、ミノサイクリンは、オートファジーが阻害された場合にもカスパーゼ-3の活性化を通じて細胞死を誘導した(Liu et al 2011)。したがって、これらの実験データは、ミノサイクリンが示す抗増殖活性、抗血管形成活性、マトリックス刺激活性が、ミノサイクリンの抗転移性および抗腫瘍性を高めることを裏付けている。さらに、ミノサイクリンは、標準的ながん化学療法を受けている患者にとって、薬物による腸の損傷を軽減することで有益であると考えられる。5-フルオロウラシルによる小腸粘膜炎のモデルでは、ミノサイクリンは腸の損傷からマウスを保護した。ミノサイクリン投与により、体重減少、下痢、絨毛の測定値が改善し、マウス小腸におけるTNF-α、IL-1β、iNOSの発現を抑制し、アポトーシス指標を低下させ、PARP-1活性を阻害した。さらに、ミノサイクリン処理は、腫瘍CT-26異種移植マウスにおける5-フルオロウラシルの抗腫瘍効果を増強するようであった(Huang et al 2009a)。
おわりに
以上、ミノサイクリンは、古くから尋常性ざ瘡、口腔周囲炎、皮膚サルコイドーシスなどの抗生物質として使用され、現在は関節リウマチなどの炎症性疾患の治療にも使用されている。しかし、現在、ミノサイクリンには、抗炎症作用、免疫調節作用、神経保護作用があることが実証されている。動物モデルを用いた様々な研究やいくつかの臨床試験により、ミノサイクリンの有益な効果と安全性が確認されており、単独または他の薬剤との併用により、炎症性疾患の治療薬として期待されている。ミノサイクリンには複数の作用機序が提案されており、複数の標的に作用する薬剤として注目されている。
抗酸化作用,カルシウムキレート作用,iNOSやMMPなどの炎症性酵素の阻害作用などは,この総説で検討したほとんどの疾患におけるミノサイクリンの有益な効果に顕著な役割を果たしていると考えられる。しかし、他のテトラサイクリン、特にドキシサイクリンは、これらの特性の一部を共有していることが報告されているが、同じモデルで同様の効果を示していない。
したがって、ミノサイクリンがテトラサイクリン系薬剤の中でも特に優れた薬剤であるのは、複数のターゲットを持っているからだと思われる。
さらに、ミノサイクリンには注目すべきいくつかの魅力的な利点がある。ミノサイクリンは、一般的にヒトにおいて安全な薬剤と考えられており、副作用のプロファイルも知られている。ミノサイクリンの治療効果を正確に評価するには,生体内での作用メカニズムをより深く理解する必要があるが,この抗生物質の有望な結果と魅力的なメリットは,この総説で述べた多くの疾患の治療法として期待されるものである。
