Contents
ハイパーサーミア・サウナによる免疫活性
発熱による免疫反応の調整
Koorts & COVID-19-Complicaties
www.researchgate.net/publication/340388937_Koorts_COVID-19-Complicaties
COVID-19は主に自然免疫系を抑制し、初期段階でウイルスを制御できず拡散を可能にする。自然免疫系の抑制される程度によって、疾患の重症度が決定される。
感染症と戦うための重要な免疫系メッセンジャー
- TNF-α
- IL-1β
- IL-6
- NF-κB
発熱は感染に対する急性の免疫反応であり、 細菌の増殖とウイルスの複製の阻害 自然免疫応答 ヒートショックプロテインの生成 によって、抗ウイルス効果を発揮する。
発熱は初期にはサイトカイン産生を増加させ、最終的にはサイトカイン産生を減少させる。この調整は部分的にHSPとNF-κBによって行われる。 発熱は諸刃の剣の側面があるが、通常は原因がわかっており脱水症状等がなければ自己制御されており危険を及ぼすことはない。
調整により、発熱は急性の過剰な免疫反応を抑制し、組織の損傷を防ぐことができる。
視床下部の体のサーモスタットを制御するメカニズムは、COX-2によるアラキドン酸(AA)からプロスタグランジンE2(PGE2)への変換を通じて機能する。 PGE2はその後、視床下部のニューロンに直接作用するため、発熱に必要不可欠である。
アスピリン、タイレノール、イブプロフェン、ジクロフェナク、ナプロキセン(または他の非ステロイド性抗炎症薬(NSAID))などの解熱鎮痛薬は、COX-2を阻害し、続いてPGE2を阻害することで発熱を緩和する。
これにより、ウイルス感染に対する免疫応答が低下し、症状が重篤化、感染期間が延長する可能性がある。 COVID-19による発熱の治療は、重度のCOVID-19合併症リスクを高める可能性がある。
解熱鎮痛剤・NSAID
サイトカインストームを抑制する可能性
ard.bmj.com/content/early/2020/04/22/annrheumdis-2020-217598
Covid-19患者において、NSAIDの併用療法が有害または安全であるかどうかは不明。ただし、抗炎症療法はCovid-19の致命的なサイトカインの嵐を防ぐ可能性がある。
一般的に処方されているNSAIDであるイブプロフェンは、ヒトの組織および喀痰においてインターロイキン-6(IL-6)を減少させることがわかっている。
発熱に対して恐怖症になってはいけない
www.sciencedirect.com/science/article/pii/S1876034120304974
2019年12月に武漢(中国)で発生した新型コロナウイルス疾患COVID-19は、容易にパンデミックに発展した。ウイルスは粘膜(鼻腔粘膜および喉頭粘膜)を介して細胞に侵入し、その後、呼吸器系の臓器に侵入し、発熱と咳である感染の最も一般的な初期症状を確立する[1]。
その後、ウイルスは呼吸器系から末梢血に移行し、ウイルス細胞の主要な受容体(すなわち、アンジオテンシン変換酵素2)を発現している臓器に感染する可能性がある。臨床症状は、初期の肺炎から始まり、急性呼吸窮迫症候群に進行し、多臓器不全を経て死亡することもある。
このウイルスは感染の初期段階では高い複製動態を示し、回復した患者では減少するが、致死的な転帰を示す患者では依然として高い複製動態を示す [2]。SARS-CoVやMers-CoVを含む高病原性コロナウイルスの特徴は、いわゆる「サイトカインストーム」である。
SARS-CoV-2は、IL-1ßおよびIL-6を含む炎症性サイトカインの放出につながるToll-Like Receptorを介して、自然免疫系、マクロファージおよびその他の自然免疫細胞を活性化する。適応免疫もまた、抗原提示細胞によって活性化される。T細胞もB細胞も抗ウイルスの役割を果たすだけでなく、炎症性サイトカインの分泌を促進する。
ウイルス感染は、インターフェロン(INF)の早期産生によって、温度上昇を含む抗ウイルス応答の強力な引き金となり、それによってウイルス複製および「ウイルス性」敗血症を制限する。臨床的には、INF産生の遅延およびウイルス力価の低下は劇症的であり、プロ炎症性サイトカインの放出を伴う強固な炎症性単球-マクロファージおよび好中球浸潤につながることは明らかである。
ウイルス感染症の治療に関する現在のガイドラインでは、病気の経過中に早期にインターフェロンを投与すれば最良の予測が保証されるが、後の段階では限られた利点しかない。
もう一つの臨床的な選択肢は、宿主免疫系を強化するか、あるいは少なくとも、ウイルスに対する身体の病態生理学的反応を妨害しないことであろう。この反応は体温の上昇に代表されるもので、ウイルス負荷の上昇や抗体反応の低下から患者を守ることができるかもしれない。
解熱剤(作用機序に関係なく、どんな解熱剤でも)で発熱を治療する場合、私たちは、Sars-CoV-2のような微妙で高病原性のウイルスの優位性に免疫反応の足を引っ張るだけである。発熱自体は自己制限的なものと考えられ、適切な水分補給が行われていれば深刻な問題になることはほとんどない。
例えば、ヒトに感染するほとんどのインフルエンザA株は温度感受性が高く、38~41℃の生理的発熱範囲内の温度では複製が阻害される。
より高い温度で増殖する変異株の中には、より重篤な感染結果につながるものもある。ウイルス感染では、発熱反応が生存の優位性を決定する [3]。
全体的に、臨床データは、軽度のウイルス性疾患の経過や重症度に抗ピリシスが臨床的に有意な有益または有害な影響を与えるという仮説を支持していない。
COVID-19感染中の死亡率の増加は、COVID-19感染症における非ステロイド性抗炎症薬(NSAIDs)の使用の妥当性に関する議論を巻き起こしている[[4], [5], [6]]が、イブプロフェンよりもアセトアミノフェンを使用することがコンセンサスとなっているが、治療は腎機能および肝機能を考慮して入院患者に個別化されるべきである。
(www.hopkinsguides.com/hopkins/ub?cmd=repview&type=4,791,124&name=4_538747_PDF)。
NSAIDs の主な副作用は、出血、アレルギー反応肝臓や腎臓の問題、高血圧を含む消化器系の副作用が含まれる。要は、NSAIDsの使用を禁忌とするエビデンスがまだ不足しているだけでなく、NSAIDsの使用が治療上有益であるというエビデンスも不足しているため、慢性疼痛やてんかんの場合のみNSAIDsの使用にとどめることが示唆されているのである。
結論として、解熱剤は継続的な医学的管理の下で投与されなければ有害であると考えられる。免疫抑制療法は、重篤な未病患者の感染サイクルの後期には有用であるが、感染した比較的無症状の患者(熱が38.5℃以下)には、熱を放っておくことが最善の選択肢の一つである。
発熱の効果
7分28秒あたりから、フィンランド式サウナ、温冷療法についての話も出てくる。
温熱療法
MedCram 温熱療法・サウナ
SARS-Cov2は宿主の免疫システムを巧妙に抑制して回避する、そのため初期症状は多くの人が軽症、しかし実際にはウイルスは増殖して体内に広がりダメージを与えていく。
ダメージが蓄積した結果、一部の患者が突如として重症化することになる。
感染後5日から12日までの軽症症状、このコロナウイルス特有の免疫システムが低下する期間、現状われわれはなにもせず放置している。
ここの免疫機構を高めれば重症化する20%を低下させ、病院のキャパオーバーを抑制し社会の崩壊を最小限に抑えることができるのではないだろうか?
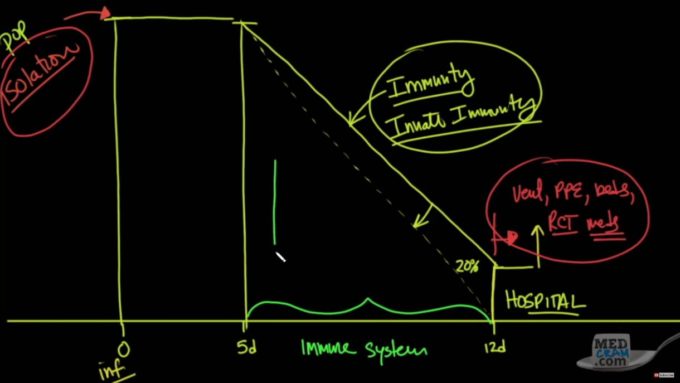
興味深いことに、フィンランドでは北欧諸国の中で100万人あたりの最小の死者数と数を維持し続けている。
概要
SARS-Cov2は宿主の免疫システムを巧妙に抑制して回避する、そのため初期症状は多くの人が軽症、しかし実際にはウイルスは増殖して体内に広がりダメージを与えていく。
ダメージが蓄積した結果、一部の患者が突如として重症化することになる。 そこで、軽症時に温冷療法などで免疫を意図的に増強させるという治療プランが考えられる。
サウナや寒冷療法などによって、COVID-19で低下した白血球や単球の上昇、サウナ好きのフィンランドやお風呂文化の日本の致死率の少なさなど、さまざまなの予備的証拠の紹介。
サウナ・熱曝露の作用メカニズム
サウナはさまざまな影響を人体に及ぼし、その熱刺激により、人体の多くのシステムの機能状態に影響を与える。
温熱療法を伴う治療として、水/電解質平衡、特定のエネルギー基質の代謝率の変化、自律神経系の活動、ホルモン系、心血管系と呼吸器系の負荷、心血管系の変化を引き起こす。
pubmed.ncbi.nlm.nih.gov/10735978/
運動は酸素と窒素のより高いレベルの反応性形態を生成し、免疫系の特定の細胞の機能を阻害する可能性がある。インビトロでIL-2、IL-4、インターフェロン(IFN)γ産生を抑制する。
www.ncbi.nlm.nih.gov/pubmed/9626336/
www.ncbi.nlm.nih.gov/pmc/articles/PMC3916915/
頻繁なサウナ入浴は中年の白人男性の肺炎リスクを減らす可能性がある 前向きコホート研究
pubmed.ncbi.nlm.nih.gov/29229091/
サウナ入浴と心肺フィットネスの組み合わせは、それぞれ単独で行うよりも心血管原因および全原因死亡率を大幅に低減させた。サウナの頻度が多い場合(週3~7回)生存にさらなる利益を増加させる可能性がある。 2277人の男性の長期コホート研究
pubmed.ncbi.nlm.nih.gov/28972808/
100万人中の感染者と死者 (2020年3月30日まで)
- サウナ好きフィンランド (感染者224人、死者11人/)
- スゥエーデン(感染者366人、死者110人/)
- ノルウェー (感染者787人、死者25人/)
- デンマーク(感染者413人、死者72人/)
免疫に対する温熱療法のポジティブな効果
- 抗原提示の増加 •腫瘍へのリンパ球動員の増加
- 樹状細胞の活動の改善
- 遺伝子治療とのポジティブな相互作用
- IL-2、TNFα、インターフェロン活動の増加
- HSPの産生 •自然免疫刺激
免疫に対する温熱療法のネガティブな効果
- 局所的な温熱療法ではサイトカイン産生は増加しない
- 発熱と全身への温熱療法ではサイトカインの産生量が違う
- リンパ球・NK細胞の活性が一時的に低下
- 腫瘍転移増加の可能性?
- ナチュラルキラー細胞の救済活動については合意がない
- 適した動物モデルがない
- 適切なヒトでの研究がない
温熱療法 NK細胞活性
ナチュラルキラー細胞を介した抗腫瘍反応における温熱療法の役割の分析
発熱範囲の熱ストレス(39.5度)が腫瘍標的細胞に対するヒトNK細胞の細胞毒性を増強することが示されている。
効果の程度はさまざまだが、臨床研究では、一般的に、がん患者または健康な被験者において、温熱療法によるNK細胞傷害活性の増強が明らかになっている。
www.tandfonline.com/doi/full/10.1080/02656730701858297
炎症誘発性サイトカインは、NK細胞活性化のフェーズを非特異的に調節する。
rupress.org/jem/article/188/9/1611/7811/An-Essential-Role-for-Tumor-Necrosis-Factor-in
NK細胞を活性化するサイトカインの一部、たとえば、TNF-α、IFN-α/β は、感染や炎症の際に発生する体温(発熱)の上昇を刺激するという点で「発熱性」サイトカインと呼べる。
pediatrics.aappublications.org/content/90/6/846.short
穏やかな温熱療法
健康なヒト被験者では、38度の軽度の全身温熱療法でも末梢血NK細胞数が増加した。ただし、局所温熱療法では効果がなかった。
europepmc.org/article/med/11146901
39.4℃で30分の全身温熱プロトコルを使用したグループでは、参加者のNK細胞を増加させた。
www.jstage.jst.go.jp/article/biomedres/28/3/28_3_119/_article/-char/ja/
39.4°Cの高温は、NK細胞によって分泌されるインターフェロンγの腫瘍細胞に対する抗増殖能力を大幅に高めることを示した。
cancerres.aacrjournals.org/content/46/1/8.short
NK細胞のATPレベルは37~41度まで安定しており、その後42度を超えると劇的に低下することがわかった。
ar.iiarjournals.org/content/38/2/655.full
NKG2D
熱ストレスによるナチュラルキラー(NK)細胞の細胞毒性の増強はNKG2D機能に依存し、形質膜NKG2Dクラスター形成と標的細胞でのウイルス感染への免疫応答に関与するMICA(MHC class I chain-related gene A)発現の増加に関連している。
jlb.onlinelibrary.wiley.com/doi/full/10.1189/jlb.1106699
HSP70によるDC-NK細胞の活性
熱ショックタンパク質70(HSP70)ワクチン接種が慢性骨髄性白血病(CML)患者のナチュラルキラー(NK)細胞活性を誘導し、インターフェロンガンマ産生を刺激する。HSP70は樹状細胞においてNKG2D発現を誘導し、NKG2Dに依存してNK細胞を活性化する
www.ncbi.nlm.nih.gov/pmc/articles/PMC2935777/
プラズマヒートショックタンパク質72応答に対する、熱クランプありおよびなしの運動の影響。
pubmed.ncbi.nlm.nih.gov/8872652/

潜在的なストレス誘導性分子シャペロンとしてのGRP78
コロナウイルス感染症の治療標的
pubmed.ncbi.nlm.nih.gov/32535155/
現在のコロナウイルスのパンデミックは世界の公衆衛生にとって最大の脅威となっており、治療標的の特定が急務となっている。本誌に掲載されたIbrahimらの最近の報告によると、SARS-CoV-2スパイクタンパク質と宿主78-kDaグルコース調節タンパク質(GRP78)との間に潜在的な結合相互作用があることが明らかになり、GRP78がウイルス侵入の促進因子となる可能性が示唆されている1。
我々の研究室では、健康と疾患の両方に影響を与え、小胞体(ER)と他の細胞コンパートメントで重要な機能を果たしているストレス誘導性、多面的なシャペロンタンパク質であるGRP78の制御と機能に長年の関心を持っている3,4 。
小胞体は、膜タンパク質や分泌タンパク質の合成、折り畳み、成熟の主要な部位である。小胞体(ER)の折り畳み能力がタンパク質合成の増加により圧倒されると、細胞はERストレスを受け、そのストレスの状況、持続時間、強度に応じてERの恒常性の回復やアポトーシスの引き金となることを目的としたアンフォールドタンパク質応答(UPR)を活性化するシグナル伝達経路の複雑なネットワークを形成する3 。
BiP/HSPA5 とも呼ばれる GRP78 は UPR のマスターレギュレーターであり、ER ストレス時にアップレギュレートされ、プロテオティックストレスを緩和する。このように、GRP78 は、制御されていない細胞増殖が UPR の活性化につながる ER 過負荷を引き起こす癌のような疾患と闘うための重要なターゲットとして浮上してきた3 。
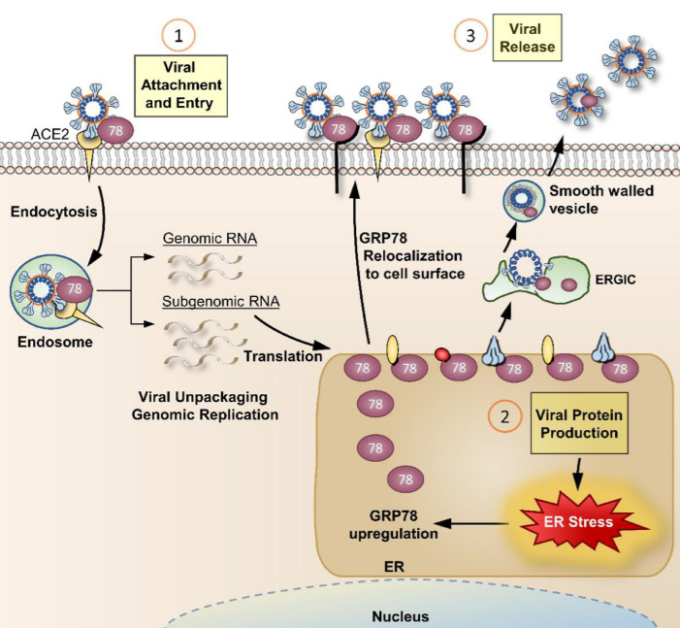
興味深いことに、ウイルス感染もまた、ERストレスを生み出し、UPRを誘発する5 。以下に概説するように、GRP78 はウイルス感染の重要な宿主因子であり、GRP78 を標的とすることで、ウイルスの侵入、産生およびその後の細胞感染を含むウイルスのライフサイクルの複数の段階を混乱させる可能性がある(図 1)。
GRP78は、ヒトおよびコウモリコロナウイルスを含む多種多様なウイルスのウイルス侵入を促進することが報告されている6(表1)。これらの研究におけるGRP78の役割は、GRP78を標的としたsiRNA、GRP78に対する抗体、SubABによるGRP78のタンパク質分解切断、低分子AR12および天然物EGCGの両方を使用して調査された3,6,7。
通常ERに存在するGRP78は、どのようにしてウイルスの宿主細胞への付着を促進するのであろうか?コロナウイルス感染などのERストレスを受けると、豊富なER内腔タンパク質であるGRP78の一部が積極的にERから細胞表面に移動し、ウイルスの侵入を含む新たな機能を獲得する3,4,6,8(図1)。
MERS-CoV および bCoV-HKU9 コロナウイルスの場合、スパイク蛋白質は細胞表面の GRP78 (csGRP78) に結合しているが、これに加えてコグニート受容体も結合している6 。
このことは、csGRP78 が CD44 や CD1098 などの細胞表面受容体と相互作用して安定化するという最近の観察結果と一致している9 。さらに、一次ウイルス受容体の発現が低い細胞型では、csGRP78 はウイルス侵入のための代替ホスト因子として機能する可能性がある。これらの概念を検証し、GRP78 が SARS-CoV-2 の侵入に重要な宿主因子であるかどうかを確認するためには、今後の研究が必要である。
ウイルス感染細胞の表面上でのGRP78のアップレギュレーションを利用して、抗ウイルス薬や免疫調節薬をSARS-CoV-2に感染した細胞集団に誘導することができるという考えもまた、研究の価値がある。
ウイルスの侵入を超えて、GRP78は、ウイルスタンパク質の合成および成熟において主要な役割を果たすことができる(表1)。ウイルスは義務的な細胞内寄生虫であり、ウイルスの生産、組み立て、および出芽に必要なタンパク質を製造するために、主に細胞内の機械に依存している。
さらに、SARS-CoV-2を含む多くのウイルスは、ウイルスの侵入を容易にするために宿主細胞の受容体と結合するために、その表面にウイルスの糖タンパク質を含む脂質二重層によって包まれている。これらのウイルスエンベロープ蛋白質は膜包埋されているため、ERで合成・処理される。
恒常性を維持するために厳密に制御されている細胞内タンパク質合成とは異なり、コロナウイルスのようなウイルスは、宿主のタンパク質生産を選択的に停止し、ウイルスタンパク質を大量に合成するために宿主のER翻訳機械を利用することができる。
これはER過負荷となり、ERストレスとUPR活性化を引き起こす。その結果、ERストレスとGRP78のアップレギュレーションは、多種多様なウイルスによる感染時に報告されている5-7 。
ウイルスのタンパク質フォールディングにおける役割に加えて、ウイルス複製中のGRP78のアップレギュレーションは、ウイルス感染した宿主細胞をアポトーシスから保護する可能性がある。これらの特徴により、ERはウイルス生産のために特に重要な細胞コンパートメントとなり、ウイルスは複製を強化するためにERを利用して操作するための複雑なメカニズムを進化させてきた。
逆に、ウイルスのタンパク質産生と宿主細胞の生存のためのERとその主要な常駐シャペロンGRP78へのウイルスの依存は、ウイルスのアキレス腱である可能性があり、SARS-CoV-2や他のウイルス感染症と戦うためのユニークな機会を提供している。
成功したウイルスのライフサイクルの最後のステップは、新しい細胞に感染するための子孫ウイルスの放出である。
ここで、GRP78もまた、ウイルス感染性に重要である可能性がある。
第一に、ウイルスの複製中にGRP78が枯渇すると、ウイルスタンパク質の合成が低下したり、不適切な折り畳みが行われたりして、感染力が低下した出芽障害や未熟なウイルスを引き起こす可能性がある。
第二に、GRP78は、ERの恒常性を維持することにより、様々なウイルス構成要素の組み立てを促進し、その結果、ウイルスの成熟のための助長的な環境を提供する可能性がある。
最後に、GRP78はウイルス粒子に取り込まれ、その後の細胞感染を促進する可能性がある。
実際、日本脳炎ウイルス粒子中にGRP78が存在し、GRP78を欠く成熟ウイルスはウイルス感染力が著しく低下することが報告されている10。これらのウイルスにおけるGRP78のトポロジーと、この興味深い驚くべき観察の一般性を明らかにすることは興味深いことであろう。
結論として、ここに提示された現在の科学的証拠と私たちの視点が、有望な標的としてのGRP78への関心をさらに刺激し、SARS-CoV-2およびウイルス感染症一般との闘いにおける抗GRP78薬の新たな開発を拡大することを期待している。
温熱療法 HSP療法
HSP入浴法
www.youko-itoh-hsp.com/hsp%E3%81%A8%E3%81%AF/hsp%E5%85%A5%E6%B5%B4%E6%B3%95/
HSPの研究は諸外国の方が進んでいるかもしれないが、HSPを増加させる活用法は日本人にとても適している。その理由は、日本のお風呂文化。家庭のお風呂、温泉、銭湯。多くの日本人は利用している。
HSPは熱ストレス(40℃~42℃)で最も効果的に増加するので、まさにお風呂は絶好の場になる。なお、シャワーでは体温を上げるのは難しくHSPは増加しない。
HSP入浴法
- バスタオルと着替えは、すぐ手の届くところに置く
- 浴槽のふたを開けたり、床や壁にシャワーをかけ浴室内を温める
- 手、足、体(心臓に遠いところから)に、かけ湯をする
- 浴槽には、足から手、体の順にゆっくりと浸かる
- 湯に浸かりながら舌下で体温を計る。38℃まで上がるのが理想。
※お湯の温度目安/42℃→入浴10分、41℃→15分、40℃→20
※血行促進作用のある入浴剤を使用の場合は、40℃→15分
6.入浴後は「10分~15分」保温する。
※HSP入浴法で一番大切なところが、最後の保温時間です。
体温を37℃以上に保つことで、体内のHSPが増えるので、体の水分はしっかりふき取り、体が冷えないよう衣類を身に着け、冬は暖かい部屋で、夏は冷房をかけずに最低10分間、体を保温します。
水分補給には、冷たいドリンクを避け、常温、もしくは温かい飲み物で補います。冷たいドリンクは保温後に飲みましょう。

HSP入浴法の注意事項
- 心臓疾患など疾患のある方は、医師に相談してください。
- 高齢者、体力の無い方は、半身浴でもかまいません。
- 半身浴では、肩を冷やさないように、お風呂の蓋を首まで付けたり、肩カバーをしたり、時々首までお湯に浸かって肩を冷やさないようにする。
- 冬は、高齢者に多い入浴事故に注意する。
1) 温度差対策
- 浴室内を温めておく → 入浴前にお風呂の蓋をとり、浴室を温める
- 浴室の床に湯をかけて温める。
- すぐに湯船に入らず、手、足、体(心臓に遠いところから)に、かけ湯をする。
- 湯船から出る時は、体についた水分をしっかり拭き取る。(下着まで着て浴室から出ても良い)
- 体についた水分が蒸発するのに必要な気化熱が体から奪われるので、 ぞくっと感じたり、冷えを感じたりする。着替えの部屋を暖めておく。
2) 家族に「お風呂に入る」と声かけをしてから入浴する。
- 一人の場合は、タイマーをセットし、時間が分かるようにする。
3) 水分補給
- 高齢者の場合、体の水分量(赤ちゃん80%、成人60%、老人50%)が少ない。よって、大量の汗をかくと、脱水になる恐れがあるので、必ず水分補給をすること。
- 高齢者の場合、1回に飲む水分量が少ないので、こまめに水分を補給する。
- 入浴後の汗は、体温調節のため水分が多いが、大量の汗では塩分も失うので、スポーツ飲料などでも良い

