Contents
pubmed.ncbi.nlm.nih.gov/33792402
オンライン公開 2021 Apr 1. doi:10.1152/japplphysiol.00141.2020
要旨
心血管疾患(心血管疾患)は世界的な死因の上位を占めており、心血管疾患の発症を予防・遅延させ、慢性疾患による社会的・医療的負担を軽減する新規治療法が切実に求められている。その一つが、温浴やサウナなどを慢性的に繰り返し利用する「温熱療法」である。温熱療法は新しい概念ではないが、近年、温熱療法が心血管系の健康に及ぼす有益な効果を実証する研究が増えてきたため、改めて注目されている。ここでは、温熱療法の心血管系への有益性を裏付ける分子メカニズムに特に焦点を当て、既存の文献をレビューする。
キーワード ヒートショックプロテイン、温水浸漬、サウナ、血管機能
序論
心血管疾患(心血管疾患)は、先進国における疾病と死亡の主要な原因であり、米国では死亡の30%以上を占めている(1)。加齢は心血管疾患の最も強い危険因子であり、現在の人口統計学的傾向では、中高年者の数が大幅に増加し、それに伴って心血管疾患の有病率と医療費も増加すると予測されている(2)。また、肥満や高血圧といった従来の心血管疾患の危険因子の有病率は、さらに高い割合で増加している(1)。そのため、心血管疾患の発症を予防、遅延、軽減するためのエビデンスに基づく戦略を明らかにすることは、生物医学研究の高い優先順位となっている(3-5)。
生活習慣に基づく介入の1つとして、受動的な温熱療法が提案されている。これは、温浴やサウナを慢性的に繰り返し使用することを指す。温熱療法は何世紀にもわたって多くの文化圏で利用されており、全体的な幸福感や生活の質の向上がよく報告されている(6)が、この古くからの習慣がもたらす膨大な生理的・健康的効果を体系的に調査し始めたのはごく最近のことである。これまでの研究の多くは、温熱療法が心血管(CV)系に及ぼす影響に焦点を当てており、健康な人や心血管疾患患者を対象とした動物モデル、疫学、介入ベースの研究において、心血管疾患のリスクや重症度を低減する効果を裏付ける証拠が得られている。また、温熱療法が心血管疾患に有効であることを裏付ける分子メカニズムについても、研究が進んでいる。本総説では、受動的温熱療法の心血管系への影響に関する既存の文献を簡単に要約し、これらの効果を媒介する分子メカニズムに焦点を当てる(図1)。温熱療法が血管機能に及ぼす影響に関するエビデンスの包括的なレビューについては、ChengとMacDonaldによる最近のレビュー(7)が読者に示されている。

図1 温熱療法を繰り返すことで、熱ストレスが短期的、長期的、生涯的に心血管リスクの低減につながることをまとめたものである。
心血管疾患に先行する心血管系機能の変化
後述するように、人生の後半に開始される温熱療法は、確立した心血管疾患の症状を改善することが示されている。しかし、心血管疾患の大部分は数十年かけて発症し、その前に加齢やその他の危険因子に関連したCV機能の変化があり、心血管疾患発症の感受性を高める。血圧(8)やコレステロール(9)低下への介入など、危険因子プロファイルおよび/または全体的な心血管系機能の改善への介入は、心血管疾患の予防、遅延、または進行を遅らせることができる。温熱療法は心血管系機能に大きな影響を与えるため、これらの効果を通じて、生涯における心血管疾患の発症リスクを低減すると考えられている。これらの加齢や危険因子に関連した心血管系機能の変化は、すべて相互に関連しており、生涯にわたって互いに進行性の低下を促すものであるため、ここに要約する。
血管内皮機能障害と大弾性動脈(すなわち、大動脈と頸動脈)の硬化を特徴とする血管機能障害は、加齢とともに自然に発症し、他の危険因子(例えば、肥満、喫煙、高コレステロール血症)によって悪化し、臨床心血管疾患の主要な先行因子となる(10-12)。内皮機能障害とは、血管拡張、血管細胞の成長および協調的な増殖・血管新生、炎症・凝固・アテローム性プラークの発生抑制に重要なシグナル伝達分子を産生・分泌する血管内皮の能力低下、すなわち、より血管収縮性、炎症性、アテローム性である表現型になることを指す。これらのシグナル伝達分子の中で最も重要なのは、おそらく一酸化窒素(NO)であろう。一酸化窒素はこれらのプロセスのほとんどに上流に位置し、その生物学的利用能は加齢、他の心血管疾患危険因子、およびほとんどの心血管疾患で低下する。内皮機能は、機械的刺激(血流やシアストレスの増加)または化学的刺激(アセチルコリン、ブラジキニンなど)に対する内皮依存性拡張によって測定されるのが最も一般的で、内皮NO合成酵素(eNOS)を優位に活性化してNOを生成し血管拡張を誘発する。血流増加に対する内皮依存性拡張[すなわち、上腕動脈血流媒介拡張(FMDBA)]は、高齢者、他の従来の心血管疾患危険因子を有する人、心血管疾患患者で減少し、FMDBAは将来のCVイベントおよび死亡の独立した予測因子である(13–15)。
頸動脈-大腿(すなわち、大動脈)脈波伝播速度の増加によって測定される動脈硬化は、将来のCVイベントおよび死亡率の独立した予測因子でもある(16–18)。動脈硬化は、動脈壁の主要な構造タンパク質(主にコラーゲン沈着とエラスチン分解)の変化、およびNOを介した内皮依存性拡張の障害や交感神経系活動の増加など、全体的に血管収縮状態を誘発する因子によって媒介される。重要なことは、動脈硬化は内皮機能障害と関連して、加齢に伴って起こる収縮期血圧の進行性上昇とそれに続く脈圧の拡大に直接関与していることである。
加齢や他の心血管疾患危険因子(特に高血圧)は心臓に直接作用し、心血管疾患発症の可能性を高める。左室肥大は、通常、慢性的な血圧上昇によって二次的に起こり、心筋細胞の構造と機能の有害な変化、心筋の線維化と硬化が特徴である。このリモデリングは心機能、特に拡張機能(心室の弛緩と充満)を障害し、長期的には心不全や不整脈のリスク上昇につながる可能性がある(19、20)。また、高齢者の心筋細胞はカルシウム流入の変化に対する耐性が低く、致命的な不整脈を起こしやすく、虚血再灌流、すなわち虚血性心疾患事象で起こるプロセスなどのストレス因子に対する耐性が低くなる。最後に、心臓のβアドレナリン感受性も加齢とともに低下し、収縮力に影響を及ぼす可能性がある(21)。
生涯を通じて心血管系に生じるこれらの変化は、酸化ストレス、特に有害なフリーラジカルであるスーパーオキシドの過剰産生によって引き起こされる酸化ストレスと、慢性低級血管炎症という、互いに増幅し合うフィードフォワード方式で作用する2つの分子プロセスによって大きく左右される。これらのプロセスはいずれもNOの生物学的利用能を低下させ(22、23)、主要な動脈構造タンパク質(24、25)や心筋線維症(26)の変化を媒介し、特に心血管疾患(アテローム性動脈硬化症など)の発症を直接促進する(19、27、28)。重要なことは、受動的温熱療法が酸化ストレスと炎症を軽減すると思われるいくつかのメカニズムがあることで、これについては後のセクションで説明することにする。
受動的温熱のモーダリティ
受動的温熱療法の目的は、体の芯温を上昇させることである。動物および一部のヒトの研究では、体温調節の適応を確実に得るためには、セッション中に体芯温が38.0~38.5℃に達する必要があると一般に考えられている(29)。しかし、心血管系への適応にそのような閾値が存在するかは、現在のところ不明である。実際、セッション中に体芯温が38.0℃に達しない場合でも、温熱療法の効果は(その程度は低いものの)報告されている(30)。このように、温熱療法の理想的な「量」を決定するためには、今後の研究が必要であり、理想的な量は、特定の臨床状態や心血管リスクプロファイルの望ましい改善によって決まる可能性が非常に高い。
体芯温の上昇は、受動的熱ストレスの様々な様式で達成することができる。体芯温が上昇する速度は、環境から身体への熱の移動速度と身体の熱損失機構の有効性に依存し、その両方が異なる様式で変化する。実験室では、受動的熱ストレスの方法として最も一般的に使用されているのは、水伝染性のあるスーツである。被験者は、裏地にチューブが縫い込まれたナイロン製のスーツを着用し、手足と顔を除く全身を覆う。このスーツは、手足と顔を除く全身を覆うように裏地にチューブが縫い付けられており、そのチューブの中を耐えられる温度で水を循環させ、皮膚温を上昇させることができる。ジアテルミーコイルや赤外線加熱ランプもいくつかの研究で使用されている。しかし、臨床研究の大半は、サウナや湯船に浸かる方法を用いている。これらの方法は、地域やレクリエーションセンター、フィットネスジムなどに温水浴槽やサウナがあるため、(一般的に)地域で利用できるという実用的な利点があり、公衆衛生の観点から最も応用が利くと思われる。
フィンランド式(ドライ)サウナ
サウナには、フィンランドの伝統的な乾式サウナと、日本人が普及させた遠赤外線サウナ(後述の「和温療法」参照)の2種類が主流である。フィンランド式サウナの室温は、通常80~100℃に保たれている。人間は乾燥した空気中では熱を効率よく放散することができるため、体幹温度を時間効率よく上昇させるためには、このような非常に高い空気温度が必要である。高温の岩に水をかけることで多少の湿度は確保できるが、それでもサウナは非常に乾燥している(相対湿度10~20%程度)。米国のサウナ業界では、乾燥したサウナの温度(華氏)と湿度の合計を200とする「200の法則」というものがある。そのため、サウナの温度が少し低ければ、湿度も少し高くなる。フィンランドの一般的なサウナでは、一度に5~20分ほどサウナに入り、その間に10~30分ほどサウナの外で休憩する(31,32)。このサイクルは、サウナ利用への慣れ具合によって、さらに1~5回繰り返されることもある。このようなセッションにおいて、体温上昇の大きさは、体温を測定する場所だけでなく、気温や滞在時間(70-100℃、15-30分)にも左右される(33)。伝統的なサウナの使用では、食道温度はわずか10分で39℃(安静時よりも約1.5℃高い)まで上昇し(34)、一方直腸温度は通常0.2~1.0℃上昇することが報告されている(33)。多くの場合、観察される体温の上昇はかなり控えめだが、長期的に見ると多くの利点があることが報告されている。
和温療法(遠赤外線サウナ)
60℃の遠赤外線サウナに15分入り、その後30分間毛布にくるまって体温を上昇させる和温療法は、日本の循環器科医のグループが、ヒトにおける温熱療法の最初の研究を行ったものである。このサウナから発生する赤外線は皮膚に浸透し、体を内側から効果的に温めることができる。そのため、フィンランド式サウナと比較して、より低い空気温度で、同等以上の体芯温の上昇を得ることができる。和温療法では、15分間で1.0~1.2℃の体温上昇が報告されている(35、36)。さらに、長時間にわたって体温を上昇させた状態を維持することで、より高い効果が得られる可能性がある。これはまだ適切に調査されていないが、遠赤外線サウナは、特に血圧調節機能が低下している人(例えば、心血管疾患患者、重度の脊髄損傷者、高齢者)にとって、血行動態上の利点もあるのではないかと推測される。もしそうであれば、皮膚血流の増加や全身血管抵抗および血圧の低下が制限される可能性がある(下記の急性受動的熱ストレスによる生理学的変化を参照)。
熱水浸漬
サウナの他に、温水浸漬は受動的な温熱療法として最も広く用いられている方法である。水中での熱伝導は空気中の約24倍であるため、水温をかなり低くしてもサウナと同様の体芯温の上昇が得られるため、温水浴は有利である。温浴の水温は、通常38~42℃程度に保たれている。湯船に浸かったときの体芯温の上昇率は、水温と湯船に浸かる深さによって異なる。41℃のお湯に肩まで浸かった場合、わずか10分で1.0~1.2℃上昇することが報告されている(36)。熱の移動速度が速いだけでなく、水中では体の冷却機構が働かず、熱を逃がすには発汗による蒸発が必要である。したがって、個々人が順応してきても、目標とする体芯温に到達するまでの時間は同じようなものである。例えば、若く座りがちな被験者(37)では、温水浸漬により直腸温が38.5℃に達するまでの時間は、8週間の介入期間中変化しなかった(セッション1:24±5分対セッション36:27±4分;P= 0.16).しかし、多嚢胞性卵巣症候群の肥満女性を対象としたその後の研究(38)では、直腸温38.5℃到達までの平均時間がセッション1の25±8分からセッション30の37±10分へと増加し(P= 0.01)、この集団では水に浸かっていない部位での熱放散量が多かったことに起因していると考えられる。
温水浸漬が他の受動的加温と大きく異なる点は、水が身体に静水圧を与え、血液を心臓に戻す静脈還流を助け、心臓充填圧を高めることである(下記の心血管血行動態を参照)。静水圧は、心拍出量や平均動脈圧の増加(39)、導管血管径の変化(40)、動脈コンプライアンスの増加(41)など、心血管系機能に対する独立した効果を持ち、長期的な適応に寄与する可能性がある(42)。したがって、受動的加温の効果を静水圧の効果から分離しようとする場合、熱中性水浸漬を行う偽グループを含めることが必要である。
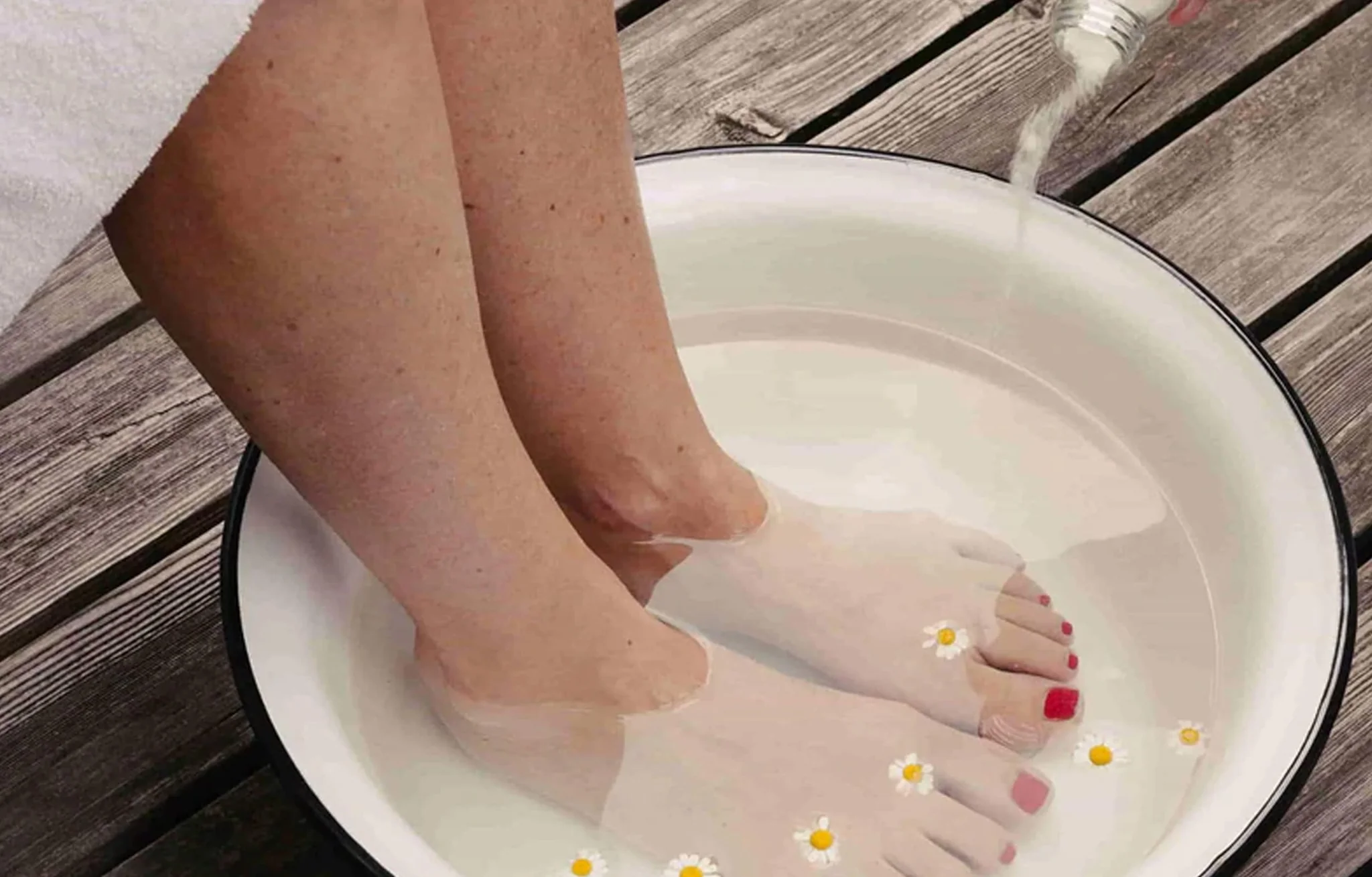
ホットタブやジャグジーでの全身温水浸漬に加え、足浴や脚浴が開発され、いくつかの研究で使用されている(43,44)。芯温の上昇は少ないが(45分で約0.4~0.5℃)、内皮機能(45)および運動耐容能(44)の急性改善が観察されている。また、足湯は、特に身体能力の低い患者集団にとって、より利用しやすいものかもしれない。
急性受動的熱ストレスに伴う生理的変化
受動的熱ストレスの急性心血管系への影響は、よく特徴づけられており、他の場所でより深く検討されている(46、47)。したがって、ここでは、CVの機能と健康における長期的な適応を促進するという文脈で、簡単に説明することにする。重要なことは、熱ストレス後数時間残る血行動態の急性変化(48–50)、特に全身血管抵抗と血圧の低下(後述)が、少なくとも部分的には、熱治療に対する慢性適応を強調すると考えられることである。
発汗と皮膚の血流
視床下部の体温調節中枢は、皮膚および体芯温の上昇に対して、まず皮膚アドレナリン作動性交感神経血管収縮を抑制し、次に皮膚コリン作動性交感神経出力を比例的に増加させることで反応し、後者は汗腺を刺激して発汗量を増加し、皮膚微細血管を血管拡張する[これらのプロセスの基礎となるメカニズムについて、Johnsonら(51)において包括的に検討]。皮膚の血管拡張と発汗は、体芯温が温度閾値に達すると開始され、通常は安静時体芯温より約0.4℃高くなる(52)。皮膚温もこの閾値を調節し、皮膚温が高いほど閾値は低くなる(55)。さらに、皮膚を直接加熱すると、主に皮膚温度でNOが局所的に放出され、血管拡張が起こる(56、57)。そのため、同じ体芯温でも、遠赤外線サウナよりもフィンランド式サウナや湯船に浸かった方が、皮膚血流がより増加する可能性がある。全体として、受動的熱ストレスでは、皮膚血流量は仰臥位で安静時より4.5~7.0リットルも増加し(58)、順応した人の受動的熱ストレスでは1.3L/hもの発汗量が報告されている(59)。
循環器血行動態学
受動的熱ストレスに関連する中枢性心血管血行動態の包括的な議論については、Craig Crandall博士とThad Wilson博士による優れた総説(47)が読者に示されている。以下では、受動的加熱のさまざまな様式に関連するデータに焦点を当てる。
心拍出量である
皮膚血流の増加を支え、発汗による水分損失を補うために、心拍出量は増加しなければならない。その増加の大きさは体芯温の上昇に依存するが、仰臥位で水灌流スーツを用いた受動的熱ストレスでは13L/minまで増加することが報告されている(58)。温水に浸かると、心拍出量は温水浴槽の外での座位ベースラインと比較して約60~140%増加する(36、49、60、61)。若い健康な男女を対象とした最近の研究では、胸骨の高さまで水が入った湯船に座った状態で、心拍出量は仰臥位でのベースラインの6.6L/minから10.4L/minに増加し、仰臥位の心拍出量は水没後40分までベースラインから著しく増加したままであった(49)。また、最近の研究では、42℃の浴槽で30分間受動的に加温すると、半座位の心拍出量が3.7L/min増加した(60)。フィンランド式サウナでは、心拍出量の増加はわずか(0.47L/min)(62)から75%の増加(63、64)まで、様々な報告がある。このばらつきは、気温、地域住民のサウナ利用時間、姿勢、皮膚を直接加熱することによる皮膚血流全体への影響などが原因であると考えられる。Radtkeら(65)は、慢性心不全患者と年齢をマッチさせた健康な対照者において、10分間の80℃サウナ入浴後に約1.5L/分の心拍出量の増加を観察したが、冠動脈疾患患者では心拍数に変化はなかった。遠赤外線サウナも同様の心拍出量の増加をもたらし、通常30~50%の増加が報告されている(36)。
心拍数である
温熱療法中の心拍数は、中強度の運動に匹敵するほど大幅に増加することがある(60、66)。ストローク量の変化は比較的緩やかであるため、心拍数を大きく増加させれば、心拍出量の増加をサポートできる。熱は洞房結節に直接クロノトロピック効果を与えることもあるが(67,68)、神経入力に比べれば心拍数の増加への寄与ははるかに小さいだろう。一般に、健康なヒトの場合、心拍数は体温が1度上昇するごとに約30拍/分増加する(52)。そのため、一般的なサウナでは、心拍数のピークは約80~90拍/分であることが多い(69-71)が、心拍数は最大で120~150拍/分まで増加することが報告されている(32)。芯温の変化に対応させると、温水浸漬時の心拍数の上昇はかなり少ないと報告されている(49、60)。
心内圧と脳卒中量
心内圧の変化は、受動的加温の様式に依存する。すべての様式において、皮膚血管拡張は、体温調節のために血液量が皮膚に向かい、脾臓および腎臓の循環から遠ざかる再分配によってサポートされる(72,73)。この再分配にもかかわらず、心臓への静脈還流が静水圧によって補助されない加熱方法(例.右心房圧は減少し(中心静脈圧から推定されることが多い)(58、72、74)、肺毛細管楔入圧で測定される左心室充填圧は右心房圧と並行して減少し(74、75)、肺動脈圧は、右心拍出量の増加と肺血管抵抗の減少のバランスにより、増加(76、77)または減少(78–80)する。一方、温水浸漬時には、水の静水圧圧縮力によって心臓への静脈還流が促進されるため、心内圧はすべて上昇する(36、81)。この違いから、心不全患者にとっては、心臓への負担が少ないサウナ入浴の方が温水浸漬より安全である可能性が提唱されている(36)。しかし、温水浴で観察されるパターンは、適度な有酸素運動による血行動態の影響をより忠実に模倣している(60)。したがって、温水浸漬の方がCV適応の誘導に効果的である可能性があるが、この可能性を判断するには、2つの方法を比較する研究が必要である。
若い健常者では、熱ストレス時に脳卒中量は変化しないか、あるいはほとんど増加しない(80,82–84)。このような脳卒中量の維持は、収縮期と拡張期の両方の心機能の増強(85–87)と駆出率の向上(36、75、88)により達成される。高齢者では、脳卒中量が減少することが報告されているが(72、89)、これは普遍的な所見ではなく、男女で異なる可能性がある(90、91)。温水浸漬では、水中に沈んだ身体にかかる圧縮静水圧が静脈還流を助け、脳卒中量の増加や維持を可能にするはずだが、サウナと温水浸漬の血行力学的効果を直接比較した1件の研究では、2つの加熱方法間で脳卒中量に差はなかった(36)。
血圧のこと
一般に、皮膚血管拡張の結果、末梢血管抵抗は減少するが、これは脾臓および腎臓の血管抵抗の増加によっていくらか相殺される(72、84)。その結果、特にサウナでは拡張期血圧がかなり低下することがある(36、92)。温水浸漬による静水圧は、血管抵抗と拡張期血圧の低下を抑えるのに役立つと考えられる(36)。健康な人の場合、収縮期血圧は通常、心拍出量と心拍数の増加により仰臥位で上昇する(72);しかし、収縮期血圧の低下は、サウナや静水圧のない他の様式で観察されることがある(36、92)。高齢者や患者では、脾臓/腎臓の収縮による血管抵抗の低下と心臓への静脈還流を相殺する能力が低下しているため、あらゆる方法で収縮期血圧が低下する可能性がある(89)。これは、有酸素運動後に観察される血圧低下の持続時間(49)に匹敵するが、これは普遍的な所見ではない(69、70);血圧低下の持続時間と程度は、受動的加熱の時間、種類、または強度に依存する可能性がある。重要なことは、多くの研究や研究者によって示唆されているように、受動的熱ストレスによる末梢血管抵抗と拡張期血圧の断続的な低下(内皮依存性拡張や血管新生の改善などの他のメカニズムとともに)は、慢性熱療法による安静時血圧の長期低下を促進するのに役立つかもしれない(38、45、50、93、94)。
受動的熱ストレスの心血管系禁忌症
受動的熱ストレスの安全性に関する研究のほとんどは、フィンランドで実施されたもので、住民の大多数が、幼少期から老年期まで、家族の文化的活動として少なくとも週に1回はサウナ浴に参加している。これらの研究では、高血圧や心不全などの安定した心血管疾患患者(96、97)、小児(98、99)、妊婦(100、101)など、多くの集団でサウナ浴の悪影響がないことが示されている[総説はKukkonen-Harjula and Kauppinen(95)参照]。ただし、1つの注意点として、これらの研究はすべて暑さによく適応しているフィンランド人を対象に行われたものであることが挙げられる。他の場所で行われた非適応者を対象とした研究では、さまざまな結果が出ている。多くは、健康な中高年(70)、未治療の高血圧患者(69)、安定した心不全や冠動脈疾患患者(65)など、明らかな有害事象がなく、CV血行動態(例:血圧や心拍)が安全範囲内にあることから、サウナは安全であるとする。しかし、非耐久性のある人が有害事象を経験する可能性は依然としてある。例えば、運動誘発性心筋虚血を有する非耐熱性安定冠動脈疾患患者は、サウナ入浴中にも心筋虚血を経験したが、そのほとんどは無症状で運動中ほど深刻ではなかった(102)。したがって、非アクライマーが新たに温熱療法を開始する際には留意し、心血管疾患リスクが上昇している人は、プライマリーケア提供者の監督のもとで行うことを推奨する。
西洋医学では、温熱療法は不整脈のリスクを高めるという懸念から、従来、心血管疾患患者には禁忌とされてきた。しかし、急性心筋梗塞患者98名と年齢をマッチさせた対照被験者をモニターした研究では、サウナ入浴中とその後に不整脈を起こしたのはわずか8%であったが、最大以下の運動では18%の被験者が不整脈を起こした(103)。さらに、1970年にフィンランドで発生したすべての突然死のうち、サウナ入浴後24時間以内に発生したものはわずか1.7%であり、これにはサウナと関係がありそうなものと、自動車事故など絶対に関係がないものが含まれている(103)。事故以外の死亡のうち、大部分はアルコール摂取に関連した心筋梗塞によるものであり、これは高体温とは無関係に心疾患のリスクを高めることが知られている(104)。
重要なのは、温熱療法には禁忌があることである。主に、運動も禁忌となるような不安定な状態である。このような条件としては、重度の大動脈弁狭窄症、不安定な狭心症、最近の心筋梗塞、最近の脳卒中や一過性虚血発作、起立性低血圧を起こしやすい高齢者などが研究されている(96、105)。
慢性受動温熱療法による心血管への効果
最近、慢性的な受動的温熱療法が心血管系の健康に及ぼす影響に注目が集まっているが、この興味深い研究分野の基礎は、Michal Horowitz博士の優れた研究成果に負うところが大きいと言える。以下、この分野の「重要な」研究を時系列で紹介する。より包括的な最近の総説(7,31)については、別の場所でお読みいただきたい。
動物における初期研究
長期の受動的な温熱療法がもたらす有益な心血管系への適応に関する最初の研究は、Michal Horowitz博士ら(106)による優雅な一連の研究で行われ、彼らはまず、4週間の連続温熱曝露を受けたラットの心臓(34℃飼育)が、24℃飼育のラットの心臓に比べて虚血再灌流の障害から完全に保護されていることを、浸潤組織の割合で明らかにした。その後、彼らはこのモデルを用いて、温熱療法によって刺激される多数の保護分子経路を同定し、以下に詳しく述べている(総説は文献107–109を参照)。重要なことは、熱に対するいくつかの適応はすぐに観察されるが(例えば、安静時体温の低下、ヒトでは発汗量の増加)、これらの著者らは、完全な細胞保護表現型を誘導するためには、4週間を超える連続熱曝露が必要であることを示している(109~111)。このことは、ヒトを対象とした研究を解釈する際に特に重要である。なぜなら、4週間を超える生理学的効果について調査した例はほとんどないからだ。さらに、ヒトを対象とした介入研究では、熱曝露が断続的に行われるため、「完全な」適応を引き起こすには、4週間を超える熱療法が必要となる場合がある。その証拠に、ヒトの心血管系や代謝系の適応の一部は、4~5週間の温熱療法では観察されないが、8~10週間までには観察されるといういくつかの研究がある(37,38)。とはいえ、次のセクションで述べるように、一部の適応はもっと早く、わずか2週間程度で得られる可能性がある。
心血管疾患患者における和温療法
受動的温熱療法のCV効果をヒトで調査した最初の研究は、日本の循環器専門医のグループによって、和温療法を用いて行われた。「和温」とは、鄭周世博士が創作した日本語で「癒し・温もり」と訳されている。したがって、和温療法は「癒しの温熱療法」であり、温熱療法のブレイクスルー研究の多くは、テイ博士らによって行われた。これらの研究の多くは、毎日和温療法を行う3週間の介入(すなわち、完全な適応に必要な時間よりも短い期間)を採用し、長期的な追跡調査は行われなかったが、このような制限にもかかわらず、すべての研究で、さまざまな心血管疾患に関連する症状や臨床バイオマーカーが大幅に低下したことが報告されている。例えば、左心不全患者において、和温療法は左室駆出率(35、112、113)、心胸郭比(112)、不整脈発生率(112)、心房性ナトリウム利尿ペプチド(心不全重症度の臨床バイオマーカー)循環レベル(112)、心不全症状の重症度の臨床分類であるニューヨーク心臓協会(NYA)機能分類(114)を改善させた。うっ血性心不全患者において、和温療法は僧帽弁逆流と心胸郭比を減少させ、左心室駆出率を増加させた(113)。慢性閉塞性冠動脈関連虚血患者において、和温療法は心筋灌流を大きく改善した(115)。
和温療法は、血管機能のバイオマーカーも改善する。冠動脈の内皮機能を測定するゴールドスタンダードであるFMDBAは(13、14)、心不全患者(35、116)、慢性閉塞性冠動脈関連虚血患者(115)、CVリスクファクターを持つ人(117)で改善されることがわかった。血圧の慢性的な低下に寄与すると考えられる全身血管抵抗は、和温療法により急性的に低下し(36)、2週間の治療後24時間に測定すると慢性的に低下したままである(116)。また、心拍変動の低周波成分(交感神経)の減少と高周波成分(副交感神経)の増加によって測定されるように、自律神経機能も改善される可能性がある(118)。
受動的温熱療法が運動トレーニングの代替または補助療法として使用できることを示す最も説得力のある論拠の1つは、わずか3週間の和温療法による改善である。V˙ O 2peak(35)、運動耐容能(6分間歩行距離(35)および修正ブルーステスト(115)の疲労までの時間の両方を用いて測定された。傍島ら(115)の研究では、検討したすべての心不全患者で運動耐容能の改善が認められ、大堀ら(35)の研究では、20人中16人の患者で改善が認められた。いずれの研究においても、これらの改善はFMDBAの改善と相関があり、運動耐容能の改善は血管機能の改善によって媒介されていることが示唆された。
私たちが知る限り、長期間の和温療法の効果を調査した研究は1つだけだ。Teiら(119)は、末梢動脈疾患患者を対象に10週間の治療を行った結果、疼痛スコア、歩行距離、足首-上腕血圧指数、安静時下肢皮膚血流(レーザー・ドップラー)が改善したと報告している。また、和温療法は、血管造影により、これらの患者の患脚に新しい側副血管の形成を誘導することに成功した(119)。ある患者のケーススタディでは、和温療法は大きな皮膚潰瘍の治癒速度を大幅に改善し、その結果、その患者の脚の切断を防ぐことができた(120)。
フィンランドのサウナの習慣的利用に関する長期的・疫学的研究
フィンランドでは、サウナ入浴の急性効果を特徴付ける大規模な研究が行われているが、サウナの定期的な利用による長期的な効果を調査したものはほとんどなく、個人を治療群に前向きに割り付けた研究もない。これは、フィンランドではサウナがほぼすべての人に利用できるという事実が一因である(32)。心筋梗塞の患者を対象とした10年間の追跡調査では、60%の患者が日常生活で狭心症の症状を経験したが、サウナ入浴に関連してこれらの症状を経験した患者は1人だけであったと報告している(96)。また、別の研究では、本態性高血圧と冠動脈疾患を持つ患者が定期的にサウナを利用する様子を追跡調査し、1年と3年の追跡調査時に血圧に好影響を与えたことが報告されている(121)。
この研究では、サウナを定期的に利用している中年男性2,315人を対象に、登録時に健康診断とサウナ入浴習慣に関するアンケートを実施し、最長30年間、あるいは死亡時まで追跡調査を行った。これらの男性において、サウナ入浴の頻度(週1回)と1回あたりの持続時間は、追跡期間中の心臓突然死、致死的心血管疾患、致死的冠動脈疾患、全死因死亡の発生率を予測した(122)。サウナを週4~7回利用する男性では、週1回しか利用しない男性に比べ、心血管疾患関連死亡リスクが48~50%低下していた。さらに、高血圧の発症リスクは、サウナの利用頻度が高いか、1回の利用時間が長い人ほど、追跡調査期間中にかなり低くなっていた(123)。これらの知見は非常に素晴らしいものだが、真の対照群が存在しないこと(基準群は依然として平均週1回サウナに入浴している)、サウナの利用頻度と利用時間が登録時にしか決定されないこと、所得、教育、裁量時間が高い人ほどサウナを利用する可能性が高いこと、女性が含まれていないことなどの理由から、本研究の解釈には注意が必要である。
温熱療法に関する介入型研究
温熱療法の利点に関する長期的な介入研究は、特に受動的な加熱の急性発作に対する心血管系の反応を調査する研究の数との関連で、明らかに不足している。しかし、いくつかの研究は有望であることを示している。若く健康な被験者において、受動的温熱療法は、主に週に3~5回の温水浸漬を約8~10週間行うもので、心血管系機能の様々なマーカーを改善することが示された。改善には、平均動脈血圧の低下(37)、導管動脈(FMDBA)(30、37、124)および微小血管内皮機能の増加(59、125)、動脈硬化の減少(37)、興味深いことに、頸動脈壁の厚さの減少(37)があり、これはおそらく血管平滑筋肥大の減少および/または血管炎症の減少を反映していると考えられる(126)。確かに、これらの研究(37,59)の中には、各温熱曝露の刺激に関して忍容性の上限と考えられるもの(60-90分、直腸温38.5-39℃)を用いたものもあり、より弱い加熱(短時間および/または芯温の上昇が少ない)を用いた研究では、導管動脈内皮機能の改善がより小さく(124)または一過性に(30)認められた。これらの研究を総合すると、温熱療法は心血管系の適応を促進するのに有効であるという証拠が得られたが、温熱療法の理想的な頻度、温度、時間についてはまだわかっていないことが多い(7)。
CVリスクが高い人のCV機能を改善するための温熱療法介入の可能性を調査した研究がいくつかある。高齢者では、温水浸漬による温熱療法を8~10週にわたって30回実施したところ、収縮期血圧が低下し、内皮機能(FMDBA)が改善された(127)。多嚢胞性卵巣症候群の肥満女性では、8-10週にわたって30回の温水浸漬を行うことで、収縮期および拡張期血圧の低下、内皮機能の改善(シアレート補正FMDBA)、動脈硬化の減少、頸動脈の壁厚減少が認められた(38)。また、安静時の筋交感神経活動の大幅な低下(多嚢胞性卵巣症候群の女性は交感神経の過剰活性があり、それがCVリスクの上昇に寄与している)、虚血再灌流による内皮機能の障害からの保護も確認された。末梢動脈疾患患者において、温水浸漬による温熱療法は収縮期血圧を低下させ、6分間歩行距離と無痛歩行距離で評価される運動耐容能を改善したが、内皮機能、動脈硬化、末梢動脈疾患の主要臨床診断指標である足首上腕指数には大きな変化がなかった(128)。著者らは、彼らの患者は動脈硬化が非常に進行していたため、介入期間内に血管機能障害を軽減することができなかったのではないかと推測している。しかし、受動的加温の刺激は先行研究(約39℃の温泉浴、3~5日/週、体温が1℃上昇する程度の30分以下、その後30分以下の体操)よりも小さかった。重要なことは、温熱療法へのアドヒアランスが、ウォーキングやジムでの運動を行った被験者グループのアドヒアランスよりもはるかに優れていたことである。Pellingerら(44)は、急性期の研究において、加熱時間が15分でも45分でも、急性の下腿加熱によって最大歩行距離が10~12%改善することを実証している。これらの研究とTeiら(120)の研究を総合すると、温熱療法は、このグループの患者において、その後の運動トレーニング中の痛みを軽減するための良い入り口として機能する可能性があるという確かな証拠が得られている。
温熱療法の心血管系への有効性を支える分子機構
温熱療法による心血管系への恩恵のメカニズムは未解明だが、受動的温熱療法による心血管系バイオマーカーや健康状態の改善の根底にあるプロセスを明らかにすることを目的とした研究がいくつか行われている。これらの研究から、CV改善効果の多くは、受動的温熱療法中およびその後の血管内のシアストレスの変化、熱ショックタンパク質(HSP)の急性および慢性的なアップレギュレーション、NOバイオアベイラビリティの改善、酸化ストレスおよび炎症マーカーの減少に由来すると考えられている。とはいえ、まだわかっていないことも多く、受動的温熱療法の効果を支えるメカニズムに関するさらなる研究が必要である。重要なことは、血管せん断応力を除いて、これらの経路と心血管系機能の改善とを結びつける研究の多くは相関的であるということである。したがって、因果関係を明らかにするためには、より多くの調査が必要である。以下では、この分野における主要な研究の概要を、私たちの理解が最も進んでいるところから、私たちの知識が不完全であるところまでを紹介する。
前向きの血管剪断応力の増加
血管シアストレスとは、血液が動脈壁に及ぼす機械的摩擦力のことで、動脈径に対する血液の速度と粘性によって決定される。重要なことは、シアストレスとシアストレスの変化による適応効果は、導管血管で最も大きいということである。シアストレスの影響は微小血管系でも観察されるが、このセクションでは主に導管血管に焦点を当てる。
完全な前方層流では、せん断応力は完全に前向きの方向(すなわち、純血流の方向で、心臓から離れる方向)に作用することになる。しかし、生体内(導管血管内)の血流は脈動的であるため、心周期において血流が停止する瞬間や、逆行的に心臓に戻る瞬間が存在する。このような前向きの流れと逆向きの流れが交互に起こる剪断パターンは振動剪断と呼ばれる。血流を増加させる刺激により、一般的に前向きのせん断が増加するが、末梢血管抵抗が増加する刺激や疾患の進行により、血液の前進に対する抵抗が大きくなるため、逆向きのせん断や振動せん断(「乱れた流れ」とも呼ばれる)が増加する。多くの研究が、異なるシアパターン(すなわち、逆行性または前向きのシアが多いか少ないか)が内皮機能と適応に及ぼす影響について研究している。一般に、高い逆行性または振動性シアーは、内皮機能障害とアテローム性プロファイルに関連するが、高い前向きのシアーは内皮機能を改善し、抗アテローム性である。逆行性および前行性シアストレスが血管系に及ぼす相反する影響について、以下に説明し、図2に要約した。受動的な熱ストレスは、前向きのシアストレスを増加させ、逆向きのシアストレスを減少させる(50、66)。したがって、温熱療法によるシアーを介した血管適応は、特に高齢者や安静時の逆行性/内転性シアストレスが若年健康成人と比較して高い患者集団において、逆行性/内転性シアストレスの有害作用の除去および前向性シアストレスの増加による有益作用の増強の組み合わせに起因すると予想される。
図2 逆行性および前行性のシアストレスが血管系に及ぼす相反する作用のまとめ。血管収縮のメカニズムとしては、α-アドレナリンによる血管収縮が大きい/小さい、エンドセリン-1の濃度が高い/低いなどがある。NO、一酸化窒素。
高い逆行性/振動性シアストレスによる有害な影響
安静時の乱れた流れが不健康なプロセスを促進することを示す情報は豊富にある(総説は文献129–132を参照)。細胞培養およびげっ歯類モデルにおいて、高い逆流/振動シアーは、NOを産生する酵素であるeNOSの発現を低下させ(133、134)、接着分子(135–137)、炎症性サイトカイン(138)、エンドセリン1(134)、NADPH酸化酵素(133、139)などの活性酸素生成酵素、スーパーオキシド(139)などの多くの動脈硬化性因子がアップレギュレートする。頸動脈の部分結紮(140)または頸動脈の鋳造により部分狭窄(138)を引き起こし、高振動シアーを与えたネズミは、すぐに深い内皮機能障害、有害な血管リモデリング(内膜肥厚、平滑筋細胞の減少、脂質の増加)、アテローム性硬化プラークを発症する。
ヒトでは、高齢(141、142)、肥満(143)、高血圧(144)など、下流の微小血管系で血管緊張が高まると、剪断パターンの乱れや逆行剪断の増加が観察される。血流障害の程度は、NOバイオアベイラビリティの低下(145)およびαアドレナリン媒介性血管収縮(146)に関連している。また、振動剪断が大きくなることによる二次的なものと思われる導管血管の内皮機能障害もこれらの集団に存在し(147–149)、内皮機能障害と動脈硬化の進行との間には確立された関連がある(150、151)。流れの乱れと内皮機能障害の因果関係を支持するものとして、若年者における急性的な流れの乱れがある、健康な人が遠位血圧計を膨らませて上腕動脈の逆行性シアーを増加させると(逆行性シアーは影響しない)、フローメディエーション拡張が減少し(152)、内皮微粒子(EMP)CD62E(Eセレクチン)とCD31(153)、それぞれ炎症性内皮の活性化とアポトーシスのバイオマーカーの放出を引き起こす(154)。EMPは、順に、C反応性タンパク質(155)を放出し、制御性マイクロRNA(156)を運び、eNOS(157)を減少させ、血栓症、炎症、活性酸素の生成を促進することができる(158)。また、平均剪断速度が低いことは、患者集団における循環EMPsのレベルが高いことと関連している(159)。
前向きの剪断応力の増加による有益な効果
逆に、前向きのシアストレスが繰り返し増加すると、抗動脈硬化作用があり、内皮機能が改善される。培養内皮細胞では、生理学的に適切な前向きのシアストレスの増加(例えば、ヒトの運動中に導管血管で達成されるレベル)は、eNOSの発現(160–162)、必須eNOS補因子テトラヒドロビオプテリン(163)、抗酸化酵素スーパーオキシドディスムターゼ(160)の増加をもたらす。前向きのせん断応力は、血管内皮増殖因子受容体(164)とホスホイノシチド3キナーゼを活性化し、プロテインキナーゼA、そしてeNOSを活性化するなどのいくつかのメカニズムによって、eNOSのリン酸化を増加(すなわち、活性化し、おそらくNO生産量が増える)することができる(165).さらに、前向きのシアストレスが増加すると、Hsp90とeNOSの会合が増加し(166)、エンドセリン-1の発現が減少し(167、168)、接着分子の発現を減少させ(169、170)、TNF-αによる障害から細胞を保護するという抗炎症効果がある(170)。重要なことに、これらの結果の一部は単離動脈で確認されており、前向きのシアストレスが生理的に増加すると、eNOSとスーパーオキシドジスムターゼの発現が増加し(171、172)、内皮依存性拡張が改善することが示されている(172)。
温熱療法による血管機能改善には、前向きのシアストレスの増加が不可欠であることを示す証拠
ヒトでは、Daniel Green博士らが一連の研究を行い、様々な刺激に対する動脈の適応には、前向きのシアストレスの増加が不可欠であることを示した。これらの著者らは、両腕の介入前後で血管機能を評価するモデルを利用した。片方の腕は通常通り適応させ、もう片方の腕には血圧計を装着し、介入セッション中は安静時の収縮期血圧まで膨らませ、血流と前向きの剪断応力が安静時より増加しないようにする。このモデルを用いて、FMDBA、皮膚微小血管内皮機能、上腕動脈径の増加(すなわち、動脈新生)によって測定される導管血管と微小血管の両方における動脈適応が、8週間の腕局所加熱(173)、全身加熱(30、125)、下肢運動トレーニング(174)、ハンドグリップ運動トレーニング(175)後にカフのある腕で妨げられることが示された。構造的リモデリングの指標であるハンドグリップ運動トレーニングによる上腕動脈壁の厚さの減少も、カフ付き腕で予防される(176)。これらのデータは、動脈適応における前向きのシアストレスの重要な役割を論証している。
注目すべきは、温熱療法に対する動脈の適応を媒介するためには、血管のシアストレスの上昇と同様に、局所温度の上昇が重要であるように思われることである。Green博士の研究室での同じ研究(125)では、全身加温を繰り返した後の皮膚微小血管機能の改善は、ウォーターバスを用いて皮膚局所温度を30℃に固定した場合には、シアストレスの増加が認められたにもかかわらず、阻止された。このように、血管の適応には、せん断応力と温度の上昇の相互作用が必要であることが示唆された。
ヒートショックプロテイン
HSPは、ストレス感受性タンパク質の一種で、熱ショックの開始時に発現が急速に激しく増加するという独自の観察から名付けられたが(177)、低酸素・虚血(178)、紫外線(179)、サイトカイン(180、181)、冷ストレス(182)、運動(183–185)、発熱を模した末梢注射(186、187)、神経毒局所注射(188)、興味深いのは血管シアーストレス(135、189)に応答しても発現することがある。細胞内HSPは、ヒトにおいて、運動による熱馴化(190-193など)と受動的熱療法(194-197)のいずれにおいても増加することが示されている(循環白血球、骨格筋、皮下脂肪組織で測定)。
HSPは細胞内において、1)熱やその他のストレス要因によるダメージから細胞を保護する、2)正常な細胞機能を促進する、という2つの主要な役割を担っていると考えられている。HSPは、より軽いストレスや可溶性ストレスにさらされると、その後に起こる致死量のストレスに対する耐性を獲得する(198,199)。この耐性は、ストレスで変性したタンパク質を処理し(200)、構造タンパク質の破壊を防ぐというHSPの役割に起因していると考えられている(201)。非ストレス状態では、HSPは、タンパク質を細胞内の他の場所に移動させ、細胞膜を越えてタンパク質をシャペロン化し、様々なタンパク質や受容体を安定化し、損傷したタンパク質を特定し修復することで細胞機能を促進する。これらのプロセスの多くは、タンパク質のアンフォールディングとリフォールディングを含んでいる。HSPは、通常、他のタンパク質と関連して、核、細胞質、ミトコンドリア、小胞体、および細胞膜に近接した場所に存在する(202)。
HSPにはいくつかの異なるファミリーがあり、分子量に基づいてグループ化され、細胞内での役割が微妙に異なっていることから名付けられた。CVの機能に最も関連するのは、HSP70とHSP90のファミリーである。また、ある種の小さなHSP、特にHsp27とHsp32の役割も明らかにされている。一般に、HSP70ファミリーのタンパク質は、細胞の成長と修復に重要であり、変性したタンパク質を処理するなど、ダメージから細胞を保護する(200,203)。そのため、熱ショックなどのストレッサーで高度に誘導される(204)。HSP90ファミリーのタンパク質は、熱中立温度で構成的に発現し、豊富だが、熱によってさらに誘導されることもある(183)。細胞内での一般的な役割は、他のタンパク質と会合することであり、それによって、これらのタンパク質のトランスロケーション(例えば、新しく形成されたタンパク質を核から細胞内の目標位置までシャペロンする)(205)、安定化、リン酸化(すなわち、活性化)を助ける(206,207)ことである。HSPの細胞内(および細胞外)機能における役割については、別のところで詳しく述べられている(205,208)。ここでは、温熱療法に対するCVの適応を媒介する「細胞内」HSPの潜在的な役割に焦点を当てることにする。細胞外HSPは熱ストレス時に増加するが、通常は高いレベルの熱負荷が必要である(209)。さらに、細胞外HSPは通常、炎症性シグナルを誘導する損傷関連分子パターンであると考えられている(210)。熱馴化/治療への適応を媒介する細胞外HSPの役割(もしあれば)は不明である。
HSP発現の大きさと時間経過
Hsp70/72とHsp90の両方が、熱ストレスに応答して細胞や無傷の動物で増加する(183,192)。一般に、熱にさらされる時間が長いほど、また周囲温度が高いほど、HSPの発現量は大きくなる。例えば、Harrisら(211)は、ウシ大動脈内皮細胞で42℃の熱ショックを1時間行ってもHsp70タンパク質に変化は見られなかったが、同じ時間の45℃熱ショックでHsp70が8倍増加することを観察している。同様に、ラットでは、熱ストレスの時間が長く(40分、60分、90分)、コア温度が高い(37,39,42,45℃)ほど、肝臓ではなく、脳、肺、皮膚の組織でHsp70とHsp27 mRNAの誘導が大きくなった(212)。Gibsonら(213)は、運動による熱ストレスを受けたヒトにおいて、直腸温が高く、直腸温が38.5℃以上の状態で過ごした時間が長いほど、白血球におけるHsp72 mRNAの増加が大きくなることを明らかにした。mRNAの発現量の変化は、必ずしもタンパク質量の特定の変化や変化のタイミングを推測するものではないが、それでも重要なシグナル伝達を表していることに注意することが重要である。さらに、培養細胞では、HSPの増加を観察するために、無傷の生物と比較してより高い周囲温度を必要としたり、HSPのピーク発現前に熱曝露後の長時間の回復時間を必要とすることが多い(205、214)。例えば、Harrisら(211)は、ラットの42℃での熱ストレス15分間で、大動脈組織のHsp70が45℃1時間後の培養大動脈細胞で得られたのと同様の倍率で増加することを確認した。
一般に、HSP mRNAの検出可能な高レベルは、熱への曝露中およびその直後に観察されることがある。Hsp70とHsp27のmRNA発現は、ネズミの熱ストレス後1時間以内にピークを迎え、約6時間後にはベースラインレベルに戻り、脳、肺、肝臓、腎臓、皮膚など様々な組織タイプで一貫した反応が見られる(212、215)。しかし、熱ストレス後数時間はタンパク質の存在量がピークに達しないことがある。さらに、HSPの誘導の時間経過は、生物種や組織型によって異なる可能性がある。ラット骨格筋において、Oishiら(216)は、1時間の熱ストレス(筋温42℃)後にHsp72タンパク質量がピークに達するタイミングは、筋線維の種類に依存することを明らかにした。遅筋を主体とするラットのヒラメ筋では、熱ストレス直後にHsp72タンパク質量が上昇し、4時間でピークに達したが、速筋を主体とする足底筋では、熱ストレス後24~48時間までHsp72タンパク質量が上昇しなかった。同様の所見は、腓腹筋の深部(主に遅筋)および表層(主に速筋)領域で観察された(217)。急性受動的熱ストレス後にヒトで外側広筋のHSP量を測定した研究が2件あるが、どちらもHSP量の変化は観察されなかった(197,218)。実際、Hafenら(197)は、Hsp27のリン酸化のわずかな減少を観察した(総含有量に変化はない)。これらの所見は、Hafenら(196,197)が毎日受動的加温を6-10日間行った後にHsp70およびHsp90含量の増加を観察したことから、筋生検を採取した時期、すなわち熱ストレス後あまりにも早い時期に起因していると考えられる。運動しているヒトでは、外側広筋のHsp70量は運動後約48時間まで増加せず、最大6-7日間ベースラインレベルより高く維持される(219、220)。しかし、運動刺激は受動的熱ストレスとは異なる発現パターンをもたらすかもしれない。興味深いことに、熱ストレスを受けたヒト末梢血単核細胞におけるHSP含量は、熱ストレス後1時間でピークに達し、約5時間後にはベースラインレベルに戻るという、より迅速な増加を示す(221)。
心血管系機能におけるHSPの役割
心血管疾患の進行に伴って変化し、CV機能に最も大きな影響を与える主要なシグナル伝達経路は、NO経路、酸化ストレス、および血管炎症である。後述するように、この3つすべてが熱ストレスや治療によって改善されるというエビデンスがある。HSPは、図3に要約したように、これら3つ全てと相互作用することができる。したがって、これらの経路は、少なくとも部分的には、HSPのアップレギュレーションによって、熱療法後に改善されることになるのだが、因果関係を明確にするためには、さらなる調査が必要である。

図3 内皮細胞における熱ショックタンパク質(HSP)と血管機能に関連する3つの主要経路(一酸化窒素(NO)経路、酸化ストレス、炎症)との相互作用
1:Hsp90は、カルシウム-カルモジュリン(Ca2+-CaM)とAkt(プロテインキナーゼBとしても知られている)による内皮NO合成酵素(eNOS)の活性化に必須である。
2:Hsp70はスーパーオキシドディスムターゼ(SOD)を、Hsp25/27はグルタチオンペルオキシダーゼ(GPx)をアップレギュレートし、活性酸素の害を軽減する。活性酸素の害には、a)アルギナーゼのアップレギュレーション、b)NOの消去、c)テトラヒドロビオプテリン(BH4)の消去があり、eNOSのカップリングが阻害される。
3:熱ストレスは、Hsp70を介して、炎症性遺伝子転写のマスターレギュレーターである核因子カッパB(NF-κB)と、炎症性サイトカインである腫瘍壊死因子(TNF)-αおよびインターロイキン(IL)-6を介したその下流効果を抑制する可能性が最も高い。Hsp70はまた、NF-κBの活性化を抑制することができる抗炎症性サイトカインIL-10をアップレギュレートする。NADPH-Ox、ニコチンアミドアデニンジヌクレオチドリン酸酸化酵素、MAPK、マイトジェン活性化プロテインキナーゼ、ONOO-、ペルオキシナイトライト、MCP-1、単球化学吸引タンパク質-1、ICAM-1、細胞間接着分子-1、ECAM-1、内皮細胞接着分子-1.
一酸化窒素の生成
NOは、内皮依存性の血管拡張、血管新生、動脈硬化の進行抑制など、多くの重要な役割を担っている(222)。NOは、主にNO合成酵素(NOS)によって、l-アルギニンから l-シトルリンとNOに変換されて生成されるが、この酵素には、内皮性NOS(eNOS)、神経性NOS(nNOS)、誘導性NOS(iNOS)の3種類の主要アイソフォームが存在する。NOSがNOを産生するためには、適切に活性化(すなわち、結合した補酵素の存在下でリン酸化)される必要があり、Hsp90の中間領域(残基259-615)に結合するeNOS(223)およびnNOS(224)の活性化と安定化にはHsp90との結合が不可欠である(225)。CVの機能に最も関連するアイソフォームであるeNOSの活性化は、細胞のカルシウム状態に依存している。不活性な状態では、eNOSはカベオリン-1によってカベオーラ細胞膜に結合している。カルシウムがメッセンジャータンパク質であるカルモジュリンを活性化し、eNOSに結合できるようになると、eNOSとカベオリン-1の解離が起こる。カルモジュリンを介したeNOSのカベオリン-1からの解離のこのプロセスは、eNOSとHsp90との結合によって媒介される(226、227)。細胞質で遊離すると、eNOSは次に活性化され、これはマイトジェン活性化プロテインキナーゼ(MAPK)およびAkt(プロテインキナーゼB)を含む種々のキナーゼによって達成することができる。Hsp90も活性化には重要である。例えば、eNOSのAktリン酸化は、Hsp90に依存している(228)。
このようなHsp90の広範な役割を通じて、eNOSタンパク質の総量の変化とは無関係に、Hsp90タンパク質の増加によってeNOSの活性化、ひいてはNO産生を促進することができる。例えば、Harrisら(229)は、10週間の運動トレーニング後のマウスにおいて、eNOSタンパク質の存在量に変化はないものの、eNOS活性の増加を観察した。Hsp90の存在量は、運動トレーニング後に増加し、Hsp90とeNOSの会合も増加した。一方、Hsp90をゲルダナマイシンで薬理学的に阻害すると、ブラジキニン、VEGF、ヒスタミン、流体せん断応力に応答するeNOS活性は50-90%減少した(166,225)。
酸化ストレスがある
スーパーオキシドや過酸化水素を含む活性酸素は、ミトコンドリアでの酸化的代謝の副産物として、電子伝達鎖内の複合体IおよびIIでの電子漏洩や、ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)酸化酵素などの活性酸素生成細胞質および膜結合酵素によって生成される。通常の健康な状態では、活性酸素の生成は、抗酸化酵素による活性酸素の還元と細胞からの除去によってバランスが保たれている。さらに、一過性の活性酸素の増加は有益であり、例えば、有酸素運動による血管新生など、細胞の適応を媒介する可能性がある(230)。しかし、活性酸素の過剰生産や抗酸化防御機能の低下により、この生成と除去のバランスが崩れると、活性酸素が蓄積し、「酸化ストレス」として知られる細胞に損傷を与える可能性がある(231)。酸化ストレスは正常な老化に伴って血管細胞に発生し、加齢に伴う内皮機能障害や動脈硬化、心機能の低下の主要なメカニズムであり、その他多くの疾患の発症に関与していると考えられている(19、22、23)。
スーパーオキシドは、NOと容易に結合してペルオキシナイトライトを生成するため、内皮細胞にとって特に有害であり、それによって生物学的に利用可能なNOの量が減少する。過剰なスーパーオキシドはまた、eNOSの結合を解除することでNO産生を減少させるが、これは主にeNOSの必須補因子の1つであるテトラヒドロビオプテリンに対するペルオキシナイトライトの作用によって達成される(232)。さらに、ペルオキシナイトライトはアルギナーゼ活性を上昇させ(233)、eNOSがNO産生に用いる基質であるl-アルギニンの利用性を低下させる。したがって、スーパーオキシドのNO経路への作用は、血管機能のより大きな障害を促進する正のフィードバックループを形成する。
血管細胞における主要な抗酸化酵素は、スーパーオキシドを過酸化水素に還元し、カタラーゼによってさらに水に還元されるスーパーオキシドジスムターゼ(SOD)と、過酸化水素を水に還元するグルタチオンパーオキシダーゼ(235)である(234)。HSPは、これらの抗酸化酵素との相互作用により、慢性的な酸化ストレスを制限および/または改善し、それによってCV機能を改善するのに役立つ。例えば、Hsp70は、新しく転写されたマンガンSOD(MnSOD/SOD2;ミトコンドリアアイソフォーム)のミトコンドリアへの移動とその後の活性化に必須である(236)。Hsp70ノックアウトマウスでは、銅/亜鉛SOD(Cu/ZnSOD/SOD2;細胞内アイソフォーム;全脳ホモジネートで測定)の活性と発現が抑制されており(237)、Hsp70がCu/ZnSODの転写に重要である可能性を示唆している。最後に、培養マウス線維芽細胞でHsp25/27を過剰発現させると、グルタチオンペルオキシダーゼの発現と活性が上昇する(238)。
炎症がある
血管機能障害と心血管疾患は、慢性的な全身および血管の炎症と強く関連している(28、239、240)。心血管疾患患者は循環する炎症性サイトカインのレベルが高く(241–243)、多くの疾患状態の病因は、慢性的な低級炎症によって媒介されていると考えられている(28)。炎症に伴う血管機能障害の主なメカニズムは、核因子κB(NF-κB)の活性化である(244,245)。NF-κBは転写因子であり、活性化されると、TNF-α、IL-6、単球化学誘引タンパク質1、接着分子などの様々な炎症性分子の産生を制御する(244–247)。これらのサイトカインの中には、NF-κBを活性化し、別の正のフィードバックループに貢献するものもある(244)。
いくつかの研究により、事前の熱ストレスは、ラットの心臓組織で示されるように、アンジオテンシン-IIを含む様々な炎症性刺激に応答してNF-κBの活性化を抑制し(248)、ラット膵臓細胞で誘導膵炎(249)、培養牛大動脈内皮細胞でTNF-α(250)。また、熱ストレスは、培養マクロファージ(251、252)および無傷の動物(249、253、254)における炎症性刺激に応答したTNF-αの放出を抑制する。Snyderらによる研究(252)では、Hsp70とTNF-αの間に相互関係があることが確認された。さらに、高レベルのHsp70を発現する細胞は、TNF-αの細胞毒性作用に対してより耐性がある(255、256)。
熱ストレスは、NF-κBやTNF-αの下流にある他の炎症性分子をダウンレギュレートすることも示されている。例えば、エンドトキシンによって誘導されるIL-1の放出は、熱処理した細胞で抑制される(251、252)。IL-1またはTNF-αが介在するIL-6の産生は、事前の熱ストレスとHsp70による処理の両方によって抑制されるが、Hsp60による処理は抑制されない(257)。熱ストレスはまた、TNF-αを介した細胞内(ICAM-1)(258)および内皮細胞接着分子の発現(250)および膵炎を介したICAM-1の生成(89)を抑制する。接着分子の発現は、部分的にNF-κBの活性化に依存することが知られている(259)。
熱ストレスは抗炎症性防御を高める可能性もある。関節炎マウスにHsp70を投与すると、IL-10レベルが上昇し、関節炎を促進する鍵となる様々な免疫細胞における炎症反応が抑制された(260)。Hsp70投与によるこれらの効果は、IL-10のノックアウトによって防止された。余談だが、このメカニズムは、サウナを常用する関節リウマチ患者が報告する症状の軽減を、少なくとも部分的には媒介すると考えられる(261)。さらに、IL-10はNF-κBの活性化を抑制することが報告されており(262)、Hsp70が全身性の炎症に対してこのような深い効果をもたらすもう一つの潜在的なメカニズムがある。
最後に、こうした熱ストレス・療法による抗炎症作用が、ヒトにも及ぶ可能性があることを示す証拠がある。フィンランドのKuopio虚血性心疾患研究に登録された中年男性において、サウナの利用頻度と全身炎症の肝臓由来マーカーであるC反応性タンパク質の循環レベルとの間には、ベースライン時および11年間の追跡調査の両方で逆の関係があり(263、264)、熱療法介入によって循環炎症マーカーが減少する可能性がある。2週間の温泉入浴は慢性心不全患者の循環C反応性タンパク質、IL-6、TNF-αを減少させ(265)、8-10週間の湯船浸かりは多嚢胞性卵巣症候群の肥満女性の循環C反応性タンパク質を低下させた(38)。
循環因子
急性熱ストレスや慢性熱療法に反応して他の場所(骨格筋や脂肪細胞など)で発現が増加した因子が循環に入り、その後血管細胞に接触して細胞プロセスに影響を与える可能性がある。実際、循環因子は、ヒト被験者の血清/血漿に細胞や組織を曝露することによって評価されるように、他の種類のライフスタイル介入の効果を媒介することが示されている(266–271)。
培養血管内皮細胞において、温熱療法を受けた若い被験者の血清(温熱療法前に採取した血清または偽/熱中性水浸漬を受けた被験者の血清と比較)は、抗酸化物質MnSODのタンパク質量を増加させ、スーパーオキシド生成を減少させ、eNOS量を増やし、内皮細胞機能の確立した指標である血管新生(93、273)を増加させた(272).この後者の効果は、NOS阻害剤であるニトロ-l-アルギニンメチルエステルとの同時投与によって阻止されたことから、NO依存性であり、熱療法血清が機能的にNOバイオアベイラビリティを増加させることが示された。また、熱療法血清は、心血管系虚血イベントの細胞モデルである内皮細胞における低酸素-再酸素化後の炎症性転写因子NF-κBの活性化、活性酸素産生、炎症性サイトカインの放出を抑制した(194)。重要なことは、これらの効果はすべて、細胞内のHSPの存在量に変化を与えることなく観察されたことである。
より多くの研究が必要であることは明らかだが、これらのデータは、循環環境は、少なくとも部分的には、温熱療法の有益なCV効果を媒介するために重要であることを示唆している。今後の研究では、どのような循環因子がこのような細胞効果をもたらすのかを、1つまたは2つの因子よりもいくつかの因子の組み合わせである可能性が高いという注意点を考慮しつつ、調査する必要がある。循環代謝物、サイトカイン/ケモカイン、および/またはタンパク質の存在量の変化に加えて、循環微粒子および/または微小小胞の役割も考慮する必要がある。急性受動的熱ストレスは、若い被験者(274)および脊髄損傷者(275)の循環内皮および血小板由来微小粒子レベルを低下させる。この微小粒子は、内皮の酸化ストレス(276)と炎症を促進することが知られており、血管疾患の進行において病原性の役割を果たすと考えられている(278).マイクロベシクル(エクソソームはその一種)は、親細胞と同様の内容物を含む細胞片であり、他の細胞種と融合し、あるいは入り込んでシグナル伝達分子として作用することができる(279)。このため、温熱療法を受けたヒトからマイクロベシクルの内容物を分離・分析することで、その基礎となるメカニズムに大きな洞察を与えることができる。
その他の細胞メカニズム
Horowitz博士らは、4週間の連続熱曝露を受けたラットの心臓において、熱療法がCV保護効果を媒介する他の多くの潜在的メカニズムを同定した。彼らは、熱療法が、HSP(280)と抗酸化酵素(281)のアップレギュレーションに加えて、以下の関連遺伝子をアップレギュレートすることを観察している:1)抗アポトーシス(282)、2)DNAとクロマチンの完全性の維持(283、284)、3)解糖と嫌気性代謝への依存度の増大(285)。これらの変化は、虚血性障害や再灌流時に起こる酸化的障害から心臓組織を保護するのに役立つ。興味深いことに、これらの代謝変化の多くは、完全な暑熱順化に必須であり(286,287)、Hsp72によって安定化される低酸素誘導因子(HIF)-1αによって媒介されると考えられている。これらの経路が、ヒト、間欠的反復(連続)熱曝露、あるいは心臓以外の組織(血管系など)でも影響を受けるかどうかはまだ不明であるため、これらの広範かつエレガントな研究は、他の研究者によってさらに調査されるべき洞察を提供している。
研究ギャップと今後の方向性
パッシブ温熱を繰り返すことで、生活の質の向上や健康増進に多くのメリットがあることはよく知られている。しかし、現代病を対象とした「治療」として熱を利用するという概念は、研究の最前線に現れたばかりで、日常臨床の一部となるには程遠い(図4)。フィンランドではサウナが文化として根付いているが、他の国ではサウナや湯船は贅沢品として捉えられている。温熱療法の研究が進むにつれて、いつか温熱療法が病気の予防や治療のために医療従事者に処方されるようになることが考えられる。現在の文献からすると、この考えは時期尚早かもしれないが、医師は自然や大自然に触れることを処方し始めており、同様の根拠がある。重要なことは、温熱療法の様々な様式を利用した、より多くの長期的かつ介入的な研究が本当に欠けているということである。特に、どの方法が特定の臨床集団に最も適しているのか、さまざまな臨床条件において効果を最大化するために体温を上げる理想的な温度があるのか、どの形態の温熱療法がグループによって最も耐えられるのか、温熱療法の効果が停止後どのくらい維持されるのか、「維持量」によってより少ない頻度で温熱暴露の効果を延長できるかなど、多くの未解決問題が残されている。また、温熱療法の健康効果を支えるメカニズムについても多くの疑問が残されている。上記のメカニズムに関するエビデンスのうち、ヒトで検討されたものはまだ比較的少ないの。例えば、ヒトにおけるHSPや循環因子の具体的な役割については、生体内でそれらを測定する最善の方法はおろか、ほとんど知られていない。このような基礎的な研究が進めば、分子生物学を専門とする研究者が満足するだけでなく、治療法をさらに検討し、温熱療法の効果を引き出すための基礎となるはずだ。特定の薬物、介入方法、サプリメントが温熱療法を妨害したり補完したりする可能性については、事実上未解明である。温熱療法が運動による心血管疾患の予防効果を高めると報告した研究は1件しかない(32)。運動療法と温熱療法が心血管系を保護するメカニズムの違いや重複を理解する必要がある。運動療法の処方については多くの文献があるにもかかわらず、温熱療法の処方についてはほとんど知られていない。要約すると、何千年も前に快適さと安全のために暖かさを求めた祖先に続いて、私たちは再び、健康への脅威に対抗するために、今度は現代病から身を守るために、熱に頼っているのである。
図4 温熱療法が心血管系(CV)の機能と健康に及ぼす影響に関する文献の主なギャップをまとめたものである。
助成金
著者らの研究は、American Heart Association Grants 14PRE20380300 and 16PRE27780085, Eugene and Clarissa Evonuk Memorial Foundation, Kenneth and Kenda Singer Endowment, and National Heart, Lung, and Blood Grants R01-HL-144128 and F32-HL-140875の支援を受けている。
ディスクロージャー
金銭的なものであれ、そうでないものであれ、利益相反はないと著者らは宣言している



