コンテンツ
Combined metabolic activators improve cognitive functions in Alzheimer’s disease patients: a randomised, double-blinded, placebo-controlled phase-II trial
https://pubmed.ncbi.nlm.nih.gov/36703196/
オンライン公開 2023年1月26日 .
Burak Yulug、#1 Ozlem Altay、#2 Xiangyu Li、#2 Lutfu Hanoglu、3Seyda Cankaya、1Simon Lam、4Halil Aziz Velioglu、5,6Hong Yang、2Ebru Coskun、3Ezgi Idil、1Rahim Nogaylar、1Ahmet Ozsimsek、1Cemil Bayram、7Ismail Bolat、8Sena Oner,9Ozlem Ozdemir Tozlu,9Mehmet Enes Arslan,9Ahmet Hacimuftuoglu,7Serkan Yildirim,8Muhammad Arif,2Saeed Shoaie,2,4Cheng Zhang,2,10Jens Nielsen,11Hasan Turkez,12Jan Borén,13Mathias Uhlén、
AI解説
この論文は、アルツハイマー病(AD)患者に対する複合代謝活性剤(CMA)の効果を調べた第2相臨床試験の結果を報告している。以下に、一般向けにポイントを抜き出し、医師・栄養士向けの実践的な内容も加えて解説する。
一般向けのポイント:
- CMAはL-セリン、ニコチンアミドリボシド、N-アセチル-L-システイン、L-カルニチン酒石酸塩の4つの成分からなる栄養補助食品である。
- CMAを84日間投与することで、AD患者の認知機能が改善し、特に重度のアルツハイマー病患者で顕著だった。
- CMAは安全性が高く、大きな副作用は見られなかった。
- CMAの投与により、AD患者の脳の構造(海馬体積や皮質の厚さ)が維持・改善された。
- 血液中の代謝物やタンパク質の分析から、CMAがADに関連する代謝異常を改善することが示唆された。
アルツハイマー病患者さん向けの実践的な内容:
- CMAは、アルツハイマー病の症状を改善する可能性のある栄養補助食品である。しかし、現在のところ、医師から処方されることはない。CMAの摂取を検討する場合は、必ず主治医や担当の栄養士に相談しよう。
- CMAの4つの成分(L-セリン、ニコチンアミドリボシド、N-アセチル-L-システイン、L-カルニチン酒石酸塩)は、個別にサプリメントとして販売されている。ただし、今回の研究で使用された割合と同じものを見つけるのは難しいかもしれない。
- CMAは、認知機能の改善に加えて、脳の構造(海馬の体積や皮質の厚さ)を維持・改善する可能性がある。これは、アルツハイマー病による脳の変化を遅らせる効果が期待できる。
- CMAの効果は、病気の進行度合いによって異なる可能性がある。今回の研究では、重度のアルツハイマー病の患者で特に効果が高いことが示唆された。
- CMAは比較的安全性が高いと考えられるが、副作用がまったくないわけではない。体調に変化があった場合は、速やかに医師や栄養士に相談しよう。
- CMAの効果を最大限に引き出すには、バランスの取れた食事、適度な運動、十分な睡眠、社会参加など、健康的な生活習慣を維持することが大切である。
- アルツハイマー病の症状や進行は個人差が大きいため、CMAの効果にも個人差があると考えられる。効果が実感できない場合は、がっかりせずに主治医や栄養士に相談しよう。
- CMAは、アルツハイマー病の根本的な治療法ではない。しかし、症状の改善や進行の遅延に役立つ可能性がある。CMAを取り入れることで、少しでも日常生活の質が向上するかもしれない。
要旨
背景
アルツハイマー病(AD)は、神経変性の重要な要素に関連する代謝異常と関連している。我々は最近、複合代謝活性剤(CMA)をADモデルラットに投与し、CMAが動物のAD関連組織学的パラメーターを改善することを観察した。CMAは、細胞質からのミトコンドリア脂肪酸の取り込みを促進し、ミトコンドリアでの脂肪酸酸化を促進し、酸化ストレスを緩和する。
方法
ここでは、無作為化二重盲検プラセボ対照第II相臨床試験を計画し、AD患者のグローバル代謝に対するCMA投与の効果を検討した。CMA1用量には、12.35gのL-セリン(61.75%)、1gのニコチンアミドリボシド(5%)、2.55gのN-アセチル–L-システイン(12.75%)、3.73gのL-カルニチン酒石酸塩(18.65%)が含まれた。AD患者は最初の28日間はCMAまたはプラセボを1日1回投与され、28日目から84日目までは1日2回投与された。主要エンドポイントは、プラセボ群と治療群間の認知機能および日常生活活動スコアの差であった。本研究の副次的目的は、CMAの安全性と忍容性を評価することであった。また、AD患者におけるCMAの有効性を評価するために、包括的な血漿メタボロームおよびプロテオーム解析が行われた。
結果
CMA群では、84日目のADAS-Cog(A. sessment Scale-cognitive subsale)スコアが0日目と比較して有意に低下した(P= 0.00001,29%の改善)。さらに、ADAS-Cogスコアの高い患者では、プラセボ群と比較してCMA群でADAS-Cogスコアの有意な低下(認知機能の改善)がみられた(P = 0.0073)。AD患者における認知機能の改善は、画像解析に基づく海馬体積と皮質厚の関連した変化によって支持された。さらに、NAD+とグルタチオン代謝に関連するタンパク質と代謝物の血漿レベルは、CMA治療後に有意に改善した。
結論
われわれの結果は、AD患者をCMAで治療することにより、認知機能が向上し、フェノミクス、メタボロミクス、プロテオミクス、画像解析に関連する臨床パラメータが改善することを示している。
Trial registration ClinicalTrials.govRegistered 17 July 2019,
補足情報
オンライン版には10.1186/s40035-023-00336-2の補足資料が含まれている。
キーワードアルツハイマー病、複合代謝アクチベーター、マルチオミクス、システム生物学、システム医学
背景
アルツハイマー病(AD)は、進行性のシナプスや軸索の機能障害、神経細胞の喪失、認知機能の低下によって特徴づけられる[1]。ADは、ミトコンドリア機能障害や生体エネルギー障害など、神経変性の重要な要素に関連する代謝異常や酸化ストレスと密接に関連しているという証拠が増えつつある[2,3]。実際、インスリン抵抗性などの全身性の代謝異常が神経細胞の生体エネルギー障害と強く関連していることを示すデータが増えている[4,5]。これは認知障害や脳特異的な神経病理として現れることがあり、グルコース代謝障害、酸化ストレス、インスリン抵抗性、アミロイド生成など、ADと共通の発症機序を有している[4,6,7]。最近のエビデンスでは、2型糖尿病患者はAD発症リスクが高いことが示唆されている[6]。
ADは、異常なアミロイド蛋白とタウ蛋白の蓄積によって定義されるが[8]、アミロイドカスケードとADにおける認知機能障害との間に直線的な因果関係があるというメカニズム論的仮定は、アミロイド低下アプローチがヒト臨床試験において認知的利益をもたらすことができなかったことから、まだ不十分である[9]。ADにおける脳エネルギー代謝障害とミトコンドリア機能障害が認知機能低下に寄与している可能性を示唆する証拠が増えてきている。同時に、代謝状態を改善し、認知機能低下を遅らせたり、認知症の進行を予防するために、代謝性疾患に対する様々な薬剤が処方されている。陽電子放射断層撮影法による研究では、AD患者において認知症状が発現する前にベースラインの脳糖代謝異常が明らかにされている[11]。さらに、最近の前臨床データでは、加齢とADは、乳酸分泌の全体的な増加や生体エネルギー酵素のダウンレギュレーションなど、脳エネルギー代謝の再編成とミトコンドリア機能障害に関連していることが示された[12,13]。
いくつかの研究から、脳のエネルギー代謝障害と酸化ストレスが、ADの進行過程におけるミトコンドリアの変性と異常なタンパク質の蓄積に関連していることが示唆されている[14-18]。このような状況において、オートファジー/リソソーム経路が損傷したミトコンドリアの除去(マイトファジー)に重要な役割を果たし、オートファジーの機能不全が神経細胞における機能不全ミトコンドリアの蓄積をもたらすことが、新たな証拠によって示唆されている[19]。このことは、ADの神経変性過程におけるミトコンドリアの健康維持および/またはマイトファジーを刺激する介入の有益な効果という新たな窓を開くものである[20]。これに関連して、脳細胞におけるミトコンドリアの完全性、オートファジー、生体エネルギー関連のシグナル伝達に対するニコチンアミドの有益な効果は、海馬における異常なAβとタウの蓄積の減少に関連し、トランスジェニックマウスにおける認知能力の改善につながる[21,22]。また、最近のヒトを対象とした研究では、AD患者における海馬のマイトファジーの障害は、マイトファジー増強戦略によく反応し、そのような治療によって、ヒトの神経細胞におけるADに関連したタウ病態とトランスジェニックモデルにおける記憶障害が最終的に改善されることが示唆された[23]。
酸化傷害を軽減し、生体エネルギーを改善するために複数の化合物を組み合わせること、言い換えれば、複数の経路を同時に標的とすることは、トランスレーショナル・アウトカムに成功する可能性が高い治療戦略として提案されている[24]。以前の研究では、マルチオミクス・プロファイリングに基づいて、ADのトランスジェニック・マウス・モデルにおいて、セリンの利用可能性の制限、de novoグルタチオン(GSH)合成の減少、NAD+代謝の変化が同定された[25]。AD動物モデルではNAD+が減少しているが、ADの実験室モデルでは、NAD+の増強がAβ、タウ、代謝病態を緩和している[23,26]。これらの知見は、AD患者においてアシルカルニチンの脳脊髄液レベルが有意に変化し、認知機能の低下や脳の構造異常と相関していることを示すヒトのメタボロームデータによっても確認されている[27,28]。
上記のADの代謝的背景に加え、いくつかの神経画像研究によって、海馬、大脳皮質、下頭頂部、中前頭部、後頭部などの重要な認知領域の変化が明らかにされている[29]。例えば、Nagataらは、海馬の脆弱性がアルツハイマー病患者の記憶障害や遂行機能障害に関与している可能性を示した[30,31]。同様に、いくつかの神経画像研究では、皮質の厚さがADの病態生理に重要な役割を果たしていることが示された[32,33]。これらの有望な研究にもかかわらず、AD患者の認知機能低下に関与する全身の代謝変化と特定の脳領域に共通する病態生理学的メカニズムを評価した研究はない。
我々は、非アルコール性脂肪性肝疾患のマルチオミクスデータの統合的ネットワーク解析に基づき、L-セリン、N-アセチルシステイン(NAC)、ニコチンアミドリボシド(NR)、L-カルニチン酒石酸塩(LCAT、L-カルニチンの塩形態)からなる複合代謝活性剤(CMA)を開発し、CMAの投与がミトコンドリアを活性化し、動物およびヒトにおいて炎症マーカーを改善することを示した[34–38]。われわれは、CMA投与が細胞質からのミトコンドリア脂肪酸の取り込みを促進し、ミトコンドリアでの脂肪酸酸化を促進し、酸化ストレスを緩和することを発見した[39]。グローバルメタボロームおよびプロテオームプロファイリングにより、CMA投与が脂肪酸酸化とde novo GSH合成を効果的に増加させることが明らかになった[34]。さらに、CMAを投与したCOVID-19患者では、抗酸化代謝と炎症に関連する代謝産物の血漿中濃度が、プラセボと比較して改善した[38]。最近、ストレプトゾトシン誘発AD様ラットにおいて、個々の代謝活性化物質とCMAを試験し、このモデルにおいてCMA投与が神経組織学的転帰と並行して行動スコアを有意に改善することを示した[40]。
これらの研究に基づき、我々は、CMA投与がアルツハイマー病患者の代謝パラメーターと脳機能を改善する有望な治療法である可能性があると仮定した。ここで我々は、包括的なフェノミクス、メタボロミクス、プロテオミクスおよび画像解析を通じて、AD患者の全身の代謝に対するCMA投与の効果を検討するために、無作為化二重盲検プラセボ対照ヒト第2相臨床試験を計画した。
材料と方法
臨床試験のデザインと監督
この無作為化、並行群間、2群間、二重盲検、プラセボ対照、第2相試験の患者は、トルコ、アンタルヤのAlanya Alaaddin Keykubat大学医学部およびトルコ、イスタンブールのIstanbul Medipol大学医学部で募集された。治験に関連する手続きを開始する前に、参加者全員から書面によるインフォームド・コンセントを得た。独立した外部データモニタリング委員会が参加者の安全性とリスク・ベネフィット解析を監督した。本試験は、Good Clinical Practiceガイドラインおよびヘルシンキ宣言の原則に従って実施された。本試験はトルコ、イスタンブールのIstanbul Medipol大学の倫理委員会により承認され(Date:22.01.2020, Decision No:7)、https://clinicaltrials.gov/、Clinical Trial ID:に登録された。
臨床試験参加者の資格基準
ADAS-cog(ADAS ≥ 12)およびCDR-SOB(CDR ≤ 2)による軽度から中等度のADを有する50歳以上の患者が試験に登録された。患者はDiagnostic and Statistical Manual of Mental Disorders-5の診断基準に従って診断された。脳卒中、重度の脳外傷、毒性薬物曝露の既往のある患者は除外された。患者の主な特徴は、Additional file1に要約されている:データセットS1。組み入れ基準、除外基準、無作為化基準の詳細は、Additional file2: Supplementary Appendixに記載されている。
無作為化、介入、追跡調査
患者はCMA投与群とプラセボ投与群に無作為に割り付けられた(2:1)。患者情報(患者番号、生年月日、イニシャル)がウェブベースの無作為化システムに入力され、無作為化コードが電子症例報告書に入力された。すべての臨床スタッフは、参加者と同様に治療について盲検化されていた。
治療は診断日から開始された。プラセボとCMAはともに粉末状で、同じプラスチックボトルに入れられ、1回分が水に溶かされて経口投与された。CMAの各用量には、12.35gのL-セリン(61.75%)、1gのニコチンアミドリボシド(5%)、2.55gのN-アセチル–L-システイン(12.75%)、3.73gのL-カルニチン酒石酸塩(18.65%)が含まれていた。全患者は最初の28日間は毎日夕食後に1回、28日目から84日目までは朝食後と夕食後にそれぞれ2回投与された。全患者は84日目にフォローアップのために来院した。詳細な情報は試験実施計画書(Additional file2: Supplementary Appendix)に記載されている。
結果
CMAはアルツハイマー病患者の認知機能と臨床パラメーターを改善する
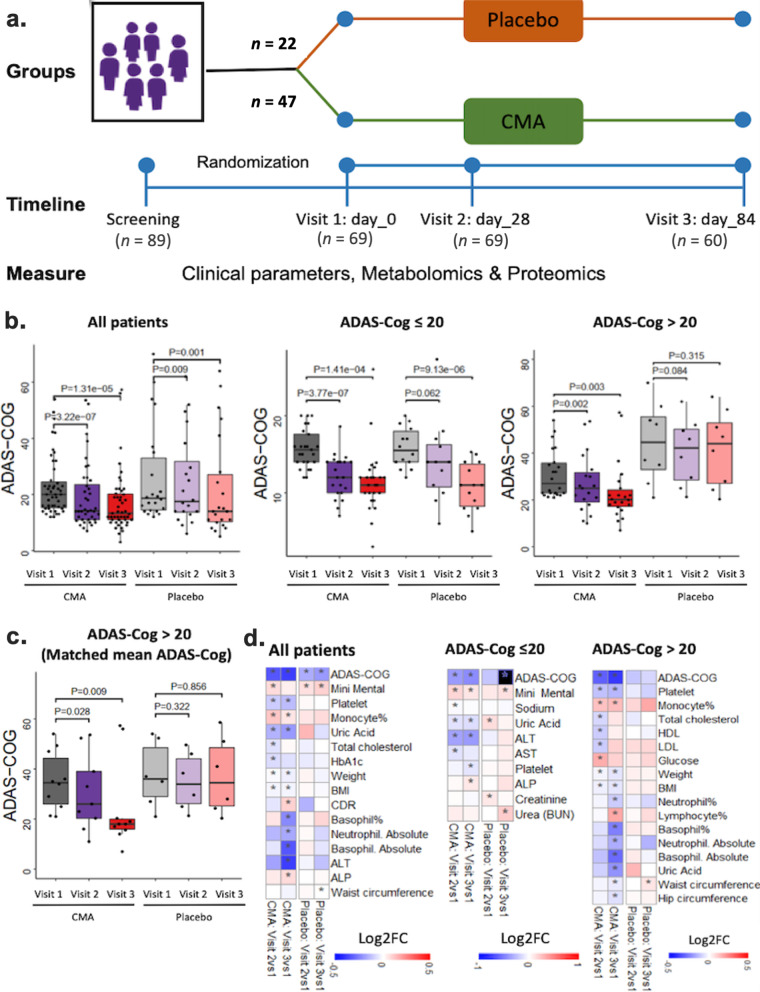
AD患者におけるCMAの効果を検証するため、二重盲検無作為化プラセボ対照第2相試験を実施し、ADと診断された成人89人をスクリーニングした。2020年2月1日から10月1日の間に、ADAS-Cog(ADAS≧12)およびCDR-SOB(CDR≦2)による軽度から中等度のADを有する50歳以上の患者69人を募集した。69人の患者のうち、47人がCMA群に、22人がプラセボ群に無作為に割り付けられ、28日後にvisit 2を終了した。9人の患者(CMA群7人、プラセボ群2人)がCOVID-19のロックダウンにより84日目の訪問前に試験から脱落した。最終的に、60人の患者(CMA群40人、プラセボ群20人)が84日目に面会3を終了した(図1a、追加ファイル3:図S1)。0日目、28日目、84日目の臨床変数を評価し、CMA群とプラセボ群の差を分析した(追加ファイル1:データセットS1、追加ファイル4:データセットS2)。
図1 CMAはADAS-Cogスコアと臨床パラメーターを改善した。
aAD患者におけるCMAの効果を検証するための試験デザイン。b0日目、28日目、84日目におけるCMA群とプラセボ群のADAS-Cogスコアの差。ADAS-Cogスコアはさらに、患者を高ADAS-Cogスコア(20点以上)群と低ADAS-Cogスコア(20点以下)群に層別化して分析した。ADAS-Cogスコアは、CMA群では28日目対0日目(Log2FoldChange [FC] = – 0.33,26%の改善、P= 0.0000003)、84日目対0日目(Log2FC = – 0.37,29%の改善、P= 0.00001)で有意に低下した。プラセボ群では、28日目対0日目(Log2FC=-0.16,12%の改善、P=0.009)、84日目対0日目(Log2FC=-0.19,14%の改善、P=0.001)で、わずかではあるが有意な低下がみられた。さらに、ADAS-Cogスコアは、0日目に対して28日目に有意に減少し(Log2FC = – 0.31,24%の改善、P= 0.002)、0日目に対して84日目に有意に減少した(Log2FC = – 0.38,30%の改善、P= 0.003)。高得点CMA群では、84日目対0日目(Log2FC = – 0.38,30%の改善、P = 0.003)、高得点プラセボ群では有意差はみられなかった。c重度(ADAS-COGスコア> 20)CMA群から、ADAS-COG値がプラセボ群と一致した患者10人を選び(P値:0.693)、ADAS-Cogスコアを提示した。ADAS-COGスコアの差を再計算したところ、CMA群では有意な改善がみられたが、プラセボ群では有意差はみられなかった。dCMA群とプラセボ群の両方で、治療前と治療後の臨床変数のlog2FCベースの変化を示すヒートマップ。アスタリスクはStudentのt検定による統計的有意性を示す(P< 0.05)
本試験における患者の平均年齢は70.8歳(56~86歳)で、52.1%が男性であった(表(表Table ,1, Additional file1: Dataset S1)。ADAS-Cogスコアの平均は、CMAで22.88(±10.51)、プラセボで26.28(±17.35)であった(表(表Table ,1, Additional file4: Dataset S2)。これらの人口統計学的パラメータとAD臨床指標には、CMA群とプラセボ群の間でベースライン時の有意差はなかった(表(表Table )1)。その他の臨床的特徴は、CMA群とプラセボ群で同様であった(追加ファイル1:データセットS1および追加ファイル4:データセットS2)。安全性に関しては、重篤な有害事象は発生せず、5例(7.2%)が有害事象を報告した。全員が試験を完了することを決定した(表(表Table 2)。
表1 研究対象者の人口統計学的特徴とベースライン特性*。
| CMA(n= 47) | プラセボ(n= 22) | P値 | |
|---|---|---|---|
| 年齢(歳) | 70.77 ± 8 | 70.91 ± 7.54 | 0.97 |
| 性別 | |||
| 男性 | 25 (53.2%) | 11 (50%) | 0.88 |
| 女性 | 22 (46.8%) | 11 (50%) | |
| エスニシティ | 白人(100) | 白人(100) | – |
| 肥満度指数 | 29.04 ± 5.25 | 27.43 ± 5.05 | 0.23 |
| ADCS-ADL | 55.79 ± 15.02 | 56.67 ± 15.63 | 0.83 |
| ADAS-コグ | 22.88 ± 10.51 | 26.28 ± 17.35 | 0.32 |
| エムエムエスイー | 19.45 ± 4.21 | 17.95 ± 5.66 | 0.22 |
| CDR | 0.82 ± 0.45 | 1.02 ± 0.6 | 0.09 |
* 性別と民族を除き、平均値±標準偏差で示す。
MMSE Mini mental state examination、ADAS-cogAlzheimer’s disease assessment scale-cognitive subsale、ADCS-ADAlzheimer’s disease cooperative study-activities of daily living、CDRClinical dementia rating scale。
表2 副作用リスト
| 患者番号 | 治療 | 有害事象 | システム器官クラス | 副作用強度 | 治験薬との関係 |
|---|---|---|---|---|---|
| TR10006 | アクティブ | そう痒症 | 皮膚・皮下組織障害 | マイルド | 無関係 |
| TR10011 | アクティブ | めまい | 神経系障害 | マイルド | 無関係 |
| TR10034 | アクティブ | 下痢 | 胃腸障害 | 中程度 | 無関係 |
| TR10036 | アクティブ | 下痢 | 胃腸障害 | 中程度 | 無関係 |
| TR20045 | アクティブ | 吐き気 | 胃腸障害 | 中程度 | 不明 |
全患者の臨床変数を測定し、活性群とプラセボ群の投与前後の差を分析した(図1b、表3,3、追加ファイル4:データセットS2)。ADAS-Cogスコアは、0日目に対して28日目に有意に低下し(Log2FoldChange [FC] = – 0.33,26%改善、P= 0.0000003、効果量 = – 0.43,95%CI = [- 0.59, – 0.29])、さらにCMA群では84日目に0日目に対して減少し(Log2FC=-0.37,29%の改善、P=0.00001、効果量=-0.50,95%CI=[-0.71、-0.29])、AD患者における認知機能の改善を示した。プラセボ群においても、28日目対0日目(Log2FC=-0.16,12%の改善、P=0.009、効果量=-0.16,95%CI=[-0.27、-0.05])および84日目対0日目(Log2FC=-0.19,14%の改善、P=0.001、効果量=-0.23,95%CI=[-0.35、-0.11])において、わずかではあるが有意な改善が認められた。28日目と84日目には群間に有意差はみられなかった。これは、プラセボ効果に関連している可能性がある。プラセボ効果は、AD臨床試験の初期段階において明らかであり、比較的不変の反応、あるいは改善さえも最大12カ月間継続することがある。
表3 CMA群とプラセボ群におけるADAS-Cog、ADCS-ADL、MMSEスコアの差
| 計測 | 患者 | プラセボ | シーエムエー | CMA vs プラセボ | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log2FoldChange | P値 | Log2FoldChange | P値 | Log2FoldChange | P値 | ||||||||||
| 28日目 vs 0日目 | 84日目 vs 0日目 | 28日目 vs 0日目 | 84日目 vs 0日目 | 28日目 vs 0日目 | 84日目 vs 0日目 | 28日目 vs 0日目 | 84日目 vs 0日目 | 0日目 | 28日目 | 84日目 | 0日目 | 28日目 | 84日目 | ||
| ADAS-COG | すべて | – 0.159 | – 0.191 | 0.009 | 0.001 | – 0.327 | – 0.371 | 3.2e-07 | 1.3e-05 | – 0.200 | – 0.368 | – 0.379 | 0.317 | 0.111 | 0.179 |
| 高得点 | – 0.106 | – 0.074 | 0.084 | 0.315 | – 0.305 | – 0.381 | 0.002 | 0.003 | – 0.522 | – 0.671 | – 0.774 | 0.013 | 0.008 | 0.007 | |
| 低得点 | – 0.213 | – 0.596 | 0.062 | 9.1e-06 | – 0.387 | – 0.449 | 3.7e-07 | 1.4e-04 | – 0.011 | – 0.218 | 0.143 | 0.886 | 0.119 | 0.478 | |
| MRI | – 0.131 | – 0.233 | 0.170 | 0.022 | – 0.262 | – 0.391 | 5.9e-05 | 3.3e-04 | – 0.388 | – 0.520 | – 0.546 | 0.159 | 0.100 | 0.135 | |
| ADCS-ADL | すべて | – 0.024 | – 0.036 | 1.000 | 0.332 | 0.062 | 0.002 | 0.104 | 0.745 | – 0.022 | 0.063 | 0.015 | 0.830 | 0.557 | 0.899 |
| ミニ・メンタル | すべて | 0.078 | 0.108 | 0.043 | 0.022 | 0.087 | 0.048 | 0.015 | 0.120 | 0.115 | 0.124 | 0.055 | 0.225 | 0.249 | 0.627 |
MMSE Mini mental state examination、ADAS-cogAlzheimer’s disease assessment scale-cognitive subscale、ADCS-ADAlzheimer’s disease cooperative study-activities of daily living、ADAS-Cogスコア20点以上が高得点、20点以下が低得点、MRIMagnetic resonance imaging。太字は統計的有意性(P< 0.05)を示す。
また、患者をADAS-Cogの低得点群(ADAS-Cogスコア20点以下、n=39)と高得点群(ADAS-Cogスコア20点以上、n=30)に層別化し、臨床パラメータの違いを分析した。84日目のADAS-Cogスコアが高い患者において、CMA群とプラセボ群との間に有意差(Log2FC = – 0.77,P= 0.0073, 効果量 = – 1.23, 95% CI = [- 0.3, – 2.17])を認めた(図1b、Additional file4: Dataset S2)。さらに、28日目と0日目のADAS-Cogスコアの有意な改善(Log2FC = – 0.31,24%の改善、P= 0.002、効果量 = – 0.48,95%CI = [- 0.76, – 0.2])、84日目と0日目のADAS-Cogスコアの有意な改善(Log2FC = – 0.38,30%改善、P=0.003、効果量=-0.59,95%CI=[-0.97、-0.21])、高スコアのCMA群では両時点で有意差がみられなかったが、高スコアのプラセボ群では有意差がみられた(図1b、追加ファイル4:データセットS2)。重度の(ADAS-Cog>20)CMA群とプラセボ群のADAS-Cogスコアのベースライン値分布と平均値には、被験者の無作為化による有意差が観察された(図1b)。結果を検証するために、ADAS-Cog値が一致したCMA群から無作為に10人の患者をプラセボ群(P値:0.693)に選択したところ(図1c)、CMA群では有意な改善が認められたが、プラセボ群では有意差は認められなかった。この結果から、ADAS-Cogスコアが高い重症AD患者はCMA投与により反応性が高いことが示された。
その他の主要評価項目はADCS-ADLとMMSEであった。ADCS-ADLでは、時点間および群間に有意差は認められなかった(図1b、表3,3、追加ファイル4:データセットS2)。MMSEについては、プラセボ群では28日目、84日目と0日目の比較で(それぞれP= 0.04,0.02)、CMA群では28日目と0日目の比較で(P= 0.02)有意差が認められたが、84日目と0日目の比較では有意差は認められなかった(図1b、表3,3、Additional file4: Dataset S2)。MRIで評価された患者では、ADCS-ADLとMMSEにおいて、どの時点においても、また群間においても有意差は認められなかった(Additional file4: Dataset S2)。
副次的結果変数の解析では、血清アラニンアミノトランスフェラーゼ(ALT)値(Log2FC=-0.38、P=0.01)と尿酸値(Log2FC=-0.19、P=0.001)は、CMA群のみ0日目に対して84日目に有意に低下した(図1d、追加ファイル4:データセットS2)。この低下は、ADAS-Cogスコアが高い群でも低い群でも見られた。一方、プラセボ群では84日目対0日目に有意差は認められなかった(図1d、追加ファイル4:データセットS2)。
全血球数パラメータも測定したところ、CMA群ではそれらの値が有意に変化していた(図1d、Additional file4: Dataset S2)。血小板、好塩基球%、好塩基球と好中球の絶対数は、CMA群でのみ84日目対0日目に有意に減少した。一方、単球のレベルは、CMA群では84日目対0日目に有意に増加した(図1d、追加ファイル4:データセットS2)。したがって、この解析から、CMAの投与は、AD患者の認知機能の改善と並行して、臨床パラメータを改善することが示された。
血液プロファイルがCMAへの反応に影響
治療反応のばらつきと臨床的不均一性は、ADにおいて文献的によく報告されている。ここでわれわれは、CMA投与に対する臨床的測定値の個人間変動に注目した。したがって、CMAによく反応する患者は他の患者よりも多く、臨床的測定によってこれらのサブセットを定義することができるという仮説を立てた。
肝障害のマーカーであるALTがCMAに対するよりよい反応を示すかどうかを調べるため、0日目の全患者のALT中央値によって患者を高ALT群と低ALT群に層別化した。ALT値が低いCMA群では、ADAS-Cogスコアが各時点で有意に改善したが、プラセボ群では改善はみられなかった。対照的に、ALT値が高いCMA群の患者もADAS-Cogスコアの改善(すなわち低下)を示したが、変化の程度はCMA群の低ALT患者ほどではなかった(図2a)。さらに、プラセボ群のALT高値患者でもADAS-Cogスコアの改善がみられた。したがって、これらの結果はALT値が低い患者ほどCMAに反応することを示唆している。
図2 CMA投与に対する反応に有益な臨床変数の同定。
a:来院1時のALT値が16IU/l以下(上段)と16IU/l超(下段)の患者におけるADAS-Cogスコアの来院期間にわたる分布。プラセボ群と比較してCMA群でADAS-Cogの有意な変化をもたらした臨床変数のグループ分けのみが示されている(P< 0.05)。カラースケールは、受診間のADAS-Cogスコアのlog2倍変化を示す。受診間の統計的有意性は、両方の受診に参加した個人間で一対のt検定により決定した。アスタリスクはP< 0.05の統計的有意性を示す。
さらに、各血液パラメータについて層別化を繰り返し、アルカリホスファターゼ(ALP)高値、γ-グルタミルトランスフェラーゼ(GGT)低値、ヘマトクリット高値、HbA1c高値、インスリン高値、尿酸高値、好塩基球数高値、赤血球数高値を、CMAに対する反応性を高める指標として同定した(図2b、Additional file5: 図S2)。
CMAは代謝活性化因子に関連する代謝産物の血漿中濃度を上昇させる
まず、セリン、カルニチン、NR、システインおよびそれらの副生成物の血漿レベルを分析した。代謝活性物質の血漿中濃度は、CMA群では84日目に0日目より上昇した(図3a、Additional file6: Dataset S3)。さらに、NR、1-メチルニコチンアミド、ニコチン酸、N1-メチル-2-ピリドン-5-カルボキサミドおよびニコチン酸アミド(NRおよびNAD+代謝に関連)、セリン、グリシンおよびサルコシン(セリンおよびグリシン代謝に関連)、ならびにデオキシカルニチンおよびカルニチン(カルニチン代謝に関連)の血漿中濃度は、CMA群では0日目と比較して84日目に有意に高かった(図3b-d, Additional file6: Dataset S3)。
図3 CMAは血漿中の代謝物レベルを変化させる。
a0日目と84日目におけるセリン、カルニチン、システイン、ニコチンアミドを含む個々のCMAの血漿中レベルの差。b-dCMA群とプラセボ群において84日目と0日目の間で有意差が認められたアミノ酸、脂質、その他の代謝物の血漿中レベル。調整後P<0.05。ヒートマップは84日目と0日目の代謝物のlog2FC値を示す。アスタリスクはpaired Student’st-testに基づく統計的有意性を示す。調整後P< 0.05。log2FC: log2(変化倍率)
次に、投与した代謝活性物質の血漿中濃度と他の代謝物との関係を調べた。セリン、L-カルニチン、NR、システインと最も有意に相関する血漿中代謝物195種を分析した(Additional file7: Dataset S4)。その結果、システインのみ、またはセリン、カルニチン、NRとともに有意に相関する代謝物の2つのクラスターが見つかった(図4a)。システインは、以前の臨床試験で報告されたように、他の3つの代謝活性化物質とは異なる血漿変化を示すことが観察された[38,51]。
図4 CMAと血漿代謝産物および変化した血漿タンパク質レベルとの相関
a個々のCMAの血漿レベルと最も有意に相関した10の血漿代謝産物との関連。アスタリスクはSpearman相関分析に基づく統計的有意性(調整後P< 0.05)を示す。cor.Coeff:相関係数。bCMA群とプラセボ群における84日目と0日目のlog2FCベースの有意差タンパク質を示すヒートマップ。cネットワーク解析に基づく統合マルチオミクスデータは、セリン、カルニチン、ニコチンアミド、システインを含むCMAの隣接領域とADAS-Cogスコアを表している。84日目対0日目のCMAで有意に変化した分析物のみが強調表示されている。
グローバルな代謝に対するCMAの効果
84日目と0日目で有意に(FDR<0.05)異なる血漿中代謝物を同定したところ、CMA群では132代謝物の血漿中濃度が有意に異なっていた(図3、Additional file6: Dataset S3)。各群で84日目と0日目に有意差のあった血漿中代謝物を評価したところ、CMA群ではプラセボ群に比べ、アミノ酸代謝(n= 53)、脂質代謝(n= 42)、その他の代謝経路(n= 37)に関連する代謝物が多く変化していた(図3、Additional file6: Dataset S3)。
N-アセチルアスパラギン酸(NAA)は、最も豊富な脳内代謝産物のひとつであり、その血漿中濃度の低下は脳組織の損傷と関連している。これまでの研究で、中枢神経系におけるエネルギー代謝の維持にNAAが重要であることが明らかにされている[52]。ここでは、NAAの血漿中濃度が、CMA群では0日目に対して84日目に有意に上昇していることが観察された(図3b、Additional file6: Dataset S3)。CMA群で84日目対0日目に上昇したもう1つの代謝物は、サルコシン(グリシンの誘導体)であった。サルコシンは、ニューロンにおけるさまざまな薬理学的活性を通じて認知症状を改善する効果が広く研究されている[53]。注目すべきは、キノリン酸(N-メチル-D-アスパラギン酸受容体に作用し、神経毒性障害を引き起こす内因性興奮毒素)が、CMA群でのみ84日目対0日目に有意に減少していたことである(図3b、Additional file6: Dataset S3)。
血漿中のホモシステイン濃度の増加はADの危険因子として知られており、いくつかの動物実験ではメチオニン制限の有望な効果が示唆されている[54,55]。我々の臨床試験では、S-アデノシルホモシステイン、2,3-ジヒドロキシ-5-メチルチオ-4-ペンテノエートおよびN-アセチルタウリンの血漿中濃度は、CMA群では84日目に0日目に対して有意に低下した(図3b、追加ファイル6:データセットS3)。注目すべきは、これらの代謝物の減少は、セリンおよびNRの補充と有意に相関していたことである(図4a、Additional file7: Dataset S4)。
キヌレニン経路の代謝物の血漿中濃度の増加は、ADの重症度と関連している[54]。我々の研究では、血漿中のキヌレネートおよび8-メトキシキヌレネート濃度が、CMA群では84日目に0日目に対して有意に低下していた(図3b、Additional file6: Dataset S3)。血漿中のキヌレン酸濃度の減少は、血漿中のセリン濃度と正の相関があった(Additional file7: Dataset S4)。酸化促進作用を持つキヌレン酸は、トリプトファン分解経路の産物である。好気的照射によりスーパーオキシドラジカルを生成し、シトクロムcの還元をもたらす[56]。キヌレニンの増加により、ネイチャーキラー細胞では活性酸素種経路を介した細胞死が起こり[57]、全身性の炎症では血圧が低下することが報告されている[58]。
腎機能異常とADとの関連を示す新たな証拠も出てきているが、腎臓が認知障害に及ぼす潜在的な影響についてはまだ未解明である[59]。最近の研究では、血漿中のN,N,N-トリメチル-5-アミノバレレートがリジン代謝に関与しており、尿中アルブミン排泄量上昇の指標となることが示された[60]。ここで、N,N,N-トリメチル-5-アミノバレレートの血漿中濃度は、CMA群では0日目に対して84日目に有意に低下し(図3b、Additional file6: Dataset S3)、セリンおよびNRの血漿中濃度と有意に逆相関していた。さらに、クレアチニンの血漿中濃度も、CMA群では0日目に対して84日目に有意に低下した(図3b、Additional file6: Dataset S3)。血漿クレアチニンの減少は、血漿セリン濃度と逆相関していた(Additional file7: Dataset S4)。さらに、解析の結果、84日目のCMA群では、ヒスチジン代謝に属するいくつかの代謝物のレベルが0日目に比べて低下していた。その中でもN-アセチル-1-メチルヒスチジンは慢性腎臓病と関連しており、セリン補給と有意な負の相関を示した(図3b、Additional file7: Dataset S4)。また、尿素サイクルに関連する代謝物(3-アミノ-2-ピペリドン、アルギニン、ホモアルギニン、N-α-アセチルオルニチン、オルニチン、プロヒドロキシ-プロ)の血漿中濃度は、84日目のCMA群で0日目に対して有意に低下し(図3b、Additional file6: Dataset S3)、セリンおよびNRの血漿中濃度と逆相関を示した(Additional file7: Dataset S4)。
脂質は、ADを含む神経変性疾患の病態生理において基本的な役割を担っている。細胞膜の特定の脂質種(例えば、コレステロールやスフィンゴ脂質)は、細胞膜の構造成分であり、脳機能の多くの重要な側面を制御している[61]。我々の研究では、スフィンゴミエリンと脂肪酸代謝に関連する多くの代謝産物(アシルカルニチン)の血漿中濃度は、CMA群で84日目に0日目に対して有意に上昇した(図3c、Additional file6: Dataset S3)。興味深いことに、血漿中のプレグネノロンステロイドと2R,3R-ジヒドロキシ酪酸の濃度は、84日目に0日目に対して有意に減少した(図3c、Additional file6: Dataset S3)。これらの変化は、カルニチンおよびセリンレベルと有意に正の相関があった(Additional file7: Dataset S4)。
血漿タンパク質に対するCMAの効果
血漿プロテオームプロファイリングプラットフォームProximity Extension Assayを用いて、1466種類のタンパク質マーカーの血漿中濃度を測定した。品質管理および50%以上のサンプルで欠損値のあるタンパク質を除外した後、1463個のタンパク質が分析された。CMA群とプラセボ群の来院時にレベルが有意に異なるタンパク質は、Additional file8: Dataset S5に記載されている。
その結果、CMA群では84日目と0日目で22のタンパク質が有意に(P< 0.01)異なっていた。これらのタンパク質のうち19個は有意に減少し、3個は0日目に対して84日目に有意に増加した。After filtering out the proteins based on log2FC, we found that the plasma levels of persephin (PSPN), oncostatin-M (OSM), PADI4 (protein-arginine deiminase type-4), PDGFC (platelet-derived growth factor C), SCGN (secretagogin),LTBP3 (latent-transforming growth factor beta-binding protein 3), CLEC4G (C-type lectin domain family 4 member G), Mer tyrosine kinase (MertK), WNT9A (protein Wnt-9a), isthmin-1, ASAH2 (neutral ceramidase), CES3 (carboxylesterase-3), HPGDS (hematopoietic prostaglandin D synthase)、プロニューロペプチドY、トロンボポエチン、SIGLEC6(シアル酸結合Ig様レクチン-6)、GDNF(グリア細胞由来向神経性因子)、PADI2(プロテイン-アルギニンデイミナーゼ-2型)、上皮成長因子様タンパク質7(EGFL7)が有意に発現低下した、一方、KLB(β-クロト)、BGN(ビグリカン)、CMP-N-アセチルノイラミン酸-β-ガラクトサミド-α-2,3-シアル酸転移酵素-1(ST3Gal1)は、CMA群では0日目に対して84日目に有意に発現が上昇した(図4b, Additional file8: Dataset S5)。プラセボ群では1つのタンパク質だけが有意に(P< 0.01)変化した(EGFL7、発現上昇)。
統合的マルチオミクス解析
マルチオミクスデータの統合は、健康状態と疾患状態の両方において、新たな洞察と人体のより全体的な見方を提供することができる[62]。本研究では、メタボロミクスデータとプロテオミクスデータを、詳細な臨床変数と組み合わせて統合的なマルチオミクスネットワークを作成し、同じオミクスデータタイプと異なるオミクスデータタイプの分析物間の機能的関係を理解した。iNetModels[49]で使用されている方法を用いてネットワークを作成し、このネットワークもiNetModelsに寄託した。ネットワークは2273のノードから937,282のエッジで構成されている(ネットワーク密度36.3%、Additional file9: Dataset S6)。
個々の代謝活性化因子、認知機能(ADAS-Cogスコア)、ハイライトされた2つのタンパク質(OSMとPSPN)、およびそれらの上位隣接因子間の相互作用を強調するサブネットワークを抽出した(図4c)。サブネットワークから、ADAS-Cogはカルニチン(およびその誘導体)およびニコチンアミド関連代謝物と負の相関を示し、代謝活性化因子は脂肪酸およびヒスチジン代謝と負の相関を示した。最後に、OSMとPSPNは免疫および細胞周期関連タンパク質と正の相関を示した。
その後、中心性分析を行い、ネットワークの中で最も中心的な代謝物を同定した。最も中心的な代謝物の上位20位は、アミノ酸代謝物(トリプトファン、グルタミン酸、分岐鎖アミノ酸代謝)と脂質代謝物(アンドロゲンステロイド経路)で占められていた、短期・長期記憶(カルビンディン)、脂質代謝(PLA2G10[分泌型ホスホリパーゼA2グループ10])、免疫反応(SELPLG[セレクチン-P糖タンパク質リガンド1]、CLEC4D[C型レクチンドメインファミリー4メンバーE]、ガレクチン-7)。
さらに、Leidenアルゴリズムを用いてネットワーク内のコミュニティ分析を行った。その結果、メンバー間で有意な相互作用を示す3つのモジュールを発見した。最大のクラスターであるcluster-0では、トリプトファン代謝(インドールアセテート)、脂肪酸代謝(3-ヒドロキシオクタノエート)、ステロイド代謝(11-ケトエチオコラノログルクロニド、11-β-ヒドロキシエチオコラノログルクロニド)に関連するノードが上位を占めた。さらに、同じクラスターに、ADと関連するα-アクチン-2とインスリン様成長因子結合タンパク質1という2つのトップタンパク質を発見した[63,64]。クラスター-1では、トップノードはロイシン代謝(3-ヒドロキシ-2-エチルプロピオネート)、セラミドホスファチジルエタノールアミン、カルニチン代謝産物(エルコイルカルニチン)に関連し、一方、クラスター-2の中心ノードはメチオニン代謝とアミノ糖代謝(N-アセチルグルコサミン/N-アセチルガラクトサミン)に関連していた。これらの結果は、統合的なマルチオミクスネットワーク解析が、単一のオミクス解析の結果を強化し、ADに関連する主要な分析物を同定するために使用できることを示している。さらに、異なるオミックスデータ内およびデータ間の機能的関係を解明することで、新たな知見が得られた。
各活性化因子(本研究では治療目的で使用)と臨床、代謝、プロテオミクスパラメータとの相関を評価したところ、セリン、カルニチン、システイン、ニコチンアミド濃度と、ADの病態に関連する肝機能、全血球数(CBC)、糖化ヘモグロビン(HbA1c)などの末梢血パラメータの改善との有意な相関が確認された。したがって、ADAS-Cogスコアの改善は血清セリンおよびカルニチンの変化とも関連しており、よく知られている認知促進作用やエネルギー増強作用とよく一致していた。同様の結果は、メタボロームおよびプロテオームデータでも観察された。活性化因子の大部分は、ADにおける変性過程の遅れに関連して、代謝物やタンパク質の改善(増加または減少)と有意な相関を示した。OSMとPSPNという2つのタンパク質は、他の有益なタンパク質代謝物と最も強く関連していたが、スペルミジンやヒポタウリンといったいくつかのアミノ酸の重要な変化とも関連しており、ADで報告されたエネルギー不足を補うために、タンパク質代謝からアミノ酸代謝への代謝シフトが示唆された。
海馬体積と皮質厚に対するCMAの効果
MRI群のベースライン人口統計学的特徴と改善した臨床パラメータは、全患者コホートと有意に一致していた(追加ファイル1:データセットS1、追加ファイル4:データセットS2)。皮質厚の縦断的解析によると、活動群はプラセボ群と比較して、両側後頭部、両側吻側中前頭部、左下頭頂部、左傍中心部で統計的に有意な変化を示した(図5a)。さらに、図5bに示す解剖学的下位海馬領域の評価も行った。各治療群における治療前後の差を比較した結果、左海馬全体の平均体積(海馬体と海馬頭の平均体積で表される)と海馬体の左分子層の体積はCMA治療後も維持されたが、プラセボ群では有意に減少した(P<0.05、図5c、Additional file10: Dataset S7)。その他の解剖学的下位海馬領域(左CA1体、左海馬体全体)は、薬物群とプラセボ群で有意差はなかったが、統計学的に有意なレベルに近かった(それぞれP= 0.055、P= 0.052、Additional file10: Dataset S7)。
図5 構造的磁気共鳴画像解析
aFreeSurferのQdecアプリケーションのイラストに基づく、下頭頂、外側後頭、中前頭および傍中心皮質領域における研究グループの皮質厚の増加(赤-黄色)(P< 0.05)。b矢状面(上)、軸方向(中)、および冠状面(下)に表示された海馬亜野のセグメンテーションマップ。cFreeSurferのQdecアプリケーションに基づく海馬亜野の測定では、左平均海馬(左上)および左海馬分子層(左下)において、研究グループで体積が増加した(P< 0.05)。左CA1体(右上)を含むその他の海馬サブ解剖学的領域iii)およびiv)左海馬体全体(右下)は有意ではなかったが、統計学的に有意なレベル(P> 0.05)に近かった。
考察
その結果、CMAの84日間の経口投与は、ADAS-Cogスコアに基づくアルツハイマー病患者の認知機能にかなりの効果があることが示唆された。ADAS-Cogスコアが高い患者の認知機能はCMA群で改善したが、プラセボ群では有意差はなかった。また、重度および軽度の患者においても有益な効果が認められた。AD患者の認知機能は、84日後にCMA群で29%改善したのに対し、プラセボ群では14%しか改善せず、他のAD臨床試験でみられるプラセボ効果と一致していた[50,65,66]。認知機能の改善は、プラセボ群では皮質の厚さに差はなかったが体積の有意な減少がみられたのに対し、CMA群では皮質の厚さの肯定的な変化と海馬亜野の体積の維持によって支持された。重症AD患者には、緩和的支援を除いて現在の治療法がないため、重症ADに有益な効果がある可能性があるというわれわれの発見は特に価値がある。臨床的重症度とは別に、さまざまな臨床変数が治療効果に関連していることが観察された。例えば、ALTが低く、代謝負荷(すなわち、HbA1cとインスリンレベルの上昇)が高い患者やCBC値が低下している患者は、CMA治療によく反応した。
CMAの経口投与の効果は、マルチオミクス分析プラットフォームを用いた患者の血漿中のタンパク質と代謝物の包括的分析によって立証された。この臨床結果は、ミトコンドリア機能障害の明らかな証拠を示した600人以上のアルツハイマー病患者のゲノムスケールの代謝モデリングと一致していた[40]。また、CMAを経口投与した動物でADに関連する組織学的パラメータの改善を示した動物モデルの結果とも一致している[67]。したがって、本研究は、AD患者の代謝性変化を改善するのに役立つ可能性のある有望な治療法を示唆している。
AD発症における海馬と前頭頭頂部の変性の役割を考慮すると、代謝刺激後に海馬亜野の体積と皮質の厚さが改善するという我々の神経画像観察は驚くべきことではなかった。ここでは、CMA群では海馬体積と前頭葉および頭頂葉皮質の厚さが有意に改善したのに対し、プラセボ群ではプラスの効果は観察されなかった。この結果は、ADの主要な認知脳領域におけるCMA群の治療効果を示唆するものであった。
健康な被験者を対象とした数多くの研究から、代謝と認知的な脳ネットワーク構成が強く関連していることが示唆されている[68,69]。このことは、脳にとって最も代謝負荷の高い高次認知タスクに特に当てはまり、「燃え尽き」によって、脳は神経細胞の代謝機能障害によって特徴づけられる神経変性や加齢に関連した変化を起こしやすくなる[70]。代謝補因子は、3段階の戦略によってミトコンドリア代謝を改善する:(1)L-カルニチンはミトコンドリア膜を通過する脂肪酸の輸送を促進し、(2)NAD+前駆体であるニコチンアミドリボシドはミトコンドリアにおける脂肪酸のβ酸化を促進し、(3)セリンやNACを含むGSH前駆体は、ミトコンドリアにおける脂肪酸のβ酸化の増加によって生じるフリーラジカルを介した酸化ストレスから肝臓を保護するために必要なGSHを形成する。したがって、CMAの認知促進効果に関する我々の結果は、認知ネットワークの代謝負荷と、そのような代謝介入に対する反応性に関連している可能性がある。
ADの病態においてミトコンドリアの著しい機能障害が起こっていることを示すデータが増えている[71]。我々の以前の研究では、CMA投与がミトコンドリアにおける脂肪酸酸化を効果的に促進し、de novo GSH合成によって酸化ストレスを緩和することを報告した[34–39]。しかし、これらの有益な効果がどのように構造的異常と認知的異常の両方に寄与しているかは不明であり、さらなる評価が必要である。現在の文献に基づけば、NAD+レベルを高めることは、認知機能の低下に関与する脳のエネルギー代謝と酸化ストレスの回復に役立つ可能性がある。動物モデルを用いた研究では、NRやNMNなどのNAD+前駆体が神経炎症を正常化し、学習や運動機能を改善し、マイトファジーを誘導し、神経学的損傷から保護することが示されている[72–77]。これと並行して、高齢動物の酸化還元ホメオスタシスを維持することで、NMDA受容体の活性化を維持できる可能性があり、認知機能の低下を防ぐことが示されている[78]。最近の研究では、アストロサイトの解糖がシナプスのNMDA受容体を介して認知機能を制御していることが報告され、AD患者に対する利用しやすい治療法としてL-セリンの経口投与が示唆された。同様に、NAC療法はPD動物モデルの海馬においてNMDA受容体の活性化を回復し、酸化傷害を軽減することが示されている[80]。CMA投与による酸化ストレスの除去は、AD関連病態に伴う脳機能低下に対する合理的な生物学的説明を示唆しているが、さらなる機序の研究が必要である。
本研究のプロテオーム解析により、ADの病態形成に重要な役割を果たすいくつかの重要なタンパク質のレベルが著しく変化していることが明らかになった。例えば、MertK[81,82]、EGFR[83,84]、オンコスタチン[85–89]、PAD4[90,91]、LTGF[92–96]、および神経炎症、アミロイド産生、アポトーシスの強力な誘導因子として知られるTPO[97]のレベルが有意に低下していた。対照的に、Klotho[98,99]やST3Gal1[100]のような神経保護作用や認知促進作用を持つタンパク質は、CMA投与後に増加した。さらに興味深いことに、分析したタンパク質のほとんどは、最近のヒトAD研究[92-96,101– 107]でも有意に変化していることが示された。KlothoBレベルもCMA処理後に有意に変化しており、補因子および向神経性因子としての神経保護的役割と一致していた。最近の研究では、KlothoBは脳の一部の領域に発現し、学習と記憶に関与するF2F1を通じて、間接的にグルコースとエネルギー代謝を調節することが示されている[106]。さらに、γ-アミノ酪酸(GABA)シグナルは、軽度認知障害(MCI)の進行におけるジヒドロキシ酪酸の増加の有害な影響を媒介する上で重要な役割を果たすことも示されている[108]。興味深いことに、メタボローム解析の結果、治療後にジヒドロキシ酪酸レベルが低下することがわかった。DHBAの代謝的生成に関与する正確な経路はまだ明らかではないが、ジヒドロキシ酪酸レベルは、クレブスサイクルの機能低下による二次的な細胞ストレスの増加に対する代償反応であり、ADにおける代替エネルギー産生経路を作り出しているのではないかという仮説が立てられている[108]。これは、CMAのエネルギー調節効果を示す間接的な証拠である。この研究では 2000を超える脳と400近くの脳脊髄液サンプルを定量的プロテオミクスで評価し、ADにおける全体的な認知機能および病理学的変化と強い相関を示す最も影響を受ける6つの代謝経路の1つとしてミトコンドリア代謝を同定した[109]。したがって、ミトコンドリアの生体エネルギー機構と神経炎症過程に関連するタンパク質が有意に改善されたことは、CMA治療後の認知スコアの上昇と海馬体積の維持と関連していることが観察された。
メタボロミクスのデータは、CMA治療によって期待される生物学的結果と一致していた。血漿中ニコチンアミドおよび関連代謝物のレベルが上昇したことから、NRがミトコンドリアの脂肪酸酸化に十分な基質を提供していることが示唆された。細胞内代謝産物としての役割に加えて、NAD+はDNA修復タンパク質ポリ(ADPリボース)ポリメラーゼ1(PARP1)の必須補因子として機能する[110]。PARP1の過剰活性化とNAD+の減少は、すでにアルツハイマー病患者の脳で確認されている[111,112]。血漿中のセリンレベルも上昇しており、CMA治療がADに伴うセリン欠乏を改善することを示唆している。例えば、最近の研究では、グルコース代謝低下によるアデノシン三リン酸(ATP)減少作用が、経口セリン補給によって回復することが示され、ADに対する即効性のある治療法として経口セリンを使用できる可能性が示唆された[79]。正確な作用機序はシステインにも当てはまる。GSH前駆体として、システインは抗酸化剤および抗炎症剤として作用し、ミトコンドリアのホメオスタシスと、学習と記憶に関与するグルタミン酸などの主要な神経伝達物質系を維持する[113,114]。したがって、NACはADの治療薬として試験され、代替薬としての可能性が示されている[115]。さらに重要なことは、血漿中のカルニチン濃度が有意に上昇したことからわかるように、脂肪酸酸化とカルニチン代謝が有意に促進されたことである。これらの所見は、AD患者では重度のミトコンドリア機能障害と関連して、重度のカルニチン代謝障害が頻繁に起こることを示す最近のヒトのデータとよく一致している[116,117]。Cristofanoらは、正常な状態からADに移行する個体において、カルニチンの血清濃度が漸減することを示し、カルニチンの血清濃度が低下するとADになりやすいことを示唆した[118]。この仮説を裏付けるように、ヒトの臨床研究では、MCIおよびADにおけるカルニチンの認知促進効果が実証されている[119–121]。
さらに、キヌレネート、キヌレニン、トリプトファンベタインを含むトリプトファン代謝物のレベルは、CMA投与後に有意に減少した。これらの代謝物レベルの増加は、高い酸化負荷による神経変性の重症度上昇や臨床的認知障害、神経原線維変化(NFT)の形成と関連している[122,123]。例えば、最近のデータでは、β-アミロイド1-42とトリプトファン・キヌレニン経路の酵素活性化との間に相乗的な関係があることが示され、その結果、酸化ストレスが増大し、これがNFTの形成や老人斑の発生に関連している可能性がある[124]。また、最近の研究で、トリプトファン-2,3-ジオキシゲナーゼがアルツハイマー病患者の脳で高発現し、死後脳の海馬でキノリン酸、NFT、アミロイド沈着と共局在していることが明らかになった[125]。
また、NAA、サルコシン、メチオニン、システイン、S-アデノシルメチオニンが有意に増加し、認知機能に重要な役割を果たすヒスチジン、トリプトファンキノレート、尿素サイクルの代謝物が減少していることが観察された。例えば、NAAの増加は、特にグルコース代謝がダウンレギュレーションされている場合、神経変性過程における細胞間代謝産物輸送のための追加エネルギー源となる可能性がある[52]。同様に、酸化的損傷とグルコース代謝障害が重要な役割を果たす疾患である統合失調症患者において以前に示されたように、サルコシンレベルの増加は認知機能を高める可能性がある[126]。さらに、ヒスチジン代謝の低下や、ホモシステインやS-アデノシルホモシステインなどの他の低下マーカーは、適切に制御されると認知機能の老化を遅らせることが示されている[127]。例えば、血漿中のホモシステイン濃度の増加はADの危険因子として知られているが、低ロイシン・低アルギニン食は認知機能に有益な効果をもたらす[128]。
興味深いことに、CMAは尿酸および関連代謝物のレベルを急速に低下させた。尿酸は、直接またはNLRP3インフラムソームを活性化することによって炎症を刺激する[129]。尿酸の減少が認知障害の退縮にどの程度寄与しているかは不明であるが、その効果は代謝恒常性の改善と関連している可能性がある。例えば、最近の臨床研究では、AD患者において尿素代謝が増加していることが示されている[130]。したがって、タウリンおよび尿素代謝産物レベルの低下は、認知症リスクの低下と関連している[131]。
現在までに、ADにおける代謝産物や代謝経路のグローバルな変化を明らかにした研究はいくつかある[25,132,133]。その中で、脂質代謝の変化もADの病態生理に重要な役割を果たしていることを強調している研究もある[134]。脂質代謝に関しては、AD患者においていくつかの化合物のレベルに有意な差が観察されている。AD患者の脂質を調べた横断的研究[135,136] では、いくつかの傾向が異なっていたにもかかわらず、スフィンゴ脂質、スフィンゴミエリン[137,138]、アシルカルニチン[139] およびホスファチジルコリン[140-142]の血漿中濃度は、AD患者では、疾患の前臨床段階においてさえ、統計的に低い濃度を示した[27]。さらに、AD患者を対象とした研究では、さまざまな脂質代謝産物、タウやアミロイドの病態、脳の萎縮、認知機能の低下との間に有意な相関が観察された[27]。前頭皮質の代謝物に関する剖検研究では、グリセロリン脂質代謝の障害が、ADで変化する6つの中枢代謝経路に関与していることが示された[143]。手短に言えば、スフィンゴミエリン、カルニチン、カルニチン関連副生成物など、AD患者で減少することが以前に報告されていた脂質代謝物のレベルが、CMA治療後に有意に増加することが観察された。
コレステロール代謝物およびジカルボン酸(DCAs)に関するADの臨床データは不十分であったが、CMA投与後にこれらの代謝物レベルが有意に低下することが観察された[144]。本研究で減少が認められたプレグネノロンの代謝産物であるプレグナンジオールおよびβ-またはω酸化の最終産物であるDCAのレベルは、AD患者の尿中で低下することが以前に報告されていた[145,146]。胆汁酸の神経毒性的役割とDCAの酸化特性を考慮すると、本研究で胆汁酸代謝産物およびDCA生成物のレベルが低下したことは驚くべきことではない。同様に、アロプレグナノロンもGABAシグナルを介して認知機能に有害な影響を及ぼすことがすでに報告されている[147]。また、MCIやADでは胆汁酸レベルの上昇が報告されている。対照的に、胆汁酸は前臨床期においてシステイン異化経路を強く阻害し、遊離システインプールの枯渇とGSH濃度の低下をもたらす[148]。
この研究には限界がある。研究の限界の1つは、患者をADAS-Cogスコアの低い群と高い群に分類した後のサンプルサイズが小さかったことである。したがって、脳の機能的および構造的変化に対するCMAの効果を明らかにするためには、よりサンプル数の多い臨床試験が必要である。さらに、今後の研究では、CMA投与後のミトコンドリア機能とβアミロイド1-42、総タウ、リン酸化タウ濃度の変化を分析すべきである。この研究のもう一つの限界は、ApoEの遺伝子型判定が行われなかったことである。このような評価はアルツハイマー病患者のリスク変異の検出に有益であろう。
結論
今回の第2相臨床試験では、CMAの経口投与がアルツハイマー病患者の代謝変化を改善することが示唆され、CMAは安全で忍容性が高く、安全性に関する重大な懸念は認められなかった。AD患者における代謝活性化剤の安全性プロファイルは、われわれが以前に行った1日キャリブレーション試験および第2相および第3相臨床試験の結果と一致している。重要なことは、CMAが、特に重度のアルツハイマー病患者において、認知機能および代謝異常のマーカーにプラスの効果を示すことが示されたことである。なお、われわれの結果は、無作為化二重盲検プラセボ対照第3相臨床試験で確認されるまでは慎重に解釈されるべきである。