Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8120436/
2021年4月28日オンライン公開
要旨
骨組織には、古典的な役割(支持・保護、造血、カルシウムの貯蔵、リン酸の貯蔵)のほかに、複数の役割があり、臓器としての性格が強くなってきている。特に内分泌機能、より一般的には様々な刺激を感知・統合し、他の組織にシグナルを送る機能は、ホメオスタシスにおける骨の重要性を浮き彫りにしている。
骨は高度に神経化されており、すべての神経系分岐を受け入れている。骨細胞は、代謝活性や機械的刺激に対する感受性に直接影響を与える神経伝達物質、神経ペプチド、神経ホルモンのほとんどに感受性がある。実際、骨は機械的刺激に敏感な主要な器官である。
メカノセンシティブな常在細胞、特に骨細胞のおかげで、機械的刺激は骨形成細胞(骨芽細胞)と骨吸収細胞(破骨細胞)に代謝的反応を引き起こし、環境の変化に対する患部骨セグメントの適応を可能にしている。骨細胞は、刺激を受けると、いくつかのメディエーター(オステオカイン)を発現・分泌し、あるいは包接マトリックスから遊離し、遠くの標的に対して反応を誘導する。
これらのメディエーター(オステオカルシン、リポカリン2、スクレロスチン、ディックコップ関連タンパク質1(Dkk1)、線維芽細胞増殖因子23など)のほとんどは血液脳関門を通過できるため、脳がターゲットとなる。その他のものについては、脳での役割が仮定されているが、まだ実証されていない。
運動は、これらのオステオカインの放出や循環レベルを効果的に変化させることから、運動による脳機能への有益な効果の一部は、このような骨-脳間のコミュニケーションに関連しているのではないかという仮説が立てられてきた。この仮説には、アルツハイマー病やパーキンソン病などの神経変性疾患の治療を、運動がうまくサポートするのではないかという、興味深い臨床的ヒントが隠されている。
キーワード:オステオカイン、運動、生体力学的刺激、メカノセンシング、血液脳関門、神経変性疾患
はじめに
ここ数年、骨組織が生体の基本的な機能を解決していることから、ホメオスタシスにおける骨組織の役割が浮かび上がってきている。実際、生体に力学的支持と保護を与え、造血、カルシウム貯蔵、イオン恒常性、リン酸代謝における重要な役割を解決するだけでなく、さらなる機能が報告されている(Calviら、2003;Bergwitz and Juppner、2010)。
メカノセンシティブな器官である骨は、バイオメカニクスや身体と環境の関係、そして機能的な感覚や運動行動を確立するための神経系コミュニケーションにおいて、ダイナミックな役割を担っている。実際、骨と神経系は双方向の接続により互いにコミュニケーションをとっている。
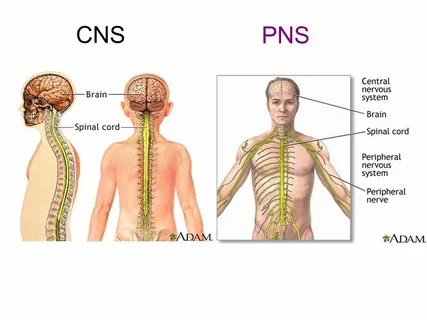
このように骨は、末梢神経系(PNS)を介して間接的に、あるいは血液脳関門(BBB)を通過して脳レベルに作用する分子を放出することによって、末梢臓器のみならず脳ともコミュニケーションできる複合的な周辺要素であることが明らかにされている。
注目すべきは、最近の知見で、骨は内分泌組織としても働き、内外の刺激に動的に反応することが示されていることである(Cappariello et al.、2016)。骨は他の器官と活発にコミュニケーションをとり、特定の環境に身体を適応させることを目的とした回路の基本的なキープレーヤーとなる。
さらに、骨はその内分泌機能を通じて、全身の恒常性、エネルギー代謝、少なくとも男性では生殖機能を調節し、最近では認知機能も調節している(武田ら、2002;Yadavら、2009;Ouryら、2011、2013)。
* *
本総説では、骨と神経系とのコミュニケーションの重要性、特に力学的刺激時のこの関係の寄与に焦点を当てたい。まず、メカノセンサーとして機能する骨要素とその刺激に対する反応について述べる。さらに、神経系と骨がどのように結びつき、コミュニケーションをとりながら、受ける生体力学的刺激に応じて骨のホメオスタシスや骨リモデリングを調節しているのかを説明する。
まず、脳と骨とのコミュニケーションの仕組みについて説明する。最後に、現状ではほとんど知られていないが、この軸に関与する可能性のある骨由来の分子に関する新しい知見に基づき、骨-脳間のコミュニケーションに焦点を当てる。
* *
骨と脳の間の双方向コミュニケーションシステムに関する知識を深めることは、生体力学的刺激に対する骨の反応や適応のメカニズムに関する研究に取り組む上で、基本的な興味となる。また、この回路が障害されるような病態(骨粗鬆症、骨脆弱性など)に対して、適応反応の回復や改善を目的とした適切な治療介入の新しいターゲットの探索にも役立つが神経系に影響を及ぼす状態の改善にも役立つ可能性がある。したがって、我々の最終目標は、骨粗鬆症、骨の脆弱性、骨折のリスクの増加など、骨の欠陥によって特徴づけられる可能性のある神経学的病態の治療標的として、骨と骨が放出する分子を引き出すことだ。
骨の生体力学的刺激とメカノセンシング
骨への生体力学的刺激は、骨のホメオスタシスを制御し、常在細胞を適応、維持、修復に導くだけでなく、体全体を環境の変化に適応させるための基本的なものである。* *
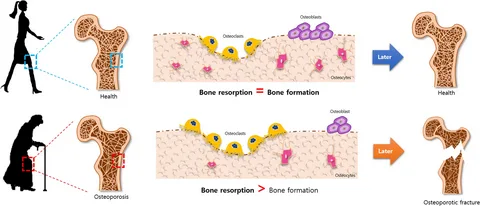
骨は静的な要素ではなく、静的あるいは単純な動きから身体活動が生み出す多方向の応力まで、受ける様々な刺激に応じて細胞成分や構造全体をリモデルできることがよく知られている(Duncan and Turner, 1995)。骨の恒常性維持の基本である骨吸収と骨形成の均衡を保つために、細かく制御されたプロセスがあり、これを骨リモデリングと呼んでいる。
このプロセスは、破骨細胞と骨芽細胞によって媒介され、それぞれ骨吸収と細胞外マトリックス(ECM)の沈着と骨形成を担う(Parfitt, 2000; Florencio-Silva et al., 2015; Owen and Reilly, 2018)。
注目すべきは、破骨細胞は単球系の前駆細胞に由来し、その分化過程は主に免疫細胞以外のストローマ細胞や骨芽細胞が発現・放出するRANKリガンド(RANKL)による核因子κB(RANK)の活性化により刺激される(Suda et al, 1999)点である。
逆に、骨芽細胞や骨細胞に発現するRANKLのデコイ受容体であるオステオプロテジェリン(OPG)は、RANKL-RANK結合を阻害し、破骨細胞の分化を抑制し、結果として骨吸収を抑制する(Simonet et al.、1997年)。
* *
破骨細胞や骨芽細胞の活動、ひいては骨リモデリング全体は、機械的刺激(負荷や運動)だけでなく、内分泌や副次的シグナルによっても制御される(Davidら、2007; Senら、2011)。この文脈では、身体の静止や空間内の移動に対応する外部刺激が、メカノセンサーと呼ばれる骨要素の生体力学的刺激に収束する。
このメカノセンサーは、環境中の生物物理学的要因を感知し、反応することができるものである。実際、骨格は、機能的要求(例えば、負荷の強度および/または方向の変化)に対応するために自己改造する必要がある(Thompsonら、2012年)。慢性的に激しい身体活動(=負荷)を行うと、骨は大きく強くなり、逆に負荷の強度を下げる(=ベッドレスト、固定)と、骨吸収が促進され、骨強度や骨量の低下、骨折リスクの上昇を招く。
* *
骨は、少なくとも4つの要素がメカノセンシティブな器官であり、互いに協力して骨のモデリングとリモデリングを制御していると考えられている。これらの要素は、骨組織に常駐する主な細胞種、すなわち、骨細胞、骨芽細胞、破骨細胞、骨形成細胞(間葉系幹細胞、MSC)に対応している。
機械的刺激の重要な結果として、破骨細胞の機能と、骨形成細胞によるRANKLの発現を介したその動員を間接的に制御することが挙げられる(Yasuda et al.、1998)。機械的活性環境である骨髄や骨膜に存在する骨芽細胞や前骨芽細胞は、その増殖、分化、コミットメントの制御を通じて機械的刺激に応答し、その結果、骨芽細胞形成を調節する(Davidら、2007;Senら、2011)。
さらに、骨細胞は骨における主要な機械応答性要素と考えられているが、骨芽細胞も機械刺激に応答することができることが実証されている(Xiao and Quarles, 2015)。したがって、機械的刺激は、これらの細胞のそれぞれが、他のアクターの共同制御をもたらす経路を調節することによって、機械的刺激に応答することができるので、直接的および間接的にこれらすべての細胞を制御する。
骨メカノセンサーの主要な要素としての骨細胞
骨細胞は、骨組織に存在する最も豊富な細胞であり、機械的刺激に応答し、メカノセンシングとメカノトランスダクションを制御する主要な細胞型と考えられている(Thompson et al.) さらに、骨細胞は、破骨細胞および骨芽細胞活性の調節を通じて骨のホメオスタシスを制御し、骨だけでなく他の組織および器官の細胞の機能に影響を与えるホルモン様メディエーターを分泌することによって内分泌要素として機能する(Chenら, 2015; Robling and Bonewald, 2020)、他の二つの重要な役割を解決する。
* *
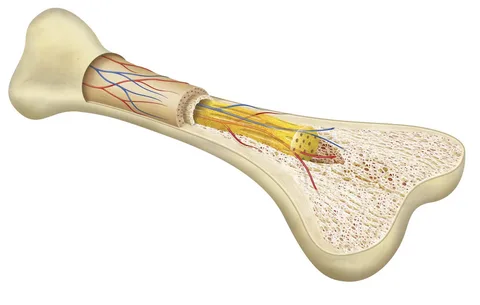
これらの機能は、他の骨細胞との直接接触や、間質液、ひいては血液との直接接続を可能にするその特異な形態によって促進される。実際、これらの細胞は、骨のミネラル化したECMに埋め込まれた星形の細胞で、ラクーノ・キャナリキュラーシステム(LCS)内に発達した延長により、各骨細胞は他のいくつかの骨細胞、骨芽細胞、破骨細胞、さらには骨髄や血管などの複雑な構造物と連絡を取り合っている。
さらに、LCSは間質液で満たされており、血漿と平衡状態にある骨細胞の本体と延長を取り囲み、骨細胞を遠位器官からもたらされる血液因子にさらしている。LCS内の流体移動を支配する力学のおかげで、骨細胞は主にせん断応力によって刺激され、流体によって運ばれる可溶性メディエーターの異なる濃度を感知する(Bonewald, 2017)。
骨細胞はこれらの入力を統合し、他の骨細胞の適切な反応を調整する化学シグナルを生成する。機械的刺激の感知は、骨芽細胞および破骨細胞の機能の調節につながり、それによって骨形成および骨吸収に影響を与える。骨細胞は、細胞骨格、樹状突起、インテグリンベース焦点接着、コネキシンベース細胞間結合、一次繊毛、イオンチャンネル、ECMなどの複数の機械感受性構造のおかげで機械刺激を感知することができる(Dallasら、2013;Qinら、2020;RoblingとBonewald、2020)。
* *
メカノトランスダクションの間、骨細胞では、最初に起こる事象は細胞内カルシウムの増加であり、それは外部コンパートメントからだけでなく、小胞体(ER)のものなどの内部貯蔵からも派生する(Lewisら、2017年)。この最初のイベントの後、いくつかの経路が活性化され、骨のホメオスタシスの調節に介入する。
* *
Wnt/β-Catenin 機械的刺激は、正規のWnt経路を活性化し、負荷時の骨形成の骨細胞制御に影響を与える(Galliら、2012年;Holguinら、2016年)。通常、負荷がかかっていない状態では、骨細胞はWnt経路の阻害剤、すなわちスクレロスチンやDickkopf関連タンパク質1(Dkk1)を分泌し、破骨細胞形成を促進させる。
その代わりに、負荷下では、スクレロスチンとDkk1の骨細胞発現が抑制され、その結果、Wntリガンドはこの経路を活性化することができ、成熟骨芽細胞では、遅発性分化マーカーのオステオポンチン(OPN)の発現によって示される骨芽細胞形成および骨芽細胞移動の直接的刺激、ならびにOPGの放出を通じて破骨細胞形成の阻害につながる(Galea et al, 2017)。
一方では、Wntによって誘導されたOPGがRANKL-RANK相互作用を阻害し、破骨細胞の分化を抑制する一方で、OPNは機械的に刺激された環境での骨形成に積極的に関与する骨芽細胞形成の活性化因子であるので骨吸収を防ぐ(Moriobu et al.、2003年)。
* *
フォーカルアドヒージョン Focal Adhesions (FA) は、ECM と細胞内のアクチン細胞骨格をダイナミックにつなぐタンパク質のネットワークである。そのため、細胞外液の動きは、ECMに固定されたこれらの膜タンパク質を通して、細胞内に伝達される(Chen et al.) インテグリンとアドヘソームタンパク質は、骨細胞において、メカノセンサーの反応につながるフォーカルアドヒージョンにおいて協力する主要な要素である。これらのタンパク質複合体は、骨細胞における重要なメカノセンサーであり、骨格の発達だけでなく、骨のメカノバイオロジーも制御している(Salterら、2001年)。
* *
アポトーシスと老化 適切な力学的刺激は、骨細胞のアポトーシスを防ぐ。機械的刺激は、確かに骨細胞の生存を助けるErkの活性化を促進するが、負荷が高すぎると損傷を誘発し、ひいては骨細胞のアポトーシスを促進する(Plotkinら, 2005; Cardosoら, 2009)。したがって、適切な負荷(強度および時間)だけが、骨細胞の老化を防ぎ、その生存率を向上させる。
* *
Sclerostin 上述のように、Wnt-βカテニンシグナル伝達のアンタゴニストであり、骨吸収を促進し、骨形成を抑制する(Li et al.、2005)。長期のベッドレストや固定化中の被験者の循環で高いことが確認されている(Spatzら、2015)。したがって、適切なメカノスティミュレーション、その結果、正しい運動は、スクレロスチンの循環レベルをダウンレギュレートし、それによって骨吸収プロセスを抑制する可能性がある。
* *
YAP/TAZ これらのタンパク質は、異なる種類の細胞において、メカノセンサーおよびメカノトランスデューサーとして作用する2つの癌原遺伝子である(Dupont et al.) 骨細胞では、これらのタンパク質は、F-アクチンと連結したFAと膜の機械的刺激後に活性化されたピエゾイオンチャネルの両方によって伝達される機械的刺激を受けて核に転移している(Li et al.、2019)。
この転座は、YAP/TAZの核転座を決定する正確なメカニズムが十分に定義されていないとしても、骨形成と骨の力学的特性の維持を刺激するいくつかの経路を活性化する(Kegelmanら、2018、2020)。
* *
図1に、骨細胞におけるメカノセンシングとメカノセンシング経路の模式図を表す。
図1 骨細胞におけるメカノセンシングの模式図
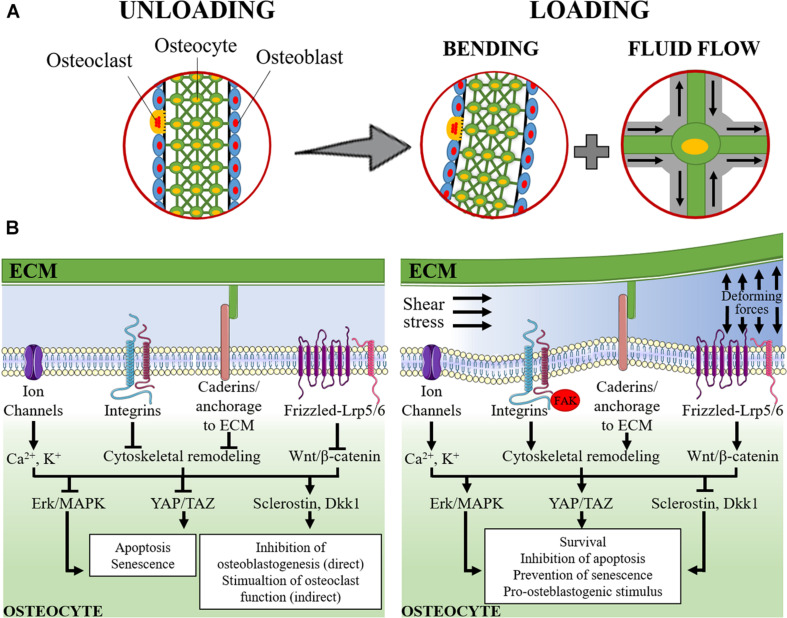
(A)骨基質内で隣接する骨細胞と接触する骨細胞(緑色の細胞)と、骨セグメントの表面にある骨芽細胞(水色の細胞)と破骨細胞(黄色の細胞)で、ラクノ・カニクラシステムを模式的にモデル化した。
左側は休息状態(アンローディング)。一方、ラクーノ・カナル系では、間質液が再分配され、その流れによって、骨細胞がせん断応力と細胞外圧の変化にさらされる。(B)無負荷時(左)と負荷時(右)に活性化されるシグナル伝達経路を模式的に示している。
除荷時には、アポトーシスおよび老化促進経路が活性化され(その結果、Erk/MAPKおよびYAP/TAZが阻害される)、スクレロスチンおよびDickkopf関連タンパク質1(Dkk1)の誘導が起こる。これらのメディエーターは細胞間液に放出され、骨芽細胞や前骨芽細胞に到達して抗骨芽細胞増殖作用を発揮し、間接的に破骨細胞の機能を促進させる。
荷重がかかると、加わる力と管内液のせん断応力により、骨細胞の細胞膜と細胞外マトリックス(ECM)が変形する。その結果、(1)電解質恒常性(Ca2+とK+)の乱れ、(2)カドヘリンとインテグリンを介したシグナル伝達とそれに関連するFAK(focal adhesion kinase)経路の活性化、(3)Wnt/βカテニンシグナルの活性化、が引き起こされる。
この下流シグナルは、Erk/MAPKおよびYAP/TAZの活性化を決定し、スクレロスチンおよびDkk1の発現抑制とともに、骨細胞の生存刺激、アポトーシス抑制、老化防止をもたらし、ひいては骨芽細胞形成および骨芽細胞機能の支援につながるものと考えられる
脳と骨の双方向のつながり
本総説の前半では、骨で起こる複雑なメカノセンシング戦略について簡単に説明し、生体力学的刺激に積極的に反応し、その結果、身体が環境の変化に適応するために、この器官がいかにダイナミックであるかを説明した。さらに、骨のメカノセンシングの複雑さについて、神経系との関連性を強調しながら、より深く掘り下げていく。
実際、骨液の動き、骨格筋の牽引、地面や衝撃の反応から受ける力学的刺激に応じて、骨細胞レベルで起こる骨代謝、恒常性、リモデリングの直接的な制御以外に、骨の反応と代謝を制御するもう一つの重要なメカニズムとして、神経系が関与していることが挙げられる。
* *
骨は、直接的にはPNSにより、間接的には中枢神経系(CNS)により制御される。しかし、最近、骨と脳の間の強い双方向の相互作用が出現し、それは骨脳軸と定義することができる:脳が骨を制御するだけでなく(求心性経路)、骨は脳で作用することができ、実際に脳で発見されている分子、すなわちオステオカインの放出を通じて脳に伝えることができる(Brazillら、2019;Millerら、2019)。
可溶性メディエーターに加え、臓器間クロストークの他のルートも存在する。興味深い、そして研究が進んでいる経路は、細胞外小胞(EV)とその荷物に代表される。EVsは細胞由来の膜小胞で、大きさ、生合成、膜タンパク質プロファイルが異なる(すなわち、エクソソーム、マイクロベシクル(MVs)、アポトーシス体など)。
エクソソームとMVは、パラクラインおよび内分泌の細胞間コミュニケーションに関与している。それらは、源となる細胞から活発に放出され、細胞質から選別された特定の成分を選択的に搭載し、小胞の内容が生物学的反応を誘発する標的細胞に到達する。
EVは、含まれる情報の標的細胞への直接的な伝達を媒介し、EVを介した情報伝達は、いくつかの疾患に関与している(Faraldi et al.) 脳と骨の間のEVを介したクロストークについては証拠があるが、この分野はまだ十分に描かれる必要がある。
* *
ここでは、まず、神経系が骨とどのようにコミュニケーションしているのか、そのメカニズムについて説明し、次に、より革新的な骨-脳間コミュニケーションについて説明する。
脳と骨のコミュニケーション
末梢神経系による骨の直接制御 骨格筋の神経支配
自律神経系は、生体の恒常性維持を促す末梢機能の調節や、生体力学的刺激を含む様々なストレスに対する適応反応を開始することが知られている。副交感神経は「休息と消化」反応を、交感神経は「闘争と逃走」反応を司り、拮抗する2つのシステムで作用する。
* *
副交感神経はムスカリン受容体とニコチン受容体を活性化する神経伝達物質であるアセチルコリン(ACh)を放出することで作用し、交感神経はシナプス前末端とシナプス後末にそれぞれ発現するα-、β-アドレナリン受容体(α-AR、β-AR)を介して神経伝達物質であるノルエピネフリン(NE)を放出することが特徴的である。
* *
近年、新しい技術の開発により、骨は交感神経と感覚神経の両方から高度な神経支配を受けていることが明らかになり、骨がPNSと物理的に関連していることが示された(Machら、2002年)。興味深いことに、組織学的解析では、骨形成活性の高い部位に自律神経枝に属する神経が高密度で存在することが示された。
さらに、免疫細胞化学の実験により、骨細胞上に神経ペプチドの受容体が存在することが証明されることに成功した(Elefteriou, 2005)。最後に、脳と骨のつながりの重要性は、逆行性トランスシナプスシグナルを用いて大腿骨髄とCNSの間に神経路を同定したことにより、さらに裏付けられている(Denesら、2005年)。
* *
骨の副交感神経支配 ニコチン性アセチルコリン受容体(nAChR)サブユニットは、破骨細胞、分化および成熟骨芽細胞によって発現される(Mandlら、2016年)。さらに、ムスカリン性AChRタイプM1、M2、M4の転写物が未熟骨芽細胞および分化した骨芽細胞で見出されている(Sato et al.) また、マウス骨細胞様細胞であるMLO-Y4では、両タイプのAChRの転写が検出され、そのレベルはAChによって調節されているが、これらの細胞でAChによって活性化される正確な経路はまだ知られていない(Ma et al.、2014)。
AChRsの他に、骨芽細胞はAChを合成する機械を発現しているが、この存在の機能的役割はまだ不明である(En-Nosseら、2009)。骨芽細胞、骨細胞、破骨細胞のいずれにもニコチン性、ムスカリン性ACh受容体が発現していることから、これらの細胞は副交感神経系によって直接制御されていることが示唆される。
nAChRの活性化がRANKL依存性の破骨細胞形成を抑制することは、いくつかの結果が矛盾しているため、異なるnAChRのサブユニットの骨恒常性に対する特定の役割をより良く解明するためにさらなる実験が必要だとしても、in vitroおよびin vivo実験の両方で観察されている(Mandl et al.、2016年)。
さらに、nAChRのアゴニストは、破骨細胞のアポトーシスを増加させ、骨吸収を抑制することが観察されている(Bajayoら、2012年)。これらの証拠はすべて、副交感神経系が骨吸収を抑制し、その結果、骨形成を促進することを示唆している(表1)。
表1 末梢神経系と骨とのコミュニケーション
| 神経系ブランチ | 神経伝達物質 | レセプター | 対象細胞 | 主な動作 |
| 副交感神経 | ACh | nAChR | 骨芽細胞 | の抑制 |
| mAChR | 破骨細胞 | 骨吸収 | ||
| シンパセティック | エヌイー | αAR | 骨芽細胞 | の推進 |
| ベータアール | 破骨細胞 | 骨吸収 | ||
| センサリー | CgRP | CgRPR | 骨芽細胞 | 骨形成の促進 |
| SP | SPR | 破骨細胞 | ||
| Sem3A | Nrp1、Plxna1、2、3 |
Ach, acetylcholine; nAChR, nicotinic acetylcholine receptor; mAChR, muscarinic acetylcholine receptor; NE, norepinephrine; αAR, alpha adrenergic receptor; βAR, beta adrenergic receptor.All rights reserved; CgRP, calcitonin gene-related peptide; SP, substance P; Sem3A, semaphorin 3A; CgRPR, calcitonin gene-related peptide receptor; SPR, substance P receptor; Nrp1, sema3A receptor; Plxnal1, 2, 3, sema3A co-receptors.NgRPR, sema3A receptor; Nrp1, sema3A共受容体。
交感神経の骨への作用 骨芽細胞や破骨細胞におけるα-ARのmRNAレベルが非常に低く、β-ARのレベルが高いことが観察されたことから、交感神経の骨リモデリングへの作用が推測される。その結果、β-ARは骨における交感神経の作用を媒介する主なARであると考えられる(Khosla et al.、2018)。
さらに、β-ARは、骨細胞様MLO-Y4細胞にも見出されている(Yao et al.、2017)。骨芽細胞や破骨細胞はβ-2ARを発現しているが、これらの受容体の破骨細胞への作用の生物学的関連性はまだ分かっていない。知られているのは、β-2ARの刺激により破骨細胞の形成が亢進し、骨芽細胞の機能が損なわれ、その結果、骨量が増加することだ。
逆に、これらの受容体を阻害すると、骨形成が促進されることが知られている(Elefteriou, 2008)。さらに、骨細胞様MLO-Y4細胞におけるβ-ARの刺激は、RANKL対OPG比を増加させることによって破骨細胞形成に影響を与える(Yaoら、2017;Liangら、2018)。
まとめると、自律神経系による骨リモデリングの制御は、副交感神経系による骨形成の促進、逆に交感神経系による骨吸収の促進をもたらす(表1)。* *
骨の感覚神経 骨における副交感神経と交感神経の活動の他に、感覚神経が骨形成に重要であり、力学的負荷に対する反応に基本的な役割を果たすことが明らかにされている。感覚神経は、骨リモデリングの制御に関与する自律的なシステムの第三の腕である。
このような神経支配が骨に存在することは、骨中の感覚繊維や、感覚繊維から放出され神経伝達物質として働く神経ペプチドであるカルシトニン遺伝子関連ペプチド(CGRP)やサブスタンスP(SP)の検出により証明されている(Machら、2002年)。
また、これらの神経ペプチドの受容体は、骨芽細胞や破骨細胞で検出されている(Kodama et al.、2017)。骨細胞ではSPの受容体であるNK1-Rが少量検出されているが、これらの細胞における特異的な機能は未だ不明である(Goto et al.、1998)。
CGRPとSPは、骨芽細胞の増殖と活性を刺激し、骨形成に影響を与える。具体的には、CGRPは機械的負荷によって誘発される骨形成を刺激する(Maら、2013;Sampleら、2014)。
骨形成のプロモーターとしての感覚神経系の骨リモデリングにおける役割も、脱神経研究および共培養系における感覚神経細胞と骨芽細胞の双方向コミュニケーションに関する研究を通じて実証されている(Ding et al.、2010;Kodama et al.、2017)。特に、共培養実験により、感覚神経細胞がグルタミン酸やSPを放出して骨芽細胞に作用し、骨芽細胞がATPを放出して感覚神経細胞に作用することが観察されている(Kodama et al.、2017)。
* *
その他、骨のホメオスタシスを制御することが知られている重要な神経ペプチドとして、セマフォリンがある。特に、感覚線維から放出されるセマ3Aは、Nrp1受容体やPlxna1, 2, 3共受容体に作用して、骨量増加や樹状骨細胞伸長を促進し、骨リモデリングの調節に関与している。
実際、sema3Aのノックアウトマウスでは、骨量が減少し、その結果、骨形成が低下することが示されている(Fukuda et al, 2013; Niimura et al, 2016)(表1)。さらに、骨細胞におけるsema3Aの欠損は、骨細胞の生存を促進するため、高齢のマウスでは、重度の骨減少を引き起こす(Hayashi et al, 2019)。
中枢神経系による骨の間接的な制御。
神経内分泌シグナル伝達
現在までに、骨の代謝やリモデリングは、神経ホルモン、神経ペプチド、神経伝達物質としていくつかの分子の作用により、PNSだけでなくCNSでも制御されていることが知られている。
* *
骨代謝を調節する神経ホルモン CNSによる末梢機能の調節の主なメカニズムは、視床下部からの神経ホルモンの放出が下垂体からのホルモン放出を刺激することによって行われる。骨細胞ではなく、骨芽細胞と破骨細胞は、これらのホルモンに対して異なる受容体を発現し、これらのいくつかは、骨吸収または骨形成のどちらかを優先して骨格の完全性を制御することが証明されている(表2)。
表2 脳から骨への情報伝達:神経ホルモン
| 神経ホルモン | 骨の中の標的細胞 | 主な動作 |
| FSH | 破骨細胞 | 破骨細胞新生および破骨細胞機能の活性化 |
| 破骨細胞前駆体 | ||
| TSH | 骨芽細胞 | 骨形成と骨吸収の独立した制御 |
| 破骨細胞 | ||
| プロラクチン | 骨芽細胞 | 骨芽細胞増殖抑制作用および骨塩量増加作用 |
| 副腎皮質刺激ホルモン(ACTH | 骨芽細胞 | 骨芽細胞増殖促進 |
| ジーエイチ | 骨芽細胞 | 骨形成の促進 |
| AVP/ADH | 骨芽細胞 | 骨芽細胞形成の抑制 |
| 破骨細胞 | 破骨細胞形成の促進 | |
| OT | 骨芽細胞 | 骨芽細胞新生促進作用 |
| 破骨細胞 | 破骨細胞活性の抑制 | |
| メラトニン | 骨芽細胞 | 骨芽細胞分化促進作用 |
| 破骨細胞 | 骨形成の促進 |
FSH:卵胞刺激ホルモン、TSH:甲状腺刺激ホルモン、ACTH:副腎皮質刺激ホルモン、GH:成長ホルモン、AVP/ADH:アルギニン-バソプレシン/抗利尿ホルモン、OT:オキシトシンを表す。
卵胞刺激ホルモン(FSH)と甲状腺刺激ホルモン(TSH)は、ともに骨のリモデリングを直接的に制御している。FSHは破骨細胞とその前駆体の細胞膜に発現するFSH受容体を介して作用し、破骨細胞の形成と機能を刺激し、骨吸収を促進することがin vitroおよびin vivo実験で明らかになった(Sun et al.、2006;Robinson et al.、2010)。
逆に、TSHは、骨芽細胞の機能を刺激し、これらの細胞に発現するTSH受容体を介して直接作用することにより破骨細胞の活性を抑制することによって、骨の完全性を維持する(Abeら、2003;Baliramら、2013)。一方では、TSHは破骨細胞新生を減少させることによって骨量減少を制限し、他方では、骨芽細胞新生を促進することによって骨量を回復させる。
さらに、TSHは骨芽細胞の分化を抑制することができる。これらの多面的な作用により、TSHは、骨形成と骨吸収の両方に作用する骨リモデリングを制御する単一かつ独立した分子であると定義される(Abeら、2003;Sampathら、2007;Baliramら、2011)。
プロラクチン受容体の発現は、破骨細胞ではなく骨芽細胞で検出され、プロラクチンが骨芽細胞の増殖および骨塩基形成を抑制することにより、骨の恒常性制御に寄与することが実証されている(Seriwatanachaiら、2008、2009年)。プロラクチン依存性の間接的な骨吸収促進は、泌乳期に骨からカルシウムを動員して乳汁分泌に使用することに関与している可能性がある。
* *
副腎皮質刺激ホルモン(ACTH)は、骨芽細胞で発現するメラノコルチン受容体ファミリー2(MC2R)に結合し、その発現は骨沈着が活発な部位で高いことから、骨芽細胞増殖の刺激による骨形成促進への関与が示唆されている(Zhongら、2005年;Tourkovaら、2017年)。
* *
成長ホルモン(GH)は、骨格形成を調節するインスリン様成長因子(IGF)を刺激することで間接的に、また骨細胞に作用することで直接的に骨増加を促す(DiGirolamoら、2007; Dobieら、2014)。
* *
アルギニン-バソプレシン(AVP、抗利尿ホルモン、ADHとしても知られる)とオキシトシン(OT)は、相反する作用によって骨代謝を調節している。AVPは骨芽細胞と破骨細胞の両方に発現するAVP受容体に直接作用することで骨芽細胞形成を障害し破骨細胞形成を誘導し、逆にOTは骨芽細胞と破骨細胞に発現するOT受容体に作用することで骨芽細胞形成を促進し破骨細胞の活性を抑制する(Tammaら、2013; Sunら、2016)。
* *
最後に、メラトニン受容体の発現は骨芽細胞と破骨細胞の両方で観察されており、メラトニンが骨芽細胞の分化や骨芽細胞形成を促進することで骨のホメオスタシスを調節していることが実証されている(Rothら、1999; Zhangら、2010)。メラトニンのシグナル伝達の欠損は、骨芽細胞の機能低下や脊柱管狭窄症の発症と関連している(Akoume et al.、2019)。
骨代謝を制御する神経ペプチド 骨のホメオスタシスとリモデリングは、視床下部から放出されるいくつかの神経ペプチドの直接制御下にもある(Table 3)。
表3 脳から骨への情報伝達:神経ペプチド
| 神経ペプチド | 骨の中の標的細胞 | 主な動作 |
| エヌピーアイ | 骨芽細胞(Y1受容体) | 骨芽細胞機能抑制作用(Y1) |
| 視床下部(Y2受容体) | 抗骨形成作用(Y2) | |
| アグレップ | 骨芽細胞、破骨細胞(交感神経系全体) | 骨芽細胞活性化 |
| CART | 骨細胞への直接的な役割を示す証拠はない。
|
骨量増加の促進 |
| メラノコルチン | 視床下部 (MC4R) | 骨形成促進 |
| 骨芽細胞(MC4R) | ||
| 骨芽細胞・破骨細胞(MCR) | ||
| ニューロメジンU | レプチンを介した中枢作用 | 骨量増加の抑制 |
| ビップ | 骨芽細胞 | 吸収抑制効果 |
| 破骨細胞 |
NPY, neuropetide Y; AgRP, agouti-related protein; CART, cocaine/amphetamine-related transcript; MC4R, melanocortin 4 receptor; MCRs, melanocortin receptors; VIP, vasoactive intestinal peptide.の頭文字をとったもの。
神経ペプチド Y(NPY)は、末梢で重要な役割を果たすことが明らかにされている。NPY は、視床下部の円弧状核(ARC)で中枢的に産生され、末梢では部位特異的に作用して骨の恒常性を調節する(Baldock et al.、2009)。
NPYとその相対的なY1受容体は共に骨芽細胞系の細胞で発見されている。NPYは骨芽細胞活性の抑制を通じて末梢で骨異化作用を発揮し、メカニカルシグナルと相互作用して骨芽細胞の制御と局所環境負荷状態を統合している。具体的には、この相互作用とNPYの局所作用は、力学的刺激後に骨芽細胞活性に影響を与える局所NPYを産生する骨細胞によって媒介されている(Igwe et al.) 注目すべきは、この神経ペプチドの骨ホメオスタシスにおける作用は、骨芽細胞が発現するY1受容体の末梢だけでなく、Y2受容体を通じて中枢神経系に、シグナル伝達を介して発揮されることである(Shiら、2011;Le N. J. ら、2015)。
特に、視床下部のNPY発現ニューロンに存在するY2受容体が活性化されると、皮質骨ではなく海綿骨に対して抗骨形成作用を引き起こすことが観察されている(Shi et al.) 興味深いことに、新生児カルバリアにおいて実証されたように、前骨細胞および骨細胞はNPYを発現し、その発現は流体せん断応力に応答して減少することが示された。
子牛の骨芽細胞をNPYで処理すると、サイクリックAMP(cAMP)の細胞内レベルが低下し、骨芽細胞分化のマーカー(例えば、オステオカルシン(OCN)、骨サイアルタンパク質、および象牙質酸性リンタンパク質1-DMP1)の発現を制限した(Igweら、2009年)。
* *
アグーチ関連ペプチド(AgRP)は、交感神経系を介して骨代謝に作用する。神経細胞AgRP活性の増加は、骨芽細胞活性の増強を通じて骨量増加に有利な交感神経緊張をダウンレギュレートする(Kimら、2015;Shiら、2017)。
* *
Cocaine amphetamine regulated transcript (CART) は、視床下部だけでなく末梢にも高発現している神経ペプチド前駆体タンパク質である。視床下部のCART発現が低いと骨吸収が増加する一方、より高レベルのRANKLの誘導を通じて、CART発現の上昇は骨量の増加をもたらすことが観察されている(Elefteriouら、2005年)。
* *
メラノコルチンペプチドは 5 種類の G タンパク質共役型受容体に結合し、視床下部に高発現しているメラノコルチン 4 受容体 (MC4R) に結合することにより、骨形成促進作用を持続します (Farooqi et al., 2000)。
メラノコルチン受容体 MC4R は、マウスの骨膜やラットの骨芽細胞で発見されており、メラノコルチンが骨の発達や代謝に直接関与していることが示唆されている (Dumont et al., 2005)。さらに、他のメラノコルチン受容体も骨芽細胞と破骨細胞の両方で検出されている(Zhongら、2005)。
メラノコルチン作動薬は、in vitroモデルにおいて骨芽細胞の増殖を刺激する。また、MC4Rのノックアウトマウスでは破骨細胞の減少により骨量が増加することから(Elefteriou, 2005)、メラノコルチンは骨芽細胞および破骨細胞の増殖速度の調節を通じて骨形成を促進することが示唆される。
骨量を調節するもう一つの神経ペプチドは、レプチンを介した経路で骨吸収を誘発するニューロメジンUであり、末梢よりも中枢神経レベルで優先的に作用する(Sato et al.、2007)。* *
血管作動性腸ペプチド(VIP)は、交感神経および副交感神経線維を介して作用する。骨膜レベル、主に骨端部において、副交感神経終末からAChとともに放出されることが多い。G タンパク質共役型受容体に結合することにより、骨芽細胞や破骨細胞に直接作用し、吸収抑制作用を発揮する(Togari et al.、1997)。
VIPは、骨芽細胞のRANKL発現を抑制する一方、破骨細胞のRANKを抑制し、並行して骨芽細胞のOPG発現を誘導することが示されている(Mukohyamaら、2000; Juarranzら、2005)。
* *
骨代謝を制御する神経伝達物質 骨の恒常性と骨リモデリングは、セロトニン、グルタミン酸、ドーパミンなどの中枢神経系から放出される神経伝達物質によっても制御されている(表4)。実際、骨細胞はこれらの神経伝達物質に対する受容体を発現している。
骨芽細胞、骨細胞および破骨細胞は、セロトニンに対する異なるサブタイプのGタンパク質共役型受容体を発現している。特に、骨細胞様細胞であるMLO-Y4は、セロトニン受容体5-HT1Aおよび5-HT2A、さらにセロトニントランスポーター(5-HTT)およびセロトニン合成に関わる酵素を発現し、骨におけるセロトニンシステムの重要な構成要素となる(Bliziotes et al, 2006)。
興味深いことに、骨細胞の活性を調節するセロトニンの正確な作用機序はまだ研究中であり、腸由来のセロトニンは骨芽細胞増殖を減少させるが、CNS由来のセロトニンは骨形成を促進するなど、起源によって異なる作用を示すと推測されている(Cui et al.)
表4 脳から骨への情報伝達:神経伝達物質
| 神経伝達物質 | レセプター | 骨の中の標的細胞 | 主な動作 |
| セロトニン | セロトニン用GPCR | 骨芽細胞 | 中枢性セロトニン:骨形成の促進 |
| 破骨細胞 | 末梢性セロトニン:骨芽細胞増殖抑制作用 | ||
| グルタミン酸 | NMDA受容体 | 骨芽細胞 | 骨芽細胞の分化と機能の促進 |
| 破骨細胞 | 破骨細胞活性の抑制 | ||
| ドーパミン | DR-1、DR-2、DR-3、DR-5 | 骨芽細胞 | 骨形成およびミネラル化の促進 |
| 破骨細胞 | 破骨細胞形成の抑制 |
GPCR、Gタンパク質共役型受容体、NMDA、n-methyl-d-aspartate、DR、ドーパミン受容体。
骨芽細胞と破骨細胞はグルタミン酸受容体を発現しており、特にN-methyl-d-aspartate(NMDA)型が定量的に最も多く発現している(Chenuら、1998;Guら、2002)。骨におけるグルタミン酸の役割は、活性なグルタミン酸が中枢と末梢の両方に由来し、その作用が異なる細胞を含むことから、興味深く、非常に複雑である。
一方では、グルタミン酸受容体を発現する骨細胞(すなわち、骨芽細胞および破骨細胞)の近傍で骨レベルのグルタミン酸神経支配が存在するが、他方では、骨芽細胞集団全体がグルタミン酸の放出を制御するための一連の成分を発現している(Hinoiら、2002;Bhangu、2003)。
しかし、異なる研究により、グルタミン酸は破骨細胞の活性を抑制し、骨芽細胞の機能を促進することが明らかにされている(Taylor, 2002; Morimoto et al, 2006)。注目すべきは、グルタミン酸トランスポーターであるGLASTとグルタミン酸レセプターの両方が機械的負荷に応答することだ。
In vivoの研究では、機械的負荷が骨におけるGLASTとグルタミン酸受容体の発現を調節することが示された(Masonら、1997;Hoら、2005)。興味深いことに、骨細胞は骨への力学的負荷に対する最初の応答者であるという仮説がある。実際、力学的負荷の数日後、GLASTタンパク質は骨細胞では検出されなかったが、骨芽細胞ではその発現が増加した (Mason et al., 1997)。
* *
ドーパミンはもう一つの重要な中枢神経伝達物質であり、骨のホメオスタシスに影響を与える。ドーパミン受容体(DR)-1、-2、-3、-5を介して作用し、骨芽細胞増殖および骨ミネラル化を促進し、破骨細胞形成を抑制する(Hanamiら、2013;Lee D. J. ら、2015;Wang ら、2020)。
ドーパミンレベルの調節障害によって特徴付けられるそれらの病理学[例えば、アルツハイマー病(AD)、パーキンソン病(PD)]に対する治療介入としてのドーパミンレベルの調節は、骨量に干渉し得る(Chenら、2016年)。
骨-脳軸の2つの中間体としての脂肪組織と骨格筋
脳から骨への直接的な軸の他に、これら2つの器官は、第3の組織によって発現・放出されるメディエーターを含む間接的なクロストークを通じてコミュニケーションをとっている可能性がある。脂肪組織と骨格筋は、異なる性質の刺激(生体力学的および生化学的)を統合し、全身に影響を及ぼすメディエーター(例えば、マイオカインやアディポカイン)を放出できる重要な器官であり、したがって、骨にも直接または神経系の仲介により影響を及ぼす。
 * *
* *
脂肪細胞から分泌されるホルモン。アディポカイン 実際には、いくつかのアディポカインのうち、脂肪細胞から放出され、中枢神経系に作用して骨の代謝やリモデリングを調節するホルモンが、主に2つある。* *
レプチンはインスリン刺激やグルコース取り込みなどの同化作用に対応して脂肪細胞から放出され (Barr et al., 1997; Mueller et al., 1998) 、食欲やエネルギー代謝の調節に関与する中枢神経系に存在する受容体に結合する。
また、視床下部に存在するレセプターに結合し、SNSの活性化を通じて骨代謝を調節する。したがって、レプチンが制御する神経経路は、骨リモデリングの両側面を制御していることになる(Takeda et al.、2002;Elefteriou et al.、2005)。
* *
また、アディポネクチンは青斑核の神経細胞に作用して骨代謝を調節し、交感神経の緊張を低下させ、その結果、骨量を増加させる(Kajimura et al.) なお、後述する骨由来ホルモンであるOCNは、脂肪細胞によるアディポネクチンの放出を促進する(Hillら, 2014; Otaniら, 2015)。このように、末梢の脂肪組織を介して、さらにCNSを介して作用する骨が、自らのリモデリングを制御するという間接的な方法の存在と考えることができる。
* *
骨格筋細胞から放出されるホルモン。骨格筋は、その活動(収縮)時にマイオカインと呼ばれる分子を放出し、ホルモンに似た活性で他の組織に作用し、適応反応を媒介することが知られている(Gomarasca et al.、2020)。
* *
イリシンは、最近同定されたマイオカインの1つで、運動中および運動後に骨格筋から放出される循環ホルモン様メディエーターである(Bostromら、2012年;Wrannら、2013年;Lombardiら、2016年)。エネルギー基質の利用を促して熱を放出することでエネルギー代謝を調節し、骨格筋だけでなく、脂肪組織、骨、脳にも作用する。
骨においては、イリシンは同化作用を仲介し、骨芽細胞の活性を刺激し、破骨細胞の数を減少させることで作用し(Colaianni et al.、2015)、骨形成を促進する。一方、運動によってその循環レベルが上昇すれば、他方、骨粗鬆症のような骨代謝機能不全では減少する(Anastasilakis et al, 2014)。
脳においては、イリシンはラットやマウスの小脳のプルキンエ神経細胞で発現しており、胚性幹細胞の適切な神経分化に必要である(Forouzanfar et al, 2015)。さらに、虚血性脳卒中後の神経保護効果を有し、海馬に作用することで、ADにおけるシナプス可塑性と記憶障害を救済する可能性がある(Asadi et al., 2018; Lourenco et al., 2019; Martinez Munoz et al., 2018)。
イリシンは、その同化促進作用に基づき、また、その循環レベルが身体運動によって増加し得るという事実から、神経変性障害に関連する骨粗鬆症形質における興味深い治療ターゲットとなり得る。しかしながら、骨格筋から放出される末梢性イリシンが、BBBを通過することで直接中枢神経系に作用し、運動後の骨リモデリングを制御することができるかどうかはまだわかっていない。
骨から脳への情報伝達
骨細胞はカルシウム依存的なメカニズムで EV を放出し、その EV には RANKL、OPG、スクレロスチンが含まれていることが明らかにされている。このメカニズムは、機械的刺激に続いてEVの放出の促進を示した無傷の骨のex vivo研究(Morrellら、2018)によって示されたように、機械的負荷に対する骨細胞の応答が他の組織/器官に伝達され得る方法を示すと想定されている。しかしながら、骨由来のメディエーターの中心的な役割については、ほとんど知られていない。例えば、骨由来のメディエーターがBBBを通過する正確なメカニズムはよく分かっておらず、現在も研究中である。
* *
閉経後の女性では、低骨密度(BMD)および骨粗鬆症が認知症やADと関連することが示されている(Tan et al.、2005;Loskutova et al.、2009)。さらに、低BMDとBMD減少は骨粗鬆症とADの危険因子であり、認知症の早期危険因子である。
股関節の骨量減少が多い女性は、減少が少ない女性に比べ、認知性認知症を発症する確率が高くなる。また、この点を別の視点から見ると、除脂肪体重が多いほど認知障害や認知症のリスクが低いことが示されている(Burns et al., 2010; Friedman et al., 2010; Basgoz et al., 2020)。
* *
骨由来のメディエーターの血清レベルは、骨粗鬆症などの骨疾患に罹患した患者において調節されていることが分かっているが、ADなどの神経変性疾患の場合にも調節されている[e.g.]。OCN、OPN、スクレロスチン(Yuanら、2019)、Dkk-1(Huangら、2018)、リポカリン2(Song and Kim、2018)]やPD[例えば、骨形成タンパク質2(Gouldingら、2020)、OCN(Shanら、2019)]などである。
興味深いことに、AD、PDだけでなく、他の神経変性疾患においても、骨減少症や骨粗鬆症が併存していることが多い(Roos, 2014; Binks and Dobson, 2016)。したがって、これらの分子は、骨代謝異常によって特徴づけられるCNSに影響を及ぼす病的状態における適切な治療標的として考慮されるかもしれない。実際、取り組んだ運動プログラムで末梢的に作用することにより、骨以外のCNSに有益な効果をもたらす可能性のあるこれらのタンパク質のレベルを調節することが可能かもしれない(Leeら、2019)。
* *
このレビューの最後の部分では、神経系における骨由来分子の確立された作用と推定される作用に関する現在の知識を議論し、それらの運動誘発性モジュレーションが潜在的に両方の器官に利益をもたらす可能性に焦点を当てる(表5)。
表5 骨から脳への情報伝達:ホルモンとペプチド
| 骨由来メディエーター | 骨や脳にある細胞のもと | 運動に関する修正 | 主な動作 | |
| オーシーエヌ | 骨芽細胞 | ↑ 有酸素運動による血中濃度(マウス、ヒト) | ボーン | cOCNは骨ECM中のハイドロキシアパタイトと結合し、ミネラル化を制御する |
| 非体重負荷耐久運動によるucOC ↑。 | 骨形成のマーカー | |||
| ↑ 持久的な体重負荷・衝撃を伴う運動によるcOC | ||||
| ブレーン | マウス | |||
| BBBを越えることができる | ||||
| 異なる脳領域での神経伝達物質合成の制御 | ||||
| 脳の発達と機能の両方に必要 | ||||
| 学習・記憶・認知機能の制御 | ||||
| 人間 | ||||
| 女性における血漿中OCN濃度とグローバル認知力の相関性 | ||||
| 低レベルのOCNは脳の微細構造の変化と相関する | ||||
| ヒトの脳内で活性化するOCN型は不明 | ||||
| エルシーエヌツー | 骨芽細胞(少なくとも循環LCN2の50%以上) | 体操による↓。 | ボーン | 破骨細胞形成の促進 |
| ↑ベッドで休んで | LCN2とBMDの逆相関、女性において | |||
| ブレーン | マウス | |||
| BBBを越えることができる | ||||
| 視床下部MC4Rに作用し、食欲反応を制御する。 | ||||
| 代謝性炎症時に増加し、海馬に作用して炎症を調節する | ||||
| スクレロスチン | 骨細胞 | 機械的負荷による↓。 | ボーン | Wnt/β-カテニン経路の阻害とRANKL遊離刺激による骨芽細胞形成の阻害 |
| ↑ ベッド上での安静・固定によるもの。 | ブレーン | Wnt/β-カテニンを介した神経変性疾患における神経機能制御の可能性 | ||
| BBBを通過できるかどうかは不明 | ||||
| Dkk1 | 骨芽細胞、骨細胞 | 慢性的な運動による ↓ (血清レベル) | ボーン | Wnt/β-カテニン経路の阻害による骨芽細胞形成の抑制 |
| ブレーン | マウス | |||
| ADトランスジェニックマウスで発現が上昇 | ||||
| LTP、学習および記憶の障害に寄与する。 | ||||
| 人間 | ||||
| AD患者において発現が増加 | ||||
| 高齢女性における循環器系Dkk1の認知能力との逆相関 | ||||
| BBBを通過できるかどうかは不明 | ||||
| FGF23 | 骨細胞、骨芽細胞、脳の特定部位(視床下部、海馬、大脳皮質、脳脊髄液中)に発現。 | ↑ 荷降ろし中 | ボーン | 骨芽細胞活性の抑制 |
| 破骨細胞を介した骨吸収の活性化 | ||||
| ブレーン | BBBを通過できるかどうかは不明(他のFGFタンパク質で実証済み) | |||
| KOマウスは海馬の認知機能に障害を持つ | ||||
| 脳での役割はまだよく分かっていない | ||||
| オープンネットワーク | 骨芽細胞 | 減量プログラムにおける急性期運動によって ↓。 | ボーン | 骨吸収・脱灰の促進 |
| BMDとの負の相関 | ||||
| ブレーン | PD患者の脳切片で高発現 | |||
| AD患者における血清中の高濃度 | ||||
| 神経変性疾患における修復過程の制御 | ||||
| RANKL | 骨芽細胞、免疫細胞 | ↓ 急性運動による | ボーン | 破骨細胞新生および破骨細胞機能の活性化 |
| ブレーン | 視床下部で高発現し、体温や発熱の調節に関与、うつ病性疾患にも関与 | |||
| BMPs | 骨芽細胞(合成)、破骨細胞(ECMからの吸収依存性放出) | ↑ 急性運動 | ボーン | 骨形成の促進 |
| 機械的刺激に伴う骨形成のモジュレーション | ||||
| ブレーン | 胎生期および成体期の神経新生に関与する | |||
| BDNF | CNS, PNS, 骨芽細胞, 軟骨細胞 | ↑ 急性運動 | ボーン | 骨細胞に対する有益な効果、特にMSCの増殖および骨芽細胞への分化を促進する効果 |
| 脳内マウスの条件付きKOで骨欠損を発症 | ||||
| ブレーン | シナプス可塑性、神経発達、神経細胞分化への支援 | |||
| ADおよびPD患者における循環レベルの低下 | ||||
| IGF-1 | 骨芽細胞、軟骨細胞 胎生期および成体期の脳に存在する(小脳、嗅球、海馬) | 急性運動による↑。 | ボーン | 軟骨細胞増殖および骨芽細胞分化の促進による骨形成促進作用 |
| 慢性的な運動による↓。 | 加齢および骨粗鬆症の患者における血清レベルの低下 | |||
| ブレーン | 神経発達と可塑性への関与 | |||
| 加齢に伴う神経変性疾患への関与 | ||||
オステオカルシン
オステオカルシンは、骨γ-カルボキシグルタミン酸タンパク質(BGLAP)としても知られ、主に骨芽細胞から放出される骨由来のタンパク質であり、通常、骨形成の指標として血清レベルで測定される(Hauschka et al.、1989)。
OCNは、まずプレプロペプチドとして産生され、3つのグルタミン酸残基がカルボキシル化(Glu → Gla)された後、成熟したものとなる。OCNが成熟し、カルボキシル化されると、細胞外に放出され、骨のECMに組み込まれ、ハイドロキシアパタイトに結合する(Poserら、1980;Malashkevichら、2013)。
OCNには、完全カルボキシル化型(cOCN)、完全非カルボキシル化型(ucOCN)、中間のモノおよびバイカルボキシル化型からなるいくつかの形態があり、特に低カルボキシル化型は酵素による断片化に弱いため、いくつかの切断生成物が存在する(Lombardi et al.、2015年)。
* *
マウスを用いたいくつかの研究により、OCN、主にucOCNフォームの代謝における生物学的役割が示されている。OCNがグルコース代謝を調節し、膵島からのインスリン放出を刺激し、生殖能力や性ステロイドホルモンの生成に影響を与えることが示されている(Pattiら、2013)。
さらに、脂肪細胞に作用し、アディポネクチンの放出を促進することが報告されている(Kanazawa, 2015)。OCN活性の他の標的として、精巣、骨格筋、肝臓、血管、小腸が同定されている。実際、齧歯類やin vitro細胞系での証拠にもかかわらず、ヒトにおけるそのような役割は確立されておらず、また、現在の証拠は、OCNの内分泌機能は、穏やかで、おそらく間接的な調節に追いやられるかもしれないことを示している(Lombardi et al.、2015)。
* *
近年、齧歯類において、神経系に関連するOCNの新たな役割が浮かび上がってきた。実際、マウスにおいて、OCNは脳の発達と機能の両方に必要であることが示されている(Ouryら、2013;Khrimianら、2017)。
* *
OCN-/-のin vivoマウスモデルは、野生型(WT)対応と比較して、著しい受動性を示し、脳の発達と認知を修正するためのOCNの有用性が示された(Oury et al.、2013)。成体OCN-/-マウスは、脳構造の異常や神経伝達物質レベルの変化、学習・記憶の障害、不安抑うつ表現型などを発症した。
さらに、OCNを完全に欠損させたマウスは、出生後、成体OCN-/-マウスで観察される脳形態異常を除く表現型変化と同じか、少なくとも、より軽度ではあるが類似の表現型変化を示した。これらのマウスにOCNを脳室内投与すると、正常な表現型が回復し、不安と記憶の障害が修正された(Ouryら、2013)。
このマウスモデルの実験では、加齢に伴う認知機能障害を軽減するためにOCNが必要である可能性が示唆された(Villeda et al.、2014)。興味深いことに、OCNの循環レベルと認知機能は年齢と強く逆相関しており、OCNが加齢に伴う認知機能低下を抑制するために必要である可能性が示唆された。
* *
注目すべきは、最近の論文で、OCNがBBBを通過し、CNSに入ると、脳幹、中脳、海馬で直接作用し、いくつかの神経伝達物質の合成に影響を与え、ニューロン機能を調節することが示されていることだ。OCN-/-マウスでは、末梢に投与されたucOCNはBBBを通過して脳レベルに局在するが、cOCN型はBBBを効率よく通過しないことが観察されている(Shan et al.) 中枢では、OCNはセロトニン、ドーパミン、ノルアドレナリンなどのモノアミン神経伝達物質の合成を刺激し、主要な抑制性神経伝達物質であるγ-アミノ酪酸(GABA)の合成を阻害する。
このように、骨から放出されたOCNはBBBを通過し、学習、記憶、認知機能の調節に影響を与える可能性がある(Oury et al.)
* *
OCNが骨代謝と認知機能にどのような相関をもたらすかについては、最近の臨床研究によって明らかにされつつある。女性では、血漿OCNと実行機能、グローバルな認知機能との間に正の相関があることが実証されているが、エピソード記憶との間にはない(Bradburnら、2016年)。
興味深いことに、男性ではそのような相関は観察されておらず、認知パフォーマンスにおける性差の存在の可能性が示唆されている。さらに、低レベルのOCNは、中年女性の磁気共鳴画像で観察される脳の微細構造の変化と相関することが報告されている(Puig et al.、2016)。
* *
運動の効果
マウスや、おそらくヒトでも、一回の持久的な運動後に、骨格筋によるグルコースの取り込みが増加し、循環血中インスリン濃度が低下すると、循環血中OCN濃度が上昇する(Mera et al. 特に、マウスでは、この運動に関連した循環OCNの増加が、骨吸収速度の増加と関連していることが観察されている(Mera et al.、2016)。
このように、有酸素運動は、マウスにおいて、IL-6/gpr130軸を介して作用し、エネルギー代謝および認知を改善する可能性のあるOCNの循環レベルを増加させる。ヒトでは、有酸素運動、および有酸素-抵抗複合運動は、OCNの血清レベルを増加させる(Chahlaら、2015;Mohammad Rahimiら、2020)。
これらの知見は、OCN放出の誘導が、認知症に対する運動の予防効果に関連するのではないかという仮説を導き出すものである。しかし、どのようなOCNが実際に脳機能を刺激するのか、また、どのような運動が特定のOCNを調節するのかを明らかにするためには、さらなる研究が必要である。
このことは、認知機能障害を改善する目的で、特定の患者群に身体活動を処方する場合に、特に興味深いことだ。この目的のために、異なる種類の身体活動が、ある種のOCNの相対的な有病率と関連することが証明された。3週間のステージレース中、負荷のない状態で激しい運動をしたプロのサイクリストは、破骨細胞活性の刺激に関連して、ucOCNのレベルに変化はなく(すなわち、cOCNの減少)、総循環OCNが減少した(Lombardiら、2012b)。
一方、高い負荷を伴う激しい活動を慢性的に行っている男性山岳ウルトラマラソン選手では、循環血中cOCNレベルが座り仕事の選手と同程度になったが、ucOCNレベルは半分になった。注目すべきは、山岳ウルトラマラソンが急性に骨形成マーカーの循環レベルの低下を誘発するものの、ucOCNレベルのさらなる低下を引き起こすことである(Sansoni et al.、2017)。

リポカリン2(Lipocalin2)
Lipocalin2は、いくつかの機能を制御する糖タンパク質であり、中でも病原体に対する好中球の反応(好中球ゼラチナーゼ関連リポカリンとも呼ばれる)、腎尿細管細胞における酸化ストレスの制御、インスリン放出の調節、エネルギー代謝を制御している。
最近、正常な状態では、循環血中リポカリン2(LCN2)の少なくとも50%が骨芽細胞から放出され、この画分がBBBを通過し、視床下部で作用することが発見された。実際、骨芽細胞に特異的にLcn2を欠損させたモデルマウスLcn2osb-/-(Mosialouら、2017)の作成を通じて、骨芽細胞は、少なくとも基礎状態において、食欲およびグルコース代謝を制御するのに十分なLCN2レベルをもたらす細胞であることが証明された。
この仮説は、生殖細胞からLCN2を欠失させたマウスモデルで行われたいくつかの研究から得られた観察によって、さらに支持されてきた。しかしながら、異なる研究により、論争の的となる結果が得られている。実際、代謝性炎症はLCN2の増加と密接に関連しており、このホルモンが糖尿病促進および肥満防止に関与していることが示唆されている。一方、他の研究では、LCN2の役割は正反対であり、抗糖尿病および抗肥満の機能を強調するものであることが証明されている。
* *
代謝性炎症中のLCN2の増加は、末梢だけでなく、CNS、特に、炎症の調節に役割を解決する可能性のある海馬でも観察されている(Bhusalら、2019)。興味深いことに、LCN2の末梢および中枢投与の両方が、食物摂取量および体重の増加を減少させる。
* *
リポカリン2はBBBを通過し、視床下部において作用し、室傍核のニューロンを活性化することができる。さらに、一連の分子生物学的研究により、LCN2がMC4Rと直接結合することにより、MC4R経路を活性化することが示された。
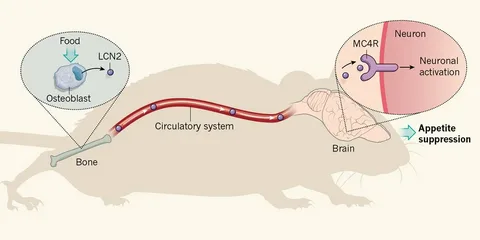
骨由来のLCN2による食欲の制御は、確立された骨量の中枢制御へのフィードバック機構を提供し、したがって、骨と脳の間のクロストークがいかに重要であるかをさらに示している。* *
運動の効果
ベッドレスト中に、健康なボランティアは、時間依存的に循環LCN2レベルの上昇を経験した。さらに、尾部懸垂による機械的負荷の除去、ボツリヌス毒素Aによる筋麻痺、ジストロフィーマウスでは、正常負荷・健康なマウスと比較して、骨におけるLCN2発現量が増加した。しかし、これらのマウスでは、運動によってLCN2の増加が打ち消された(Rucciら、2015)。
スクレロスチン
スケロスチンは、骨細胞から放出される糖タンパク質で、Wnt-βカテニン経路の阻害を介して骨芽細胞形成を阻害し、その結果、骨芽細胞におけるRANKLの誘導を伴って破骨細胞による骨吸収も持続させる(Liら、2005年)。スクレロスチンはSOST遺伝子によってコードされ、その産生は機械的刺激を含む様々な因子によって制御される。
実際、機械的負荷は骨細胞におけるSOSTの転写を減少させ、その結果、骨形成を増加させることが報告されている。固定化は、動物モデルおよびヒトにおいて、BMDの減少および血清スクレロスチンの上昇と関連している(Roblingら、2008年;Spatzら、2013年)。
しかし、骨格内でのスクレロスチンの作用は、骨細胞から放出されるスクレロスチンの局所作用を反映していると考えられ、循環スクレロスチンの量は必ずしも骨密度を反映しているとは限らない。実際、循環血中スクレロスチンと骨形成の関係は単純ではなく、明確にはほど遠いため、この点に関するさらなる探求が必要である。ヒトにおけるスクレロスチンの産生不全は、骨密度の増加を特徴とする強皮症およびVan Buchem病を引き起こす(Brunkowら、2001;Balemansら、2002)。
* *
スクレロスチンは低密度リポタンパク質受容体関連タンパク質-5および-6(LRP5/6)に結合し、Wntシグナルを阻害することが明らかにされている(Li et al.、2005)。この経路の多面的作用のうち、Wntシグナルはシナプス可塑性や記憶を制御し、ADなどの神経変性疾患の病態に関連している(Wan et al., 2014; Libro et al., 2016; Tapia-Rojas and Inestrosa, 2018)。
仮説としては、スクレロスチンが神経変性疾患におけるこの経路の制御に関与している可能性があるが、スクレロスチンがBBBを通過できるかどうか、まだ実証されていない。スクレロスチンの循環レベルの調節(例えば、特定の運動プログラムを通して)が、脳内のWntシグナル伝達に影響を与えるかどうか、またどのように影響を与えるかを理解するためには、他の研究が必要である。
* *
運動の効果
急性身体活動は、スクレロスチンにとって重要な抑制刺激となる(Lombardiら、2017)。しかし、この活動が負荷のない状態で行われた場合、特にサイクリングのように高強度の場合、増加し、骨吸収が刺激される状態に結びつく可能性がある(Grassoら、2015年)。しかし、慢性的に高いトレーニング負荷がかかるプロスポーツ選手では、安静時にこの刺激はネガティブフィードバック機構(Lombardiら、2012a)または骨量全体に依存するためか減衰する。

ディックコップ関連タンパク質1(Dickkopf-Related Protein 1)
Dickkopf関連タンパク質1タンパク質は、骨組織で高発現しており、特に骨芽細胞と骨細胞で最初に検出され、骨の微小環境下で分泌されている(Li et al.) スクレロスチンと同様に、骨のメカノトランスダクションに関与し、LRP6と結合することにより、Wnt/β-カテニン経路に拮抗し、骨芽細胞新生を阻害し、骨吸収を促進する(Li et al.2006; Pinzone et al.2009) 。
* *
Wntシグナルは、シナプス可塑性、神経細胞の発達、機能などの調節に重要な役割を果たしており、その調節障害は、ADなどの神経変性疾患と関連していることが知られている。
* *
興味深いことに、Dkk1タンパク質はAD患者やトランスジェニックADマウスの脳で過剰に発現していることが分かっている。その後、神経変性におけるDkk1タンパク質の役割を調べたところ、海馬マウスでDkk1タンパク質を過剰発現させると、長期増強、学習および記憶に障害が生じることが明らかになった(Purro et al.) さらに、ラットやマウスのin vivo研究および神経細胞培養のin vitro研究により、Dkk1タンパク質の発現増加は、脳虚血、てんかん、神経変性疾患における細胞死に寄与する可能性が示された(Cappuccio et al.、2005;Busceti et al.、2007;Mastroiacovo et al.、2009;Rosi et al.、2010)。
Dkk1のバイオマーカーとしての役割の可能性を調べるために、記憶に不安のある高齢女性の末梢Dkk1レベルを測定した興味深い研究がある。この研究では、Dkk1と認知能力の間に逆相関があることが明らかになったが、Dkk1の血清レベルがその脳レベルに対応するかどうかは判断できなかった(Ross et al.)
* *
明らかでないのは、骨の微小環境内で放出された循環Dkk1がBBBを通過して、この推定される効果を媒介することができるか、代わりに、Dkk1の神経放出が表現型の所見に関与しているかということだ。
* *
運動の効果
Dickkopf関連タンパク質1の血清レベルは長期間の運動によって低下し(Kimら、2017)、一方、ベッドレスト中、運動はスクレロスチンとDkk1の血清レベルのアンロードに関連した上昇を妨げない(Belavyら、2016)。
線維芽細胞成長因子23
線維芽細胞増殖因子23は、視床下部、海馬、大脳皮質などの一部の脳領域でも少量ながら発現が検出され(Liuら、2006;Yoshikoら、2007)、脳脊髄液(CSF)にも検出されている(Kunertら、2017)としても、そのほとんどが骨の骨芽細胞や骨細胞で発現している。
しかし、循環する線維芽細胞増殖因子23(FGF23)の大部分は骨細胞に由来する(Fengら、2006)。刺激されていない(すなわち、負荷がかかっていない)骨細胞は、スクレロスチンおよびDkk1とともに、FGF23を発現する。
この反応は、一方では骨芽細胞の合成活性と分化を阻害し、破骨細胞を介した骨吸収を促進し、他方では骨異化産物(例えば、カルシウムやリン)の循環負荷の増加を他の臓器に認識させる。実際、FGF23は腎臓の尿細管に作用し、尿中のリンの排泄を促し、ビタミンDの代謝も調節する(Lombardiら、2014年)。
* *
脳での発現と検出が報告されているにもかかわらず、脳機能におけるFGF23の決定的な役割はまだ確立されていない。* *
In vitroでは、FGF23を濃縮した培地で処理したマウス海馬のニューロンは、あまり複雑でない形態を示す(Henselら、2016年)。FGF23ノックアウトマウスモデルを用いた最近の論文では、脳の構造的な変化を伴わない海馬依存性の認知機能の障害が実証されている(Laszczyk et al.、2019)。
* *
興味深いことに、FGFファミリーに属するすべての化合物がBBBを通過できることを示すさまざまな論文があり、その結果、FGF23にも同様の特徴があると仮定されている(Cuevasら、1998年;Hsuchouら、2013年)。
* *
運動の効果
急性および慢性的な身体運動を行ったマウスでは、FGF23の血清レベルが低下し、これは骨格のミネラル化におけるFGF23の役割と一致する(Liら、2016年)。負荷のない状態で激しい骨格筋活動を経験するサイクリストの3週間のステージレース中、破骨細胞活性の増強と血清リン濃度の並行上昇に関連してFGF23血清レベルが上昇した(Lombardiら、2014年)。
しかし、ラットを用いて行われた別の研究では、ピークパワーおよび持久力トレーニング後のFGF23血清レベルの変化がないことが示され、身体活動後のFGF23血清レベル調節についてよりよく調査するためにさらなる研究が必要であることが示された(Buskermolenら、2019年)。

脳-骨-脳のクロストークにおける他のメディエーター
脳と骨の両方で発現し、機能を発揮する重要な分子がいくつかある。したがって、特定の研究がない場合、これらの分子が局所的にのみ作用するのか、骨由来の分子がBBBを通過して脳でも作用するのか、またはその逆なのかを理解することは困難である。これらの分子のうち、イリシン(その役割は前述)、OPN、RANKL、骨形成タンパク質(BMP)、脳由来神経栄養因子(BDNF)、IGF-1を挙げることができる。
オステオポンチン
オステオポンチンは、骨由来の糖タンパク質で、他の異なる組織や器官にも発現し、骨-免疫クロストークのメディエーターとして知られている(Lanteriら、2012)。OPNは脳でも発現していることが証明されている。骨においてはECMに存在し、破骨細胞を骨ミネラルマトリックスに固定することにより、骨脱灰を支える骨吸収を促進する(Reinholtら、1990;Singhら、2018)。OPNの血清レベルが高い患者はBMDが低いことが観察されている(Filardi et al., 2019)。
* *
脳では、様々な脳障害や神経変性疾患において、ニューロンを保護し、修復プロセスを制御しているようである(Kaleta, 2019)。興味深いことに、OPNタンパク質レベルは、CSFと血漿の両方でAD患者で高く、慢性患者と比較して新たに診断されたADでより高いことが判明した(Comiら、2010;Sunら、2013)。また、PD患者の脳内にも高発現していることが確認されている(Maetzler et al.、2007)。
核因子κB受容体活性化因子(Receptor Activator of Nuclear Factor κB)
Receptor Activator of Nuclear Factor κB ligandは、前述のように破骨細胞や破骨細胞前駆体に発現するRANKと結合し、成熟した吸収細胞への分化を活性化する(Liu and Zhang, 2015)。骨や脳など様々な組織で発現している。
* *
骨においては、骨吸収を促進し、骨粗鬆症の治療標的として確立されている。実際、RANKLとRANKの結合を阻害する抗RANKL抗体は、骨吸収抑制治療薬として使用されている。* *
脳では、RANKLは視床下部に高発現し、その機能は女性の体温や発熱の中枢調節に関与している(Hanada et al.) 興味深いことに、慢性的な社会的敗北ストレスを受け、うつ病様症候群を発症したマウスに抗RANKLを投与すると、その表現型が改善されることから、抗RANKL抗体のヒトうつ病に対する新規治療法として期待されている (Zhang et al., 2020).
骨形成タンパク質(Bone Morphogenic Proteins)
骨形成タンパク質(BMP)は、最大のトランスフォーミング成長因子β(TGFβ)スーパーファミリーに属する成長因子であり、骨や脳など様々な組織で発現している。これらのタンパク質は細胞外の多機能サイトカインであり、ECMが沈着する際にECM内に隔離される可能性がある。
実際、ECM中にはBMPのリガンドや、膜貫通型のセリン・スレオニンキナーゼ受容体を介してBMPの活性を阻害するアンタゴニストが高濃度に存在する。したがって、ECMに内包されたBMPsの作用は、アゴニストやアンタゴニストによって細かく制御されている(Weiss and Attisano, 2013)。
* *
骨においては、BMPsは骨格の成長を刺激し、骨の形成とリモデリングを促進する。BMPsのシグナルは、様々な力学的刺激によって調節され、特定のBMP作用につながる。BMPはECMに封入されているため、様々な力学的刺激に反応する動的な活性空間にある。
例えば、流体せん断応力は、ECMからの解放の結果、BMPsシグナルの即時増加を決定し、骨細胞および骨芽細胞を刺激する(Schreivogelら、2019)。このように、機械的に調節されたBMPsは、骨形成に影響を与える。しかし、メカノセンシングとBMPsシグナルの中間的な分子が他にもいくつか存在することを念頭に置くことが重要である(da Silva Madaleno et al.、2020)。
メカノセンシティブな成長因子MGF24Eは、これらの分子の一つであり、SMADのリン酸化と骨形成遺伝子の発現を刺激し、最終的に骨密度を増加させる(Dengら、2015年)。このことは、BMPsの量を調節することで骨再生を促すことを目的とした治療法の観点からも重要である。
* *
成体脳では、海馬歯状回顆粒下帯という神経幹細胞を宿すニッチが存在し、そこでは成体神経新生が持続していることが知られている。身体活動によって骨格筋が刺激され、その結果、脳内で骨格筋が活性化されるため、成体神経新生が促進される可能性がある。
脳内のBMPは、そのレベルで作用することにより、胚の段階でも成人期でも神経発生に関与している(Gobeske et al., 2009; Armenteros et al., 2018; Jovanovic et al., 2018)。したがって、これらの分子は、神経新生と骨同化の両方を刺激する可能性があるため、骨損失が神経変性障害に関連するそれらの病態のための新規治療標的として考えられる可能性がある。
脳由来神経栄養因子(BDNF)
脳由来神経栄養因子は、中枢神経系および中枢神経系から放出される神経栄養因子である。さらに、骨などの他の組織でも発現・放出される可能性がある。脳内では、シナプス可塑性、神経発達、神経細胞分化の支援など、様々な役割を担っている。ADやPDなどの神経変性疾患の患者では、BDNFの濃度が低下していることが観察されている(Mattson, 2008)。
上記のように、BDNFとその受容体は、骨芽細胞や軟骨細胞にも発現している。In vitroの実験では、BDNFが骨細胞に対してMSCの骨芽細胞への分化を促進する有益な効果を示し(Kauschke et al., 2018)、脳のBDNFの条件付きノックアウトマウスでは、高い骨量と長い大腿骨などの骨の欠陥が表示された(Camerino et al.)
インスリン様成長因子1(Insulin-Like Growth Factor 1)
インスリン様成長因子1(IGF-1)は、インスリンと構造的に類似したホルモンで、主にGHシグナル伝達後に肝臓で合成される(Laviolaら、2008年)。肝臓以外にも、骨や脳などの組織で合成される。IGF-1シグナルは、細胞の成長、生存、成熟、増殖を促進する経路の中心であり、組織の成長と再生を可能にする。
実際、IGF-1は、胚発生期および成人期に、神経新生が持続する脳領域(小脳、嗅球、海馬)のすべての神経上皮細胞型に高度に発現している(Bachら、1991;Bartlettら、1991;Bondyら、1992)。
* *
骨においては、軟骨細胞の増殖および骨芽細胞の分化を刺激し、骨形成を促進する。実際、IGF-1の血清レベルは加齢や骨粗鬆症の患者で低下することが分かっている(Yakarら、2002; Rosen、2004; Wrigleyら、2017)。
* *
脳においてIGF-1は、出生前および出生後早期の神経発達、そして生涯を通じて可塑性とリモデリングに関与している。注目すべきは、このホルモンが加齢に伴う神経精神疾患や神経変性疾患に関与していることである(Cohen et al., 2009; Bozdagi et al., 2013; Shcheglovitov et al., 2013; Gontier et al., 2015)。
結論
脳の病気
治療のサポートとしてのバイオメカニカル・インターベンション
さまざまな研究により、認知機能障害と骨疾患には強い相関があることが示されている。認知機能の低下や神経変性は、確かに、しばしば骨の欠陥と関連しており(Roos, 2014; Binks and Dobson, 2016)、一方、骨の状態の改善を目的とした治療戦略(例えば、運動トレーニング)は、認知障害や認知症のリスクの低下と関連している(Lee et al, 2019)。
* *
脳および神経変性疾患は、骨格筋の関与とは無関係に、骨機能の低下(すなわち、骨減少症および骨粗鬆症)をもたらす身体活動行動の制限と関連する。しかし、運動は骨機能に有益であり、エネルギー代謝の改善による脳機能への好影響の他に、骨(および骨格筋)由来のメディエーターが中枢神経系に作用し、好影響を与える可能性がある。
このような骨由来のメディエーターは、特に運動トレーニングによって誘導することができる。このように、骨と脳の間に存在する関係を利用し、骨代謝を刺激することで脳機能を向上させることができるという新しい見解が生まれつつある。
* *
低骨密度(BMD)および骨粗鬆症は、閉経後女性における認知症およびADと関連する可能性があることが示されている(Filardi et al, 2019; Kaleta, 2019)。さらに、低BMDとBMD低下は骨粗鬆症とADの危険因子であり、認知症の早期危険因子である。
股関節の骨量減少が多い女性は、減少が少ない女性に比べ、認知認知症になる確率が高いと言われている。また、この点を別の視点から見ると、除脂肪体重が高いと認知障害や認知症のリスクが低いことが示されている(Maetzler et al., 2007; Comi et al., 2010; Sun et al.、2013)。
身体活動がいくつかの疾患のリスクを低下させ、生活の質を向上させることはよく知られている。いくつかの研究では、身体運動が認知障害や認知症の状態を予防したり、改善したりするだけでなく、記憶や脳機能に利益をもたらす可能性があることが示されている(Hillmanら、2008;Heiszら、2015)。
また、運動以外にも、良い食習慣や十分な睡眠時間などの健康的なライフスタイルも認知症を予防する。運動を通して認知症を予防することは、運動がフリーラジカル消去酵素の産生を制御するそれらの遺伝子の転写を促進し、フリーラジカルによる神経細胞の損傷を防ぐことができるという研究によって証明されている(Simioni et al.) さらに、運動は海馬の体積を改善し、神経細胞のミトコンドリア生合成を増加させ、神経細胞のエネルギー代謝を有利にすることで認知機能を改善することが確認されている(Olsonら、2006;Fabelら、2009;Steinerら、2011)。
* *
近年、運動による脳機能の向上は、生体力学的刺激に応答して骨から放出される分子の活性と関連している可能性が提唱されている。そして実際に、運動後に膨大な量のメディエーターが血流中に放出され、その多くが神経新生、血管新生、シナプス可塑性、海馬の樹状突起棘密度、さらには認知機能の維持・向上に特異的に良い影響を与えることが知られている(Katsimpardiら、2014年;Heiszら、2017年)。
* *
上記で詳述したように、骨由来分子であるオステオカインの循環レベルは、負荷の状態や条件によって変化する。LCN2の末梢レベルは運動状態と逆相関しており、運動量が少ないとLCN2が高くなり、その結果、脳が決定するカロリー摂取量が減少することに対応する。
OCNの循環レベルも運動によって調節されることから、加齢に伴う認知機能低下の改善、不安やうつ病の予防、PDやADなど神経細胞の減少に影響を受ける病態における神経変性の予防のための治療的調節の可能性が強調されている。
* *
運動によるスクレロスチンとDkk1の循環レベルの調節は、骨リモデリングの調節に重要である。循環血中スクレロスチン濃度は運動と逆相関しており、機械的刺激によって骨吸収が抑制されると減少するようである。骨リモデリングにおけるWntシグナルの重要な役割が浮かび上がり、この経路は負荷と非負荷によって高度に調節される(Robling and Turner, 2009; Duan and Bonewald, 2016; Galea et al.) したがって、Wnt/β-カテニンシグナルを標的とする薬物療法は、負荷のかかる運動プログラムと組み合わせて有用である可能性がある。

IGF-1およびBDNFは、虚血性脳卒中または他の神経変性病態に苦しむ患者の回復のためのバイオマーカーとして使用できる可能性がある2つの神経トロフィンだが、それらのレベルが身体活動によって制御され得る正確な分子機構は、明確に理解されていない (Carro et al., 2000; Trejo et al., 2001; Huang et al., 2014; Maass et al., 2016)。
* *
重要なことは、身体運動は、特定の認知トレーニングとの組み合わせを通して、その影響がさらに強化される可能性がある肯定的な利益を生み出すことによって、認知機能を改善することだ。実際、記憶機能および神経栄養分子、特にIGF-1とBDNFの血清レベルに対する身体運動と認知運動の相乗効果は、若年成人において記述されており、それらのレベルは、運動に対するより良い反応を経験している被験者のポジティブな結果と関連していた(Heiszら、2017年)。
今後の展望
このレビューで、我々は骨と脳の間に存在する複雑な相互関係の新たな側面を強調した。この概要から、メカノセンサーおよび内分泌器官としての骨の動的な役割が浮かび上がり、変化する環境状況への適切な養子反応を調整する機能を持つ分子の放出を通じてメカノスティミュレーションに応答することができる。
運動は、確かに骨の恒常性を乱し、骨そのものや、直接的、間接的に脳への恩恵を決定することによって、骨の反応を刺激する。しかし、ある種のメディエーターは、脳と脳のクロストークの文脈で生物学的役割に関する知識がある程度進んでいる一方で、他のメディエーターについては、そのような機能は仮説に過ぎず、実証には至っていないのが現状である。実のところ、これらの因子の発現はアンバランスである。
* *
上記のように、脳の病気と骨の病気の両方にかかっている患者は、骨の代謝異常も経験していることが非常に多い。骨が脳に及ぼす影響を利用すれば、神経疾患の治療に、標準的な薬物療法や精神療法の補助として、運動療法に基づいた新しい治療介入を行うことができるかもしれない。
このような戦略は、特定の運動プログラムを通じて、特定の骨由来分子の循環レベルを調節することで、中枢レベルでも肯定的な効果を得ることに取り組むべきである。しかし、このようなアプローチを効果的に行うためには、骨から脳への軸となるメカニズムをさらに深く研究する必要がある。
今後の研究では、どのような刺激が与えられたメディエーターの発現を特異的に調節できるのか、このメディエーターはBBBを通過できるのか、どの程度通過できるのか、メディエーターは脳内でどう作用するのかといった疑問に答えることが必要であろう。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係のない状態で実施されたことを宣言する。
脚注
資金提供 この研究は、イタリア保健省(”Ricerca Corrente “プログラム)の資金援助を受けている。
